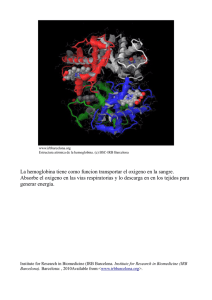
Relacion de ESTRUCTURA Y FUNCION Hemoglobina como
Anuncio
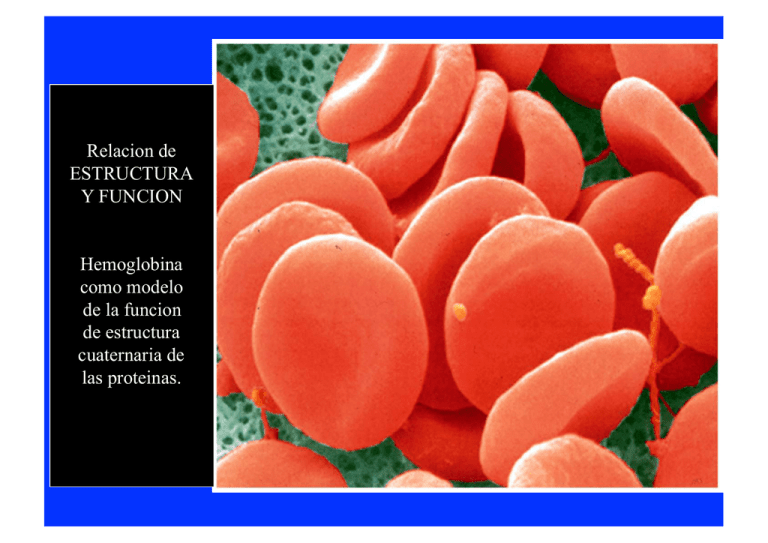
Relacion de ESTRUCTURA Y FUNCION Hemoglobina como modelo de la funcion de estructura cuaternaria de las proteinas. Ligando Sitio de enlace (Binding site) Efecto inducido (Induced Fit) Efecto inducido (Induced Fit) Dos moleculas que enlazan oxigeno Mioglobina y Hemoglobina Grupo Heme de Mioglobina y Hemoglobina Grupo prostetico no proteico Anillo organico de protoporfirina- Enlaza Fe Los enlaces de Fe al N de la molecula de protoporfirina ayudan a evitar que el Fe pase de Fe+2 a Fe +3 El Fe +3 no enlaza O2 El Fe tambien esta protegido al enlazarce al N de un residuo de His de una de las helices alfa de la globina Importancia de la estructura tridimensional de la proteina En un grupo heme libre, CO se enlaza 20,000 mas fuerte que O2. El angulo en que cada molecula se enlaza afecta su enlace con el grupo heme de la proteina, ya sea mioglobina o hemoglobina. La presencia del residuo His E7 hace que el CO se enlace mas debilmente a la proteina. (200 veces mejor) θ= sitios de enlace ocupados sitios de enlace totales L=ligando Kd= constante de disociacion La reaccion entre proteina y ligando se describe como una hiperbole. La fraccion de sitios ocuapdos se va saturando de forma asimptotica a medida que aumenta la concentracion de ligando. En mioblobina L= pO2 Kd= P50 Rol de Mioglobina Rol de Hemoglobina Observación: O2 es poco soluble en agua y nuestro cuerpo es mayormente agua. Relacion de ESTRUCTURA Y FUNCION EritrocitosEn mamiferos son sacos de Hb. Transporte de Oxigeno de pulmon a tejidos Hb adultos proteina tetramerica Dos cadena α Dos cadenas β Menos del 50% de residuos son identicos entre ambas. Sin embargo la estructura terciaria es similar Comparacion Hb α y β con Mb Residuos variables e invariables Importancia entre la interaccion de las cadena α y β en terminos de la funcion de Hb. Ejemplo de interacciones entre cadenas de Hb mediadas por atracciones ionicas Dos posibles conformaciones de Hb. (Ej de Proteina alosterica) Dos afinidades diferentes con Oxigeno T state- Tenso (se relaciona con DeoxiHb) R state- Relajado (se relaciona con OxiHb) Cambio conformacional en la estructura cuaternaria de Hb cuando uno de sus cadenas se enlaza a oxigeno. No hay necesidad de cambios grandes en estructura terciaria Como se obtine la curva sigmoide de Hb? Transicion entre dos estados de afinidad. Relacion a funcion Transporte de Oxigeno Ecuación de Hill • Describe el grado de saturación como función de pO2 • Constante de Hill- describe la interacción de la proteína con el ligando – N =1 no cooperativo – N>1 cooperatividad positiva – N< 1 cooperatividad negativa MODELOS DE INTERCONVERSION ENTRE T Y R Concertado Secuencial Hb tambien interacciona con otras moleculas: H+- transporte a pulmones/amortiguador Efecto de Bohr CO2- transporte a pulmones Carbamino BPG (bifosfo glicerato)- Modulador CO- competidor por el grupo heme Relacion de Enlace de O2 con el pH de la sangre Transporte de CO2: HCO3 Es responsable del 70 – 80% CO2 - Transporte de CO2: carbamino-Hb Responsable de 15 – 20% R-NH3+ Oxy-Hb Δ pka Terminal Amino Group R-NH2 + H+ Deoxy-Hb Carbamate ANEMIA FALCIFORME Anemia falciforme sickle cell - Mutacion genetica en cadena β Glu cambia a Val. Causa cambio dramatico en estructura de Hb.