Problemas Conceptos Básicos Química
Anuncio
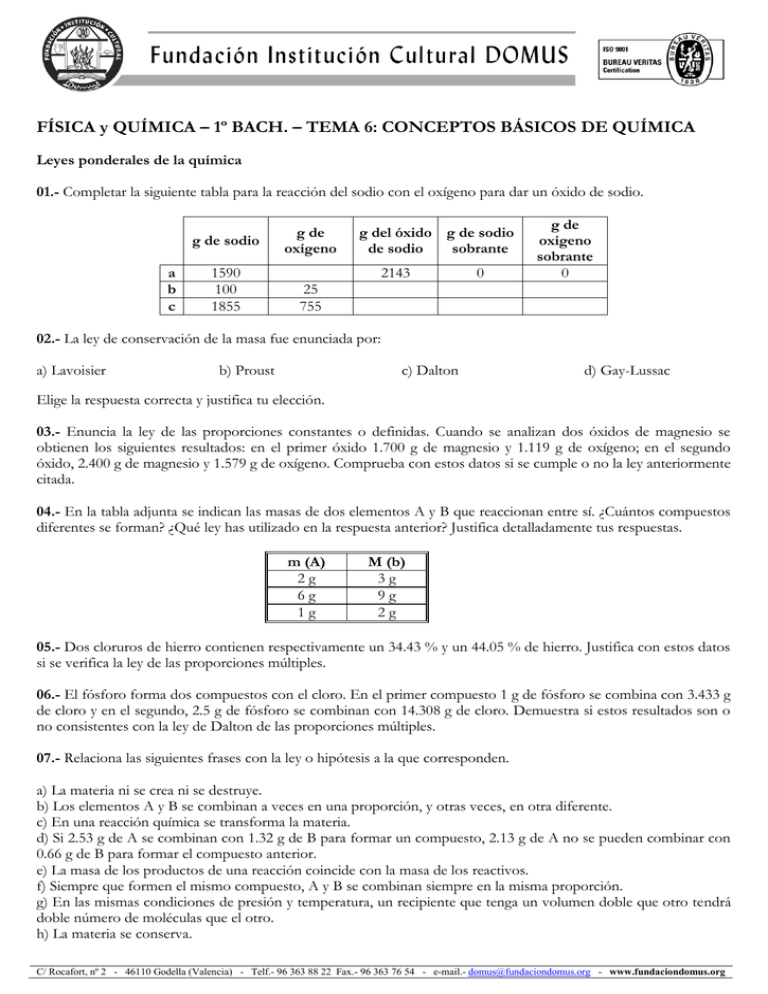
FÍSICA y QUÍMICA – 1º BACH. – TEMA 6: CONCEPTOS BÁSICOS DE QUÍMICA Leyes ponderales de la química 01.- Completar la siguiente tabla para la reacción del sodio con el oxígeno para dar un óxido de sodio. g de sodio a b c 1590 100 1855 g de oxígeno g del óxido g de sodio de sodio sobrante 2143 0 g de oxígeno sobrante 0 25 755 02.- La ley de conservación de la masa fue enunciada por: a) Lavoisier b) Proust c) Dalton d) Gay-Lussac Elige la respuesta correcta y justifica tu elección. 03.- Enuncia la ley de las proporciones constantes o definidas. Cuando se analizan dos óxidos de magnesio se obtienen los siguientes resultados: en el primer óxido 1.700 g de magnesio y 1.119 g de oxígeno; en el segundo óxido, 2.400 g de magnesio y 1.579 g de oxígeno. Comprueba con estos datos si se cumple o no la ley anteriormente citada. 04.- En la tabla adjunta se indican las masas de dos elementos A y B que reaccionan entre sí. ¿Cuántos compuestos diferentes se forman? ¿Qué ley has utilizado en la respuesta anterior? Justifica detalladamente tus respuestas. m (A) 2g 6g 1g M (b) 3g 9g 2g 05.- Dos cloruros de hierro contienen respectivamente un 34.43 % y un 44.05 % de hierro. Justifica con estos datos si se verifica la ley de las proporciones múltiples. 06.- El fósforo forma dos compuestos con el cloro. En el primer compuesto 1 g de fósforo se combina con 3.433 g de cloro y en el segundo, 2.5 g de fósforo se combinan con 14.308 g de cloro. Demuestra si estos resultados son o no consistentes con la ley de Dalton de las proporciones múltiples. 07.- Relaciona las siguientes frases con la ley o hipótesis a la que corresponden. a) La materia ni se crea ni se destruye. b) Los elementos A y B se combinan a veces en una proporción, y otras veces, en otra diferente. c) En una reacción química se transforma la materia. d) Si 2.53 g de A se combinan con 1.32 g de B para formar un compuesto, 2.13 g de A no se pueden combinar con 0.66 g de B para formar el compuesto anterior. e) La masa de los productos de una reacción coincide con la masa de los reactivos. f) Siempre que formen el mismo compuesto, A y B se combinan siempre en la misma proporción. g) En las mismas condiciones de presión y temperatura, un recipiente que tenga un volumen doble que otro tendrá doble número de moléculas que el otro. h) La materia se conserva. C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org i) 1 L de gas A no se combina nunca con 1.3792 L de otro gas que se encuentre en las mismas condiciones de presión y temperatura que él. j) Si A y B dan dos compuestos diferentes, puede que en un caso se combinen 1.57 g de A con 2 g de B y, en otro, 3.14 g de A se combinan con 2 g de B. 08.- Supongamos que reaccionan dos elementos (X e Y) de forma que las relaciones de las masas combinadas de los mismos son: Experimento Primera reacción Segunda reacción Tercera reacción Cuarta reacción Masa de X (g) 2.50 2.50 5.00 2.50 Masa de Y (g) 1.20 0.60 2.40 0.40 A la vista de estos datos, discute razonadamente la veracidad o falsedad de las siguientes afirmaciones: a) Los datos de las reacciones 1 y 3 justifican la ley de Proust. b) Los datos de las reacciones 1, 2 y 4 justifican la ley de las proporciones múltiples. c) Los compuestos formados en las reacciones 1 y 2 son iguales. d) Los compuestos formados en las reacciones 1 y 3 son iguales. 09.- Cuando 3.06 g de hidrógeno reaccionaron con un exceso de oxígeno, se formaron 27.35 g de agua. En un segundo experimento, se descompuso una muestra de agua por electrólisis, produciéndose 1.45 g de hidrógeno y 11.51 g de oxígeno. Enunciar la ley de las proporciones constantes y verificar si los datos del enunciado son o no consistentes con esta ley. 10.- Después de analizar cuatro muestras distintas que contienen plomo y oxígeno, se han obtenido los siguientes resultados: - Muestra A: 92.82 % de Pb. - Muestra B: 6.41 g de Pb en 7.40 g de muestra. - Muestra C: 7.89 g de Pb en 8.50 g de muestra. - Muestra D: 90.65 % de Pb. a) ¿Se trata del mismo compuesto o de varios compuestos diferentes? b) ¿Se cumple la ley de las proporciones múltiples? 11.- Observa la siguiente tabla y complétala. Compuesto Masa de Pb y Cl Total (g) 1º 349.20 2º 55.64 3º 83.46 4º x Masa Pb (g) 207.2 y 62.16 51.80 Masa Cl (g) z 14.20 w 35.50 Determina cuántos compuestos diferentes aparecen y comprueba que se cumple la ley de las proporciones múltiples. 12.- El azufre forma dos cloruros. Una muestra de 30 gramos del primero de ellos se descompone y se observa que está formada por 5.53 gramos de azufre y 24.47 gramos de cloro. Por el contrario, una segunda muestra de 30 C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org gramos al descomponerse da lugar a 3.93 gramos de azufre y 26.07 gramos de cloro. Demostrar que estas muestras verifican la ley de las proporciones múltiples. 13.- Los siguientes datos se obtuvieron para una serie de compuestos de yodo y fluor: Compuesto A B C D Masa Yodo (g) 1.000 0.500 0.750 1.000 Masa Fluor (g) 0.1497 0.2246 0.5614 1.0480 a) Enuncia la ley de las proporciones múltiples. b) Demuestra si los datos de la tabla cumplen o no dicha ley. c) Si la fórmula del compuesto A es IF, ¿cuáles son las fórmulas de los compuestos B, C y D? 14.- El azufre forma dos cloruros. Una muestra de 30 gramos del primero de ellos se descompone y se observa que está formada por 5.53 gramos de azufre y 24.47 gramos de cloro. Por el contrario, una segunda muestra de 30 gramos al descomponerse da lugar a 3.93 gramos de azufre y 26.07 gramos de cloro. Demostrar que estas muestras verifican la ley de las proporciones múltiples. Concepto de mol 01.- Calcular el número de átomos de carbono presentes en las siguientes sustancias: a) 1.24 moles de glucosa (C6H12O6). b) 3.31 1019 moléculas de glucosa. c) 0.275 gramos de glucosa. Masas molares (g/mol): H = 1; C = 12; O =16 02.- 1 mol de hierro y 1 mol de sodio a) contienen el mismo número de moléculas. b) pesan lo mismo. c) contienen el mismo número de átomos. d) ocupan el mismo volumen en condiciones normales de presión y temperatura. Elige la respuesta correcta y justifica tu elección. 03.- La fórmula molecular de la glucosa es C6H12O6. En una muestra de glucosa se han contabilizado 1.5 1022 átomos de carbono. a) ¿Cuántos átomos de hidrógeno contiene la muestra? b) ¿Cuántas moléculas de glucosa? c) ¿Cuántos moles de glucosa? d) ¿Cuál es la masa de la muestra expresada en gramos? Masas atómicas: H = 1 u; C = 12 u; O = 16 u 04.- El químico alemán Fritz Haber propuso pagar las indemnizaciones impuestas a Alemania después de la Primera Guerra Mundial, extrayendo oro del agua del mar. Dado que (a) la cantidad de las indemnizaciones era de C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org 28.8 miles de millones de dólares, (b) el valor del oro en ese momento era aproximadamente de 21.25 dólares por onza (1 onza = 31.103 g), y (c) el oro se encuentra en el agua de mar en una proporción de 4.67 10 17 átomos por tonelada de agua de mar, ¿cuántos kilómetros cúbicos de agua de mar tendrían que ser procesados para obtener la cantidad necesaria de oro? Suponga que la densidad del agua de mar es 1.03 g/cm3. (Por cierto, el proyecto de Fritz Haber no resultó factible comercialmente, y las indemnizaciones nunca se acabaron de pagar). Masa atómica del oro (u): 196,97 05.- El sulfato de amonio se utiliza como fertilizante en agricultura. Calcular: a) El tanto por ciento de nitrógeno presente en dicho compuesto. b) La cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno. c) El número de moléculas presentes en la muestra anterior. d) El número de átomos de oxígeno que hay en dicha muestra. Masas atómicas (u): H = 1, N = 14, O = 16, S = 32 06.- Una muestra contiene 3.01 1020 moléculas de SFn y tiene una masa de 54 mg. Calcula el valor de n. Masas atómicas (u): F = 18.998; S = 32.0 07.- El monel es una aleación de cobre-níquel resistente a la corrosión utilizada en la industria electrónica. Una determinada aleación con una densidad de 8.80 g/cm3 que contiene un 0.022 por ciento en masa de silicio se utiliza para fabricar una plancha rectangular de 15 cm de longitud, 12.5 cm de anchura y 3 mm de espesor con un agujero de 2.5 cm de diámetro en el centro. Calcular el número de átomos de silicio-30 que hay en esta plancha teniendo en cuenta que de todo el silicio existente solo el 3.1 % es silicio-30. La masa atómica del silicio-30 es 29.97376 u. 08.- Calcular: a) los moles de átomos de oxígeno que hay en 200 g de nitrato de bario. b) los átomos de fósforo que hay en 0.15 moles de pentaóxido de difósforo. c) los gramos de oxígeno que hay en 0.15 moles de trióxido de difósforo. d) los átomos de oxígeno que hay en 5.22 g de nitrato de bario. Masas atómicas (u): N = 14, O = 16, P = 31, Ba = 137.33 09.- La arsina es un compuesto de fórmula AsH3. Si disponemos de 0.8 1025 moléculas de arsina, calcular: a) El número de moles de arsina de los que se dispone. b) Los gramos de arsina presentes en la muestra. c) Los gramos de hidrógeno de los que se dispone. d) Los gramos de arsénico que se tienen. Masas at. (u): H = 1.01; As = 74.92 10.- La hemoglobina C2952H 4664N812O832S8 Fe4 es la responsable del transporte del oxígeno en la sangre. a) Calcular su masa molar. b) En promedio, un adulto tiene alrededor de 5 L de sangre. Cada mililitro de sangre contiene 5 10 9 eritrocitos y cada una de estas células contiene alrededor de 2.8 108 moléculas de hemoglobina. Calcular la masa de hemoglobina (en gramos) que tiene una persona adulta. Masas atómicas (u): H = 1, C = 12, N = 14, O = 16, S = 32.1, Fe = 55.8 C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org 11.- Una gota de agua de rocío tiene una masa de 0.9 mg. Averigua el número de moléculas de agua que contiene. Si distribuyéramos dichas moléculas entre los 6000 millones de habitantes de la Tierra, ¿cuántas moléculas corresponderían a cada uno? Masas at. (u): H = 1.01; O = 16 12.- Calcular el número de átomos que hay en un alambre de cobre de calibre 20 de 1 m de longitud. Un alambre de calibre 20 tiene un diámetro de 0.03196 pulgadas y la densidad del cobre es de 8.92 g/cm3. Masas atómicas (u): Cu = 63.546 Dato: 1 pulgada = 2.54 cm 13.- Señala en qué caso hay mayor número de átomos de azufre: a) 1 gramo de ácido sulfúrico. b) 0.005 moles de sulfuro de hierro (II). c) 1 L de SO2 medido en condiciones normales. d) 1022 átomos de azufre. Masas atómicas (u): H = 1, O = 16, S = 32, Fe = 55.8 14.- Las feromonas (C19H38O) son un tipo especial de compuestos secretadas por las hembras de muchas especies de insectos con el fin de atraer a los machos para aparearse. Normalmente, la cantidad de esta feromona secretada por un insecto hembra es de 10-12 g. Calcular el número de moléculas y de átomos de carbono que hay en dicha cantidad de feromona. Masas atómicas (u): H = 1; C = 12; O = 16 15.- ¿Dónde hay mayor número de átomos: en 17 g de hierro, en 21 g de vanadio o en 10 g de estaño? Masas atómicas: Fe = 55.8; V = 50.9; Sn = 118.7 16.- El fluoruro de xenón está formado por moléculas del tipo XeFn donde “n” es un número natural. Si la masa de 9.03 1020 moléculas del compuesto es 0.311 g, calcula el valor de “n”. Masas atómicas: F = 19; Xe = 131.3 17.- El wolframio es un metal muy denso (19.3 g/cm3) que tiene unos puntos de fusión y ebullición extremadamente altos (3370 ºC y 5900 ºC). Cuando se añade una pequeña cantidad de wolframio en el hierro, la aleación resultante adquiere una dureza y una resistencia mucho mayores que las que tiene el hierro ordinario. Dos importantes sales del wolframio son el FeWO4 y el CaWO4. Calcula el número de gramos de CaWO4 que deberíamos tener para que estos poseyeran la misma masa de wolframio que hay en 569 g de FeWO4. Masas molares (g/mol): O = 15.99, Ca = 40.08, Fe = 55.84, W= 183.8 18.- Se dispone de dos cilindros rígidos y sellados de 1 L de volumen, uno que contiene helio y otro que contiene neón. Si ambos cilindros están a la misma presión y a la misma temperatura, podemos afirmar que contendrán el mismo número de: a) átomos b) electrones c) iones d) protones e) neutrones Escoge la respuesta correcta y justifica tu elección C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org 19.- Una de las siguientes sustancias es un compuesto. Indica cuál: a) aire b) amoniaco c) leche d) agua de mar e) vino Escoge la respuesta correcta y justifica tu elección Leyes de los gases 01.- Un recipiente con paredes móviles contiene una muestra de 6 L de un gas a una temperatura de 293 K y a una presión de 1 atmósfera. Si el recipiente se calienta hasta una temperatura de 303 K mientras la presión se mantiene constante podemos afirmar que el volumen final de la muestra será de: a) 9 L b) 6.2 L c) 5.8 L d) 4 L Elige la respuesta correcta y justifica tu elección. 02.- Una muestra de 4.74 g de un gas de fórmula molecular C2H3X3 ocupa un volumen de 891 ml a 769 mmHg y 35 ºC. Identifica la masa atómica de X sabiendo que las masas atómicas de hidrógeno y carbono son, respectivamente, 1 u y 12 u. 03.- Una cantidad de oxígeno molecular, O2, ocupa un volumen de 825 ml a 27 ºC y 705 mmHg de presión. ¿Qué volumen ocupará esa cantidad de oxígeno en condiciones normales de presión y temperatura? 04.- La densidad de un gas es 1.71 g/l cuando su temperatura es de 75 ºC y la presión en que se encuentra es de 640 mmHg. Calcula su masa molecular. 05.- En un recipiente de 5 L en el que se ha hecho previamente el vacío se inyectan 5.32 g de aire. Si la presión ejercida es de 894 mb y la temperatura de 20 ºC, calcular: a) la masa molecular del aire. b) la densidad del aire en condiciones normales. c) la densidad del aire a 790 mmHg y 70 ºC. 06.- Se tiene un recipiente de 2 L que contiene H2(g) en condiciones estándar de presión y temperatura. Indica cuál de los siguientes recipientes contendrá el mismo número de moléculas que el recipiente anterior si se mantienen las mismas condiciones de presión y temperatura: a) Uno de 1 L de volumen de O2(g). b) Uno de 2 L de volumen de CH4(g). c) Uno de 1.5 L de volumen de NH3(g). d) Uno de 4 L de volumen de He(g). Elige la respuesta correcta y justifica tu elección. 07.- Calcula la densidad del nitrógeno gaseoso: a) en condiciones normales. b) a 700 mmHg y 35 ºC. Masas molares (g/mol): N = 14 C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org 08.- La composición en volumen del aire seco es 78 % nitrógeno, 21 % oxígeno y el resto, otros gases. Las dimensiones de nuestra clase son 7 m de largo, 6 m de ancho y 3 m de alto. Si la presión es de 790 mmHg y la temperatura de 20 ºC, calcular la masa de oxígeno que tenemos en clase. Masa atómica (u): N = 14, O = 16 09.- El monocloroetileno se utiliza para obtener cloruro de polivinilo (PVC). Calcular la masa molar del monocloroetileno sabiendo que tiene una densidad de 2.56 g/L a 22.8 ºC y 756 mmHg. 10.- Un vendedor de globos tiene un recipiente de 30 litros lleno de helio a la temperatura de 25 ºC y sometido a una presión de 8 atmósferas. Calcula el número de globos de 2 L, a presión de 1 atmósfera y a la misma temperatura, que puede llenar con todo el helio del recipiente. 11.- Una botella de gases de 34.0 L contiene 305 g de O2(g) a 22 ºC. Calcular los gramos de O2(g) que deben abandonar la botella para que la presión se reduzca hasta 1.15 atm. Masas atómicas (u): O = 16 12.- La masa molar de un gas con una densidad de 5,8 g/L a 25 ºC y 740 mmHg está cercana a: a) 190 g/mol b) 150 g/mol c) 20 g/mol d) 10 g/mol e) 5 g/mol Elige la respuesta correcta y justifica tu elección. 13.- Para que un globo lleno de un gas ascienda en el aire, la densidad del gas del globo debe ser inferior a la del aire. a) Teniendo en cuenta que el aire tiene una masa molar de 28.96 g/mol, calcular su densidad, en g/L, a 25 ºC y 1 atm. b) Demostrar mediante cálculos que un globo lleno de dióxido de carbono (CO2) a 25 ºC y 1 atm no puede elevarse en el aire a dicha temperatura. Masas atómicas (u): C = 12; O = 16 14.- Un estudiante intenta determinar el volumen de un recipiente y obtiene los siguientes resultados: - Masa del recipiente llenado con aire a 23 ºC y 744 mmHg = 91.6843 g. - Masa del recipiente al vacío = 91.4715 g. Calcular el volumen del recipiente. Composición del aire: 78 % N2, 21 % O2 y 1 % Ar. Masas atómicas (u): N = 14; O = 16; Ar = 39.95 15.- Un recipiente de vidrio de 132.20 mL pesa 56.1035 g después de haberse hecho el vacío y 56.2445 g cuando se llena con el hidrocarburo gaseoso acetileno a 749.3 mmHg y 20.02 ºC. Calcular la masa molar del acetileno. 16.- Si la temperatura (en escala absoluta) de un gas se dobla y el volumen se reduce a la mitad, podemos afirmar que su presión: a) se multiplica por 4 b) se multiplica por 2 c) permanece constante d) se divide por 4 Escoge la respuesta correcta y justifica tu respuesta. C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org Fórmula empírica y molecular 01.- Un cierto anestésico contiene un 64.9 % de carbono, un 13.5 % de hidrógeno y un 21.6 % de oxígeno. A 120 ºC y 750 mmHg, 1 litro del compuesto en estado gaseoso pesa 2.30 gramos. Calcular la fórmula molecular del compuesto. Masas molares (g/mol): H = 1; C = 12; O =16 02.- Una sustancia contiene un 57.1 % de carbono, un 4.76 % de hidrógeno y un 38.14 % de azufre. Si 16.25 gramos de esta sustancia contiene 5.85 1022 moléculas, calcular la formula empírica y la fórmula molecular de la sustancia. Masas molares (g/mol): H = 1; C = 12; S = 32 03.- En momentos de tensión, como puede ser la realización de un examen de física y química, el cuerpo humano libera una sustancia llamada adrenalina, que hace aumentar la velocidad metabólica del organismo. Experimentalmente, se ha determinado que su composición porcentual en masa es: 56.8 % de carbono, 6.5 % de hidrógeno, 28.4 % de oxígeno y 8.28 % de nitrógeno. Determina la fórmula empírica de la adrenalina. Masas atómicas: C = 12 u; H = 1 u; O = 16 u; N = 14 u 04.- La masa de un hidrocarburo gaseoso contenido en un matraz de 500 ml a 37 ºC y a 0.84 atm es de 0.496 gramos. Si dicho hidrocarburo contiene un 80 % de carbono, halla la fórmula empírica y molecular. ¿De qué compuesto se trata? 05.- Calcular la fórmula empírica de los siguientes compuestos químicos: a) Benzopireno, posible carcinógeno encontrado en el humo de los cigarrillos, que contiene un 95.22 % de carbono y 4,78 % de hidrógeno, en masa. b) Hexaclorofeno, utilizado en jabones bactericidas, que contiene en masa 38.37 % de carbono, 1.49 % de hidrógeno, 52.28 % de cloro y el resto, oxígeno. Masas atómicas (u): H = 1, C = 12, O = 16, Cl = 35.45 06.- Un compuesto tiene como fórmula empírica (CH2O)n. Si su masa molecular es de 60 g/mol, podemos afirmar que su fórmula molecular será: a) CH2O ´ b) C2H4O2 c) C3H8O d) C4H8O4 Masas molares (g/mol): H = 1; C = 12; O =16 Elige la respuesta correcta y justifica tu elección. 07.- La fructosa es un tipo de azúcar encontrado en las frutas y en la miel. Se ha utilizado tradicionalmente como edulcorante para diabéticos. Su composición centesimal es: carbono 40 %, hidrógeno 6.66 % y oxígeno 53.34 %. Teniendo en cuenta que su masa molar es de 180 g/mol averigua su fórmula empírica y su fórmula molecular. Masas molares (g/mol): H = 1; C = 12; O = 16 08.- Tras analizar un compuesto químico vemos que su composición centesimal es la siguiente: Carbono 70.02 %; Hidrógeno 3.34 % y Oxígeno 26.64 %. Sabiendo que su masa molar es de 240.2 g/mol, calcula su fórmula empírica y su fórmula molecular. C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org Masas molares (g/mol): H = 1, C = 12, O = 16 09.- El medicamento L-Dopamina, utilizado en el tratamiento de la enfermedad de Parkinson, contiene un 54.86 % de carbono, un 5.58 % de hidrógeno, un 7.10 % de nitrógeno y el resto, oxígeno. Sabiendo que su masa molar es de 591 g/mol, averigua sus fórmulas empírica y molecular. Masas molares (g/mol): H = 1, C = 12, N = 14, O = 16 10.- El acetileno es un gas que se utiliza como combustible en los sopletes de soldadura. En su composición interviene un 92.3 % de carbono y un 7.7 % de hidrógeno. Determinar la fórmula molecular del acetileno si cuando se introducen 4.15 g del mismo en un ampolla de 1.5 L a 70 ºC ejercen una presión de 3 atmósferas. Masas atómicas (u): H = 1, C = 12 11.- El betacaroteno proporciona el color naranja a las zanahorias y es importante para la visión correcta en los seres humanos. Su composición centesimal, en masa, es 89.55 % de carbono y 10.45 % de hidrógeno. Si la masa molecular del betacaroteno es 536.0 u, calcula su fórmula molecular. Masas atómicas: H = 1 u; C = 12 u. 12.- La nicotina es una sustancia altamente tóxica que produce una fuerte adicción. Un análisis elemental de esta sustancia demuestra que su composición centesimal es la siguiente: C (74.02 %), H (8.70 %) y N (17.28 %). Deduce la fórmula empírica y la fórmula molecular de la nicotina, sabiendo que su masa molecular relativa es de 162.20 u. Masas atómicas (u): H = 1, C = 12, N = 14. 13.- El paracetamol tiene la siguiente composición centesimal: 63.57 % de carbono, 5.96 % de hidrógeno, 9.27 % de nitrógeno y el resto, oxígeno. Si su masa molar es de 151 g/mol, determinar la fórmula molecular del paracetamol. Masas atómicas (u): H = 1, C = 12, N = 14; O = 16 14.- La aspirina es un analgésico muy conocido por todos. Su composición, al analizar 1 gramos de aspirina comercial, es la siguiente: 0.6 g de carbono, 0.044 g de hidrógeno y el resto, oxígeno. Teniendo en cuenta que la masa molecular de la aspirina es de 180 u, determina sus fórmulas empírica y molecular. Masas at. (u): H = 1.01; C = 12.01; O = 16 15.- El índigo, el colorante azul de los pantalones vaqueros, tiene una composición centesimal en masa, del 73.27 % de carbono, 3.84 % de hidrógeno, 10.68 % de nitrógeno y el resto de oxígeno. Su masa molar es de 262 g/mol. Calcular su fórmula molecular. Masas atómicas (u): H = 1; C = 12; N = 14; O = 16 16.- Una sustancia orgánica tiene la siguiente composición: 63.16 % de C, 8.77 % de H y 28.07 % de O. Sabiendo que 1.65 gramos de ella, en estado vapor, ocupan 629 mL a 250 ºC y 750 mmHg, determina su fórmula molecular. Masas at. (u): H = 1, C = 12, O = 16 17.- La putrescina, un producto proveniente de la descomposición de la carne, contiene un 54.50 % de carbono, un 13.72 % de hidrógeno y un 31.78 % de nitrógeno. Calcular la fórmula empírica de la putrescina. Masa molares (g): H = 1, C = 12, N = 14 C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org 18.- La alicina es el compuesto responsable del olor característico del ajo. Un análisis de dicho compuesto muestra la siguiente composición porcentual: C – 44.43 %; H – 6.21 %; S – 39.50 % y O – 9.86 %. Calcular su fórmula empírica y su fórmula molecular si su masa molar es de 162 g. Masas atómicas (u): H = 1; C = 12; O = 16; S = 32 19.- Un hidrocarburo está formado por un 82.65 % de carbono y un 17.35 % de hidrógeno. Un litro de este gas medido a 1 atm y 0 ºC tiene una masa de 2.6 gramos. Calcula su fórmula molecular. Masas atómicas (u): H = 1; C = 12 20.- El timolol es un medicamento que se utiliza para reducir la presión intraocular. Su composición es 49.4 % de carbono, 7.58 % de hidrógeno, 17.7 % de nitrógeno, 15.18 % de oxígeno y 10.14 % de azufre. La masa de 0.01 moles de timolol es 3.16 g. Calcular la fórmula empírica y molecular del timolol. Masas molares (g/mol): H = 1, C = 12.01, N = 14, O = 15.99, S = 32.06 C/ Rocafort, nº 2 - 46110 Godella (Valencia) - Telf.- 96 363 88 22 Fax.- 96 363 76 54 - e-mail.- [email protected] - www.fundaciondomus.org







