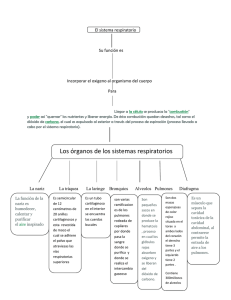
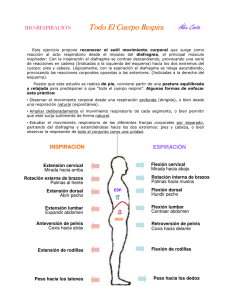
Examen Calificacion Final
Anuncio

Universidad de Chile Facultad de Ciencias Físicas y Matemáticas Departamento de Ingeniería Eléctrica Procesamiento de señales rrespiratorias espiratorias aplicadas a un model odelo biomecánico y a registros polisomnográficos Alumno: Leonardo Causa Morales Profesor Guía: Dr. Claudio Held B., Laboratorio Ingeniería Biomédica, DIE, Universidad de Chile, Santiago, Chile. Profesor Co-Guía: Guía: Dr. Patricio Peirano, Laboratorio oratorio de Sueño, INTA, INTA Universidad de Chile, Santiago, Chile. Director de tesis: Dr. Bezhad Shariat, Laboratorio LIRIS, Université Claude Bernard Lyon 1, Lyon, Francia. Codirector de tesis: Dr. Fabrice Jaillet, Laboratorio LIRIS, Université Claude Bernard Lyon 1, Lyon, Francia. Santiago – Chile, Septiembre 2009 1 Contenido ABREVIATURAS .............................................................................................................................. 3 RESUMEN ...................................................................................................................................... 6 1. INTRODUCCIÓN...................................................................................................................... 7 2. SISTEMA RESPIRATORIO Y RESPIRACIÓN ................................................................................ 8 3. MOTIVACIÓN ....................................................................................................................... 23 4. DEFINICIÓN DEL PROBLEMA ................................................................................................. 27 5. ESTADO DEL ARTE ................................................................................................................ 30 6. PROPUESTA DE INVESTIGACIÓN ........................................................................................... 39 7. RESULTADOS ESPERADOS..................................................................................................... 43 8. METODOLOGÍA .................................................................................................................... 46 9. PLAN DE TRABAJO ................................................................................................................ 48 10. CONCLUSIONES ................................................................................................................ 51 11. REFERENCIAS.................................................................................................................... 53 2 ABREVIATURAS ABC: Active breathing control. Sistema utilizado para bloquear el flujo de aire durante la respiración. BD: Base de datos. C: Compliance (distensibilidad). Corresponde a la pendiente de la curva presión-volumen pulmonar. Se define como el cambio de volumen por unidad de cambio de presión. CI: Capacidad inspiratoria. Volumen de aire inspirado máximo que ingresa a los pulmones desde el volumen de reposo. CFR: Capacidad funcional residual. Volumen de gas pulmonar existente al final de una espiración tranquila, corresponde al volumen de reposo del sistema tóraco-pulmonar. CPT: Capacidad pulmonar total. Máxima cantidad de aire que pueden contener los pulmones CR: Ciclo respiratorio. CT: Tomografía computarizada. CV: Capacidad vital. Volumen que puede ser inspirado con un esfuerzo inspiratorio máximo realizado al término de una espiración máxima lenta. CVF: Capacidad vital forzada. Maniobra realizada en espirometría que consiste en espirar lo más rápido posible a partir de una inspiración máxima. ECG: Electrocardiograma. EEG: Electroencefalograma. EF: Elementos finitos. Método numérico general para la aproximación de soluciones de ecuaciones diferenciales parciales. EMD: Descomposición modal empírica (empirical mode decomposition). Técnica que permite descomponer señales no lineales y no estacionarias en una colección finita de modos (asociados a bandas de frecuencia). EMG: Electromiografía. EOG: Electrooculograma. ERP: Potenciales evocados cognitivos (event-related potential). FCFM: Facultad de Ciencias Físicas y Matemáticas. FEV1: Volumen espiratorio forzado del primer segundo. Técnica espirométrica que relaciona el volumen espirado con la resistencia de la vía aérea. FFT: Transformada de Fourier. 3 Gaw: Conductancia de la vía aérea. Inverso de la resistencia de la vía aérea. GMCAO: Équipe Gestes Médico-Chirurgicaux Assités par Ordinateur. Equipo de trabajo sobre simulación computacional de la Université Joseph Fourier, Grenoble, Francia. HHT: Transformada de Hilbert-Huang. Técnica que permite representar una señal en los dominios de la frecuencia y el tiempo en forma simultánea. I: Impedancia. IAH: Índice de apnea/hipopnea. Porcentaje de sueño en apnea/hipopnea. INTA: Instituto de Nutrición y Tecnología de los Alimentos. LIRIS: Laboratoire d’InfoRmatique en Image et Systèmes d’information. Laboratorio de informática e imágenes de la Université Claude Bernard Lyon 1, Lyon, Francia. NURBS: Non-uniform rational B-splines. Modelo matemático utilizado en computación gráfica que permite generar y representar curvas y superficies. P: Presión. Palv: Presión alveolar. Presión dentro del alvéolo. Pb: Presión barométrica. Presión existente en la superficie del cuerpo y en la vía aérea. Pes: Presión esofágica. Presión dentro del esófago. PET: Tomografía por emisión de positrones. Pg: Presión gástrica. Presión medida en el estómago, justo por debajo del diafragma. Pmusc: Presión muscular. Presión ejercida por los músculos respiratorios. Ppl: Presión pleural. Presión dentro de la cavidad pleural. PRETA: Équipe Physiologie cardio-Respiratoire Experimentale Théorique et Appliquée. Equipo de investigación sobre señales cardio-respiratorias, perteneciente a la Université Joseph Fourier, Grenoble, Francia. Pt: Presión transtotal. Diferencia de presión necesaria para vencer la suma de la resistencia de las vías aéreas y la retracción elástica del pulmón. Ptd: Presión transdiafragmática. Presión ejercida sobre la superficie del diafragma. Ptp: Presión transpulmonar. Diferencia de presión necesaria para contrarrestar la retracción elástica del pulmón. Ptt: Presión transtorácica. Diferencia de presión a través de la pared torácica. P-V: Curva presión-volumen. IQ: Coeficiente intelectual (intelligence quotient). Raw: Resistencia de la vía aérea. RME: Presión bucal máxima (maximum mouth pressure). Prueba que permite relacionar 4 la fuerza muscular respiratoria a través de la presión medida en la boca. SAARA: Équipe Simulation, Analyse et Animation pour la Réalité Augmentée. Equipo dedicado al desarrollo de modelos de simulación computacional del laboratorio LIRIS, Université Claude Bernard Lyon 1, Lyon, Francia. SAHOS: Síndrome de apnea/hipopnea obstructiva del sueño. Sindrome respiratorio asociado al cierre total (apnea) o parcial (hipopnea) de la vía aérea en forma repetitiva durante el sueño. SaO2: Saturación de oxígeno. SP: Sueño paradójico. SQ: Sueño quieto. SRBD: Desórdenes respiratorios asociados al sueño (sleep related breathing disorders). SWS: Sueño de ondas lentas (slow wave sleep). TRS: Trastornos respiratorios del sueño. TST: Tiempo total de sueño (total sleep time). V: Volumen. VMG: Vibromiografía. VR: Volumen residual. Cantidad de aire que permanece al interior del pulmón, se trata de una cantidad de aire intrapulmonar no movilizable sin importar el esfuerzo espiratorio que se realice. VRE: Volumen de reserva espiratoria. Cantidad de aire, por debajo del volumen corriente que puede ser exhalado con un esfuerzo espiratorio máximo. VRI: Volumen de reserva inspiratoria. Cantidad de aire adicional al volumen corriente que se puede introducir en los pulmones al realizar un esfuerzo inspiratorio máximo. VT: Volumen tidial o volumen corriente. Volumen que sale y entra de los pulmones con cada movimiento respiratorio tranquilo o en reposo. 5 RESUMEN En el presente trabajo se expone el proyecto de tesis correspondiente al examen de calificación del programa de Doctorado en Ingeniería Eléctrica de la Universidad de Chile. El trabajo propuesto se desarrollará en el marco de un convenio de cotutela entre el Departamento de Ingeniería Eléctrica (DIE) de la Universidad de Chile (Chile) y el Laboratoire d’InfoRmatique en Image et Systèmes d’information (LIRIS) de la Université Claude Bernard Lyon 1 (Francia). Dado que el trabajo será realizado en cotutela, se propone la realización de una investigación en la cual se cuente con un tronco común de trabajo y a partir del que se desarrollarán 2 aplicaciones específicas (en relación a los intereses de cada laboratorio). El trabajo a desarrollar (tronco común) consistirá en el desarrollo y aplicación de técnicas de procesamiento de señales respiratorias. Las herramientas resultantes serán aplicadas a dos tareas específicas: 1. Incorporación de señales respiratorias a un modelo biomecánico del proceso respiratorio (LIRIS). 2. Detección de episodios de apnea e hipopnea en registros polisomnográficos (DIE). Para llevar a cabo las tareas anteriores se estudiará la posibilidad de aplicar técnicas avanzadas de procesamiento de señales, por ejemplo: descomposición modal empírica, transformada de Fourier, transformada de Hilbert-Huang, lógica difusa, entre otras. Posteriormente, cada una de estas técnicas y herramientas desarrolladas serán adaptadas para cada una de las aplicaciones. Las hipótesis para cada uno de los casos indican que las técnicas de procesamiento de señales respiratorias permitirán: 1. Incorporar señales respiratorias para adaptar, guiar y mejorar el desempeño de un modelo biomecánico del proceso respiratorio 2. Mejorar la detección de patrones de sueño, específicamente episodios de apnea e hipopnea, y poder relacionarlo con la arquitectura del sueño y ciertas funciones neurocognitivas. 6 1. INTRODUCCIÓN En este trabajo se presenta el proyecto de tesis para realizar el examen de calificación del programa de Doctorado en Ingeniería Eléctrica de la Universidad de Chile. El tema central se relaciona con el desarrollo de herramientas y técnicas de procesamiento de señales respiratorias en dos tareas: i. ii. Modelación y simulación computacional del proceso respiratorio. Detección de patrones respiratorios en registros polisomnográficos de sueño. Las técnicas de procesamiento de señales son poderosas herramientas que pueden ser aplicadas en una serie de ámbitos, especialmente, en aplicaciones biomédicas. En este sentido es de interés estudiar la respiración y los aspectos mecánicos, físicos y fisiológicos que participan en este proceso vital. El desarrollar y aplicar técnicas de procesamiento de señales a variables respiratorias es una tarea de interés dada la amplia gama de aplicaciones que se pueden relacionar. En este trabajo de tesis, se abordará la respiración asociada a dos aplicaciones: respiración y radioterapia, y respiración y sueño. A continuación, se expondrán los aspectos más importantes relacionados con el sistema respiratorio. En primer lugar se estudiarán los órganos y sus funciones, luego los aspectos mecánicos involucrados y las variables que rigen este comportamiento, y finalmente las metodologías y técnicas utilizadas para medir las variables que participan en el proceso respiratorio. Posteriormente se mostrarán las motivaciones para el trabajo a desarrollar, la definición del problema, la propuesta de investigación, la metodología a utilizar y el plan de trabajo. Finalmente se presentan las conclusiones sobre el proyecto propuesto para desarrollar en este trabajo. 7 2. SISTEMA RESPIRATORIO Y RESPIRACIÓN 2.1 El sistema respiratorio La respiración1 corresponde al movimiento de la caja torácica y de los pulmones y a los consecutivos cambios volumétricos y de presión que se presentan en estas estructuras. Es un complejo proceso mecánico que involucra un gran número de componentes, entre ellos: los pulmones y la pleura, la caja torácica y los músculos intercostales, el diafragma y los músculos del abdomen. Los movimientos respiratorios permiten el intercambio gaseoso, es decir, el ingreso de oxígeno al organismo y la expulsión del dióxido de carbono. El ciclo respiratorio (CR) corresponde al proceso alternante de una inspiración y una espiración. La frecuencia respiratoria normal es de aproximadamente 15 veces por minuto, con un volumen promedio de 500 ml de aire. El proceso de inspiración corresponde a la incorporación de aire desde el exterior a los pulmones. Durante la inspiración en reposo los músculos intercostales externos y el diafragma se contraen. El diafragma desciende y los músculos intercostales externos elevan las costillas. Esto produce que el volumen de la caja torácica aumente. La variación de volumen se traduce en una variación de presión (negativa) en la cavidad pleural y producto de esta diferencia de presiones el aire ingresa en los pulmones aumentando su volumen. Finalizada la inspiración comienza el proceso contrario llamado espiración, que corresponde a la salida del aire desde los pulmones hacia el exterior. En reposo es una fase pasiva de la respiración. Los músculos respiratorios se relajan, el diafragma asciende y empuja hacia arriba las bases pulmonares, reduciendo el volumen de la caja torácica. Durante el ejercicio y en algunas patologías, la espiración se convierte en un proceso activo en el cual participan los músculos de la pared abdominal, los músculos intercostales internos y los músculos accesorios de la respiración [10]. La figura 1 muestra las estructuras que intervienen durante el CR. 1 La respiración, como término general, incluye a la ventilación y la respiración celular. La ventilación corresponde al ingreso de aire desde el exterior hacia los pulmones (inspiración), el intercambio de gases a nivel de los alvéolos y la expulsión del aire desde los pulmones al exterior (espiración). La respiración celular es un proceso bioquímico que se produce en las estructuras celulares llamadas mitocondrias, corresponde a la generación de ATP a partir de glucosa para la generación de energía. 8 Figura 1. Etapas del ciclo respiratorio (CR). a) Durante la inspiración el diafragma se contrae y desciende, los músculos intercostales externos se contraen elevando las costillas y aumentando el tamaño del tórax (etapa activa del CR), esto produce un gradiente de presión que permite el ingreso de aire a los pulmones y la expansión de éstos. b) Durante la espiración los músculos se relajan (diafragma y músculos intercostales externos) volviendo a sus posiciones de reposo, disminuyendo el tamaño de la caja torácica y produciendo la salida del aire desde los pulmones hacia el exterior (etapa pasiva del CR). 2.1.1 Componentes del sistema respiratorio En la respiración participan diversas estructuras que actúan en conjunto para mantener la correcta mecánica respiratoria y que se describe con mayor detalle a continuación. 9 Figura 2. Componentes del aparato respiratorio humano: está formado por las vías aéreas: orificios y fosas nasales, faringe, laringe, tráquea, bronquios y bronquiolos; los pulmones, la pleura, la caja torácica: costillas, esternón (omitido en la figura), músculos intercostales (internos y externos) y vertebras torácicas; el diafragma y el sistema circulatorio pulmonar. Vías aéreas Corresponden a la parte superior del aparato respiratorio por la cual transita el aire hacia los pulmones. Están compuestas por las siguientes estructuras: nariz (fosas y orificios), boca, faringe, laringe, tráquea, bronquios y bronquiolos [10]. Los pulmones Los pulmones ocupan la mayor parte del volumen del tórax. Ambos pulmones se encuentran separados por el mediastino, que incluye el corazón, importantes venas y arterias, el esófago y la tráquea (Figura 3). Cada pulmón tiene la forma de un semicono, de eje mayor vertical, con su superficie externa convexa en contacto con la pared torácica, una cara medial que contiene el hilio pulmonar (vasos y bronquios) y una base adaptada a la forma del diafragma. El pulmón derecho se encuentra más elevado y es de mayor tamaño que el izquierdo; presenta dos cisuras (horizontal y oblicua) que lo dividen en tres lóbulos: superior, medio e inferior. El pulmón izquierdo por su parte se encuentra en estrecha relación con el corazón y posee sólo una cisura (principal u oblicua) que lo divide en los lóbulos superior e inferior [10]. 10 Figura 3. Anatomía de los pulmones: están ubicados dentro de la caja torácica, se encuentran separados por el mediastino. El pulmón derecho es el de mayor tamaño, posee dos cisuras (horizontal y oblicua) que lo divide en tres lóbulos: superior, medio e inferior. El pulmón izquierdo está en estrecho contacto con el corazón, es de menor tamaño y posee sólo una cisura (oblicua) que lo divide en los lóbulos superior e inferior. La función principal de los pulmones es el intercambio de gases con el ambiente. Durante la respiración los pulmones siguen pasivamente los movimientos de la caja torácica y el diafragma produciendo la inflación/deflación de éstos. En un adulto, ventilan en promedio 10800 litros de aire diarios, con un paso de 5700 litros de sangre, permitiendo el intercambio de casi 600 litros de oxígeno y 460 litros de dióxido de carbono. La pleura La pleura separa a los pulmones de los demás órganos (ver figura 2). Está compuesta de dos membranas: la pleura parietal que cubre la pared torácica, el mediastino y el diafragma y la pleura visceral que cubre la superficie externa de los pulmones. El espacio entre ambas pleuras corresponde a la cavidad pleural y está ocupado por el líquido pleural [10]. El volumen normal de líquido pleural en un adulto es de aproximadamente 0,1 a 0,2 ml/kg de peso. La caja torácica La caja torácica es el volumen definido por el esternón, las costillas y los músculos intercostales y por las doce vertebras torácicas. Tiene forma de cono truncado o pirámide cuadrangular. Su función es la de proteger al corazón y los pulmones, además tiene la capacidad de ensancharse para producir la inspiración. La figura 4 muestra la anatomía de la caja torácica. 11 Figura 4. Anatomía de la caja torácica: está formada por el esternón, las 12 costillas y las vertebras torácicas, los músculos intercostales internos y externos y los ligamentos intercostales. La pared de la caja torácica está formada por 12 pares de costillas y los músculos intercostales: internos y externos; 7 pares de costillas están unidas directamente al esternón desde las vertebras torácicas, 3 pares se encuentran unidas al esternón a través de cartílago y 2 pares, llamadas costillas flotantes, sólo están unidas a la columna vertebral. Estas últimas, al no estar ligadas, permiten una mayor movilidad del diafragma durante el proceso inspiratorio. El movimiento de las costillas es llevado a cabo por los músculos intercostales; los músculos intercostales internos se activan sólo durante la espiración forzada, mientras que los músculos intercostales externos se activan durante la inspiración forzada [10]. El diafragma El diafragma es el músculo más importante de la respiración. La figura 5 muestra la anatomía de este músculo. Corresponde a un músculo de tipo digástrico con un espesor promedio de 3 a 5 cm. Separa la cavidad torácica de la cavidad abdominal. Está constituido por una zona muscular periférica y una parte central formada por tendones; todas sus fibras confluyen en el centro frénico. En este músculo existen varios orificios, entre los que destacan el hiato aórtico (para el paso de la aorta y el conducto torácico), el hiato esofágico (para el paso del esófago y los troncos vagales) y el orificio para la vena cava inferior y en algunos casos el nervio frénico derecho. También lo atraviesan varios nervios y vasos linfáticos. 12 Figura 5. Anatomía del diafragma: músculo digástrico formado por un tendón central (parte más alta) y por fibras musculares que confluyen en dicho tendón, posee algunos orificios (hiatos) para el paso de la vena cava inferior, la aorta (crura diafragmática), el esófago y algunos nervios. Es el principal músculo respiratorio. Durante la inspiración las fibras musculares tensan hacia abajo el tendón central, produciendo un incremento en la dirección vertical del tórax, lo que produce una disminución de presión al interior de los pulmones. Cuando el diafragma se relaja y vuelve a su posición normal, curvado hacia arriba, los pulmones se contraen y el aire sale. Además, al contraerse presiona el abdomen ayudando al estómago a realizar el proceso de digestión [10]. Músculos accesorios Los músculos accesorios son aquellos que no participan del proceso de respiración tranquilo (reposo), pero sí durante la respiración forzada o en ciertas patologías respiratorias, la figura 6 presenta estos músculos. Los escalenos ayudan en la elevación de las primeras costillas. Los músculos pectorales y esternocleidomastoideos elevan el esternón. Los músculos de la pared abdominal anterior: oblicuos interno y externo, transverso y recto del abdomen ayudan en ciertas patologías generando una espiración activa [10]. 13 Figura 6. Músculos accesorios de la respiración: son aquellos que no participan durante la respiración tranquila, se activan durante la respiración forzada, por ejemplo durante el ejercicio o en ciertas patologías. Los músculos son los siguientes: esternocleidomastoideo, escalenos, pectorales, recto del abdomen, oblicuo externo e interno y transverso del abdomen. Las flechas indican la dirección del movimiento del músculo durante su contracción. 2.1.2 Mecánica respiratoria En este capítulo se examina el comportamiento mecánico del sistema respiratorio, para ello se describen los principales componentes que entran en juego durante la respiración y las variables que pueden ser monitoreadas durante el proceso. La figura 7 describe la ecuación de movimiento de la mecánica clásica, para un móvil de masa M sobre un plano, unido a un resorte y un amortiguador. Figura 7. Ecuación de movimiento de la mecánica clásica. F, es la suma de las fuerzas aplicadas al sistema, x la posición del móvil, k la constante del resorte, ν el coeficiente de roce, y M la masa del móvil unido al resorte. 14 Por analogía, se puede establecer la misma ecuación para el sistema respiratorio (ver figura 8), donde éste es modelado como un fuelle conectado al exterior por medio de un tubo de resistencia no nula al flujo2 [55][86][102]. Figura 8. Analogía de la ecuación de movimiento para el sistema respiratorio. P representa la presión que genera el flujo de aire en los pulmones, V es el volumen del fuelle, C la compliance o distensibilidad del sistema respiratorio (pulmón y caja torácica), R la resistencia al flujo de aire e I la inercia relativa a la aceleración de presión. Esta analogía permite ligar las características mecánicas del proceso respiratorio a los volúmenes y presiones pulmonares. A continuación, se explican cada uno de estos conceptos. Volúmenes y capacidades pulmonares Normalmente se habla de volúmenes y capacidades respiratorias [101], los volúmenes son aquellas cantidades de gas que ya no pueden ser subdivididas, mientras que las capacidades corresponden a la suma de dos o más volúmenes. La figura 9 muestra y explica cada uno de los volúmenes y capacidades pulmonares. 2 Este modelo fue planteado por primera vez por Leonardo Da Vinci, 5 siglos después sigue siendo válido. 15 Figura 9. Volúmenes y capacidades pulmonares. Un individuo respira normalmente en promedio 15 veces por minuto. En cada respiración ingresan aproximadamente 500 ml de aire que corresponden al volumen corriente o tidial (VT). La frecuencia, así como la profundidad de la respiración, pueden cambiar el volumen respirado. El aumento máximo del volumen inspirado sobre el nivel de VT, corresponde al volumen de reserva inspiratoria (VRI). El aumento del volumen inspirado trae como consecuencia un aumento en el volumen de aire espirado, en este caso el volumen de aire espirado máximo por debajo del nivel de VT (espiración forzada), corresponde al volumen de reserva espiratoria (VRE). Aún realizando un esfuerzo espiratorio máximo queda una cantidad de aire en los pulmones, el cual no puede ser movilizado, éste corresponde al volumen residual (VR). La máxima cantidad de aire que pueden contener los pulmones corresponde a la capacidad pulmonar total (CPT). El volumen existente luego de una espiración tranquila es la capacidad funcional residual (CFR). El volumen de aire inspirado máximo que ingresa a los pulmones desde CFR corresponde a la capacidad inspiratoria (CI). La capacidad vital (CV) es el volumen que puede ser inspirado con un esfuerzo inspiratorio máximo desde VR. Desde una perspectiva funcional los volúmenes y capacidades pulmonares pueden ser divididos en: dinámicos, aquellos que se movilizan con la respiración y estáticos, aquellos que no se movilizan (VR y las capacidades que lo contienen: CFR y CPT) [101]. Los volúmenes y capacidades pulmonares dinámicas pueden ser determinados en base a un test de función mecánica respiratoria llamada espirometría [3][100][109]. Los volúmenes y capacidades estáticos pueden ser medidos utilizando técnicas como la pletismografía corporal [2][33], el método de dilución de gases [100] e imagenología [32]: imágenes de resonancia magnética (MRI) [76], tomografía computarizada (CT 3D) [61][74], ultrasonido [71], entre otras. 16 También es posible deducir volúmenes y capacidades pulmonares a través de los cambios de volumen de la caja torácica y del abdomen utilizando pletismografía inductiva respiratoria [15][45][129] o neumografía inductiva respiratoria [88]. Presión Los cambios de presión producidos por la acción de los músculos respiratorios son los responsables del ingreso de aire a los pulmones [10]. Las presiones más importantes que participan en el proceso respiratorio son las siguientes: 1. Presión barométrica (Pb): presión existente en la superficie del cuerpo y en la vía aérea. 2. Presión alveolar (Palv): presión dentro del alvéolo. En equilibrio se puede señalar que: Pb=Palv. 3. Presión pleural (Ppl): presión dentro de la cavidad pleural. 4. Presión esofágica (Pes): presión dentro del esófago. En equilibrio se tiene que Ppl=Pes. 5. Presión gástrica (Pg): presión medida en el estómago, justo por debajo del diafragma. 6. Presión transpulmonar (Ptp=Palv-Ppl): diferencia de presión que se requiere para contrarrestar la retracción elástica del pulmón. 7. Presión transtorácica (Ptt=Ppl-Pb): diferencia de presión a través de la pared torácica, corresponde a la diferencia de presión que se requiere para contrarrestar la retracción elástica de la caja torácica. 8. Presión transdiafragmática (Ptd=Pg-Ppl): presión ejercida sobre la superficie del diafragma. 9. Presión transtotal (Pt): corresponde a la suma de Ptp y Ptt, y corresponde a la diferencia de presión necesaria para vencer la suma de la resistencia de las vías aéreas y la retracción elástica del pulmón. La medida de las presiones involucradas en el proceso respiratorio es una tarea difícil, principalmente debido a que se trata de técnicas invasivas y requieren de la correcta participación del paciente. Normalmente se utiliza un balón de presión insertado a través de la vía esofágica para medir Pes, la que en condiciones de equilibrio se puede aproximar a la Ppl. Por otra parte, se utiliza un manómetro para la medición de la Pb. Con estos valores es posible obtener la presión transtorácica, Ptt. Distensibilidad pulmonar Con las medidas simultáneas de presión y volumen se pueden obtener las curvas presiónvolumen pulmonar (P-V) [55][86][102]. La pendiente de la curva P-V equivale a la compliance o distensibilidad pulmonar, que corresponde al cambio de volumen por cada unidad de cambio de presión, como se puede ver en la ecuación 1.1, es decir, entrega información sobre la mayor o menor facilidad del pulmón para aumentar su volumen, el inverso de la distensibilidad corresponde a la elasticidad y mide la fuerza de retracción pulmonar. C ( p) = ∆V , ∆P (1.1) 17 las curvas P-V son diferentes si se trata de inspiración o espiración. Este fenómeno es conocido como histéresis, y se traduce en que a una presión dada el volumen pulmonar es mayor durante la espiración que durante la inspiración [42]. La figura 10 muestra un ejemplo de una curva P-V que muestra el fenómeno de histéresis del pulmón durante los procesos de inspiración y espiración. Los factores involucrados en la distensibilidad pulmonar vienen dados por [10]: 1. las fibras elásticas del pulmón en estructura reticular, esto debido a que la distensibilidad de una red es mayor que la de las fibras que la constituyen; y 2. la interface aire-líquido de los alvéolos: las fuerzas de atracción intermolecular son mayores en los líquidos que en los gases. En la interfaz aire-líquido, las moléculas superficiales son atraídas más hacia el líquido que hacia el gas, produciendo una tensión superficial (tendencia de una burbuja a retraerse), este fenómeno es producido por el surfactante3. Figura 10. Representación de la curva presión-volumen (P-V). La curva ascendente representa la inspiración y la curva descendente la espiración. La pendiente de la curva PV corresponde a la distensibilidad pulmonar o compliance (C). La distensibilidad pulmonar varía según se produzca la inspiración o espiración, fenómeno conocido como histéresis. El volumen máximo corresponde al punto de inestabilidad elástica en el cual por efecto de la presión se pierden las propiedades elásticas debido a la acción de los receptores de 3 El surfactante es una sustancia compleja que contiene fosfolípidos y un número de apoproteínas. Este líquido esencial es producido por las células alveolares Tipo II, y cubre los alveolos y pequeños bronquiolos. El surfactante reduce la tensión superficial en todo el pulmón. 18 estiramiento. También se puede observar que a pesar de que P=0, todavía existe aire en los pulmones, el que corresponde al VR. La distensibilidad varía en las distintas zonas del pulmón, distensibilidad regional, debido al efecto de las diferentes presiones transpulmonares, dado que el efecto de la gravedad hace que Ptp sea mayor en la base que en el ápice del pulmón (por la posición que adoptan los alvéolos). También es importante señalar el efecto de la distensibilidad de la caja torácica sobre la distensibilidad del sistema respiratorio, esto debido a la tendencia de la caja torácica a expandirse, lo que produce que la pleura visceral “siga” este movimiento y colabore en mantener los pulmones expandidos. Resistencia La resistencia es el impedimento que encuentra el aire para ventilar los pulmones. Esta resistencia se presenta en 2 estructuras: la vía aérea y el parénquima pulmonar (alvéolos). La vía aérea presenta una resistencia al roce del aire inspirado/espirado con las paredes de la misma (resistencia resistiva), mientras que el parénquima presenta una resistencia a la distensión debido a la tendencia al colapso que tiene (resistencia elástica) [20]. La resistencia del parénquima es despreciable en comparación con la resistencia de la vía aérea, por lo que al referirnos a resistencia estaremos considerando sólo la resistencia de la vía aérea. La resistencia de la vía aérea (Raw) se define a través de la relación mostrada en la ecuación 1.2: Raw = ∆P , ∆V (1.2) normalmente se utiliza el concepto de conductancia (Gaw) que es el inverso de la Raw. La resistencia en la vía aérea depende de si el flujo es laminar o turbulento, de las dimensiones de la vía aérea (largo l y radio r) y de la viscosidad del gas (γ). En el flujo laminar, la resistencia es muy baja. Esto se debe a que se necesita una presión de empuje pequeña para producir cierta velocidad de flujo. La resistencia durante el flujo laminar se puede calcular por la ley de Hagen-Poiseuille: R= 8lγ , π r4 (1.3) En la ecuación (1.3) podemos ver que la variable más importante es el radio r, que viene dado por su elevación a la cuarta potencia, lo que produce un gran impacto en el valor de la resistencia. Los principales factores que afectan el radio de las vías aéreas son: tono del músculo liso bronquial, diferencias de presión en las paredes de la vía aérea y factores físicos (temperatura, humedad, etc.). Durante el flujo turbulento la resistencia es relativamente mayor, necesitándose mayores diferencias de presión para aumentar el flujo (comparado con el caso laminar). Dado que 19 la relación presión/flujo deja de ser lineal durante el flujo turbulento, no existe una ecuación para comparar su resistencia. La resistencia también depende del número de vías paralelas presentes; por esta razón, las vías aéreas grandes y de medio tamaño presentan una resistencia mayor al flujo que la que ofrecen las muy numerosas pero pequeñas vías aéreas. En relación a este punto se puede indicar que cerca del 80% de la Raw viene dada por la tráquea y los bronquios y sólo un 20% corresponde a bronquíolos. La Raw tiende a disminuir a medida que aumenta el volumen pulmonar, porque la vía aérea se distiende cuando los pulmones se inflan, ampliándolas [10]. Para la determinación de la Raw se utiliza el pletismógrafo [40], el balón esofágico [134], el método de oscilación forzada [95] y espirometría forzada [100]. Contracción Muscular Los músculos respiratorios son un elemento activo fundamental durante la respiración. Su contracción en condiciones adecuadas es la que genera el gradiente de presiones que permite la entrada de aire en los pulmones. En este punto es de vital importancia la acción ejercida por el diafragma. El diafragma ha sido estudiado utilizando técnicas como la electromiografía (EMG) [9][93]; vibromiografía (VMG) [138] o fonografía, que permiten determinar la actividad mecánica y eléctrica del músculo. También se utilizan técnicas que en forma indirecta permiten relacionar la fuerza muscular respiratoria utilizando medidas de presión [56][70][93]. El inconveniente de estas técnicas es que requieren de la participación y cooperación del paciente, por lo que muchas veces las mediciones pueden ser erróneas. Para superar esta dificultad se han desarrollado técnicas que permiten mejorar la medición de la fuerza muscular, las principales son la estimulación eléctrica o magnética del nervio frénico [50][69][93][94][134]. 2.1.3 Técnicas de medición de las variables respiratorias Espirometría Ésta es una prueba fisiológica que mide como un individuo inhala y exhala volúmenes de aire en función del tiempo (espirometría simple) y la rapidez con la que estos volúmenes y capacidades son movilizados (espirometría forzada). Permite determinar curvas de tipo volumen/tiempo y flujo/volumen como las mostradas en la figura 11 [3][109]. 20 Figura 11. Curvas volumen/tiempo y flujo/volumen medidos utilizando espirometría. Pletismografía corporal Es una prueba para medir la cantidad de aire que queda en el pulmón luego de una espiración forzada (volúmenes estáticos) [2][33]. Para realizar esta prueba es necesario que el paciente se ubique en una cabina herméticamente cerrada, conectado a un espirómetro a través de una boquilla y con una pinza en la nariz. El paciente respira en forma normal por un corto período de tiempo y luego se procede a cerrar la boquilla durante algunos segundos. Durante este período el paciente continúa respirando aunque no haya flujo (dado que la válvula está cerrada). Una vez abierta la válvula el paciente debe realizar una espiración forzada seguida de una inspiración forzada hasta CPT y luego una maniobra espiratoria forzada para después respirar tranquilamente. Los cambios de presión y volumen que producen los esfuerzos respiratorios del paciente para vencer el obstáculo permiten estimar, mediante ecuaciones matemáticas complejas, el volumen de gas intratorácico. Método de dilución de gases El método de dilución de gases consiste en conectar al paciente a un circuito cerrado que tiene una mezcla de gas con un volumen total y un porcentaje de gas marcador conocidos (normalmente He), junto con oxígeno a una concentración próxima a la ambiental. Durante la prueba, el paciente respira normalmente, con lo que el He se mezcla con el gas del pulmón y las vías aéreas, disminuyendo su concentración y aumentando la concentración alveolar. El principio físico en el que se basa esta prueba es que la cantidad total de gas inicial será igual a la final, ya que ni se transfiere (es prácticamente insoluble en los tejidos) ni se destruye. Por tanto, si se miden sucesivamente las concentraciones de He, llegará un momento en el que se alcance un equilibrio, con concentraciones prácticamente constantes. Esta técnica permite medir el gas en contacto con la vía aérea. 21 Pletismografía inductiva respiratoria La pletismografía inductiva respiratoria consiste en la utilización de sensores para medir los cambios del área transversal de la caja torácica y abdominal durante un CR. Típicamente los sensores consisten en una matriz de hilos de cobre ordenados en forma de bobina y excitados por un circuito oscilador de alta frecuencia y baja corriente. Los movimientos del tórax y el abdomen propician la generación de campos magnéticos que se miden como variaciones de voltaje en función del tiempo. A través de un proceso de reconstrucción es posible estimar las curvas de volumen torácico y abdominal, además de obtener información cardiaca (electrocardiograma) [15][40][45][129]. La pletismografía es una técnica no invasiva, los últimos trabajos se han enfocado al desarrollo de chaquetas que posibilitan la medición de las señales respiratorias y cardiacas sin contacto (VISURESP) [15], aplicando estos desarrollos a la telemedicina. Técnicas de medición actividad muscular La EMG consiste en la aplicación de electrodos sobre la piel que miden la actividad eléctrica del músculo o en la aplicación de electrodos de bajo voltaje en forma de agujas en la zona muscular para aplicar pequeñas corrientes para generar la contracción del músculo y luego medir la actividad eléctrica. Es una prueba que permite estudiar el estado tanto del sistema nervioso periférico como muscular. La VMG es una técnica que registra las vibraciones que ocurren en el músculo esquelético cuando se contrae. Se aplica principalmente para la detección de diferentes desordenes musculares. También se utilizan técnicas basadas en mediciones de presión, las que relacionan la presión ejercida en la boca con los niveles de activación de los músculos respiratorios, principalmente del diafragma [56][70][134]. La estimulación muscular corresponde a la provocación de una contracción de un músculo o grupo muscular mediante un estímulo eléctrico. Este examen permite comprender y estudiar la excitación eléctrica de las fibras nerviosas motoras periféricas y del tejido muscular. 22 3. MOTIVACIÓN La respiración es un proceso complejo y vital para todos los seres vivos. Constantemente nuestro sistema respiratorio se ve expuesto a sustancias nocivas que pueden afectar su correcto funcionamiento, provocando desde un simple resfrío, gripe, neumonía, TRS, pudiendo incluso llegar a un cáncer de pulmón. En este trabajo se estudiará el proceso respiratorio, más precisamente las señales respiratorias que pueden ser medidas, de manera de relacionar la respiración con 2 aplicaciones: 1. Respiración y radioterapia. 2. Respiración y sueño. 3.1 Respiración y radioterapia La radioterapia es una de las técnicas más efectivas utilizada para el tratamiento del cáncer. Se basa en el empleo de radiaciones ionizantes (ondas electromagnéticas) o haces de partículas, conocidas como hadrones, para la destrucción de los tejidos tumorales, bloqueando su capacidad de multiplicarse. El objetivo en un proceso de radioterapia es conservar los tejidos sanos en forma indemne, concentrando la dosis irradiada de manera óptima en el tumor. Esto es difícil de lograr, especialmente en el caso de tumores pulmonares, debido al movimiento del pulmón, y por ende el del tumor, producido principalmente por la respiración del paciente. Variados trabajos se han realizado para medir la magnitud del desplazamiento del pulmón durante la respiración [7][41][92][119]. Los resultados muestran desplazamientos de entre 4 a 30 mm, principalmente en las direcciones cráneo-caudal4, lateral5 y antero-posterior6, y de mucho mayor magnitud en la base del pulmón que en su parte superior o ápice. De la misma manera, estudios sobre el movimiento del tumor, como los mostrados en [41][87][92][118][119] señalan que éstos presentan un movimiento “no predecible”. Este hecho se explica por la dificultad de inspirar y espirar un mismo volumen de aire durante distintos CR. Además, el movimiento de un tumor durante dos CR idénticos varía, debido a que existen diversas formas para obtener un mismo volumen respiratorio, por ejemplo, realizando respiración puramente torácica, puramente abdominal o una mezcla de ambas. Dada esta situación es que el conocimiento de la posición del pulmón y a través de ella la predicción en tiempo real de la posición del tumor pulmonar durante cualquier etapa del CR podría mejorar drásticamente el tratamiento radiológico del cáncer pulmonar. Para la planificación de la radioterapia, proceso conocido como dosimetría, se debe definir 4 La dirección cráneo-caudal corresponde al eje vertical que atraviesa al paciente desde la cabeza a los pies. 5 La dirección lateral corresponde al eje que atraviesa al paciente de izquierda a derecha. 6 La dirección antero-posterior corresponde al eje que atraviesa al paciente desde la parte dorsal a la parte ventral. 23 la zona de irradiación y la dosis a aplicar, de manera de dirigir el haz de manera óptima sobre el tumor. La zona de irradiación se determina a partir de la adquisición de imágenes 3D del paciente, previas al tratamiento. Esta definición previa trae como consecuencia que no se consideran las variaciones en los movimientos respiratorios que el paciente experimenta durante la radioterapia, los que ocurren por estrés, posición adoptada u otros factores. Con la finalidad de disminuir esta fuente de error se han desarrollado variadas técnicas que permiten mejorar el proceso de irradiación pulmonar, que se dividen en dos grupos importantes: i) técnicas de “gating” respiratorio [48][84][87][136] y ii) técnicas de “tracking” [35][46][113]. Las técnicas de gating respiratorio consisten en irradiar el tumor pulmonar en un instante preciso del CR del paciente. Se pueden definir dos tipos: 1. Técnicas activas: son aquellas que controlan la respiración del paciente. Principalmente se utiliza el bloqueo del flujo de aire y en la mayoría de los casos se realiza en inspiración máxima. Las principales variantes corresponden al bloqueo forzado del aire mediante algún dispositivo, por ejemplo el active breathing control (ABC) [136] o al bloqueo voluntario realizado por el paciente. 2. Técnicas pasivas o empíricas: estos métodos utilizan medidas externas para adaptar el protocolo de irradiación en función del movimiento dado por el CR [84]. En este caso se utilizan principalmente marcadores sobre la piel del paciente para determinar el momento exacto para la irradiación. Las técnicas de tracking se basan en la utilización de imágenes médicas obtenidas en instantes distintos del CR. En este grupo los métodos más utilizados corresponden a las técnicas basadas en modelos de simulación computacional. Estas técnicas utilizan modelos gráficos del pulmón y tórax y modelos de predicción del movimiento respiratorio de la caja torácica para predecir el movimiento del tumor y poder “seguirlo” durante el proceso de irradiación. 3.2 Respiración y sueño El sueño es un estado biológico indispensable, que en humanos comprende aproximadamente un tercio de las 24 horas del día. Está caracterizado por una pérdida reversible de conciencia, una disminución de los niveles de actividad fisiológica y una baja respuesta a los estímulos externos. Está controlado por procesos circadianos y homeostáticos [18][25]. El sueño no es homogéneo, pues existen 2 estados: sueño paradójico (SP) y sueño quieto (SQ). Estos estados pueden ser identificados por la concordancia temporal de patrones de las actividades electroencefalográfica (EEG), electrooculográfica (EOG) y electromiográfica (EMG). Clásicamente el SQ ha sido dividido en 4 etapas de acuerdo a los patrones presentes en el EEG (SQ1, 2, 3 y 4) [106], pero actualmente las etapas de SQ3 y 4 son consideradas como una sola etapa llamada sueño profundo o sueño de ondas lentas (SWS) [17]. Los trastornos respiratorios del sueño (TRS) o alteraciones respiratorias asociados al sueño (sleep related breathing disorders, SRBD) tienen relación con la obstrucción 24 repetitiva, completa o parcial, de la vía aérea superior durante el sueño, causando el cese completo del flujo aéreo (apnea) o la reducción del flujo de aire (hipopnea), patología denominada síndrome de apnea/hipopnea obstructiva del sueño (SAHOS) [54]. La identificación precisa y confiable de apneas e hipopneas es crítica tanto para establecer el diagnóstico como para estimar la severidad del mismo [107]. En condiciones normales, los músculos de la parte superior de la faringe mantienen la vía aérea permeable y permiten que el aire fluya hacia los pulmones. Aunque estos músculos se relajan durante el sueño, la parte superior de la faringe permanece lo suficientemente abierta para permitir el paso del aire. Sin embargo, algunas personas tienen un área más estrecha y durante el sueño la relajación de estos músculos hace que el pasaje se cierre, completa o parcialmente, lo que impide que el aire ingrese a los pulmones. El estrechamiento de la vía aérea durante el sueño puede estar magnificado, entre otros, por sobrepeso u obesidad, el hecho de fumar (incluso exponerse al humo del cigarrillo), consumo de alcohol, uso o abuso de sustancias depresoras del sistema nervioso central y/o horarios irregulares de sueño. Los patrones respiratorios durante el sueño son muy variables, pero incluyen obstrucción cíclica, aumento del esfuerzo respiratorio, restricción de flujo aéreo, taquipnea (aumento de la frecuencia respiratoria por encima de los valores normales), y/o trastornos del intercambio gaseoso. Si bien el despertar (o micro-despertar) abre inmediatamente la vía aérea y normaliza el intercambio gaseoso, también altera la continuidad del sueño. Efectivamente, éste es un fenómeno gradual que implica modificaciones neurofuncionales (en particular, activación de los músculos dilatadores de la faringe), manifestándose desde una sutil modificación autonómica (o activación subcortical), hasta un despertar electro-cortical visible en el EEG. Si bien el umbral de obstrucción que implica interferencia de la homeostasis (fragmentación) del sueño es mayor en SWS, intermedio en etapa de SQ2 y menor en SP, el principal estímulo para despertar es el esfuerzo respiratorio y la hipercapnia (aumento de la presión parcial de CO2) [107]. La fisiopatología de la obstrucción de la vía aérea es una compleja interacción entre su predisposición hacia el colapso y la compensación neuromuscular. En efecto, las dimensiones anatómicas del lumen de la vía aérea, de los tejidos blandos y del esqueleto, son relevantes para el desarrollo de la obstrucción, pero no permiten explicar completamente el patrón de TRS. Esto indica que factores tales como la activación neuromuscular, el control ventilatorio y el umbral de despertar juegan roles claves en la permeabilidad de la vía aérea durante el sueño. Al inicio del sueño, durante el SQ, se reduce la actividad muscular de la vía aérea, aumenta la variabilidad ventilatoria y el umbral apneico queda ligeramente por debajo del nivel normal. La colapsabilidad de la vía aérea es compensada por la actividad del dilatador faríngeo en respuesta a la hipercapnia y a la presión negativa intraluminal. Los mecanismos de control respiratorio modulan tanto la ventilación como la activación de los músculos dilatadores de la faringe. La fragmentación del sueño contribuye a la inestabilidad ventilatoria y, en consecuencia, a la instalación de la obstrucción cíclica. Durante SP, las reducciones paroxísticas de la actividad del dilatador faríngeo relacionadas con los procesos cerebrales propios de dicho estado de sueño contribuyen a magnificar la severidad de las obstrucciones. 25 El SAHOS implica un sueño fragmentado y no sosegado, asociado con somnolencia diurna excesiva y reducción de la calidad de vida (cansancio, problemas de concentración, cambios de personalidad, etc.). Además, diversos estudios en niños muestran que quienes presentan este síndrome se caracterizan por ser hiperactivos. Una persona con SAHOS generalmente ronca muy fuerte al comienzo del sueño. Estos ronquidos continúan en forma regular durante un tiempo (pudiendo hacerse más fuertes), pero luego son interrumpidos por un largo periodo de silencio durante el cual no hay respiración, esto va seguido por un fuerte resoplido y jadeo para retornar a los ronquidos, produciendo un cambio a una etapa de sueño más ligero. Este patrón se repite frecuentemente a lo largo de la noche [54]. La hipótesis diagnóstica se establece en base a la historia y los antecedentes clínicos y el examen físico, mientras que la confirmación del SAHOS se realiza utilizando polisomnografía [72]. La polisomnografía es el registro simultáneo (adquisición de datos) de diversas variables durante el sueño. 26 4. DEFINICIÓN D DEL PROBLEMA Este trabajo de tesis se centrará en el desarrollo y aplicación de herramientas de procesamiento de señales respiratorias aplicadas a: 1. ell estudio de la mecánica de la respiración para el mejoramiento y monitoreo de un modelo de simulación computacional para el seguimiento del tumor pulmonar durante la radioterapia, y 2. el desarrollo de técnicas de procesamiento de señales aplicadas a registros polisomnográficos isomnográficos para la detección de episodios de SAHOS y su relación con la arquitectura del sueño. La figura 12 muestra un diagrama explicativo del problema a abordar en este trabajo. Figura 12: Diagrama explicativo del tema de tesis a desarrollar. Este ste trabajo tendrá un tronco central común ún para ambas aplicaciones. Este ste tronco común com corresponde al desarrollo y aplicación ón de técnicas t de procesamiento de señales es aplicadas a variables respiratorias. Estas técnicas écnicas serán serán aplicadas al mejoramiento de un sistema de modelación ón computacional del proceso respiratorio y a la detecci detección de patrones respiratorios en registros polisomnogr polisomnográficos. 27 4.1 Modelos de respiratorio simulación computacional del proceso Las técnicas desarrolladas hasta ahora para el mejoramiento de la dosimetría en radioterapia para tumores pulmonares presentan imprecisiones. Las técnicas de gating tratan de corregir el hecho de que los CR no son iguales, pero se ven afectadas por no considerar que el tumor varía su posición aún para un mismo volumen respiratorio. Además, son técnicas que necesitan de la cooperación y participación del paciente y son altamente invasivas. Por otra parte, las principales técnicas de tracking consideran el hecho de que el movimiento del tumor y los CR son no predecibles, pero se ven afectadas principalmente porque utilizan información obtenida antes del tratamiento (imágenes médicas). Por lo anterior, es de interés el desarrollo de un modelo respiratorio que incorpore los factores que producen la no predictibilidad del movimiento del tumor, que sean no invasivos y requieran la mínima participación del paciente. En el laboratorio LIRIS (Laboratoire d’InfoRmatique en Image et Systèmes d’information), el equipo SAARA (Simulation, Analyse et Animation pour la Réalité Augmentée) de la Université Claude Bernard Lyon 1, Lyon-Francia, ha trabajado por varios años en el desarrollo de modelos de simulación por computación gráfica, específicamente en el desarrollo de modelos 3D de tórax y pulmón para el seguimiento del tumor durante la respiración [38][39]. Estos modelos de simulación del proceso respiratorio están basados en leyes mecánicas (físicas) y consideraciones anatómicas, pero no incluyen hasta ahora la adquisición de valores de variables respiratorias medibles potencialmente relevantes, tales como el volumen y flujo de aire, actividad eléctrica muscular, características de la vía aérea y elasticidad pulmonar, entre otras. Por otra parte se han desarrollado trabajos en el ámbito de procesamiento de señales respiratorias, que apuntan a describir la variabilidad y complejidad del proceso en humanos [12], pero no se han utilizado en un modelo de simulación computacional. Por lo anterior, es de interés estudiar la posibilidad de incluir información tanto del proceso mecánico y las consideraciones anatómicas, como las variables medibles on-line para obtener un modelo de simulación computacional que permita una mejor simulación de la respiración del paciente. También es de interés el poder realizar la correlación entre las distintas variables respiratorias medidas para poder realizar procesos de reconstrucción de las señales en los casos en que éstas no estén disponibles. 4.2 Trastornos respiratorios del sueño (TRS) Los TRS representan un problema relevante de salud en términos de alta prevalencia, con niveles relevantes de morbilidad y mortalidad [107]. Los pacientes con SAHOS presentan repetidas alteraciones en los estados del sueño y la respiración, asociados con cambios hemodinámicos que incluyen alteraciones de la presión arterial, frecuencia cardiaca y función cardiovascular. También aparecen alteraciones en las funciones neurocognitivas, especialmente en niños. La polisomnografía es la herramienta principal para la confirmación diagnóstica de SAHOS [72]. Para ello se deben registrar las siguientes señales: flujo aéreo, esfuerzo ventilatorio, recambio gaseoso, monitorización de la saturación de O2 (SaO2), EEG, EOG, 28 EMG, ECG, movimientos corporales, ronquidos, posición, etc. Una vez realizada la polisomnografía se debe efectuar el diagnóstico de los estados de sueño y de vigilia, y luego analizar la eficacia y la eficiencia del sueño, tiempo total de sueño (TST), latencia al sueño, microdespertares, porcentaje de SP y de SQ, número y duración de apneas e hipopneas (IAH), índice de micro-despertares (arousals) e índice de movimiento periódico de piernas [67]. El Laboratorio de Ingeniería Biomédica del Departamento de Ingeniería Eléctrica de la Universidad de Chile, en conjunto con el Laboratorio de Sueño del Instituto de Nutrición y Tecnología de los Alimentos (INTA) de la Universidad de Chile, han trabajado en el desarrollo de una amplia base de datos de registros polisomnográficos de niños, con un seguimiento que va desde los 6 meses hasta los 16 años de edad. También cuentan con una amplia serie de pruebas neurocognitivas. En el ámbito de la colaboración entre ambos laboratorios se han desarrollado sistemas para la detección de estados y etapas de sueño [43][57], detección de patrones de sueño: husos sigma [58] y movimientos oculares rápidos; y herramientas para el análisis del polisomnograma y del hipnograma7. En esta línea de investigación es de interés el estudio y determinación de los episodios de apnea e hipopnea (SAHOS), índice de micro-despertares y el estudio de la arquitectura del sueño utilizando técnicas de procesamiento de señales aplicadas a registros polisomnográficos de sueño para estudiar su relación con procesos y funciones neurocognitivas en niños. Se busca establecer relaciones estadísticas que permitan relacionar los efectos de los TRS, específicamente de los episodios de SAHOS, con el desarrollo de las funciones neurocognitivas en niños. 7 Representación temporal de la organización de los estados y etapas de sueño durante la noche. 29 5. ESTADO DEL ARTE 5.1 Modelos de respiratorio simulación computacional del proceso Los modelos de simulación computacional son utilizados en una amplia gama de áreas en medicina, en tareas de planificación quirúrgica, simulación médica, realidad aumentada, robótica médica, entre otras. Diversos órganos y tejidos del cuerpo humano han sido simulados utilizando este tipo de modelos: cerebro, próstata, hígado, pulmones, piel, articulaciones, huesos, etc. La neurocirugía es una de las áreas con mayor desarrollo en este ámbito, con modelos que facilitan la planificación e intervención quirúrgica [8][90], así como la predicción de las deformaciones del cerebro durante la cirugía (brain-shift) [23][121]. La modelación de la próstata y su interacción con el entorno en la zona urogenital [79][132] es otro ejemplo de modelo de simulación de tejidos blandos. Estos modelos se aplican en tareas como por ejemplo de resección de próstata [26] y también ayudan a mejorar la planificación y aplicación de la curieterapia8 [79]. La simulación de las vísceras y órganos abdominales es una tarea que se enfoca principalmente a la planificación de la cirugía y la generación de simuladores [123]. También es de gran importancia el estudio del efecto de la respiración sobre el movimiento de los órganos abdominales [125]. Otras aplicaciones de modelos de simulación computacional se aplican a cirugía maxilofacial [27][89] y de la órbita ocular [75], y modelos de huesos y articulaciones [124]. Se pueden definir 2 tipos de modelos de simulación computacional: 1. Modelos geométricos: corresponden a métodos de animación que se basan sólo en las características geométricas del objeto a simular. 2. Modelos físicos: este tipo de modelos se basan principalmente en las leyes de la mecánica y consideraciones anatómicas. 5.1.1 Modelos geométricos Los modelos geométricos comenzaron a ser desarrollados durante los años 80. Son conocidos como modelos “no físicos”, porque se basan únicamente en la geometría del objeto en estudio y no en las propiedades del material. Consisten en la visualización de las estructuras a través de la reconstrucción mediante procesamiento de imágenes. Los procesos de deformación y animación del modelo se realizan a través de interpolaciones o transformaciones geométricas entre estados conocidos del proceso, por ejemplo entre etapas distintas del CR. Son utilizados para el desarrollo de simuladores para la cirugía y la animación. Este tipo de modelo posee un gran realismo visual que ayuda a la comprensión global del sistema en estudio, pero no entrega la precisión ni la realidad física del proceso. 8 La curieterapia o braquiterapia es una modalidad de tratamiento radioterapéutico en el que la fuente radiactiva queda en contacto o próxima al tumor. 30 5.1.2 Modelos físicos Los modelos físicos incluyen en su diseño las leyes de la mecánica del proceso en estudio. Se pueden distinguir 2 tipos: 1. Modelos discretos: son los que consideran al sólido como una serie de puntos materiales Mi de masa mi. 2. Modelos continuos: son aquellos basados en una representación continua de la materia. Estos modelos buscan realismo visual, velocidad de cálculo y también el realismo físico del comportamiento del proceso modelado. Modelos discretos Los métodos masa-resorte son los modelos discretos más utilizados. En este tipo de método se modela un objeto como un ensamble de n puntos unidos entre ellos por segmentos. Los puntos (nodos de la malla) son considerados como masas puntuales, mientras que los segmentos son representados mediante resortes. El estado del sistema en un tiempo t está definido por las posiciones xi(t) y las velocidades vi(t) de las masas i=1,…, n. Para una masa puntual mi la fuerza aplicada sobre ella por los j nodos vecinos puede ser calculada utilizando los principios fundamentales de la dinámica. Los resortes más utilizados son los que ejercen una fuerza proporcional a su estiramiento/compresión en relación a su posición de reposo (comportamiento elástico lineal). Los métodos de tipo masa-resorte han sido utilizados para realizar modelos de la cara, piel, grasa, músculos y procesos de deformación de tejidos blandos [28][82][83][120][133]. Los modelos discretos son útiles en tareas de animación y de simulación quirúrgica para el aprendizaje, ya que entregan un gran realismo visual, pero son poco precisos y tienen un alto costo computacional. Modelos continuos Los modelos continuos se basan en los postulados de la mecánica de medios continuos9 y utilizan los métodos de elementos finitos (EF) como herramienta de resolución de las ecuaciones involucradas en el proceso. El principio básico de los EF consiste en discretizar el objeto a modelar en pequeños elementos, llamados nodos (volumétricos o de superficie) a través de la construcción de una malla. Estos nodos son los puntos de unión de cada elemento con sus vecinos adyacentes. El comportamiento de cada elemento se determina con el comportamiento de los nodos vecinos, mediante la utilización de funciones de interpolación (sistema de ecuaciones lineales). Este método se 9 La mecánica de medios continuos es un modelo matemático de la materia construido en el marco de la física clásica (no cuántica y no relativista) que ignora la estructura atómica de la materia. Se sostiene sobre 4 principios fundamentales de la física: 1. conservación de la masa, 2. mecánica de Newton, 3. conservación de la energía, y 4. termodinámica. 31 utiliza para calcular los campos de desplazamiento, y a través de relaciones cinemáticas y constitutivas, las deformaciones y tensiones. Los EF son utilizados para modelar órganos, huesos y músculos, y para la caracterización de los procesos mecánicos de los tejidos. Algunos trabajos que se pueden mencionar son los realizados por Sagar et al. [111] que modela el ojo para simulaciones quirúrgicas, Chen and Zeltzer [29] que modela músculos, Bettendorff-Bakmana et al. [13] que modela los ventrículos del corazón considerando el comportamiento mecánico así como las características del músculo miocárdico y Skrinjar et al. [121][122] que modela el brainshift. 5.1.3 Modelos de respiratorio simulación computacional aplicados al sistema La utilización de modelos físicos que permiten integrar la información adquirida de mediciones realizadas sobre el paciente y adaptar los modelos y realizar las deformaciones correspondientes, son conocidos como modelos biomecánicos. En las aplicaciones relacionadas con la modelación de la respiración, los modelos biomecánicos son los más utilizados. Variados trabajos han sido propuestos para modelar el sistema respiratorio y el proceso respiratorio. Para ello se han desarrollado modelos para los pulmones, la caja torácica, o para el modelo respiratorio completo. La revisión de los trabajos tendrá la siguiente estructura: en primer lugar se presentarán los modelos de simulación desarrollados para el pulmón y la pleura, luego los modelos de la caja torácica y el diafragma, para finalizar con los modelos que integran todos los componentes del sistema respiratorio. En cuanto al tipo de modelo, primero serán presentados los modelos geométricos, luego los modelos discretos (masa-resorte) y finalmente los modelos continuos basados en EF. Se han desarrollado diversos modelos geométricos para representar los movimientos respiratorios del pulmón. Boldea [16] utiliza análisis de imágenes para predecir los desplazamientos del pulmón debidos a la respiración, para ello realiza tres adquisiciones CT a distintos volúmenes respiratorios para calcular los campos de deformación de cada voxel. La idea principal es realizar una interpolación lineal de estos desplazamientos para obtener los estados intermedios. Moreno et al. [81] proponen un método que utiliza fusión de imágenes CT-PET. Las imágenes CT son adquiridas en dos etapas extremas del CR, además se considera que el estiramiento del pulmón es proporcional al aumento del volumen pulmonar. Una curva P-V de un paciente sano es parametrizada para simular la geometría del pulmón a diferentes volúmenes, posteriormente utilizando imágenes PET se realiza la adaptación del modelo para cada paciente. En el ámbito de la modelación de los pulmones utilizando modelos discretos Kaye et al. [63] proponen un modelo para la animación de los pulmones, para aplicaciones clínicas. Promayon et al. [96][98][99] definen diferentes zonas, centrando su estudio en la simulación del comportamiento de las distintas estructuras respiratorias y la hipótesis de incompresibilidad de los órganos y vísceras abdominales durante la respiración. Para la simulación del pulmón considera las características elásticas en un modelo masa-resorte. 32 Amrani et al. [4] proponen un modelo híbrido en el que la caja torácica se modela como una superficie rígida con la que el pulmón estará en contacto y sobre la cual se deslizará y por otra parte considera a los pulmones y el corazón como sacos de pequeños elementos inflables (partículas) que interaccionan entre ellas. La inflación/deflación de los pulmones y del corazón consiste en la variación de los radios de las partículas a partir de los movimientos dados por el CR. Este modelo simula de forma realista las deformaciones, pero no considera todos los aspectos fisiológicos del proceso respiratorio. Santhanam et al. [112] proponen un método basado en masa-resorte que considera constantes los desplazamientos de los nodos que forman parte de la superficie del pulmón durante el CR y los modela utilizando un módulo que ejerce una fuerza que produce una deformación lateral en el modelo para simular el movimiento de la superficie del pulmón. En cuanto a la utilización de modelos continuos basados en EF podemos mostrar los siguientes trabajos: Vawter et al. [130] proponen un método en que considera el comportamiento elástico del pulmón, pero no toma en cuenta el efecto de la tensión superficial (debida a los alvéolos). Además supone que la histéresis genera un proceso contracción-deformación pulmonar diferente tanto para inspiración como espiración. Los resultados obtenidos muestran que este modelo entrega muy buenos resultados respecto del proceso contracción-deformación del pulmón comparado con modelos experimentales. Denny and Schroter [37] modelan el parénquima pulmonar con el objetivo de estudiar el efecto de grandes distorsiones no-lineales y el comportamiento elástico del pulmón. Los resultados muestran un comportamiento similar a las medidas obtenidas experimentalmente. Bettinelli et al. [14] desarrollaron un modelo basado en EF para estudiar el efecto de la gravedad y de la postura sobre la mecánica del pulmón. Brock et al. [21] desarrollaron un modelo de pulmón que considera las características mecánicas y anatómicas del proceso y deduce que los movimientos producidos por la caja torácica sobre los pulmones son perpendiculares a la superficie del pulmón. Kowe et al. [66] proponen un modelo que permite examinar las propiedades elásticas y estructurales constituyentes de las redes que conforman los alvéolos del pulmón. Los resultados obtenidos, como curvas P-V del modelo fueron comparables con las medidas P-V de las mediciones de flujo de aire realizadas experimentalmente. Gefen et al. [49] proponen un modelo para el estudio de pulmones sanos y pulmones con enfisema. La geometría del modelo se obtuvo mediante la adquisición por microscopía electrónica de cortes de pulmón, la pared alveolar se supone bajo una ley elástica no lineal. Este modelo permite comprender a escala microscópica el comportamiento alveolar. Son pocos los modelos que incorporan estudios de los movimientos de los pulmones y que toman en consideración el efecto de la pleura durante el proceso respiratorio. Chi et al. [31] reproducen los movimientos respiratorios aplicando desplazamientos en la superficie de los pulmones, simulando de esta manera el efecto mecánico de la pleura. Didier et al. [38][39] presentan un modelo basado en EF que considera el efecto producido por la pleura en los movimientos de los pulmones inducidos por la caja torácica. En este modelo, el desplazamiento de la caja torácica es perpendicular a la superficie, pero el movimiento de la pleura es de deslizamiento en torno a los pulmones. La caja torácica rodea a los pulmones y en gran medida es la responsable de sus movimientos. El estudio, la modelación y el cálculo de la cinemática de la caja torácica y de la acción ejercida por los músculos intercostales es una etapa fundamental para la obtención de un modelo completo del sistema respiratorio. 33 Ratnovsky et al. [103][104] presentan un modelo 2D de la pared torácica en el cual cada músculo es representado por un resorte. Este modelo fue desarrollado con el fin de estudiar la fuerza y el trabajo que genera cada músculo de la respiración. Segars et al. [116] proponen un modelo de simulación basado en NURBS (non-uniform rational Bsplines) para un “fantoma” (phantom) de tronco con el objetivo de analizar los efectos de las variaciones anatómicas debidas a la respiración. Los puntos de la superficie del modelo fueron extraídos de la segmentación de imágenes provenientes de Visible Human Project10 [137]. Este modelo puede modificar la geometría de las estructuras anatómicas y los movimientos del paciente simplemente cambiando la posición de ciertos puntos importantes de la superficie del modelo, en función de las curvas volumen-tiempo dadas por el CR. En Mohr et al. [80] se realiza un estudio de la geometría de las costillas y de la deformación de la caja torácica para definir los parámetros característicos de la curvatura de éstas durante la respiración. En el trabajo de Saunders et al. [114] se estudian los efectos del cambio de volumen pulmonar, en la configuración toraco-abdominal y de la contracción de los músculos respiratorios sobre la deformación de la caja torácica. Los resultados relacionan el tipo de respiración realizado (diafragmática o costal) con las variaciones de diámetro de la caja torácica (lateral y antero-posterior). Algunos estudios han sido realizados a partir de modelos mecánicos de la caja torácica. En los trabajos desarrollados por Zordan et al. [139][140] sobre movimientos respiratorios utilizando modelos discretos se modela el movimiento de las costillas y de los músculos intercostales y del diafragma a partir de resortes, y se considera la característica de incompresibilidad de los cuerpos para estudiar los movimientos del abdomen durante la respiración. Promayon et al. [96][99] consideran los aspectos relacionados con la acción ejercida por el diafragma y los músculos intercostales durante el movimiento respiratorio. En cuanto a los modelos de tórax basados en métodos continuos, Loring [73] desarrolló un modelo 3D basado en EF con el fin de simular la acción de los músculos respiratorios. En la literatura se presentan estudios sobre la forma y los cambios del diafragma durante la respiración, utilizando modelos geométricos. Pettiaux et al. [91] proponen un método de reconstrucción del diafragma a partir de varios cortes de una misma imagen CT en el plano coronal y sagital. En cada corte se identifica el diafragma y se reconstruye en 3D. Behr et al. [11] utilizan un método de reconstrucción similar al anterior, basado en la detección del contorno delo diafragma en cada imagen CT. A partir de esta reconstrucción se crea una superficie continua aproximando mediante splines y curvas de nivel. Angelillo et al. [5] han descrito la geometría del diafragma basados en la hipótesis de que los grupos de fibras musculares se sitúan sobre las líneas de la curvatura principal de la superficie del músculo. En cuanto a modelos discretos, Amancharla et al. [1] desarrollaron un modelo cinemático del diafragma que considera los efectos del desplazamiento de la pared torácica sobre la curvatura del diafragma. Promayon y Braconnier [97] presentan un modelo basado en el método masa-resorte. En este modelo, los objetos, incluido el diafragma, son 10 “The Visible Human Project” es una iniciativa de la Biblioteca Nacional de Medicina (National Library of Medicine) de USA. Tiene como objetivo crear una completa y detallada representación anatómica, en 3D, del cuerpo humano de un hombre y una mujer. 34 representados como partículas sobre las cuales se ejercen fuerzas para generar las deformaciones del modelo. Boriek y Rodarte [19] desarrollaron un modelo basado en EF en el que consideraron los efectos de las propiedades de la parte muscular y de la membrana del diafragma. El modelo se ajusta de buena manera a los cambios de forma del diafragma durante la respiración. En la literatura son pocos los trabajos sobre el desarrollo de un modelo biomecánico completo del sistema respiratorio. En el trabajo de tesis de Promayon [96] se propone un modelo completo del sistema respiratorio basado en masa-resorte. En este trabajo el autor modela las distintas estructuras considerando las características físicas de cada estructura y considera comportamientos elásticos para realizar las deformaciones del modelo. El modelo respiratorio pulmón-tórax desarrollado por Didier [38] en el laboratorio LIRIS, propone un modelo completo del sistema respiratorio que considera los pulmones, la caja torácica, los tejidos blandos (grasa y piel), el diafragma y el efecto de la pleura utilizando un modelo continuo basado en EF. El objetivo es tomar en cuenta los movimientos de los pulmones y de su entorno con el fin de predecir la posición del tumor a partir del movimiento de la superficie externa del tórax (piel), a partir de marcadores utilizando videocámaras. 5.2 Trastornos respiratorios del sueño y SAHOS Variados son los trabajos que se han realizado para el estudio de la relación entre la respiración y el sueño. Principalmente éstos se enfocan en el estudio de los TRS, los cuales producen efectos importantes no tan sólo durante el sueño, sino también durante la actividad diurna del sujeto, afectando diversas capacidades y habilidades. Los principales trabajos en este sentido apuntan a la detección de los episodios de SAHOS. EL SAHOS está asociado a enfermedades como: hipertensión arterial pulmonar y sistémica, arritmia cardiaca, enfermedad coronaria y accidente vascular encefálico [117][131][135]. También está asociado con el riesgo de sufrir accidentes laborales y automovilísticos [127] y a problemas en el desarrollo de las funciones cognitivas [6][47][62][65]. La polisomnografía nocturna constituye el principal y más completo procedimiento para el estudio de los TRS [30][53][72], específicamente para la detección de los episodios de apneas e hipopneas. La información obtenida mediante el polisomnograma permite evaluar el tiempo de sueño, los estados y etapas de sueño, flujo de aire (nasal y bucal), movimientos toraco-abdominales y de SaO2. Las variables anteriores permiten obtener información relevante del sueño del paciente como por ejemplo: eficiencia, latencia, arquitectura, presencia de eventos respiratorios obstructivos, período respiratorio, etc. [53][115]. Los resultados obtenidos se comparan con los rangos establecidos en la literatura para definir los criterios de normalidad o anormalidad. Los pacientes con SAHOS presentan una latencia al sueño disminuida, alteración de la arquitectura del sueño y aumento del número de episodios de micro-despertar. La polisomnografía tiene como desventaja el hecho de que se trata de un estudio caro y de difícil acceso. Los estudios 35 realizados con este método diagnóstico constan de pocos casos y siempre se realizan sobre una población seleccionada. En base a diversos parámetros clínicos, existen diferentes aproximaciones diagnósticas para SAHOS, pero no han demostrado ser precisas como efectivamente lo es el registro polisomnográfico. Una de las técnicas más utilizadas es la realización de cuestionarios clínicos, pero este procedimiento presenta una baja especificidad y sensibilidad. También se utiliza la valoración de registros sonoros de los ronquidos. Esta técnica presenta un nivel de sensibilidad cercana al 70%, pero no es considerada como prueba diagnóstica [68]. Otra de las técnicas consiste en la realización de oximetría de pulso, pero tampoco es un método diagnóstico preciso [22]. La polisomnografía aplicada a la detección del SAHOS se centra en la determinación del porcentaje de sueño en apnea/hipopnea (IAH), ya que este índice se considera el factor más importante para la determinación de la severidad de la enfermedad [108]. Muchos estudios se han realizado para identificar el índice IAH, pero la mayoría de ellos presentan discrepancias en los resultados. Estas discrepancias se atribuyen a los tipos de sensores utilizados para la detección de los cambios en la respiración y el flujo de aire, a los distintos criterios de identificación y corroboración de los cambios hemodinámicos y, a la utilización de disímiles criterios de amplitud de las señales respiratorias para identificar los episodios de SAHOS. Recientemente la American Academy of Sleep Medicine (AASM) ha propuesto la estandarización de los procesos para la determinación del IAH [107]. Diversos estudios han sido realizados para evaluar la conducta y las funciones neurocognitivas en niños con SRBD. Kaemingk et al. [62] realizaron un estudio de apneas del sueño sobre un gran número de niños en edad escolar utilizando polisomnografía. Los niños con IAH ≥ 5/h fueron comparados con niños con IAH < 5/h. En este estudio los coeficientes intelectuales (IQ) en ambos grupos estaban por sobre el promedio; sin embargo, los niños con IAH ≥ 5/h obtuvieron puntajes menores que los niños IAH < 5/h en ciertas pruebas neurocognitivas como por ejemplo nivel de aprendizaje y tiempo de respuesta. No se encontraron diferencias significativas entre los grupos para los niveles de IQ o en pruebas de logro académico. Los autores además encontraron que existía una correlación significativa (aunque débil) entre el IAH y los resultados de las pruebas, así como entre los niveles de desaturación de oxígeno durante SQ1. En Goodwin et al. [51] los reportes de somnolencia diurna y de problemas de aprendizaje entregados por los padres fueron evaluados de acuerdo a diversos cortes para el índice IAH. Índices IAH ≥ 5/h sin niveles de desaturación estaban asociados con una historia de problemas de aprendizaje y somnolencia excesiva durante el día. Un IAH > 1/h con desaturación ≥ 2% estaba asociado con problemas de aprendizaje, pero no con excesiva somnolencia diurna. En Kennedy et al. [65] se realizó la comparación entre 13 niños roncadores y 16 niños no roncadores. Los niños roncadores mostraron bajos puntajes para mediciones de IQ y malos resultados en las pruebas de memoria y atención. A nivel polisomnográfico no se encontraron diferencias en el número de episodios de SAHOS entre los 2 grupos. Sin embargo, el grupo roncador presentó un IAH mayor comparado con el grupo control. En O’Brien et al. [85] se estudió un grupo de niños en edad escolar con síntomas de hiperactividad y déficit atencional. Sólo un grupo reducido presentó un IAH ≥ 5/h. En relación a los parámetros polisomnográficos ambos grupos presentaron diferencias en el tiempo de latencia al SP y el tiempo de SP como porcentaje del TST. 36 Los estudios muestran que en general los niños con SRBD tienen una mayor somnolencia durante el día que los adultos. En Gozal et al. [52] se realizó un estudio utilizando múltiples pruebas de latencia al sueño para evaluar los niveles de somnolencia en niños. Los niños somnolientos tenían un alto nivel de severidad de los TRS. También se estudiaron las correlaciones entre las latencias al sueño e IAH, índice de microdespertares y porcentajes de TST con los niveles de SaO2, encontrando relaciones estadísticamente significativas. Una serie de otros trabajos se han desarrollado en el campo de los SRBD, entre ellos estudios de confiabilidad en la detección de episodios y eventos SRBD [105], definición de criterios de duración y clasificación de episodios de apneas e hipopneas [128], corroboración de datos [126], medición y comparación de técnicas de adquisición de datos [24], estudios de comportamiento cardiovascular [77], crecimiento, complicaciones metabólicas [44], entre otras. 5.3 Análisis revisión bibliográfica 5.3.1 Modelos de simulación computacional del proceso respiratorio La planificación de la radioterapia en el caso de tumores pulmonares debe tomar en cuenta los movimientos debidos a la respiración. Para considerar estos efectos se han desarrollado las técnicas de gating respiratorio, como por ejemplo el ABC. Esta técnica permite bloquear la respiración del paciente durante una etapa específica del CR para poder realizar la irradiación; y las técnicas de tracking respiratorio, que permiten realizar el seguimiento del tumor pulmonar basándose en modelos de simulación computacional de los órganos involucrados en el proceso respiratorio. Las técnicas de gating respiratorio permiten reproducir los CR, pero no consideran que el movimiento del tumor es no predecible y además son invasivas y requieren de la colaboración del paciente. Las técnicas de tracking respiratorio, toman en consideración el hecho de que el movimiento del tumor pulmonar es no predecible y son capaces de adaptarse al CR del paciente. Existen dos tipos de técnicas de tracking: las técnicas geométricas, que no consideran los aspectos físicos ni las características de los tejidos relacionados con el problema, y los modelos físicos, que sí consideran los aspectos mecánicos y anatómicos involucrados en el problema. Los primeros permiten comprender los procesos en forma global, pero no permiten precisión en la predicción de las deformaciones del modelo. Entre los segundos se distinguen los modelos discretos y los modelos continuos. Los modelos discretos, principalmente los basados en masa-resorte, permiten un gran realismo visual del proceso y tienen un bajo costo computacional para el procesamiento, pero son poco precisos. Los modelos continuos, basados en técnicas de EF, permiten un alto nivel de precisión, pero son altamente costosos desde un punto de vista computacional. Los modelos continuos son más realistas y sobre todo más precisos que los modelos 37 geométricos. Además, a estos modelos pueden incorporarse mediciones realizadas al paciente para adaptar su comportamiento. Estos son los llamados modelos biomecánicos. La construcción de los modelos de simulación del proceso respiratorio se ha realizado en su mayoría por partes, desarrollando en forma aislada modelos para cada estructura involucrada en el proceso respiratorio. El primer trabajo que presenta un modelo de simulación computacional completo del proceso respiratorio y de sus estructuras es el desarrollado por Didier en su trabajo de tesis en el laboratorio LIRIS-SAARA [38]. Los modelos biomecánicos desarrollados hasta la fecha sólo incorporan información del proceso mecánico y de las características anatómicas involucradas, pero no toman en consideración las señales y variables respiratorias que pueden ser medidas e incorporadas al modelo, tanto para su mejoramiento como para servir de guía (monitoreo del comportamiento de modelo). 5.3.2 TRS y SAHOS Los TRS son patologías que no sólo afectan al paciente durante el sueño, sino que tienen un efecto en todas sus actividades diarias. Los trabajos en el área de detección de patrones respiratorios durante el sueño, asociados a los TRS buscan validar las técnicas de detección, sensores utilizados y metodologías implementadas, de manera de estandarizar los criterios para la correcta detección de los episodios de apnea e hipopnea (SAHOS). La polisomnografía es la metodología más utilizada para la detección y determinación de la severidad de los episodios de apneas e hipopneas. Esta técnica se basa en el registro de señales fisiológicas durante el sueño. Permite la determinación de los estados y etapas de sueño, duración del sueño, latencias al sueño, arquitectura del sueño, episodios de SAHOS, entre otros. Diversos trabajos han sido realizados para correlacionar los efectos de los TRS con ciertas funciones neurocognitivas. La mayoría de estos trabajos entregan como resultados correlaciones estadísticamente significativas en relación a la presencia de trastornos, específicamente episodios de SAHOS, y ciertas funciones neurocognitivas. La mayoría de los trabajos concuerdan en que los pacientes con episodios de SAHOS aumentados se ven afectados en ciertas tareas, como por ejemplo tareas de aprendizaje o tiempos de reacción. Además de la relación entre TRS y funciones neurocognitivas, existe una amplia gama de trabajos enfocados en el estudio de los efectos de estos trastornos del sueño sobre la somnolencia diurna, la función cardiovascular, alteraciones metabólicas, etc. 38 6. PROPUESTA DE INVESTIGACIÓN 6.1 Objetivos El objetivo general de este estudio es desarrollar herramientas de procesamiento de señales respiratorias que puedan ser aplicadas para: 1. Desarrollar una metodología que permita incorporar en un modelo de simulación computacional del sistema respiratorio, información mecánica, anatómica y de las señales respiratorias (volumen, presión etc.), para poder guiarlo y mejorar su desempeño y monitorear su comportamiento. 2. Detectar patrones respiratorios de sueño, específicamente episodios de apnea e hipopnea durante el sueño (SAHOS), para poder correlacionarlos con información sobre la arquitectura del sueño y estudiar sus efectos sobre el desarrollo neurocognitivo. 6.2 Propuesta En este trabajo de tesis se estudiará el proceso de la respiración asociado a dos temas; el primero en relación al mejoramiento y monitoreo de un modelo de simulación computacional pulmón-tórax, y el segundo en relación con los TRS y de sus patrones respiratorios asociados y sus efectos sobre las funciones neurocognitivas. El hilo común de ambas aplicaciones esta dado por el desarrollo de herramientas y técnicas de procesamiento de señales que sean aplicables en ambos casos. Por un lado el procesamiento de señales respiratorias que puedan ser incluidas como entradas del modelo de simulación computacional, y por otro para el procesamiento de registros polisomnográficos para la detección de episodios de SAHOS. 6.2.1 Modelos de simulación computacional proceso respiratorio Aprovechando ámbitos de investigación desarrollados y activos, en que las técnicas puedan contribuir efectivamente en el caso del cáncer de pulmón para la planificación de la dosimetría en radioterapia, es necesario considerar los efectos adversos producidos por la respiración del paciente durante el procedimiento. Para solucionar este problema se plantea la utilización de un modelo de simulación computacional del proceso respiratorio para lograr una correcta predicción de la posición del tumor y evitar el daño de los tejidos sanos durante la radioterapia. Como se señaló anteriormente, algunos de los modelos de simulación computacional del proceso respiratorio están basados en leyes de la mecánica e información anatómica del proceso, pero no incluyen las variables respiratorias del problema: volumen y flujo de aire, actividad eléctrica muscular, características de la vía aérea y elasticidad pulmonar como entradas al modelo. En esta aplicación del trabajo de tesis se busca incorporar al modelo biomecánico del proceso respiratorio desarrollado por el laboratorio LIRIS-SAARA [38] las variables respiratorias medibles, a través del procesamiento de señales respiratorias, para poder 39 correlacionar esta información con la mecánica respiratoria. Se pretende de esta manera poder guiar y monitorear el modelo biomecánico desarrollado para el apoyo en el proceso de radioterapia de cáncer de pulmón. De esta manera se busca desarrollar un modelo del proceso respiratorio que incluya los aspectos mecánicos de la respiración, la información anatómica y de las variables respiratorias medibles. Para lograr lo anterior se plantea incluir, como parte del modelo, información sobre: 1. Deformación del diafragma, basada en el estudio de la actividad eléctrica de este músculo, la que será medida a través de electromiografía (EMG) y por métodos de estimulación eléctrica y magnética del nervio frénico. 2. Flujo de aire durante el CR, el que será medido con la ayuda de un espirómetro o de un pletismógrafo. 3. Variación de presión durante el CR: medido utilizando un manómetro o balones de presión. 4. Características de la vía aérea y del pulmón (resistencia y elasticidad pulmonar): estimadas a partir de curvas P-V del paciente. Además se tratará de implementar y aplicar técnicas de procesamiento de señales que permitan estimar y correlacionar las distintas señales respiratorias, para poder realizar una reconstrucción de las señales en casos que algunas no estén disponibles o no puedan ser obtenidas durante el proceso de radioterapia. En una primera instancia se definirá cuáles señales respiratorias serán tomadas en cuenta y cuales estarán disponibles durante la radioterapia, para poder construir modelos que permitan estimar las señales no disponibles. Luego se aplicarán las técnicas de procesamiento de señales desarrolladas a las señales respiratorias, para obtener los parámetros y patrones relevantes que serán incorporados al modelo biomecánico. Se estudiará la posibilidad de utilizar descomposición modal empírica (EMD) [110], transformada de Hilbert-Huang (HHT) [60], transformada de Fourier (FFT), lógica difusa, entre otras. En la etapa siguiente, una vez estimados los parámetros y patrones relevantes para ser incorporadas al modelo, se espera realizar el proceso de guiado y monitoreo del modelo de simulación pulmón-tórax. Se espera poder incorporar conocimiento experto basado en lógica difusa directamente sobre el modelo para poder guiar las deformaciones debidas a la respiración. Para evaluar el desempeño se utilizarán “pacientes virtuales” generados a partir de datos clínicos. El desempeño del modelo será estimado midiendo las diferencias de desplazamiento debidas a las deformaciones producidas por la respiración. Posteriormente el modelo será probado con datos de pacientes reales, utilizando imágenes CT y técnicas de localización basadas en marcas sobre la piel del paciente, para poder contrastar la magnitud de los desplazamientos entregada por el modelo con la posición real del paciente y así obtener una medida de su desempeño. Las imágenes médicas, el modelo biomecánico y las medidas de desplazamiento intratorácicas serán obtenidas en el laboratorio LIRIS, Lyon-Fracia. Las señales respiratorias serán aportadas principalmente por el laboratorio PRETA (Physiologie cardio-Respiratoire Expérimentale Théorique et Appliquée) de la Université Joseph Fourier, Grenoble-Francia, las cuales son obtenidas en el marco de un proyecto sobre 40 interacciones cardio-respiratorias, generación de modelos y estudio de patrones respiratorios. 6.2.2 Detección de episodios de SAHOS y patrones respiratorios de sueño en registros polisomnográficos La detección de episodios de SAHOS es una tarea que relaciona varias actividades; por una parte es necesaria la detección de patrones de sueño para la clasificación de estados y etapas, así como el estudio de la arquitectura del sueño y de los patrones respiratorios de sueño. Para esta parte del trabajo de tesis se busca desarrollar herramientas de procesamiento de señales que permitan detectar los episodios de SAHOS en registros polisomnográficos de sueño, para poder relacionarlos con otros parámetros de relevancia obtenidos durante el sueño, por ejemplo información de la arquitectura del sueño u otros patrones respiratorios. Además, se busca determinar la relación entre SAHOS y desarrollo de las funciones neurocognitivas. Para ello, se busca definir un modelo que pueda relacionar la incidencia y severidad del SAHOS y su efecto sobre las funciones cognitivas. Para medir el efecto sobre las funciones cognitivas, se utilizarán registros de potenciales cognitivos (ERP). Las técnicas de procesamiento de señales que serán desarrolladas para el modelo de simulación pulmón-tórax, serán adaptadas al procesamiento de registros polisomnográficos, ya que una de las metas principales de este trabajo es la generación de herramientas que puedan ser usadas en ambas aplicaciones. Para evaluar los resultados en la detección de SAHOS se contará con la ayuda de expertos en sueño que realizarán la revisión y comparación visual de los resultados obtenidos. Para el estudio de la relación entre SAHOS y desarrollo neurocognitivo se realizarán pruebas estadísticas. Las señales a utilizar, registros polisomnográficos y ERP, serán obtenidas del laboratorio de sueño del INTA de la Universidad de Chile, en el contexto de proyectos de investigación referidos a la interacción entre sueño y nutrición a través del ciclo vital. 6.3 Hipótesis En relación al modelamiento de la simulación del proceso respiratorio, la hipótesis planteada es que la incorporación de las variables respiratorias, en conjunto con las variables mecánicas y anatómicas del proceso, pueden mejorar el comportamiento del modelo de simulación computacional pulmón-tórax y permitirán guiar y monitorear el modelo biomecánico y de esta manera estimar de mejor forma el movimiento de tumores pulmonares. Con respecto a la detección de SAHOS se espera que las técnicas y herramientas de procesamiento de señales respiratorias desarrolladas sean aplicables sobre registros polisomnográficos y que permitan mejorar la detección de episodios de apnea e hipopnea, así como la detección automatizada de estados y etapas de sueño, y de otros patrones 41 respiratorios asociados con los TRS. Se espera además, encontrar una relación estadísticamente significativa entre los episodios de SAHOS y el desarrollo de las funciones neurocognitivas. 42 7. RESULTADOS ESPERADOS El resultado principal que se espera obtener de este trabajo es el desarrollo de herramientas y de técnicas de procesamiento de señales que puedan ser aplicadas en distintas tareas. En este caso específico, para el mejoramiento en el desarrollo de un modelo de simulación del proceso respiratorio; y para la detección de patrones respiratorios de sueño, específicamente, episodios de SAHOS. En cuanto a la simulación computacional del proceso respiratorio se espera obtener un nuevo y mejorado modelo de simulación pulmón-torax, que incorpore información sobre las señales respiratorias. Se espera que la incorporación de estas variables respiratorias mejore el desempeño del modelo. En cuanto a la detección de SAHOS, se espera que las herramientas de procesamiento de señales, permitan realizar una buena detección de los episodios de SAHOS durante el sueño, así como de otros patrones respiratorios en registros polisomnográficos. 7.1 Indicadores La modelación y simulación del proceso respiratorio aplicado a la planificación de la dosimetría en radioterapia tiene por finalidad actualizar la información obtenida de forma previa al tratamiento tomando en cuenta las variaciones inducidas por la respiración. Los trabajos de investigación desarrollados para poder cuantificar el efecto de los movimientos de los órganos y de la caja torácica [64] se centran en el estudio de las direcciones de los desplazamientos de los órganos. Estos desplazamientos son generalmente descritos según la dirección lateral, antero-posterior o cráneo-caudal. La dirección en la que la amplitud es mayor corresponde al desplazamiento cráneo-caudal. En el tórax, el desplazamiento cráneo-caudal de los pulmones es máximo a nivel del diafragma y disminuye a medida que se aleja del diafragma hasta ser casi nulo en la parte superior de los pulmones. Los movimientos en los ejes antero-posterior y lateral son sensiblemente menores; además, no existiría una correlación evidente entre la amplitud del desplazamiento de estos ejes y la distancia al diafragma. En Hostettler [59] se presenta un exhaustivo estudio sobre los efectos de los movimientos respiratorios sobre la caja torácica y los órganos abdominales, cuyos resultados se muestran en la tabla 1. 43 Tabla 1. Desplazamientos pulmonares durante la respiración (extraído de Hostettler [59], pp. 19). L. I.: lóbulo inferior, L. M.: lóbulo medio, L. S.: lóbulo superior, Completo: pulmón considerado como una unidad, X: no medido. Los casos en que sólo se presenta un valor corresponden a los promedios y en paréntesis los desplazamientos máximos y mínimos. Las casos en que se muestran dos valores corresponden a los desplazamientos máximo y mínimo. Referencia Barnes Chen Ekberg Engelsam Erridge Grills Hanley Murphy Plathrow Seppenwoolde Shimizu Sixel Stevens Parte del Desplazamiento pulmón cráneo-caudal [mm] L. I. 18,5 (9-32) L. M. y S. 7,5 (2-11) Completo 0 - 50 Completo 3,9 (0 -12) L. I. 2–6 L. M. y S. 2–9 Completo 12,5 (6 – 34) Completo 2 - 30 Completo 12 (1 – 20) Completo 7 (2 – 15) L. I. 9,5 (4,5 – 16,4) L. M. 7,2 (4,3 – 10,2) L. S. 4,3 (2,6 – 7,1) Completo 5,8 (0 - 25) Completo X Completo 0 – 13 Completo 4,5 (0 – 22) Desplazamiento antero-posterior [mm] X X 2,5 X X X 9,4 (5 – 22) 0 - 10 5 (0 – 13) X 6,1 (2,5 – 9,8) 4,3 (1,9 – 7,5) 2,8 (1,2 – 5,1) 2,5 (0 – 8) 6,4 (2 - 24) 0-5 X Desplazamiento lateral [mm] X X X X X X 7,3 (3 -12) 0–6 1 (0 – 1) X 6,0 (2,9 – 9,8) 4,3 (1,5 – 7,1) 3,4 (1,3 – 5,3) 1,5 (0 – 3) X 0-4 X Estos estudios muestran que durante la respiración los desplazamientos cráneo-caudales pueden llegar en promedio a presentar una variación de 18,5 mm., con un rango que puede llegar a los 50 mm., mientras que los desplazamientos promedio en las direcciones laterales y antero-posteriores son menores a 10 mm. Las diferencias entre los resultados obtenidos por cada grupo, se pueden explicar por los diversos tipos de adquisición utilizados y por la naturaleza y la posición de la zona estudiada. En este trabajo se utilizarán mediciones externas de la superficie de la caja torácica del paciente (piel) para medir los desplazamientos, y conocer la distancia entre la posición predicha por el modelo y la posición real. También es importante cuantificar la diferencia del error en la predicción del desplazamiento de diferentes zonas de la caja torácica. Los estudios realizados en el campo de la detección de eventos respiratorios durante el sueño señalan que el índice que mejor representa la recurrencia y severidad del SAHOS, tiene relación con el índice de apnea/hipopnea (IAH). Este índice puede ser calculado a partir del estudio polisomnográfico. En el caso de la detección de episodios de apnea e hipopnea se medirá la capacidad de pesquisa y caracterización del SAHOS. Para la determinación de las funciones cognitivas 44 utilizando ERP, se utilizarán índices como porcentaje de aciertos, tiempos de respuesta, entre otros. 7.2 Simulaciones y experimentos Se simularán los desplazamientos del modelo de simulación respiratorio para distintas etapas del CR bajo distintos niveles de ventilación. Luego estas simulaciones serán contrastadas con la deformación real sufrida durante la respiración. El modelo biomecánico desarrollado por el LIRIS-SAARA fue implementado utilizando técnicas de EF y el software Code Aster [34]. Las técnicas de procesamiento de señales respiratorias serán implementadas en MATLAB y luego adaptadas para ser incorporadas al modelo, ya sea directamente mediante MATLAB o utilizando Code Aster, luego éstas serán utilizadas para guiar el modelo de pulmón-tórax. En el mejoramiento del modelo de simulación computacional se trabajará en el laboratorio LIRIS con la ayuda de los investigadores Prof. Behzad Shariat, Dr. Fabrice Jaillet y Prof. Michael Beuve. En el mejoramiento del modelo de simulación se trabajará en colaboración con el equipo GMCAO (Gestes Médico-Chirurgicaux Assistés par ordinateur) de la Université Joseph Fourier, Grenoble-Francia con la participación y apoyo del prof. Yohan Payan. Los datos para guiar el modelo y comprobar su desempeño, serán adquiridos en el Laboratorio PRETA, donde principalmente se trabajará en colaboración con los investigadores Dr. Pascale Calabrese y Dr. Pierre-Yves Gumery. En el caso de la detección de SAHOS, las herramientas de procesamiento de señales serán implementadas en MATLAB y serán aplicadas y probadas sobre los registros polisomnográficos y ERP para relacionar los efectos de SAHOS sobre el sueño y las funciones cognitivas utilizando modelos estadísticos. Las técnicas de procesamiento de señales serán implementadas en el laboratorio de Ingeniería Biomédica del DIE de la Universidad de Chile, bajo la supervisión del Dr. Claudio Held y la colaboración del Dr. Pablo Estévez y del Dr. Claudio Pérez. Además, para esta parte del trabajo, se cuenta con la colaboración (desde hace más de 16 años) del laboratorio de sueño del INTA de la Universidad de Chile, en esta institución se trabajará en colaboración con el Dr. Patricio Peirano, la Dra. Cecilia Algarín y el Ms. Marcelo Garrido. 7.3 Propuesta de publicaciones Se propone la publicación de al menos dos artículos en revistas ISI; el primero en relación al mejoramiento y monitoreo del modelo de simulación computacional del proceso respiratorio. Las revistas más acordes con este aspecto podrían ser: Medical Image Analysis e IEEE Transactions on Medical Imaging. El segundo artículo en relación a la detección de patrones respiratorios de sueño, específicamente la detección de episodios de SAHOS y su relación con la arquitectura del sueño y su efecto sobre las funciones neurocognitivas. Las revistas más acordes podrían ser Sleep e IEEE Engineering in Medicine and Biology. Se espera también poder presentar los avances del trabajo en congresos nacionales e internacionales. 45 8. METODOLOGÍA Para cumplir con los objetivos de la investigación se deberán seguir los siguientes pasos: 1) Introducción al modelo biomecánico pulmón-tórax LIRIS-SAARA: El modelo biomecánico que se quiere perfeccionar ha sido el fruto de un trabajo de muchos años (3 trabajos de tesis). Para un correcto entendimiento y aplicación de las señales electrofisiológicas es necesario conocer acabadamente el modelo estudiando los algoritmos implementados, para definir la forma de incorporar las señales al modelo. Actualmente, se cuenta con un modelo biomecánico del sistema respiratorio que incluye información que simula el funcionamiento de los pulmones y el efecto de la pleura, la caja torácica y el diafragma. 2) Generación de una base de datos (BD): La construcción de una BD es una tarea que puede significar un alto costo en tiempo si no se consideran las variables adecuadas. En este punto se deben generar 2 BD para este trabajo de tesis, una correspondiente a la BD de señales respiratorias para el modelo de simulación; y la segunda correspondiente a la BD de registros polisomnográficos y de ERP. En el ámbito del desarrollo de las herramientas para el monitoreo del modelo pulmón-tórax se cuenta con el apoyo de los laboratorios LIRIS y PRETA. Las señales respiratorias con las que se cuenta, corresponden a medidas obtenidas a través de pletismografía inductiva respiratoria: volumen de tórax y abdomen, flujo de aire y ECG; además se cuenta con medidas de flujo de aire, saturación de CO2, entre otras. Además, se cuenta con información proveniente de EMG y estimulación eléctrica del nervio frénico para modelar el comportamiento del diafragma durante la respiración. Todo lo anterior relacionado con imágenes médicas (CT y MRI). En el tema de procesamiento de señales respiratorias asociadas al sueño para la detección de SAHOS, se cuenta con una amplia BD desarrollada por el laboratorio de sueño del INTA. Esta BD cuenta con registros polisomnográficos de niños desde los 6 meses hasta los 16 años de edad. Los registros polisomnográficos incluyen señales EEG, EOG, EMG, ECG, movimientos corporales y señales respiratorias, entre otras. Para poder relacionar la información proveniente de la detección de SAHOS con el desarrollo neurocognitivo, se cuenta con una BD de registros de ERP asociados a los registros polisomnográficos. 3) Implementación de los métodos de procesamiento de señales: Las herramientas de procesamiento de señales a desarrollar para ambas aplicaciones se basarán en la utilización de técnicas como la EMD, HHT, FFT, lógica difusa, entre otras. Para el modelo de simulación computacional, las señales serán procesadas para encontrar patrones que pudieran servir como entrada al modelo biomecánico. Luego se implementarán técnicas que permitan guiar y monitorear el modelo. Además, se desarrollarán herramientas que permitan correlacionar las señales de manera de poder reconstruir señales que sean útiles para el monitoreo del modelo y que no pueden ser adquiridas durante la radioterapia. 46 De igual manera para la detección de SAHOS y patrones respiratorios de sueño, se aplicarán las técnicas de procesamiento de señales para determinar los niveles de precisión en la detección, los resultados serán comparados con la revisión visual realizada por expertos en sueño. 4) Incorporación de señales respiratorias al modelo biomecánico pulmón-tórax: Utilizando las técnicas de procesamiento de señales se procederá a la incorporación de éstas al modelo biomecánico y para guiar, adaptar y monitorear el modelo. Se espera que la incorporación de las señales electrofisiológicas logren mejorar el desempeño del modelo de simulación. 5) Incorporación de conocimiento experto al modelo biomecánico pulmón-tórax: En una segunda etapa de perfeccionamiento del modelo de simulación, se desea incorporar conocimiento experto basado en lógica difusa directamente sobre el modelo para guiar las deformaciones del modelo debidas a la respiración. Esta tarea no ha sido explorada aún por los autores, para ello se estudiará la posibilidad de aplicar criterios difusos al procesamiento para el cálculo de EF. 6) Aplicación de herramientas de procesamiento de señales sobre registros polisomnográficos: Las herramientas de procesamiento de señales serán usadas para la detección de apneas e hipopneas para la detección de episodios de SAHOS y para el mejoramiento del desempeño de clasificadores de estados y etapas de sueño y de patrones respiratorios de sueño. 7) Definición del modelo para relacionar SAHOS y función neurocognitiva: Se aplicarán modelos estadísticos para correlacionar el impacto del SAHOS, arquitectura del sueño y las funciones neurocognitivas. Se espera obtener un modelo que relacione los episodios de apneas/hipopneas y la calidad del sueño sobre funciones neurocognitivas como por ejemplo, aprendizaje y memoria. 8) Actualización del modelo biomecánico pulmón-tórax: Se desarrollará un sistema de actualización para el modelo respiratorio durante la radioterapia de manera de mejorar la precisión de la predicción del movimiento del tumor pulmonar. Los datos se extraerán de medidas externas: movimiento de la caja torácica, mediciones de volumen, flujo y presión durante el CR. 9) Medidas de desempeño: Se evaluará el desempeño del modelo biomecánico pulmón-tórax y del modelo respiratorio-sueño. Para el primero se utilizarán indicadores relacionados con el desplazamiento inferido por el modelo en relación con el desplazamiento real. Para el segundo se medirán los porcentajes de detección para los eventos de apnea e hipopnea. 10) Mejora de los modelos: Se estudiará la posibilidad de integrar otras características al modelo biomecánico del proceso respiratorio y al modelo estadístico SAHOS-funciones cognitivas. 47 9. PLAN DE TRABAJO 9.1. Modelos de simulación computacional proceso respiratorio El plan de trabajo para el desarrollo del modelo de simulación del proceso respiratorio se puede dividir en las siguientes etapas: Etapa 1: Estudio del modelo biomecánico pulmón-tórax desarrollado por el laboratorio LIRIS-SAARA. La generación de una BD y el desarrollo de las herramientas de procesamiento de señales aplicadas al modelo de pulmón-tórax requieren el estudio completo del sistema desarrollado por el laboratorio LIRIS-SAARA. Para lograr este objetivo se estudiará en profundidad el sistema desarrollado, para ello se procederá de la siguiente manera: 1. Modelo de simulación del pulmón y del efecto de la pleura 2. Modelo cinemático de la caja torácica 3. Modelo del diafragma 4. Integración de todas las estructuras en el modelo biomecánico de pulmón-tórax Posterior al estudio de las partes que conforman el modelo, se procederá a conocer y entender los algoritmos desarrollados, para ello se prevé el estudio y aprendizaje de programación de técnicas de EF utilizando Code Aster. Etapa 2: Conformación de la Base de Datos La generación de la Base de datos se realizará durante el periodo de permanencia en el laboratorio LIRIS en Francia. La adquisición de la BD constara de imágenes médicas, principalmente CT de tórax y señales respiratorias adquiridas mediante espirometría, pletismografía inductiva respiratoria, EMG y estimulación eléctrica. Etapa 3: Desarrollo de técnicas de procesamiento de señales Se realizará el procesamiento de las señales respiratorias utilizando técnicas de procesamiento de señales (EMD; HHT, FFT, lógica difusa, etc.) Con estas técnicas se espera poder perfeccionar el modelo de pulmón-tórax y guiar las deformaciones del modelo durante la respiración. Etapa 4: Desarrollo de un sistema de deformación debido a la respiración Se desarrollará un sistema de actualización para el modelo, el cual pueda ser utilizado dentro del pabellón de radioterapia. Para este sistema se utilizarán imágenes intratorácicas de CT y la posición de determinados puntos sobre la piel del paciente. Utilizando las señales respiratorias obtenidas “on-line” durante la irradiación se procederá a realizar los procesos de deformación, para predecir el movimiento del tumor pulmonar. Las imágenes y señales respiratorias serán utilizadas para calibrar y adaptar el modelo al paciente y para validar su desempeño. 48 Etapa 5: Medidas de desempeño Se medirá el desempeño del modelo. A partir de estos resultados se podrá evaluar el perfeccionamiento del modelo así como la estimación del comportamiento considerando las nuevas variables incorporadas. Las tareas en esta etapa son: 1. Medición del error en la predicción de la deformación del modelo debido a la respiración del paciente. 2. Evaluación de la influencia de las variables respiratorias del modelo 9.2. Detección de episodios de SAHOS y patrones respiratorios de sueño en registros polisomnográficos Para el desarrollo del sistema para la detección de episodios de SAHOS, se proponen las siguientes etapas: Etapa 1: Generación BD registros polisomnográficos y de potenciales evocados cognitivos La BD para la detección de episodios de SAHOS en registros polisomnográficos se realizará a partir de registros en formato EDF (European Data Format) existentes en el INTA de la Universidad de Chile. Se seleccionará una muestra de pacientes de distintas edades y sexo que posean además del polisomnograma registros de ERP. Etapa 2: Adaptación de técnicas de procesamiento de señales Las técnicas desarrolladas e implementadas para el procesamiento de señales respiratorias aplicadas al modelo pulmón-tórax serán adaptadas para el procesamiento de registros polisomnográficos y de ERP. Se utilizarán técnicas como la EMD, HHT, FFT y lógica difusa. Etapa 3: Detección de episodios SAHOS y de patrones respiratorios de sueño Luego de la adaptación de las herramientas de procesamiento de señales, éstas serán aplicadas para el desarrollo de un sistema de detección de episodios de apnea e hipopnea durante el sueño y a la detección de otros patrones relevantes del sueño. Etapa 4: Medición del desempeño en la detección de SAHOS y patrones respiratorios Este trabajo consistirá en la determinación de la capacidad de pesquisa de los sistemas desarrollados. Para esta etapa se requerirá de la revisión por parte de los expertos médicos de los patrones de interés y la concordancia con las detecciones automáticas generadas por los sistemas. Etapa 5: Definición de un modelo para relacionar presencia de episodios SAHOS y funciones neurocognitivas Utilizando herramientas estadísticas se estudiarán las correlaciones existentes entre los episodios de SAHOS y las funciones neurocognitivas. Para esta tarea se utilizarán índices 49 como el IAH y patrones extraídos de los registros IRP, como por ejemplo, razón de aciertos, tiempos de respuesta, etc. Se espera obtener relaciones que sean estadísticamente significativas y que ayuden a comprender el efecto de patologías como el SAHOS u otros TRS sobre el desarrollo cognitivo. 50 10. CONCLUSIONES El desarrollo y aplicación de técnicas de procesamiento de señales es una poderosa herramienta que puede ser aplicada en distintos ámbitos, especialmente en el caso de desarrollos en biomedicina. En este sentido, la posibilidad de desarrollar herramientas de procesamiento de señales respiratorias para aplicaciones como el modelamiento de la respiración para radioterapia o la detección de patrones respiratorios asociados a TRS se presenta como una tarea muy interesante. En el ámbito del desarrollo de modelos de simulación del proceso respiratorio como ayuda al mejoramiento del proceso de radioterapia para el cáncer de pulmón se han desarrollado muchos trabajos. En este sentido se pueden distinguir las técnicas de gating respiratorio que buscan reproducir los CR del paciente para mejorar el proceso de irradiación y las técnicas de tracking o de seguimiento respiratorio, las que a partir de imágenes médicas permiten simular el proceso respiratorio y “seguir” el movimiento del tumor. Las técnicas de tracking han demostrado ser más efectivas que las de gating, ya que consideran el hecho de que el movimiento del tumor pulmonar durante la respiración no es predecible y porque requieren muy poca o nula participación del paciente (son menos invasivas). Entre las técnicas de tracking están las técnicas basadas en modelos geométricos y las basadas en modelos físicos. Los modelos geométricos sólo incorporan información de la geometría del objeto en estudio y no consideran los aspectos de la física del proceso. Los modelos físicos por su parte, incorporan aspectos anatómicos y de la mecánica del proceso. Los modelos físicos más utilizados son los discretos, basados en modelos masa-resorte, y los modelos continuos, basados en técnicas de EF. Los trabajos realizados hasta la fecha se basan principalmente en modelos físicos, porque son más precisos en la simulación de las deformaciones producidas por la respiración. En cuanto al modelamiento del proceso respiratorio, la mayoría de los trabajos realizados modelan cada estructura del tórax por separado y no generan un modelo completo del proceso respiratorio. El trabajo desarrollado por Didier [38] es uno de los pocos trabajos que considera las diversas estructuras que participan en el proceso respiratorio y las integra en un solo modelo biomecánico. Ninguno de los modelos de simulación estudiados, incluido el trabajo realizado por Didier, incluye información proveniente de señales respiratorias medibles como parte del modelo. En este trabajo de tesis se propone incluir estas señales respiratorias para mejorar, guiar y monitorear el comportamiento del modelo biomecánico desarrollado por Didier. En relación a los TRS se puede señalar que este es un problema muy importante, ya que genera consecuencias negativas en el individuo a distintos niveles. Por un lado provoca un sueño poco reparador y por ende problemas de somnolencia diurna, alteraciones cardiacas, mayores niveles de accidentabilidad, entre otros. 51 El principal patrón relacionado con los TRS son los episodios de apnea e hipopnea durante el sueño, estos patrones conforman la patología conocida como SAHOS. El SAHOS afecta patrones de desarrollo de ciertas funciones neurocognitivas. La principal técnica diagnóstica para el SAHOS es la utilización de polisomnografía. Este examen permite monitorear varias señales fisiológicas en forma simultánea. Esta técnica se utiliza para determinar los episodios de apnea e hipopnea, así como una serie de patrones respiratorios relevantes. También es utilizada para la clasificación de estados y etapas de sueño y para determinar la arquitectura del sueño. Los trabajos que relacionan SAHOS con funciones neurocognitivas, coinciden en que índices IAH altos se relacionan con funciones neurocognitivas deprimidas. Por este motivo es de interés la detección de episodios de SAHOS durante la noche y poder establecer como estos afectan el normal desarrollo de las funciones cognitivas. Finalmente como aspecto general, el desarrollo de este trabajo de tesis posibilita el poder trabajar en una tarea multidisciplinaria, en la cual participan ingenieros, físicos, mecánicos, neumólogos, neurofisiólogos, sicólogos, entre otros. Además, se propicia el desarrollo de redes de contacto y de colaboración con instituciones extranjeras (Univesité Cluade Bernard Lyon 1 y Université Joseph Fourier). 52 11. REFERENCIAS [1] M. R. Amancharla, J. R. Rodarte and A. M. Boriek, “Modeling the Kinematics of the Canine Midcostal Diaphragm”, American Journal of Physiology Regulatory Integrative and Comparative Physiology, Vol. 280, pp. 588-597, 2001. [2] American Association for Respiratory Care, “Clinical Protective Guidelines: Static Lung Volumes and Body Plethysmography”, Respiratory Care, Vol. 39, pp. 797-836, 1994. [3] American Thoracic Society, “Standardization of Spirometry, 1994 Update”, American Journal of Respiratory and Critical Care Medicine, Vol. 152, pp. 1107-1136, 1993. [4] M. Amrani, F. Jaillet and B. Shariat, “Simulation of Deformable Organs with a Hybrid Approach”, Revue Internationnale de CFAO et d'Infographie, pp. 213-242, 2001. [5] M. Angelillo, A. M. Boriek, J. R. Rodarte and T. A. Wilson, “Theory of Diaphragm Structure and Shape”, Journal of Applied Physiology, Vol. 83, N°5, pp. 1486-1491, 1997. [6] K. H. Archbold, B. Giordani, D. L. Ruzicka, R. D. Chervin, “Cognitive Executive Dysfunction in Children with Mild Sleep-Disordered Breathing”, Biological Research for "ursing, Vol. 5, pp. 168-76, 2004. [7] E. A. Barnes, B. R. Murray, D. M. Robinson, L. J. Underwood, J. Hanson and W. H. Roa, “Dosimetric Evaluation of Lung Tumor Immobilization Using Breath Hold at Deep Inspiration”, International Journal of Radiation Oncology, Biology, Physics, Vol. 50, N°4, pp. 1091-1098, 2001. [8] G. H. Barnett, R. Maciunas and D. Roberts, "Computer-Assisted Neurosurgery", Informa Healthcare, 1st edition, New York, Nov 8, 2005. [9] J. Beck, C. Sinderby, L. Lindström and A. Grassino, “Effects of Lung Volume on Diaphragm EMG Signal Strength During Voluntary Contractions”, Journal of Applied Physiology, Vol. 85, N° 3, pp. 1123-1134, 1998. [10] C. Behn, “Apuntes Curso Fundamentos Científicos de la Medicina II: Sistema Respiratorio”, Facultad de Medicina, Universidad de Chile, Santiago, Chile, 2005. [11] M. Behr, L. Thollon, P. J. Arnoux, T. Serre, S. V. Berdah, P. Baque, and C. Brunet, “3D Reconstruction of the Diaphragm for Virtual Traumatology”, Surgical and Radiologic Anatomy, Vol. 28, pp. 235-240, 2006. [12] G. Benchetrit, “Breathing Pattern in Humans: Diversity and Individuality”, Respiration Physiology, Vol. 122, pp. 123-129, 2000. [13] D. E. Bettendorff-Bakman, P. Schmid, P. P. Lunkenheimer and P. Niederer, “A Finite Element Study Relating to the Rapid Filling Phase of the Human Ventricles”, Journal of Theoretical Biology, Vol. 238, pp. 303-316, 2006. [14] D. Bettinelli, C. Kays, O. Bailliart, A. Capderou, P. Techoueyres, J. L. Lachaud, P. Vaïda and G. Miserocchi, “Effect of Gravity and Posture on Lung Mechanics”, Journal of Applied Physiology, Vol. 93, N°6, pp. 2044-2052, 2002. 53 [15] N. Blanc Gras, E. Beauvois, F. Esteve and G. Benchetrit, “VISURESP: A New Device for Pulmonary Rehabilitation Based on Visual Feedback”, Biological Psychology, Vol. 41, pp. 85-86, 1995. [16] V. Boldea, “Intégration de la Respiration en Radiothérapie : Apport du Recalage Déformable d'Images”, PhD. thesis, Université Lumière Lyon2, Lyon, France, 2006. [17] M. H. Bonnet, K. Doghramji, T. Roehrs, E. J. Stepanski, S. H. Sheldon, A. S. Walters, M. Wise and A. L. Chesson, “The Scoring of Arousal in Sleep: Reliability, Validity, and Alternatives”, Journal of Clinical Sleep Medicine, Vol. 3, N° 2, pp. 133145, 2007. [18] A. A. Borbely, “A Two Process Model of Sleep Regulation”, Human "eurobiology, Vol. 1, pp. 195-204, 1982. [19] A. M. Boriek and J. R. Rodarte, “Effects of Transverse Stiffness and Central Tendon on Displacement and Shape of a Simple Diaphragm Model”, Journal of Applied Physiology, Vol. 82, N°5, pp. 1626-1636, 1997. [20] W. A. Briscoe and A. B. Dubois, “The Relationship between Airway Resistance, Airway Conductance and Lung Volume in Subjects of Different Age and Body Size”, Journal of Clinical Investigation, Vol. 37, pp. 1279-1285, 1958. [21] K. K. Brock, M. B. Sharpe, L. A. Dawson, S. M. Kim and D. A. Jaffray, “Accuracy of Finite Element Model-Based Multi-Organ Deformable Image Registration”, Medical Physics, Vol. 32, N°6, pp. 1647-1659, 2005. [22] R. T. Brouillette, A. Morielli, A. Leimanis, K. A. Waters, R. Luciano and F. M. Ducharme, “Nocturnal Pulse Oximetry as an Abbreviated Testing Modality for Pediatric Obstructive Sleep Apnea”, Pediatrics, Vol. 105, N°2, pp. 405-412, 2000. [23] R. D. Bucholz, D. D. Yeh, J. Trobaugh, L. L. McDurmont, C. D. Sturm, C. Baumann, J. M. Henderson, A. Levy and P. Kessman, "The Correction of Stereotactic Inaccuracy Caused by Brain Shift Using an Intraoperative Ultrasound Device", Proceedings of the First Joint Conference on Computer Vision, Virtual Reality and Robotics in Medicine and Medial Robotics and Computer-Assisted Surgery, Vol. 1205, pp. 459-466, Berlin, Germany, 1997. [24] R. Budhiraja, J. L. Goodwin, S. Parthasarathy and S. F. Quan, “Comparison of Nasal Pressure Transducer and Thermistor for Detection of Respiratory Events During Polysomnography in Children”, Sleep, Vol. 28, pp. 1117-1121, 2005.1997. [25] M. A. Carskadon and W. C. Dement, “Normal Human Sleep: An Overview”, Principles and Practice of Sleep Medicine: M. H. Kryger, T. Roth, W. C. Dement (eds.), Elsevier Inc, 4th edition, pp 13-23, Phyladelphia, USA, 2005. [26] M. P. Castañeda and F. A. Cosio, “Deformable Model of the Prostate for Turp Surgery Simulation”, Computer and Graphics, Vol. 28, pp. 767-777, 2004. [27] M. Chabanas, V. Luboz and Y. Payan, “Patient Specific Finite Element Model of the Face Soft Tissue for Computer-Assisted Maxillofacial Surgery”, Medical Image Analysis, Vol. 7, pp. 131-151, 2003. 54 [28] J. Chadwick, D. Haumann and R. Parent, “Layered Construction for Deformable Animated Characters”, International Conference on Computer Graphics and Interactive Techniques, SIGGRAPH '89, pp. 243-252, Boston, USA, 1989. [29] Y. Chen and D. Zeltzer, “Pump it up: Computer Animation of a Biomechanically Based Model of Muscle using the Finite Element Method”, Computer Graphics, Vol. 26, N°2, pp. 89-98, 1992. [30] R. D. Chervin, K. H. Archbold, “Hyperactivity and Polysomnographic Findings in Children Evaluated for Sleep-Disordered Breathing”, Sleep, Vol. 24, pp. 313-320, 2001. [31] Y. Chi, J. Liang and D. Yan, “A Material Sensitivity Study on the Accuracy of Deformable Organ Registration using Linear Biomechanical Models”, Medical Physics, Vol. 33, N°2, pp. 421-433, 2006. [32] J. Clausen, “Measurement of Absolute Lung Volumes by Imaging Techniques”, European Respiratory Journal, Vol. 10, pp. 2427-2431, 1997. [33] A. L. Coates, R. Peslin, D. Rodestein and J. Stockcs, “Measurement of Lungs Volumes by Plethysmography”, ERS/ATS Workshop Report Series, European Respiratory Journal, Vol. 10, pp. 1415-1427, 1997. [34] Code Aster. http://www.code-aster.org/, 2009. [35] W. Crum, T. Hartkens and D. Hill, “Non-Rigid Image Registration: Theory and Practice”, British Journal of Radiology, Vol. 77, N° 2, pp. 140-153, 2004. [36] S. L. Davidson Ward, C. L. Marcus, “Obstructive Sleep Apnea in Infants and Young Children”, Journal of Clinical "europhisiology, Vol. 13, N°3, pp. 198-207, 1996. [37] E. Denny and R. C. Schroter, “A Model of Non-Uniform Lung Parenchyma Distorsion”, Journal of Biomechanics, Vol. 39, N°4, pp. 652-653, 2006. [38] A. L. Didier, “Simulation du Mouvement Pulmonaire pour l’Amélioration des Traitements par Radiothérapie”, PhD. thesis, Université Claude Bernard Lyon 1, Lyon, France, 2009. [39] A. L. Didier, P. F. Villard, J. Y. Bayle, M. Beuve and B. Shariat, “Breathing Thorax Simulation Based on Pleura Physiology and Rib Kinematics”, International Conference on Medical Information Visualisation, pp. 35-42, Zurich, Switzerland, 2007. [40] A. B. Dubois, S. Y. Botelho and J. H. Comroe, “A New Method for Measuring Airway Resistance in Man Using a Body Plethysmograph”, Journal of Clinical Investigation, Vol. 35, pp. 327-335, 1956. [41] S. C. Erridge, Y. Seppenwoolde, S. H. Muller, M. Van Herk, K. De Jaeger, J. S. Belderbos, L. J. Boersma and J. V. Lebesque, “Portal Imaging to Assess Set-Up Errors, Tumor Motion and Tumor Shrinkage During Conformal Radiotherapy of Non-Small Cell Lung Cancer”, Radiotherapy and Oncology, Vol. 66, N°1, pp. 75-85, 2003. [42] J. D. Escolar and A. Escolar, “Lung Hysteresis: A Morphological View”, Histology and Histopathology, Vol. 19, pp. 159-166, 2004. 55 [43] P. Estévez, C. M. Held, C. A. Holzmann, C. A. Perez, J. P. Pérez, J. Heiss, M. Garrido and P. Peirano, “Polysomnographic Pattern Recognition for Automated Classification of Sleep-Waking States in Infants”, Medical & Biological Engineering & Computing, Vol. 40, pp. 105-113, 2002. [44] R. C. de la Eva, L. A. Baur, K. C. Donaghue and K. A. Waters, “Metabolic Correlates with Obstructive Sleep Apnea in Obese Subjects”, Journal of Pediatrics, Vol. 140, pp. 654-659, 2002. [45] M. N. Fiamma, Z. Samara, P. Baconnier, T. Similowski and C. Straus, “Respiratory Inductive Plethysmography to Assess Respiratory Variability and Complexity in Humans”, Respiratory Physiology and "eurobiology, Vol. 156, pp. 234-239, 2007. [46] E. C. Ford, G. S. Mageras, E. Yorke and C. C. Ling, “Respiration Correlated Spiral CT: A Method of Measuring Respiratory-Induced Anatomic Motion for Radiation Treatment Planning”, Medical Physics, Vol. 30, N°1, pp. 88-97, 2003. [47] B. C. Friedman, A. Hendeles-Amitai, E. Kozminsky, A. Leiberman, M. Friger, A. Tarasiuk and A. Tal, “Adenotonsillectomy Improves Neurocognitive Function in Children with Obstructive Sleep Apnea Syndrome”, Sleep, Vol. 26, N°8, pp. 999-1005, 2003. [48] B. Gagel, C. Demirel, A. Kientopf, M. Pinkawa, M. Piroth, S. Stanzel, C. Breuer, B. Asadpour, T. Jansen, R. Holy, J. E. Wildberger and M. J. Eble, “Active Breathing Control (ABC): Determination and Reduction of Breathing-Induced Organ Motion in the Chest”, International Journal of Radiation Oncology Biology Physics, Vol. 67, N° 3, pp. 742-749, 2007. [49] A. Gefen, D. Elad and R. J. Shiner, “Analysis of Stress Distribution in the Alveolar Septa of Normal and Simulated Emphysematic Lung”, Journal of Biomechanics, Vol. 32, N°9, pp. 891-897, 1999. [50] W. W. L. Glenn and M. L. Phelps, “Diaphragm Pacing by Electrical Stimulation of the Phrenic Nerve”, "eurosurgery, Vol. 17, N° 6, pp. 974-984, 1985. [51] J. L. Goodwin, K. L. Kaemingk, R. F. Fregosi, G. M. Rosen, W. J. Morgan, D. L. Sherrill and S. F. Quan, “Clinical Outcomes Associated with Sleep-Disordered Breathing in Caucasian and Hispanic Children – the Tucson Children’s Assessment of Sleep Apnea Study (TuCASA)”, Sleep, Vol. 26, pp. 587-591, 2003. [52] D. Gozal, M. Wang and D. W. Pope, “Objective Sleepiness Measures in Pediatric Obstructive Sleep Apnea”, Pediatrics, Vol. 108, pp. 693-697, 2001. [53] C. Guilleminault, F. L. Eldridge, B. Simmons and W. C. Dement, “Sleep Apnea in Eight Children”, Pediatrics, Vol. 58, pp. 28-32, 1976. [54] C. Guilleminault, A. Tilkan and W. C. Dement, “The Sleep Apnea Syndromes”, Annual Review of Medicine, Vol. 27, pp. 465-484, 1976. [55] R. S. Harris, “Pressure-Volume Curves of the Respiratory System”, Respiratory Care, Vol. 50, N° 1, pp 78-98, 2005. 56 [56] N. Hart, P. Hawkins, C-H. Hamnegård, M. Green, J. Moxham and M. I. Polkey, “A Novel Clinical Test of Respiratory Muscle Endurance”, European Respiratory Journal, Vol. 19, pp. 232-239, 2002. [57] J. E. Heiss, C. M. Held, P. E. Estévez, C. A. Perez, C. A. Holzmann and J. P. Pérez, “Classification of Sleep Stages in Infants: A Neuro Fuzzy Approach”, IEEE Engineering in Medicine and Biology, Vol. 21, N°5, pp. 147-151, 2002. [58] C. M. Held, L. Causa, P. Estévez, C. Pérez, M. Garrido, C. Algarín and P. Peirano, “Dual Approach for Automated Sleep Spindles Detection within EEG Background Activity in Infant Polysomnograms”, Proceedings of the 26th Annual International Conference of the IEEE EMBS, Vol. 1, pp. 566-569, San Francisco, CA, USA, 2004. [59] A. Hostettler, “Modélisation et Simulation Patient-Dépendante, Préopératoire, Prédictive, et Temps-Réel du Mouvement des Organes de l’Abdomen Induit par la Respiration Libre”, PhD thesis, Université Louis Pasteur Strasbourg 1, Strasbourg, France, 2008. [60] N. E. Huang, Z. Shen, S. R. Long, M. C. Wu, H. H. Shih, Q. Zheng, N. C. Yen, C. C. Tung and H. H. Liu, “The Empirical Mode Decomposition and the Hilbert Spectrum for Nonlinear and Non-Stationary Time Series Analysis”, Royal Society of London Proceedings Series A, Vol. 454, N° 1971, pp. 903–995, 1998. [61] H. U. Kauczor, C.P. Heussel, B. Fischer, R. Klamm, P. Mildenberger and M. Thelen, “Assessment of Lung Volumes Using Helical CT at Inspiration and Expiration: Comparison with Pulmonary Function Test”, American Journal of Roentgenology, Vol. 171, pp. 1091-1095, 1998. [62] K. L. Kaemingk, A. E. Pasvogel, J. L. Goodwin, S. A. Mulvaney, F. Martínez, P. L. Enright, G. M. Rosen, W. J. Morgan, R. F. Fregosi and S. F. Quan, “Learning in Children and Sleep Disordered Breathing: Findings of the Tucson Children’s Assessment of Sleep Apnea (tuCASA) Prospective Cohort Study”, Journal of the International "europsychological Society, Vol. 9, pp. 1016-26, 2003. [63] J. Kaye, D. N. Metaxas and F. P. Primiano, “A 3D Virtual Environment for Modeling Mechanical Cardiopulmonary Interactions”, Proceedings of the First Joint Conference on Computer Vision, Virtual Reality and Robotics in Medicine and Medial Robotics and Computer-Assisted Surgery, pp. 389-398, Berlin, Germany, 1997. [64] P. J. Keall, G. S. Mageras, J. M. Balter, R. S. Emery, K. M. Forster, S. B. Jiang, J. M. Kapatoes, D. A. Low, M. J. Murphy, B. R. Murray, C. R. Ramsey, M. B. Van Herk, S. S. Vedam, J. W. Wong and E. Yorke, “The Management of Respiratory Motion in Radiation Oncology Report of AAPM Task Group 76”, Medical Physics, Vol. 33, N°10, pp. 3874-3900, 2006. [65] J. D. Kennedy, S. Blunden, C. Hirte, D. W. Parsons, A. J. Martin, E. Crowe, D. Williams, Y. Pamula and. K. Lushington, “Reduced Neurocognition in Children who Snore”, Pediatric Pulmonology, Vol. 37, pp. 330-337, 2004. 57 [66] R. Kowe, R. C. Schroter, F. L. Matthews and D. Hitchings, “Analysis of Elastic and Surface Tension Effects in the Lung Alveolus using Finite Element Methods”, Journal of Biomechanics, Vol. 19, N°7, pp. 541-549, 1986. [67] J. Krieger, E. Sforza, A. Boudewijns, M. Zamagni and C. Petiau, “Respiratory Effort during Obstructive Sleep Apnea”, Chest, Vol. 112, pp. 875-884, 1997. [68] C. Lamm, J. Mandeli and M. Kattan, “Evaluation of Home Audiotapes as an Abbreviated Test for Obstructive Sleep Apneas Syndrome (OSAS) in Children”, Pediatric Pulmonology, Vol. 27, N°4, pp. 267-272, 1999. [69] F. Laghi, M. J. Harrison and M. J. Tobin, “Comparison of Magnetic and Electrical Phrenic Nerve Stimulation in Assessment of Diaphragmatic Contractility”, Journal of Applied Physiology, Vol. 80, pp. 1731-1742, 1996. [70] D. Laporta and A. Grassino, “Assessment of Transdiaphragmatic Pressure in Humans”, Journal of Applied Physiology, Vol. 58, N° 5, pp. 1469-1476, 1985. [71] A. Lee, A. Kratochwil, I. Stümpflen, J. Deutinger and G. Bernaschek, “Fetal Lung Volume Determination by Three-Dimensional Ultrasonography”, American Journal of Obstetrics and Gynecology, Vol. 173, N°3, pp. 588-592, 1996. [72] M. Littner, “Polysomnography in the Diagnosis of the Obstructive Sleep ApneaHypopnea Syndrome”, Chest, Vol. 118, N° 2, pp. 286-288, 2000. [73] S. H. Loring, “Action of the Human Respiratory Muscles Inferred from Finite Element Analysis of Rib Cage”, Journal of Applied Physiology, Vol. 72, N°4, pp. 14611465, 1992. [74] H. M. Loyd, T. String and A. B. Dubois, “Radiographic and Plethysmographic Determination of Total Lung Capacity”, Radiology, Vol. 28, pp. 7-14, 1966. [75] V. Luboz, A. Pedrono, D. Ambard, F. Boutault, Y. Payan and P. Swider, “Prediction of Tissue Decompression in Orbital Surgery”, Clinical Biomechanics, Vol. 19, N°2, pp. 202-208, 2004. [76] D. Mahieu-Caputo, P. Sonigo, M. Dommergues, J. C. Fournet, J. C. Thalabard, C. Abarca, A. Benachi, F. Brunelle and Y. Dumez, “Fetal Lung Volume Measurement by Magnetic Resonance Imaging in Congenital Diaphragmatic Hernia”, International Journal of Obstetrics and Gynecology, Vol. 108, N° 8, pp. 863-868, 2001. [77] C. L. Marcus, M. G. Greene and J. L. Carroll, “Blood Pressure in Children with Obstructive Sleep Apnea”, American Journal of Respiratory and Critical Care Medicine, Vol. 157, pp. 1098-1103, 1998. [78] C. L. Marcus, K. J. Omlin, D. J. Basinsky, S. L. Bailey, A. B. Rachal, W. S. Von Pechmann, T. G. Keens and S. L. Ward, “Normal polisomnographic values for children and adolescents”, American Review of Respiratory Disease, Vol.146, pp. 1235-1239, 1992. [79] A. Mohamed, C. Davatzikos and R. Taylor, “A Combined Statical and Biomechanical Model for Estimation of Intra-Operative Prostate Deformation”, 58 Proceedings of the 5th International Conference on Medical Image Computing and Computer-Assisted Intervention, Part II, pp. 452-460, Tokyo, Japan, 2002. [80] M. Mohr, E. Adams, C. Engel, W. B. Long and M. Bottlang, “Geometry of Human Ribs Pertinent to Orthopedic Chest-Wall Reconstruction”, Journal of Biomechanics, Vol. 40, N°6, pp. 1310-1317, 2007. [81] A. Moreno, S. Chambon, A. P. Santhanam, R. Brocardo, P. Kupelian, J. P. Rolland, E. Angelini and I. Bloch, “Thoracic CT-PET Registration using a 3D Breathing Model”, International Conference on Medical Image Computing and Computer Assisted Intervention, MICCAI 2007, pp. 626-633, Brisbane, Australia, 2007. [82] L. P. Nedel and D. Thalmann, “Modeling and Deformation of the Human Body using Ananatomically-Based Approach”, Proceedings of Computer Animation, pp. 3440, Philadelphia, USA, 1998. [83] L. P. Nedel and D. Thalmann, “Real Time Muscle Deformations Using Mass-Spring Systems”, Proceedings of the Computer Graphics International, pp. 156-165, Hannover, Germany, 1998. [84] T. Neicu, H. Shirato, Y. Seppenwoolde and S. B. Jiang, “Synchronized Moving Aperture Radiation Therapy (Smart): Average Tumour Trajectory for Lung Patients”, Physiology, Medicine and Biology, Vol. 48, pp. 587-598, 2003. [85] L. M. O’Brien, C. R. Holbrook, C. B. Mervis, C. J. Klaus, J. L. Bruner, T. J. Raffield, J. Rutherford, R. C. Mehl, M. Wang, A. Tuell, B. C. Hume and D. Gozal, “Sleep and Neurobehavioral Characteristics of 5- to 7-Year-Old Children with Parentally Reported Symptoms of Attention-Deficit/Hyperactivity Disorder”, Pediatrics, Vol. 111, pp. 554-563, 2003. [86] A. B. Otis, W. O. Fenn and W. Rahn, “Mechanisms of Breathing in Man”, Journal of Applied Physiology, Vol. 2, pp. 592-607, 1950. [87] C. Ozhasoglu and M. J. Murphy, “Issues in Respiratory Motion Compensation during External-Beam Radiotherapy”, International Journal of Radiation Oncology Biology Physics, Vol. 52, N° 5, pp. 1389-1399, 2002. [88] A. F. Pacela, “Impedance Pneumography: A Survey of Instrumentation Techniques”, Medical and Biological Engineering and Computing, Vol. 4, N°1, pp. 115, 1966. [89] Y. Payan, M. Chabanas, C. Vilain, X. Pelorson, P. Levy, V. Luboz and P. Perrier, “Biomechanical Models to Simulate Consequences of Maxillofacial Surgery”, Comptes Rendus Biologies, Vol. 325, N°4, pp. 309-319, 2002. [90] T. M. Peters, "Image-Guidance for Surgical Procedures", Physics in Medicine and Biology, Vol. 51, pp. 505-540, 2006. [91] N. Pettiaux, M. Cassart, M. Paiva and M. Estenne, “Three-Dimensional Reconstruction of Human Diaphragm with the Use of Spiral Computed Tomography”, Journal of Applied Physiology, Vol. 82, N°3, pp. 998-1002, 1997. 59 [92] C. Plathow, S. Ley, C. Fink, M. Puderbach, W. Hosch, A. Schmahl, J. Debus and H. U. Kauczor, “Analysis of Intrathoracic Tumor Mobility During Whole Breathing Cycle by Dynamic MRI”, International Journal of Radiation Oncology Biology Physics, Vol. 59, N° 4, pp. 952-959, 2004. [93] M. I. Polkey, M. Green and J. Moxham, “Measurement of Respiratory Muscle Strength”, Thorax, Vol. 50, pp. 1131-1135, 1995. [94] M. I. Polkey, Y. Luo, R. Guleria, C. H. Hamneg Ård, M. Green and J. Moxham, “Functional Magnetic Stimulation of the Abdominal Muscles in Humans”, American Journal of Respiratory Critical Care Medicine, Vol. 160, N° 2, 513-522, 1999. [95] N. B. Pride, “The Assessment of Airflow Obstruction. Role of Measurements of Airways Resistance and Test of Forced Expiration”, British Journal of Diseases of the Chest, Vol. 65, pp. 135-169, 1971. [96] E. Promayon, “Modélisation et Simulation de la Respiration”, PhD thesis, Université Joseph Fourier, Grenoble, France, 1997. [97] E. Promayon and P. Baconnier, “A 3D Discrete Model of the Diaphragm and Human Trunk”, Lung Modeling: L. Boudin, C. Grandmont, Y. Maday, B. Maury, J. –F. Gerbeau (eds.), Vol. 23, pp. 66-77, 2008. [98] E. Promayon, P. Baconnier and C. Puech, “Physically-Based Deformations Constrained in Displacements and Volume”, Computer Graphic Forum, Vol. 15, N°3, pp. 155-164, 1996. [99] E. Promayon, P. Baconnier and C. Puech, “Physically-Based Model for Simulating the Human Trunk Respiration Movements”, Proceedings of the First Joint Conference on Computer Vision, Virtual Reality and Robotics in Medicine and Medial Robotics and Computer-Assisted Surgery, pp. 379-388, Berlin, Germany, 1997. [100] P. H. Quanjer (ed.), “Standardized Lung Function Testing. Report Working Party Standardization of Lung Function Tests, European Community for Coal and Steel”, Bulletin Europeen de Physiopathologie Respiratoire-Clinical Respiratory Physiology, Vol. 19, N°5, pp. 1-95, 1983. [101] P. H. Quanjer, G. J. Tammeling, J. E. Cotes, O. F. Pedersen, R. Peslin and J. C. Yernault, “Lung Volumes and Forced Ventilatory Flows”, European Respiratory Journal, Vol. 6, N° 16, pp. 5-40, 1993. [102] H. Rahn, A. B. Otis, L. E. Chadwick and W. O. Fenn, “The Pressure-Volume Diagram of the Thorax and Lung. American Journal of Physiology, Vol. 146, N° 6, pp. 161-178, 1946. [103] A. Ratnovsky and D. Elad. “Anatomical Model of the Human Trunk for Analysis of Respiratory Muscles Mechanics”, Respiratory Physiology and "eurobiology, Vol. 148, pp. 245-262, 2005. [104] A. Ratnovsky, D. Elad and P. Halpern, “Mechanics of Respiratory Muscles”, Respiratory Physiology and "eurobiology, Vol. 31, N°2, pp. 333-340, 2008. 60 [105] E. Rebuffat, J. Grswasser, I. Kelmanson, M. Sottiaux and A. Kahn, “Polygraphic Evaluation of Night-to-Night Variability in Sleep Characteristics and Apneas in Infants”, Sleep, Vol. 17, pp. 329-332, 1994. [106] A. Rechtschaffen and A. Kales, “A Manual of Standardized Terminology, Techniques and Scoring System for Sleep Stages of Human Subjects”, UCLA, Brain Research Institute/ Brain Information Service, Los Angeles, USA, 1968. [107] S. Redline, R. Budhiraja, V. Kapur, C. L. Marcus, J. Mateika, R. Mehra, S. Parthasarthy, V. Somers, K. P. Strohl, L. G. Sulit, D. Gozal, M. S. Wise and S. F. Quan, “The Scoring of Respiratory Events in Sleep: Reliability and Validity”, Journal of Clinical Sleep Medicine, Vol. 3, N°2, pp. 169-200, 2007. [108] S. Redline and M. Sanders, “A Quagmire for Clinicians: When Technological Advances Exceed Clinical Knowledge”, Thorax, Vol. 54, pp. 474-475, 1999. [109] A. D. Renzetti, “Standardization of Spirometry”, American Review of Respiratory Disease, Vol. 179, pp. 831-838, 1979. [110] G. Rilling, P. Flandrin and P. Gonçalves, “On Empirical Mode Decomposition and its Algorithms”, Proceedings of the IEEE-EURASIP Workshop on "onlinear Signal and Image Processing "SIP-03, Vol. 1, Italy, 2003. [111] M. Sagar, D. Bullivant, G. Mallinson and P. Hunter, “A Virtual Environment and Model of the Eye for Surgical Simulation”, Proceedings of the 21st Annual Conference on Computer Graphics and Interactive Techniques, pp. 205-212, Florida, USA, 1994. [112] A. P. Santhanam, C. Imielinska, P. Davenport, P. Kupelian and J. P. Rolland, “Modeling Real-Time 3D Lung Deformations for Medical Visualization”, IEEE Transactions on Information Technology in Biomedicine, Vol. 12, N°2, pp. 257-270, 2008. [113] D. Sarrut, V. Boldea, M. Ayadi, J. N. Badel, C. Ginestet, S. Clippe and C. Carrie, “Non Rigid Registration Method to Assess Reproducibility of Breath-Holding with ABC in Lung Cancer”, International Journal of Radiation Oncology Biology Physics, Vol. 61, N° 2, pp. 594-607, 2005. [114] N. A. Saunders, S. M. Kreitzer and R. H. Ingram, “Rib Cage Deformation during Static Inspiratory Efforts”, Journal of Applied Physiology, Vol. 46, N°6, pp. 1071-1075, 1979. [115] M. S. Schechter, “Technical Report: Diagnosis and Management of Childhood Obstructive Sleep Apnea Syndrome”, Pediatrics, Vol. 109, N°4, e69, 2002. [116] W. P. Segars, D. S. Lalush and B. M. W. Tsui, “Modeling Respiratory Mechanics in the Mcat and Spline-Based Mcat Phantoms”, IEEE Transactions on "uclear Sciences, Vol. 48, N°1, pp. 89-97, 2001. [117] J. W. Shepard, “Cardiopulmonary Consequences of Obstructive Sleep Apnea”, Mayo Clinic Proceedings, Vol. 65, pp. 1250-1259, 1990. [118] H. Shirato, “Speed and Amplitude of Lung Tumor Motion Precisely Detected in Four-Dimensional Setup and in Real-Time Tumor-Tracking Radiotherapy”, 61 International Journal of Radiation Oncology Biology Physics, Vol. 64, N°4, pp. 12291236, 2006. [119] K. E. Sixel, M. Ruschin, R. Tirona and P. C. Cheung, “Digital Fluoroscopy to Quantify Lung Tumor Motion: Potential for Patient-Specific Planning Target Volumes”, International Journal of Radiation Oncology Biology Physics, Vol. 57, N°3, pp. 717-723, 2003. [120] O. M. Skrinjar and J. S. Duncan, "Real Time 3D Brain Shift Compensation" Proceedings of the 16th International Conference on Information Processing in Medical Imaging, Vol. 1613, pp. 42–55, Visegrad, Hungary, 1999. [121] O. M. Skrinjar, A. Nabavi and J. Duncan, "Model-Driven Brain Shift Compensation", Medical Image Analysis, Vol. 6, pp. 361–373, 2002. [122] O. M. Skrinjar, C. Studholme, A. Nabavi and J. Duncan, "Steps Toward a StereoCamera-Guided Biomechanical Model for Brain Shift Compensation", Proceedings of the 17th International Conference on Information Processing in Medical Imaging, Vol. 2082, pp. 183-189, Davis, CA, USA, 2001. [123] V. Sojar, D. Stanisavljević, M. Hribernik, M. Glušič, D. Kreuh, U. Velkavrh and T. Fius, “Liver Surgery Training and Planning in 3D Virtual Space”, Proceedings of the 18th International Congress and Exhibition on Computer Assisted Radiology and Surgery, CARS 2004, Vol. 1268, pp. 390-394, Chicago, USA, 2004. [124] E. Stindel, J. Briard, P. Merloz, S. Plaweski, F. Dubrana, C. Lefevre and J. Troccaz, “The Bone Morphing : 3D Morphological Data for Total Knee Arthroplasty”, Computer-Aided Surgery, Vol. 7, N°3, pp. 156-168, 2002. [125] I. Suramo, M. Paivansalo and V. Myllyla, “Cranio-Caudal Movements of the Liver, Pancreas and Kidneys in Respiration”, Acta Radiologica. Diagnosis, Vol. 25, N°2, pp. 129-131, 1984. [126] J. P. Tang, C. L. Rosen, E. K. Larkin, J. M. DiFiore, J. L. Arnold, S. A. Surovec, J. M. Youngblut and S. Redline, “Identification of Sleep-Disordered Breathing in Children: Variation with Event Definition”, Sleep, Vol. 25, pp. 72-79, 2002. [127] J. Terán Santos, A. Jimenez Gómez, J. Cordero-Guevara and the Cooperative Group Burgos-Santander, “The Association between Sleep and the Risk of Traffic Accidents”, "ew England Journal of Medicine, Vol. 340, pp. 847-851, 1999. [128] S. Uliel, R. Tauman, M. Greenfeld and Y. Sivan, “Normal Polysomnographic Respiratory Values in Children and Adolescents”, Chest, Vol. 125, pp. 872-878, 2004. [129] P. Valta, J. Takala, R. Foster, C. Weissman and J. M. Kinney, “Evaluation of Respiratory Inductive Plethysmography in the Measurement of Breathing Pattern and PEEP-Induced Changes in Lung Volume”, Chest, Vol. 102, N°1, pp. 234-238, 1992. [130] D. L. Vawter, Y. C. Fung and J. B.West, “Constitutive Equation of Lung Tissue Elasticity”, Journal of Biomechanical Engineering, Vol. 101, pp. 38-45, 1979. [131] L. D. Víctor, “Obstructive Sleep Apnea”, American Family Physician, Vol. 60, N°8, pp. 2279-2286, 1999. 62 [132] M. Wachowiak, X. Wang, A. Fenster and T. Peters, “Compact Support Radial Basis Functions for Soft Tissue Deformation”, Proceedings of IEEE International Symposium on Biomedical Imaging, Vol. 2, pp. 1259-1262, Arlington, USA, 2004. [133] K. Waters, “A Muscle Model for Animation Three-Dimensional Facial Expression”, Proceedings of the 14th Annual Conference on Computer Graphics and Interactive Techniques, pp. 17-24, Anaheim, USA, 1987. [134] A. Watson, P. Hughes, M. L. Harris, N. Hart, R. Ware, J. Wendon, M. Green and J. Moxham, “Measurement of Twitch Transdiaphragmatic, Esophageal, and Endotracheal Tube Pressure with Bilateral Anterolateral Magnetic Phrenic Nerve Stimulation in Patients in the Intensive Care Unit”, Critical Care Medicine, Vol. 29, N° 7, pp. 13251331, 2001. [135] W. J. Weiss, S. Remsburg, E. Garpestad, J. Ringler, D. Sparrow and A. Parker, “Hemodynamic Consequences of Obstructive Sleep Apnea”, Sleep Vol. 19, pp. 338397, 1996. [136] J. W. Wong, M. B. Sharpe, D. A. Jaffray, V. R. Kini, J. M. Robertson, J. S. Stromberg and A. A. Martinez, “The Use of Active Breathing Control (ABC) to Reduce Margin for Breathing Motion”, International Journal of Radiation Oncology Biology Physics, Vol. 44, N° 4, pp. 911-919, 1999. [137] K. H. Yang and K. H. Wang, “Finite Element Modeling of the Human Thorax”, The Second Visible Human Project Conference, Maryland, USA, 1998. [138] Y. T. Zhang, W. Herzog, M. A. Vaz and A. C. S. Guimarães, “Vibromiography as an Index of Muscular Fatigue”, Proceedings of the Canadian Medical and Biological Engineering Society, pp. 98-99, Ottawa, Canada, 1993. [139] V. B. Zordan, B. Celly, B. Chiu and P. C. Di Lorenzo, “Breathe Easy: Model and Control of Simulated Respiration for Animation”, Proceedings of the Symposium on Computer Animation, pp. 29-37, Grenoble, France, 2004. [140] V. B. Zordan, B. Celly, B. Chiu and P. C. Di Lorenzo, “Breathe Easy: Model and Control of Human Respiration for Computer Animation”, Graphical Models, Vol. 68, pp. 113-132, 2005. 63