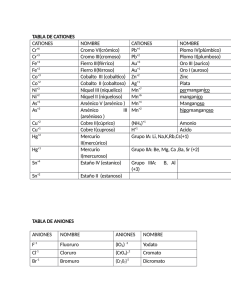
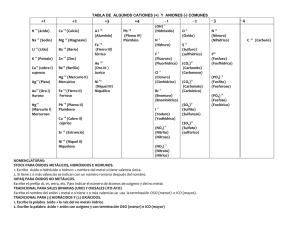
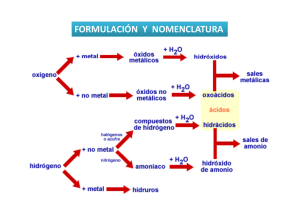
Complete el cuadro: OXIDOS
Valencia
1
2
3
4
5
6
7
1
2
2
3
4
Fórmula
N. sistemática
(la más frecuente)
F2O
Cl2O
SO
I2O3
SeO2
Br2O5
S2O3
I2O7
Na2O
CaO
FeO
Fe2O3
PbO2
N. stock
N. tradicional
Monóxido de di cloro
Óxido de selenio (IV)
Complete BASES O HIDROXIDOS
Valencia
1
2
2
3
4
Fórmula
NaOH
Ca(OH)2
Ni (OH)2
Al(OH)3
Pb(OH)4
N. sistemática
N. stock
(la más frecuente)
N. tradicional
Hidróxido de sodio
Hidróxido de níquel (II)
Hidróxido plúmbico
COMPLETE ACODOS HIDRACIDOS
Valencia Fórmula
1
1
1
1
2
2
2
HF
HCl
HBr
HI
H2S
N. tradicional *
(cuando está en disolución)
N. tradicional * (cuando está en estado puro)
Fluoruro de hidrógeno
Ácido sulfhídrico
Seleniuro de hidrógeno
Ácido telurhídrico
COMPLETE ACIDOS OXACIDOS
Valencia
1
2
3
4
5
6
7
Fórmula
F2O + H2O = H2F2O2 =
SO + H2O =
Cl2O3 + H2O = H2Cl2O4 =
S2 O + H 2 O =
Cl2O5 + H2O = H2Cl2O6 =
SO3 + H2O =
Cl2O7 + H2O = H2Cl2O8 =
N. tradicional
HFO
H2SO2
HClO2
H2SO3
HClO3
H2SO4
HClO4
Ácido hiposulfuroso
COMPLETE - SALES
Ácido
HClO
HClO2
HClO3
HClO4
H2SO2
H2SO3
H2SO4
H4P2O7
H3AsO3
Nombre del ácido
Ácido hipocloroso
Sal
Ca(ClO)2
Ca(ClO2)2
Sn(ClO3)4
LiClO4
CaSO2
Pb(SO3)2
Al2(SO4)3
Fe4(P2O7)3
K3AsO3
Nombre de la sal
Hipoclorito de calcio
ESCRIBA LA FORMULA
NOMBRE
1.
Óxido de bario
FORMULA
NOMBRE
FORMULA
1
26.
Ácido carbónico
26
2.
Óxido de sodio
2
27.
Ácido perclórico
27
3.
Óxido de plat
3
28.
Ácido fosfórico
28
4.
Óxido de níquel (III)
4
29.
Ácido metafosfórico
28
5.
Óxido de cloro (VII)
5
30.
Ácido sulfhídrico
30
6.
Óxido nitroso
6
31.
Ácido sulfúrico
31
7.
Hidruro de litio
7
32.
Ácido hipoyodoso
32
8.
Cloruro de cobalto (III)
8
33.
Hidruro de magnesio
33
9.
Hidruro de plata
9
34.
Ácido silícico
34
10.
Ácido bromhídrico
10
35.
Hidróxido de calcio
35
11.
Ácido sulfhídrico
11
36.
Hidróxido de hierro (III)
36
12.
Amoniaco
12
37.
Ácido nitroso
37
13.
Ácido clorhídrico
13
38.
Hidróxido de aluminio
38
14.
Peróxido de bario
14
39.
Bromuro de cobalto (II)
38
15.
Peróxido de sodio
15
40.
Hidróxido de potasio
40
16.
Óxido de estroncio
16
41.
Sulfato de calcio
41
17.
Ácido clorhídrico
17
42.
Cloruro de cobalto (III)
42
18.
Cloruro de sodio
18
43.
Nitrito de litio
43
19.
Fluoruro de calcio
19
44.
Carbonato sódico
44
20.
Yoduro de plomo (II)
20
45.
Cloruro potásico
45
21.
Bromuro potásico
21
46.
Sulfuro de zinc
46
22.
Sulfuro de bario
22
47.
Hipoiodito potásico
47
23.
tricloruro de arsénico
23
48.
Fosfato cálcico
46
24.
Peróxido de litio
24
49.
Hidrógeno sulfato de litio
49
25.
Ácido nítrico
25
50.
Peróxido de plata
50
COLEGIO PEDAGÓGICO DE LOA ANDES
QUÍMICA
Mg. JOSÉ BENJAMÍN VILLAMIZAR MALDONADO
Nombre _________________________________________________________________________
Frente a cada formula coloque el peso molar
Ca(ClO)2
Ca(ClO2)2
Sn(ClO3)4
LiClO4
CaSO2
Pb(SO3)2
Al2(SO4)3
Fe4(P2O7)3
K3AsO3
Br2O5
S2O3
I2O7
Na2O
CaO
FeO
Fe2O3
PbO2
H2O
18 g/mol
Coloque el estado de oxidación para cada elemento de cada compuesto
Ca(ClO)2
Ca(ClO2)2
Sn(ClO3)4
LiClO4
CaSO2
Pb(SO3)2
Al2(SO4)3
Fe4(P2O7)3
K3AsO3
Ca+2
Cl+1
O-2
Br2O5
S2O3
I2O7
Na2O
CaO
FeO
Fe2O3
PbO2
H2O
EJERCICOS DE ESTEQUIOMETRIA
1. Calcule cuantos gramos de fosfato de calcio se pueden producir a partir de la reacción entre 100 gramos de carbonato
de calcio y 70 gramos de acido fosfórico?
CaCO3 + H3PO4 ==== Ca3 (PO4)2 + H20
2. calcule el número de gramos de reactivo exceso sobrante en la reacción del ejercicio anterior
3. la soda caustica comercial NaOH se prepara a partir de la siguiente reacción
Ca (OH)2
____
NaOH +
CaCO3
Na2C03 +
a.
b.
c.
d.
cuantos moles de NaOH a partir de un1,00 Kg de Na2C03
cuantos moles de Ca(OH)2 reaccionan con 1,00 Kg de Na2C03
cuantas moles de CaCO3 se produce durante el proceso
cuantas gramos de NaOH se prepara comercialmente
4. Cuando se calienta Cu en presencia de S se produce Cu2S. ¿Cuánto sulfuro de azufre se produce a partir de 100 gramo
de Cu y 50 gramos de S? ¿Cuántos gramos sobran del reactivo exceso?
5. se hace reaccionar 750 g de NaCl de una pureza del 80% con 830 g de acido sulfúrico de una pureza del 95% y se
obtiene 415 g de sulfato de sodio: ¿cual es rendimiento de la reacción? ¿Cuántos gramos de acido clorhídrico se producen
en el proceso?