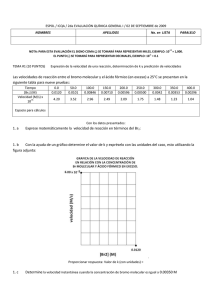
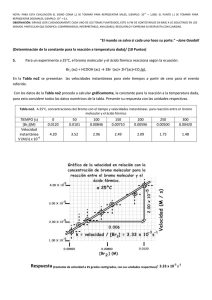
CINETICA QUÍMICA Estudio de las velocidades de reacción
Anuncio

CINETICA QUÍMICA Estudio de las velocidades de reacción Temas de Química General Fuerzas intermoleculares y gases reales Cambios de estado C bi d d Sólidos Soluciones - Propiedades coligativas Equilibrio Químico Equilibrios iónicos Equilibrios heterogéneos Electroquímica Cinética Química Cinética Química Concentración y velocidad de reacción Leyes de velocidad y orden de reacción g p medio de reacción. Ecuaciones integradas de velocidad. Tiempo Mecanismos de reacción Efecto de la temperatura sobre la velocidad de reacción Teoría de colisiones Catálisis. Catálisis Proceso Haber Combustión de madera: proceso rápido Oxidación de hierro: proceso lento Co oncentracción mola ar Hidrógeno (reactivo) N2 + 3H2 Nitrógeno (reactivo) Amoníaco (producto) Tiempo te 2NH3 La velocidad de una reacción se expresa como el cambio de las concentraciones en función del tiempo concentraciones en función del tiempo. A medida que se forman productos, A medida que se forman productos comienza a producirse la reacción inversa. a A + b B c C + d D Conce entración m molar Hidrógeno (reactivo) Nitrógeno (reactivo) Amoníaco (producto) Tiempo p te velocidad neta = velocidad directa – velocidad inversa. Consideremos el caso donde sólo es importante la velocidad de la reacción directa. NO + O3 → NO2 + O2 v=− d [O 3 ] d [NO 2 ] d [O 2 ] d [NO] =− = = dt dt dt dt 2 HI(g) → I2(g) + H2(g) 1 d [HI] d [H 2 ] d [H 2 ] = = v=− dt dt 2 dt aA+bB→cC+dD 1 d [A] 1 d [B] v= − = − = b dt a dt 1 d [C] = c dt 1 d [D] d dt Δ (concentración) Con nc. molarr de produ uctos tangente g Δ (tiempo) Tiempo aA+bB→cC+dD 1 d [C] v= = c dt 1 d [D] d dt Conce entración n molar Velocidad a e (tangente a e) Tiempo La velocidad de una reacción depende de: La concentración de los reactivos reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador. La velocidad de una reacción depende de: La concentración de los reactivos reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador. A temperatura constante, la velocidad de una reacción depende de las concentraciones de los reactivos: aA+bB→cC+dD 1 d [A] 1 d [C] v=− = = k [A]m [B]n a dt c dt m: orden de reacción respecto a A n : orden de reacción respecto a B m + n : orden total de reacción k constante k: t t de d velocidad l id d m y n no son necesariamente los coeficientes estequiométricos q de A y B en la reacción global El orden d de d la l reacción ió debe d b determinarse d t i experimentalmente. i t l t I2(g) + H2(g) → 2 HI(g) d [H 2 ] − = k[H 2 ] [I 2 ] dt Br2(g) + H2(g) → 2 HBr(g) d [H 2 ] − = k[H 2 ] [Br2 ]1/ 2 dt LEYES INTEGRADAS DE VELOCIDAD Reacciones de orden cero A → productos dC − =k dt ∫ C C0 dC = − kdt dC = − k t ∫ dt C - C0 = −k t 0 Reacción de orden cero Co oncentracción de rreactivo C - C0 = −k t C0 pendiente = -k Tiempo Tiempo medio Ti di d de reacción: ió tiempo ti requerido id para que lla concentración del reactivo sea la mitad de su concentración inicial. inicial C = ½ C0 R Reacción ió d de orden d cero 1 C 0 - C 0 = − k t1/ 2 2 t1/ 2 1 C 0 = k t1/ 2 2 C0 = 2k Reacciones de p primer orden N2O5(g) → 2 NO2(g) + ½ O2(g) d [N 2 O 5 ] − = k[ N 2 O 5 ] dt A → productos dC − =kC dt dC = −k C0 C ∫ C C = −k t ln C0 dC = − k dt C t ∫ dt 0 Reacción de primer orden ln C = ln C 0 − k t C0 ln C0 ln C Co oncentra ación pendiente = -k Tiempo Tiempo 1/2 C 0 ln = − k t1/ 2 C0 1 ln = − k t1/ 2 2 ln 1 − ln 2 = − k t1/ 2 Reacción de primer orden t1 / 2 ln 2 = k Conccentración molar d de A, [A] Tiempo p medio k pequeña t1/2 largo t1/2 corto k grande Tiempo Con ncentración ´ C0 C0 C0 C0 Tiempo (unidades arbitrarias) Æ Reacciones de segundo orden C4H6(g) → ½ C8H12(g) − d [C 4 H 6 ] = k [C 4 H 6 ]2 dt A → productos dC = − k dt 2 C dC − = k C2 dt dC = −k 2 C0 C ∫ C 1 1 − = kt C C0 t ∫ dt 0 Reacción de segundo g orden 1/C Æ 1 1 = +kt C C0 pendiente = k 1/C0 Ti Tiempo Æ Tiempo medio 1 1 − = k t1/ 2 1 / 2C 0 C 0 1 = k t1/ 2 C0 t1/ 2 1 = k C0 Reacción de segundo orden Concentración ´ 2 1 − = k t1/ 2 C0 C0 C0 C0 C0 C0 Tiempo (unidades arbitrarias) Æ Od Orden E Ecuac. d de veloc. l Cero v=k C - C0 = −k t t1/ 2 = C0 2k Uno v=kC C = −k t ln C0 t1 / 2 = lln 2 k Dos v = k C2 1 1 − = kt C C0 t1/2 = 1 k C0 1 1 − 2 = 2k t 2 C C0 t1/ 2 = Tres Unidades de k v = k C3 E Ecuac. i t integrada d ti tiempo medio di 3 2 k C 02 DETERMINACIÓN EXPERIMENTAL DE LAS LEYES DE VELOCIDAD Método de ensayo. Se determina la concentración de reactivo a distintos intervalos de tiempo. Ejemplo: en la reacción + Br2(ac) 2( ) + HCOOH(ac) ( ) → 2 Br (ac) ( ) + 2 H (ac) ( ) + CO2(g) 2( ) se coloca un gran exceso de ácido fórmico y se mide la concentración de Br2 en función del tiempo: tiempo / s [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0 00710 0,00710 0,00596 0,00500 0 00420 0,00420 0,00353 0,00296 tiempo / s [Br2] 0 50 100 150 200 250 300 350 400 Orden cero: 0,0120 0,0101 0,00846 0 00710 0,00710 0,00596 0,00500 0 00420 0,00420 0,00353 0,00296 0,0101 – 0,0120 = - k x 50 k = 1,98x10-4 M/s 0,00596 – 0,0120 = - k x 200 k = 3,02x10-5 M/s 0,00296 – 0,0120 = - k x 400 k = 2,26x10-5 M/s 0 014 0.014 0.012 [Brr2] 0.010 0.008 0.006 0.004 0.002 0 100 200 t / seg 300 C - C 0 = −k t 400 500 tiempo / s 0 50 100 150 200 250 300 350 400 [Br2] 0,0120 0,0101 0,00846 0 00710 0,00710 0,00596 0,00500 0 00420 0,00420 0,00353 0,00296 ln n [Br2] -4 -5 -6 6 0 100 200 300 400 500 t/s Primer orden: C l ln = −k t C0 ln 0.0101 = −k × 50 0.0120 ln 0.00596 = − k × 200 0.0120 k = 3.5 × 10 −3 s −1 ln 0.00296 = − k × 400 0.0120 k = 3.5 × 10 −3 s −1 k = 3.4 × 10 −3 s −1 [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0 00710 0,00710 0,00596 0,00500 0 00420 0,00420 0,00353 0,00296 1 / [Br2] tiempo / s 400 350 300 250 200 150 100 50 0 0 100 200 300 400 500 t/s Segundo orden: 1 1 − = kt C C0 1 1 − = k × 50 0.0101 0.0120 k = 0.31 1 1 − = k × 200 0.00596 0.0120 k = 0.42 1 1 − = k × 400 0.00296 0.0120 k = 0.64 Tiempo medio de reacción. t1/ 2 1 = cte × n −1 C0 Ejemplo: En la descomposición del acetaldehido gaseoso a 528ºC se encontró que el tiempo necesario para descomponer la mitad del material era 410 s cuando la presión inicial era 363 torr y 880 s para una presión inicial de 169 torr. ¿Cuál es el orden de la reacción?. Cuánto vale la constante de velocidad? t1/ 2 1 = k C0 1 k= t1/ 2 C 0 k= 1 = 6.7 × 10 −6 torr −1s −1 410 s × 363 torr k= 1 = 6.7 × 10 −6 torr −1s −1 880 s × 169 torr t Método de las velocidades iniciales. Se determina la velocidad inicial a diferentes concentraciones iniciales de reactivo. Se determina el orden a través de la ecuación de velocidad v = k [A]m [B]n A+2B → C vinicial /Ms-1 [A]0 [B]0 5.50 x 10-6 2.20 x 10-5 1.65 x 10-5 0.10 0.20 0.10 0.10 0.10 0.30 v1 5.50 × 10 −6 M/s M/ 1 k (0.10 M ) m (0.10 M ) n = = = −5 v 2 2.20 × 10 M/s 4 k (0.20 M ) m (0.10 M ) n 1 ⎛1⎞ =⎜ ⎟ 4 ⎝2⎠ m m=2 v1 5.50 × 10 −6 M/s 1 k (0.10 M ) m (0.10 M ) n = = = −5 v 3 1.65 × 10 M/s 3 k (0.10 M ) m (0.30 M ) n 1 ⎛1⎞ =⎜ ⎟ 3 ⎝ 3⎠ n n =1 5.50 × 10 −6 Ms M -1 −4 - 2 -1 k= = 5 . 50 × 10 M s 2 (0.10 M ) × 0.10 M v = 5.50 5 50 x 10-3 M-2s-1 [A]2 [B] Mecanismos de reacción. NO + O3 → NO2 + O2 2 N2O5 → 4 NO2 + O2 NO2 + CO Æ NO + CO2 NO3: intermediario de la reacción 2 N2O Æ 2N2 + O2 Molecularidad: número de moléculas de reactivo que intervienen en un proceso elemental. Proceso unimolecular: P Proceso bi l bimolecular: l Proceso termolecular: NO + O3 → NO2 + O2 O + N2 + O2 → N2 + O3 NO(g) + O3(g) → NO2 (g)+ O2(g) d [NO] − = k [NO][O 3 ] dt O(g) + N2(g) + O2(g) → N2(g) + O3(g) d [O] − = k [O][N 2 ][O 2 ] dt O3*(g) → O(g) + O2(g) [ ] [ ] d O*3 − = k O*3 dt La molecularidad coincide con el orden de reacción del proceso elemental. Mecanismo y leyes de velocidad. 3A+2B→C+D A+B → E+F A+E → H A+F → G H+G+B → C+D 3A+2B→C+D La velocidad de una reacción que se produce en etapas está determinada por la velocidad de la etapa más lenta. 3A+2B→C+D A+B → E+F A+E → H A+F → G H+G+B → C+D 3A+2B→C+D Si la primer etapa es la más lenta, − 1 d [A] = k1[A] [B] 3 dt La velocidad de una reacción depende de: La concentración de los reactivos reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador. Efecto de la temperatura sobre la velocidad de reacción. 2 N2O5 → 4 NO2 + O2 Temp / ºC 25 45 65 −Ea / RT k = Ae k 3.46 x 10-5 4 19 x 10-44 4.19 4.87 x 10-3 E Ecuación ió d de A Arrhenius h i k = Ae − Ea / RT Ea ln k = ln A − RT Ea ⎛ 1 1 ⎞ ln = − ⎜⎜ − ⎟⎟ kT1 R ⎝ T2 T1 ⎠ kT2 Pendiente = -Ea/R Teoría de las colisiones. La velocidad de una reacción depende de: • Concentración de reactivos • Temperatura v ∝ número de colisiones / segundo A + B → productos 1/ 2 ⎛ colisiones MA + MB ⎞ 2 ⎟⎟ = σ n A nB ⎜⎜ 8πRT 3 cm × s M AM B ⎠ ⎝ 1/ 2 ⎛ colisiones MA + MB ⎞ 2 ⎟⎟ = σ n A nB ⎜⎜ 8πRT 3 cm × s M AM B ⎠ ⎝ 2 HI (g) → I2(g) + H2(g) 556 ºK, [HI] = 1 M nº moléculas que chocan entre sí = 6 x 1031 moléc/(ml s) nº moléculas que reaccionan = 2 x 1014 moléc/(ml s) es efectivo 1 choque de cada 1017. HI + Cl Æ HCl + I Reacción Sin reacción Cono de reacción Estado de transición En nergía po otencial Energía de activación, Ea Barrera de activación Reactivos Productos Progreso de la reacción Energía potencial Æ (E t d d (Estado de ttransición) i ió ) (Reactivos) (P d t ) (Productos) activa2[1].swf P Progreso de d lla reacción ió Æ Reactivos Progreso de la reacción Æ Reactivos Exxotérmica a Energ gía potencial Æ Ea (direccta) Ea (inve ersa) End dotérmica a Ea (directta) Energíía potenccial Æ Productos Ea (inversa a) Estado de transición E t d de Estado d ttransición i ió Productos Progreso de la reacción Æ velocidad de colisión ∝ T1/2 2 N2O5 → 4 NO2 + O2 Temp / ºC 3.46 x 10-5 4.19 x 10-4 4.87 x 10-3 25 45 65 1/ 2 ⎛ 318 ⎞ ⎜ ⎟ ⎝ 298 ⎠ Veloc. específica = 1.033 ⎛ 4,19 × 10 −4 ⎞ ⎜⎜ ⎟ = 12,11 −5 ⎟ ⎝ 3,46 ×10 ⎠ Fra acción de e moléculas Temperatura baja Temperatura alta Energía cinética CATÁLISIS CATALIZADORES Sustancias que cambian velocidad de una reacción Acelera: catálisis positiva Retarda: catálisis negativa CATALIZADORES •Se recuperan al final de la reacción •Bastan pequeñas cantidades •Sufren S f cambios físicos f pero no químicos Catálisis homogénea: g Catálisis heterogénea: g Bibliografía • P. P Atkins Atkins, L. L Jones, Jones Principios de Química Química. Los caminos del descubrimiento descubrimiento, 3° Edición, Buenos Aires, Editorial Médica Panamericana (2006). • B. B Mahan Mahan, Química. Química Curso Universitario, Universitario Fondo Educativo Interamericano, Interamericano USA (1977) • S. Glasstone y D. Lewis, Elementos de Química Física, 2° edición, Editorial Médico Quirúrgica Buenos Aires (1962) Quirúrgica, (1962).