Diapositiva 1 - Eureka! Zientzia Museoa
Anuncio

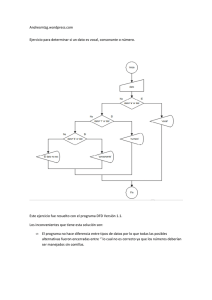
Lo cotidiano, la prensa y la historia como herramientas en el aprendizaje de la Química: Algunos ejemplos. Bernardo Herradón García Consejo Superior de Investigaciones Científicas Donostia, 1 de julio de 2010 ENSEÑANZA DE LA QUÍMICA Enseñanza formal (conceptos, memorizar, etc.). Nuestra vida cotidiana. Lo que nos rodea. Lo que ocurre a diario. Las noticias de prensa. Los hechos y anécdotas históricas. El desarrollo histórico de los conceptos. Las prácticas de laboratorio. Los métodos de la difusión de la cultura científica. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué es enseñar bien química? ¿Mucha materia? ¿Poca materia y bien aprendida? ¿Prácticas de laboratorio? ¿Horas lectivas? ¿La química en Física y Química o en Ciencias Naturales? Situación actual de las ciencias Falta de vocaciones científicas. ¿A que es debido? ¿Se percibe la utilidad de la ciencia? ¿Materias aburrida, difíciles? ¿Calidad y cantidad de los estudios en secundaria/bachilerato? ¿Reconocimiento social del científico? http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿CUÁNDO EMPIEZA LA VOCACIÓN CIENTÍFICA? ¿CUÁNDO SE DEBE EMPEZAR A FOMENTAR LA VOCACIÓN CIENTÍFICA? http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué imagen tiene un adolescente de un científico? Prácticas de laboratorio Papel del profesor de primaria, ESO y bachillerato http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ PRÁCTICAS (REALES, VIRTUALES, DEMOSTRACIONES) ¿CUANDO EMPEZAR? ¿EN PRIMARIA? Prácticas adaptadas para la edad (componente lúdico) ¿QUÉ SE PUEDE ENSEÑAR EN LAS PRÁCTICAS EN SECUNDARIA? Operaciones básicas en ciencia (masa, volumen) Conservación de la masa Mezclas (homogéneas, heterogéneas) Mezcla y sustancia química Disoluciones Cristalización Destilación Reacciones sencillas (electrolisis del agua, síntesis del nylon, uso de colorantes, etc.) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Química en Acción Importancia de las prácticas de laboratorio (incluso en el ciclo universitario, dónde son escasas, en relación con la teoría). http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.chemlabs.bris.ac.uk/outreach/ Los actores: Maestros y profesores Padres Real Sociedad Española de Química (RSEQ) Universidades Consejo Superior de Investigaciones Científicas (CSIC) Foro Química y Sociedad Profesionales de la química http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Aspectos a tener en cuenta al enseñar Química: Despertar el interés del alumno con actividades adecuadas (prácticas de laboratorio, visitas a instalaciones científicas, ferias científicas). Destacar la utilidad de la Ciencia en el progreso de la Sociedad. La Ciencia nos rodea: Noticias en los medios de comunicación Objetos cotidianos Actividades relacionadas con la Divulgación Científica (el profesor de secundaria como divulgador o como transmisor de la Divulgación). Aprovechar los recursos proporcionados por INTERNET. Aspectos históricos y biográficos de los científicos (también son personas). Colaboración con entidades (CSIC, RSEF, RSEQ). http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Papel del profesor: ideas a transmitir La creatividad de la Ciencia. La utilidad de la Ciencia (el profesor de Ciencia tiene que ser un apasionado y transmitir que su Ciencia es el motor que hace progresar nuestra Sociedad). La Ciencia es divertida. Cada día nos enfrentamos a lo desconocido, y el resultado nos permite progresar en el conocimiento. La Ciencia es la mayor obra colectiva de la historia de la humanidad. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.csic.es/web/guest/ http://www.proyectomovilab.es/ http://www.quimica2 011.es/actividades/e xposiciones/entremol%C3%A9culas http://www.quimicaysociedad.org/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Papel de la Real Sociedad Española de Química Labor docente. Asistencia al profesorado de secundaria y bachillerato. Tipos de artículos en Anales de la RSEQ y en la Revista de Física Distribución on line gratuita a profesores y alumnos. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Los Científicos y la Cultura Científica Tareas didácticas, educativas. Participación en tareas de divulgación científica. Apoyo al profesorado no universitario. Aumentar la cultura científica de los ciudadanos. Acercar la Ciencia a la Sociedad. Reivindicar el papel de la Ciencia en el beneficio de la humanidad. Estar orgullosos de ser científicos. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué es la química y para qué sirve? http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué causa todo esto? 1)Nos proporciona una vida más larga. 2) La vida es más saludable. Hace medicinas que curan nuestras enfermedades, piezas de recambio para nuestro cuerpo, palia dolores y achaques. 3) Nos suministra agua que podemos beber, usar para nuestra higiene o regar nuestras plantaciones. 4) Nos ayuda a tener más y mejores alimentos. 5) Cuida de nuestro ganado. 6) Nos proporciona energía: calor en invierno, frescor en verano, electricidad para la iluminación, nos permite circular en vehículos. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué causa todo esto? 7) Hace que nuestras ropas y sus colores sean más resistentes y atractivos; mejora nuestro aspecto con perfumes, productos de higiene y de cosmética; contribuye en la limpieza del hogar y de nuestros utensilios; ayuda a mantener frescos nuestros alimentos; y prácticamente nos proporciona todos los artículos que usamos a diario. 8) Nos permite estar a la última en tecnología: el ordenador más potente y ligero; el móvil más ligero; el sistema más moderno de iluminación, el medio de transporte adecuado; el material para batir marcas deportivos; y muchas aplicaciones más. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La respuesta: La ciencia y, especialmente, la química. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Científicos de la naturaleza Materia Energía Interacción entre la materia y la energía Geología Física Química Biología Ecología Ciencias medioambientales Toxicología Bioquímica Biología molecular Astrofísica etc…. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ ¿Qué es la Química? La Química estudia las transformaciones de la materia. Es decir, como una sustancia se convierte en otra. La materia que conocemos está formada por partículas más pequeñas: las moléculas, que están formadas por átomos. Las moléculas son los componentes básicos de la materia que nos rodea. Por lo tanto, todo es Química. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Átomo, elemento químico. Elemento químico: sustancia formada por una única clase de átomos (con el mismo número de protones en el núcleo). Toda la materia está formada por sólo 90 clases de átomos. ¿La Química empieza en los electrones? Responsable de los enlaces químicos, que es lo que hace que la materia sea estable. Enlace químico (interacción entre electrones): la interacción que mantiene a los átomos unidos en la molécula. Pero la posición de los núcleos es fundamental. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ El lenguaje de los químicos: las fórmulas y los nombres OH Hidrógeno (H) O HO HO Oxígeno (O) OH O O OH OH HO Carbono (C) OH Sacarosa: a-D-glucopiranosil(1-2)-b-D-fructofuranósido La formulación, la nomenclatura, ……. El lenguaje de la química: No hay que asustarse con ella, ni obligar a aprenderla (sólo ciertas nociones básicas) y enseñar lo importante que es conocerlo. ..... Y El sistema periódico…….. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ DIMÍTRI IVÁNOVICH MENDELÉIEV (Tobolsk, 1834 - San Petersburgo, 1907). Químico ruso, creador de la Tabla Periódica de los elementos. Su investigación principal fue la que dio origen a la enunciación de la ley periódica de los elementos base del sistema periódico que lleva su nombre. En 1869 publicó la mayor de sus obras, “Principios de Química”, donde formulaba su famosa Tabla Periódica, traducida a todas las lenguas y que fue libro de texto durante muchos años. Se considera a Mendeléiev un genio, no sólo por el ingenio que mostró para aplicar todo lo conocido y predecir lo no conocido sobre los elementos químicos, plasmándolo en su tabla periódica, sino por los numerosos trabajos realizados a lo largo de toda su vida en diversos campos científicos y tecnológicos (agricultura, ganadería, industria petroquímica, etc). Se nombró Mendelevio (Md) al elemento químico sintético de número atómico 101 en homenaje al ilustre químico ruso. El día 2 de febrero de 2007 se cumplió el centenario de su muerte. 1 1 6,941 +1 Li 9,0122 [He] 2s2 BERILIO 3 22,990 Na +1 5 Rb Cs Sr +1 [Kr] 4d15s2 ITRIO Ba +2 [Xe] 4f145d16s2 LUTECIO BARIO +1 [Rn] 7 s1 FRANCIO 119 88 (226,03) Ra Lr [Rn] 7 s2 RADIO +3 [Kr] 4d45s1 NIOBIO [Ar] CROMO 95,94 +2 +3 +4 +5 5 1 [Kr] 4d 5s +6 MOLIBDENO Mo +5 Ta [Xe] 4f145d36s2 TÁNTALO Mn 186,21 76 Re ¿? [Rn] 5f147s17p1? [Rn] 5f146d27s2? LAURENCIO RUTHERFORDIO ¿? Db [Rn] 5f146d37s2 DUBNIO Sg Bh [Rn] 5f146d47s2 SEABORGIO +3 +4 +8 ¿? [Rn] 5f146d57s2 BOHRIO [Kr] 4d85s1 RODIO +4 +6 +8 [Xe] 4f145d66s2 OSMIO +2 +3 Ni [Ar] 3d84s2 NÍQUEL +1 +2 +3 +4 26,982 14 +2 +4 [Kr] 4d10 PALADIO ¿? Hs Mt [Rn] 5f146d67s2 HASSIO [Rn] 5f146d77s2 MEITNERIO +1 +2 Au 112,41 [Kr] 4d105s2 CADMIO [Xe] 4f145d106s1 ORO Ds ¿? [Rn] 5f146d97s1 DARMSTADTIO Rg ¿? Tl 113 (285) ¿? 32,065 17 +3 +5 -3 [Kr] 4d105s25p3 ANTIMONIO 83,798 Kr 131,29 I 0 +2 +4 +6 [Kr] 4d105s25p6 +8 XENÓN (209,99) 86 +1 +3 +5 +7 10 2 [Kr] 4d 5s 5p- 51 YODO (208,98) 85 Xe +1 +3 Pb +2 +4 Bi (289) 115 (284) 114 +3 +5 Po (288) 116 ¿? +2 +4 (222,02) Rn At (289) 117 118 ¿? ¿? Uut Uuq Uup Uuh Uus Uuo [Rn]5f146d107s27p1 [Rn]5f146d107s27p2 [Rn]5f146d107s27p3 [Rn]5f146d107s27p4 [Rn]5f146d107s27p5 [Rn]5f146d107s27p6 UNUNCUADIO UNUNPENTIO UNUNHEXIO UNUNSEPTIO UNUNOCTIO UNUNTRIO [Rn]5f146d107s2 UNUNBIO 120 138,91 58 57 [Uuo] 8s2 UNBINILIO La +3 5d16s2 [Xe] LANTANO 89 Ac +1 +3 GASEOSOS SÓLIDOS LÍQUIDOS (30ºC) SINTÉTICOS +3 +4 4f15d16s2 [Xe] CERIO (227,03) 90 [Rn] 6d17s2 ACTINIO 140,12 59 Ce Th +4 +3 4f36s2 [Xe] PRASEODIMIO 232,04 91 [Rn] 6d27s2 TORIO 140,91 60 Pr Pa +3 +4 +5 [Rn] 5f26d17s2 PROTOACTINIO +3 4f46s2 [Xe] NEODIMIO 231,04 92 (144,91) 62 144,24 61 Nd +3 Pm 4f56s2 [Xe] PROMETIO 238,05 93 +3 +4 +5 +6 [Rn] 5f36d17s2 URANIO U 150,36 63 Sm 4f66s2 [Xe] SAMARIO +3 +4 +5 +6 [Rn] 5f46d17s2 NEPTUNIO NO-METAL Pu +2 +3 [Xe] EUROPIO +3 +4 +5 +6 157,25 65 +3 Gd 4f76s2 [Rn] 5f67s2 PLUTONIO GASES NOBLES 151,96 64 Eu (244,06) 95 (237,05) 94 Np +2 +3 [Xe] GADOLINIO +3 +4 +5 +6 METALES ALCALINOS +3 +3 +4 Bk SEMICONDUCTOR * Los valores entre paréntesis se refieren al isótopo más estable ** Los valores de los elementos gaseosos corresponden al líquido a temperatura de ebullición 4f106s2 [Xe] DISPROSIO (247,07) 98 [Rn] 5f97s2 BERQUELIO [Rn] 5f76d17s2 CURIO METALES ALCALINOTÉRREOS Dy [Xe] TERBIO (247,07) 97 162,50 67 +3 +3 4f96s2 Am Cm [Rn] 5f77s2 AMERICIO 158,93 66 Tb 4f75d16s2 (243,06) 96 0 2 4 [Ar] 3d104s24p6 CRIPTÓN 126,90 54 53 +4 +6 -2 [Kr] 4d105s25p4 TELURIO 208,98 84 83 +1 +3 +5 +7 10 2 5 [Ar] 3d 4s 4p - 1 BROMO 127,60 Te 0 [Ne] 3s23p6 ARGÓN Br [Ar] 3d104s24p4 SELENIO 39,948 Ar 79,904 36 35 +4 +6 -2 Se 35,453 18 Cl 78,96 34 0 [He] 2s22p6 NEÓN +1 +3 +5 +7 [Ne] 3s23p5 - 1 CLORO +2 +4 +6 -2 [Ne] 3s23p4 AZUFRE 20,180 Ne [He] 2s22p5 FLÚOR S 121,76 52 Sb 207,2 ¿? Uub [Rn]5f146d107s1 ROENTGENIO +2 +4 -1 F +1 0 +3 2 +5 +7 14 10 2 2 14 10 2 3 14 10 2 4 14 10 2 1 14 10 2 1 14 10 2 5 [Xe]4f 5d 6s 6p [Xe]4f 5d 6s 6p [Xe]4f 5d 6s 6p [Xe]4f 5d 6s 6p [Xe]4f 5d 6s 6p [Xe]4f 5d 6s 6p6 RADÓN POLONIO TALIO PLOMO BISMUTO ASTATO +1 +2 [Xe] 4f145d106s2 MERCURIO (281) 111 (272,15) 112 +3 +5 -3 [Ar] 3d104s24p3 ARSÉNICO [Kr] 4d105s25p2 ESTAÑO 204,38 82 81 74,922 As 118,71 51 Sn [Kr] 4d105s25p1 INDIO 200,59 Hg +3 In 33 +2 +4 [Ar] 3d104s24p2 GERMANIO 114,82 50 49 +2 +1 +3 Ge [Ar] 3d104s24p1 GALIO [Ne] 3s23p3 FÓSFORO 72,64 +3 Ga Cd 196,97 80 [Ne] 3s23p2 SILICIO 69,723 32 31 +2 [Ar] 3d104s2 CINC [Kr] 4d105s1 PLATA Pt 65,409 Zn 107,87 48 Ag 195,08 79 +1 +2 +2 +4 +3 +4 14 9 1 +6 14 7 2 [Xe] 4f 5d 6s [Xe] 4f 5d 6s IRIDIO PLATINO Ir Cu 106,42 47 192,22 78 +1 +2 [Ne] 3s23p1 ALUMINIO +3 +5 -3 P 0 1s2 HELIO 18,998 10 -1 -2 [He] 2s22p4 OXÍGENO 30,974 16 15 +2 +4 -4 Si O He 17 15,999 9 N 28,086 +3 16 14,007 8 +2 +3 +4 +5 [He] 2s22p3 - 2 NITRÓGENO- 3 +2 +4 -4 [He] 2s22p2 CARBONO Al 12 63,546 30 [Ar] 3d104s1 COBRE Pd (277) 109 (268,14) 110 ¿? 11 58,693 29 102,91 46 Rh 190,23 77 Os +2 +3 [Ar] 3d74s2 COBALTO 101,07 45 Ru 10 58,933 28 15 12,011 7 C [He] 2s22p1 BORO Co [Ar] 3d64s2 HIERRO [Kr] 4d75s1 RUTENIO [Kr] 4d65s2 TECNECIO +2 +4 +3 +6 +4 +7 +5 14 5 +6 14 4 2 [Xe] 4f 5d 6s2 [Xe] 4f 5d 6s WOLFRAMIO RENIO W Fe +4 +6 +7 Tc +2 +3 +6 6 +3 B 9 55,845 27 98,907 44 43 183,84 75 180,95 74 +2 +3 +4 +6 +7 (262,11) 105 (262,11) 106 (266,12) 107 (264,12) 108 Rf Uue Ubn [Uuo] 8s1 UNUNENIO +4 [Xe] 4f145d26s2 HAFNIO 103 (262,11) 104 +2 Nb +3 +5 8 54,938 26 [Ar] 3d54s2 MANGANESO 3d54s1 92,906 42 +4 +2 +3 +6 14 18,811 13 7 51,996 25 Cr [Ar] 3d34s VANADIO 178,49 73 Hf +2 +3 +4 +5 2 V [Kr] 4d25s2 CIRCONIO +3 Lu [Xe] 6 s2 (223,02) Zr 6 50,942 24 91,224 41 174,97 72 71 +2 +3 +4 [Ar] 3d24s2 TITANIO +3 Y 137,33 56 Ti 88,906 40 39 +2 5 47,867 23 +3 [Ar] 3d14s2 ESCANDIO [Kr] 5 s2 ESTRONCIO [Xe] 6 s1 CESIO Fr Sc 87,62 38 4 44,956 22 21 +2 CALCIO 132,91 87 Ca +1 [Kr] 5s1 RUBIDIO 6 40,078 [Ar] 4 s2 85,468 55 20 +1 [Ar] 4 s1 POTASIO 37 3 MAGNESIO 39,098 K Mg 5 Estructura electrónica ** +2 13 * Estados de oxidación [He] 2s22p2 CARBONO Nombre 24,305 [Ne] 3s2 [Ne] 3s1 SODIO 19 12 +2 +4 -4 C Símbolo Masa atómica 12,011 6 Nº atómico +2 Be [He] 2s1 LITIO 11 8 4 4,0026 2 TABLA PERIÓDICA DE LOS ELEMENTOS 2 1s1 HIDRÓGENO 2 7 +1 -1 H 3 4 18 1,0079 1 164,93 68 +3 Ho 4f116s2 [Xe] HOLMIO (251,08) 99 167,26 69 Er +3 4f126s2 [Xe] ERBIO 168,93 70 Tm +3 4f136s2 [Xe] TULIO +3 +3 [Rn] 5f127s2 FERMIO [Rn] 5f137s2 MENDELEVIO METALES DE LANTÁNIDOS TRANSICIÓN ACTÍNIDOS +3 +3 4f146s2 [Xe] ITERBIO (252,08) 100 (257,10) 101 (258,10) 102 (259,10) [Rn] 5f117s2 EINSTENIO Cf [Rn] 5f107s2 CALIFORNIO 173,04 Yb +3 Es Fm Md +3 No [Rn] 5f147s2 NOBELIO El sistema periódico: No se debe aprender Se debe enseñar según se enseña química Se debe captar la inmensa información que hay en él Una de las mayores aportaciones de la química a la historia de la cultura universal Se debe amar http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Otras “visiones” sobre la Química LA QUÍMICA CREA SU PROPIO OBJETO Papel de la síntesis química (capacidad de obtener sustancias químicas): Sustancias naturales (productos naturales) Sustancias no-naturales (interés teórico o práctico) con mejores propiedades que las naturales Otras “visiones” sobre la Química LA QUÍMICA: LA CIENCIA CENTRAL, ÚTIL Y CREATIVA http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Química y su relación con otras Ciencias Ciencia de los alimentos Toxicología Ciencias Medioambientales Geología Ciencias de la tierra Astrofísica QUÍMICA Agricultura Veterinaria Matemáticas Bioquímica Biología molecular Biología Biomedicina Medicina Física Ciencias de los materiales Nanociencias Nanotecnología Ingeniería Otras “visiones” sobre la Química LA QUÍMICA, ENTRE LA FÍSICA Y LA BIOLOGÍA BIOLOGÍA QUÍMICA ¿Qué significa? Objeto de estudio Métodos de estudio Aproximación científica Aspectos filosóficos FÍSICA La Química del futuro Energía Aspectos sociales Medio ambiente Nuevos compuestos químicos para nuevos retos Salud Electrónica Alimentación http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Dependeremos de procesos y materiales (formados por moléculas) adecuados LA QUÍMICA Y LOS MATERIALES DEL “FUTURO” Aplicaciones tecnológicas Biomédicas http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Química entre la Biomedicina y la Ciencia de los Materiales BIOLOGÍA BIOMEDICINA Medicina Biología humana Biología del organismo Fisiología Inmunología Neurociencia Endocrinología Bioquímica Biología celular Biología molecular Química Materiales Física Matemáticas FÍSICA QUÍMICA MATERIALES Química Física Nanociencia Nanotecnología Ingeniería Matemáticas Otras “visiones” sobre la Química LA QUÍMICA, LA CIENCIA DE LO COTIDIANO Podemos verdaderamente decir que el alcance de la Química y sus aplicaciones son interminables (Leo H. Baekeland, 1932) Beneficios de la Química para el ser humano Vida más larga. Vida más saludable (curamos enfermedades, hacemos biomateriales, paliamos dolores y achaques). Potabilización de agua. Mejores alimentos. Fertilizantes, abonos, protectores de cosechas, cuidado del ganado. Producción de energía: carbón, petróleo, hidrógeno. Nuestra vida cotidiana: higiene, limpieza, cosméticos, ocio, deporte, seguridad, vestidos , tintes, ….. Alta tecnología: electrónica, ordenadores, nanomateriales,….. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ LA ENSEÑANZA DE LA QUÍMICA Dar mucha materia o dar poca Que aprendan bien los conceptos fundamentales Aplicaciones en la vida cotidiana La vida cotidiana nos permite explicar conceptos de química Mucha experimentación http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Los conceptos fundamentales de la Química La materia consiste de alrededor de 100 elementos. Los elementos se componen de átomos. La estructura orbitálica de los átomos (dónde están los electrones) explica la periodicidad de sus propiedades. Los enlaces químicos se forman cuando los electrones se emparejan. La forma es fundamental para la función. Si quieres estudiar la función, estudia la estructura. Las moléculas se atraen y repelen entre sí. La energía es ciega a su modo de almacenaje. Las reacciones son de un número pequeño de tipos. Las velocidades de reacción se describen por las leyes (cinéticas). Atkins, Chemistry, The Great Ideas. Pure Appl. Chem. 1999, 71, 927 INTERNET Y EL ORDENADOR COMO HERRAMIENTA Forma (estructura) de las moléculas Los átomos dentro de las moléculas La posición de los núcleos atómicos La orientación de los átomos Los enlaces Los electrones en las moléculas Las propiedades geométricas (longitudes, ángulos, ángulos dihedros). http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ H2O PBB-77 Las vibraciones moleculares Espectro IR de las moléculas (vibraciones) Aplicaciones en astrofísica La Química y la Astrofísica http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Propiedades del agua • Dos propiedades moleculares del agua: - el momento dipolar de la molécula de agua - la capacidad para establecer enlaces de hidrógeno intermoleculares Momento dipolar: 1‟85 D Cte dieléctrica relativa: 80 http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Ángel Herráez (Universidad de Alcalá) http://biomodel.uah.es/agua/index.htm http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Estructura del DNA Aspectos estructurales de la molécula de ADN En los seres vivos está constituida por dos cadenas antiparalelas, formando la conocida “doble hélice” Interacciones por enlaces de = hidrogeno por pares A=T y C=G Estados físicos de la materia Gaseoso Líquido Sólido (amorfo o cristalino) Gas Líquido Sólido El estado físico depende de la estructura molecular y de las interacciones entre moléculas (interacciones intermoleculares). Implicación en las propiedades físicas y tecnológicas. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Estado físico: dependiente de las interacciones entre moléculas. Carbono (C) CARBÓN ACTIVO (C) Diamante Grafito http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Diseño de compuestos con propiedades tecnológicas. Ingeniería cristalina. NC CN S NC CN S TCNQ S Propiedades electrónicas S TTF Alves et al. Nature Materials, 2008 http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ El papel de la historia (desarrollo histórico de los conceptos de Química). Las noticias que interesan: salud, medio ambiente, energía, tecnología, deporte. La ciencia detrás de la noticia: Un químico lee el periódico. 1895-1930: La revolución científica. La estructura del átomo. Aplicaciones beneficiosas de la radioactividad. Detectores de humo. Radiodiagnóstico en medicina. Noticias de energía. Conceptos básicos de termodinámica. La revolución industrial y el papel de la ciencia. Los protagonistas. El concepto de molécula. Noticias de Astrofísica. Propiedades atómicas y moleculares. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Noticias de medio ambiente. La concentración. Sentido de la vista, interacción de la luz con la materia (absorción y emisión de luz), colorantes (sus tipos, sus utilidades), historia de la química (colorantes de la antigüedad, Perkin, von Baeyer, la industria química en la actualidad). Fotosíntesis. Su relevancia en nuestra vida cotidiana. Centros fotosintéticos artificiales. Lo natural y lo sintético. Siglo XX: El siglo de los plásticos. El coche. Materiales, energía, reactividad. Catálisis. Producción de amoniaco. Fertilizantes. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La química y la producción de alimentos. Purificación y potabilización de agua. La química y la salud: Medicamentos y biomateriales. La industria química. Desarrollos industriales mediambientalmente convenientes (química verde y química sostenible). http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ 2011: Un año de conmemoraciones químicas. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Celebrando el papel de la mujer en la Ciencia Centenario del Premio Nobel de Química a Marie Curie 200º Aniversario de la hipótesis de Avogadro 350º Aniversario de la publicación de „El Químico Escéptico‟ (Robert Boyle) Boyle y su escuela El futuro Avogadro y su tiempo Curie y la ciencia moderna 1661-1911: 250 años que cambiaron el mundo (gracias a la ciencia) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La química antes de Boyle La oscura edad media: los alquimistas. Procedimientos experimentales. Paracelso (1493-1541): aplicaciones de la alquimia a la medicina (iatroquímica). http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Las ciencias (la física y las matemáticas) en el siglo XVII La época dorada. Nacimiento de la Física Galileo (1564-1642) Método científico Patriarca de la Física Las matemáticas son el alfabeto con el cual Dios ha escrito el Universo. Otras aportaciones: Newton (1643-1727) Padre de la Física La química en el siglo XVII: dominada por la alquimia Alquimista. Primer intento de reducir la química a la física. Sin éxito Boyle (1627-1691) y su escuela Hooke (1635-1703), Mayow (1641-1679) Boyle y su escuela Creación de un grupo de investigación (Hooke, Mayow) Aplicación del método científico Experimentos cuidadosos Perfeccionamiento de equipo de laboratorio Trabajo con gases Ley de Boyle (PV = cte) Concepto de elemento químico Especulaciones sobre la estructura de la materia Concepto de compuesto químico Fundación de la Royal Society 350º Aniversario de la publicación de „El Químico Escéptico‟ (Robert Boyle) La química del siglo XVIII Teoría del Flogisto: Un siglo de retraso conceptual Black (1728-1799) Priestley (1733-1804) Becher (1635-1682) Stahl (1659-1734) Cavendish (1731-1810) Scheele (1742-1786) El nacimiento de la química como ciencia moderna Lavoisier (1743-1794) Rigor en las medidas Identificación del papel del oxígeno Nomenclatura Sistematización de los conceptos químicos Ley de la conservación de la masa El nacimiento de la química como ciencia moderna Dalton (1766-1844) Proust (1754-1826) Ley de las proporciones Ley de las proporciones múltiples definidas Teoría atómica Berzelius (1779-1848) Gay-Lussac (1754Richter (1762-1807) Composición 1850) Ley de las proporciones Ley de las volúmenez Sistematización equivalentes definidas nomenclatura. El nacimiento de la química como ciencia moderna 1811. Hipótesis de Avogrado. Volúmenes iguales de todos los gases, a la misma presión y temperatura, contienen el mismo número de moléculas. 1860 Avogadro (1776-1856) Kekulé (1829-1896) Cannizzaro (1826-1910) El desarrollo de la Termodinámica: La interacción entre la física (los físicos) y la química (los químicos). Joule Mayer Carnot Clausius (1818-1889) (1814-1878) (1796-1832) (1822-1888) Kelvin Maxwell Boltzmann (1824-1907) (1831-1879) (1844-1906) Los principios (leyes) de la termodinámica: Cero: Definición de temperatura. Primero: Conservación de la energía. Segundo: Imposibilidad de usar toda la energía (aumento de la entropía). Tercero: La entropía de un sólido perfecto a 0 K es 0. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ El desarrollo de la Termodinámica: La interacción entre la física (los físicos) y la química (los químicos). Para los físicos de mediados del siglo XIX, la existencia de moléculas era evidente; algunos químicos dudaron de su existencia hasta el siglo XX. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ El nacimiento de la química como ciencia moderna Mendeleev (1834-1907) 1869 Número de Avogadro: número de moléculas en un mol de sustancia. Perrin (1870-1942) 200º Aniversario de la hipótesis de Avogadro La ciencia a finales del siglo XIX Gravitación Electromagnetismo Teoría cinética de los gases Ecuaciones de la termodinámica Leyes de la óptica (naturaleza de la luz) There is nothing new to be discovered in physics now, All that remains is more and more precise measurement. Lord Kelvin (finales del siglo XIX) Sólo quedaban por explicar unos „pocos‟ fenómenos naturales Radiación del cuerpo negro Espectros de los elementos químicos Efecto fotoeléctrico Descubrimiento del electrón Rayos X Radiactividad Efecto Compton Movimiento Browniano Estructura del átomo (experimentos de Rutherford) Interacciones de la materia y la energía Centenario del Premio Nobel de Química a Marie Curie Aplicaciones de la radiactividad. Detectores de humo. Sintetizado en 1944 por Seaborg (Premio Nobel de Química, 1951) 241 Am 95 237 Np 93 + 4 2 He2+ Las partículas a- no pueden escapar del detector. No atraviesan la materia sólida. Vida media del Am-241: 432 años. Se desintegran 33000 núcleos de Am241 por segundo. Un microgramo de Am-241 por detector. Los fundamentos de la Química: la mecánica cuántica aplicada a la Química (Química cuántica) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Ciencia en la vida cotidiana: la energía http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Química física influye en los avances de la Sociedad Termodinámica Utilización de las formas de energía: calor, electricidad, mecánica. Fuentes de energía: química, solar, eólica, solar, nuclear, mecánica, mareas, etc… Desarrollo de la Termodinámica: máquina de vapor. La fuente de energía es el carbón (energía química). Newcomen (1711) Watt (1774) Los padres de la Termodinámica Joule Mayer Carnot Clausius (1818-1889) (1814-1878) (1796-1832) (1822-1888) Kelvin Maxwell Boltzmann (1824-1907) (1831-1879) (1844-1906) Los principios de la termodinámica: Primero: Conservación de la energía. Segundo: Imposibilidad de usar toda la energía (aumento de la entropía). Tercero: La entropía de un sólido perfecto a 0 K es 0. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Fuentes y formas de energía en las que interviene la Química: Carbón Petróleo Gas natural Uranio Materiales electroactivos (baterías) “Formas” de energía: Química Eléctrica Calor Lumínica Hay que avanzar en la eficiencia energética http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.quimica2011.es/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Petróleo y sus derivados Recursos limitados Medioambientalmente perniciosa Quemamos materias primas valiosas para producir bienes de consumo NO HAY FUTURO PARA LA ENERGÍA BASADA EN QUEMAR MASIVAMENTE COMBUSTIBLES FÓSILES http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Aprender Química con lo cotidiano http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La química de cada día http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Primera hora: nos despertamos, desayuno Componentes químicos del café Extracción de sólidos ¿Más de 200 compuestos químicos? 99‟3% de agua 0‟04% de cafeína 0‟12 % de proteínas 0‟02% de grasas Vitaminas Sales metálicas Alimentos: mezclas de compuestos químicos (naturales y artificiales) Alimento Todo producto no venenoso, comestible o bebible que consta de componentes que pueden ingerirse, absorberse y utilizarse por el organismo para su mantenimiento y desarrollo. Composición química Hidratos de carbono o sus constituyentes. Grasas o sus constituyentes. Proteínas o sus constituyentes. Vitaminas o precursores con los que el organismo puede elaborarlas. Sales minerales. Agua. Todo lo que comemos es una mezcla de compuestos químicos http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.quimica2011.es/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ PRODUCCIÓN DE ALIMENTOS No hay problemas de producción de alimentos en el mundo. El problema es de distribución. Pronóstico de Malthus (1766-1834): la población humana desaparecerá por falta de alimentos (durante el siglo XIX). Pronóstico equivocado. Campos son mucho más productivos: fertilizantes/abonos, pesticidas, protectores de cosechas, aditivos para cosechas, etc. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ EL PAPEL DE LA QUÍMICA EN LA PRODUCCIÓN DE ALIMENTOS Premio Nobel de Química, 1918 N2 (g) + 3 H2 (g) 2 NH3 (g) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ PROCESOS QUÍMICOS CATALÍTICOS PRODUCCIÓN INDUSTRIAL DE AMONIACO. APLICACIÓN A LA PREPARACIÓN DE ABONOS NITROGENADOS. N2 (g) + 3 H2 (g) 2 NH3 (g) Alta presión (200 atmósferas), temperatura moderada (400-500 ºC) Presencia de un catalizador (sales de Fe3+). Aplicación de las leyes del equilibrio químico (principio de Le Chatelier). Cinética química. Catálisis. Reactivos Productos Velocidad = k x f(concentración) Ecuación de Arrhenius Ea es la energía de activación Un catalizador es una especie química que no se consume durante la reacción y que disminuye la energía de activación (aumentando k). No afecta a la constante de equilibrio. Cinética química. Catálisis. Reactivos Productos Velocidad = k x f(concentración) Un catalizador es una especie química que no se consume durante la reacción y que disminuye la energía de activación (aumentando k). PROCESOS QUÍMICOS CATALÍTICOS CATALIZADORES DE LOS COCHES La combustión incompleta genera hidrocarburos, monóxido de carbono (CO) y óxidos de nitrógeno (NO y NO2). El papel del catalizador es acelerar las reacciones de oxidación de los hidrocarburos y el CO y de reducción del NO y el NO2. Metales catalizadores http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.quimica2011.es/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Reacciones químicas: airbag NaN3 Na + 3/2 N2 http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Ciencia detrás de la noticia ¿Se puede explicar la Física y la Química leyendo las noticias? http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ La Química (Ciencia) y los medios de comunicación ¿Papel del científico en la generación de noticias? Papel del periodista. Revistas de divulgación científica. Siempre es bueno que se hable de Ciencia. Necesidad de que haya programas de divulgación científica en radio y TV y que los periódicos tengan secciones fijas de Ciencia. http://www.elpais.com/suple/futuro/ http://www.elmundo.es/elmundo/ciencia.html http://www.publico.es/ciencias http://www.heraldo.es/index.php/mod.noticias/mem.detalle/idnoticia.35465 ¿Qué noticias de Ciencia nos interesan? Nuestra salud: Cáncer. Alzheimer y otras enferemedades degenerativas (Parkinson, vacas locas, etc…). Enfermedades metabólicas (diabetes, hipertensión, arterioesclerosis, etc…). Malaria. Gripe A y cualquier otra amenaza. Energía. Medio ambiente. Alimentación. Deportes ¿Nos preocupamos de la Ciencia que hay detrás de la noticia? ¿Son aprovechables las noticias para la docencia? Medio ambiente, dopaje, salud, toxicidad http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ 50 nanogramos/mL ó 0‟00000000005 gramos/litro CLEMBUTEROL Paracelso (1493-1541) Todas las cosas son venenosas y nada es inócuo. Únicamente la dosis determina lo que no es un veneno. La concentración es un concepto fundamental en Química ¿Cómo se proporcionan los datos de sustancias química en un medio? La actividad biológica debe expresarse de manera adecuada (actividad biológica por mol de sustancia) Si se habla de moléculas, siempre sale un valor muy alto, pues las moléculas son muy pequeñas y pesan muy poco. La concentración se expresa en moles. Un mol es un número de Avogadro de partículas. Numero de Avogadro: aproximadamente 600.000.000.000.000.000.000.000 (un mol), que son las moléculas que hay en 18 gramos de agua o en 277 gramos de clembuterol. La concentración de clembuterol en la muestra de Contador es 0‟00000000018 molar; es decir, 100.000.000.000.000 moléculas por litro. Contaminación química Concentración: 0‟1 ng/l (3‟33 x 10-13 M) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ HAY QUE TENER VOCACIÓN PARA DEDICARSE A LA INVESTIGACIÓN Y ESTAR DISPUESTO A SEGUIR UNA CARRERA CREATIVA. LA CARRERA CIENTÍFICA ES MUY DIVERTIDA. CADA DÍA NOS ENFRENTAMOS A LO DESCONOCIDO. VAMOS PROGRESANDO EN EL CONOCIMIENTO. http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ III CURSO DE DIVULGACIÓN “LOS AVANCES DE LA QUÍMICA Y SU IMPACTO EN LA SOCIEDAD” A partir de marzo de 2012 http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/ Química, nuestra vida, Nuestro futuro Marie Curie Premio Nobel (1903, 1911) http://www.losavancesdelaquimica.com/ http://www.madrimasd.org/blogs/quimicaysociedad/ http://educacionquimica.wordpress.com/