Asimetria - WordPress.com
Anuncio

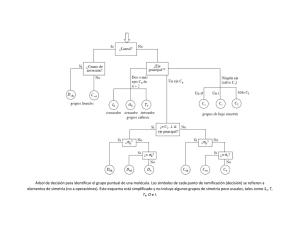
Grupo # 5 200911024 – Claudia Flores 200921127 – Christian Castro 200923657 – Luis López ASIMETRÍA! MOLECULAR En las moléculas orgánicas, la presencia de asimetría es causada en la mayoría de los casos por la existencia de uno o más “carbonos asimétricos” Esto sucede cuando las cuatro valencias de un carbono con hibridación sp3, orientadas hacia las esquinas de un tetraedro, se encuentran unidas a grupos químicos diferentes, perdiéndose así todo elemento de simetría. § En química explica la teoría de partículas elementales, un compuesto químico se identifica determinando su estructura. La mayoría de los métodos para determinar estructuras son métodos espectroscópicos, y la base de estos métodos es la simetría. § La simetría molecular es aquella simetría que presentan los átomos de una molécula en su estado de equilibrio el cual será el más estable. § La simetría se define en términos de operaciones y elementos de simetría. § Las operaciones de simetría son operadores que transforman la posición de un cuerpo en el espacio tridimensional, en una posición de simetría se desplaza una molécula en torno a un elemento de simetría a otra posición indistinguible a la original, dicho elemento de simetría puede ser un plano, un eje o un centro. § Un factor importante es el estado energético en el cual se encuentra la molécula, si la molécula se encuentra en estado excitado la simetría que presentará será diferente a la que podría presentar en un estado de equilibrio. § Los elementos más sencillos de simetría son: El centro, el eje y el plano de simetría. La simetría en la química sirve para: § Predecir ciertas propiedades que tiene la molécula tales como su quiralidad, su actividad óptica, su estructura y su momento dipolar. § Para predecir la interacción que sufre la molécula con respecto a una onda electromagnética, esto es muy importante para espectroscopia infrarroja. § Para describir los orbitales responsables en los enlaces de la molécula. Operación de simetría § Rotación propia: el elemento de simetría que le corresponde esta operación es al eje de rotación, el cual es la línea en la cual se da la rotación. § Reflexión: el elemento que le corresponde esta operación es el plano de simetría. § Inversión: el elemento de simetría es el centro de inversión. § Rotación impropia: el elemento de simetría es un eje de rotación reflexión, en esta operación de primero hay una rotación de 360º y después habrá una reflexión en un plano perpendicular al eje de rotación. Cada molécula contiene un conjunto de elementos de simetría que dan como resultado un conjunto de operaciones simetría, este conjunto describe la simetría completa de la molécula y se denomina grupo puntual de simetría. Los principales grupos puntuales son: § Alta simetría § Baja simetría § Lineales Una molécula que posee un carbono asimétrico existe en dos formas que no pueden superponerse, correspondiendo una de ellas a la imagen especular de la otra, tal como sucede con la mano derecha respecto a la izquierda. Ambas moléculas desviarán el plano de vibración de la luz polarizada en igual magnitud, pero mientras una es levógira, su imagen especular será dextrógira. La acción de una molécula sobre el plano de vibración de la luz polarizada se explica de la siguiente manera: Los campos electro-magnéticos provocados por los electrones de los grupos atómicos en una molécula, al recibir ésta un rayo de luz polarizada, desvían el plano de vibración. Si la molécula es simétrica, el efecto resultante es cero, no observándose cambios en el plano de vibración. Si la molécula es asimétrica, el efecto producido por un átomo o grupo no será compensado por el otro idéntico ubicado en posición simétrica (que producirá el efecto opuesto), y el resultado es una rotación del plano de vibración. Un ejemplo simple de asimetría molecular con un carbono asimétrico lo encontramos en el ácido láctico que existe en dos formas, el ácido dextro-láctico y el ácido levo-láctico. Estos isómeros son imágenes especulares, como puede verse mejor en las fórmulas de perspectiva, donde el carbono asimétrico ha sido colocado en el centro del tetraedro. Una solución que contiene cantidades iguales de las formas “dextro” y “levo” de una sustancia de denomina solución racémica o racemo. Esta solución carece de actividad óptica, pues el efecto dextrorrotatorio causado por un tipo de moléculas es neutralizado totalmente por las moléculas levorrotatorias de composición idéntica y diferenciadas sólo por la posición espacial de sus grupos químicos que desvían el plano de vibración en el sentido opuesto y en igual grado. Por esta razón se dice que esta solución es ópticamente inactiva por compensación externa. Los dos isómeros componentes del racemo, que son imágenes especulares o antípodas) reciben el nombre de “enantiomorfos o enantiómeros”. Si una sustancia tiene varios carbonos asimétricos, la desviación de la luz polarizada será la resultante del efecto causado por cada uno de ellos. Cuando existe un carbono asimétrico sólo hay dos formas ópticamente activas: dextro y levo. Al existir dos carbonos asimétricos, cada uno de los cuales puede tomar la disposición dextro o levo, existirán cuatro formas ópticamente activas. Por cada carbono asimétrico que se agregue, se duplicará el número de formas activas. El número total de formas activas de una molécula dada será entonces igual a 2n, en que n es el número de carbonos asimétricos presentes en ella. GRACIAS