reviSión Imagen por susceptibilidad magnética por RM en la
Anuncio

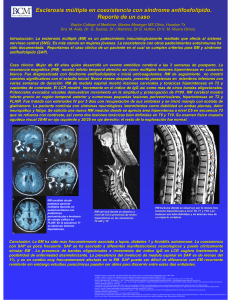
Imagen por susceptibilidad magnética por RM en la esclerosis múltiple Álex Rovira Unidad de Resonancia Magnética (IDI). Servicio de Radiología. Hospital Universitari Vall d’Hebron. Barcelona. RESUMEN. La imagen de susceptibilidad magnética (SWI) es una técnica relativamente reciente de RM que basa su contraste tisular en las diferencias en las propiedades magnéticas existentes en los tejidos biológicos. En este artículo se revisan los resultados de la utilización de las secuencias SWI en pacientes con esclerosis múltiple, donde esta técnica ha abierto nuevas posibilidades en el análisis del componente neurodegenerativo de la enfermedad. Palabras clave: esclerosis múltiple, resonancia magnética, imagen por susceptibilidad magnética. ABSTRACT. Susceptibility weighted imaging (SWI) is a relatively novel MR imaging technique, based on the differences in the magnetic properties existing in biological tissues. This article reviews the results of the use of SWI sequences in multiple sclerosis, where this technique has opened new possibilities for assessing the neurodegenerative component of the disease. Key words: multiple sclerosis, magnetic resonance, susceptibility weighted imaging. L a imagen por susceptibilidad magnética (SWI) es una técnica de RM, diseñada por Haacke en 20041, que obtiene contraste de forma diferente al de las secuencias clásicas, en las que éste se obtiene a partir de diferencias en los tiempos de relajación longitudinal (T1) o transversal (T2). La SWI obtiene el contraste a partir de las diferencias en la susceptibilidad magnética (SM) de determinados elementos o compuestos contenidos en los tejidos orgánicos2, los cuales inducen variaciones en la fase de la magnetización transversal. Estas variaciones no dependen de las características en la relajación intrínseca de los tejidos, sino de las variaciones locales de la frecuencia de precesión de los núcleos de hidrógeno, y se escalan con la potencia del campo magnético3. Los cuerpos materiales contienen cargas eléctricas en continuo movimiento (por ejemplo: electrones girando en sus órbitas). En consecuencia, cuando están sometidos a un campo magnético, poseen propiedades magnéticas y, por tanto, comportamientos que dependen básicamente de su composición electrónica. Estos comportamientos se cuantifican mediante la SM, que es una medida de la tendencia a magnetizarse de un material cuando se coloca bajo el efecto de un campo magnético externo. Los materiales se pueden clasificar según el valor de su SM en dos grupos principales: los paramagnéticos y los diamagnéticos4. Los cuerpos con valores de SM < 0 se llaman “diamagnéticos” y se conocen en general como “no magnéticos”. En su interior el campo magnético tiende a ser menor que el del campo magnético externo al que está sometido. Los tejidos biológicos son ge- neralmente diamagnéticos, si bien poseen distintos valores de SM. Esto origina que en las interfases entre tejidos biológicos con diferente SM se originen variaciones locales del valor del campo magnético conocidos como gradientes de susceptibilidad, que causan artefactos que distorsionan las imágenes obtenidas. Los elementos o compuestos con valores de SM > 0 se llaman “paramagnéticos” e inducen incrementos locales del campo magnético. Los elementos de la tabla periódica clasificados en el grupo de las tierras raras, como el “Gadolinio” o el “Dysprosium”, se encuentran entre las sustancias de mayor paramagnetismo por poseer múltiples electrones no apareados. Este elevado paramagnetismo influye en la relajación de los núcleos de 1H que se encuentran en su cercanía, por lo que pueden ser utilizados como medios externos de contraste en RM. Dentro de las sustancias paramagnéticas se encuentran las “ferromagnéticas” (hierro), que se caracterizan por tener un valor de SM muy elevado, y que entran en sincronía cuando se someten al efecto de un campo magnético externo. Correspondencia: Álex Rovira – Unidad de Resonancia Magnética (IDI) – Servicio de Radiología – Hospital Universitari Vall d’Hebron Universidad Autónoma de Barcelona – Passeig Vall d’Hebron, 119-129 – 08035 Barcelona – E-mail: [email protected] Revisión ❑❑Características de las secuencias SWI Las secuencias de SWI se obtienen combinando la información proveniente tanto de las imágenes de magnitud como de fase, maximizando estas últimas las diferencias en el valor de SM de los vóxeles contenidos en la imagen. De esta forma, sustancias con propiedades paramagnéticas por su contenido en hierro, como la deoxihemoglobina, la hemosiderina REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 5 Revisión 13 Figura 1 Imágenes obtenidas con la secuencia de susceptibilidad magnética (SWI). De forma estandarizada se obtienen cuatro tipos de imágenes: magnitud, fase, SWI, y venográfica. Esta última se obtiene a partir de una proyección de mínima intensidad de las imágenes SWI que permite visualizar la conectividad de las estructuras venosas. 6 y la ferritina, y que se caracterizan por tener valores de SM >0, producen un desplazamiento positivo en las imágenes de fase, lo que permite diferenciarlas de sustancias con propiedades diamagnéticas o “no magnéticas”5. Las imágenes de SWI se obtienen a partir de secuencias en eco de gradiente tridimensionales de alta resolución ponderadas en T2* con compensación de flujo en los tres ejes del espacio y con tiempos de eco relativamente largos cuyo valor dependerá del campo magnético utilizado (40 ms en campos de 1.5T; 25 ms en campos de 3T)3, 6. A diferencia de una secuencia convencional ponderada en T2* (que también potencia las diferencias en SM al no corregir las incoherencias en la relajación transversal), las secuencias de SWI utilizan la información de la máscara de contraste de fases, que tras ser filtrada para eliminar artefactos de fase no deseados como son los secundarios a las interfases entre tejidos biológicos con diferente SM (interfases entre tejido óseo y cerebral) y las imperfecciones en la homogeneidad del campo magnético, se multiplica a la máscara de magnitud con el objeto de magnificar los efectos de SM. Ello permite incrementar la conspicuidad de las venas cerebrales (elevada concentración en deoxihemoglobina) y de tejidos con presencia de hierro, tanto de origen hemático como no hemático, que aparecen hipointensos en las imágenes de SWI. Debido a que la escala utilizada en las imágenes SWI es arbitraria, esta técnica no puede considerarse un auténtico método para cuantificar la concentración tisular de hierro. Sin embargo, recientemente se han desarrollado técnicas que permiten realizar análisis cuantitativos de las imágenes SWI (QSM, quantitative susceptibility mapping) que si bien tiene una cierta complejidad en su obtención, han demostrado una gran sensibilidad en la detección de hierro tisular3, 7. Con frecuencia a las imágenes de SWI se les aplica un programa de reconstrucción que crea proyecciones de mínima intensidad (mIP) que facilita REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 la visualización de la conectividad de las estructuras venosas (venografía por RM). De esta forma, un estudio completo de SWI incluye las imágenes de magnitud, las imágenes de fase filtradas, las imágenes propiamente de SWI y la reconstrucción mIP o imágenes venográficas (Figura 1). La mayor sensibilidad de las secuencias SWI en comparación con las secuencias en eco de gradiente ponderadas en T2* (habitualmente utilizadas para identificar calcificaciones o hemorragias) se fundamenta en la información obtenidas con las imágenes de fase. Estas imágenes, y la información que de ellas se deriva, suelen ser ignoradas en los estudios clínicos de RM, con excepción de determinadas secuencias angiográficas (angiografía por contraste de fases) o que analizan la dinámica del líquido cefalorraquídeo, en las que permiten obtener información sobre la direccionalidad de tejidos con movimiento macroscópico (sangre circulante, líquido cefalorraquídeo) gracias a los cambios en la fase de los protones inducidos por el mismo (Figura 2). Con el desarrollo en los últimos años de técnicas de adquisición en paralelo, y la utilización de equipos de 3T, es posible en la actualidad obtener secuencias SWI con tiempos de adquisición aceptables (4-5 minutos), de alta resolución y con cobertura cerebral completa8. Ello ha facilitado la implementación de esta secuencia en estudios experimentales y clínicos de RM en diferentes procesos que afectan el sistema nervioso central, como son los traumatismos cerebrales, las enfermedades cerebrovasculares, los procesos tumorales y las enfermedades neurodegenerativas9. En la esclerosis múltiple las secuencias SWI se han utilizado para analizar por un lado la presencia de depósitos de hierro, tanto en la sustancia gris subcortical como en las lesiones visibles en secuencias T2, y por otro la visibilidad o grosor de las venas medulares de los hemisferios cerebrales y su relación topográfica con las lesiones desmielinizantes focales. Álex Rovira ❑❑Visibilidad de las venas cerebrales Las lesiones de EM visibles en las secuencias ponderadas en T2 muestran una clara tendencia a localizarse en la sustancia blanca periventricular de los hemisferios cerebrales, donde es frecuente que exista al menos una lesión de morfología ovoidea con su eje mayor perpendicular al eje antero-posterior de los hemisferios cerebrales10. Esta característica morfo-topográfica se explica por la predisposición de las placas desmielinizantes a situarse alrededor de las vénulas, que en la sustancia blanca que rodea los ventrículos laterales tienen un trayecto perpendicular a las paredes ependimarias. Esta morfología ovoidea es un reflejo radiológico de los llamados dedos de “Dawson”, hallazgo histopatológico descrito por este autor y que indica la localización de las placas desmielinizantes rodeando estructuras venulares11. Tan et al.12, utilizando una secuencia venográfica de alta resolución en un equipo de 1,5T, similar a la secuencia SWI, identificaron la distribución perivenular de las lesiones desmielinizantes, confirmando que su topografía y morfología viene determinada, al menos en algunas lesiones, por la localización y orientación de las vénulas. Así, en este estudio pudieron observar cómo en el 45% de las lesiones desmielinizantes visibles en las secuencias T2, existía una vena que las atravesaba centralmente. Sin embargo, este concepto se ha discutido en base a la heterogeneidad que estudios histopatológicos han mostrado en la presencia de estructuras venulares en el centro de las lesiones desmielinizantes13. Sin embargo, estudios posteriores de RM que utilizaron equipos de muy alto campo (3-7T) no solo confirmaron los hallazgos iniciales de Tan et al., sino que demostraron que la presencia de venas centrales en placas de EM es un hallazgo prácticamente constante en las lesiones desmielinizantes de localización periventricular14-17, mientras que este hallazgo es muy infrecuente en lesiones focales de sustancia blanca no relacionadas con la EM, confiriéndole a este hallazgo valor diagnóstico (Figura 3). Además de la identificación de venas en el centro de lesiones periventriculares, diferentes estudios han analizado, mediante la utilización de secuencias SWI, la visibilidad de las venas medulares de los hemisferios cerebrales en pacientes con EM. Así, Ge et al., en un estudio preliminar, utilizando secuencias SWI en un equipo 3T, describieron una disminución en la visibilidad de las venas medulares de los hemisferios cerebrales en pacientes con EM remitenterecurrente que se correlacionaba de forma negativa con el volumen lesional en T218. Posteriormente se ha descrito este mismo hallazgo, utilizando una técnica similar, pero en pacientes con un síndrome neu- Figura 2 Angiografía obtenida con secuencias T1 tras administración de contraste (izquierda) y con técnica de contraste de fases (derecha) del sistema vertebrobasilar (plano coronal) en un paciente con un síndrome de robo de la arteria subclavia izquierda. La angiografía con contraste muestra la oclusión proximal de la arteria subclavia izquierda (flecha), pero únicamente la angiografía con contraste de fase objetiva la inversión del flujo de la arteria vertebral izquierda, que se muestra hipointensa (de forma arbitraria el flujo ascendente se codifica en blanco y el descendente en negro). 7 Figura 3 RM cerebral obtenida en una paciente diagnosticada de esclerosis múltiple. La secuencia ponderada en T2-FLAIR (izquierda) muestra una típica lesión ovoidea de localización periventricular. La imagen de susceptibilidad magnética (derecha) identifica claramente una vénula en el centro de la lesión (flecha). REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 Revisión 13 8 rológico aislado que presentaban lesiones desmielinizantes cerebrales19 (Figura 4). Finalmente Sinnecker et al.17, utilizando un equipo de 7T, mostraron este mismo hallazgo en formas iniciales de EM. Diferentes hipótesis intentan explicar este hallazgo. La teoría inicialmente contemplada es que esta disminución se produce como consecuencia de una disminución de la concentración venular de deoxihemoglobina atribuible a una disminución en la fracción de extracción de oxígeno en el contexto de un proceso hipometabólico difuso. Ello causaría una disminución del efecto de SM y, por tanto, una menor hiposeñal de las venas que conlleva su menor visibilidad. Este efecto, denominado “efecto BOLD” (Blood Oxygenation Level Dependent) es la base de los estudios de RM funcional, en los que, ante la activación de un área cortical, se produce un aumento en la concentración relativa de oxihemoglobina en las vénulas postcapilares y, por tanto, una reducción del efecto paramagnético (inducido por la deoxihemoglobina) con el consiguiente aumento de la señal de resonancia en las áreas corticales activadas20, 21. Este proceso hipometabólico difuso, que podría ser consecuencia de una disfunción astrocitaria, se ve apoyado por estudios que, utilizando tomografía por emisión de positrones (PET), mostraron una reducción global en el metabolismo de la glucosa en pacientes con EM, que se correlacionaba con el volumen lesional en T2 y con el grado de disfunción cognitiva22-24. Además de estas consideraciones metabólicas, también se ha sugerido como causa de esta disminución en la visibilidad de estructuras venosas la existencia de alteraciones hemodinámicas y vasculares. Así, en pacientes con formas crónicas de EM se ha descrito una disminución del flujo y volumen sanguíneos cerebrales que produce alteraciones en la microcirculación25. Esta hipoperfusión difusa, que podría ser secundaria a una lesión vascular primaria, también podría explicarse por la existencia de una disfunción astrocitaria difusa atribuible a una liberación de potasio en el espacio perivascular que causaría una menor vasodilatación, o por daño mitocondrial secundario a la existencia de mediadores inflamatorios tóxicos26, 27. Además, el propio proceso neuroinflamatorio puede contribuir de forma directa en la disminución de la densidad venosa en base a estudios histopatológicos que describen daño de las estructuras venosas28-30. Este daño incluye la existencia de infiltrados perivasculares, depósitos de material fibrinoide y de hemosiderina, e incremento de colágeno, que producirían un engrosamiento de las paredes de los vasos afectos y una reducción en su calibre. Una hipótesis muy controvertida es la que proponen Zivadinov et al.31, que pretende explicar esta REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 Figura 4 Análisis de la visibilidad de las vénulas medulares de los hemisferios cerebrales. Imágenes de susceptibilidad magnética obtenidas en un sujeto sano (fila superior) y en un paciente con un síndrome neurológico aislado que presentaba lesiones cerebrales de características desmielinizantes. La visibilidad de las vénulas es menor en el paciente en comparación con el sujeto sano. Esta menor visibilidad puede cuantificarse a partir de programas que analizan la densidad venosa en regiones predeterminadas (imágenes derechas). menor visibilidad de las estructuras venosas por efecto de la llamada insuficiencia venosa cerebroespinal crónica (CCSVI) que causaría una destrucción de las venas cerebrales de pequeño tamaño como consecuencia de la congestión venosa y la hipertensión capilar que produce. Sin embargo, la ausencia de un incremento en la presión venosa intracraneal en pacientes con EM32 iría en contra de esta hipótesis. Además, la oclusión de las venas extracraneales debería producir una ingurgitación de las intracraneles (mayor volumen) y una potenciación de los efectos de SM como consecuencia de una mayor extracción de oxígeno (mayor visibilidad). Se ha sugerido que la CCSVI, que se manifiesta por una estenosis de las venas de drenaje en pacientes con EM, podría explicarse simplemente por una respuesta fisiológica adaptativa a la hipoperfusión e hipometabolismo que ocurre en la EM, por lo que probablemente deba considerarse una condición secundaria pero no causal de esta enfermedad33. Álex Rovira Recientemente Gaitán et al. han analizado diferencias en la visibilidad de las estructuras venosa en pacientes con EM en base a su relación anatómica con las placas visibles en secuencias T234. Estos autores han mostrado como el calibre de las estructuras venosas intralesionales está disminuido en relación con las que tienen una situación extralesional. Desde el punto de vista histológico, este hallazgo podría explicarse por el hecho de que las venas localizadas en el centro de las lesiones focales presentan, tal como se ha comentado previamente, exudados fibrinoides y depósitos de colágeno, que causan su compresión y disminuye su distensibilidad, lo que finalmente produce su estenosis11, 35. Más difícil de explicar es el mayor calibre de las venas extralesionales en pacientes con EM en comparación con sujetos sanos, si bien se ha sugerido que podría ser una consecuencia de una dilatación ex-vacuo secundaria a la pérdida de tejido cerebral34. ❑❑Detección de hierro en el sistema nervioso central en la esclerosis múltiple El hierro es un elemento esencial para el metabolismo neuronal participando en la producción de mielina, en la generación de energía mitocondrial, en el trasporte de oxígeno, en la síntesis de neurotransmisores y en la reacción de Fenton, la cual cataliza el peróxido de hidrógeno dando como resultado la generación de radicales oxidantes que participan en mecanismos biológicos de degradación no enzimáticos36-38. También se ha implicado el hierro en mecanismos reparativos (remielinización, biogénesis mitocondrial) en respuesta a enfermedades del sistema nervioso central. El exceso de hierro en el tejido cerebral puede inducir, a su vez, un proceso neurodegenerativo a través de su implicación en la génesis de radicales oxidantes, bloqueando mecanismos reparadores, activando la microglia y los macrófagos con incremento de su actividad pro-inflamatoria y facilitando el desarrollo de daño mitocondrial39. En el tejido cerebral, el hierro se almacena predominantemente en las proteínas ferritina y hemosiderina que sirven de reservorio frente a deficiencias o sobrecargas graves de este elemento40. En el envejecimiento normal, diferentes regiones cerebrales, especialmente los ganglios de la base, tienen una tendencia a incrementar su concentración de hierro no hemático, en forma de ferritina41. Así, la concentración de hierro aumenta de forma rápida hasta los 30-40 años para posteriormente mantenerse o aumentar levemente, con excepción de los tálamos donde se produce una disminución tras los 35 años de edad41. Este incremento también se ha descrito en diferentes enfermedades neurodegenerativas, incluida la EM, evidencia fundamentada, además de por estudios histopatológicos, en hallazgos de RM. En el caso específico de la EM, este incremento de hierro no sólo se ha detectado en los núcleos grises centrales, sino también en las lesiones focales que se localizan en la sustancia blanca encefálica. De todas maneras no está bien establecido si este incremento del hierro tisular en la EM explicaría al menos parcialmente el desarrollo de lesión neuroaxonal irreversible, o si simplemente corresponde a un epifenómeno de la enfermedad39, 42. ❑❑Incremento de hierro en los núcleos grises centrales Diferentes técnicas de RM se han propuesto para la cartografía en vivo del contenido de hierro en los tejidos cerebrales. El principio básico de todas estas técnicas es la interacción entre los complejos de hierro de alto peso molecular, tales como la ferritina o la hemosiderina, y las moléculas de agua, lo que conduce a una disminución de los tiempos de relajación T2 y T2* como consecuencia de su elevada SM43, y por tanto a una disminución de señal. Sin embargo, la evaluación visual de esta pérdida de señal no es lo suficientemente sensible para detectar sutiles cambios asociados con la concentración tisular de hierro en el tejido cerebral. Además, la evaluación visual no proporciona una evaluación cuantitativa del depósito de hierro, debido a que las intensidades de señal en secuencias ponderadas en T2 no se escalan linealmente con la concentración de hierro tisular3. Para superar esta limitación se ha propuesto un método cuantitativo conocido como relaxometría T2* o R2* (R2* es el inverso de T2*) cuyas principales ventajas son que, al menos para la sustancia gris, la escala linealmente con el contenido de hierro en toda la gama de concentraciones fisiológicas44, 45 y que puede obtenerse en equipos de RM disponibles comercialmente utilizando tiempos de exploración razonables y con cobertura anatómica cerebral completa.Diferentes estudios a partir de diferentes técnicas de mapeo de hierro tisular por RM, incluidas las secuencias de SWI, han analizado la presencia y concentración de hierro tisular en la EM. Estos estudios han mostrado un aumento de hierro en los ganglios basales y en los tálamos en la EM en comparación con controles sanos (Figura 5), que se correlaciona con la progresión de la discapacidad, el incremento del volumen lesional en T2, la atrofia de sustancia gris, la duración de la enfermedad, la discapacidad física y la velocidad de procesamiento mental46-51, por lo que se ha propuesto el mapeo de hierro tisular como un posible marcador de neurodegeneración en la EM. Diversas hipótesis intentan explicar el aumento de hierro en los núcleos grises centrales, entre la que destaca un incremento en su demanda como conseREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 9 Revisión cuencia de un mayor requerimiento energético a nivel mitocondrial52. Si bien inicialmente Khalil et al. no demostraron la presencia de incrementos de hierro en los núcleos grises centrales en pacientes con un síndrome neurológico aislado utilizando relaxometria T2* en equipos de 3T47, posteriormente Al-Radaideh et al., utilizando secuencias SWI obtenidas en un equipo de 7T, sí lo mostraron53, lo que indica que el incremento de hierro se produce incluso en las fases más iniciales de la enfermedad y que la sensibilidad de la RM en su detección depende no solo del tipo de secuencia utilizada, sino especialmente de la potencia del campo magnético en las que éstas se obtienen. Este hallazgo se ha visto corroborado recientemente por Langkammer et al. que, utilizando mapeos cuantitativos de hierro con SWI (QSM), que son muy sensibles en la detección de hierro tisular, han demostrado incrementos de hierro en los ganglios basales en las fases más iniciales de la enfermedad7. 13 Figura 5 Imágenes de susceptibilidad magnética obtenidos en un sujeto sano (izquierda) y en un paciente con esclerosis múltiple (derecha) pareados por edad. Obsérvese la mayor hiposeñal de los núcleos grises centrales y tálamos en el paciente con esclerosis múltiple en relación con el sujeto sano, que probablemente refleja un incremento en la concentración de hierro. ❑❑ Incremento de hierro las lesiones desmielinizantes focales de sustancia blanca 10 Diferentes estudios indican la existencia de un incremento de hierro en el seno de las lesiones focales desmielinizantes que afectan la sustancia blanca cerebral. Este aumento de hierro podría tener una relación directa con la existencia de daño en la pared vascular, que causaría un incremento en la permeabilidad de la barrera hematoencefálica y consecuentemente una extravasación de células sanguíneas con incremento de depósitos perivasculares de hierro28, 52, 54. Este aumento de hierro también podría tener un origen no hemático y deberse a un incremento en la demanda de hierro como consecuencia del estrés metabólico, de la misma forma que induce este incremento en los núcleos grises centrales. Finalmente también se produce un incremento de hierro en la microglia activada y en los macrófagos55 como respuesta a la hipoxia o a la fagocitosis de hematíes extravasados, o de detritus de membranas mielínicas o de células oligodendrogliales, las cuales son ricas en hierro, elemento necesario para catalizar su elevada síntesis lipídica52, 56. Varios estudios que han utilizado secuencias SWI obtenidas con campos magnéticos de diversa potencia han detectado la presencia de hiposeñales en el interior de las placas desmielinizantes visibles en secuencias ponderadas en T2 que probablemente reflejan presencia de hierro. Estas hiposeñales, que pueden adoptar un patrón nodular o anular57, 58 (Figuras 6 y 7), se han identificado predominantemente en placas crónicas, si bien también de identifican en las agudas (Figura 8). Un reciente estudio longitudinal ha mostrado cómo estas hiposeñales son tempoREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 Figura 6 RM cerebral obtenida en una paciente diagnosticada de esclerosis múltiple. La secuencia ponderada en T2-FLAIR (izquierda) muestra lesiones desmielinizantes subcorticales en ambos hemisferios cerebrales, múltiples de las cuales presentan una hiposeñal nodular en la imagen de susceptibilidad magnética (flechas en imagen derecha). Figura 7 RM cerebral obtenida en una paciente diagnosticada de esclerosis múltiple. La secuencia ponderada en T2-FLAIR (izquierda) muestra múltiples lesiones desmielinizantes periventriculares y subcorticales en ambos hemisferios cerebrales. Múltiples de estas lesiones presentan una hiposeñal en anillo en la imagen de susceptibilidad magnética (flechas). Álex Rovira ralmente estables tanto en su intensidad como en su tamaño y morfología59. El patrón en anillo podría explicarse en las placas agudas por la presencia de macrófagos activados ricos en hierro que rodean las placas desmielinizadas60. En las placas crónicas, en las que la presencia de macrófagos activados es escasa61, 62, éstas células pueden modificar su fenotipo, y pasar de tener una actividad pro-inflamatoria a tener una actividad antiinflamatoria promoviendo fenómenos reparativos, lo que explicaría su permanencia a lo largo de la evolución lesional en la periferia de las lesiones desmielinizantes y, por tanto, la persistencia del patrón en anillo en las secuencias SWI63-65. Este fenómeno sería similar al que se produce en las hemorragias cerebrales, donde la presencia de hierro en forma de hemosiderina en el interior de los macrófagos es visible de forma indefinida en los estudios de RM66. El patrón nodular tiene probablemente un sustrato patológico diferente y reflejaría la existencia de astrogliosis, fenómeno que caracteriza las placas crónicas y que se desarrolla durante los primeros meses del desarrollo lesional. Estos astrocitos incrementan su contenido en hierro por efecto de una sobreexpresión del enzima hemo-oxigenasa que promueve el secuestro de hierro en el interior de las mitocondrias en los astrocitos con estrés oxidativo67, 68. Se ha descrito que estas hiposeñales pueden preceder al desarrollo de las lesiones visibles en T259 de la misma forma que ocurre con otras técnicas de RM, como la transferencia de magnetización, la espectroscopia de protón o la difusión, que son capaces de detectar alteraciones en la fase pre-lesional, es decir, semanas o meses antes de que la lesión se identifique en forma de hiperseñal en secuencias ponderadas en T2, lo que apoyaría la hipótesis de que el proceso desmielinizante puede ocurrir antes del desarrollo del proceso inflamatorio69-75. Finalmente, la detección de estas hiposeñales en el interior de placas desmielinizantes, al igual que la identificación de vénulas en el centro de placas desmielinziantes, podría conferir a las secuencias SWI de RM valor diagnóstico, ya que estas alteraciones no parecen observarse en lesiones focales de sustancia blanca de etiología diferentes a la EM. Figura 8 RM cerebral obtenida en una paciente diagnosticada de esclerosis múltiple. La secuencia ponderada en T1 tras la administración de contraste (izquierda) muestra una placa desmielinizante con signos de actividad inflamatoria localizada en el centro oval izquierdo. La lesión presenta una hiposeñal en anillo en la imagen de susceptibilidad magnética asociada a una vena central (flechas). ❑❑Conclusiones Las secuencias de SWI han abierto un nuevo campo en la caracterización tisular por RM, con aplicaciones en diferentes procesos que afectan el sistema nervioso central. A pesar de algunas limitaciones técnicas, de su escasa disponibilidad en los equipos clínicos de RM y de la necesidad de una cierta experiencia para su interpretación, su progresiva utilización ha de abrir nuevas expectativas no solo en el campo experimental, sino también en el clínico. En la actualidad las secuencias SWI tienen ya una aplicabilidad clínica evidente, sobre todo en las enfermedades neurovasculares, pero en un futuro próximo es de esperar que también las tenga en las enfermedades neurodegenerativas, como la esclerosis múltiple, donde esta técnica es capaz de analizar la visibilidad de las venas cerebrales y la presencia de hierro en el tejido cerebral. Estos hallazgos no solo permiten avanzar en el conocimiento del sustrato patológico de la EM y mejorar la especificidad de la RM en el diagnóstico de la EM, sino que además podrían utilizarse como biomarcadores del componente degenerativo de esta enfermedad. References 1.- Haacke EM, Xu Y, Cheng YC, Reichenbach JR. Susceptibility weighted imaging (SWI). Magn Reson Med 2004;52:612-8. 2.- Reichenbach JR, Venkatesan R, Schillinger DJ, Kido DK, Haacke EM. Small vessels in the human brain: MR venography with deoxyhemoglobin as an intrinsic contrast agent. Radiology 1997;204:272-7. 3.- Ropele S, de Graaf W, Khalil M, et al. MRI Assessment of Iron Deposition in Multiple Sclerosis. J Magn Reson Imaging 2011;34:13-21. 4.- Saini S, Frankel RB, Stark DD, Ferrucci JT Jr. Magnetism: a primer and review. AJR Am J Roentgenol 1988;150:735-43. REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 11 Revisión 13 12 5.- Gupta RK, Rao SB, Jain R, Pal L, Kumar R, Venkatesh SK, Rathore RK. Differentiation of calcification from chronic hemorrhage with corrected gradient echo phase imaging. J Comput Assist Tomogr 2001;25:698-704. 6.- Rauscher A, Sedlacik J, Barth M, Mentzel HJ, Reichenbach JR. Magnetic susceptibility-weighted MR phase imaging of the human brain. AJNR Am J Neuroradiol 2005;26:736-42. 7.- Langkammer C, Liu T, Khalil M, Enzinger C, Jehna M, Fuchs S, Fazekas F, Wang Y, Ropele S. Quantitative Susceptibility Mapping in Multiple Sclerosis. Radiology 2013 Jan 11. [Epub ahead of print] 8.- Haacke EM, Mittal S, Wu Z, Neelavalli J, Cheng YC. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR Am J Neuroradiol 2009;30:19-30. 9.- Mittal S, Wu Z, Neelavalli J, Haacke EM. Susceptibility-weighted imaging: technical aspects and clinical applications, part 2. AJNR Am J Neuroradiol 2009;30:232-52. 10.- Ormerod IE, Miller DH, McDonald WI, du Boulay EP, Rudge P, Kendall BE, et al. The role of NMR imaging in the assessment of multiple sclerosis and isolated neurological lesions. A quantitative study. Brain 1987;110:1579-616. 11.- Dawson J. The histology of disseminated sclerosis. Trans Roy Soc Edinb 1916;50: 517. 12.- Tan IL, van Schijndel RA, Pouwels PJ, van Walderveen MA, Reichenbach JR, Manoliu RA, et al. MR venography of multiple sclerosis. AJNR Am J Neuroradiol 2000;21:1039-42. 13.- Lucchinetti C, Brück W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000;47:707-17. 14.- Kollia K, Maderwald S, Putzki N, Schlamann M, Theysohn JM, Kraff O, et al. First clinical study on ultra-high-field MR imaging in patients with multiple sclerosis: comparison of 1.5T and 7T. AJNR Am J Neuroradiol 2009;30:699-702. 15.- Tallantyre EC, Morgan PS, Dixon JE, Al-Radaideh A, Brookes MJ, Evangelou N, et al. A comparison of 3T and 7T in the detection of small parenchymal veins within MS lesions. Invest Radiol 2009;44:491-4. 16.- Tallantyre EC, Dixon JE, Donaldson I, Owens T, Morgan PS, Morris PG, Evangelou N. Ultra-high-field imaging distinguishes MS lesions from asymptomatic white matter lesions. Neurology 2011;76:534-9. 17.- Sinnecker T, Bozin I, Dörr J, Pfueller CF, Harms L, Niendorf T, et al. Periventricular venous density in multiple sclerosis is inversely associated with T2 lesion count: a 7 Tesla MRI study. Mult Scler 2013;19:316-25. 18.- Ge Y, Zohrabian VM, Osa EO, Xu J, Jaggi H, Herbert J, et al. Diminished visibility of cerebral venous vasculature in multiple sclerosis by susceptibility-weighted imaging at 3.0 Tesla. J Magn Reson Imaging 2009;29:1190-4. 19.- Rovira A, Aymerich F, Auger C, Huerga E, Mitjana R, Tintoré M, et al. Brain medullary veins visibility with susceptibility-weighted MR imaging in clinically isolated syndromes and relapsing-remitting multiple sclerosis. Mult Scler 2012;18 (S4):157. 20.- Ogawa S, Lee TM, Kay AR, Tank DW. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proc Natl Acad Sci USA 1990;87:9868-72. 21.- Arthurs OJ, Boniface S. How well do we understand the neural origins of the fMRI BOLD signal? Trends Neurosci 2002;25:27-31. 22.- Brooks DJ, Leenders KL, Head G, et al. Studies on regional cerebral oxygen utilisation and cognitive function in multiple sclerosis. J Neurol Neurosurg Psychiatry 1984;47:1182-91. 23.- Bakshi R, Miletich RS, Kinkel PR, Emmet ML, Kinkel WR. High-resolution fluorodeoxyglucose positron emission tomography shows both global and regional cerebral hypometabolism in multiple sclerosis. J Neuroimaging 1998;8:228-34. 24.- Blinkenberg M, Rune K, Jensen CV, Ravnborg M, Kyllingsbaek S, Holm S, et al. Cortical cerebral metabolism correlates with MRI lesion load and cognitive dysfunction in MS. Neurology 2000;54:558-64. 25.- Wuerfel J, Paul F, Zipp F. Cerebral blood perfusion changes in multiple sclerosis. J Neurol Sci 2007;259:16-20. 26.- De Keyser J, Steen C, Mostert JP, Koch MW. Hypoperfusion of the cerebral white matter in multiple sclerosis: possible mechanisms and pathophysiological significance. J Cereb Blood Flow Metab 2008;28:1645-51. 27.- Kalman B, Leist TP. A mitochondrial component of neurodegeneration in multiple sclerosis. Neuromolecular Med 2003;3:147-58. 28.- Adams CW. Perivascular iron deposition and other vascular damage in multiple sclerosis. J Neurol Neurosurg Psychiatry 1988;51:260-5. 29.- Adams CW, Poston RN, Buk SJ, Sidhu YS, Vipond H. Inflammatory vasculitis in multiple sclerosis. J Neurol Sci 1985;69:269-83. 30.- Tanaka R, Iwasaki Y, Koprowski H. Ultrastructural studies of perivascular cuffing cells in multiple sclerosis brain. Am J Pathol 1975;81:467-78. 31.- Zivadinov R, Poloni GU, Marr K, Schirda CV, Magnano CR, Carl E, et al. Decreased brain venous vasculature visibility on susceptibility-weighted imaging venography in patients with multiple sclerosis is related to chronic cerebrospinal venous insufficiency. BMC Neurol 2011;11:128. REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 Álex Rovira 32.- Meyer-Schwickerath R, Haug C, Hacker A, Fink F, Seidel D, Hartung HP, et al. Intracranial venous pressure is normal in patients with multiple sclerosis. Mult Scler 2011;17:637-8. 33.- Filippi M, Rocca MA, Barkhof F, Bakshi R, Fazekas F, Khan O, et al. Multiple sclerosis and chronic cerebrospinal venous insufficiency: the neuroimaging perspective. AJNR Am J Neuroradiol 2011;32:424-7. 34.- Gaitán MI, de Alwis MP, Sati P, Nair G, Reich DS. Multiple sclerosis shrinks intralesional, and enlarges extralesional, brain parenchymal veins. Neurology 2013;80:145-51. 35.- Adams CW. The onset and progression of the lesion in multiple sclerosis. J Neurol Sci 1975;25:165-82. 36.- Kell DB. Towards a unifying, systems biology understanding of large-scale cellular death and destruction caused by poorly liganded iron: Parkinson’s, Huntington’s, Alzheimer’s, prions, bactericides, chemical toxicology and others as examples. Arch Toxicol 2010;84:825-89. 37.- Kell DB. Iron behaving badly: inappropriate iron chelation as a major contributor to the aetiology of vascular and other progressive inflammatory and degenerative diseases. BMC Med Genomics 2009;2:2. 38.- Crichton RR, Dexter DT, Ward RJ. Brain iron metabolism and its perturbation in neurological diseases. J Neural Transm 2011;118:301-14. 39.- Zecca L, Youdim MB, Riederer P, Connor JR, Crichton RR. Iron, brain ageing and neurodegenerative disorders. Nat Rev Neurosci 2004;5:863-73. 40.- Bothwell TH. Overview and mechanisms of iron regulation. Nutr Rev 1995;53:237-45. 41.- Hallgren B, Sourander P. The effect of age on the non-haemin iron in the human brain. J Neurochem 1958;3:41-51. 42.- Schneider SA, Hardy J, Bhatia KP. Iron accumulation in syndromes of neurodegeneration with brain iron accumulation 1 and 2: causative or consequential? J Neurol Neurosurg Psychiatry 2009;80:589-90. 43.- Gossuin Y, Muller RN, Gillis P. Relaxation induced by ferritin: a better understanding for an improved MRI iron quantification. NMR Biomed 2004;17:427-32. 44.- Vymazal J, Brooks RA, Baumgarner C, Tran V, Katz D, Bulte JW, et al. The relation between brain iron and NMR relaxation times: an in vitro study. Magn Reson Med 1996;35:56-61. 45.- Langkammer C, Krebs N, Goessler W, Scheurer E, Ebner F, Yen K, et al. Quantitative MR imaging of brain iron: a postmortem validation study. Radiology 2010;257:455-62. 46.- Zhang Y, Metz LM, Yong VW, Mitchell JR. 3T deep gray matter T2 hypointensity correlates with disability over time in stable relapsing-remitting multiple sclerosis: a 3-year pilot study. J Neurol Sci 2010;297:76-81. 47.- Khalil M, Langkammer C, Ropele S, Petrovic K, Wallner-Blazek M, Loitfelder M, et al. Determinants of brain iron in multiple sclerosis: a quantitative 3T MRI study. Neurology 2011;77:1691-7. 48.- Ceccarelli A, Filippi M, Neema M, Arora A, Valsasina P, Rocca MA, et al. T2 hypointensity in the deep gray matter of patients with benign multiple sclerosis. Mult Scler 2009;15:678-86. 49.- Bermel RA, Puli SR, Rudick RA, Weinstock-Guttman B, Fisher E, Munschauer FE 3rd, et al. Prediction of longitudinal brain atrophy in multiple sclerosis by gray matter magnetic resonance imaging T2 hypointensity. Arch Neurol 2005;62:1371-6. 50.- Zivadinov R, Schirda C, Dwyer MG, Haacke ME, Weinstock-Guttman B, Menegatti E, et al. Chronic cerebrospinal venous insufficiency and iron deposition on susceptibility-weighted imaging in patients with multiple sclerosis: a pilot case-control study. Int Angiol 2010;29:158-75. 51.- Habib CA, Liu M, Bawany N, Garbern J, Krumbein I, Mentzel HJ, et al. Assessing abnormal iron content in the deep gray matter of patients with multiple sclerosis versus healthy controls. AJNR Am J Neuroradiol 2012;33:252-8. 52.- Williams R, Buchheit CL, Berman NE, LeVine SM. Pathogenic implications of iron accumulation in multiple sclerosis. J Neurochem 2012;120:7-25. 53.- Al-Radaideh AM, Wharton SJ, Lim SY, Tench CR, Morgan PS, Bowtell RW, et al. Increased iron accumulation occurs in the earliest stages of demyelinating disease: an ultra-high field susceptibility mapping study in Clinically Isolated Syndrome. Mult Scler 2012. [Epub ahead of print] 54.- Craelius W, Migdal MW, Luessenhop CP, Sugar A, Mihalakis I. Iron deposits surrounding multiple sclerosis plaques. Arch Pathol Lab Med 1982;106:397-9. 55.- Williams R, Rohr AM, Wang WT, Choi IY, Lee P, Berman NE, Lynch SG et al. Iron deposition is independent of cellular inflammation in a cerebral model of multiple sclerosis. BMC Neurosci 2011;23;12:59. 56.- LeVine SM, Chakrabarty A. The role of iron in the pathogenesis of experimental allergic encephalomyelitis and multiple sclerosis. Ann N Y Acad Sci 2004;1012:252-66. 57.- Haacke EM, Makki M, Ge Y, Maheshwari M, Sehgal V, Hu J, et al. Characterizing iron deposition in multiple sclerosis lesions using susceptibility weighted imaging. J Magn Reson Imaging 2009;29:537-44. 58.- Eissa A, Lebel RM, Korzan JR, Zavodni AE, Warren KG, Catz I, et al. Detecting lesions in multiple sclerosis at 4.7 tesla using phase susceptibility-weighting and T2-weighting. J Magn Reson Imaging 2009;30:737-42. REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013 13 Revisión 13 14 59.- Bian W, Harter K, Hammond-Rosenbluth KE, Lupo JM, Xu D, Kelley DA, et al. A serial in vivo 7T magnetic resonance phase imaging study of white matter lesions in multiple sclerosis. Mult Scler. 2013;19:69-75. 60.- Bagnato F, Hametner S, Yao B, van Gelderen P, Merkle H, Cantor FK, et al. Tracking iron in multiple sclerosis: a combined imaging and histopathological study at 7 Tesla. Brain 2011;134:3602-15. 61.- Adams CW, Poston RN. Macrophage histology in paraffin-embedded multiple sclerosis plaques is demonstrated by the monoclonal pan-macrophage marker HAM-56: correlation with chronicity of the lesion. Acta Neuropathol 1990;80:208-11. 62.- Brück W, Porada P, Poser S, Rieckmann P, Hanefeld F, Kretzschmar HA, et al. Monocyte/macrophage differentiation in early multiple sclerosis lesions. Ann Neurol 1995;38:788-96. 63.- Lucchinetti C, Brück W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000;47:707-17. 64.- Barnett MH, Henderson AP, Prineas JW. The macrophage in MS: just a scavenger after all? Pathology and pathogenesis of the acute MS lesion. Mult Scler 2006;12:121-32. 65.- Lassmann H. Review: the architecture of inflammatory demyelinating lesions: implications for studies on pathogenesis. Neuropathol Appl Neurobiol 2011;37:698-710. 66.- Dimigen M, Keir S, Dennis M, Wardlaw J. Long-term visibility of primary intracerebral hemorrhage on magnetic resonance imaging. J Stroke Cerebrovasc Dis 2004;13:104-8. 67.- Schipper HM. Heme oxygenase-1: transducer of pathological brain iron sequestration under oxidative stress. Ann N Y Acad Sci 2004;1012:84-93. 68.- Mehindate K, Sahlas DJ, Frankel D, Mawal Y, Liberman A, Corcos J, Dion S et al. Proinflammatory cytokines promote glial heme oxygenase-1 expression and mitochondrial iron deposition: implications for multiple sclerosis. J Neurochem 2001;77:1386-95. 69.- Narayana PA, Doyle TJ, Lai D, Wolinsky JS. Serial proton magnetic resonance spectroscopic imaging, contrast-enhanced magnetic resonance imaging, and quantitative lesion volumetry in multiple sclerosis. Ann Neurol 1998;43:56-71. 70.- Tartaglia MC, Narayanan S, De Stefano N, Arnaoutelis R. Antel SB, Francis SJ. et al. Choline is increased in pre-lesional normal appearing white matter in multiple sclerosis. J Neurol 2002;249:1382-90. 71.- Silver NC, Lai M, Symms MR, Barker GJ, McDonald WI, Miller DH. Serial magnetization transfer imaging to characterize the early evolution of new MS lesions. Neurology 1998;51:758-64. 72.- Filippi M, Rocca MA, Martino G, Horsfield MA, Comi G. Magnetization transfer changes in the normal appearing white matter precede the appearance of enhancing lesions in patients with multiple sclerosis. Ann Neurol 1998;43:809-14. 73.- Rocca MA, Cercignani M, Iannucci G, Comi G, Filippi M. Weekly diffusion-weighted imaging of normal-appearing white matter in MS. Neurology 2000;55:882-4. 74.- Pike GB, De Stefano N, Narayanan S, Worsley KJ. Pelletier D, Francis GS, et al. Multiple sclerosis: magnetization transfer MR imaging of white matter before lesion appearance on T2-weighted images. Radiology 2000;215:824-83. 75.- Werring DJ, Brassat D, Droogan AG, Clark CA, Symms MR, Barker GJ. et al. The pathogenesis of lesions and normalappearing white matter changes in multiple sclerosis: a serial diffusion MRI study. Brain 2000;123:1667-76. REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 26 - Junio de 2013