Trichomonas vaginalis: Parasito numero uno de transmisión sexual
Anuncio

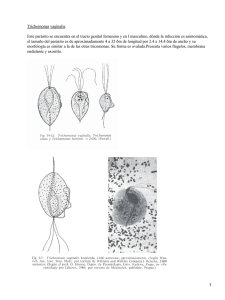
Trichomonas vaginalis: Parasito numero uno de transmisión sexual CHRYSTHIAN MARISOL CASTRO SANDOVAL [email protected] Laboratorio de zoología Escuela de biología Ciudad universitaria Avenida universitaria S/N C.P. 800100 Culiacán, Rosales, Sinaloa, México. UNIVERSIDAD AUTÓNOMA DE SINALOA Diciembre del 2003. INDICE INTRODUCCIÓN ................................................................................................................ 3 PATOGENOSIDAD ............................................................................................................. 3 EPIDEMIOLOGIA .............................................................................................................. 3 ESTUDIOS CELULARES Y GENETICOS ...................................................................... 4 RELACION DE T vaginalis CON OTRO MICROORGANISMOS. .............................. 4 INFECCIÓN POR VIRUS ................................................................................................... 4 SIMBIOSIS CON BACTERIAS ......................................................................................... 4 PREVENCIÓN 5 DIAGNOSTICO ................................................................................................................... 5 TRATAMIENTO.................................................................................................................. 6 REFERENCIAS .................................................................................................................... 6 Trichomonas vaginalis: PARASITO NUMERO UNO DE TRANSMISIÓN SEXUAL INTRODUCCIÓN Las enfermedades de transmisión sexual a lo largo de la historia a tenido impactos importantes sobre la población mundial; por lo que se han realizado diversos estudios para comparar los efectos que estas tienen. Dichos efectos son modificaciones en los hábitos y vivencias experimentadas por una población, así como la introducción de nuevas tecnología y el uso de fármacos (1). Por tal motivo una revisión de los resultados arrojados por diversas investigaciones sobre una de las infecciones mas comunes, este caso Trichomonas vaginalis, es de suma importancia. Trichomonas vaginalis (TV) es un parásito protista del tracto urogenital de los humanos numero uno de transmisión sexual no viral en el mundo(2-11). Coloniza el epitelio vaginal de mujeres(3), causándoles vaginitis(12, 13) por lo que es considerada una enfermedad venérea clásica(13). Donde el epitelio vaginal aparece con edemas, hemorragia pequeña y ulceraciones; y en hombres provoca uretritis, epididimitis y prostatitis(7). PATOGENOSIDAD Sus mecanismos celulares patogénicos no están bien definidos; por lo que un estudio del cultivo puro in vitro de las células hVECs, proporciona un sistema para estudiar la patogenosidad de los T vaginalis, los mecanismos citopatogenéticos del anfitrión y la patobioquimica de la triconomiasis(8). Los daños a las células epiteliales inician con la formación microcanales superficiales, después, induce cambios en al membrana plasmática , seguida por la muerte de la célula y la separación de las células lysed MDCK, lo que manifiesta un proceso de adherencia mas que una fagocitosis verdadera(7). La formación de pseudocystos y la capacidad de estos para adherirse a la célula huésped, sugieren que no son formas degenerativas, sino que, existe la posibilidad de la existencia de dos formas de tricomonas: los tropozoitos, caracterizados por células móviles que presentan estructura esquelética axial, y los pseudocystos, células redondeadas e inmóviles, con un diverso modo de mitosis, y una participación activa en la adherencia(14). Por lo otro lado, se encontró que para sobrevivir adquiere alimentos, elimina el ambiente celular hostil en la cavidad vaginal, y ejerce sus mecanismos patógenos con un proceso fagocitario eficiente(15). EPIDEMIOLOGIA La epidemiología de la enfermedad es mal atendida, por lo que repasamos la dinámica de la transmisión con un modelo matemático de la infección, que tiene implicaciones para el diseño de un programa de salud publica para el control de ETS(16). La técnica polimórfica amplificada al azar del DNA (RAPD) representa una herramienta eficiente que será utilizada en estudios moleculares de la epidemiología de aislantes de T vaginalis, por su alta capacidad y su bajo costo(17). ESTUDIOS CELULARES Y GENETICOS Al caracterizarse la ultraestructura del complejo de Golgi, se obtiene que siguen la división citoesquelética durante fase de la síntesis y durante la migración, el alargamiento y la separación de las células hijas durante mitosis(10). Se codifico el primer gen de proteína G en T vaginalis y de su producto el TvGa 402, con lo que se presume que TvGa 402 es un componente del heterotrimero de G proteína(18). El montaje del racimo de FeS puede funcionar en amitocondrias y en mitocondrias ancestrales, por lo que se identifico y codifico el gen tipo IscS en Trichomonas vaginalis y el organismo tipo I de Giardia intestinalis(19). RELACION DE T vaginalis CON OTRO MICROORGANISMOS. INFECCIÓN POR VIRUS T vaginalis abriga diversos virus, que pueden ser detectados por hibridación de su dsRNAs(2). Se evaluó el predominio de tricomonas tipo II (virus-positivos) y los factores clínicos y demográficos asociados a la infección viral del dsRNA de la TV, pero son necesarias mas investigaciones con la adición de antihongos potentes, y concentrarse en la edad de los aislantes que abrigan virus(6). Muchos aíslenles de T vaginalis son infectados por el virus designado T vaginalis virus (TVV), el móvil de este virus podría ser una razón de la alta incidencia de las infecciones de los T vaginalis, sin embargo son necesarios mas estudios para determinar la patogenia y virulencia de los T vaginalis(4). Además, la comparación entre aislantes con diversos grados de virulencia proporciona información sobre factores que determinan su grado de citopatogenia, datos que sugieren que las diferencias de virulencia del parásito dependen de tipo y/o cantidad de carbohidratos en la capa superior de la célula hospedador(3). Sin embargo deben hacerse estudios adicionales sobre la taxonomía de los virus así como de la correlación parásito-hospedador(2). SIMBIOSIS CON BACTERIAS Existe una gran diversidad de especies en la flora bacteriana genital femenina y su equilibrio es perturbado por variabilidad fisiología o presencia de microorganismos patógenos(20). Los agentes patógenos y/o marcadores de una flora microbiana de individuos sanos comparados con las especies presentes pacientes en muestras pre y post tratamiento antibiótico, demuestran que el tratamiento antibiótico tiene poco efecto en la variabilidad, complejidad y dinámica de la flora residente, y que la detección de las especies que desaparecen en el desarrollo de la enfermedad puede tener implicaciones en la terapia(21). La presencia de Mycoplasma hominis esta correlacionada con la presencia de T vaginalis(20). Su simbiosis tiene implicaciones clínicas y debe ser considerada por los médicos, por lo que al diagnosticar una infección con tricomonas, debe realizarse adicionalmente una prueba de detección para M hominis(22). Sin embargo un cultivo epidemiológico molecular demostró que en pacientes promiscuos el predominio de M hominis es mas elevado que los infectados con T vaginalis, descartando la idea de la correlación obligatoria entre ambos organismos(20). Sin embargo otros estudios deben encontrar la localización de las bacterias dentro de la célula trichomonal, y la influencia de esta asociación biológica en la patogenosidad de ambos simbiontes(22). PREVENCIÓN No se han publicado estudios sobre los predictores de esta infección entre mujeres adolescentes, ya que en adultos pueden ser diferentes, reflejando la necesidad de diseñar sesiones de educación ni dividual y grupal que promuevan evitar el uso de la marigüana, sexo con parejas mayores y no constantes (sin protección) y la delincuencia para reducir la incidencia de T vaginalis(23). Ya que la infección con T vaginalis y los tratamientos existentes aumenta resultados adversos durante el embarazo, los tratamientos no deben ser recomendados(24). Por lo que la prueba de la susceptibilidad de T vaginalis al metronidazol, bajo concentraciones de oxigeno in vitro, se debe realizar mas a menudo, sin embargo este análisis solo es sugerido para laboratorios clínicos avanzados de microbiología(25), lo que refleja una urgente necesidad de un nuevo método para determinar esta susceptibilidad. DIAGNOSTICO La incidencia de T vaginalis es de 180 millones de casos anuales a nivel mundial, por lo que su diagnostico es de importancia ya que esta presente en pacientes asintomáticos y es de fácil transmisión(26). Se ha diagnosticado infección por T vaginalis usando examinación directa del material vaginal, lo que requiere de mucho tiempo(27). La transferencia de muestra de papanicolaou en base-liquido es mejor diagnostico, ya que autoriza su tratamiento sin prueba adicional (26). Además los análisis de amplificación de ácidos nucleicos son alternativas para detectar el DNA de T vaginalis; por lo que se desarrollo un análisis cuantitativo basado en ABI 7700 , como indicador pronostico en mujeres con riesgo de adquirir otras ETS(27). Adicionalmente existe un método de diagnosis con base a la reacción de cadena polimerasa para T vaginalis (RCP TV), sin embargo aun es necesario determinar si facilitara su tratamiento y disminuirá su morbosidad asociada(5). Por ello se desarrollo una técnica de PCR que usa la cartilla del gen rRNA 18s de los T vaginalis, este análisis es fácil de realizar y tiene una alta sensibilidad y especificidad(9). Esta técnica también demostró ser sensible para detectar los T vaginalis en hombres(28). Resultando ser útil para la diagnosis rutinaria de la infección con T vaginalis(9). TRATAMIENTO El metronidazol es el agente antimicrobiano mas usado para el tratamiento contra la triconomiasis(25). Pero como, los Centros para el Control y la Prevención de ETS recomiendan terapia con metronidazol para los pacientes con infección de la TV diagnosticada con la preparación mojada y para los pacientes con exposición a una pareja TV-INFECTADA(5); sigue siendo el tratamiento de opción para los pacientes, por lo que son necesarios mas estudios en pacientes con síntomas de la vulvo-vaginitis para saber el verdadero predominio de la resistencia(29). Por esto, hubo una necesidad de desarrollar nuevos medicamentos antitriconomiasis, en este contexto el medicamento quinolinium bisquaternary (MQB) es casi tan efectivo como el metronidazol y tiene baja toxicidad con las células humanas, pero son necesarios mas estudios para aprobar su uso en quimioterapia contra T vaginalis(13). La producción de spermine en el ciclo de vida de T vaginalis es inhibido por la acción del DENSpm, lo que proporciona el potencial de esta vía como blanco para el diseño de agentes antitricomonas (30).Sin embargo, las recomendaciones de terapia con metronidazol para mujeres se puede instituir en instalaciones para el cuidado medico, ya que este antibiótico es barato, seguro y bien tolerado y no debe ser ignorado(16). REFERENCIAS 1. Adad SJ, de Lima RV, Sawan ZT, Silva ML, de Souza MA, Saldanha JC, et al. Frequency of Trichomonas vaginalis, Candida sp and Gardnerella vaginalis in cervical-vaginal smears in four different decades. Sao Paulo Med J 2001;119(6):200-5. 2. Benchimol M, Chang TH, Alderete JF. Trichomonas vaginalis: observation of coexistence of multiple viruses in the same isolate. FEMS Microbiol Lett 2002;215(2):197-201. 3. Gonzalez-Robles A, Cristobal-Ramos AR. Ultrastructural cytochemical observations of the cell coat of two Trichomonas vaginalis isolates with different degree of virulence. J Submicrosc Cytol Pathol 2002;34(2):207-10. 4. Weber B, Mapeka TM, Maahlo MA, Hoosen AA. Double stranded RNA virus in South African Trichomonas vaginalis isolates. J Clin Pathol 2003;56(7):542-3. 5. Wendel KA, Erbelding EJ, Gaydos CA, Rompalo AM. Trichomonas vaginalis polymerase chain reaction compared with standard diagnostic and therapeutic protocols for detection and treatment of vaginal trichomoniasis. Clin Infect Dis 2002;35(5):576-80. 6. Wendel KA, Rompalo AM, Erbelding EJ, Chang TH, Alderete JF. Doublestranded RNA viral infection of Trichomonas vaginalis infecting patients attending a sexually transmitted diseases clinic. J Infect Dis 2002;186(4):558-61. 7. Gonzales Robles A LHA. Trichomonas vaginalis: ultraestructural bases of the cytopathic effect. J. Euk Microbiol 1995;5(42):641-651. 8. Gilbert RO, Elia G, Beach DH, Klaessig S, Singh BN. Cytopathogenic effect of Trichomonas vaginalis on human vaginal epithelial cells cultured in vitro. Infect Immun 2000;68(7):4200-6. 9. Mayta H, Gilman RH, Calderon MM, Gottlieb A, Soto G, Tuero I, et al. 18S ribosomal DNA-based PCR for diagnosis of Trichomonas vaginalis. J Clin Microbiol 2000;38(7):2683-7. 10. Benchimol M, Ribeiro KC, Mariante RM, Alderete JF. Structure and division of the Golgi complex in Trichomonas vaginalis and Tritrichomonas foetus. Eur J Cell Biol 2001;80(9):593-607. 11. Guimar RMMCA. Hydrogen peroxide induces caspase activation and programmed cell death in the amitochondrial Tritrichomonas foetus. Histochem Cell Biol 2003(120):129-141. 12. Cindy van der Schee HJS. Host and pathogen interaction during vaginal infection by Trichomonas vaginalis and Mycoplasma hominis or Ureaplasma urealyticum. Journal of Microbiological Methods 2001;45:61-67. 13. Chavalitshewinkoon-Petmitr P, Ramdja M, Kajorndechakiat S, Ralph RK, Denny WA, Wilairat P. In vitro susceptibility of Trichomonas vaginalis to AT-specific minor groove binding drugs. J Antimicrob Chemother 2003;52(2):287-9. 14. Benchimol RMMM. Tritrichomonas foetus pseudocysts adhere to vaginal epithelial cells in a contact-dependent manner. Parasitology Research 2003. 15. Rendon Maldonado Jose G. ECM. Trichomonas vaginalis: In Vitro Phagocytosis of Lactobacilli, Vaginal Epithelial Cells, Leukocytes, and Erythrocytes. Experimental Parasitology 1998(89):241-250. 16. Bowden FJ, Garnett GP. Trichomonas vaginalis epidemiology: parameterising and analysing a model of treatment interventions. Sex Transm Infect 2000;76(4):24856. 17. Fraga J, Rojas L, Sariego I, Sarria CA. Optimization of random amplified polymorphic DNA techniques for its use in genetic studies of Trichomonas vaginalis isolates. Infect Genet Evol 2002;2(1):73-5. 18. Hirt RP, Lal K, Pinxteren J, Warwicker J, Healy B, Coombs GH, et al. Biochemical and genetic evidence for a family of heterotrimeric G-proteins in Trichomonas vaginalis. Mol Biochem Parasitol 2003;129(2):179-89. 19. Tachezy J, Sanchez LB, Muller M. Mitochondrial type iron-sulfur cluster assembly in the amitochondriate eukaryotes Trichomonas vaginalis and Giardia intestinalis, as indicated by the phylogeny of IscS. Mol Biol Evol 2001;18(10):1919-28. 20. van Belkum A, van der Schee C, van der Meijden WI, Verbrugh HA, Sluiters HJ. A clinical study on the association of Trichomonas vaginalis and Mycoplasma hominis infections in women attending a sexually transmitted disease (STD) outpatient clinic. FEMS Immunol Med Microbiol 2001;32(1):27-32. 21. Riemersma W. A. vdSCJC. Microbial population diversity in the urethras of hearthy males and males suffering from nonchlamydial, nogonococcal urethritis. Journal of Clinical Microbiology 2003;5(41):1977-1986. 22. Rappelli P, Carta F, Delogu G, Addis MF, Dessi D, Cappuccinelli P, et al. Mycoplasma hominis and Trichomonas vaginalis symbiosis: multiplicity of infection and transmissibility of M. hominis to human cells. Arch Microbiol 2001;175(1):70-4. 23. Crosby R, DiClemente RJ, Wingood GM, Harrington K, Davies SL, Hook EW, 3rd, et al. Predictors of infection with Trichomonas vaginalis: a prospective study of low income African-American adolescent females. Sex Transm Infect 2002;78(5):3604. 24. Klebanoff MA, Carey JC, Hauth JC, Hillier SL, Nugent RP, Thom EA, et al. Failure of metronidazole to prevent preterm delivery among pregnant women with asymptomatic Trichomonas vaginalis infection. N Engl J Med 2001;345(7):487-93. 25. Meri T, Jokiranta TS, Suhonen L, Meri S. Resistance of Trichomonas vaginalis to metronidazole: report of the first three cases from Finland and optimization of in vitro susceptibility testing under various oxygen concentrations. J Clin Microbiol 2000;38(2):763-7. 26. Lara-Torre E, Pinkerton JS. Accuracy of detection of trichomonas vaginalis organisms on a liquid-based papanicolaou smear. Am J Obstet Gynecol 2003;188(2):354-6. 27. Jordan JA, Lowery D, Trucco M. TaqMan-based detection of Trichomonas vaginalis DNA from female genital specimens. J Clin Microbiol 2001;39(11):3819-22. 28. Schwebke JR, Lawing LF. Improved detection by DNA amplification of Trichomonas vaginalis in males. J Clin Microbiol 2002;40(10):3681-3. 29. Perez S, Fernandez-Verdugo A, Perez F, Vazquez F. Prevalence of 5nitroimidazole-resistant trichomonas vaginalis in Oviedo, Spain. Sex Transm Dis 2001;28(2):115-6. 30. Yarlett N, Martinez MP, Goldberg B, Kramer DL, Porter CW. Dependence of Trichomonas vaginalis upon polyamine backconversion. Microbiology 2000;146 ( Pt 10):2715-22.