Los solidos ionicos
Anuncio

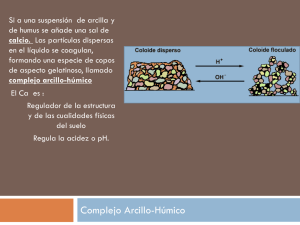
Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio tienen puntos de fusión moderadamente altos y son solubles en disolventes polares, en particular en agua. Sin embargo existen excepciones como el CaF2 el cual presenta un elevado punto de fusión pero es insoluble en agua. Los compuestos iónicos también presentan una baja conductividad eléctrica en el estado sólido pero se hacen buenos conductores de la electricidad cuando se funden o cuando se disuelven en disolventes polares como el agua. Los sólidos iónicos presentan estructuras con bajos números de coordinación, a diferencia de los sólidos metálicos, lo que explica su menor densidad. De hecho, la distinción entre un sólido iónico y uno covalente puede establecerse en función del número de coordinación, al que puede llegarse de forma experimental mediante técnicas de difracción de rayos X. Sin embargo, algunos sólidos covalentes como el diamante presentan también bajos números de coordinación, por lo que es necesario un criterio más específico para establecer un sólido como iónico. La clasificación de un sólido como iónico se basa en la comparación de sus propiedades con las que predice el modelo iónico. Este es un modelo límite del enlace entre átomos y se basa en considerar al sólido formado por una red de esferas cargadas con signos opuestos y que interaccionan entre sí mediante fuerzas de tipo coulombianas. Si los parámetros termodinámicos calculados para el sólido empleando el modelo iónico coinciden con los determinados experimentalmente, entonces el sólido presenta naturaleza iónica. No obstante, hay que indicar que en algunos casos particulares esta coincidencia numérica no implica siempre la existencia de un enlace iónico. Estructuras características de los sólidos iónicos Las estructuras que se describen en este apartado son los modelos que describen a un gran número de sólidos iónicos. Por ejemplo, la estructura de la sal de roca, que toma su nombre de la forma mineral del NaCl, es característica de muchos otros sólidos iónicos. Muchas de las estructuras pueden considerarse constituidas por redes formadas por iones positivos y negativos en las que se maximizan las fuerzas atractivas entre iones de signos opuestos y se minimizan las fuerzas repulsivas entre iones de la misma carga. Tabla 3. Estructuras cristalinas modelo de compuestos ionicos Estructura cristalina Ejemplo Antifluorita K2O, K2S,Li2O, Na2O, Na2Se, Na2S Cloruro de cesio CsCl, CaS, TlSb, CsCN, CuZn Fluorita CaF2, UO2, BaCl2, HgF2, PbO2 Arseniuro de níquel NiAs, NiS, FeS, PtSn, CoS Perovskita CaTiO3, BaTiO3, SrTiO3 Sal de roca NaCl, LiCl, KBr, RbI, AgCl, AgBr, MgO, CaO, TiO, FeO, NiO, SnAs, UC, ScN Rutilo TiO2, MnO2, SnO2, WO2, MgF2, NiF2 Blenda ZnS, CuCl, CdS, HgS, GaP, InAs Wurtzita ZnS, ZnO, BeO, MnS, AgI, AlN, SiC, NH4F La estructura del cloruro sódico Esta estructura está basada en un empaquetamiento cúbico compacto (centrado en las caras) de los aniones y en el que los cationes ocupan todos los huecos octaédricos. La interpretación opuesta es igualmente válida: estructura de empaquetamiento compacto de cationes con los aniones ocupando los huecos octaédricos. En cada celda unidad los iones de un tipo ocupan los vértices y los centros de las caras del cubo mientras que los de signo contrario se sitúan en los centros de las aristas y en el centro del cubo (Figura 6). Cada ion de un signo está rodeado de 6 iones de signo contrario, por lo que el número de coordinación del catión y del anión en este tipo de estructura de 6. Se dice que la estructura presenta coordinación (6,6), donde el primer dígito representa el número de coordinación del catión y el segundo el del anión. Los seis iones de signo contrario que rodean a un ion central se disponen en forma octaédrica. Este tipo de estructura es adoptada por la mayoría de los haluros alcalinos como los de Li, Na, K, Rb y el CsF. También es adoptada por los óxidos de Mg, Ca, Sr, Ba y Cd. Figura 6 . Estructura del NaCl La estructura del cloruro de cesio Esta estructura es menos común que la del cloruro de sodio y la presentan los compuestos como el CsCl, CsBr y CsI, así como otros compuestos formados por iones de radios similares a estos como los haluros de amonio (excepto el NH4Br). La estructura del cloruro de cesio presenta una celda unidad cúbica en la que cada vértice está ocupado por el anión y el centro del cubo se ocupa por el catión, o viceversa (Figura 7) (o viceversa), lo que conduce a una coordinación (8,8). Figura 7. Estructura del CsCl Las estructuras de la blenda y de la wurtzita (ZnS) El sulfuro de cinc cristaliza en dos formas polimórficas, la wurtzita y la blenda. La primera se basa en un empaquetamiento hexagonal de los aniones en el que los cationes ocupan la mitad de los huecos tetraédricos. La estructura de la blenda está basada en un empaquetamiento de los aniones de tipo cúbico centrado en las caras en el que los cationes ocupan la mitad de los huecos tetraédricos. En ambos tipos de estructuras se da la coordinación (4,4). Las dos estructuras se presentan en los óxidos y sulfuros de los metales divalentes como el Be, Zn, Mn, Cd, Hg. Figura 8. Estructura de la blenda Estructura de la wurtzita La estructura de la fluorita (CaF2) Esta estructura toma su nombre del mineral fluorita, CaF2. Consiste en un empaquetamiento cúbico centrado en las caras de los cationes Ca2+ en el que los aniones F- ocupan todos los huecos tetraédricos. La estructura de tipo antifluorita presenta una disposición de cationes y aniones inversa a la de la fluorita. En la estructura de tipo fluorita, los aniones están rodeados de 4 cationes vecinos dispuestos en un entorno tetraédrico. Los cationes están rodeados de 8 aniones que se disponen en un entorno cúbico. Por lo tanto, los números de coordinación para el catión y el anión son diferentes, 8:4 respectivamente, consistente con la estequiometría del compuesto (hay doble número de aniones que de cationes). Este tipo de estructura la presentan los fluoruros de Ca, Sr, Ba, Cd, Hg(II), Pb(II). Figura 9. Estructura del CaF2. La estructura del rutilo (TiO2) Toma su nombre del mineral rutilo, un mineral de óxido de Ti(IV). Se basa en un empaquetamiento hexagonal compacto de los aniones en el que los cationes ocupan la mitad de los huecos octaédricos. Cada átomo de Ti está rodeado de seis átomos de oxígeno (disposición octaédrica) y cada átomo de oxígeno se rodea de tres átomos de titanio (disposición trigonal), de forma que la estructura de tipo rutilo presenta coordinación de 6:3. Esta estructura es la adoptada, entre otros, por el óxido de Sn(IV) o casiderita, el MnO2 y el WO2 y por los fluoruros del tipo MgF2 y NiF2. Figura 10 . Estructura del TiO2 (rutilo) La estructura de tipo perovskita El mineral perovskita CaTiO3 posee una estructura que es el prototipo de muchos sólidos de composición ABX3, particularmente óxidos. En su forma idealizada, la estructura de perovskita es cúbica, con los átomos A ocupando el centro del cubo y rodeado de 12 átomos de tipo X y los átomos B ocupando los vértices del cubo y rodeado por 6 átomos de tipo X. La suma de las cargas de los iones positivos A y B debe ser de 6 (A2+ B4+, A3+ B3+,...). La estructura de tipo perovskita está relacionada con la de materiales que presentan propiedades eléctricas muy interesantes como los sólidos piezoeléctricos, ferroeléctricos y los superconductores de alta temperatura. Figura 11. Estructura de la perovskita.