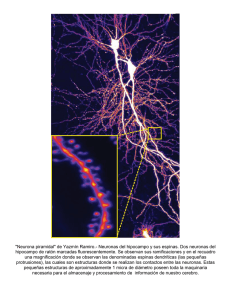
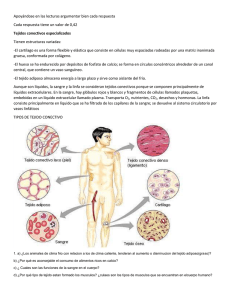
estudio de mecanismos de integración sensorial en el bulbo
Anuncio

UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA ESCUELA DE POSTGRADO ESTUDIO DE MECANISMOS DE INTEGRACIÓN SENSORIAL EN EL BULBO OLFATORIO DE RATA José Ignacio Egaña Tomic TESIS PARA OPTAR AL GRADO DE DOCTOR EN CIENCIAS BIOMEDICAS Director de Tesis: Profesor Dr. Pedro Maldonado A. 2010 UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA ESCUELA DE POSTGRADO INFORME DE APROBACION TESIS DE DOCTORADO EN CIENCIAS BIOMEDICAS Se informa a la Comisión de Grados Académicos de la Facultad de Medicina, que la Tesis de Doctorado en Ciencias Biomédicas presentada por el candidato José Ignacio Egaña Tomic ha sido aprobada por la Comisión Informante de Tesis como requisito para optar al Grado de Doctor en Ciencias Biomédicas en Examen de Defensa de Tesis rendido el día Día de Mes de 2008. Profesor Dr. Pedro Maldonado Director de Tesis Programa de Fisiología y Biofísica, ICBM, Facultad de Medicina Universidad de Chile COMISION INFORMANTE DE TESIS Prof. Dra. MARÍA INES FORRAY C. Prof. Dr. JUAN BACIGALUPO V. Prof. Dr. JUAN CARLOS LETELIER P. Prof. Dr. LUIS ROBLES W. Presidente Comisión de Examen 2 DEDICATORIA a Enrique Egaña Barahona a Juan Ignacio Egaña Moreno a Tomás Egaña Tomic a Vicente y Emilio Egaña Luzoro 3 AGRADECIMIENTOS Fueron muchas las personas que ayudaron a que este trabajo de tesis se pudiera realizar y hoy tome cuerpo en este documento. Temo agradecer porque temo olvidar más de un nombre. Son tantos grandes y pequeños aportes que el que me falte alguno no es desconsideración, tan solo mala memoria. Quiero agradecer muy especialmente al Dr. Pedro Maldonado A., no sólo por haber sido mi tutor de tesis, sino por haberme enseñado a hacer ciencia. Ciencia entretenida, seria, responsable, humilde y abierta. Ciencia colectiva, ciencia reflexiva y ciencia espontánea. Pedro en su enseñanza de la ciencia me ha dado herramientas, creo yo, para ser mejor profesional, amigo y persona. Eso es mucho más que un tutor. Otro agradecimiento especial es para la Dra. Marilú Aylwin O. De ella he aprendido la capacidad de observación, no sólo de los fenómenos, sino del trabajo científico y en especial del propio. Marilú fue en la práctica otra tutora más. A ella le debo mucho de mis primeros pasos en este entretenido mundo de la ciencia. Un muy personal agradecimiento a mi familia: mis padres y mis hermanos de quienes siempre tuve el apoyo incondicional. A mi mujer, Amaranta, quién me acompaño en este largo camino, que me animó en los momentos difíciles, me aconsejó en la frustración y se rió conmigo en las alegrías. A mis hijos, por ser ellos. A mis compañeros y amigos del laboratorio: a Rómulo Fuentes, Paul Delano, Francisco Flores y Marcelo Aguilar. A Cecilia Babul e Isaac Oporto. A Pedro Rosas, Juan Pablo Ossandon, Andrea Helo, Hachi Manzur, Rodrigo Montefusco, Fernando Ramirez y Fabian Muñoz. A Carlos Hamame y Viviana Nuñez. 4 A las todas las personas del laboratorio de la Dra. Aylwin, en especial a Guillermo Aguilar, Ximena García y Verónica Lastra. Muchas gracias a la comisión informante de quienes siempre recibí criticas constructivas que mejoraron mi trabajo de tesis. También quiero agradecer a las siguientes instituciones por el financiamiento otorgado durante mis estudios en el Programa de Doctorado: CONICYT, MIDEPLAN (Iniciativa científica MILENIO) y CENI. 5 ÍNDICE DE CONTENIDOS ÍNDICE DE CONTENIDOS 6 ÍNDICE DE FIGURAS 10 ABREVIATURAS 12 RESUMEN 13 ABSTRACT 16 1. INTRODUCCIÓN 19 1.1 Sistema olfatorio y percepción 19 1.2 Organización anatómica del sistema olfatorio de mamíferos 21 1.3 La integración sensorial en el bulbo olfatorio 25 1.3.1 Convergencia jerárquica o modelo de línea marcada 26 1.3.2 Código poblacional 31 1.3.3 Correlación temporal 33 1.4 Integración y respiración 37 2. HIPÓTESIS DE TRABAJO 41 3. OBJETIVOS 42 4. MATERIALES Y MÉTODOS 44 4.1 Animales y procedimientos quirúrgicos 44 4.1.1 Animales 44 4.1.2 Cirugía 44 4.2 Estimulación con odorantes 46 4.3 Entrega de los estímulos y protocolo de estimulación 47 4.4 Registros electrofisiológicos y adquisición de datos 49 4.4.1 Electrodos 49 4.4.2 Digitalización 51 4.5 Análisis de datos 53 6 4.5.1 Extracción de espigas e identificación de unidades aisladas 53 Cálculo de la tasa de descarga y efectos gatillados por la estimulación 55 4.5.3 Cálculo de respuesta de neuronas vecinas 56 4.5.4 Cálculo de autocorrelogramas y correlogramas cruzados 56 4.5.5 Cálculo inicial de la descarga de neuronas MT durante el ciclo respiratorio 57 Cálculo vectorizado de la descarga de neuronas MT durante el ciclo respiratorio 58 Oscilaciones del potencial de campo local durante el ciclo respiratorio 60 Detección de regiones con actividad significativa del PCL en el ciclo respiratorio 60 Detección de cambios en el PCL como consecuencia de a estimulación 60 4.5.2 4.5.6 4.5.7 4.5.8 4.5.9 l 5. RESULTADOS 62 5.1 Caracterización la respuesta de neuronas MT vecinas 62 5.1.1 Registro de actividad unitaria 58 5.1.2 Respuesta de las neuronas MT a las mezclas de odorantes 65 5.1.3 Los estímulos evocaron respuestas distintas entre neuronas MT vecinas 5.2 67 5.1.4 Las neuronas MT presentan un largo período refractario que se modifica, pero no desaparece durante la estimulación 69 5.1.5 Actividad oscilatoria y sincrónica entre células MT vecinas 72 5.1.6 Patrón respiratorio en MT vecinas 73 Modulación de la respiración sobre la actividad neuronal del BO 75 5.2.1 75 Registros de unidades MTs 7 5.2.2 5.2.3 5.3 La frecuencia y fase poblacional muestran muy poca variación del PCL entre estímulos y/o épocas 6.2 87 87 5.3.2 Patrones diversos entre la oscilación en la capa de células mitrales del BO 90 5.3.3 Los patrones de PCL son dependientes de la naturaleza del estímulo DISCUSIÓN 6.1 77 La evaluación individual de la descarga MT demuestra modulación estímulo-dependiente de la fase y/o magnitud del vector suma 81 Registros del potencial de campo local 5.3.1 6. La población de neuronas MTs exhibe acoplamiento a la respiración, pero no modulación de esta por la estimulación 94 96 Caracterización la respuesta de neuronas MT vecinas y determinación de su organización funcional 96 6.1.1 Conexiones y preferencia por odorantes en células MT vecinas 97 6.1.2 Perfiles de respuesta en células MT vecinas 101 6.1.3 Actividad oscilatoria de las células MT 102 6.1.4 Sincronía entre células MT vecinas 103 Patrones respiratorios en células MT vecinas 6.2.1 6.2.2 6.2.3 Rol modulador de la respiración en la actividad neuronal del BO La actividad poblacional a gran escala no necesariamente refleja los cambios en la respuesta de las MT frente a la estimulación La respuesta de las células MT es específica para cada odorante 105 105 106 107 8 6.3 Las oscilaciones del PCL también muestran respuesta dependiente del estímulo dentro de una respuesta global que es más bien estereotipada 108 6.4 Descarga de neuronas MT y oscilaciones del PCL como un mecanismo para codificar la identidad del estímulo en el BO 110 Conclusiones 112 6.5 7. CONCLUSIONES FINALES 114 8. BIBLIOGRAFÍA 115 9 INDICE DE FIGURAS Figura 1. Vía olfatoria periférica y organización celular del bulbo olfatorio 24 Figura 2. Sinapsis y neurotransmisores en el bulbo olfatorio 27 Figura 3. Convergencia de axones de neuronas receptoras olfatorias (NRO) que expresan una misma proteína receptora 29 Figura 4. Organización quimiotópica en el bulbo olfatorio de vertebrados 32 Figura 5. Acoplamiento de las descargas de neuronas a la oscilación del potencial de campo local 36 Figura 6. La descarga de las neuronas y las oscilaciones del PCL están moduladas por la respiración 39 Figura 7. Entrega automatizada de los distintos estímulos durante los experimentos 48 Figura 8. Fotografías y esquemas de los tipos de tétrodos utilizados 52 Figura 9. Principales parámetros que determinan la forma de una onda 54 Figura 10. Ejemplos de registros con tétrodos en la capa mitral del bulbo olfatorio 64 Figura 11. Resumen y ejemplos de la respuesta de neuronas mitrales/penacho vecinas 66 Figura 12. Neuronas MT vecinas exhiben distintas preferencias por odorantes 68 Figura 13. Las neuronas MT exhiben un largo período silente y bajos niveles de oscilación 71 10 Figura 14. Las neuronas MT vecinas muestran baja incidencia de actividad sincrónica 74 Figura 15. Neuronas MT vecinas muestran patrones respiratorios diferentes 76 Figura 16. Análisis vectorial de la descarga de neuronas MT durante el ciclo respiratorio 78-79 Figura 17. Magnitudes y ángulos de la población de células MT 82 Tabla 1. Valores de fase y magnitud para todos los eventos y variación de estos en los eventos significativos 83 Figura 18. Ejemplos de respuesta a la estimulación en la descarga de las células MT durante el ciclo respiratorio 85-86 Figura 19. Analisis de las oscilaciones del potencial de campo local durante el ciclo respiratorio 88-89 Figura 20. Distribuciones de frecuencia y fase de las oscilaciones del PCL en el bulbo olfatorio 91 Figura 21. Ejemplos de patrones de oscilaciones del potencial de campo local 93 Figura 22. El potencial de campo local varía según la identidad del odorante 95 11 ABREVIATURAS cAMP adenosina – monofosfato cíclico BO bulbo olfatorio principal CG célula granular CHO mezcla de aldehídos COOH mezcla de ácidos carboxílicos DS desviación estándar H high (oscilaciones de alta frecuencia) IP intraperitoneal K mezcla de cetonas L low (oscilaciones de baja frecuencia) LA lóbulo antenal M1 mezcla de odorantes no relacionados MT neuronas mitrales/en penacho NL neurona local NP neurona de proyección NRO neurona receptora olfatoria NS sin estímulo = control con aire OH mezcla de alcoholes PG interneuronas periglomerulares PCL potencial de campo local RO receptor olfatorio (proteína) SNC sistema nervioso central 12 RESUMEN La experiencia perceptual es una de las herramientas más importantes con que cuentan los organismos para adaptarse a su siempre cambiante entorno. Dentro de los sentidos desarrollados a lo largo de la evolución el sistema olfatorio es de los más antiguos y conservados a través de una gran diversidad de especies. Debido a recientes descubrimientos el sistema olfatorio ha tomado un rol importantísimo en el estudio de los mecanismos que dan cuenta no sólo de la olfacción, sino que de la percepción en general. Especial mención merecen, dentro de estos nuevos paradigmas, las llamadas dinámicas temporales. Bajo este concepto se agrupan una serie de ideas que sostienen que el tiempo es un elemento clave en la codificación de estímulos sensoriales. En el Bulbo Olfatorio (BO) las neuronas Mitrales/Penacho (MT) son un modelo muy interesante debido a que en ellas confluyen la actividad eléctrica del epitelio nasal, la modulación que de esta hace el propio BO y la influencia proveniente de estructuras del encéfalo superior. Las oscilaciones del Potencial de Campo Local (PCL) también son elementos que contribuyen a la percepción olfatoria. Esta señal, generada por poblaciones de neuronas, también posee patrones dinámicos y está estrechamente asociada a la descarga de las MT actuando como coordinador de múltiples elementos individuales. Ambos fenómenos, descargas MT y oscilaciones del PCL, se asocian con un tercer elemento también variable en el tiempo: el ciclo respiratorio. Mucha de la evidencia obtenida como respaldo para la existencia de dinámicas temporales en el sistema olfatorio proviene de estudios en invertebrados y peces, contándose con relativamente pocas experiencias en mamíferos. Esto es relevante puesto que el sistema olfatorio de mamíferos es más complejo. Tampoco existen muchos experimentos que contextualicen las descargas MT y las oscilaciones del PCL con el ciclo respiratorio, siendo que este determina de manera importante la 13 temporalidad de la percepción olfatoria en mamíferos. Esta tesis se abocó al estudio de los patrones de respuesta de células MT y PCL frente a la estimulación con odorantes en ratas anestesiadas. La hipótesis propone que las características temporales de la actividad neuronal son parte de la representación de los estímulos en el BO. Su objetivo principal fue estudiar y caracterizar las propiedades temporales de la actividad individual (single-units) y colectiva (PCL) de ensambles neuronales en el bulbo olfatorio de ratas anestesiadas. No obstante lo planteado en la hipótesis, los registros obtenidos se analizaron en un contexto amplio, teniendo en cuenta parámetros clásicos de la respuesta neuronal, como tasa de descarga, en conjunto con algunas de las dinámicas temporales que presentan mayor evidencia de constituir elementos codificantes de la percepción. Los principales métodos utilizados fueron el registro electrofisiológico mediante tétrodos y los análisis a los que fueron obtenidos dichos registros. En una primera etapa se analizó la respuesta de las MT a la estimulación con especial énfasis en sus propiedades temporales y en el nivel de similitud de la respuesta de neuronas vecinas. En una fase posterior se examinó las descargas MT y oscilaciones del PCL a lo largo del ciclo respiratorio. Al analizar la temporalidad de la descarga se observó que las MT poseen un largo período refractario que permanece incluso durante la respuesta a odorantes. La oscilación individual de las MT es prácticamente nula. Lo mismo ocurre con la sincronía neuronal entre neuronas vecinas, la cual en valores muy pequeños. Interesantemente, al comparar la respuesta de pares de MT vecinas se demostró que cada una de las células posee un espectro de preferencia por odorantes individual que difiere del de neuronas vecinas a pesar de tener una inervación aferente idéntica. En una segunda etapa se evaluó de manera más completa la modulación que ejerce el ciclo respiratorio sobre la descarga MT y las oscilaciones del PCL. La descarga durante el ciclo fue sometida a una transformación vectorial para su análisis. Para cada MT se obtuvo el ángulo y la magnitud de la 14 descarga durante el ciclo. Las MT descargan preferentemente durante la transición espiración/inspiración. La población MT como un todo no mostró variaciones significativas con la estimulación ni entre distintos odorantes. Tampoco hubo diferencias en la distribución de magnitudes significativas ni preferencia de fase. Individualmente las MT mostraron cambios en fase y/o magnitud dependientes de la identidad del estímulo. El PCL fue analizado diferencialmente para sus componentes Beta (β) y Gamma (γ). La actividad Gamma es significativamente mayor al inicio de la espiración. Beta es más frecuente en la mitad de la inspiración. Se observaron distintos patrones de respuestas a la estimulación. Estas consistieron principalmente en aumento de β y disminución de γ. Al igual que para la descarga MT no se pudo observar cambio en el patrón oscilatorio en la respuesta del PCL como un todo, sino más bien variaciones individuales dependientes de la identidad del estímulo. No hubo dos sitios que se comportaran del mismo modo para todos los estímulos. Este trabajo muestra, en primera instancia, que la descarga MT es mucho más diversa y compleja de lo supuesto únicamente por sus aferencias glomerulares. Neuronas vecinas tienen una preferencia por odorantes muy disímil. La actividad oscilatoria y sincrónica es muy baja a este nivel lo que sugiere que no son mecanismos utilizados por el BO o por lo menos no a nivel de vecindad neuronal. Al analizar la modulación que ejerce la respiración sobre la actividad del BO se encontró que la población total se comporta relativamente indiferente a la estimulación. Sin embargo, al hacer un análisis individual se verifican cambios a nivel individual tanto para MT como para las oscilaciones del PCL. En su conjunto este trabajo muestra que la actividad neuronal a nivel de MT y PCL es más compleja que lo mostrado para otras regiones del BO y para otros organismos como invertebrados. Es posible que esa complejidad se utilice para codificar una percepción más diversa y robusta. 15 ABSTRACT Perceptual experience is one of the most important tools on which organisms count to adapt to their ever-changing environment. Among the many senses developed during evolution, the olfactory system is one of the oldest and more conserved along species. Due to recent discoveries, the olfactory system has gained an important role in the study of mechanisms that underlie not only olfaction, but also perception as a whole. Among these new paradigms, temporal dynamics requires special attention. Under this concept several ideas are grouped, all of them states than time is a key element in coding sensory stimuli. In the Olfactory Bulb (OB) Tufted/Mitral neurons (MT) is a very interesting model because their activity results from the convergence of nasal epithelia activity, intrinsic OB modulation over it and encephalic structures influence. Local Field Potential (LFP) oscillations are also elements that contribute to olfactory perception. This signal generated by neuronal populations, also posses dynamics patterns and is closely associated with MT activity acting as a coordinator of multiple individual elements. Both mechanisms, MT firing and LFP oscillations are associated with a third element also variable in time: the respiratory cycle. Much of the evidence supporting the existence of temporal dynamics in the olfactory system comes from studies on invertebrates and fishes with relatively few experiences on mammals. This is not minor because mammal’s olfactory system is far more complex. There’s also lack of experiments that contextualize MT firing and LFP oscillations with the respiratory cycle. This is important in mammals where respiratory cycle determines perception’s temporality. This thesis addressed the study of MT and LFP response patterns to stimulation in anesthetized rats. The hypothesis proposes that neuronal activity’s temporal properties are part of stimuli representation within the OB. Its main objective was to study and 16 characterize temporal properties of individual (single-units) and collective (LFP) activity of neuronal ensembles in the OB of anesthetized rats. Despite hypothesis’ formulation recordings where analyzed in a wide context, taking in account classic neuronal response’s parameters, like firing rate, along with some of the temporal dynamics that are more likely to be elements of perception coding. Methods were electrophysiological recordings using tetrodes and data analysis on those recordings. On a first stage MT response’s to stimulation was studied with emphasis on their temporal properties and similarity of activity among neighboring neurons. Later MT firing and LFP oscillations across respiratory cycled was assessed. MT neurons showed a long refractory/silent period that remains even during response to stimulation. Individual oscillation among MT neurons is almost inexistent. The same is true for synchronic activity between neighboring neurons. Although some synchrony was recorded, its value was very low. Interestingly, when similarity of response among neighboring MT cells was compared little match was found demonstrating that each was one them has an individual receptive range despite they most likely share an identical epithelial input. On a second stage a more complete evaluation analysis over respiratory cycle’s modulation over MT firing and LFP oscillation was performed. Firing within the cycle was transform into a vector for its analysis. For each MT cell angle and magnitude of firing within the cycle were calculated. MT population as a whole did not showed significant variations among events with significant magnitude neither for epochs nor odorants. No differences in distributions of significant magnitudes and for phase preferences. Individually MT cells did show changes in magnitude and/or phase depending in stimulus identity. LFP was analyzed differentially for its Beta (β) and Gamma (γ) components. Gamma activity is significantly larger towards the beginning of expiration. Beta is more frequent in the middle of inspiration. Several LFP patterns were observed in response to stimulation. They were mainly an 17 increase in β and a decrease in γ power. As with MT firing, no changes in LFP oscillation were found when all sites were taken into account. Individual variations depending on stimulus identity were found. There were no sites that exhibited the same patterns for the whole set of stimuli. This works shows that MT firing is far more complex that what is inferred from its glomerular inputs. Neighboring neurons had very different odorant preferences. Individual oscillatory and synchronic activity is very low at this level suggesting that these are not mechanism used in the OB, at least not at this level of neighboring. When respiratory cycle’s modulation is analyzed low effects on MT populations and LFP oscillations is found. Nevertheless individual examination shows that changes could be verified and that they depend on stimulus identity. In summary this works shows that neuronal activity at MT firing and LFP oscillation level is more complex that was has been described for other regions of the OB and for other organisms such as invertebrates. It is possible that this complexity is used to encode a more diverse and robust perception. 18 1. INTRODUCCIÓN 1.1 Sistema olfatorio y percepción La experiencia perceptual es uno de los determinantes en la relación entre un ente y su entorno. Las distintas modalidades sensoriales permiten al individuo interaccionar con su ambiente siempre cambiante y desarrollar las conductas necesarias para su supervivencia. En vertebrados y especialmente en mamíferos el sistema olfatorio es necesario para guiar una serie conductas vitales como son la búsqueda de alimentos, el reconocimiento entre individuos, detección de depredadores, apareo, etc. (Roskies, 1999; Lledo et al., 2005; Leon and Johnson, 2006). El olfato ha evolucionado como una herramienta extremadamente sensible, capaz de detectar concentraciones muy bajas de un sinnúmero de moléculas volátiles (Hu et al., 2007). Además es una percepción precisa, capacitada para distinguir e integrar los distintos componentes (moléculas) de un odorante (Kepecs et al., 2006, 2007) y también robusta, permitiendo el reconocimiento de un estímulo particular en un ambiente lleno de otros odorantes (Porter et al., 2007). Para lograr este nivel de refinación sensorial la olfacción se ha transformado desde la quimo taxis unicelular hacia un complejo sistema compuesto de múltiples elementos y estructuras altamente especializados. Llama la atención que su conformación anatómica parece ser extremadamente conservada a través de las especies (Shipley and Ennis, 1996; Bargmann, 2006). Esta transversalidad se da no solo a nivel de mamíferos (Lledo et al., 2005; Johnson and Leon, 2007), sino que a niveles más inespecíficos como vertebrados (Hamdani el and Doving, 2007) e incluso insectos (Lin et al., 2007). Si bien con mayor controversia, también se ha postulado la idea de un paralelismo que abarque conjuntos de distintos órdenes y clases de animales para los mecanismos 19 fisiológicos que dan cuenta de la percepción olfatoria como un proceso universal (Laurent, 2002). Del mismo modo se ha propuesto una similitud de mecanismos entre las distintas modalidades sensoriales. A partir de este postulado es que muchas de las ideas respecto a la fisiología olfatoria, en especial la codificación de estímulos, provienen de otros sentidos como la visión (Singer and Gray, 1995) y la audición (Wang, 2007). La aplicación de modelos originados en otras modalidades sensoriales se basa, como ya se mencionó, en el supuesto de que los mecanismos fisiológicos de codificación e integración perceptual son universales desde el punto de vista del funcionamiento del Sistema Nervioso Central (SNC). El conocimiento de la organización anatómica en el BO ha avanzado enormemente en el último tiempo. Se conocen en detalle los tipos celulares presentes en el BO (Shipley and Ennis, 1996), su origen embrionario (Gheusi et al., 2000), su organización espacial (Buonviso et al., 1991a), conectividad (Mombaerts, 2006) y un sinnúmero de otras características estructurales. Por otro lado, la fisiología perceptual olfatoria cuenta con mucho menor evidencia. El cómo los elementos celulares interactúan entre sí y con otras partes del SNC para dar cuenta de lo que denominamos olfacción sigue siendo un campo comparativamente menos explorado. Las dinámicas neuronales –no solo el cuánto, sino el cuándo y con quién descargan las neuronashan cobrado gran importancia en los últimos años como mecanismo que da cuenta de fenómenos complejos dentro de los que se incluye la percepción. La transversalidad ya mencionada también ha sido reclamada por los estudiosos de dichas dinámicas. Si bien se ha obtenido una gran cantidad de datos y se han propuesto un gran número de mecanismos integradores, basados a su vez en diversas dinámicas neuronales, la gran mayoría de la evidencia apunta hacia la existencia de al menos tres grandes fenómenos: la convergencia jerárquica, el código poblacional y la correlación temporal. 20 El sistema olfatorio ha sido uno de los modelos preponderantes en los estudios de dinámicas temporales entre neuronas. Su ya mencionada conservación a través de especies, familias, incluso phyla lo ha transformado en un interesante paradigma para el estudio de los mecanismos que posee el sistema nervioso para dar cuenta de la percepción. Obviamente la estructura y sobre todo el número de elementos (tipos celulares) es cada vez más intricada a medida que se trata de especies más complejas (mamíferos versus insectos) pero su organización básica en cada caso conserva la transversalidad señalada. A continuación se hará una reseña de las principales características de la organización anatómica del BO de rata. Posteriormente se revisarán algunos de los principales postulados respecto a cómo el olfato realiza la integración sensorial. Se entiende por integración sensorial la capacidad de agrupar los distintos atributos y componentes de un constructo en una sola representación que lo identifica y diferencia del entorno o de otros estímulos. 1.2 Organización anatómica del sistema olfatorio de mamíferos En mamíferos el sistema olfatorio se inicia en las cavidades nasales, específicamente en el epitelio respiratorio. En esta estructura, bajo una cubierta de mucus, se ubican las neuronas receptoras olfatorias (NRO). Actualmente se sabe que cada NRO expresa un único tipo de proteína receptora (Zou et al., 2001; Mombaerts, 2004, 2006). Cada una de estas proteínas de siete dominios transmembrana (los receptores) es codificada por un gen perteneciente a una súper familia de aprox. 1000 miembros (Buck and Axel, 1991; Buck, 2000). La transducción sensorial está mediada por la activación de una proteína G (Golf) que actúa vía AMP Cíclico (cAMP) para desencadenar una cascada de eventos (dentro de los cuales se cuentan canales activados por nucleótidos) que llevan a la generación de potenciales de acción (Reed et al., 1992; Schild and 21 Restrepo, 1998; Mombaerts, 1999; Ronnett and Moon, 2002). Así la información es transmitida, vía filetes del nervio olfatorio a la primera estación de procesamiento y relevo: el bulbo olfatorio. El BO es una alocorteza que como otras estructuras corticales posee una organización laminar. En el BO es posible reconocer 6 capas en disposición radial. La primera de estas láminas es la capa del nervio olfatorio que contiene los axones de las NRO y células gliales. Los filetes del nervio ingresan a la segunda capa, denominada capa glomerular, donde se ramifican y establecen sinápsis glutamatérgicas con las dendritas apicales de las células mitrales/en penacho(tufted) (MT). Los axones de las NRO y las dendritas de las MT involucrados en dichas sinápsis forman estructuras globulares de 80-160 µm de diámetro denominadas glomérulos. En la figura 1A se observa un esquema de la vía olfatoria periférica desde las proteínas receptoras hasta las eferencias del BO. En la figura 1B se muestra un dibujo representando la organización laminar con especial énfasis en la capa mitral. Se estima que la rata posee cerca de 3000 glomérulos (Buck, 1996). En los últimos años se ha postulado a los glomérulos como las unidades funcionales del BO basándose principalmente en que las NRO que expresan en mismo receptor se proyectan únicamente a dos glomérulos simétricos con respecto al eje céfalo-caudal en cada bulbo olfatorio (Mombaerts et al., 1996; Meister and Bonhoeffer, 2001), que cada glomérulo posee un aislamiento sináptico dado por una gruesa capa de astrocitos que lo rodea y que cada MT recibe aferencias de un único glomérulo (Mori et al., 1983; Kishi et al., 1984). El principal componente celular de la capa glomerular está dado por las neuronas periglomerulares (PG). Las células PG envían la mayoría de sus proyecciones hacia un único glomérulo adyacente. Una menor proporción de sus ramificaciones se dirigen hacia glomérulos vecinos y hacia la capa mitral. Las sinapsis que van en dirección MT→PG son excitatorias mediadas por glutamato (Isaacson, 1999), mientras que las que van en dirección inversa son inhibitorias mediadas por 22 GABA (Schoppa and Urban, 2003). Inmediatamente bajo la capa glomerular se encuentra la capa plexiforme externa. Esta contiene las dendritas secundarias de las MT y de las células granulares (CG). Estas dendritas, que pueden extenderse por hasta 2 mm en forma horizontal, establecen numerosos contactos con las CG. No existe evidencia de conexión sináptica entre MTs. Al igual que con las PG las sinápsis MT↔PG son dendro-dendríticas mediadas por glutamato y GABA (Shipley and Ennis, 1996; Moberg et al., 1999). El rol de estos circuitos inhibitorios (MT↔PG y en especial MT↔CG) es tema de actual debate ya que existen quienes postulan que servirían para sintonizar la especificidad de la respuesta de los glomérulos a los distintos odorantes actuando de manera homóloga a la inhibición lateral descrita en visión (Yokoi et al., 1995), mientras otros proponen que estas interacciones contribuyen a un mecanismo de “reinicio” o “blanqueo” de la actividad temporal permitiendo la formación de nuevos ensambles (Stopfer and Laurent, 1999). La siguiente capa, denominada capa celular o mitral, contiene los cuerpos celulares de estas neuronas. Las células MT son relativamente grandes (25-35 µm) y se ordenan en una monocapa. Como se mencionó anteriormente, las dendritas primarias de las MT contactan un único glomérulo que, por lo general, se ubica inmediatamente encima de sus somas (Buonviso et al., 1991b) mientras que las secundarias establecen miles de sinápsis a lo largo de su extenso recorrido (Margrie et al., 2001). Las MT son las neuronas de proyección del sistema y sus axones se dirigen hacia el BO contralateral, vía núcleo olfatorio anterior, y al SNC llegando al tubérculo olfatorio, la corteza piriforme, la amígdala y la corteza entorrinal (Shipley and Ennis, 1996). 23 A B Bulbo Olfatorio 4. Las señales son transmitidas hacia regiones superiores del Sistema Nervioso Central Célula Mitral Glomérulo NRO 3. Las señales son procesadas en el Bulbo Olfatorio GL Hueso Capa Glomerular Epitelio Nasal Neuronas Receptoras Olfatorias 2. Las Neuronas Receptoras son activadas y envían señales eléctricas PG T(P) Capa Plexiforme Externa M 1. El Odorante se une a su Recetpor Receptor Olfatorio Aire con Moléculas de Odorantes Gr Capa Mitral Capa Plexiforme Interna Capa Granular Tracto Olfatorio Lateral Figura 1. Via olfatoria periférica y organización celular del bulbo olfatorio A. Esquema que representa la vía olfatoria y el flujo sináptico desde la proteína receptora en el epitelio olfatorio hasta el bulbo olfatorio y sistema nervioso central. B Organización histológica del bulbo. Se observan las distintas capas y principales células que las constituyen. NRO: neurona receptora olfatoria; GL: Glomérulo; T(P) célula en penacho o tufted;PG: célula peri-glomerular; M: célula mitral; Gr: célula glomerular. Modificado de www.nobelprize.org (A) y de Mori et al., Science, 286(5540):711-715, 1999 (B). 24 La capa mitral es seguida por la plexiforme interna de bajo contenido celular pero rica en neuropilas tanto granulares como MT. La capa granular contiene los somas de las CG (8-10 µm) que se ordenan en pequeños grupos de distribución lineal interconectados por gap-junctions (Friedman and Strowbridge, 2003; Christie et al., 2005). La región más profunda del BO, denominada zona subependimal, es en estos momentos centro de interés puesto que es el lugar de arribo de neuronas generadas en la región subventricular durante la neurogénesis en el adulto (Gheusi et al., 2000). Las distintas sinápsis, así como los elementos celulares entre los cuales estas ocurren y los neurotransmisores involucrados, se observan en la figura 2. Finalmente el BO recibe eferencia de tres vías centrífugas: Una vía noradrenérgica proveniente del locus coeruleus, una serotoninérgica proveniente del rafe dorsal y una colinérgica que desciende desde el cerebro basal anterior (Shipley and Ennis, 1996). Estas vías eferentes están siendo intensamente estudiadas. Se sabe que algunas de ellas, como la vía serotoninérgica, actúan en distintos niveles (Hardy et al., 2005). Esto incluye al sistema feromonal en el lóbulo antenal de insectos (homólogo al BO) influyendo de manera importante en la conducta de apareo en la polilla del tabaco Manduca sexta (Kloppenburg and Mercer, 2008). En mamíferos se ha demostrado que su acción está ligada a plasticidad sináptica y por lo tanto a procesos complejos como aprendizaje perceptual y memoria (Sullivan et al., 1989; Wilson et al., 2004a). Se sabe que no sólo actúan directamente sobre las neuronas del BO, sino que pueden modular otras sinápsis como las mediadas por dopamina (Pignatelli and Belluzzi, 2008). 1.3 La integración sensorial en el bulbo olfatorio Tal como se mencionó en un principio, los mecanismos que llevan a cabo la compleja integración sensorial que debe realizar el olfato lejos de aceptarse como una problemática resuelta son fuente 25 actual de numerosos estudios y candente controversia. A continuación revisaremos los tres principales mecanismos con los que actualmente se pretende responder a esta interrogante. 1.3.1 Convergencia jerárquica o modelo de línea marcada: Al igual que en la visión uno de los primeros mecanismos propuestos fue el de la convergencia jerárquica. Derivado de, entre otros, los ya clásicos trabajos de Hubel y Wiesel (Hubel and Wiesel, 1968) ella propone que niveles básicos de representación convergen en etapas superiores en estructuras especializadas en procesar atributos u objetos cada vez más complejos (Barlow, 1972; Tanaka, 1993). Un fuerte respaldo a este postulado a nivel olfatorio proviene de la organización anatómica del BO. Son de especial soporte a) la convergencia encontrada a nivel de NRO y b) la organización quimiotópica de la capa glomerular del BO. Estas serán explicadas brevemente. 26 Nervio Olfatorio Carnosina Glu Célula PG GABA DA Enk SP Célula de Axón Corto GABA DA Ach Ach 5HT NA Enk Célula de Axón Corto GABA DA Ach Enk SOM Célula en Penacho Glu/Asp DA SP Célula Granular GABA Enk Ach 5HT Enk LHRH SP Célula Mitral Glu/Asp NAAG Ach 5HT NA Enk GABA Ach 5HT NA DA GABA Glu/Asp SP LHRH Figura 2. Sinápsis y neurotransmisores en el bulbo olfatorio Representación de las células del bulbo olfatorio y las direcciónes de las interacciones sinápticas entre ellas (flechas pequeñas). Además se muestran los neurotransmisores presentes en cada una de ellas. Las flechas gruesas representan las entradas centrígugas hacia el bulbo olfatorioGlu: glutamato; GABA: ácido gamma-amino butírico; DA: Dopamina; Ach: Acetilcolina; NA: noradrenalina; SP. sustancia P; Enk: metionina-encefalina; SOM: samatostatina; 5HT: serotonina; LHRH: hormona liberadora de hormona luteinizante; NAAG: N-acetil-aspartil-glutamato. Modificado de Moberg et al., Neuropsychopharmacology, 21(3):325-340, 1999. 27 a) La convergencia de NRO o la hipótesis “un receptor, una neurona”: Los genes que codifican proteínas receptoras olfatorias (RO) fueron descubiertos en 1991 (Buck and Axel, 1991). Estos genes dan origen a proteínas de siete dominios transmembrana. Análisis geonómicos han supuesto entre 1000 – 1300 genes para RO en el ratón (Zhang and Firestein, 2002; Zhang et al., 2004). Esta es la mayor familia de genes en mamíferos. Un gran número de experimentos que incluyen técnicas como detección de ácidos nucleicos en el epitelio olfatorio (Ressler et al., 1994), marcaje molecular celular y visualización de convergencia axonal (Mombaerts et al., 1996), doble marcaje genético (Lodovichi et al., 2003), etc. han demostrado que cada NRO expresa un único tipo de RO y que eso determinaría que los axones de NRO que expresan el mismo receptor converjan en dos glomérulos por bulbo. Un interesante ejemplo de marcaje genético es el trabajo de Mombaerts et.al, del cual se muestran ejemplos en la figura 3. Nótese la clara convergencia de los axones marcados desde un amplio sector en el epitelio hacía un único glomérulo. En conclusión, evidencia abundante y sólida parece demostrar que las NRO expresan sólo uno de los genes para RO, que el gen expresado, dentro de una gran posibilidad que incluye más de 1000 genes, determina y limita la conectividad a un par de glomérulos por bulbo. Estos hemibulbos serían imágenes especulares entre sí (Lodovichi et al., 2003). La direccionalidad entregada por la expresión de determinado RO resulta en que decenas de miles de células converjan en un único glomérulo (Belluscio et al., 2002) y que por tanto un odorante active uno o unos pocos pares de glomérulos simétricos. 28 A B Glomerulo Glomerulo Axones Axones Epitelio Epitelio Figura 3. Convergencia de axones de neurona receptoras olfatorias (NRO) que expresan una misma proteína receptora Fotografías obtenidas de ratones transgénicos que co-expresan un marcador (taulacZ) junto con una proteína receptora olfatoria determinada. Debido a esta manipulación fue posible observar que todas las neuronas que expresan dicha molécula convergen en un único par de glomérulos en el bulbo olfatorio. Vistas distintas del mismo fenómeno en A y B. Modificado de Mombaerts et al., Cell, 87(4): 675-86, 1996. 29 b) La distribución espacial de los glomérulos o la “quimiotopía” en el bulbo: Durante los últimos años se han realizado numerosos esfuerzos en determinar si existe alguna agrupación funcional en el BO. La mayoría de estos trabajos han sido enfocados a la capa glomerular. Una de las hipótesis que cuenta con mayor evidencia es la que supone que los glomérulos del BO se agrupan en torno a elementos que son sensibles al mismo determinante molecular (Johnson and Leon, 2007). Mucha de la evidencia recogida proviene de estudios de imágenes utilizando diversas metodologías, que incluyen marcación con c-Fos (Guthrie and Gall, 1995), captación de 2deoxiglucosa (Johnson and Leon, 2000b; Johnson et al., 2004), Resonancia Nuclear Magnética funcional (RNMf) (Yang et al., 1998), tinturas sensibles a voltaje (Friedrich and Korsching, 1998; Lam et al., 2000) y análisis de imágenes intrínsecas (Friedrich and Korsching, 1997; Rubin and Katz, 1999) entre otros. Estos trabajos concluyen que los glomérulos individuales estarían asociados en grupos que son sensibles al determinante químico de la molécula percibida por el RO. De esta manera existirían regiones del bulbo sensibles a, por ejemplo, alcoholes, aldehídos, ácidos carboxílicos, etc. Estas regiones estarían segregadas y tendrían muy poca sobreposición entre ellas (Uchida et al., 2000). Variaciones dentro de las regiones estarían construidas a partir de elementos como el largo de la cadena carbonada. La evidencia electrofisiológica es más reducida pero también apunta hacia el supuesto de que neuronas con espectro sensorial similar están ubicadas en grupos discretos (Imamura et al., 1992; Katoh et al., 1993). Ejemplos de las diversas técnicas utilizadas y parte de sus hallazgos están representados en la figura 4. En A se observan grandes regiones en el BO con distinta sensibilidad que se ordenan de manera segregada. Parte de la evidencia electrofisiológica proviene del estudio de regiones con distinta preferencia por determinados aminoácidos. La figura 4B muestra regiones para 3 aminoácidos 30 distintos. En 4C se observa la conservación de estas regiones entre distintos animales y el eje de simetría presente en cada BO. 1.3.2 Código poblacional: El problema de una representación basada en la especificidad de la respuesta a nivel de los glomérulos y MT, además de su limitante combinatorial, es que no parece ser concordante con la naturaleza de la respuesta de las NRO. Las células del epitelio poseen un amplio rango de sensibilidad (Duchamp-Viret et al., 1999). Esta variabilidad estaría determinada por el receptor que expresan. Estas proteínas poseen una alta especificidad frente a ciertos atributos pero a la vez son capaces de responder de forma no selectiva ante otros cambios estructurales moleculares (Araneda et al., 2000). Esta versatilidad en la respuesta es transmitida a las NRO (Duchamp-Viret et al., 1999). Dado que existe ambigüedad en la respuesta de las NRO, es poco probable que se pueda establecer un orden preciso a nivel de los glomérulos. También es conocido que incluso grandes lesiones del BO, con extracción de gran parte de este, no necesariamente determinan incapacidad para percibir odorantes de una naturaleza química dada (Fecteau and Milgram, 2001). Para suplementar los hallazgos a nivel de epitelio y NRO se han realizado experimentos en que es posible observar que la estimulación del epitelio con moléculas de naturaleza conocida produce la activación selectiva de varios glomérulos en distintas regiones (Rubin and Katz, 1999). Dicha activación posee un grado de sobreposición importante para distintos compuestos, en otras palabras, moléculas muy disímiles pueden reclutar el mismo glomérulo. No solo eso, moléculas idénticas como enantiómeros no comparten una población idéntica de glomérulos (Rubin and Katz, 2001). Incluso estudios más recientes han logrado determinar que el espectro sensorial de un glomérulo in vivo es mucho mayor al supuesto por ensayos in vitro (Wilson et al., 2004b). 31 A B % del Largo estandarizado Nucleótidos Sales Biliares % del Largo estandarizado Nervio Olfatorio Dorsal Aminoácidos Nervio Olfatorio Ventral C Rata 1 Rata 2 Rata 3 Eje de Simetría Eje de Simetría Figura 4. Organización quimiotópica en el bulbo olfatorio de vertebrados. Distintas técnicas experimentales han mostrado una organización quimiotópica en la capa glomerular del bulbo olfatorio. A. Región dorsal del BO de rata en la que mediante imágenes intrínsecas e inyecciones de tintura fue posible reconstruir las regiones activadas por ácido pentanoico (rojo) y fenoles (azul). B Vistas dorsal (sup) y ventral (inf) del bulbo olfatorio del pez gato, representado en largo estandarizado, mostrando la ubicación de 178 neuronas obtenidas de 37 peces. Observese como es posible identificar regiones con células que sólo responden a un determinado estímulo. L: lateral; M:medial; C: caudal; R: rostral. C Mapas de respuesta glomerular a aldehídos alifáticos. Resultados en 3 ratas distintas.Cada panel muestra una imagen borrosa del bulbo olfatorio junto con la respuesta para esta seri de estímulos. Cada glomerulo activo está marcado por un circulo y coloreado de acuerdo al largo de la cadena carbonada preferida. Laslíneas punteadas en la tercera rata indican el eje de simetría propuesto. Modificado de Uchida et al., Nat Neurosci., 3(10):1035-43, 2000 (A); de Caprio & Nikonov, J Neurophysiol., 86(4):1869-76, 2001 (B) y Meister & Bonhoeffer, J Neurosci.,15;21(4): 1351-60, 2001 (C). 32 La evidencia señalada ha supuesto la idea de que, al igual que en el sistema visual, la codificación de odorantes está dada no por una o unas pocas células clave, sino por un conjunto de neuronas que actúan simultáneamente (Georgopoulos et al., 1986). Se postula que la construcción de perceptos en el BO utilizaría una representación distribuida o código poblacional, también conocido como código computacional. En otras palabras, los objetos son codificados por un ensamble de neuronas activas. Esta configuración es más robusta que la convergencia jerárquica, puesto que no depende de una célula única, y soluciona el problema combinatorial ya que una neurona puede pertenecer a más de un conjunto o ensamble y por lo tanto codificar más de un atributo u objeto (Vogels, 1990). 1.3.3 Correlación temporal: Si se acepta que la representación se basa en una población de elementos dispersos, es necesario preguntarse a) cómo se agrupan estos elementos y b) de qué manera se logra que un elemento perteneciente a dos o más poblaciones preceptúales no se confunda o fusione dentro de las distintas agrupaciones (perceptos) posibles al representar más de un objeto simultáneamente. Von der Malsburg planteó una solución a estas interrogantes proponiendo que las distintas neuronas que codifican en un momento dado para cierto atributo u objeto sincronizan sus descargas en escala de pocos milisegundos (< 5 ms) (von der Malsburg, 1999). Esta agrupación dinámica permite agrupar neuronas que no necesariamente presentan cercanía espacial, porque no la requiere, y soluciona el problema de la identidad del ensamble al cual pertenece una unidad en un momento dado (Singer, 1999). La escala temporal corta garantiza además sumación temporal entre los elementos sincronizados lo que aumentaría la relevancia de la respuesta del ensamble a nivel post sináptico. La sincronía neuronal ha dado origen a lo que se conoce como hipótesis de la “correlación temporal” (Engel et al., 1990; Singer and Gray, 1995). Evidencia empírica para este postulado en el sistema olfatorio proviene 33 principalmente de trabajos en invertebrados (Getz and Akers, 1994; Laurent and Naraghi, 1994; Laurent, 1996; MacLeod and Laurent, 1996). Distintos grupos han utilizado como paradigma experimental el lóbulo antenal (LA) de insectos (antennal lobe), que es el homólogo al BO de mamífero (Heinbockel et al., 1999; Carlsson et al., 2002). En el LA las MT están representadas por las neuronas de proyección (NP) y las PG y CG por las neuronas locales (NL). Al examinar el patrón de descarga de las NP se observan patrones odorante-específicos de aumento o disminución de la actividad. Durante la respuesta es posible evidenciar descargas sincrónicas entre distintas NP. Por lo tanto la sincronización de las NP es transitoria (Laurent and Naraghi, 1994; MacLeod and Laurent, 1996). Cada odorante, a una concentración dada, activa un ensamble específico de NPs cuyos componentes son reclutados en precisas y algunas veces múltiples etapas de respuesta (Laurent et al., 2001). Estudios realizados en abejas demostraron que la actividad sincrónica del PCL es necesaria para realizar correctamente una tarea de discriminación fina de odorantes (Stopfer et al., 1997). Aunque la correlación temporal exige únicamente actividad coordinada de potenciales de acción, en el último tiempo se ha señalado al potencial de campo local (PCL) como elemento modulador de los primeros (MacLeod and Laurent, 1996). Se ha propuesto que esta señal, que se distribuye por regiones amplias del tejido nervioso (Lam et al., 2000; Varela et al., 2001), actúa como un director de orquesta imprimiendo una temporalidad precisa a una población de neuronas que están siendo estimuladas permitiendo la formación de ensambles sincrónicos transitorios (Friedrich and Laurent, 2001; Wilson and Mainen, 2006). Lo anterior ha sido evidenciado con registros en los que se observa que las descargas de las neuronas están acopladas a la fase de oscilación del PCL (Laurent, 1999). En la figura 5A se observa como neuronas de distintas regiones están acopladas a fases diferentes de la oscilación del PCL. Al eliminar las oscilaciones se pierde la sincronía entre neuronas sin que 34 estas modifiquen sustancialmente su patrón general de descarga. Ejemplo de ello en la figura 5B. Si bien la homologación a vertebrados (Kang and Caprio, 1995) y en especial a mamíferos es válida (Kashiwadani et al., 1999) el sistema olfatorio en estos últimos es más complejo tanto desde el punto de vista estructural como anatómico. Como era de esperar, se ha generado evidencia que sustenta la transmisibilidad de las propiedades del lóbulo antenal al BO (Schoppa, 2006) como también trabajos que discrepan y suponen múltiples niveles de interacción en vertebrados y mamíferos y complican la homologación de mecanismos (Leon and Johnson, 2006). En resumen: los mecanismos de integración sensorial en el sistema olfatorio, en especial de mamíferos, están lejos de ser materia consensuada. Muy poco se sabe de la actividad de los elementos celulares intrínsecos y en especial de las neuronas MT que son quienes transfieren la actividad generada en el BO al encéfalo. Es por eso que este estudio intenta dar luces respecto a cómo operan estos mecanismos en el BO de rata. Enfocándose en la actividad de las células MT y a partir de ella propone mecanismos que dan cuenta, en parte al menos, del cómo el olfato genera e integra la actividad sensorial generada como consecuencia de la estimulación olfatoria. 35 Control PCL A B Picrotoxina C NPs ICLs Tiempo (s) Probabilidad de Descarga PCL CKs Desfase de Tiempo (ms) Desfase de Tiempo (ms) Figura 5. Acoplamiento de las descargas de neuronas a la oscilación del potencial de campo local. A. Las neuronas de distintas regiones del lobulo antenal de insectos están acopladas a distintas fases en la oscilación del potencial de campo local. PCL: potencial de campo local; NP: neuronas de proyección; ICLs: interneuronas del cuerno lateral; CKs: células de Kenyon. B La descarga de las neuronas en el lóbulo antenal (PNs) es oscilatoria y está correlacionada con la oscilación del potencial de campo. De arriba abajo se muestran el registro del potencial de campo, el registro intracelular y un autocorrelograma de las PNs en el tiempo. En C se muestra la perdida de ritmicidad al agregar picrotoxina que elimina las oscilaciones. Nótese que el patrón de descarga es similar en ambas condiciones. Modificado de Laurent, Nat Rev Neurosci., 3(11):884-95, 2002(A) y Laurent et al., Nature, 390(6655):70-4, 1997(B). 36 1.4 Integración y respiración Quizás como ningún otro sistema sensorial, el olfato posee un momento preciso en que se realiza el muestreo del medio ambiente: la inspiración. Ya en los antiguos trabajos de Adrian, basados en electroencefalograma, mostraban que la actividad intrínseca del BO está fuertemente modulada por el ciclo respiratorio (Adrian, 1950). Estudios más recientes teniendo como referencia las oscilaciones del PCL o la actividad neuronal única corroboran esta fuerte conexión (Buonviso et al., 2003; Buonviso et al., 2006). Aunque la respiración ocurre a frecuencias relativamente bajas, el sistema olfatorio es extremadamente rápido y preciso en la detección y reconocimiento de estímulos (Kepecs et al., 2007). La identificación puede llevarse a cabo en sólo un ciclo respiratorio (Uchida and Mainen, 2003). Una parte importante de este proceso de detección, identificación y representación ocurre en el BO. Numerosos experimentos demuestran que la estimulación del epitelio produce una modulación en la actividad de las células MT. El ciclo respiratorio genera complejos patrones dinámicos (Macrides and Chorover, 1972), como sincronía neuronal (Kashiwadani et al., 1999), que no necesariamente van acompañados de una aumento en la tasa de descarga de las neuronas (Meredith, 1986). También es conocido el hecho que esta misma estimulación puede llevar a cambios en las oscilaciones del PCL (Gray and Skinner, 1988). Dentro de las diversas bandas de frecuencia, especial atención han cobrado la banda Beta (β) y la banda Gamma (γ) debido a estudios que han asociado la actividad oscilatoria del PCL dentro del BO con distintas etapas del procesamiento. Específicamente la banda Gamma con la detección del estímulo (Kay and Freeman, 1998; Neville and Haberly, 2003; Ravel et al., 2003; Martin et al., 2004a) y la banda Beta con el reconocimiento de este (Gheusi et al., 2000; Nusser et al., 2001; Ravel et al., 2003; Fletcher et al., 2005; Martin et al., 2006). Los estímulos olfatorios son prácticamente infinitos y el sistema es capaz de percibir decenas de miles de 37 distintos odorantes (Laurent, 1999; Mori et al., 1999). Un ejemplo de esta modulación se resume en la figura 6. En la columna se muestra diversos patrones de descarga en tres capas o regiones del BO y la figura de la derecha resume la actividad (potenciales de acción) de las distintas capas así como las dinámicas oscilatorias del PCL. Nótese como la banda β y γ aparecen en distintos momentos del ciclo respiratorio. Es así que, a la luz de los experimentos señalados anteriormente, sea coherente pensar que cambios en los patrones dinámicos de la actividad neuronal, ya sea descarga MT y/o oscilaciones del PCL, producidos dentro de cada ciclo respiratorio puedan ser utilizados por el sistema olfatorio como mecanismos de codificación de los estímulos (Spors and Grinvald, 2002; Duchamp-Viret et al., 2005). Es para eso necesario medir la actividad dentro de cada ciclo y evaluar eventuales cambios. Estos cambios no necesariamente involucran únicamente un aumento en la cantidad de repuesta (tasa de disparo en caso de las MT y/o poder espectral en el caso del PCL) (Buonviso et al., 2006; Roux et al., 2006). Es necesario, por lo tanto, buscar modificaciones en los patrones temporales de la aparición/desaparición de la descarga durante el ciclo y/o en el tipo de frecuencia (β o γ) del PCL durante la respiración. Finalmente cabe recalcar que la codificación de los estímulos en el BO ha generado numerosas hipótesis respecto a los mecanismos que dan cuenta de estos fenómenos. Los 3 grandes supuestos mencionados –correlación temporal, código poblacional y correlación temporal- han basado muchos de sus postulados en conocimientos previos de otros sistemas sensoriales, pero su transposición al olfato requería al momento de formular este proyecto (y aún requiere), estudiar estos fenómenos en este sistema. 38 90° PI 180° MIT GL1 GL2 γ 0/360° β PI / GR 270° PRE ODO POST PE MIT PRE ODO POST PRE ODO POST GL1 Figura 6. La descarga de las neuronas y las oscilaciones del PCL están moduladas por la respiración. En el panel de la izquierda es posible observar ejemplos de patrones de descarga de las neuronas en las distintas capas del bulbo olfatorio previo, durante y posteriormente a la presentación de odorantes (señaladas a la izquierda de cada figura). La señal respiratoria promedio está superimpuesta. Inhalación: línea delgada; exhalación: línea gruesa. A la derecha se observa el vector promedio de la fase como función del ciclo respiratorio. Se muestra la actividad de las distintas neuronas bulbares (flechas sólidas) junto con el vector para β y γ (flechas punteadas). Las zonas grises corresponden a 2 DS. La transisión I/E está localizada en los 0/360°.GL1: capa glomerular superficial; GL2: capa glomerular profunda; PE: capa plexiforme externa; MIT: capa mitral; PI/GR: capa plexiforme interna/granular. 39 Es necesario señalar que muchos de los experimentos realizados, y de los cuales se han obtenido las diversas hipótesis, se han llevado a cabo con técnicas histológicas o genéticas, pero no fisiológicas ni funcionales. Es más, muchas de las técnicas funcionales, se basan en metodologías que permiten visualizar o registrar la actividad en la capa glomerular del BO, habiendo pocos trabajos que analicen la actividad intrínseca de este y de sus elemento de salida, es decir las MT. En esta tesis se estudiaron neuronas MT en ratas anestesiadas a fin de establecer diversas características de su descarga. Especial énfasis se puso en las propiedades temporales de dicha actividad o descarga puesto que estas son propuestas como mecanismo de integración sensorial. En esta perspectiva se estudian no solo las descargas de neuronas individuales, sino de grupos de neuronas cercanas. Se describieron parámetros relacionados con la dinámica como son la sincronía y actividad oscilatoria. Del mismo, modo se establecieron relaciones entre las propiedades de descarga y oscilaciones del PCL con la respiración en el entendido que los patrones dinámicos mencionados y su asociación con el ciclo respiratorio proveen otro elemento codificante que es, a su vez, también variable en el tiempo. 40 2 HIPÓTESIS DE TRABAJO Las propiedades temporales de la actividad neuronal en el Bulbo Olfatorio son utilizadas en la representación de estímulos odorantes. Esto se verifica por la existencia de descargas sincrónicas entre las células mitrales y por la presencia de oscilaciones frecuencia-especifica en el potencial de campo local, durante la respuesta a odorantes. A una mayor escala, ambos fenómenos (sincronía neuronal y oscilaciones del PCL) son modulados por efecto del ciclo respiratorio. Siendo estas propiedades temporales parte de un mecanismo de representación, deberá observarse que éstas varían de acuerdo a la identidad de los estímulos olfatorios. 41 3 OBJETIVOS Objetivo General Estudiar las propiedades temporales de la actividad individual (single-units) y colectiva (PCL) de ensambles neuronales en el bulbo olfatorio de ratas anestesiadas durante la exposición a odorantes. Objetivos Específicos 1. Analizar las características de la descarga de poblaciones de células mitrales durante la exposición a diferentes estímulos: 1.1 Establecer propiedades cuantitativas (variaciones en la tasa de descarga). 1.2 Determinar aspectos cualitativos de la respuesta (preferencia por uno o más estímulos). 1.3 Estudiar las propiedades temporales individuales (autocorrelación) como interneuronales (crosscorrelación o correlación cruzada). 2. Caracterizar la respuesta de neuronas MT vecinas y determinar si su organización funcional se corresponde con la descrita previamente para otras estructuras del BO, en especial con la de la capa glomerular. 3. Estudiar el posible rol modulador de la respiración en la actividad neuronal del BO. 3.1 Determinar propiedades de la descarga MT que sean susceptibles de ser modificadas por la respiración. 3.2 Determinar propiedades de la oscilación del PCL que sean susceptibles de ser modificadas por la respiración. 3.3 Establecer las modificaciones que genera la estimulación sobre dichas propiedades 3.4 Desarrollar métodos de análisis que permitan cuantificar y comparar las propiedades mencionadas y sus modificaciones. 43 4. MATERIALES Y MÉTODOS Los resultados obtenidos en esta tesis se lograron mediante la adquisición de señales biológicas a través del registro electrofisiológico en el bulbo olfatorio de ratas anestesiadas y el posterior análisis matemático-computacional de dichas señales. A continuación se describen en detalle estas etapas. 4.1 Animales y procedimientos quirúrgicos 4.1.1 Animales: El modelo utilizado fue el BO de rata. Se usaron animales adultos de la cepa Sprague-Dawley (250-450 gr) obtenidos del bioterio de la facultad. Los animales fueron mantenidos en ciclo luz : oscuridad 12 : 12 y tuvieron acceso a agua y alimento ad limitum hasta la noche anterior al experimento. En ese momento se les restringió el alimento para disminuir la posibilidad de regurgitación y aspiración de comida con la anestesia. Se utilizaron machos y hembras indistintamente puesto que experimentos iniciales no demostraron diferencias entre sexos. El manejo pre, intra y post quirúrgico fue llevado a cabo según protocolos publicados en “Preparation and maintenance of higher animals during neuroscience experiments” publicado por el National Institute of Health (NIH, Maryland, USA), Nº 94-3207 y acordes con el Protocolo CBA #0154 de la Facultad de Medicina de la Universidad de Chile. Se realizaron máximos esfuerzos en orden a utilizar el mínimo de animales y minimizar el sufrimiento de estos. 4.1.2 Cirugía: Los animales fueron retirados de sus jaulas y pesados el día del procedimiento. Se indujo anestesia con una inyección de ketamina (50 mg/kg IP) y acepromazina (0,75 mg/kg Intraperitoneal, IP). Conjuntamente se administró atropina (0,04 mg/kg, Intramuscular, IM) para reducir la salivación y secreciones bronquiales. Para la anestesia profunda se eligió Uretano (1- 44 1,5 gr/kg IP) ya que proporciona, en dichas dosis, buenos niveles de anestesia por periodos superiores 5 hrs. Cuando el nivel de anestesia inicial no fue el adecuado o cuando se requirieron dosis de refuerzo, se aplicó una dosis de Uretano correspondiente a un 10% de la dosis inicial. Nótese que se utilizó Ketamina una única vez durante el experimento, esto es durante la inducción inicial. A lo largo todo el procedimiento se monitorizó electrocardiograma (ECG), frecuencia cardiaca y temperatura corporal vía termómetro rectal. Para evitar hipotermia se utilizó indistintamente una manta termoeléctrica o una bolsa de agua tibia. Cuando la profundidad anestésica era la adecuada, el animal se colocaba en un aparato estereotáxico. La cirugía propiamente tal consistía en una incisión medio-sagital de aprox. 5cm de largo entre la región occipital y la punta del hocico. De esta manera se lograba exponer el cráneo en donde, con la ayuda de una fresa neumática, se realizó una craneotomía. Normalmente esta exponía uno o ambos bulbos completamente. De esta manera los electrodos podían penetrar toda la superficie dorsal de uno de los BO. Especial cuidado se ponía en no perforar el macizo facial y comunicar la cavidad craneana con los senos paranasales. De la misma manera siempre se verificaba que el registro no se realizara sobre el BO accesorio ubicado en la región supero-caudal de la craneotomía. La duramadre fue abierta con una incisión y se expuso el parénquima donde fueron insertados los tétrodos. El electrodo a tierra fue colocado en los músculos adyacentes a la incisión (nuca). Una vez finalizado el experimento se colocaba una sobredosis de Tiopental IP para eutanizar al animal. 45 4.2 Estimulación con odorantes. Naturaleza química de los estímulos: Uno de los aspectos relevantes que este proyecto buscó dilucidar es si la organización quimiotópica propuesta para la capa glomerular es transmitida hacia la neuronas MT o, dicho de otra manera, si las célula mitrales también están agrupadas en módulos funcionales. Para lo anterior fue necesario la activación selectiva de glomérulos agrupados en distintas regiones. La utilización de mezclas en vez de odorantes puros o únicos buscó maximizar la respuesta entre estas poblaciones de glomérulos. Es por esto que los estímulos fueron agrupados en mezclas de sustancias de una misma naturaleza química. Experiencias realizadas previamente a la formulación del proyecto demostraron que la estimulación con un único odorante es sustantivamente menos eficaz que la obtenida con mezclas. Si bien es razonable pensar que la utilización de una mezcla puede evocar actividad distinta a la suma de sus componentes debido a interacciones químicas entre los compuestos, poblaciones de NRO reclutadas, actividad diferencial de glomérulos y/o circuito intrabulbar, experimentos realizados en invertebrados (Getz and Akers, 1994; Galizia et al., 2000), peces (Kang and Caprio, 1997) y ratas (Giraudet et al., 2002) han demostrado que en la gran mayoría de los casos la respuesta a una mezcla evocada tanto nivel de glomérulos como de neuronas MT es predecible a partir de la respuesta obtenida para cada uno de los componentes. Esta linealidad, junto con lo conservada que parece ser la representación de odorantes entre individuos (Uchida et al., 2000; Uchida and Mainen, 2003) hace suponer con propiedad que el efecto de una mezcla es más bien aditivo y restringido a la zona codificante para el grupo principal. Los odorantes ocupados son representantes de algunas de las supuestas regiones glomerulares codificantes. Típicamente se utilizaron 4 o 5 estímulos más una ronda de aire purificado (AGA, Santiago, Chile) como control. Cada estímulo estaba compuesto de entre 2 a 5 compuestos químicamente 46 relacionados. También se utilizó una mezcla de compuestos no relacionados que poseen una gran representación a nivel glomerular (ver fig. 4 y fig. 1) Los estímulos consistieron en: Alcoholes (1-propanol, 1-butanol, 1-pentanol, 1-hexanol y 1- heptanol), Ácidos Carboxílicos (ac. propiónico, ac. butírico, ac. pentanoico, ac. hexanóico y ac. heptanóico), Aldehidos (propionaldehido, butiraldehido, pental, hexanal y heptanal), Cetonas (2-hexanona y 3-hexanona) y la Mezcla (R-(+)-carvone, R-(-)-carvone y Isoamilacetato). 4.3 Entrega de los estímulos y protocolo de estimulación: La estimulación fue efectuada utilizando un olfactómetro construido en el laboratorio. Este consistió en una serie de válvulas y mangueras que permiten el paso selectivo de un flujo de aire por tubos de plástico que contienen los odorantes. El flujo de aire sintético fue mantenido constante por medio de un flujómetro. Se utilizó un flujo de 3 L/min. Los tubos convergieron en un embudo colocado frente a la nariz del animal. Para la administración de un pulso de odorante se cierra la válvula del tubo 1 (sin odorante) y se abre simultáneamente la válvula de un tubo con odorante, desviando así el flujo de aire hacia éste último. El flujo arrastra el aire dentro del tubo, obteniéndose en la salida del olfactómetro un pulso de aire saturado con el odorante. El olfactómetro fue controlado digitalmente por un programa computacional especialmente diseñado escrito en lenguaje C utilizando LabWindows CVI (National Instruments, Austin, TX, USA). Un esquema del montaje experimental se muestra en la figura 7. El protocolo experimental utilizado fue el siguiente: 2 segundos de aire, 4 segundos de estímulo, 4 segundos de aire post-estímulo y 5 segundos entre ensayos. Las 3 etapas, aire, estímulo y aire post-estímulo, fueron designadas como PRE, STIM y POST. Con esta nomenclatura se referirá a ellas a partir de ahora. 47 Flujómetro 3 L/min Aire Seco Válvula Selenoide Aire Húmedo On / Off On / Off On / Off On / Off On / Off Embudo On / Off Od Od Od C Od H 20 Od Humidificador de Aire A Animal Anestesiado Figura 7. Entrega automatizada de los distintos estímulos durante los experimentos. Esquematización de la preparación experimental y la entrega de estímulos. El aire purificado fue primeramete humidificado en agua destilada. El flujo hacia las válvulas fue controlado por un flujómetro y fijado en 3 L/min. El aire ingresaba a tubos de plástico con los distintos estímulos. La salida de cada tubo estaba adjunta a una válvula selenoide controlada por computador. Sólamente una válvula está abierta durante la estimulación entregando una única mezcla de compuestos que se dirigía hacia el embudo colocado enfrente del animal. A: aire; C: craneotomía; H2O: agua destilada. 48 Esta temporalidad permitió establecer diferencias entre el estado basal y variaciones que se pudieron producir tanto durante la presentación del estímulo como en la etapa posterior (ej. respuesta off). Los estímulos fueron presentados en forma secuencial para evitar una estimulación repetida con el mismo odorante y una potencial desensibilización de receptores y/o estructuras del BO. Se realizaron entre 10-25 repeticiones de cada estímulo, típicamente 15. 4.4 Registros electrofisiológicos y adquisición de datos. 4.4.1 Electrodos: Se utilizaron electrodos tipo tétrodo. Cada tétrodo consiste, básicamente, en cuatro alambres enrollados entre sí. Esta configuración permite una muy buena discriminación entre señales eléctricas adyacentes (Gray et al., 1995). En otras palabras, facilita la detección de unidades individuales (single-units) cercanas. Además permite el registro simultáneo de la actividad del PCL. Los tétrodos utilizados en el trabajo experimental fueron de 2 tipos: construidos en el laboratorio y comerciales. Para la fabricación de los tétrodos en el laboratorio se utilizó cable de Nicron (Nichrome) de 12 µm de diámetro que posee una cubierta aislante de poliamida (H. P. Reid Palm Coast, Florida, 32164, US). Inicialmente se obtienen dos trozos de ± 28 cm de longitud que son colocados en una barra de metal sobre un batidor magnético, los extremos colgantes son tensados delicadamente (para asegurar un enrollamiento parejo de los hilos) y colocados en una pinza de metal a la cual posteriormente se le agrega un clip de acero. Utilizando el batidor magnético es posible enrollar los 4 hilos colgantes sobre si mismos para obtener un cable de 25-30 µm de diámetro, de ± 12 cm de largo y cuyos extremos proximales están separados. Luego, con el fin de mantener esta configuración y aumentar la rigidez, se calienta la cobertura aislante del cable colgante de modo que se funda y adhiera los alambres entre si. Es necesario hacer notar que no debe utilizarse demasiado calor pues se corre el riesgo 49 de eliminar el aislante de uno o más hilos lo que provocaría un cortocircuito o permitiría la entrada de corriente por otro lugar que no sea la punta. Utilizando un pequeño soldador (Portasol P-1K®, Coopertools) a potencia media, que se moviliza a 1 cm del tétrodo en sentido de su eje longitudinal, se logra el efecto deseado. Luego el cable es retirado del batidor y sus extremos proximales no fundidos en U son cortados para obtener cuatro hilos. Estos son sostenidos con una pinza de manera tal que extremos de ± 5 mm quedan libres y son expuestos a una pequeña llama por 1-2 seg. con el fin de remover la cubierta aislante. La pinza actúa como disipador evitando que el calor se propague hacia distal quemando más aislante del deseado. Los extremos libres así obtenidos son adheridos a un conector de 4 puntas. Se utilizan trozos de cilindros de poliamida de 36 mils (milésima de pulgada) (Advanced Polymers, Salem, NH, USA) que son llenados por capilaridad con soldadura líquida (Quick Grid®, Loctite) insertando por uno de sus extremos uno de los puntas del conector y por el otro la punta no aislada de un cable del tétrodo. Luego de conectado los 4 hilos, se procede a comprobar la indemnidad eléctrica de cada uno de ellos haciendo pasar un pulso de corriente que va desde el conector al extremo distal el cual está sumergido en una solución salina al 0,9%. También se comprueba que no exista cortocircuito entre los alambres al confirmar que no exista paso de corriente de un conector a otro. El cable trenzado se recubre con un tubo metálico (0,010’’ DEX; 0,005’’ DI; HTX-33-24; Small Parts, Miami Lake, FL, USA). La punta remanente fue cortada del largo deseado (5-10 mm), redondeada utilizando un esmeril pequeño y sellada al tubo metálico agregando pegamento a base de metacrilato (Loctite). Finalmente la impedancia de cada uno de los canales (alambres) es ajustada mediante electro-reducción o “dorado” utilizando solución de Aurocianuro (Au(CN)2-). Para este trabajo se utilizaron impedancias de 1-3 MΩ. Los tétrodos comerciales utilizados fueron tipo “Michigan” (Neuronexus Technologies®, Ann Arbor, MI, USA) en configuraciones 50 4x1 y 2x2. Esto último señala el número de peines y el número de tétrodos por peine. En el primer caso corresponde a 4 peines con un tétrodo en cada uno (4 canales). La segunda equivale a 2 peines con 2 tétrodos cada uno (8 canales). La impedancia de estos electrodos era ajustada de fábrica, que fluctuó entre 1-3 MΩ. Los distintos tétrodos utilizados se muestran en la figura 8. 4.4.2 Digitalización: Las señales neuronales obtenidas fueron amplificadas en 2 etapas. La primera o “headstage” consistía en un amplificador de baja ganancia (10X) colocado cerca de la cabeza del animal. Esta señal era transmitida a un amplificador que aumentaba la ganancia (1000X para un total de 10K) y filtrada para obtener el componente de baja frecuencia (1-300 Hz), es decir PCL, y el de alta frecuencia (espigas 300-5kHz). Ambos espectros fueron digitalizados (3 kHz para PCL y 25 kHz para espigas) y almacenadas como archivos binarios en computadores dotados de tarjetas conversoras análogo–digitales (PCI 6071E, National Instruments) para su reconstrucción y análisis posterior. Un proceso similar se realizó con la respiración, que fue medida con una termocupla colocada inmediatamente por fuera de las narinas del animal. La señal de la termocupla fue filtrada (0,1-10Hz) y digitalizada a 100 Hz. El proceso de adquisición y coordinación entre los distintos computadores que registraban las señales fue controlado mediante un programa computacional especialmente diseñado para estos efectos y escrito en lenguaje C. 51 A B C 12.9 mm D 94 mm 3 mm 3 mm 51mm 80 mm 150 mm 83 mm 80 mm 150 mm 150 mm 3.5 mm 177 mm2 25 mm 177 mm2 25 mm 83 mm Figura 8. Fotografías y esquemas de los tipos de tétrodos utilizados. Los distintos tipos de tétrodos utilizados en el proyecto. En A se muestran fotografías electrónicas de barrido de un tétrodo fabricado en el laboratorio. Se visualizan claramente los cuatro alambres, su cubierta aislante de poliamida y sus puntas desnudas y cercanas. B Fotografía y dimensiones del circuito impreso de un tétrodo tipo michigan. C Esquema y dimensiones de una configuración 4x1. D Lo mismo que en C, pero en configuración 2x2. Fotografías gentilmente proporcionadas por el Dr. Pedro Maldonado (A). Modificado de www.neuronexustech.com (B-D) 52 4.5 Análisis de los datos 4.5.1 Extracción de espigas e identificación de unidades aisladas: Este procedimiento se realizó en dos etapas ocupando algoritmos y programas computacionales distintos pero complementarios. La extracción de espigas desde los registros obtenidos del bulbo se realizó con un programa que permitía el almacenamiento de las 4 ondas percibidas por los distintos canales cada vez que una de ellas superaba el umbral previamente definido para dicho canal (normalmente 2 a 3 veces el ruido). Junto con la información respecto a la forma de onda (32 puntos) se almacenaba su tiempo de ocurrencia. Completado este primer paso se procedía a traspasar la información así obtenida a una plataforma Sun (Sun Microsystems, Santa Clara, CL, USA) sobre la cual se ejecutaba un programa específicamente diseñado en el laboratorio para la identificación de unidades aisladas (Tetrode Wave Sorter v5.1 y v6.0) (Maldonado and Gray, 1996). Este puede computar los siguientes parámetros para cada espiga en cada canal: pico de amplitud positiva, pico de amplitud negativa, amplitud pico-a-pico, ancho de la onda (definido como la diferencia de tiempo entre pico positivo y negativo), componentes principales y tiempo de ocurrencia. La figura 9 corresponde a un dibujo que muestra algunos de los parámetros y cómo se calculan. El programa permite fabricar gráficos 2D comparando estas variables en los distintos canales representando cada espiga como un punto. De este modo es posible aislar nubes de espigas gracias a que neuronas separadas no van a tener una misma razón de parámetro medido (ancho, pico-a-pico, etc.) en los cuatro canales y se representarán como nubes discretas en a lo menos una combinación. Por el contrario, si los datos corresponden a una misma neurona o a registro multi-unitario, la proporción en los 4 canales se mantendrá constante y aparecerá en la pantalla como una nube única. 53 Pico positivo Punto de alineamiento Umbral de detección Ancho Pico a pico Pico negativo Tiempo al pico Ventana de muestreo (32 puntos) Figura 9. Principales parámetros que determinan la forma de una onda Dibujo de una potencial de acción extracelular típico y los elementos que determinan su forma. Dado que la descarga de cada neurona es esterotipada, las espigas de una célula determinada mantienen sus parámetros en cada disparo. Esta caracteristica permite diferenciar potenciales de acción generados por distintas neuronas. El punto de alineación corresponde al primer valor que supera el umbral de detección (rojo). 54 El programa permite, también, la visualización de la forma de las espigas (onda de 32 puntos) circunscritas en una nube junto con el promedio y desviación standard de dicha representación de modo que espigas de una misma neurona tenderán a ser constantes en el tiempo y por consiguiente se representarán como una onda uniforme con poca desviación standard. Lo contrario acaece en caso de corresponder a neuronas distintas o registros multi-unitarios. Es así como espigas provenientes de neuronas distintas son vistas como nubes de color distinto, cada una de las cuales contiene ondas uniformes. Las distintas descargas de una neurona dada, representadas por una nube de un color determinado, fueron almacenadas en archivos de texto que contenían la identidad de la neurona y el tiempo de descarga en precisión de décimas de milisegundo (10-4 seg.). 4.5.2 Calculo de tasa de descarga y efectos gatillados por la estimulación: La tasa de descarga se calculó utilizando bines de 500 ms durante cada época (PRE, STIM y POST). Estos bines de relativa larga duración permitieron incluir neuronas con baja tasa de descarga espontánea. Además se calcularon la descarga en el tiempo de cada neurona (raster), las tasas instantáneas de descarga, típicamente con una ventana de ± 50 ms, autocorrelogramas, correlogramas cruzados e histogramas peri-estímulo. Para eso se desarrollaron programas computacionales escritos en lenguaje C (LabWindows CVI, National Instruments, Austin, TX, USA) y/o en MATLAB (Mathworks, Natick, MA, USA). Se consideraron respuestas excitatorias o inhibitorias, ya sea durante las épocas STIM y/o POST, cuando el promedio de descarga de una neurona dada excedía o caía bajo los niveles de significancia calculados para dicha neurona durante PRE. Este nivel de significancia quedó determinado por el promedio ± 2 desviaciones standard (DS) de la tasa de descarga en PRE para dicha célula. 55 4.5.3 Cálculo de respuesta de neuronas vecinas: Para comparar la similiradidad de respuesta entre neuronas MT vecinas se utilizaron los promedios de respuesta de cada MT durante las tres diferentes épocas. Las variaciones en los promedios durante o después de la estimulación fueron evaluadas utilizando la siguiente fórmula: si o si (1) En ella XS es la descarga promedio durante STIM o POST y XA representa el promedio en PRE. De esta manera, y a modo de ejemplo, si una célula duplica su descarga su radio de aumento será 1. De la misma manera si una célula disminuye su descarga a la mitad, se le asignará el valor -1. Utilizando los valores obtenidos se construyeron gráficos 2D en los cuales cada punto representa las variaciones de respuesta de un par de neuronas de las cuales una al menos varió significativamente su descarga. Cada neurona está asimilada a uno de los ejes (X e Y). Al superponer los distintos puntos se puede comparar la variación en la tasa de descarga de un gran número de pares de neuronas simultáneamente. Para estimar la respuesta poblacional se realizó una regresión lineal de los puntos obtenidos. En una situación ideal en que en todos los pares de neuronas ambos componentes hayan variado su tasa en la misma magnitud, el resultado de tal regresión sería una diagonal de valor 1. 4.5.4 Cálculo de autocorrelogramas y correlogramas cruzados: Debido a que se ha propuesto que las propiedades temporales de la descarga de las MT son utilizadas en el código olfatorio(Laurent, 1999), se estimó la ritmicidad de las neuronas registradas mediante el cálculo del poder espectral del autocorrelograma de cada MT. La ventana de cada autocorrelograma fue de ± 128 ms y el rango de frecuencia estudiado fue 20-100 Hz. La significancia estadística de los 56 valores obtenidos para el poder espectral fue calculada utilizando una simulación de MonteCarlo. Para este procedimiento se generó un tren de espiga pseudo-azaroso (simulado) por para cada conjunto de datos registrados en cada época y ensayo. Cada tren simulado, que contenía el mismo número de descargas que el original, fue construido extrayendo azarosamente espigas desde un pool generado a partir de una distribución con uniformidad y periodo silente (intervalo inter-espigas) idéntico al tren registrado. Se calcularon autocorrelogramas y su correspondiente espectro de poder para cada tren simulado y se extrajo el valor mayor (pico) de cada espectro entre 20-100 Hz(Gray and Viana Di Prisco, 1997). Para los autocorrelogramas las simulaciones se realizaron 500 veces y cualquier valor registrado (experimental) fue considerado significativo si superaba el 99% de los valores generados con la simulación (valor de corte)(Friedman-Hill et al., 2000; Maldonado et al., 2000). Un método similar fue utilizado para medir la actividad sincrónica entre neuronas MT vecinas. Para esto la región central del correlograma cruzado medido fue comparada contra la misma región de un correlograma cruzado pseudo-azaroso generado a partir de trenes de espigas con idéntico número de descargas, intervalo inter-espigas, tasa promedio de descarga y duración que los datos experimentales. El valor de corte para está medición también se fijó en 99%. 4.5.5 Cálculo inicial de la descarga de neuronas MT durante el ciclo respiratorio: Dado que las células MT presentan una fuerte modulación en su descarga dada por el ciclo respiratorio, se construyeron histogramas peri-estímulo alrededor de un ciclo respiratorio. Se calculó el ciclo respiratorio promedio para cada época en cada ensayo y se homologó a una señal sinusoidal de 360º. De esta manera 90º correspondieron al final de la exhalación y 270º al final de la inhalación. El punto medio de estos histogramas fue el punto central de la fase inhalatoria. Se construyeron histogramas de intervalos (bin) de 20 ms para cada célula y los picos significativos 57 (considerados como promedio ± 2 DS del promedio de los intervalos) fueron asignados a una de las 4 regiones para cada ciclo. Para esto los ciclos fueron arbitrariamente divididos en 4 etapas: 90, 180, 270 y 0/360º 4.5.6 Cálculo vectorizado de la descarga de neuronas MT durante el ciclo respiratorio: En una etapa posterior se desarrolló un método analítico para la descripción y medición de la respuesta de las células MT durante el ciclo respiratorio. Este consistió en la vectorización de la descarga de cada neurona durante el ciclo respiratorio. Si bien existen reportes previos de metodologías similares en otros sistemas sensoriales (Goldberg and Brown, 1969), incluso en el mismo sistema olfatorio (Buonviso et al., 1992), se decidió generar una metodología propia que permitiera adaptarse de mejor manera a la naturaleza de los datos. Inicialmente la señal de la termocupla fue filtrada digitalmente (filtro pasa-bajo de 7 Hz) con un método que evitara un cambio de fase de la señal. Esto se logró pasando la señal por el filtro, invirtiéndola, filtrándola invertida y luego restaurando su posición original. De ella se extrajeron los ciclos respiratorios. Estos fueron homologados a una señal sinusoidal y divididos en 18 intervalos de 20º (0,349 radianes) cada uno. Las descargas de las distintas neuronas MT presentes en el registro durante cada ciclo respiratorio fueron utilizadas para construir histogramas de 18 intervalos. De esta manera cada intervalo representa la descarga de una neurona durante un período de 20º del ciclo respiratorio. Fueron eliminados los ciclos incompletos y aquellos que ocurrieron en la transición PRE-STIM o STIM-POST. Posteriormente la descarga neuronal fue vectorizada en relación con ciclo respiratorio para cada neurona y condición experimental. El valor único para cada MT fue obtenido a través de una suma vectorial de los valores de los 18 intervalos, teniendo cada uno de ellos un ángulo dado por su posición en el histograma y una magnitud dada por el promedio de descarga durante ese período del ciclo. De esta manera el ángulo del vector suma representa la 58 preferencia de descarga de la neurona durante el ciclo respiratorio y su magnitud cuán agrupada o esparcida fue la descarga de las neuronas durante la respiración, en otras palabras, qué tan fuerte o selectiva fue la respuesta celular para un período particular, dado por el ángulo, del ciclo respiratorio. Los histogramas para cada época fueron sumados y normalizados. Para evaluar la significancia estadística de los cambios en los vectores dados por las distintas condiciones experimentales se procedió a simular un re-muestreo de los datos (bootstraping). Para esto, cada grupo de 18 datos fue re-muestreado azarosamente 1000 veces obteniéndose valores promedio para cada intervalo y la distribución de estos a lo largo del ciclo respiratorio. Se utilizó un test de Kolmogorov-Smirnov para evaluar diferencias entre la distribución obtenida en el registro y la simulada mediante re-muestreo. La primera característica en ser medida fue si las neuronas tenían preferencia por alguna de las etapas del ciclo respiratorio. Para esto se definió como neuronas con preferencia específica aquellas cuyo vector suma tenía un valor superior a 2 veces el intervalo (bin) de mayor magnitud para ese vector (recordar que el vector suma se obtuvo de 18 intervalos). Esta medida minimiza los falsos significativos en células con gran variabilidad en sus patrones de respuesta. Para evaluar cambios significativos en la magnitud del vector por efecto de la estimulación, se calcularon las diferencias entre PRE/STIM, PRE/POST y STIM/POST. Los cambios significativos fueron definidos como cambios en la magnitud mayores/menores a 2 DS en relación con la situación inicial. Finalmente, para determinar si las MT podían exhibir cambios en la preferencia respecto al momento del ciclo en que ocurría la mayor descarga (cambios de fase del vector) se calcularon las medianas para las distribuciones obtenidas antes, durante y después de la aplicación del estímulo. Si la mediana varió entre una y otra situación a un valor por debajo/encima del percentil 2/98 de la situación original se consideró como significativa. Se 59 utilizaron percentiles ya que la mayoría de las distribuciones no fueron normales. Para evaluar lo anterior se utilizó la prueba Lilliefors de normalidad. 4.5.7 Oscilaciones del potencial de campo local durante el ciclo respiratorio: La señal cruda obtenida en el registro fue filtrada (pasa-banda 10-100 Hz sin alteración de fase). Para la señal de cada ensayo y condición se construyeron espectrogramas (tablas tiempo-frecuencia) utilizando una Transformada Rápida de Fourier de corto tiempo convolucionada con una ventana de Hamming de 213 ms. Esta ventana se deslizó a través de la señal en pasos de 10 ms. El espectrograma de la señal entera fue dividido en intervalos del largo del ciclo respiratorio promedio para esa situación. De esta manera se obtuvo un espectrograma por cada ciclo respiratorio. El punto central de estos espectrogramas, al igual que lo descrito para espigas, correspondió al punto medio de la fase inhalatoria (cruce por 0 de la señal). Los espectrogramas correspondientes a una misma situación experimental (época y estímulo) fueron alineados y superpuestos en torno a este punto central. Se procedió a calcular el promedio y DS para cada uno de los puntos equivalentes en los espectrogramas. 4.5.8 Detección de regiones con actividad significativa del PCL en el ciclo respiratorio: Debido al interés que suscitan la banda Beta (10-30 Hz) y Gamma (30-100 Hz), se procedió a analizar los valores correspondientes a ellas de manera separada. Para cada banda se calculó el promedio y DS de todos los puntos que constituyeran esa región. Si un punto determinado excedió o cayó bajo el promedio ± 2 DS de esa región, fue considerado como sitio de actividad significativa. 4.5.9 Detección de cambios en el PCL como consecuencia de la estimulación: Para evaluar cambios en los espectrogramas como consecuencia de la estimulación, se realizó un t-Test de 60 doble cola entre los puntos homólogos de los espectrogramas evaluados. Se consideró variación significativa aquella cuyo p < 0,01 61 5. RESULTADOS 5.1 Caracterización de la respuesta de neuronas MT vecinas 5.1.1 Registro de actividad unitaria Las penetraciones en los animales fueron realizadas en las regiones dorsales de ambos BOs sin preferencia por lado (BO izquierdo/derecho) ni posición dentro de cada BO, esto es, las penetraciones fueron al azar tanto en el eje céfalo-caudal como en el medio-lateral. El único cuidado especial respecto a su ubicación fue evitar introducir el electrodo en el Bulbo Olfatorio Accesorio. Esta estructura es reconocible a simple vista en algunos animales, pero la regla general fue evitar penetrar el 1/3 posterior del encéfalo expuesto por la craneotomía para minimizar la posibilidad de atravesar dicha estructura. La certeza de que los registros provenían efectivamente de la capa mitral y no de otra estructura del BO proviene de trabajos de otros autores que, con un método homólogo, habían descrito que la profundidad de los registros y las características electrofisiológicas del BO hacían fácilmente distinguible a la capa mitral del resto de las estructuras (Kay and Laurent, 1999). Además existía el aval de estudios piloto realizados durante la formulación del proyecto y otros trabajos realizados con anterioridad en el laboratorio usando una técnica similar (Aylwin Mde et al., 2005). Estos últimos habían demostrado que las células MT son las únicas lo suficientemente grandes (± 25 µm) como para producir corrientes extracelulares detectables con este método. Los autores, mediante lesiones electrolíticas en los sitios de registro, habían corroborado que las espigas captadas provenían de la capa mitral. Se registraron un total de 261 unidades provenientes de 103 sitios en 25 animales. Se obtuvieron registros tanto de la capa mitral dorsal como de la capa mitral ventral de cada BO. En cada penetración se obtuvieron entre 1 y 6 unidades (promedio = 2,5). Estas cifras corresponden a 62 todas las unidades registradas. Dado que el objetivo del proyecto fueron caracterizar la respuesta de neuronas individuales, es decir actividad electrofisiológica unitaria, los registros pertenecientes a actividad multi-unitaria fueron excluidos. Debido a que posteriormente se requirió caracterizar la respuesta de neuronas vecinas, aquellos datos que poseían actividad de una única neurona también fueron apartados. Finalmente aquellos registros unitarios con muy poca actividad basal (<0,5 Hz) tampoco fueron incluidos en el análisis. Realizada la selección de material apto para el análisis, se contó finalmente con 70 unidades individuales provenientes de 29 sitios en 11 ratas. El promedio de esta muestra fue 2,4 células/sitio. La figura 10A muestra un ejemplo de la actividad MT tal como es vista por los 4 canales del tétrodo. Es posible observar que cada célula posee un patrón único proveniente de los 4 alambres del tétrodo. La figura 10B muestra un acercamiento de la región sombreada en 10A. Aquí es posible observar detalladamente las claras diferencias en las representaciones de los 4 canales para 2 neuronas distintas. Las amplitudes son diferentes en canales vecinos y varían para cada célula. La amplitud de la señal en los 4 canales junto con los perfiles de la onda y análisis de componentes principales fueron utilizados para construir gráficos 2D y realizar la identificación de las unidades (10C). En la figura 10D es también posible observar el registro de la señal cruda de la respiración. 63 Figura 10. Ejemplos de registros con tétrodos en la capa mitral del bulbo olfatorio. A Trazados de la señal registrada en los cuatro alambres (canales) de un tétrodo. Los potenciales de acción de neuronas cercanas a la punta del electrodo muestran distintas amplitudes dependiendo de su distribucuón espacial. Registro de 1 s. B Magnificación de la región sombreada en A en que se observa los patrones de 2 neuronas en los distintos canales. C Las descargas de una misma neurona forman nubes al representarse en gráficos 2D. Estas nubes pueden seguirse a través del espacio de representación para permitir identificar unidades (neuronas) únicas. En el ejemplo se muestran gráficos de la amplitud pico-a-pico de dos neuronas en los distintos canales del tétrodo. En al menos una de estas representaciones se observa que ambas nubes están separadas y, por lo tanto, pertenecen a neuronas diferentes. D Señal respiratoria obtenida mediante una termocupla colocada delante de la nariz del animal. Diez segundos de registro. 64 5.1.2 Respuesta de las neuronas MT a las mezclas de odorantes Uno de los primeros hallazgos durante la caracterización de la respuesta de las MT fue su gran rango de frecuencia para su actividad basal. Este fue 1,1-38,34 Hz, con un promedio ± DS de 12 ± 8,2 Hz. Con el fin de comparar la respuesta de células vecinas, se seleccionaron los registros en que al menos una de ellas respondiera, ya fuere excitatoria o inhibitoriamente, a uno o más de los 5 estímulos presentados. Los estímulos consistieron en 2 a 5 odorantes con similar grupo químico principal, pero con variaciones en el largo de la cadena carbonada (ver Materiales y Métodos). Un hallazgo interesante fue que además de responder con cambios en la tasa de descarga durante la estimulación (STIM), un número importante de células MT exhibió cambios en el período inmediatamente posterior a la estimulación (POST). En resumen un 67,1% de las células (47/70) mostraron cambios significativos en la descarga durante la estimulación (STIM) o inmediatamente posterior a esta (POST) con al menos 1 de los 5 estímulos. La gran mayoría de las neuronas mantuvo una respuesta sostenida, ya sea excitatoria o inhibitoria, durante STIM y/o POST. Únicamente en 2 casos fue posible hallar respuestas complejas (con excitación e inhibición durante una misma época). Durante esta fase del trabajo experimental ya fue posible observar una fuerte modulación de la respiración en la descarga MT. Al cuantificar las variaciones de la tasa de descarga respecto a los distintos odorantes, hallamos que 22/70 (31,42%) respondieron únicamente a 1 odorante, 11/70 (15,71%) a 2 odorantes y 14/70 (20%) a 3 o más odorantes. Un resumen de la respuesta de las 70 neuronas a los 5 odorantes utilizados está esquematizado en la figura 11A. 65 1 Aire Alcoholes Ac. Carbx Aldehidos Cetonas Mezcla Aire Alcoholes Ac. Carbx Aldehidos Cetonas Mezcla 2 1 2 Aumento Disminución Sin Cambio Figura 11. Resumen y ejemplos de la respuesta de las neuronas mitrales/penacho vecinas. A Matriz bi-dimensional que resume la actividad de las 70 células MT registradas tanto para STIM como para POST. Algunas neuronas muestran respuestas opuestas al ser estimuladas con el mismo odorante. B Ejemplos de respuesta de pares de neuronas MT vecinas a los diferentes estímulos. Cada fila representa una neurona. Las espigas obtenidas para 15 presentaciones del odorante se muestran en el panel superior mientras que la tasa de descarga instantanea se ubica en la región inferior (tamaño del bin = 50 ms). La línea sobre las espigas corresponde al protocolo de estimulación. La célula 1 en B es inhibida por alcoholes, ácidos carboxílicos y la mezcla; es excitada por aldehídos y cetonas. La célula 2, en cambio, es excitada por alcoholes sin ninguna otra respuesta. C MT vecinas mostraron el mismo comportamiento para algunos odorantes (ambas son excitadas por aldehídos) y opuestos para otros (cetonas). Nótese la respuesta excitatoria post-estímulo para cetonas de la célula 2. 66 5.1.3 Los estímulos evocaron respuestas distintas entre neuronas MT vecinas De las 70 unidades registradas se obtuvieron 58 pares distintos. De ellos únicamente 8 no mostraron cambios en la descarga para ninguno de los estímulos. Los 50 pares remanentes mostraron respuestas disímiles (aumento, disminución o no cambio) para al menos 1 de los estímulos en las MTs constituyentes del par. La mayoría de estas diferencias observadas correspondieron al estímulo que provocó repuesta más que al tipo de respuesta exhibida. En otras palabras las neuronas diferían más en su preferencia por uno u otro estímulo que en el cambio de descarga observado. Al examinar los patrones de respuesta de los distintos pares frente a los 5 estímulos se encontró que la mayoría de los pares exhibió preferencia similar en al menos 2 estímulos, pero difirieron en al menos 1 de ellos. En la figura 11B y 11C, trenes de espigas y frecuencias instantáneas muestran los perfiles de preferencia de odorantes para un par típico de MTs vecinas. La célula 11B-1 responde con una fuerte inhibición a alcoholes, aldehídos, ácidos carboxílicos y la mezcla, mientras es excitada importantemente por aldehídos y levemente por acetonas. Aldehídos y acetonas, por el contrario, excitan escasamente a la célula 11B-2 quien además no presenta respuesta al resto de los estímulos. Un ejemplo de similar preferencia por odorantes, pero distinto efecto en la descarga se observa en la figura 11C. En ella es posible observar que ambas responden únicamente a aldehídos y acetonas, pero si bien ambas aumentan tasa con los aldehídos, la célula 1 es excitada por las cetonas, mientras las célula 2 es inhibida. Sorprendentemente no se halló ningún par de células que exhibiera el mismo tipo de respuesta para los 5 estímulos utilizados. La figura 12A esquematiza, en forma de código de colores, la respuesta de los 58 pares de neuronas al conjunto completo de odorantes a que fueron sometidas. Debido al gran número de parámetros mediante los cuales la respuesta de células vecinas podía 67 Cel 1 Cel 1 C Aumento / Aumento Aumento / Sin Cambio Aumento / Disminución Disminución / Sin Cambio Disminución / Disminución Sin Cambio / Sin Cambio Cel 2 Cel 2 Figura 12. Neuronas MT vecinas exhiben distintas preferencias por odorantes A Matriz bi-dimensional que esquematiza la actividad de 58 pares de células MT registradas durante STIM y POST. La mayoría de los pares de neuronas muestran respuestas individuales a los odorantes (ver código inferior) por parte de una de ellas, mientras que la otra no responde (negro). La mayoría de los pares difieren en su respuesta en al menos una condición de estimulación. B Gráfico bi-dimensional en que cada eje representa la tasa de descarga entre el período de estimulación y la exposición a aire puríficado. Cada punto representa un par de neuronas en que al menos uno de sus elementos cambió significativamente la tasa de descarga. Si ambas neuronas en el par hubiesen exhibido respuesta similar a los odorantes, los puntos debiesen agruparse en torno a una línea diagonal. La regresión lineal mostró, por el contrario, una curva casi plana (r = 0.06). C Similar análisis, pero para la condición post-estímulo vs aire. Al igual que en B la regresión mostró una curva alejada de la diagonal (r = 0.12) indicando que las células vecinas no covarían su respuesta durante la estimulación ni inmediatamente después de esta. 68 ser comparada, se elaboró un método sencillo para cuantificar la similitud de respuesta de células vecinas basado en los cambios relativos en la tasa de descarga de cada par de neuronas. En la figura 12B y 12C cada eje representa la dirección (positivo para los aumentos, negativo para las disminuciones) y magnitud de la respuesta para cada una de las 2 células que componían los pares. Si el cambio para un estímulo dado es exactamente igual para ambas neuronas el punto representativo debiera caer en una diagonal que va desde el cuadrante inferior izquierdo al superior derecho del gráfico. De manera contraria, si las respuestas fueran completamente independientes los puntos estarían distribuidos al azar en los 4 cuadrantes. Por lo tanto, un gran nivel de similitud en la respuesta resultaría en una regresión lineal con pendiente cercana a 1. En este análisis fueron incluidos todos los pares para los 5 estímulos, pero fueron excluidos los puntos que representaban estímulos en los cuales ninguna de las 2 células mostró cambios significativos. La figura 12B muestra el resultado de los 94 puntos obtenidos al comparar PRE con STIM. La regresión lineal para ellos es de 0,06. Igualmente la figura 12C incluye a los 86 puntos obtenidos entre POST y PRE. El coeficiente de regresión para ellos es de 0,012. Estos resultados indican que tanto durante la estimulación como durante el retiro del estímulo las neuronas MT vecinas poseen respuestas diferentes, demostrando un alto grado de heterogeneidad en el rango receptivo de neuronas MT vecinas. 5.1.4 Las neuronas MT presentan un largo período refractario que se modifica, pero no desaparece durante la estimulación El concepto de propiedad(es) de descarga de una neurona ha evolucionado aceleradamente en las últimas décadas. Se ha demostrado que ciertos atributos temporales, entre las que se cuentas la actividad oscilatoria de neurona única, la sincronía neuronal y la sincronía oscilatoria, se asocian 69 a la percepción sensorial y olfatoria. Es por eso que este trabajo incluyo el análisis de estas características en los registros obtenidos desde las MT. Trabajos anteriores realizados en el laboratorio en neuronas no estimuladas habían mostrado que las células MT exhiben un período silente entre espigas poco habitual. Este hallazgo se denominó período silente o “refractario” (Aylwin Mde et al., 2005). Los registros obtenidos en este proyecto volvieron a mostrar que efectivamente este período refractario es una característica robusta de las MT. Esta etapa tuvo una duración de entre 5 y 29 ms. La ausencia de descarga fue evidente tanto en los histogramas intra-estímulo como en los autocorrelogramas. En los datos registrados, únicamente 2/70 células (2,85%) no presentaron esta característica. En este trabajo se analizó si el período refractario era susceptible de ser modificado y si las neuronas vecinas exhiben modificaciones similares de este período en presencia de odorantes. Encontramos que la población general disminuyó su período refractario al ser estimuladas. De un promedio ± DS de 11,0 ± 7,3 ms durante PRE este se acortaba significativamente (t-Test pareado, p < 0,01) a 9,9 ± 6,7 ms durante STIM. Si bien durante POST hubo una reducción importante a 10,0 ± 6,3 ms, esta no alcanzó los niveles de significancia exigidos (p > 0,01). La figura 13 es un ejemplo de lo anterior en donde se puede observar que la célula que en PRE posee un período refractario de 14 ms. Durante STIM este se reduce a 10 ms en STIM y se recupera parcialmente, a 12 ms, luego del retiro del estímulo (POST). Posteriormente se analizó la variación del periodo refractario en pares de MTs vecinas que respondieran de la misma manera (excitación o inhibición) al mismo odorante. En 23 pares de neuronas en que ambas tuvieron la misma respuesta, 13 (56,52%) se comportaron de manera similar ya sea aumentando o disminuyendo la etapa silente. En 5 pares (21,74%) sólo una de ellas cambió su período silente y en los restantes 5 pares (21,74%) observamos un aumento del periodo silente en una célula y una disminución en la otra. 70 PRE 2s STIM 6s PRE POST 10s STIM sp/s POST Figura 13. Las neuronas MT poseen un largo período silente y bajos niveles de oscilación. A Potenciales de acción y frecuencia de descarga instantánea de una neurona MT al ser expuesta a una mezcla de aldehidos (15 repeticiones). Observese la clara respuesta excitatoria durante la presentación del estímulo. B Autocorrelogramas y sus correspondientes espectros de poder durante PRE, STIM y POST. Nótese le largo período silente durante PRE (14 ms) que se acorta durante STIM (10 ms) y se recupera parcialmente durante POST (12 ms). El análisis de los espectros de poder mostró que ninguna(s) frecuencia(s) alcanzó niveles de significancia. 71 5.1.5 Actividad oscilatoria y sincrónica entre células MT vecinas La actividad neuronal oscilatoria en el BO, obtenida mediante registros de PCL en respuesta a la estimulación, es una de las características más robustas y reportadas en el olfato (Laurent, 1996; Buonviso et al., 2003; Ravel et al., 2003). Al registrar PCL se observaron oscilaciones importantes en la banda β (10-30 Hz) como en la banda γ (30-100 Hz). Para determinar si las unidades individuales de MT exhibían actividad oscilatoria en estas frecuencias, y así poder señalarlas como su potencial fuente de origen, además de corroborar si neuronas vecinas tenían o no un comportamiento similar, se calcularon autocorrelogramas para cada neurona. Al separar los resultados por época, encontramos que ninguna célula exhibió actividad oscilatoria en reposo. La estimulación (STIM) únicamente logró un alza marginal de estas. Durante PRE sólo en el 0,74% de los casos se detectó oscilaciones significativas. Durante STIM el 1,72% de los registros mostraron picos significativos en los autocorrelogramas. En resumen, la actividad oscilatoria sostenida encontrada fue extremadamente baja. Debido a esto la comparación de oscilaciones entre neuronas vecinas no fue llevada a cabo. Si bien las neuronas individuales no presentan actividad oscilatoria, esta no es un requisito para que haya actividad sincrónica entre neuronas vecinas. Es más, dado que las neuronas vecinas en el BO poseen alta probabilidad de recibir aferencias desde el mismo glomérulo, es lógico suponer que neuronas vecinas deben tener altos niveles de sincronía (Schoppa and Westbrook, 2002). Para poner a prueba esta idea se examinó la actividad coherente (sincrónica) entre pares de neuronas vecinas registradas por el mismo electrodo. Se calcularon correlogramas cruzados para los 58 pares de neuronas registrados y para cada uno de los estímulos a que fueron sometidos. La incidencia de actividad sincrónica entre pares de MTs vecinas en PRE fue extremadamente baja (0,31%), Se observó un pequeño aumentó durante la estimulación (2,80%). Después del retiro del estímulo (POST) hubo otro 72 pequeño incremento (3,78%). Un ejemplo típico del escaso nivel de sincronía se muestra en la figura 14. En ambos casos se observa un aumento de la descarga de las MTs frente a la estimulación, pero no es posible observar actividad oscilatoria individual (autocorrelogramas planos) ni sincronía entre ambas neuronas (correlograma cruzado sin pico). 5.1.6 Patrón respiratorio en MT vecinas El disparo o descarga de las MT es no-estacionario tanto en ausencia como en presencia de odorantes. Muchas de estas neuronas parecen estar moduladas por la respiración. Esto se conoce como patrón respiratorio (Chalansonnet and Chaput, 1998; Buonviso et al., 2003). Dada esta característica, se decidió evaluar si las neuronas MT vecinas comparten o no patrón respiratorio. Se calcularon histogramas de descarga usando como punto medio la mitad de la fase de inhalación y se dividió el ciclo en 4 segmentos de 90º. Las descargas fueron asignadas a uno de estos 4 periodos (ver materiales y métodos). Al aplicar esta aproximación inicial a los 58 pares de neuronas se observó que en un 10,34% (6/58) existe preferencia por una fase determinada en ambas células, en un 32,75% (19/58) únicamente una de las células presentaba modulación y en un 56,89% (33/58) ninguna de ellas presentaba patrón respiratorio. De los 6 pares en que existía modulación, en 2 (33,33%) se demostró que ambas células variaban su respuesta en la misma fase del ciclo. Estos resultados sugieren que el patrón respiratorio entre células vecinas es más bien heterogéneo y que los pares de neuronas observados tienen un comportamiento individual más que colectivo entre sus integrantes. Un ejemplo de los resultados de esta aproximación inicial se halla en la figura 15. Se observa que sólo algunos odorantes producen cambios en la descarga en relación al ciclo respiratorio. Además estos cambios ocurren en neuronas vecinas específicas, pudiendo haber neuronas con o sin cambio de patrón en una misma zona de registro. 73 Cel 1 Cel 2 Autocorrelograma Cel 1 Correlograma cruzado Cel 1 vs. Cel 2 Espectro Autocorrelograma Cel 2 Espectro de Frecuencias Espectro Figura 14. Las neuronas MT vecinas muestran baja incidencia de actividad sincrónica A La descarga y el análisis de la frecuencia de descarga instantanea revelan que tanto la célula 1 como la célula 2 son excitadas por los aldehídos. B Los autocorrelogramas y espectros de poder muestran la ausencia de actividad oscilatoria importante. C El correlograma cruzado más bien plano, sin presencia de picos significativos, revela la ausencia de sincronía. El poder espectral bajo él también muestra la practicamente nula actividad oscilatoria. La ausencia de cuentas en el bin central (0) se debe a que ambas células fueron extraídas del mismo tétrodo. Nótese que la célula 1 no posee período silente. 74 5.2 Modulación de la respiración sobre la actividad neuronal del BO Sin duda en el sistema olfatorio el ciclo respiratorio constituye un elemento fundamental en la temporalidad de la percepción. Se sabe que contribuye a cambios dinámicos ya desde tempranas etapas en la vía como el epitelio olfatorio y las NRO. Los estudios a niveles más altos en esta vía, léase BO y corteza entorrinal, también han señalado que la actividad neuronal es modulada por la respiración. Dado que es lógico proponer que las dinámicas relacionadas al ciclo respiratorio están asociadas a la codificación y percepción, en el presente trabajo se procedió a registrar y cuantificar las variaciones de la descarga MT y oscilaciones del PCL mientras el sistema era estimulado con diversos odorantes. 5.2.1 Registros de unidades MTs Al igual que en los registros previos, la actividad neuronal registrada provino de las capa mitral. Para esta segunda etapa se seleccionaron 56 células obtenidas de 22 sitios. La respuesta de cada una de ellas a través de las distintas épocas del protocolo (PRE, STIM y POST) y para cada uno de los estímulos a que fueron expuestas, se denomino “evento”. Fueron analizados un total de 765 eventos. Nuevamente los registros fueron calificados como provenientes de la capa mitral dada la profundidad de los registros y las características electrofisiológicas del BO. Como se mencionó, estas hacen fácilmente distinguible a la capa mitral del resto de las estructuras. 75 Aire Alcoholes Ac. Carboxílicos Aldehidos Cetonas Mezcla PRE STIM POST PRE STIM POST Figura 15. Neuronas MT vecinas muestran patrones respiratorios diferentes. Se construyeron histogramas peri-estímulo basados en el ciclo respitratorio (ver métodos) para las 15-25 presentaciones del estímulo. La línea sólida semisinusoidal representa el ciclo respiratorio promedio. Los movimientos hacia arriba y abajo representan la exhalación e inspiración respectivamente. En este ejemplo la actividad de las células M2 y M3 se concentra en fases opuestas del ciclo respiratorio. Durante STIM, los aldehídos, cetonas y la mezcla inducen un cambio de fase en la descarga de M2 mientras que generan una inhibición de fin de inspiración en M1. La respuesta de la célula M3 no es modificada por ningún estímulo. Reversión parcial o comleta de estos fenómenos es observable en POST. 76 5.2.2 La población de neuronas MTs exhibe acoplamiento a la respiración, pero no modulación de esta por la estimulación Para poder establecer cambios en la dinámica de disparo de las MTs durante la respiración se realizó una vectorización normalizada de la respuesta para cada evento. La figura 16 esquematiza el proceso de vectorización de la descarga tomando como ejemplo un registro con dos neuronas. En él, cada ciclo respiratorio fue representado como una onda sinusoidal de 360º (2π radianes). El tren de descarga de cada neurona durante cada ciclo respiratorio fue dividido en 18 intervalos de 20º cada uno. Luego los intervalos correspondientes de todos los ciclos respiratorios fueron sumados y normalizados. Para cada histograma normalizado se calculó un vector suma. La existencia de preferencia, por parte de la descarga, de una etapa determinada del ciclo fue evaluada comparando la magnitud resultante del vector suma con el mayor de los intervalos individuales del histograma (ver métodos). Durante la exposición a aire puro (PRE) se observó que, para un total de 255, 95 de ellos (37,25%) mostraron un vector suma con magnitud significativa. Esto es, poseían descarga asociada a un momento particular del ciclo respiratorio. Durante la estimulación con los 5 odorantes (STIM),125/255 (49,02%) mostraron magnitud significativa, mientras que en POST lo hicieron 101/255 (39,61%) de los eventos. Observamos que la incidencia general de vectores con magnitud significativa fue similar en las tres condiciones. 77 78 79 Al comparar los datos de los distintos estímulos contra los ensayos control con aire puro (AIR) se observó que con aire 68/169 (40,48%) eventos mostraron acoplamiento respiratorio. Para los estímulos con alcoholes se encontró que estos fueron 71/168 (42,26%), para ácidos carboxílicos 69/168 (41,07%), para aldehídos 67/168 (39,88%), para cetonas 73/168 (43,45%) y 41/93 (44,09%) para la mezcla. No hubo diferencias significativas al comparar cualquier a de los estímulos con la condición control (AIR). Las distribuciones de amplitudes para todas las épocas fueron evaluadas con una prueba no paramétrica de Kolmogorov-Smirnov sin encontrar diferencias significativas como se observa en la figura 17. Es posible que la similitud encontrada se debiera a la baja tasa de descarga de las MTs registradas. El rango de estas fue 0,56-17,89 espigas/ciclo, promedio ± DS = 5,18 ± 3,65 espigas/ciclo. Para evaluar esa posibilidad se utilizó un algoritmo de remuestreo azaroso (bootstrap) de los datos. Los trenes de espigas asociados a cada ciclo en toda época en cada ensayo fueron remuestreados al azar 1000 veces. Para cada uno de estos conjuntos de datos obtenidos azarosamente se calculó el ángulo del vector suma. Así se obtuvo la distribución de ángulos remuestreados (simulados). Esta distribución se comparó con la distribución medida originalmente (con los datos experimentales) y no se encontró diferencias entre ellos (prueba de Kolmogorov-Smirnov). Estos resultados sugieren que la estimulación no produce grandes cambios poblacionales en el acople de las MTs a la respiración. De una manera homóloga se calcularon las propiedades de fase de los ángulos obtenidos. La población completa mostró una fase promedio de 292,79 ± 32,51°. Esto reflejó que la mayor actividad MT se encuentra al final de la inspiración (270°). Para PRE, STIM y POST los valores fueron 295,90 ± 32,84°, 285,36 ± 32,65° y 297,12 ± 32,04. Estos son valores para eventos con magnitud significativa. A pesar de la fuerte tendencia de las MTs hacía el fin de la inspiración, en las distribuciones de fase se observa un número pequeño de neuronas que tienen preferencia por el 80 fin de la espiración (90°). Al evaluar discrepancias en las distribuciones causadas por época y/o identidad del estímulo, no se encontraron diferencias significativas. Los distintos parámetros evaluados y los resultados se muestran en la figura 17. Se observa que ni la época ni el estímulo (17A) presentaron diferencias en la cantidad de eventos con magnitud significativas. Al analizar las distribuciones de las magnitudes, se observa que la estimulación no produce variaciones (17B). Finalmente las distribuciones de fase tampoco fueron modificadas por los estímulos, tanto para datos medidos como para remuestreados (17C-D). 5.2.3 La evaluación individual de la descarga MT demuestra modulación estímulodependiente de la fase y/o magnitud del vector suma Examinamos cambios de la fase o de la magnitud durante la exposición a los distintos odorantes. La tabla 1 demuestra que de un total de 765 eventos, 244 (31,9%) exhibieron cambios en fase y/o magnitud. La variación promedio de la fase para ellos fue de 36,16 ± 14,40º. Para los eventos que registraron aumento significativo de la magnitud, el aumento promedio de ella fue de 15 el ± 10%. Para los eventos que registraron disminución significativa de la magnitud, esta fue -18 ± 10%. Se procedió a verificar cambios concomitantes en la fase y magnitud. Se crearon así tres grupos: aquellos que sólo mostraron variación en la magnitud del vector, los que sólo modificaron la fase del vector y un tercer grupo que cambió tanto fase como magnitud en respuesta a la estimulación. Fue así como los eventos que solamente alteraron la magnitud (n = 62; 8,1% del total) su orientación promedio se desvió en 23,00 ± 3,96º, los eventos que solamente presentaron cambios significativos en la fase (n = 146; 19,08%) variaron esta en 63,32 ± 14,42º. 81 % Por Estímulo % 50 48 STIM evt 50 % Significativo C 0 D PRE 0 180 360 0 STIM POST 0.4 20 20 0 0 0 180 360 0 180 360 20 0 180 360 20 0 0.2 Magnitud Normalizada Angulos Remuestreados POST PRE STIM 20 0 50 % Significativo Angulos Medidos 0 evt POST AIR OH COOH CHO K M POST STIM PRE 35 17 B evt Magnitudes Medidas PRE A Por Epoca 20 0 180 Anguloº 360 0 180 Anguloº 360 Figura 17. Magnitudes y Ángulos de la población de células MT. A Porcentaje de eventos significativos al analizar los datos por épocas y/o estímulos. En el gráfico de la izquierda se observa que entre PRE, STIM y POST no hubo diferencias entre los cambios de magnitud. El análsis de los distintos odorantes tampoco reveló diferencias entre ellos (derecha). Las barras sobre cada columna representan la desviación estandard. B Distribuciones de las magnitudes para las 3 épocas. En blanco se muestran aquellas que fueron significativas. El eje y corresponde al N° de eventos con determinada magnitud. No se encontraron diferencias entre las distribuciones. C Distribución de ángulos para las 3 épocas del experimento. Nótese la tendencia de las neuronas MT a descargar alrededor de la transición inspiración/espiración (270°). En blanco los eventos significativos. No se obtuvieron diferencias al comparar las distribuciones entre ellas. D Similar análisis que en C, pero esta vez realizado a la población de datos remuestreados. 82 Tabla 1. Valores de Fase y Magnitud para todos los eventos y variación de fase y magnitud en los eventos significativos. Todos los Eventos Eventos con Cambio Cambio Promedio de Fase en Rad Varianza del Cambio en Rad 244 0,6311 0,2513 Total Eventos 31,89% 36,16 % de Eventos con Cambio Cambio Promedio de Fase en Grad° 765 14,4 Varianza del Cambio en Grad° Eventos Significativos Fase Ambos Magnitud n (% del Total) Promedio ± Varianza en Radianes Promedio ± Varianza en Grados° 146 (19,08%) 1,1051 ± 0,2516 63,32 ± 14,42 n (% del Total) Promedio ± Varianza en Radianes Promedio ± Varianza en Grados° 36 (4,71%) 1,6540 ± 0,2865 94,77 ± 16,42 n (% del Total) Promedio ± Varianza en Radianes Promedio ± Varianza en Grados° 0,4014 ± 0,0691 23,00 ± 3,96 62 (8,10%) 83 Interesantemente, las células con variaciones de fase y magnitud (n = 36; 4,71%) mostraron un desplazamiento de la fase promedio significativamente más grande, 94,77 ± 16,42º, que aquellas que sólo cambiaron su fase. Por lo tanto, si la reorientación es acompañada por un cambio en la magnitud sufre un cambio más grande de fase que si la reorientación no se acompaña de variaciones de la magnitud. Ejemplos de diversos patrones del comportamiento de las células se demuestran en la figura 18. Nótese que cualquier clase de cambio (fase, magnitud o ambas) es selectiva para ciertos estímulos. En los ejemplos de la figura 18 el desplazamiento de fase ocurre solamente para CHO, K y M1 (18B); aumento de la magnitud para el OH, CHO y K (18C) y ambas solamente para COOH (18C). Un promedio de 1,64 estímulos por célula fue capaz de evocar cambios en magnitud y/o fase. 84 85 86 5.3 Registros del potencial de campo local Los registros de PCL fueron hechos simultáneamente con la adquisición de la actividad unitaria, por lo tanto, todos los datos presentados aquí fueron obtenidos en la capa de células mitrales. Luego de que para cada ensayo se construyera una carta tiempo/frecuencia, utilizando para ello una Transformada de Fourier Rápida de corto tiempo, para cada evento se calculó una carta tiempo/frecuencia promedio centrado en la mitad de la fase inspiratoria (ver métodos). Para cada carta se obtuvieron estadísticas del valor promedio de cada pixel (poder espectral de cada frecuencia a lo largo del ensayo) y se obtuvieron de esta manera dos datos relevantes: oscilaciones (β y/o γ) con niveles de significancia durante PRE, STIM y POST y cambios significativos de dichas frecuencias gatillados por la estimulación. Un esquema del proceso de análisis de los datos se representa en la figura 19. La actividad de PCL se obtuvo de 26 sitios, con total de 702 espectrogramas promedio para todas las condiciones (4 o 5 odorantes durante épocas PRE, de STIM y del POST) 5.3.1 La frecuencia y fase poblacional muestran muy poca variación del PCL entre estímulos y/o épocas Los eventos con por lo menos un pico significativo en la banda gamma fueron denominados H (del inglés High) y los eventos para las bandas beta fueron llamados eventos L (del inglés Low). De 702 eventos totales, 243 (34,62%) de ellos demostraron por lo menos un pico significativo en frecuencias H o L. El promedio ± DS para la fase fue 314,28 ± 42,14° Hz y 163,03 ± 46,48° para H y L, respectivamente. El promedio de frecuencia para los registros L con picos significativos (68/351, 19,37%) fue 27,94 ± 4,44 Hz, mientras que la fase tuvo un promedio de 51,47 ± 25,83°. 87 88 89 En los H significativos (175/351, 49,86%), estos mismos parámetros fueron 78,01 ± 16,57Hz y 326,40 ± 29,59°. Dividido por época: PRE L: eventos significativos (29/117, 24,79%) la frecuencia fue 27,83 ± 3,55 Hz y la fase 271,90 ± 43,68°. PRE H: (65/117, 55,55%) ciclaron a 77,82 ± 15,96 Hz y tuvieron una fase de 328,09 ± 26,32°. STIM L: (16/117, 13,68%) con 27,13 ± 5,38 Hz y 74,15 ± 47,04°. STIM H: 76,91 ± 18,34 Hz y 308,25 ± 30,84°. POST L: (26/100, 19,66%) 28,65 ± 4,53 Hz y 53,87 ± 35,25°. POST H: (61/117, 52,14%) 79,02 ±16,14 Hz de frecuencia y 338,82 ± 29,2° de fase. La figura 20 muestra la distribución de la frecuencia y de la fase para todos los eventos significativos para las bandas gammas y beta. La única diferencia fue encontrada en la fase de los eventos L durante la condición PRE. No se encontró ninguna otra diferencia ya sea para identidad del estímulo como para época del ensayo. 5.3.2 Patrones diversos entre la oscilación en la capa de células mitrales del BO Al analizar los datos, se encontró que la oscilación dentro del OB no siguió un orden o esquema único. Por el contrario, las oscilaciones de PCL tienden a tener diversos tipos de patrones. Eso significa que el patrón predominante de la oscilación del pre-estímulo puede variar de sitio a sitio y que la respuesta al estímulo odorante conduce no sólo a uno, sino a diversos cambios en el patrón oscilatorio. Los ejemplos de estos patrones se muestran en la figura 21. Dado esta variabilidad de las respuestas se clasificó estos patrones basados en tres aspectos. El primero correspondió a la ocurrencia de picos de la actividad (aumentos significativos del poder espectral) relacionados con un período específico dentro del ciclo respiratorio. 90 Distribution de Frecuencias 50 100 40 30 20 10 0 90 180 270 360 30 40 30 20 10 0 90 180 270 360 γ 30 10 30 48 50 65 Hz 83 β 30 10 Distribution de Fases 10 15 20 Hz 25 º º Figura 20. Distribuciones de Frecuencia y Fase de las oscilaciones del PCL en el bulbo olfatorio. Resumen de las frecuencias y fases tanto para Gamma (fila superior) como para Beta (fila inferior). En el cuadrante superior izquierdo se observa que las oscilaciones en banda Gamma se agrupan en la sección alta del espectro (> 65 Hz) y que tienden a aparecer al inicio de la espiración, ~ 300° (superior derecho). Beta, por su parte, se agrupa en torno a los 25-30 Hz (inferior izquierdo) y se concentra en la transición entre inspiración y espiración (180°, inferior derecho). En todos los casos las barras negras son los eventos totales y las barras blancas los eventos significativos. En el eje y está el N° de eventos. 91 Éstos fueron llamados los eventos con “acoplamiento de fase” y típicamente poseían un pico pequeño pero intenso en cierta frecuencia y en un momento específico del ciclo respiratorio (figura 21A). Por el contrario, algunos acontecimientos eran más “borrosos” sin una frecuencia y/o momento de respuesta preferidos. Del 46,98% (210/447) de eventos con actividad significativa, el 51,43% (108/210) correspondió a eventos con acoplamiento de fase. El segundo aspecto considerado fue la oscilación predominante durante la exposición inicial al aire (PRE). En el 48,99% (73/149) de los eventos en los cuales actividad exhibió por lo menos un pico la frecuencia predominante, un 13,70% (10/73) de estos estaba en la banda beta, un 63,01% (46/73) en la banda gamma y en 23,29% (17/73) un pico era observable en ambas bandas. El tercer aspecto fue cuál de las frecuencias varió su poder espectral en respuesta al estímulo y la dirección de ese cambio (aumento o disminución). Se observó que la actividad beta o gamma podría aumentar o disminuir independientemente durante el estímulo. Con respecto a cambios de la frecuencia encontramos que en 6,12% (6/98) casos, el estímulo conduce a aumentos en la energía en gamma (figura 21B), en 7,14% (7/98) situaciones la respuesta del PCL dio lugar a una disminución gamma (figura 21D), un 5,10% (5/98) exhibió aumentos en beta (figura 21C). No hubo eventos con declinación de esta banda. Encontramos incrementos beta junto con decrementos gammas (figura 21E) en 8,16% (8/98) de los casos, mientras que no se registraron eventos con cambios inversos (aumento gamma, disminución de beta). 92 AIR A STIM POST Acoplamiento de Fase γ B Aumento γ C Aumento β D Disminución γ Disminución γ + E Aumento β Figura 21. Ejemplos de patrones de oscilaciones del potencial de campo local. Se representan aquí los diversos patrones descritos para las oscilaciones del potencial de campo local. A En la fila superior se observa que Gamma está claramente acoplada a un momento correspondiente al inicio de las espiración. No hay cambios con la estimulación. B El aumento de Gamma, durante el estímulo, en la segunda fila se verifica con un aumento en la intensidad y tamaño de la marca roja. C La tercera fila muestra la aparición de una señal de baja frecuencia sin alteración de gamma durante el estímulo. Esto corresponde a un aumento de Beta. D En este caso se observa que Gamma disminuye al estimularse el bulbo olfatorio. E Gran disminución de Gamma con aumento de Beta durante el estímulo. En todos los casos, salvo A en que no hay cambios con el estímulo, se observa una reversión de los fenomenos en POST. Colores y escalas idénticas a figura 19. 93 5.3.3 Los patrones de PCL son dependientes de la naturaleza del estímulo Cuando los diversos tipos de respuesta fueron estudiados para cada sitio, encontramos que la actividad de PCL en respuesta a los estímulos no fue estereotipada, sino que, por el contrario, variaba de estímulo a estímulo y de sitio a sitio. Encontramos que en 19,46% (29/149) de los casos por lo menos un patrón era distinguible en uno de los estímulos. De los 26 sitios de registro, 6 (23,07%) mostraron respuesta solamente a un estímulo, 2 (7,69%) para dos y 5 (19,23%) para 3 o más. Un ejemplo de ello se muestra en el figura 22. Nótese que cuando la condición del estímulo se compara a su exposición anterior al aire es posible observar una reducción gamma clara y un crecimiento beta es observable para los alcoholes (OH, figura 22), aldehídos, cetonas y la mezcla (CHO, K y M1 respectivamente). Los ácidos carboxílicos (COOH) conducen a un aumento ligero en beta, pero esta vez acompañado por un aumento pequeño en la actividad gamma. No se encontró ningunos cambios durante el estímulo control (aire, NS). No hubo 2 sitios con patrones idénticos. Siempre existieron diferencias, ya fuere en el estímulo que provocaba cambios en la oscilación y/o en el tipo de oscilación observada. 94 SE 100 Hz STIM PRE STIM vs PRE POST γ β OH 10 100 Hz γ β CHO COOH 10 100 Hz γ β 10 100 Hz γ β 10 100 Hz K γ β M1 10 100 Hz 10 0º γ 180º 360º 0º 180º 360º 0º 180º 360º β 0º 180º 360º Figura 22. El potencial de campo local varía según la identidad del odorante. Ejemplos de la variación de las oscilaciones del PCL en un mismo sitio al estimular con distintos odorantes. En cada fila se muestra la carta tiempo/frecuencia durante las distintas épocas y el análisis comparativo entre STIM y PRE (columna de la derecha). El control con aire (SE) no produce variación en las oscilaciones. La estimulación con ácidos carboxílicos (COOH) produce un leve aumento de Beta sin modificar la banda Gamma practicamente. Esto contrasta con el resto de los estímulos que producen aumento de Beta acompañados de una importante disminución de Gamma. SE: sin estímulo; OH: alcoholes; COOH: ác. carboxílicos; CHO: aldehídos; K: cetonas; M1: mezcla; línea roja: repiración promedio; colores: ver figura 19. 95 6. DISCUSIÓN 6.1 Caracterización la respuesta de neuronas MT vecinas y determinación de su organización funcional Uno de los objetivos específicos de este trabajo fue caracterizar las propiedades de respuesta de poblaciones de neuronas MT vecinas en el BO. Para esto se utilizó el tétrodo, ya que este tipo de electrodo posee la capacidad de registrar simultáneamente varias neuronas cercanas. Diversos criterios fueron utilizados para describir el comportamiento exhibido por de pares de células MT mientras fueron estimuladas con conjuntos de odorantes químicamente relacionados entre si (mismo grupo principal). Los experimentos se llevaron a cabo en ratas anestesiadas con uretano respirando libremente. Uno de los hallazgos más novedosos corresponde al hecho que neuronas MT vecinas, que supuestamente reciben aferencias muy similares, no necesariamente poseen patrones de respuesta similar a los determinantes moleculares de los odorantes. También logró determinarse que la actividad oscilatoria, así como la sincronía de espigas es un hecho de muy baja ocurrencia entre las neuronas MT del BO. Los experimentos corroboraron el hecho que las neuronas MT poseen un gran período silente que, si bien es modificado por la estimulación, sigue siendo considerable en relación a lo observado en otros sistemas sensoriales. Finalmente se muestra que cada neurona tiene un patrón de descarga particular y único asociado a la respiración. Tomando los hallazgos como un todo sugieren que la organización quimiotópica descrita para la capa glomerular del BO (Uchida et al., 2000; Meister and Bonhoeffer, 2001; Inaki et al., 2002) no se extiende automáticamente hacia la capa de células mitrales. Esto indica que las MT no actúan como un mero relevo de los cambios ambientales percibidos por las NRO. El hecho que la preferencia por odorantes, la descarga oscilatoria, la actividad sincrónica y los 96 patrones asociados a la respiración se comporten de manera individual para neuronas vecinas indican que la codificación de estímulos en el BO es mucho más compleja de lo inicialmente sugerido y que las aferencias (inputs) provenientes del epitelio olfatorio son sustancialmente modificadas por otros componentes y dinámicas presentes en el BO. 6.1.1 Conexiones y preferencia por odorantes en células MT vecinas En mamíferos las neuronas MT poseen una única dendrita primaria que recibe aferencias sensoriales desde un único glomérulo ubicado, generalmente, centrífugo al soma de la célula (Kishi et al., 1984). Del mismo modo, cada glomérulo representa la activación de un único tipo de receptor (Ressler et al., 1994; Buck, 2000; Mombaerts, 2006). Estudios histológicos utilizando marcaje vía peroxidasa han demostrado que el 96% de las neuronas mitrales que inervan el mismo glomérulo se encuentran separadas por menos de 120 µm. Este porcentaje disminuye a 79% para células conectadas a glomérulos adyacentes. Es más, solo el 29% de las mitrales separadas por menos de 120 µm se conectan a glomérulos lejanos (Buonviso et al., 1991b). Estudios más recientes utilizando un aproximación genética han confirmado que las neuronas que envían su dendrita primaria al mismo glomérulo se encuentran a una distancia de 120-160 µm (Zou et al., 2001). Dado que los tétrodos tienen un radio de detección estimado en alrededor de 65 µm (Gray et al., 1995; Buzsaki, 2004), las neuronas registradas en estos experimentos tienen altas probabilidades de estar conectadas a un mismo glomérulo o, al menos, a glomérulos adyacentes. Por otro lado, varios grupos de investigación han demostrado que glomérulos que responden a determinada estructura química se agrupan juntos en áreas extensas de la superficie del BO (Johnson et al., 1998; Johnson and Leon, 2000a; Uchida et al., 2000; Johnson et al., 2002). Por lo tanto, dichas áreas son activadas simultáneamente con fuerza variable por odorantes químicamente relacionados. Teniendo en consideración la conectividad anatómica de las neuronas MT y la distribución estructurada (odorotópica) de la respuesta de los glomérulos las 97 células MT vecinas tienen muchas posibilidades de recibir la misma aferencia sensorial, o una muy parecida, desde el mismo glomérulo o de glomérulos vecinos. El hecho que la mayoría de los registros obtenidos en MT vecinas hayan mostrado respuestas a odorantes pertenecientes a agrupaciones de glomérulos (racimos) espacialmente muy distantes entre sí, sugiere fuertemente que las células MT no son un simple estación de paso de las aferencias sensoriales provenientes de las NRO. En esta etapa los cambios percibidos por el plano sensorial son fuertemente modificados, tanto así como para cambiar su espectro de sensibilidad química, antes de ser llevados a centros superiores. A pesar de que evidencia obtenida en rebanadas de BO mostró que sólo un 27% de las células mitrales estaban conectadas al mismo glomérulo y un 31% conectada a glomérulos adyacentes (Schoppa and Westbrook, 2001), la gran extensión espacial reportada para los racimos o áreas de quimiotopía (incluso mayor que el área de una rebanada) hace muy improbable que los registros aquí exhibidos provengan de MTs conectadas con glomérulos pertenecientes a racimos con distinta preferencia por grupo químico. ¿Dónde, quiénes y bajo qué mecanismos se generan estas modificaciones en la respuesta de MT vecinas? La estimulación con un único compuesto químico activa una combinación particular de glomérulos que a su vez definen interacciones específicas a través de las células periglomerulares. Dado que las neuronas periglomerulares median interacciones entre glomérulos vecinos y cercanos, es posible plantear que una mezcla de odorantes puede modificar el espectro de respuesta de los glomérulos. Al usar una mezcla de odorantes se generan a este nivel una serie de interacciones, cualitativamente similares pero más complejas dadas por el mayor número de glomérulos activos, que probablemente genera inhibiciones recíprocas entre los glomérulos activos. A pesar de que no se puede descartar totalmente que las interacciones gloméruloglomérulo, mediada por las neuronas periglomerulares, estén involucradas en el cambio en las propiedades sensoriales de MT vecinas, desde el punto de vista de la organización del BO es poco probable. Esto porque las interacciones a nivel de la capa glomerular son principalmente inhibitorias (Aungst et al., 2003) y si bien podrían dar cuenta de la gran respuesta inhibitoria encontrada (figura 11), pero no del hecho que muchos de los pares de células cercanas analizados 98 exhibieran respuesta para odorantes supuestamente codificados por glomérulos ubicados en regiones muy lejanas a donde se ubica su dendrita primaria. En muchos casos las áreas o racimos de glomérulos que responden a un determinante molecular dado están claramente delimitados y no se sobreponen con aquellos que son sensibles a otros compuestos químicos (Uchida et al., 2000; Nagayama et al., 2004). Siguiendo esta misma línea de razonamiento, la gran extensión de estos racimos o áreas hace muy poco probable que las diferencias en la respuesta de células vecinas encontradas se deban a que los registros se realizaron en regiones fronterizas entre dos áreas. Los hallazgos descritos sugieren que el patrón espacial de actividad evocada a nivel del plano sensorial (NRO) es sustancialmente transformado en el BO y que las respuestas de las células MT hacia las aferencias provenientes del epitelio olfatorio son fuertemente moduladas por otros componentes. Estudios previos han mostrado que mecanismos como la inhibición lateral y la inhibición recurrente pueden afectar la descarga de neuronas MT cercanas entre si (Schoppa et al., 1998). Se sabe, por ejemplo, que los potenciales de acción viajan largas distancias (mayores incluso que las áreas o racimos de quimiotopía) dentro de las dendritas secundarias (Christie and Westbrook, 2003) y que las células MT realizan numerosas sinapsis recíprocas con las células granulares a través de estas neuropilas (Shipley and Ennis, 1996). En vertebrados la exposición a mezclas binarias de compuestos demostraron que la representación a nivel glomerular es mucho más predecible que la respuesta de las MT frente al mismo estímulo (Tabor et al., 2004). Esta respuesta alejada de la linealidad probablemente se origine en interacciones como la inhibición lateral. Este mecanismo actúa a distancia y podría, por ejemplo, aumentar la ganancia de estímulos más débiles a nivel de las neuronas MT (Christie and Westbrook, 2006). Esto determinaría un espectro sensorial mucho más amplio que el dado por las aferencias directas, tal como se observó en los registros aquí reportados. Trabajos previos utilizando mamíferos y no mamíferos revelaron que las células MT dentro de ciertas regiones del BO comparten preferencia por odorantes. Muchos de estos trabajos, sin embargo, se llevaron a cabo mediante registros unicelulares de modo que no pudieron ser utilizadas ni las variables temporales (registros 99 simultáneos de más de 1 célula) ni las variables espaciales (proximidad de las células) para comparar la respuesta entre neuronas vecinas. La capacidad del tétrodo para registrar simultáneamente dos o más unidades cercanas a su punta nos permitió medir de manera precisa las características temporales de neuronas vecinas. Del mismo modo, muchos de los experimentos previos utilizaron respiración artificial. Este procedimiento puede haber alterado la actividad espontánea de las MT. A modo de ejemplo, la actividad basal en situaciones bajo respiración artificial es prácticamente inexistente (Imamura et al., 1992; Mori et al., 1992), mientras que en los datos aquí obtenidos todas las neuronas mostraron un grado de actividad espontánea. Experiencias realizadas en ratas despiertas han mostrado que la presencia de cierto nivel de descarga en situaciones libres de estímulo es un hallazgo robusto en cuanto a MT se refiere (Kay and Laurent, 1999). Existe, sin embargo, un trabajo previo que reportó que células MT muy cercanas entre sí (< 40µm) exhiben un perfil de respuesta similar para varios odorantes. Las diferencias encontradas entre esos reportes y los datos aquí presentados pueden tener su explicación en el tipo de estímulo presentado. Buonviso y Chaput utilizaron un protocolo de estímulo único (Buonviso and Chaput, 1990), mientras que en este trabajo se utilizaron mezclas de odorantes químicamente relacionados a mayor concentración que la reportadas por estos autores. Puede haber colaborado el reclutamiento que ocurre cuando más de un odorante está presente y especialmente cuando la concentración aumenta (Fried et al., 2002; Johnson et al., 2002). En estos casos la actividad dentro del BO puede llevar a una actividad diferencial cada vez mayor entre las neuronas MT. Esta diferenciación expande las propiedades del espacio codificante permitiendo la diferenciación entre estímulos muy similares entre sí (Friedrich and Laurent, 2001; Laurent, 2002). A pesar de que se requiere mucha investigación adicional para establecer la real contribución de cada una de las interacciones con otras células y estructuras que posee una MT dada en su respuesta final, los datos aquí mostrados sugieren que las aferencias recibidas desde las NRO son fuertemente transformadas por la red en que cada célula está inmersa. 100 6.1.2 Perfiles de respuesta en células MT vecinas El estudio de Buonviso y Chaput era, hasta la fecha de estos trabajos, uno de los pocos (sino el único) que investigó las propiedades de descarga de células MT cercanas (Buonviso and Chaput, 1990). Este trabajo muestra que la mayoría de los pares de células estudiados exhiben diferencias en sus componentes tanto en la preferencia por odorantes como en el tipo de respuesta exhibida (inhibición/excitación). Es posible argumentar que estas diferencias pueden estar explicadas por los diferentes tipos de neuronas de proyección existentes en el BO: Mitrales y en Penacho (tufted). Estudios relativamente recientes revelaron que ambos tipos celulares poseen diferentes atributos codificantes, pero estos están dados por los patrones de descarga (inhibición/excitación) más que por la selectividad hacia la naturaleza química de los estímulos (Nagayama et al., 2004). Es argumentable que las diferencias encontradas entre células cercanas sean una consecuencia de no poder precisar exactamente si se trata de células Mitrales o en Penacho. En el BO las población de Mitrales es mucho mayor que la de neuronas en Penacho (Shipley and Ennis, 1996) por lo que la probabilidad de registrar Mitrales y en Penacho en un solo registro es baja. Si a esto agregamos el hecho que los datos aquí presentados demuestran que células cercanas difieren principalmente en la selectividad hacia la naturaleza química de los odorantes, más que en propiedades de tasa de descarga, la posibilidad de que las diferencias encontradas se deban a registros simultáneos de Mitrales y en Penachos son bajas. Estos hallazgos refuerzan la hipótesis que sostiene que las aferencias sensoriales de las MT son modificados fuertemente por la actividad de los diversos elementos celulares y dinámicas presentes en el BO (Schoppa and Urban, 2003). Esto sugiere un modelo que tiene a las MT como unidades funcionales independientes, con su propio patrón de respuesta y rango o espectro molecular. Una consecuencia de esta hipótesis es que la actividad en el BO se hace más distribuida. Al ser las MT la unidad funcional la restricción espacial y combinatorial dada por patrón de racimos glomerulares se supera. Esto explica, por ejemplo, la capacidad de realizar discriminación de odorantes incluso con la eliminación de muchos elementos, como lo demuestran estudios en que se realizaron extensas lesiones bulbares (Fecteau and Milgram, 2001). Experimentos transgénicos 101 realizados en pez zebra (Tabor et al., 2004) (Danio rerio) y Drosophila (Wilson et al., 2004b) (Drosophila melanogaster), consistentes con este postulado, demostraron que la preferencia por odorantes dada por la aferencia glomerular se pierde a nivel de las segundas neuronas y, al mismo tiempo, se genera una actividad mucho más distribuida. Esta evidencia anterior, junto con los datos aquí presentados, son consistentes con la idea que la organización espacial dada por los glomérulos es, a lo menos, parcialmente modificada durante la codificación olfatoria a nivel de las células MT. Una consecuencia directa de esta transformación es la aparición en MT vecinas de patrones de selectividad y descarga mucho más complejos que los esperados si sólo se tienen en cuenta sus aferencias glomerulares. 6.1.3 Actividad oscilatoria de las células MT Las oscilaciones en la banda Gamma son un hallazgo robusto en los registros de PCL del BO y numerosos estudios han dado cuenta de su rol en la codificación olfatoria (Adrian, 1950; Gray and Skinner, 1988; Lam et al., 2000; Perez-Orive et al., 2002; Ravel et al., 2003). Para establecer potenciales relaciones entre este ritmo y la descarga de las neuronas MT se midió la actividad oscilatoria individual de estas células. Los datos revelaron la inexistencia de actividad oscilatoria significativa tanto en ausencia como en presencia de odorantes. El hecho de que las neuronas individuales no oscilen, pero que si lo hagan los registros multi-unitarios y el PCL (Nusser et al., 2001; Ravel et al., 2003) sugiere que la actividad de este último pudiera generarse por la suma de descargas episódicas coordinadas dentro de una población dada. En otras palabras cada neurona descarga en sólo alguno de los ciclos de la señal (banda Gamma), pero lo hace de manera temporalmente muy precisa en los ciclos en que descarga (Laurent, 2002; Perez-Orive et al., 2002). Se puede hacer la analogía a un instrumento musical durante un concierto: cada instrumento tiene momentos precisos en que suena o no, pero en cada aparición su sonido y métrica temporal están perfectamente establecidos y alineados con el resto, lo que hace que se genere música armónica. Esto es nuevamente consistente con la idea de que cada neurona MT, con sus propiedades de respuesta individual y única, es capaz de participar en múltiples ensambles neuronales y que estos no están determinados únicamente por las aferencias recibidas 102 desde las NRO (Wilson et al., 2004b). Fue posible observar que las neuronas MT poseen un largo período refractario (~ 11ms). Interesantemente, si bien sufre una modificación, este permanece incluso durante la presentación de odorantes sugiriendo que las MT pueden responder a aferencias inhibitorias que alteren su respuesta incluso durante periodos de estimulación intensa. Esta característica particular no está presente en otras modalidades sensoriales. Si bien es necesario establecer claramente el origen de esta inhibición, es muy posible que esta tenga su génesis en las conexiones reciprocas entre MTs y células granulares. La actividad oscilatoria en banda Gamma (40 - 150Hz) es consistente con el periodo silente de 10 ± 5 ms observado en los datos de neurona única, y es congruente con la idea de una coherencia de fase colectiva como mecanismo de codificación a nivel de las MT en el BO. 6.1.4 Sincronía entre células MT vecinas La sincronía neuronal, en una escala de milisegundos, ha sido propuesta como mecanismo integrador mediante el cual se forman ensambles de unidades (neuronas) que actúan como elementos codificantes. En el presente trabajo se analizó la tasa de sincronía en poblaciones de neuronas MT vecinas. De los 58 pares registrados, únicamente un 2,8% mostró actividad sincrónica durante la estimulación con odorantes. Este resultado contrasta con el de un estudio similar realizado por Kashiwadani et al. (Kashiwadani et al., 1999) en el que se reportó que un 27% de los pares de neuronas de la región dorsomedial del BO mostraron sincronía. Este trabajo reporta la sincronía entre neuronas que responden de la misma manera a un mismo estímulo, lo que genera que la medición se lleve a cabo en un grupo preseleccionado de neuronas. Nuestro trabajo reporta la incidencia total en pares de neuronas que no necesariamente respondieron igualmente frente a los odorantes. Los autores señalan que la sincronía fue registrada en células por más de 300μm y con poca probabilidad de estar conectados al mismo glomérulo. Es más, las diferencias en las tasas de sincronía reportadas pueden deberse, en parte al menos, a los distintos criterios utilizados para definir sincronía. En este trabajo utilizó una simulación de Monte-Carlo 103 con un nivel de corte de 99%, siendo este umbral mucho más estricto que el reportado por Kashiwadani et al. Finalmente el uso de respiración artificial puede alterar las propiedades naturales de descarga de las MT, lograndose mayor sincronía. Los datos obtenidos mostraron que a pesar que se puede registrar sincronía entre neuronas MT cercanas, esta ocurre en niveles muy bajos. Esto llama la atención, sobretodo teniendo en consideración que las neuronas vecinas tienen muchas probabilidades de compartir aferencias provenientes de las mismas NRO. Trabajos realizados en rebanadas mostraron niveles de sincronía significativamente mayores entre neuronas que sinapsan el mismo glomérulo versus aquellas que contactan glomérulos distintos (Schoppa and Westbrook, 2002). Si bien la metodología aquí utilizada no permite establecer directamente la conectividad sináptica de las MT registradas, el bajo nivel de sincronía entre células supuestamente conectadas a un mismo glomérulo, o al menos a glomérulos vecinos, sugieren que existen otros mecanismos que influencian fuertemente el comportamiento temporal de las MT en el BO. Si además se toma en cuenta el bajísimo nivel de oscilaciones a nivel de célula única a pesar de fuerte oscilación del PCL, es posible predecir un nivel bajo de sincronía como el aquí descrito. 104 6.2 Patrones respiratorios en células MT vecinas La modulación de la descarga de las neuronas MT por la respiración es una observación bien documentada (Macrides and Chorover, 1972; Chaput et al., 1992). En estos experimentos describimos que esta modulación es variable entre células vecinas. Dado esto, es posible pensar que los patrones de descarga durante el ciclo respiratorio son utilizados como herramienta codificante por el BO (Buonviso et al., 2003). Al igual que la preferencia por odorantes, los patrones de descarga dentro del ciclo respiratorio son modulados fuertemente por la actividad del BO, lo que también genera las características descritas para los primeros, es decir, individualidad en la respuesta de MT vecinas y cambios importantes en el espectro sensorial dado por las aferencias de las NRO. Dada estas características de individualidad e independencia es posible postular a la descarga de las MT durante el ciclo respiratorio como un elemento codificante utilizado por el BO durante la discriminación sensorial 6.2.1 Rol modulador de la respiración en la actividad neuronal del BO En los experimentos realizados en esta segunda etapa se estudiaron las dinámicas neuronales de las descargas de células MT y PCL asociadas a la respiración durante la estimulación con odorantes. El tétrodo, como se mencionó anteriormente, es una herramienta sumamente útil pues permite el registro simultáneo de múltiples unidades individuales y PCL. Se observó que las neuronas MT pueden reflejar su estimulación no solo mediante cambios en la tasa de descarga, sino también mediante cambios en su patrón de potenciales de acción durante el ciclo respiratorio. Se describió que estas variaciones pueden ocurrir ya sea en la forma de momento preferido del ciclo para descargar (fase), en cuán distribuida o circunscrita es la descarga en torno a una parte del ciclo (magnitud) o en ambas. También se muestra que si bien no es posible observar cambios poblacionales (al analizar las unidades como un todo) significativos, si se producen cambios a escala individual que son específicos para cada estímulo. Lo anterior también es válido para las oscilaciones del PCL donde los promedios poblacionales tienden a 105 mantenerse invariables enmascarando pequeños cambios locales. Se puso énfasis en las bandas Beta (β) y Gamma (γ) ya que estas han sido previamente asociadas a la estimulación olfatoria (Martin et al., 2004b; Martin et al., 2004a). Gamma se ha relacionado a procesos o eventos como detección y Beta a reconocimiento y modulaciones provenientes del SNC (Martin et al., 2006). Su aparición y/o patrón de respuesta se han adjuntado a propiedades del estímulo como la concentración. En el presente trabajo se observó que tanto las oscilación β como γ tienden a actuar como fenómenos individuales y pueden responder a la presencia de estímulos con aumento o disminución de su poder espectral de manera independiente. 6.2.2 La actividad poblacional a gran escala no necesariamente refleja los cambios en la respuesta de las MT frente a la estimulación Los datos obtenidos no muestran cambios significativos en la respuesta de las neuronas MT (medida como un todo) en fase y/o magnitud al estimular con odorantes. La figura 17 no muestra cambios en el número de eventos con respuesta al estimular (figura 17A1). También se observó que ningún estímulo tuvo una respuesta promedio mayor que el control con aire (figura 17A2). Al separar las respuestas por cambios en fase o magnitud, los promedios poblacionales son semejantes para estimulados v/s no estimulados. No hubo diferencias en las distribuciones de magnitud entre las tres épocas y la fase de respuesta está claramente localizada en el último cuarto del ciclo (± 300º) sin importar si los datos provienen de neuronas estimuladas o no. Al utilizar un algoritmo de remuestreo para evitar un sesgo (bias) por bajo muestreo tampoco se logró obtener diferencias (figura 17C y 17D). Este resultado está en concordancia con experiencias previas que muestran que gran parte de la descarga de las células MT ocurre durante la transición inspiración/espiración (Buonviso et al., 2003). La poca o nula diferencia entre épocas se explica principalmente por el hecho que una pequeña fracción de las células muestra 106 respuesta a la estimulación. Del grupo analizado, sólo 13/56 (23,21%) mostraron cambios de fase significativos entre dos épocas del experimento. Esta observación es más palpable cuando se analizan los cambios en magnitud. Sólo 4 células mostraron incrementos significativos en magnitud (7,14%) y 5 (8,93%) descensos significativos. Estos resultados con baja respuesta neuronal están en línea con con trabajos previos que muestran que la actividad en el sistema entero es extremadamente discreta aún en presencia de odorantes (Laurent et al., 2001; Nikonov and Caprio, 2001; Aylwin Mde et al., 2005). La baja tasa de respuesta ha sido descrita en proteínas receptoras, neuronas receptoras olfatorias (NROs), glomérulos y células MT. Es entonces razonable esperar que los cambios en fase y/o magnitud también ocurran en sólo un pequeño número de elementos dentro de la población codificante (neuronas MT). 6.2.3 La respuesta de las células MT es específica para cada odorante Dado que la población mostró muy poco efecto de la estimulación en la población celular, se dirigió el análisis hacia la respuesta individual de las células. El comportamiento de las dinámicas individuales (unidades aisladas) puede utilizarse como un potencial mecanismo codificante. De ser así, debiera se posible observar células con variaciones para ciertos estímulos, pero no para todos. Estas variaciones individuales quedarían ensombrecidas bajo el gran manto poblacional que no mostró cambios. Los potenciales de acción a lo largo del ciclo respiratorio han sido estudiados previamente y medidos con diferentes instrumentos como histogramas de ciclo inhalatorio (Macrides and Chorover, 1972), histogramas sincronizados con la inhalación, funciones complejas (Roux et al., 2007), etc. En este trabajo se utilizó un método relativamente sencillo que permitió caracterizar la descarga de cada una de las células individualmente durante el ciclo respiratorio. Se generó un vector único representativo de cada célula. Esto permitió cuantificar de manera clara la descarga 107 y evitar el uso de métodos cualitativos que agrupan la respuesta en patrones pre-definidos. De esta manera se pudo medir la repuesta de las neuronas a cada uno de los estímulos y detectar pequeñas variaciones. Se conoce la relación y sincronización entre los componentes celulares del sistema olfatorio y el ciclo respiratorio desde las NROs hasta la corteza piriforme, incluyendo el BO. Esta relación se presenta de diversas maneras y ha sido extensamente reportada (Duchamp-Viret et al., 2005). En este trabajo se muestra que la actividad de las células MT durante el ciclo respiratorio no está solo relacionada, o es modificada por, la presencia o ausencia de odorante, sino que también por la naturaleza (identidad) de ese estímulo. La repuesta fue odorante específica y contiene al menos dos elementos, la fase y la magnitud. Ambos se comportan de manera independiente (tabla 1). Esto es altamente sugerente de que las propiedades dinámicas de la respuesta MT durante el ciclo respiratorio pueden ser utilizadas como mecanismo codificante. Como se muestra aquí, la existencia de estas dinámicas está determinada por la presencia del estímulo, son claramente distinguibles del estado basal (control) y cambian de una manera específica sólo para un estímulo determinado. Sería muy interesante contar o desarrollar experimentos que exploren y manipulen estas propiedades de las células MT en animales llevando a cabo una tarea perceptual. De esta manera se podría indagar más en su papel como elementos codificantes en el sistema olfatorio. 6.3 Las oscilaciones del PCL también muestran respuesta dependiente del estímulo dentro de una respuesta global que es más bien estereotipada A pesar que su origen sigue siendo materia de controversia, se reconoce a los patrones oscilatorios del PCL un rol importante en la percepción olfatoria. Como se mencionó previamente, especial atención han capturado las bandas β y γ. En este trabajo se registró la 108 actividad oscilatoria en la capa mitral del BO en ratas anestesiadas encontrándose evidencia que corrobora su rol clave en el olfato. Primero se mostró que, tomado como un todo, la respuesta global del PCL es más bien estereotipada. Esto es especialmente cierto para la banda γ que concentra la mayor actividad instantes después de la transición inspiración/espiración (± 320º). A pesar que los eventos significativos en la banda β fueron menores que los encontrados para γ, la actividad global tiende a concentrarse en torno al punto medio de la inspiración (± 180º)(figura 20). Estos resultados están en concordancia con estudios previos realizados por el grupo de Buonviso refuerzan la idea de que Beta y Gamma tienen distintos momentos de aparición durante el ciclo respiratorio, oscilan alternadamente y se utilizan para procesos distintos dentro de la percepción olfatoria. Los resultados también muestran que existen patrones de oscilación que son dependientes de la naturaleza del estímulo. Tradicionalmente se ha señalado que la actividad del PCL es estereotipada e independiente de la identidad del estímulo (Neville and Haberly, 2003; Buonviso et al., 2006). Es lógico pensar que si la actividad o elementos que dan cuenta de la actividad oscilatoria (células MT) tienen patrones de respuesta particulares para cada estímulo, la actividad resultante de la suma de ellos sea también individual. Una posible explicación para la diferencia de resultados obtenidos en comparación a experiencias previas puede provenir del sitio de registro. En este trabajo se registraron corrientes relativamente pequeñas provenientes de la capa mitral. Se sabe que dentro del BO la principal fuente de corriente para las oscilaciones del PCL no proviene de la actividad de las neuronas MT, sino de la capa granular, donde la masa de células es mayor y donde ocurren la mayor cantidad de interacciones MT/Granulares (Neville and Haberly, 2003) vía sinapsis dendo-dendríticas (Schoppa and Urban, 2003). 109 6.4 Descarga de neuronas MT y oscilaciones del PCL como un mecanismo para codificar la identidad del estímulo en el BO En los últimos años se recogido una gran cantidad de evidencias que sugieren que el BO utiliza las dinámicas temporales como mecanismo codificante. Este mecanismo utiliza un gran número de elementos, dentro de los cuales están la descarga MT y las oscilaciones del PCL, fusionándolos y integrándolos para generar la representación de los odorantes (Buonviso et al., 1992; Laurent, 2002; Perez-Orive et al., 2002; Cang and Isaacson, 2003). Es razonable suponer que el ciclo respiratorio pertenezca a este proceso de múltiples niveles como un componente más, al igual que la descarga de las neuronas MT y las oscilaciones del PCL. Estudios previos han determinado que las dinámicas de los potenciales de acción de las MT tienden a ser estereotipadas y dependen más de la identidad de la célula que las produce que del estímulo que las genera. Es por esto que no han sido propuesta como mecanismo de codificación en el BO (Buonviso et al., 2006). En el presente trabajo, utilizando un método que permite eliminar análisis cualitativos junto con un algoritmo de remuestreo logrando así una mejor medición de los cambios producidos durante el ciclo respiratorio, se muestra que la descarga o actividad de las células MT si refleja la identidad del estímulo. Estas variaciones pueden presentarse como un cambio en la distribución de la descarga en torno a una parte del ciclo (magnitud), un cambio en el momento del ciclo en que la neurona descarga con más frecuencias (fase) o en ambos. Interesantemente, los estímulos que generan desplazamientos en la fase acompañados de variaciones en la magnitud llevan a un mayor cambio de fase que aquellos que solo involucran cambio de fase. Es posible proponer que tanto la fase como la magnitud son utilizados por el sistema como elementos codificantes y que por lo tanto una disyunción total en el patrón basal de descarga (cambio de fase y magnitud) pueden estar relacionados a estímulos que generan una 110 mayor respuesta o activación de esa neurona en especial. De esta manera es posible utilizar esta disyunción como una “marca o etiqueta” para estímulos que por alguna razón (baja concentración, asociados a una situación particular como un alimento, relevancia social, etc.) requieran ser destacados dentro de un ambiente con múltiples estímulos. Las oscilaciones en banda Beta y Gamma han sido asociadas fuertemente a procesos o estados complejos como el aprendizaje (Martin et al., 2006). El aprendizaje, pero también otros como detección y reconocimiento, requieren que ocurran modificaciones de los patrones neuronales que transcurren en el cerebro. Es posible pensar que dichos cambios ocurren constantemente en el SNC, y por cierto en el BO, y que lo que logran procesos como el aprendizaje es rescatar o destacar entre los muchos procesos simultáneos aquellos que tienen relevancia en una situación dada. En este trabajo se muestra que las oscilaciones del PCL no son estacionarias y cambian en circunstancias básicas distintas como la identidad del estímulo. Estas variaciones ocurren dentro de una respuesta a gran escala (poblacional) que es estereotipada y excede en magnitud a estas pequeñas modificaciones. De alguna manera la respuesta pequeña, local, individual es “escondida” u “opacada” por esta enorme respuesta poblacional. Lo mismo es cierto para la descarga de las neuronas MT. Estas pequeñas variaciones por un grupo pequeño de elementos del conjunto proveen de un mecanismo robusto para que tareas complejas como detección y reconocimiento puedan lograrse en períodos cortos de tiempo. En el caso del BO, estos fenómenos pueden dar cuenta de las capacidades del sistema olfatorio para lograr detección y reconocimiento en tan solo un ciclo respiratorio. 111 6.5 Conclusiones En este trabajo se describe las propiedades de poblaciones vecinas de neuronas MT en ratas anestesiadas, respirando libremente mientras fueron expuestas a una estimulación con diferentes conjuntos de odorantes químicamente relacionados entre sí. La heterogeneidad en la respuesta temporal y en la preferencia por odorantes en células muy probablemente conectadas al mismo glomérulo o a glomérulos vecinos, y que por lo tanto que reciben la misma aferencia o similares desde las NRO, indican que estas aferencias (inputs) son intensamente modificadas y moduladas por interacciones con otros elementos de la red del BO en que cada MT está inmersa. Es posible proponer que los módulos de funcionamiento representados por los glomérulos y las MT conectados a ellos son expandidos o aumentados a nivel de célula única a través de una individualización de la respuesta. Una ventaja de esta transformación del BO de las aferencias provenientes de las NRO es que la heterogeneidad en la respuesta de MT puede hacer que estas actúen como elementos que disminuyen y separan la correlación entre características de los odorantes. Esto aumenta significativamente el espacio de representación, lo que aumenta las posibilidades de combinaciones y la robustez del sistema codificante (Laurent, 2002). Conjuntamente se describen los resultados obtenidos al evaluar el rol modulador de la respiración en el BO. Específicamente se midieron los cambios producidos en la descarga de las neuronas MT y en las bandas β y γ del PCL. En este sentido cabe destacar que la respuesta generalizada de la población de MT considerada como un todo es más bien homogénea, estereotipada y relativamente insensible a la estimulación. Dentro de este contexto colectivo es posible observar pequeñas variaciones individuales dentro de la descarga de las células MT. Estas variaciones que puede venir en forma de cambio de fase, magnitud o ambas, es, al contrario de lo especificado para la población general, sensible no sólo a la presencia del estímulo sino que también a la identidad de este. El mismo fenómeno ocurre para las oscilaciones del PCL. La respuesta global es uniforme con una tendencia a la alternancia de β y γ dentro del ciclo respiratorio. Al igual que para neuronas individuales, al analizar de manera detallada las oscilaciones, es posible en 112 ocasiones percibir cambios en el patrón de presentación de estas que son específicos (en esa zona del BO) para los diversos estímulos presentados. En su conjunto los resultados indican que la respuesta a odorantes en el BO es más compleja de lo inicialmente propuesto. Los datos aquí mostrados no concuerdan con la visión de un BO estructurado anatómicamente con zonas, células y respuestas específicas para cierto tipo de odorantes y con patrones estereotipados de descarga u oscilación. Por el contrario están más en línea con otras nuevas hipótesis respecto al funcionamiento del sistema olfatorio (también validadas para sistemas sensoriales y SNC en general) que suponen que las dinámicas neuronales son utilizadas como mecanismos codificantes. De estas ideas se predice el hecho que cada elemento codificante (descarga MT u oscilación del PCL) no está limitado por su posición espacial, sino por las dinámicas que pueda generar con otros elementos. Como la dinámica depende de muchos factores (conectividad, propiedades intrínsecas, estructura celular, etc.), las posibilidades de interacción de un elemento determinado se expanden más allá de los determinantes puramente espaciales. Esto genera que cada elemento sea capaz de pertenecer a un mayor número de ensambles que los predichos por su ubicación. Al contar con esta expansión el olfato se hace más diverso, plástico y robusto, todas ellas características imprescindibles en un sistema que se desenvuelve en un ambiente con prácticamente infinitos estímulos distintos y cambiantes en el tiempo. 113 7. CONCLUSIONES FINALES 7.1 Las neuronas MT poseen un espectro sensorial mayor que el dado únicamente por sus aferencias glomerulares. 7.2 Pares de neuronas MT vecinas tienen distinta preferencia por odorantes, lo que supone que el perfil de respuesta es individual para cada una de estas células. 7.3 Tanto la actividad oscilatoria individual, así como la sincronía neuronal entre células MT vecinas presenta bajos niveles de incidencia. 7.4 El ciclo respiratorio modula la respuesta de las neuronas MT y de las oscilaciones del PCL en el BO. 7.5 La modulación ejercida por el ciclo respiratorio se verifica en cambios en intensidad de la descarga en un momento dado (magnitud), en el cambio del momento de mayor descarga en el ciclo respiratorio (fase) o en ambos. 7.6 Si bien no es posible establecer un patrón poblacional en la modulación de la respiración sobre la descarga MT, existen patrones individuales que son estímulo específico. 7.7 La respuesta de las oscilaciones del PCL no es estereotipada, por el contrario, es posible observar diversos patrones frente a la estimulación. 7.8 Al igual que con las MT, la respuesta poblacional parece no cambiar con la estimulación, pero es posible observar cambios en menor escala que dependen de la identidad del estímulo. 114 8. BIBLIOGRAFIA Adrian ED (1950) The electrical activity of the mammalian olfactory bulb. Electroencephalogr Clin Neurophysiol 2:377-388. Araneda RC, Kini AD, Firestein S (2000) The molecular receptive range of an odorant receptor. Nat Neurosci 3:1248-1255. Aungst JL, Heyward PM, Puche AC, Karnup SV, Hayar A, Szabo G, Shipley MT (2003) Centresurround inhibition among olfactory bulb glomeruli. Nature 426:623-629. Aylwin Mde L, Diaz E, Maldonado PE (2005) Simultaneous single unit recording in the mitral cell layer of the rat olfactory bulb under nasal and tracheal breathing. Biol Res 38:13-26. Bargmann CI (2006) Comparative chemosensation from receptors to ecology. Nature 444:295301. Barlow HB (1972) Single units and sensation: a neuron doctrine for perceptual psychology? Perception 1:371-394. Belluscio L, Lodovichi C, Feinstein P, Mombaerts P, Katz LC (2002) Odorant receptors instruct functional circuitry in the mouse olfactory bulb. Nature 419:296-300. Buck L, Axel R (1991) A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 65:175-187. Buck LB (1996) Information coding in the vertebrate olfactory system. Annu Rev Neurosci 19:517-544. Buck LB (2000) The molecular architecture of odor and pheromone sensing in mammals. Cell 100:611-618. 115 Buonviso N, Chaput MA (1990) Response similarity to odors in olfactory bulb output cells presumed to be connected to the same glomerulus: electrophysiological study using simultaneous single-unit recordings. J Neurophysiol 63:447-454. Buonviso N, Revial MF, Jourdan F (1991a) The Projections of Mitral Cells from Small Local Regions of the Olfactory Bulb: An Anterograde Tracing Study Using PHA-L (Phaseolus vulgaris Leucoagglutinin). Eur J Neurosci 3:493-500. Buonviso N, Chaput MA, Scott JW (1991b) Mitral cell-to-glomerulus connectivity: an HRP study of the orientation of mitral cell apical dendrites. J Comp Neurol 307:57-64. Buonviso N, Chaput MA, Berthommier F (1992) Temporal pattern analyses in pairs of neighboring mitral cells. J Neurophysiol 68:417-424. Buonviso N, Amat C, Litaudon P (2006) Respiratory modulation of olfactory neurons in the rodent brain. Chem Senses 31:145-154. Buonviso N, Amat C, Litaudon P, Roux S, Royet JP, Farget V, Sicard G (2003) Rhythm sequence through the olfactory bulb layers during the time window of a respiratory cycle. Eur J Neurosci 17:1811-1819. Buzsaki G (2004) Large-scale recording of neuronal ensembles. Nat Neurosci 7:446-451. Cang J, Isaacson JS (2003) In vivo whole-cell recording of odor-evoked synaptic transmission in the rat olfactory bulb. J Neurosci 23:4108-4116. Carlsson MA, Galizia CG, Hansson BS (2002) Spatial representation of odours in the antennal lobe of the moth Spodoptera littoralis (Lepidoptera: Noctuidae). Chem Senses 27:231244. Chalansonnet M, Chaput MA (1998) Olfactory bulb output cell temporal response patterns to increasing odor concentrations in freely breathing rats. Chem Senses 23:1-9. 116 Chaput MA, Buonviso N, Berthommier F (1992) Temporal Patterns in Spontaneous and Odourevoked Mitral Cell Discharges Recorded in Anaesthetized Freely Breathing Animals. Eur J Neurosci 4:813-822. Christie JM, Westbrook GL (2003) Regulation of backpropagating action potentials in mitral cell lateral dendrites by A-type potassium currents. J Neurophysiol 89:2466-2472. Christie JM, Westbrook GL (2006) Lateral excitation within the olfactory bulb. J Neurosci 26:2269-2277. Christie JM, Bark C, Hormuzdi SG, Helbig I, Monyer H, Westbrook GL (2005) Connexin36 mediates spike synchrony in olfactory bulb glomeruli. Neuron 46:761-772. Duchamp-Viret P, Chaput MA, Duchamp A (1999) Odor response properties of rat olfactory receptor neurons. Science 284:2171-2174. Duchamp-Viret P, Kostal L, Chaput M, Lansky P, Rospars JP (2005) Patterns of spontaneous activity in single rat olfactory receptor neurons are different in normally breathing and tracheotomized animals. J Neurobiol 65:97-114. Engel AK, Konig P, Gray CM, Singer W (1990) Stimulus-Dependent Neuronal Oscillations in Cat Visual Cortex: Inter-Columnar Interaction as Determined by Cross-Correlation Analysis. Eur J Neurosci 2:588-606. Fecteau J, Milgram NW (2001) The ability to smell remains intact, but does not recover, after olfactory bulb lesions. Int J Neurosci 108:11-20. Fletcher ML, Smith AM, Best AR, Wilson DA (2005) High-frequency oscillations are not necessary for simple olfactory discriminations in young rats. J Neurosci 25:792-798. 117 Fried HU, Fuss SH, Korsching SI (2002) Selective imaging of presynaptic activity in the mouse olfactory bulb shows concentration and structure dependence of odor responses in identified glomeruli. Proc Natl Acad Sci U S A 99:3222-3227. Friedman D, Strowbridge BW (2003) Both electrical and chemical synapses mediate fast network oscillations in the olfactory bulb. J Neurophysiol 89:2601-2610. Friedman-Hill S, Maldonado PE, Gray CM (2000) Dynamics of striate cortical activity in the alert macaque: I. Incidence and stimulus-dependence of gamma-band neuronal oscillations. Cereb Cortex 10:1105-1116. Friedrich RW, Korsching SI (1997) Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron 18:737-752. Friedrich RW, Korsching SI (1998) Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. J Neurosci 18:9977-9988. Friedrich RW, Laurent G (2001) Dynamic optimization of odor representations by slow temporal patterning of mitral cell activity. Science 291:889-894. Galizia CG, Kuttner A, Joerges J, Menzel R (2000) Odour representation in honeybee olfactory glomeruli shows slow temporal dynamics: an optical recording study using a voltagesensitive dye. J Insect Physiol 46:877-886. Georgopoulos AP, Schwartz AB, Kettner RE (1986) Neuronal population coding of movement direction. Science 233:1416-1419. Getz WM, Akers RP (1994) Honeybee olfactory sensilla behave as integrated processing units. Behav Neural Biol 61:191-195. 118 Gheusi G, Cremer H, McLean H, Chazal G, Vincent JD, Lledo PM (2000) Importance of newly generated neurons in the adult olfactory bulb for odor discrimination. Proc Natl Acad Sci U S A 97:1823-1828. Giraudet P, Berthommier F, Chaput M (2002) Mitral cell temporal response patterns evoked by odor mixtures in the rat olfactory bulb. J Neurophysiol 88:829-838. Goldberg JM, Brown PB (1969) Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J Neurophysiol 32:613-636. Gray CM, Skinner JE (1988) Field potential response changes in the rabbit olfactory bulb accompany behavioral habituation during the repeated presentation of unreinforced odors. Exp Brain Res 73:189-197. Gray CM, Viana Di Prisco G (1997) Stimulus-dependent neuronal oscillations and local synchronization in striate cortex of the alert cat. J Neurosci 17:3239-3253. Gray CM, Maldonado PE, Wilson M, McNaughton B (1995) Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. J Neurosci Methods 63:43-54. Guthrie KM, Gall CM (1995) Functional mapping of odor-activated neurons in the olfactory bulb. Chem Senses 20:271-282. Hamdani el H, Doving KB (2007) The functional organization of the fish olfactory system. Prog Neurobiol 82:80-86. Hardy A, Palouzier-Paulignan B, Duchamp A, Royet JP, Duchamp-Viret P (2005) 5Hydroxytryptamine action in the rat olfactory bulb: in vitro electrophysiological patchclamp recordings of juxtaglomerular and mitral cells. Neuroscience 131:717-731. 119 Heinbockel T, Christensen TA, Hildebrand JG (1999) Temporal tuning of odor responses in pheromone-responsive projection neurons in the brain of the sphinx moth Manduca sexta. J Comp Neurol 409:1-12. Hu J, Zhong C, Ding C, Chi Q, Walz A, Mombaerts P, Matsunami H, Luo M (2007) Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science 317:953-957. Hubel DH, Wiesel TN (1968) Receptive fields and functional architecture of monkey striate cortex. J Physiol 195:215-243. Imamura K, Mataga N, Mori K (1992) Coding of odor molecules by mitral/tufted cells in rabbit olfactory bulb. I. Aliphatic compounds. J Neurophysiol 68:1986-2002. Inaki K, Takahashi YK, Nagayama S, Mori K (2002) Molecular-feature domains with posterodorsal-anteroventral polarity in the symmetrical sensory maps of the mouse olfactory bulb: mapping of odourant-induced Zif268 expression. Eur J Neurosci 15:1563-1574. Isaacson JS (1999) Glutamate spillover mediates excitatory transmission in the rat olfactory bulb. Neuron 23:377-384. Johnson BA, Leon M (2000a) Modular representations of odorants in the glomerular layer of the rat olfactory bulb and the effects of stimulus concentration. J Comp Neurol 422:496-509. Johnson BA, Leon M (2000b) Odorant molecular length: one aspect of the olfactory code. J Comp Neurol 426:330-338. Johnson BA, Leon M (2007) Chemotopic odorant coding in a mammalian olfactory system. J Comp Neurol 503:1-34. 120 Johnson BA, Woo CC, Leon M (1998) Spatial coding of odorant features in the glomerular layer of the rat olfactory bulb. J Comp Neurol 393:457-471. Johnson BA, Farahbod H, Xu Z, Saber S, Leon M (2004) Local and global chemotopic organization: general features of the glomerular representations of aliphatic odorants differing in carbon number. J Comp Neurol 480:234-249. Johnson BA, Ho SL, Xu Z, Yihan JS, Yip S, Hingco EE, Leon M (2002) Functional mapping of the rat olfactory bulb using diverse odorants reveals modular responses to functional groups and hydrocarbon structural features. J Comp Neurol 449:180-194. Kang J, Caprio J (1995) Electrophysiological responses of single olfactory bulb neurons to amino acids in the channel catfish, Ictalurus punctatus. J Neurophysiol 74:1421-1434. Kang J, Caprio J (1997) In vivo responses of single olfactory receptor neurons of channel catfish to binary mixtures of amino acids. J Neurophysiol 77:1-8. Kashiwadani H, Sasaki YF, Uchida N, Mori K (1999) Synchronized oscillatory discharges of mitral/tufted cells with different molecular receptive ranges in the rabbit olfactory bulb. J Neurophysiol 82:1786-1792. Katoh K, Koshimoto H, Tani A, Mori K (1993) Coding of odor molecules by mitral/tufted cells in rabbit olfactory bulb. II. Aromatic compounds. J Neurophysiol 70:2161-2175. Kay LM, Freeman WJ (1998) Bidirectional processing in the olfactory-limbic axis during olfactory behavior. Behav Neurosci 112:541-553. Kay LM, Laurent G (1999) Odor- and context-dependent modulation of mitral cell activity in behaving rats. Nat Neurosci 2:1003-1009. Kepecs A, Uchida N, Mainen ZF (2006) The sniff as a unit of olfactory processing. Chem Senses 31:167-179. 121 Kepecs A, Uchida N, Mainen ZF (2007) Rapid and precise control of sniffing during olfactory discrimination in rats. J Neurophysiol 98:205-213. Kishi K, Mori K, Ojima H (1984) Distribution of local axon collaterals of mitral, displaced mitral, and tufted cells in the rabbit olfactory bulb. J Comp Neurol 225:511-526. Kloppenburg P, Mercer AR (2008) Serotonin modulation of moth central olfactory neurons. Annu Rev Entomol 53:179-190. Lam YW, Cohen LB, Wachowiak M, Zochowski MR (2000) Odors elicit three different oscillations in the turtle olfactory bulb. J Neurosci 20:749-762. Laurent G (1996) Dynamical representation of odors by oscillating and evolving neural assemblies. Trends Neurosci 19:489-496. Laurent G (1999) A systems perspective on early olfactory coding. Science 286:723-728. Laurent G (2002) Olfactory network dynamics and the coding of multidimensional signals. Nat Rev Neurosci 3:884-895. Laurent G, Naraghi M (1994) Odorant-induced oscillations in the mushroom bodies of the locust. J Neurosci 14:2993-3004. Laurent G, Stopfer M, Friedrich RW, Rabinovich MI, Volkovskii A, Abarbanel HD (2001) Odor encoding as an active, dynamical process: experiments, computation, and theory. Annu Rev Neurosci 24:263-297. Leon M, Johnson B (2006) Functional units in the olfactory system. Proc Natl Acad Sci U S A 103:14985-14986. Lin HH, Lin CY, Chiang AS (2007) Internal representations of smell in the Drosophila brain. J Biomed Sci 14:453-459. 122 Lledo PM, Gheusi G, Vincent JD (2005) Information processing in the mammalian olfactory system. Physiol Rev 85:281-317. Lodovichi C, Belluscio L, Katz LC (2003) Functional topography of connections linking mirrorsymmetric maps in the mouse olfactory bulb. Neuron 38:265-276. MacLeod K, Laurent G (1996) Distinct mechanisms for synchronization and temporal patterning of odor-encoding neural assemblies. Science 274:976-979. Macrides F, Chorover SL (1972) Olfactory bulb units: activity correlated with inhalation cycles and odor quality. Science 175:84-87. Maldonado PE, Gray CM (1996) Heterogeneity in local distributions of orientation-selective neurons in the cat primary visual cortex. Vis Neurosci 13:509-516. Maldonado PE, Friedman-Hill S, Gray CM (2000) Dynamics of striate cortical activity in the alert macaque: II. Fast time scale synchronization. Cereb Cortex 10:1117-1131. Margrie TW, Sakmann B, Urban NN (2001) Action potential propagation in mitral cell lateral dendrites is decremental and controls recurrent and lateral inhibition in the mammalian olfactory bulb. Proc Natl Acad Sci U S A 98:319-324. Martin C, Gervais R, Messaoudi B, Ravel N (2006) Learning-induced oscillatory activities correlated to odour recognition: a network activity. Eur J Neurosci 23:1801-1810. Martin C, Gervais R, Hugues E, Messaoudi B, Ravel N (2004a) Learning modulation of odorinduced oscillatory responses in the rat olfactory bulb: a correlate of odor recognition? J Neurosci 24:389-397. Martin C, Gervais R, Chabaud P, Messaoudi B, Ravel N (2004b) Learning-induced modulation of oscillatory activities in the mammalian olfactory system: the role of the centrifugal fibres. J Physiol Paris 98:467-478. 123 Meister M, Bonhoeffer T (2001) Tuning and topography in an odor map on the rat olfactory bulb. J Neurosci 21:1351-1360. Meredith M (1986) Patterned response to odor in mammalian olfactory bulb: the influence of intensity. J Neurophysiol 56:572-597. Moberg PJ, Agrin R, Gur RE, Gur RC, Turetsky BI, Doty RL (1999) Olfactory dysfunction in schizophrenia: a qualitative and quantitative review. Neuropsychopharmacology 21:325340. Mombaerts P (1999) Molecular biology of odorant receptors in vertebrates. Annu Rev Neurosci 22:487-509. Mombaerts P (2004) Odorant receptor gene choice in olfactory sensory neurons: the one receptor-one neuron hypothesis revisited. Curr Opin Neurobiol 14:31-36. Mombaerts P (2006) Axonal wiring in the mouse olfactory system. Annu Rev Cell Dev Biol 22:713-737. Mombaerts P, Wang F, Dulac C, Chao SK, Nemes A, Mendelsohn M, Edmondson J, Axel R (1996) Visualizing an olfactory sensory map. Cell 87:675-686. Mori K, Kishi K, Ojima H (1983) Distribution of dendrites of mitral, displaced mitral, tufted, and granule cells in the rabbit olfactory bulb. J Comp Neurol 219:339-355. Mori K, Mataga N, Imamura K (1992) Differential specificities of single mitral cells in rabbit olfactory bulb for a homologous series of fatty acid odor molecules. J Neurophysiol 67:786-789. Mori K, Nagao H, Yoshihara Y (1999) The olfactory bulb: coding and processing of odor molecule information. Science 286:711-715. 124 Nagayama S, Takahashi YK, Yoshihara Y, Mori K (2004) Mitral and tufted cells differ in the decoding manner of odor maps in the rat olfactory bulb. J Neurophysiol 91:2532-2540. Neville KR, Haberly LB (2003) Beta and gamma oscillations in the olfactory system of the urethane-anesthetized rat. J Neurophysiol 90:3921-3930. Nikonov AA, Caprio J (2001) Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. J Neurophysiol 86:1869-1876. Nusser Z, Kay LM, Laurent G, Homanics GE, Mody I (2001) Disruption of GABA(A) receptors on GABAergic interneurons leads to increased oscillatory power in the olfactory bulb network. J Neurophysiol 86:2823-2833. Perez-Orive J, Mazor O, Turner GC, Cassenaer S, Wilson RI, Laurent G (2002) Oscillations and sparsening of odor representations in the mushroom body. Science 297:359-365. Pignatelli A, Belluzzi O (2008) Cholinergic Modulation of Dopaminergic Neurons in the Mouse Olfactory Bulb. Chem Senses. Porter J, Craven B, Khan RM, Chang SJ, Kang I, Judkewitz B, Volpe J, Settles G, Sobel N (2007) Mechanisms of scent-tracking in humans. Nat Neurosci 10:27-29. Ravel N, Chabaud P, Martin C, Gaveau V, Hugues E, Tallon-Baudry C, Bertrand O, Gervais R (2003) Olfactory learning modifies the expression of odour-induced oscillatory responses in the gamma (60-90 Hz) and beta (15-40 Hz) bands in the rat olfactory bulb. Eur J Neurosci 17:350-358. Reed RR, Bakalyar HA, Cunningham AM, Levy NS (1992) The molecular basis of signal transduction in olfactory sensory neurons. Soc Gen Physiol Ser 47:53-60. 125 Ressler KJ, Sullivan SL, Buck LB (1994) Information coding in the olfactory system: evidence for a stereotyped and highly organized epitope map in the olfactory bulb. Cell 79:12451255. Ronnett GV, Moon C (2002) G proteins and olfactory signal transduction. Annu Rev Physiol 64:189-222. Roskies AL (1999) The binding problem. Neuron 24:7-9, 111-125. Roux SG, Cenier T, Garcia S, Litaudon P, Buonviso N (2007) A wavelet-based method for local phase extraction from a multi-frequency oscillatory signal. J Neurosci Methods 160:135143. Roux SG, Garcia S, Bertrand B, Cenier T, Vigouroux M, Buonviso N, Litaudon P (2006) Respiratory cycle as time basis: an improved method for averaging olfactory neural events. J Neurosci Methods 152:173-178. Rubin BD, Katz LC (1999) Optical imaging of odorant representations in the mammalian olfactory bulb. Neuron 23:499-511. Rubin BD, Katz LC (2001) Spatial coding of enantiomers in the rat olfactory bulb. Nat Neurosci 4:355-356. Schild D, Restrepo D (1998) Transduction mechanisms in vertebrate olfactory receptor cells. Physiol Rev 78:429-466. Schoppa NE (2006) Synchronization of olfactory bulb mitral cells by precisely timed inhibitory inputs. Neuron 49:271-283. Schoppa NE, Westbrook GL (2001) Glomerulus-specific synchronization of mitral cells in the olfactory bulb. Neuron 31:639-651. 126 Schoppa NE, Westbrook GL (2002) AMPA autoreceptors drive correlated spiking in olfactory bulb glomeruli. Nat Neurosci 5:1194-1202. Schoppa NE, Urban NN (2003) Dendritic processing within olfactory bulb circuits. Trends Neurosci 26:501-506. Schoppa NE, Kinzie JM, Sahara Y, Segerson TP, Westbrook GL (1998) Dendrodendritic inhibition in the olfactory bulb is driven by NMDA receptors. J Neurosci 18:6790-6802. Shipley MT, Ennis M (1996) Functional organization of olfactory system. J Neurobiol 30:123176. Singer W (1999) Neuronal synchrony: a versatile code for the definition of relations? Neuron 24:49-65, 111-125. Singer W, Gray CM (1995) Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci 18:555-586. Spors H, Grinvald A (2002) Spatio-temporal dynamics of odor representations in the mammalian olfactory bulb. Neuron 34:301-315. Stopfer M, Laurent G (1999) Short-term memory in olfactory network dynamics. Nature 402:664-668. Stopfer M, Bhagavan S, Smith BH, Laurent G (1997) Impaired odour discrimination on desynchronization of odour-encoding neural assemblies. Nature 390:70-74. Sullivan RM, Wilson DA, Leon M (1989) Norepinephrine and learning-induced plasticity in infant rat olfactory system. J Neurosci 9:3998-4006. Tabor R, Yaksi E, Weislogel JM, Friedrich RW (2004) Processing of odor mixtures in the zebrafish olfactory bulb. J Neurosci 24:6611-6620. Tanaka K (1993) Neuronal mechanisms of object recognition. Science 262:685-688. 127 Uchida N, Mainen ZF (2003) Speed and accuracy of olfactory discrimination in the rat. Nat Neurosci 6:1224-1229. Uchida N, Takahashi YK, Tanifuji M, Mori K (2000) Odor maps in the mammalian olfactory bulb: domain organization and odorant structural features. Nat Neurosci 3:1035-1043. Varela F, Lachaux JP, Rodriguez E, Martinerie J (2001) The brainweb: phase synchronization and large-scale integration. Nat Rev Neurosci 2:229-239. Vogels R (1990) Population coding of stimulus orientation by striate cortical cells. Biol Cybern 64:25-31. von der Malsburg C (1999) The what and why of binding: the modeler's perspective. Neuron 24:95-104, 111-125. Wang X (2007) Neural coding strategies in auditory cortex. Hear Res 229:81-93. Wilson DA, Fletcher ML, Sullivan RM (2004a) Acetylcholine and olfactory perceptual learning. Learn Mem 11:28-34. Wilson RI, Mainen ZF (2006) Early events in olfactory processing. Annu Rev Neurosci 29:163201. Wilson RI, Turner GC, Laurent G (2004b) Transformation of olfactory representations in the Drosophila antennal lobe. Science 303:366-370. Yang X, Renken R, Hyder F, Siddeek M, Greer CA, Shepherd GM, Shulman RG (1998) Dynamic mapping at the laminar level of odor-elicited responses in rat olfactory bulb by functional MRI. Proc Natl Acad Sci U S A 95:7715-7720. Yokoi M, Mori K, Nakanishi S (1995) Refinement of odor molecule tuning by dendrodendritic synaptic inhibition in the olfactory bulb. Proc Natl Acad Sci U S A 92:3371-3375. 128 Zhang X, Firestein S (2002) The olfactory receptor gene superfamily of the mouse. Nat Neurosci 5:124-133. Zhang X, Rodriguez I, Mombaerts P, Firestein S (2004) Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics 83:802-811. Zou Z, Horowitz LF, Montmayeur JP, Snapper S, Buck LB (2001) Genetic tracing reveals a stereotyped sensory map in the olfactory cortex. Nature 414:173-179. 129