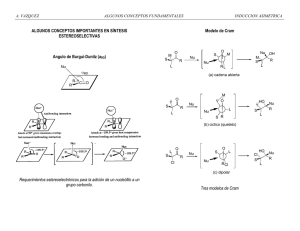
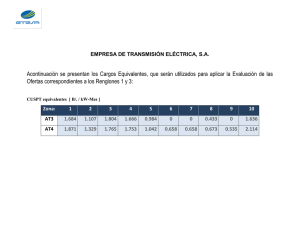
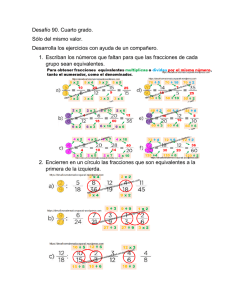
enoles y enolatos!!
Anuncio

ENOLES Y ENOLATOS!!... ENOLATOS!! CARBONILO PARTE 2!!! Podemos aceptar a una mezcla Como un compuesto puro? El equilibrio de tautomerismo!! Hay cambio en el pH ?? Por que el equilibrio favorece la forma ceto? Siempre hay algo del enol…aunque no lo detectemos… En e el NMR…los os p protones oto es desapa desaparecen ece e en D2O O… Pero se ven en masas!! La catálisis puede ser ácida o básica!! Ojo: el equilibrio sigue desplazado hacia el carbonilo! El anion intermedio en la catálisis básica se llama “ENOLATO” Que será más básico…un alcóxido ó un enolato? En el enolato…el oxígeno obtiene más de la carga negativa…pero El carbono obtiene más del HOMO…por que en el enolato los OM son De menor energía? Entonces por que esto? Entonces…por Quienes pueden formar enoles ó enolatos?? E t Entonces, cuall es ell requisito i it para Enolisar?? ENOLES ESTABLES! Cinéticamente!! ENOLES O S ESTABLES! S S Termodinámicamente!! Por que la vitamina C le dicen “ácido ascórbico” ?? Uno de los más estables de todos los enoles… Por que?? Conocido antiguamente como “ácido carbólico” Consecuencias del tautomerismo ceto-enol 1) Los carbonilos insaturados prefieren estar C j Conjugados!! d !! 2) Racemización!! Reacciones con enoles o enolatos como intermedios Halogenación!! Que p pasa en medio básico? pKa CHBr3 ~ 9 Prueba del Iodoformo!! …metilcetonas!! Por que lo del haloformo no ocurre en medio ácido? …cada cada ves menos básico! Nitrosación de enoles! EQUIVALENTES ESTABLES DE ENOLATOS!! Enol Eter s Enol-Eter“s” Reacciones de los Enol-Eter“s” 1) Hidrólisis Pero hasta Acá es como lo mismo… Entonces por que son lábiles? Grupo protector importantísimo!! …Ahora podemos halogenar en la posición menos sustituída!! Alquilación q de Enolatos Dos estrategias para resolver el problema: NITRILOS!! NITROALCANOS!! Alquilando enolatos de litio!! Alquilación de Ésteres Alquilación de ácidos De los 3 centros anionicos anionicos, cual es el más reactivo? Recordando! Alquilación de aldehídos! No se debe usar enolatos de litio de aldehídos Equivalentes de enolato…como solucionar el problema de los aldehídos? •Enaminas •Silil-enol-eteres •Aza-enolatos y derivados de iminas Silil-enol-eteres son alquilados por electrófilos tipo SN1…con ácidos Lewis! Aza-enolatos….una solución más general que las enaminas! Alquilación de compuestos dicarbonílicos!! REGIOSELECTIVIDAD EN LA ALQUILACIÓN DE CETONAS Control termodinámico: Pero por que las condiciones típicas de formación de silil-enol-eteres favorecen el más sustituido?..... 1) La base es muy debil…asi que lo primero es una interacción con el silicio Otra explicación…. Control cinético: En el experimento se adiciona la cetona a exceso de LDA en THF El papel de las enonas en el control de la regioselectividad!! Montaje para NH3 líquido Y luego rxn de Birch! Ryoji Noyori Premio nobel 2001 CONDENSACIÓN ALDÓLICA Como son las expresiones de velocidad ? A veces deshidrata..a veces no! También ocurre en medio ácido!! Y también deshidrata En resumen...tanto en medio básico como ácido!! CONDENSACIONES CRUZADAS!! Cuando usar condiciones de equilibrio? q Condenada al fracaso...por que? …de los que pueden enolizar pero que no son electrofílicos Como sintetizarían el compuesto de defensa de las termitas? Algunos experimentos en condiciones de equilibrio: Enolatos de Litio en la reacción aldólica Silil-enol éteres en la reacción aldólica Reactivos de Wittig conjugados como equivalentes de enoles específicos!! 1,3-dicarbonilos como equivalentes de enoles La reacción de Knoevenagel Equivalentes de enoles para derivados de á. carboxílicos Anhídros!! La reacción de Perkin Ésteres Reactivos de Reformatsky….solo para ésteres Ácidos carboxílicos Equivalentes de enolatos para aldehídos!! En resumen: Para aldólicas cruzadas con aldehídos… Equivalentes de enoles para cetonas Si se d desea que lla aldólica ldóli ocurra por ell lado l d más á impedido…. i did L reacción La ió de d Mannich M i h Las aldólicas más fáciles…e impresionantes!! Resumiendo La acilación de Claisen La rxn llega a completación Gracias a la desprotonación irreversible! La reacción completa sería: Donde ataca…en el carbono o en el oxígeno y porque? La desprotonación si es clave! La versión intramolecular se conoce como la Condensación de Dieckmann Condensaciones de Claisen cruzadas!! Los mismos principios de la aldólica...condenada al fracaso? Comparemos p el LUMO de un ester Con el del oxalato… Los 3 primeros L i son más á electrofílicos l t fíli de lo normal para un ester!! Ejemplos de cruzadas en equilibrio…siempre preguntarse… condenadas al fracaso? Un caso donde la inter es mejor que la intra Sin problemas tipo Mannich!! Escribamos el mecanismo para: Como con la aldólica…cuando es intramolecular no hay problema!! Y si la reacción esta condenada al fracaso…? Una síntesis interesante…el factor A Con los equivalentes de enolates de á. carboxílicos… tambien funciona! Las enaminas aquí si sirven!! Los aza-enolatos también!! Y en medios ácidos también funciona!!... Un ejemplo condenado al fracaso en medio básico…pero no en medio ácido!! Dibujemos el mecanismo!! Más ejemplos: Como será el mecanismo? Adición conjugada de enolatos!! Aquí todo es control termodinámico! Factores que afectan la adición directa vs conjugada! Para recordar! Los ideales son los 1,3-dicarbonilos! La adición conjugada puede ser catalítica en base!! Los enoles sirven para la adición conjugada! Mecanismo? Las enaminas son incluso mejores que los enoles (pero no tanto como los dicarbonilos!) Pero ojo, recuerden que las enaminas se forman por el lado menos impedido… El mejor complemento de enaminas!! Los mejores sustratos para las conjugadas!! Una combinación poderosa!! Los nitrilos conjugados son mejores y los nitros l campeones!! los !! Un truquito para los aminoácidos!! La anelación de ROBINSON Ejemplos de anelaciones de Robinson: Michael-Robinson POWER!! Y que tal si hacemos una conjugada + Claisen? Proponga mecanismo para: Los nitroalcanos son excelentes para las conjugadas! vivalan i l POR FIN