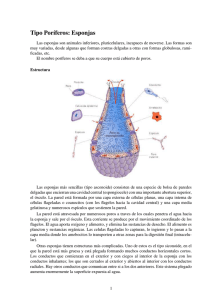
esponjas de polisacaridos para el cultivo y transpsorte de celulas.
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS 11 Número de publicación: 2 206 707 51 Int. Cl. : A61L 27/20 7 A61L 27/56 C08J 9/00 C12N 5/00 C12N 5/06 ESPAÑA 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 97920932 .7 86 Fecha de presentación: 21.05.1997 87 Número de publicación de la solicitud: 0901384 87 Fecha de publicación de la solicitud: 17.03.1999 54 Título: Esponjas de polisacáridos para el cultivo y transporte de células. 30 Prioridad: 22.05.1996 IL 11837696 73 Titular/es: BEN-GURION UNIVERSITY OF THE NEGEV RESEARCH AND DEVELOPMENT AUTHORITY 1 Hashalom Street Beer-Sheva 84419, IL 45 Fecha de publicación de la mención BOPI: 16.05.2004 72 Inventor/es: Shapiro, Lilia; Glicklis, Rachel y Cohen, Smadar 45 Fecha de la publicación del folleto de la patente: 74 Agente: Carpintero López, Francisco ES 2 206 707 T3 16.05.2004 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid ES 2 206 707 T3 DESCRIPCIÓN Esponjas de polisacáridos para el cultivo y transporte de células. 5 10 15 Campo de la invención a presente invención se refiere a nuevas esponjas de polisacárido reabsorbibles, un procedimiento para su preparación y usos de las mismas para el cultivo de células de mamíferos in vitro, así como el uso de las mismas como matrices, soportes o estructuras para el implante en un paciente con el fin de reemplazar tejido lesionado o extirpado, el implante de esponjas de polisacárido sirviendo como un sustrato, matriz o estructura destinada a que la invada el tejido circundante, para que prolifere sobre ella y eventualmente forme una parte activa del tejido u órgano en el que se ha realizado el implante, o el implante sirviendo como un sustrato inicial para la vascularización del tejido hospedador circundante, y una vez vascularizado, las células elegidas de desarrolladas in vitro u obtenidas a partir del hospedador se pueden inyectar en el implante vascularizado para permitir una aclimatación y proliferación rápida de las células que formarán posteriormente un reemplazo activo del órgano del tejido que se lesionó o se extirpó. La esponja de polisacárido también puede servir como sustrato, matriz o estructura para el transplante de células desarrolladas inicialmente sobre ella in vitro en un paciente para reemplazar el tejido no funcional lesionado o extirpado. Antecedentes de la invención y técnica anterior 20 25 30 35 40 45 50 55 60 65 Las matrices porosas y absorbibles fabricadas a partir de polímeros naturales y sintéticos (véase, por ejemplo, Yannas 1990; Natsumi y col., 1993: Grande. 1989: Vacanti, 1990; Mikos y col., 1993a; Mikos yt col., 1993b; Mikos y col., 1993c; y Langer y Vacanti, 1993), actualmente en uso o en investigación como implantes para facilitar la regeneración de tejido en los defectos producidos por enfermedad, trauma o procedimientos quirúrgicos reconstructivos. Estas matrices se han usado solas o sembradas con células con el propósito de transplante celular y tisular (Langer y Vacanti, 1993). El transplante celular puede un tratamiento alternativo para el transplante de órganos completos de órganos que fallan o funcionan mal tales como hígado y páncreas. Ya que muchas poblaciones de células aisladas se pueden expandir in vitro usando técnicas de cultivo celular in vitro, solamente un número muy pequeño de células donantes se necesitan para preparar un implante adecuado. Consecuentemente, cuando se toman tales células de un donante vivo, el donante vivo no necesita sacrificar un órgano entero. Además, para el propósito de la terapia génica, los vectores de transferencia génica se pueden introducir se pueden introducir en diversos tipos de células, tales como por ejemplo, hepatocitos, fibroblastos, queratinocitos, células endoteliales y mioblastos, que después se transplantan en el hospedador para la producción y liberación local de proteínas y otros fármacos o agentes. Otra aplicación de las matrices porosas ha sido como estructuras para investigar la conducta de las células en un armazón tridimensional in vitro (Jain y col., 1990; Doane y Brik, 1991). En algunas aplicaciones, estas matrices porosas se diseñan para que sirvan como análogos de la matriz extracelular con el fin de proporcionar un sustrato adecuado para unión celular que permita ciertos procedimientos dependientes de anclaje tales como migración, mitosis, y síntesis de matrices (Folkman y Moscona, 1978). En este aspecto, se considera que tales análogos de la matriz extracelular puede ser capaz de modular la conducta celular de una manera similar a la forma en la que la matriz extracelular nativa hace esto (véase Madri y Brasson, 1992), se cree que la química de estos análogos, así como sus características porosas tales como porcentaje de porosidad, tamaño de poro y orientación, puede influir en la densidad y distribución de las células en la matriz y por lo tanto afectar al proceso de regeneración cuando estos análogos se usan en transplantes. Las esponjas biorreabsorbibles pueden también proporcionar una estructura temporal para células transplantadas, y, por lo tanto, permiten a las células secretar la matriz extracelular de su propiedad para permitir, a largo plazo, un reemplazo de tejido completo y natural. La estructura macromolecular de estas esponjas se selecciona de manera que sean completamente degradables y se eliminen una vez que han logrado su función de proporcionar el soporte artificial inicial para las células recientemente trasplantadas. Para que estas esponjas sean útiles en transplantes celulares, deben ser altamente porosas con grandes relaciones superficie/volumen con el fin de acomodar un gran número de células, deben ser biocompatibles, es decir, no tóxicas para las células que llevan y para el tejido hospedador en el que se trasplantan, deben ser capaces de promover adherencia celular y permitir la retención de la función diferenciadas de las células unidas. Sin embargo, en la mayoría de las matrices porosas descritas hasta la fecha, las que se han preparado y usado exitosamente en implantes o transplantes se han limitado a las que llevan una capa muy delgada de células, siendo principalmente las que sirven como sustitutos o reemplazos de piel (véase, por ejemplo, Yannas, 1990). En vista de esta aplicación limitada, las matrices desarrolladas son las que la porosidad y tamaño de poro han sido del tipo que ha sido suficientemente cercano para permitir la dispersión de la capa delgada de células en la matriz. Sin embargo, cuando tales matrices se van a usar con células tales como, por ejemplo, hepatocitos que crecen en agregados de células y con un espesor mayor que el espesor con estas matrices primitivas se diseñan para soportar, un problema serio surge con relación a la adecuada difusión de oxígeno y nutrientes a las células internas en la matriz, con el resultado que estas capas internas o inferiores de células usualmente mueren. De este modo, estas matrices primitivas pueden ser útiles para preparar equivalentes de piel, pero son mucho menos útiles para la preparación de equivalentes de órganos funcionales hechos de agregados celulares multicapas, tanto in vitro como con transplante posterior in vivo. La mayoría de las matrices porosas desarrolladas hasta la fecha, como se ha indicado anteriormente, se basan en polímeros naturales tales como colágeno, o polímeros sintéticos de la familia del ácido láctico/glicólico. Las matrices 2 ES 2 206 707 T3 5 a base de colágeno tienen diversas desventajas, que incluyen: se degradan a una velocidad relativamente rápida: desapareciendo muchas tan pronto como cuatro semanas después del transplante (véase Olde Damink y col., 1995; Ben Yishay y col., 1995). Aunque la velocidad de degradación de la matriz de colágeno se puede reducir mediante reticulación con glutaraldehído, sin embargo, las matrices resultantes reticuladas mostraban inmunogenicidad, calcificación y cicatrización fibrosa cuando se implantaban durante largos períodos (véase Timple y col., 1980). Además, las matrices de colágeno no son adecuadas para cultivos prolongados de células in vitro, debido a la contracción significativa de la estructura de colágeno, que se produce después de aproximadamente una semana de incubación, haciendo esta estructura de colágeno menos susceptible a tratamiento quirúrgico cuando se intenta el uso como matriz de transplante (Ben - Yishay, 1995). 10 15 20 25 30 35 Otras espumas biodegradables sintéticas a base de poli(ácido D, L-láctico-co-glicólico) se han desarrollado como estructuras para ingeniería de tejidos, como se ha indicado anteriormente, pero estos polímeros son hidrófobos, cuando una suspensión celular o medio de cultivo se sitúa en estas espumas o se inyectan en su interior, la mayoría de sus poros permanecen vacíos, dando como resultado la infrautilización del volumen de estas espumas. Además, los estudios también han mostrado que la degradación de estas espumas biodegradables da como resultado la acumulación significativa de productos ácidos que disminuyen significativamente el pH interno en la espuma hasta un pH inferior a 3,0 (véase Park Lu y Crotts, 1995), cuya acidez es mucho más dañina para el crecimiento de las células. Previamente los alginatos se han usado para el propósito de transplante celular. Los alginatos son polímeros de polisacáridos naturales, la palabra “alginato” se refiere realmente a una familia de copolímeros polisacáridos polianiónicos derivados de algas pardas marinas y comprenden residuos de ácidos β-D-manurónico (M) y α-L-gulurónico (G) unidos en 1,4 en proporciones variables. El alginato es soluble en soluciones acuosas a temperatura ambiente, y es capaz de formar geles estables, particularmente en presencia de ciertos cationes divalentes tales como calcio, bario y estroncio. Las propiedades únicas de alginato, junto con su biocompatibilidad (véase Sennerby y col., 1987 y Cohen y col., 1991), su coste relativamente bajo y amplia disponibilidad han hecho que el alginato sea un polímero importante en aplicaciones médicas y farmacéuticas. Por ejemplo, se ha usado en vendajes de heridas y materiales de impresión dental. Además diversas autoridades reguladoras han aprobado el alginato como aceptable para uso como vendajes de heridas y como aditivos de alimentos en seres humanos. Además, los alginatos de calidad farmacéutica, que cumplen todos los requerimientos de calidad y seguridad de las autoridades reguladoras farmacológicas de Europa y Estados Unidos de América (en inglés USA), están fácilmente disponibles a partir de diversos fabricantes comerciales. De este modo, el alginato se ha usado para transplante celular, estos esfuerzos previos se han localizado generalmente en sistemas en los que se desarrolló una membrana semipermeables como considerada necesaria para la protección de células del sistema inmune del hospedador (véase, por ejemplo, King y col., 1987 y Sun y col., 1987). Estas membranas semipermeables se prepararon goteando una mezcla de células suspendidas en una solución de alginato en una segunda solución que contenía cloruro cálcico. Esto dio lugar a perlas o microcápsulas de alginato que encapsulaban las células que transportaban. Las microcápsulas habitualmente también se someten a una segunda etapa en la que se forma una membrana semipermeable alrededor de la perla de alginato mediante la absorción de un policatión tal como polilisina, en la superficie de las perlas. Sin embargo, este revestimiento reduce enormemente la permeabilidad de las microcápsulas hacia los nutrientes, que conduce a la muerte de la célula encapsulada. 40 45 50 55 60 En vista de los inconvenientes anteriores de la técnica previa, el deseo de la presente invención es proporcionar una estructura de polímeros de polisacáridos hecha de cualquier polímero de polisacárido adecuado, tales como, por ejemplo, alginatos, gelano, goma de gelano, xantano, quitosano, agar, carragenina (polímeros de polisacáridos polianiónicos), o quitosano (polímeros de polisacáridos policatiónicos), que proporciona lugares adecuados para la unión y crecimiento de una masa de células suficiente para sobrevivir y funcionar no solamente in vitro, sino también in vivo y cuya estructura de polímeros de polisacáridos, sustrato o matriz, tampoco limita la supervivencia y crecimiento de solamente las células adyacentes a la superficie de la matriz ya que las células aumentan en número dentro la matriz, sino más bien también sirve para soportar capas gruesas de células, tales como agregados celulares y es capaz de mantener las células en un estado funcional activo antes y después de implante/transplante en un tejido hospedador, en ese momento esta matriz de polisacáridos también será susceptible de la vascularización a partir del tejido circundante (angiogénesis). Otro propósito de la invención es proporcionar matrices de polisacáridos que son biodegradables pero que se degradan solamente lentamente in vivo y por lo tanto permiten que las células llevadas en ellas se hagan estables y formen su propia matriz de tejidos en el lugar del transplante al punto donde no se requiere más tiempo la matriz de polisacáridos: o cuando la matriz se usa sola como un implante, va a ser estable durante el tiempo suficiente para que el tejido circundante lo invada y prolifere sobre ella hasta el punto donde las células invasoras han llegado a establecerse y han formado su propia matriz tisular, reemplazando por lo tanto el tejido deficiente originalmente; o cuando la matriz se usa sola como primera fase de un implante, va a ser estable durante el tiempo suficiente para permitir la vascularización a partir del tejido circundante en el implante que se produce mediante su invasión de la misma por los vasos sanguíneos y que permiten la segunda fase en la que las células elegidas se pueden inyectar en la matriz vascularizada y posteriormente proliferar en ella misma hasta el punto donde las células se han llegado a establecer, han formado su propia matriz de tejido, y por lo tanto, han reemplazado, al menos funcionalmente, el tejido deficiente o lesionado originalmente. 65 Todavía otro propósito de la presente invención es proporcionar dichas esponjas de polisacáridos de una naturaleza altamente porosa que puede estar fácilmente invadida por vasos sanguíneos y/o células y posteriormente que pueden soportar adecuadamente el crecimiento, proliferación y función biológica de dichas células implantadas o 3 ES 2 206 707 T3 5 10 transplantadas, tanto in vitro como después in vivo cuando se usan en implantes o transplantes, tales como esponjas de polisacáridos que son de una morfología tal que su volumen interno se utiliza óptimamente y además proporcionando dichas esponjas que no requieren ninguna forma de revestimiento externo o el similar para el propósito de implante o transplante, y por lo tanto las esponjas no serán simplemente vehículos para la encapsulación de células sino más bien servirían como una matriz o estructura para las células que llevan y permiten transporte libre de oxígeno y nutrientes en las células in vivo proporcionan vascularización de las células para los propósitos de suministro de nutrientes y posterior regeneración de tejidos de estas células transplantadas. Por lo tanto, las esponjas de polisacáridos de la presente invención se diseñan no para que sirvan solamente como dispositivos de encapsulación para células sino más bien como matrices eficaces, soportes o estructuras para uso óptimo en implantes y transplantes para la reparación de tejidos, como se ha indicado anteriormente. Todavía otro propósito de la presente invención es proporcionar un procedimiento para la producción de las esponjas de polisacáridos de la invención. 15 20 Otros propósitos de la invención incluyen proporcionar esponjas de polisacáridos para uso en cultivos celulares de mamíferos in vitro, en implantes y en transplantes para la reparación de tejido lesionado o enfermo, así como el uso de dichas esponjas de polisacáridos para estos propósitos de cultivo de células in vitro, implantes y transplantes. Otros objetos y aspectos de la invención serán fácilmente evidentes de la siguiente descripción de la invención o surgirán con claridad de la misma. Sumario de la invención 25 30 35 40 45 50 55 60 65 La presente invención se basa en un nuevo procedimiento para la preparación de esponjas tridimensionales, porosos, biodegradables y las esponjas producidas en consecuencia, estas esponjas se hacen a partir de cualquier polisacárido adecuado tales como, por ejemplo, polímeros de polisacáridos polianiónicos, que incluyen alginatos, gelano, goma de gelano, xantano, quitosano, agar, carragenina y polímeros de polisacáridos policatiónicos que incluyen quitosano. Las esponjas de polisacáridos de la invención tienen muchas posibles aplicaciones, en particular, aplicaciones médicas tales como, por ejemplo, se pueden usar como una matriz, sustrato o estructura celular para desarrollar diversas células de mamíferos in vitro en condiciones que proporcionarán la obtención de dichas células de mamíferos in vitro que son una fase activa de proliferación celular o incluso en fases de diferenciación con actividad biológica relativa de células en estas fases. Dicho desarrollo celular, activación y/o diferenciación y/o proliferación depende totalmente de la naturaleza del sustrato, matriz o estructura sobre o en la que se desarrolla, y a este respecto las nuevas esponjas de alginato de la invención se ha mostrado que son particularmente ventajosas para el desarrollo de células de mamíferos tales como, por ejemplo, fibroblastos y hepatocitos. Además, las células de mamíferos desarrolladas en o dentro de las esponjas de polisacáridos de acuerdo con la presente invención se pueden usar en auto y alotransplantes para los propósitos de, por ejemplo, reemplazar órganos o tejidos lesionados, tales como, por ejemplo, piel, hígado y otros muchos. Igualmente, las esponjas de polisacáridos de la invención son también particularmente útiles como implantes que se insertan en un paciente para reemplazar el tejido que se ha lesionado, o extirpado y estos implantes tienen la intención de llenar el espacio dejado por tejido lesionado o extirpado y permitir que el tejido circundante invada el implante y por último llenar el implante con el material celular para restaurar el tejido originalmente lesionado o extirpado. Dichos implantes también se pueden usar en un procedimiento de dos fases, en el que, en la primera fase los implantes se insertan en un paciente para reemplazar tejido o un órgano que se ha extirpado completa o parcialmente. Después el implante se invade por vasos sanguíneos a partir del tejido circundante, para proporcionar la vascularización del implante, esto tiene lugar inmediatamente después del implante. Una vez que se ha vascularizado el implante, se realiza la segunda fase inyectando en las células implantadas elegidas las que tienen la intención de reemplazar el tejido/órgano original. Previamente estas células se han cultivado in vitro o se han obtenido recientes del paciente o donante adecuado. Una vez inyectadas las células son capaces de una rápida aclimatación debida a red vascular preformada en el implante de la primera fase. Como resultado, las células inyectadas pueden proliferar rápidamente y llenar el implante y diferenciarse posteriormente hasta diversas fases y por último proporcionar un reemplazo activo para el tejido/órgano lesionado o extirpado originalmente. La naturaleza de las esponjas de polisacáridos de la invención son particularmente útiles para las aplicaciones de transplante o implante anteriormente mencionadas porque los polisacáridos elegidos son los que tienen una inmunogenicidad muy baja, una estabilidad durante relativamente largos períodos de tiempo, y debido a que las esponjas son biodegradables, eventualmente, después de un relativamente largo período de tiempo, se romperá, en el interior del cuerpo sin ningún efecto secundario deletéreo. La porosidad y morfología de la esponja de las esponjas de polisacáridos de la invención dependen de diversos parámetros de formulación y de procedimiento que pueden variar en el procedimiento de la invención, y, por lo tanto, es posible producir una amplia diversidad de esponjas de naturaleza macroporosa adecuada para el cultivo y vascularización celular. Las diversas esponjas tienen buenas propiedades mecánicas y, por lo tanto, son adecuadas, como se ha indicado anteriormente, para soportar el crecimiento y proliferación de una amplia variedad de células de mamíferos, tales como, por ejemplo, fibroblastos y hepatocitos, y por lo tanto las esponjas de la invención sembradas con dichas células pueden proporcionar al menos un soporte temporal para dichas células cuando se trasplantan para reemplazar, por ejemplo, tejido de la piel (fibroblastos de la dermis) o de hígado (hepatocitos). Este soporte temporal estará durante el período hasta que la esponja transplantada de células se biodegrade en el interior del paciente, momento en el que se esperaría que mediante el transplante, el tejido lesionado o enfermo originalmente sería capaz de repararse él mismo. 4 ES 2 206 707 T3 5 10 El nuevo procedimiento de la invención se basa en un procedimiento en tres etapas que implican una etapa de gelificación en la que una solución de polisacáridos se gelifica en presencia de un agente reticulante, seguido de una etapa de congelación, y finalmente una etapa de secado, mediante liofilización, para producir una esponja porosa. Mediante la alteración de las condiciones en cada fase, en particular la concentración del polisacárido, la presencia o ausencia de un agente reticulante y la concentración del mismo, la forma del recipiente en la que la fase de gelificación se lleva a cabo, y la rapidez de la etapa de congelación, es posible por lo tanto, obtener un amplio intervalo de esponjas de polisacáridos de diversas formas, que tienen diversos tamaños de poros y distribución y, por lo tanto, variando también las propiedades mecánicas. Se pueden usar a lo largo de esta memoria descriptiva los siguientes significados de los diversos términos: Tamaño de poro El tamaño de poro de un poro en una esponja de polisacáridos se determina usando la ecuación 15 d= 20 √ l×h en la que l y h son la longitud y anchura media de los poros, respectivamente, según se determina por análisis microscópico de las diversas esponjas (véase el ejemplo 2). Espesor de la pared de los poros 25 Este parámetro caracteriza la distancia entre los poros en una esponja y por lo tanto es indicativo de la microestructura de las esponjas y se determina también mediante la medición a nivel microscópico de las diversas esponjas (véase el ejemplo 2). Módulo E de elasticidad 30 35 40 45 50 Esto es una medida de la rigidez relativa de las esponjas de polisacáridos y se determina en unidades de kPa cuando se someten las esponjas a compresión y controlando de la velocidad de su deformación. Cuanto mayor es el módulo E de elasticidad, mayor es la rigidez relativa de la esponja. Soluciones de polisacáridos Esto se toma para significar dos clases de soluciones, siendo la primera la solución original del polisacárido en agua, preparada mediante la disolución, en condiciones de homogenización, de una forma comercialmente disponible del polisacárido en agua, produciendo usualmente una solución de la sal del polisacárido, por ejemplo, una solución de alginato sódico. Después esta solución inicial se somete a gelificación como primera etapa en el procedimiento de la preparación de esponjas de la invención. La solución sometida a gelificación se llama la solución de polisacáridos final, y en muchos casos es una forma diluida adicional de la solución de polisacáridos inicial. Por lo tanto, cuando se indican las concentraciones de polisacárido a lo largo de esta memoria descriptiva, habitualmente se refieren a la concentración del polisacárido en la solución final que se sometió a la etapa de gelificación en la primera parte del procedimiento a partir del que se obtiene la esponja de polisacáridos. En los ejemplos de esta memoria descriptiva más adelante se ejemplifica una diversidad de esponjas hecha de uno de los polisacáridos elegidos, a saber, diversos alginatos. Por lo tanto, de acuerdo con lo anteriormente mencionado, se usará “solución de alginato original” o “solución de alginato inicial” para indicar la forma primera de la solución acuosa de alginatos mediante la disolución de un alginato en polvo, y “solución final de alginatos” para indicar la solución de alginato disuelta sometida a gelificación y posterior congelación y secado. Implante 55 60 65 Este término habitualmente significa la inserción de una esponja de polisacáridos de la invención en un paciente, en la que el implante sirve para reemplazar, total o parcialmente, tejido que se ha lesionado o extirpado sirviendo el implante como una matriz, sustrato o estructura en que el tejido circundante que puede invadir el implante y puede crecer por último de manera que, después del crecimiento suficiente de dicho tejido en la esponja y con la biodegradación de la esponja con el tiempo, el tejido lesionado o extirpado se reemplazará eficazmente . El implante en este sentido también significa el procedimiento de dos fases indicado anteriormente en el que, en la primera etapa, el implante se sitúa en el paciente y se llega a vascularizar mediante la invasión de vasos sanguíneos del tejido circundante, un procedimiento que habitualmente se produce rápidamente después del implante. Una vez vascularizado el implante es entonces accesible a la segunda etapa siendo la inyección en su interior de las células elegidas bien desarrolladas previamente in vitro u obtenidas del paciente o un donante adecuado. Dichas células son capaces de una rápida aclimatación debido a que la red vascular previamente formada en el implante, y por lo tanto también son capaces de una rápida proliferación y posterior diferenciación funcional para proporcionar un reemplazo de tejido lesionado o extirpado. De hecho, cuando es necesario reemplazar totalmente un tejido/órgano, por ejemplo, segmentos o partes de piel o hígado que se han extirpado, entonces existe una necesidad de aplicar el procedimiento anterior en dos etapas. De esta forma, las células funcionales, por ejemplo, los fibroblastos o hepatocitos, se inyectarán en el implante que 5 ES 2 206 707 T3 5 10 ya se ha vascularizado. Otro aspecto de implante se toma también para significar el uso de una esponja de polisacáridos como un vehículo para transportar fármacos terapéuticos a un cierto sitio en un paciente, usualmente mediante células transportadas por la esponja de polisacáridos que son capaces de secretar una proteína, hormona terapéutica deseada o similares, o que secreta diversas proteínas reguladoras que a su vez pueden dirigir la expresión de dichos fármacos terapéuticos requeridos de forma endógena en el interior del tejido en el que se ha insertado el implante. En este aspecto también se incluye la introducción en la esponja de polisacárido de agentes terapéuticos encapsulados, por ejemplo, factores de crecimiento, factores angiogénicos, y similares, que son ventajosos para estimular un crecimiento más rápido de las células en el implante, o una vascularización más rápida del implante. Dichos factores son habitualmente demasiado pequeños para que se retengan eficazmente en la esponja y por lo tanto se introduzcan en forma de microcápsulas de liberación lenta o liberación controlada en la esponja con el fin de conseguir su eficacia. Transplante 15 El transplante puede ser de dos tipos, es decir, alo o autotransplante, y en ambos casos las células a transplantar se desarrollarán primero in vitro sobre o en la esponja de alginato hasta que alcanzan un estado deseado de activación, proliferación de diferenciación celular según se requiera, momento en el que la esponja de alginato con dichas células sembradas se transplantarán en un paciente en el lugar deseado para el propósito de reparación o reemplazo de órgano o tejido, o reemplazo. Como se ha indicado anteriormente, el transplante también puede incluir, además de las células, microcápsulas que contienen agentes terapéuticos para las células, vascularización o para el hospedador. 20 De acuerdo con lo anterior, la presente invención proporciona una esponja de polisacáridos caracterizada porque tiene: (i) un tamaño de poro medio en el intervalo entre 10 µm y 300 µm; (ii) una distancia media entre los poros, estando el espesor celular de los poros en el intervalo entre 5 µm y 270 µm; y (iii) un módulo E de elasticidad estando una medición de la rigidez de la esponja en el intervalo entre 50 kPa y 500 kPa. 25 Una realización de la esponja de la invención es una esponja que comprende un polisacárido seleccionado entre el grupo constituido por polisacáridos polianiónicos: alginatos, gelano, goma de gelano, quitosano xantano, agar, carragenina y el polisacárido polictiónico: quitosano. 30 Otra realización de la esponja de polisacáridos de la invención es una esponja que comprende un alginato seleccionado entre el grupo de alginatos caracterizados por tener: (i) un contenido de residuos de ácido manurónico (M) en el intervalo entre 25% y 65% del total de residuos; (ii) un contenido de residuos de ácido gulurónico (G) en el intervalo entre 35% y 75% del total de residuos; (iii) una relación M/G de 1/3 y 1,86/1; y (iv) una viscosidad de la solución final de alginatos que tienen 1% p/v de alginato, a partir del que se obtiene la esponja en el intervalo entre 50 cP y 800 cP. 35 40 45 50 55 Las esponjas preferidas de polisacáridos de la invención incluyen esponjas que comprenden un alginato derivado de algas pardas marinas seleccionadas del grupo constituido por alginato Protanal™ LF 120 (LF 120) derivado de Laminaria hyperborea, alginato Protanal™ LF 20/60 (LF 20/60) derivado de Laminaria hyperborea, alginato MVG™ (MVG) derivado de Laminaria hyperborea, alginato Protanal™ HF 120 (HF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 (SF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 RB (SF 120 RB) derivado de Laminaria hyperborea, alginato Protanal™ LF 200 RB (LF 200 RB) derivado de Laminaria hyperborea, alginato Manugel™ DMB (DMB) derivado de Laminaria hyperborea, Keltone™ HVCR (HVCR) derivado de Macrocystis pyrifera, y Keltone™ LV (LV) derivado de Macrocystis pyrifera. Las esponjas de alginato anteriores de la invención preferiblemente se formulan de manera en la que el alginato se usa en forma de una solución de alginato sódico que tiene una concentración de alginato entre 1% y 3% p/v para proporcionar una concentración de alginato entre 0,1% y 2% p/v en la solución final de la que se obtiene la esponja. Todavía de acuerdo con otra realización de la invención, las esponjas de polisacáridos pueden también comprender un agente reticulante seleccionado del grupo constituido por las sales de calcio, de cobre, de aluminio, de magnesio, de estroncio, de bario, de estaño, de cromo, de cationes orgánicos, de poli (aminoácidos), de poli (etilenimina), de poli (vinilamina), de poli (alilamina) y de polisacáridos. Los agentes reticulantes más preferidos para uso en la preparación de las esponjas de la invención se seleccionan del grupo constituido por cloruro de calcio (CaCl2 ), cloruro de estroncio (SrCl2 ) y gluconato de calcio (Ca - Gl). Preferiblemente, el reticulante se usa en forma de una solución de reticulante que tiene una concentración de reticulante suficiente para proporcionar una solución de reticulante entre 0,1% y 0,3% p/v en la solución final de la que se obtiene la esponja. 60 65 Las esponjas preferidas de polisacáridos de la invención son las que se preparan a partir de una solución de polisacáridos con o sin la adición de un reticulante. Las realizaciones preferidas de estas esponjas de la invención incluyen una esponja de alginato preparada a partir de una solución de alginato final con o sin la adición de un reticulante de la que dicha esponja obtiene se selecciona del grupo de soluciones finales que tienen concentraciones de alginato o alginato y reticulante, que consta de: (i) 1% p/v de alginato LF 120 sin reticulante; (ii) 1% p/v de alginato LF 120 y 0,1% p/v de Ca - Gl; (iii) 1% p/v de alginato LF 120 y 0,2% p/v de Ca - Gl; (iv) 1% p/v de alginato LF 120 y 0,15% p/v de SrCl2 ; (v) 1% p/v de alginato LF 120 y 0,1% p/v de CaCl2 ; (vi) 0,5% p/v de alginato LF 120 y 0,2% p/v Ca - Gl; (vii) 1% p/v de alginato LF 20/60 y 0,2% p/v de Ca -Gl; (viii) 0,5% p/v de alginato HVCR y 0,2% p/v 6 ES 2 206 707 T3 Ca - Gl; y (ix) 1% p/v de alginato HVCR y 0,2% p/v de Ca - Gl. 5 Otras de dichas realizaciones incluyen esponjas obtenidas de una solución final de 1% p/v de alginato LF 120 y 0,2% p/v de reticulante Ca - Gl; y una esponja obtenida a partir de una solución final de 1% p/v de alginato HVCR y 0,2% p/v de reticulante Ca - Gl. La presente invención también proporciona un procedimiento para producir una esponja de polisacáridos de la invención que comprende: 10 (a) proporcionar una solución de polisacáridos que contiene 1% a 3% p/v de polisacárido en agua. (b) diluir dicha solución de polisacárido con agua adicional cuando se desee para obtener una solución final que tiene 0,5% a 2% p/v de polisacárido, y someter dicha solución de (a) a gelificación, para obtener un gel de polisacáridos; 15 (c) congelar el gel de (b); y (d) secar el gel congelado de (c) para obtener una esponja de polisacáridos. 20 Una realización del anterior procedimiento de la invención es un procedimiento que comprende además la adición de un reticulante a dicha solución de polisacáridos de (a) durante la etapa de gelificación (b), dicho reticulante se añade en una cantidad para proporcionar una concentración de reticulante en la solución final que se somete a gelificación de entre 0,1% y 0,3% p/v. 25 En una realización preferida de la etapa (b) de gelificación del procedimiento de la invención, la gelificación se lleva a cabo con agitación vigorosa de la solución de polisacárido en un homogenizador a aproximadamente 31800 rpm durante aproximadamente 3 minutos y en la que cuando se añade un reticulante a la solución, dicho reticulante se añade muy lentamente durante dicha agitación vigorosa de la solución de alginato. 30 En una realización preferida del procedimiento de la invención se proporciona un procedimiento en el que el polisacárido es un alginato seleccionado del grupo constituido por un alginato derivado de algas pardas marinas seleccionadas del grupo constituido por alginato Protanal™ LF 120 (LF 120) derivado de Laminaria hyperborea, alginato Protanal™ LF 20/60 (LF 20/60) derivado de Laminaria hyperborea, alginato MVG™ (MVG) derivado de Laminaria hyperborea, alginato Protanal™ HF 120 (HF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 (SF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 RB (SF 120 RB) derivado de Laminaria hyperborea, alginato Protanal™ LF 200 RB (LF 200 RB) derivado de Laminaria hyperborea, alginato Manugel™ DMB (DMB) derivado de Laminaria hyperborea, Keltone™ HVCR (HVCR) derivado de Macrocystis pyrifera, y Keltone™ LV (LV) derivado de Macrocystis pyrifera. 35 40 En la realización anterior preferida del procedimiento de la invención, cuando el polisacárido es alginato, las soluciones finales preferidas que contienen alginatos con o sin reticulante que se someten a la etapa (b) de gelificación son las siguientes: (i) 1% p/v de alginato LF 120 sin reticulante; (ii) 1% p/v de alginato LF 120 y 0,1% p/v de Ca - Gl; (iii) 1% p/v de alginato LF 120 y 0,2% p/v de Ca - Gl; (iv) 1% p/v de alginato LF 120 45 En la realización anterior preferida del procedimiento de la invención, cuando el polisacárido es alginato, las soluciones finales preferidas que contienen alginatos con o sin reticulante que se someten a la etapa (b) de gelificación son las siguientes: (i) 1% p/v de alginato LF 120 sin reticulante; (ii) 1% p/v de alginato LF 120 y 0,1% p/v de Ca - Gl; (iii) 1% p/v de alginato LF 120 y 0,2% p/v de Ca - Gl; (iv) 1% p/v de alginato LF 120 y 0,15% p/v de SrCl2 ; (v) 1% p/v de alginato LF 120 y 0,1% p/v de CaCl2 ; (vi) 0,5% p/v de alginato LF 120 y 0,2% p/v Ca - Gl; (vii) 1% p/v de alginato LF 20/60 y 0,2% p/v de Ca - Gl; ( (viii) 0,5% p/v de alginato HVCR y 0,2% p/v Ca - Gl; y (ix) 1% p/v de alginato HVCR y 0,2% p/v de Ca - Gl. 50 55 La etapa (c) de congelación del procedimiento de la invención puede ser mediante congelación rápida en un baño de nitrógeno líquido a aproximadamente 80ºC durante aproximadamente 15 minutos, o mediante congelación lenta en un congelador a aproximadamente -18ºC durante aproximadamente 8 a 24 horas. El medio más preferido de congelación es mediante una congelación rápida en un baño de nitrógeno líquido como se ha indicado anteriormente. La etapa (d) de secado es preferiblemente mediante liofilización en condiciones de aproximadamente 0,007 mmHg de presión y a aproximadamente -60ºC. 60 65 Para los propósitos de preparación de las esponjas de polisacáridos de la invención con diversas formas y tamaños, por ejemplo, forma de nariz, formas de cubos, formas cilíndricas y similares (véase la Figura 2), es preferible llevar a cabo el procedimiento de la invención vertiendo la solución inicial de polisacárido en un recipiente de forma adecuada que tenga la forma deseada y realizando la gelificación y posteriores etapas del procedimiento en este recipiente configurado. La presente invención también proporciona una esponja de polisacárido de la invención, en esponjas particulares de alginato, como se ha indicado anteriormente para uso como una matriz, sustrato o estructura para el desarrollo de 7 ES 2 206 707 T3 5 10 15 20 25 30 células de mamíferos in vitro. Otro uso preferido de las esponjas de polisacáridos de la invención es su uso como matriz, sustrato o estructura para implante en un paciente con el fin de reemplazar o reparar tejido que se ha extirpado o lesionado, en el que dicha esponja implantada es un sustrato, matriz o estructura para que el tejido circundante la invada, prolifere sobre ella y reemplace el tejido lesionado o extirpado, o en la que dicho implante es un sustrato inicial para que el tejido hospedador circundante lo vascularice y el implante vascularizado entonces sirve como sustrato para recibir células inyectadas elegidas del hospedador o cultivadas in vitro, dichas células inyectadas siendo capaces de una rápida aclimatación y proliferación en la esponja vascularizada para reemplazar rápidamente el tejido lesionado o extirpado. Todavía otro uso preferido de las esponjas de polisacáridos de la invención es el uso como soporte implantado para liberar el fármaco terapéutico en un tejido deseado, dicha liberación de profármaco siendo mediante la acción de células modificadas genéticamente o células naturales transportadas por dicha esponja y expresando dichos fármacos terapéuticos, dichas células expresando dicho fármaco o expresando proteínas reguladoras para dirigir la producción del fármaco de manera endógena en dicho tejido. En este uso preferido el fármaco terapéutico expresado mediante las células transportadas sobre o en la esponja es una proteína terapéutica en la que dichas células expresan dicha proteína o expresa proteínas reguladoras para dirigir la producción de dicha proteína de manera endógena en el tejido en el que se implanta dicha esponja. Otras realizaciones preferidas para el uso de las esponjas de polisacáridos de acuerdo con la presente invención incluyen: el uso de las esponjas como una matriz, sustrato o estructura para cultivo in vitro de células vegetales y algas: para uso como una matriz, sustrato o estructura para la distribución a un tejido u órgano de vectores virales modificados genéticamente, vectores no virales, mocroesferas poliméricas y liposomas, todos codificando o conteniendo un agente terapéutico para dicho tejido u órgano; para uso como matriz, sustrato o estructura para fertilización in vitro de oocitos de mamíferos; para uso como matriz, sustrato o estructura para almacenamiento de oocitos de mamíferos fertilizados u otras células de mamíferos cultivadas in vitro; para uso como matriz, sustrato o estructura para almacenamiento de células vegetales u algas cultivadas in vitro; y para uso como matriz, sustrato o estructura para el transplante de células desarrolladas sobre o dentro de la esponja in vitro en un tejido de un paciente en necesidad de las células como resultado de una lesión, extirpación o disfunción de tejido. Los usos preferidos de la esponja de polisacárido de la invención como se ha indicado anteriormente incluye el uso del mismo para el crecimiento de células de fibroblastos in vitro; y para desarrollar células de hepatocitos in vitro. De acuerdo con estos usos preferidos, las esponjas de polisacáridos de la invención se pueden usar como dispositivos de transplante para transplantar células de fibroblastos con el fin de reemplazar tejido cutáneo lesionado o extirpado, o para el transplante de hepatocitos con el fin de reemplazar tejido hepático lesionado o extirpado. 35 40 45 De este modo la presente invención también proporciona equivalentes de órganos artificiales que sirven para proporcionar la función esencial del órgano que se van a reemplazar total o parcialmente o cuya función se diseña para aumentar. Por lo tanto, los equivalentes de órganos artificiales de la invención comprenden una esponja de polisacáridos de la invención, como se ha indicado anteriormente, y células representativas de dicho órgano, las células que se han desarrollado sobre o dentro de la esponja in vitro fase en la que son completamente activas o equivalente a las células activas del órgano y por lo tanto el órgano artificial es adecuado para transplante o implante en todas sus diversas formas como se ha detallado anteriormente, en un paciente en necesidad del mismo que sigue a lesión, extirpación o disfunción de un órgano. Las realizaciones preferidas de los equivalentes de órganos artificiales de la invención que son piel artificial comprenden una esponja de polisacárido de la invención y células de fibroblastos dérmicos, así como un equivalente de hígado artificial que comprende una esponja de polisacárido de la invención y hepatocitos. Breve descripción de las figuras y leyendas de las figuras 50 - La Figura 1 describe una representación esquemática del procedimiento general para la preparación de esponjas de alginato de acuerdo con la invención, como se establece en detalle en el ejemplo 1; los números en las Figuras representan lo siguiente: 1, solución de reticulante; 2, mezclador; 3, solución de alginato; 4, gelificación; 5, congelación; 6, liofilización; 7, esponja de alginato 55 - La Figura 2 es una representación de una fotografía que ilustra las diversas formas y tamaños de esponjas de alginato que se pueden producir de acuerdo con la invención, como se detalla en el ejemplo 2. 60 65 - Las Figuras 3 (a) - (k) describen reproducciones de micrografías de microscopio electrónico de barrido (en inglés SEM) que muestra la morfología de diversos tipos de esponjas de alginato que se pueden preparar de acuerdo con la invención, como se detalla en el ejemplo 2. LF 120 y HVCr son alginatos como en la Tabla 3, p/v es peso por volumen, Ca - Gl es gluconato de calcio y SrCl2 es cloruro de estroncio. Las condiciones usadas eran las siguientes (salvo que se indique otra cosa, los geles se congelaron mediante nitrógeno líquido): a) LF 120, 1% (p/v) ( sin reticulante) b) LF 120, 1% (p/v) + 0,1% (p/v) de Ca - Gl 8 ES 2 206 707 T3 c) LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl d) LF 120, 1% (p/v) + 0,15% (p/v) de SrCl2 5 e) LF 120, 1% (p/v) + 0,1% (p/v) de CaCl2 f) LF 20/60, 1% (p/v) + 0,2% (p/v) de Ca - Gl g) LF 120, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl 10 h) HVCR, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl i) HVCR, 1% (p/v) + 0,2% (p/v) de Ca - Gl 15 j) LF 120, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl, congelador k) LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl, congelador 20 - Las Figuras 4 (a) - (d) describen gráficamente por medio de gráficos de barras los resultados que muestran los efectos de cambiar diversos parámetros del procedimiento para la producción de esponjas de alginato en los parámetros de la microestructura de las esponjas resultantes de alginato de la invención, como se detalla en el ejemplo 2. Las barras blancas representan las mediciones de tamaño de poros; las barras sombreadas representan las mediciones del espesor de las paredes. Los valores en ordenadas están en micrómetros [µ]. CaCl2 es cloruro cálcico; Ca - Gl, Gluconato Cálcico; SrCl2 , cloruro de estroncio. Salvo que se indique otra cosa, los geles se congelan mediante nitrógeno líquido: 25 4a): 1, LF 120, 1% (p/v) (sin reticulante) 2, LF 120, 1% (p/v) + 0,1% (p/v) de Ca - Gl 30 3, LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl 4b): 1, LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl 2, LF 120, 1% (p/v) + 0,1% (p/v) de Ca - Gl 35 3, LF 120, 1% (p/v) + 0,15% (p/v) de SrCl2 4, LF 20/60, 1% (p/v) + 0,2% (p/v) de Ca - Gl 40 4c): 1, LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl (congelador) 2, LF 120, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl (congelador) 3, LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl 45 4, LF 120, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl 4d): 1, LF 120, 1% (p/v) + 0,2% (p/v) de Ca - Gl 50 2, LF 120, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl 3, HVCR, 1% (p/v) + 0,2% (p/v) de Ca - Gl 4, HVCR, 0,5% (p/v) + 0,2% (p/v) de Ca - Gl; 55 - La Figura 5 es una representación esquemática del aparato usado para determinar las propiedades mecánicas, en particular la carga aplicada a la esponja frente a la compresión de la esponja, y por lo tanto proporciona un medio para determinar la rigidez de la esponja como se detalla en el ejemplo 3. Los números en la Figura representan lo siguiente: 1, célula de carga; 2, célula de deformación; 3, penetrador; 4, muestra; 5, tabla de traducción; 60 - La Figura 6 describe una representación gráfica de los resultados que muestran el efecto del cambio en la concentración del reticulante gluconato de calcio (Ca - Gl) sobre la compresibilidad de las esponjas de alginato según se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. La letra N indica congelación de los geles mediante nitrógeno líquido. 65 a) (triángulos): LF 120, 1% (p/v) sin reticulante, N b) (cuadrados, líneas discontinuas): 1% (p/v) de LF 120 + 0,1% (p/v) de Ca - Gl, N 9 ES 2 206 707 T3 c) (cuadrados, línea continua): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N 5 - La Figura 7 describe gráficamente los resultados que muestran el efecto de la cantidad relativa de residuos de ácido gulurónico (G) en los alginatos y la viscosidad de la solución de alginato sobre la compresibilidad de las esponjas de alginato preparadas de las mismas, como se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. De aquí en lo sucesivo la letra N indica congelación de los geles mediante nitrógeno líquido. a) (triángulos): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N 10 b) (cuadrados, líneas discontinuas): 1% (p/v) de LF 20/60 + 0,2% (p/v) de Ca - Gl, N c) (cuadrados, línea continua): 1% (p/v) de HVCR + 0,2% (p/v) de Ca - Gl, N 15 - La Figura 8 describe gráficamente los resultados que muestran el efecto de los diferentes reticulantes usados en la preparación de las esponjas de alginato sobre la compresibilidad de las esponjas de alginato producidas con eso mismo, como se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. a) (triángulos): 1% (p/v) de LF 120 +0,01 M de Ca - Gl, N 20 b) (cuadrados, líneas discontinuas): 1% (p/v) de LF 120 + 0,1 M de CaCl2 , N c) (cuadrados, línea continua): 1% (p/v) de LF 120 + 0,01 M de SrCl2 , N 25 - La Figura 9 describe gráficamente los resultados que muestran los efectos de la concentración de alginato sobre la compresibilidad de las esponjas de alginato preparadas con eso mismo, como se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. a) (cuadrados, línea continua): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N 30 b) (cuadrados, líneas discontinuas): 0,5% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N c) (triángulos, línea continua): 1% (p/v) de HCVR + 0,2% (p/v) de Ca - Gl, N d) (triángulos, línea discontinua): 0,5% (p/v) de HCVR + 0,2% (p/v) de Ca - Gl, N 35 - La Figura 10 describe gráficamente los resultados que muestran el efecto de la velocidad de congelación durante la preparación de las esponjas de alginato sobre la compresibilidad de las esponjas de alginato así preparadas, como se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. Las letras F y N indican que los geles se congelan en un congelador y con nitrógeno líquido respectivamente; 40 a) (cuadrados, línea cotinua): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N b) (cuadrados, líneas discontinuas): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, F 45 c) (triángulos, línea continua): 0,5% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N d) (triángulos, línea discontinua): 0,5% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, F 50 - La Figura 11 describe gráficamente los resultados que muestran el efecto de la esterilización por gas de las esponjas de alginato sobre la compresibilidad de las esponjas de alginato así esterilizadas, como se detalla en el ejemplo 3. Ordenadas (I): tensión [kPa]; Abcisas (II): deformación. “Gas” en b) representa esterilización del producto de alginato por gas. a) (cuadrados, línea continua): 1% (p/v) de LF 120 + 0,2% (p/v) de Ca - Gl, N 55 b) (cuadrados, líneas discontinuas): 1% (p/v) de LF 120 + 0,2% (p/v) de Ga - Gl, N, Gas 60 - La Figura 12 es una reproducción de una micrografía luminosa que muestra las esponjas sembradas con fibroblastos y cultivadas durante un largo período a 37ºC (un mes), indicadora de la estabilidad de las esponjas durante períodos prolongados en cultivo, como se detalla en el ejemplo 4; - La Figura 13 muestra dos reproducciones de micrografías luminosas a 100 x de ampliación de la parte superior de la superficie de la esponja (micrografía superior) y de la sección transversal en el interior de la esponja (ampliación inferior) cinco días después de incubar la esponja con las células como se detalla en el ejemplo 5; 65 - La Figura 14 describe una representación gráfica de los resultados que muestran la proliferación de los hepatocitos sembrados en las esponjas de alginato durante un prolongado período de tiempo en cultivo (3 semanas) como se detalla en el ejemplo 5. Ordenadas (I): concentración celular [106 células/ml]; Abcisas (II): tiempo [días]; 10 ES 2 206 707 T3 5 - La Figura 15 describe gráficamente los resultados comparativos que muestran la velocidad de secreción de albúmina de los hepatocitos sembrados en las esponjas de alginato frente hepatocitos desarrollados en geles de colágeno I in vitro durante un período de diez días, como se detalla en el ejemplo 5. Ordenadas (I): µg de anticuerpo/(día*106 células); Abcisas (II): tiempo [días]. Los círculos representan los resultados obtenidos sobre colágeno tipo I; los triángulos representan los resultados obtenidos en esponjas. - La Figura 16 muestra reproducciones de micrografía de SEM a amplificaciones alta (micrografía de la parte superior) e inferior (micrografía del fondo) en las que se pueden observar fibroblastos creciendo activamente en las esponjas sembradas con fibroblastos cinco días después de cultivo in vitro como se detalla en el ejemplo 6; 10 - La Figura 17 muestra reproducciones de micrografía de SEM a amplificaciones alta (micrografía del fondo) e inferior (micrografía de la parte superior) en las que se pueden observar microesferas que contienen proteínas en interior de los poros de la esponja de alginato, como se describe en el ejemplo 7. 15 20 25 30 35 40 45 Descripción detallada de la invención Como se ha establecido en esta memoria descriptiva anteriormente y se detalla en este documento más adelante, la presente invención se refiere a nuevas esponjas de polisacáridos caracterizadas principalmente por su morfología y características mecánicas, así como su estabilidad en cultivo prolongado, así como un procedimiento nuevo para la preparación de estas esponjas de polisacáridos. Las esponjas de polisacáridos de la presente invención son particularmente útiles para el crecimiento de diversas células de mamíferos in vitro para uso en implantes y transplantes en numerosas formas como se ha detallado anteriormente, en pacientes en necesidad del mismo, que siguen a la lesión, extirpación o disfunción de tejidos. Por ejemplo, las esponjas de alginato de la invención se han mostrado de acuerdo con la presente invención que son capaces de soportar el crecimiento, proliferación y función biológica de los hepatocitos y por lo tanto las esponjas sembradas con dichos hepatocitos se pueden usar para transplantes de células hepáticas y, del mismo modo, las esponjas son también capaces de soportar el crecimiento, proliferación y función biológica de fibroblastos y por lo tanto también se pueden usar para transplantes cutáneos (dermis). Como se ha mencionado anteriormente, las matrices absorbibles porosas conocidas fabricadas de diversos polímeros naturales y sintéticos y tienen la intención de usarse para uso como soportes o matrices para implantes con el fin de facilitar la regeneración de tejido cuando se requiera después de enfermedad, trauma o procedimientos quirúrgicos reconstructivos, tienen numerosos inconvenientes que evitan su uso en una amplia escala para las aplicaciones médicas anteriores. Estos inconvenientes incluyen los siguientes: muchas de las matrices poliméricas previas solamente proporcionan el crecimiento de capas delgadas de células y por lo tanto se limitan a las aplicaciones, por ejemplo, el desarrollo de capas delgadas de células de fibroblastos para células cutáneas, no siendo adecuadas estas matrices para soportar el crecimiento de capas gruesas de células o agregados de células, por ejemplo, el crecimiento de hepatocitos y, por lo tanto, no se pueden usar eficazmente para transplante de dichos tipos de células. Además, en muchas de las matrices porosas previamente desarrolladas diseñadas para uso como implantes o sustratos para transplantes se han diseñado de acuerdo con lo anterior de manera que sean biodegradables, pero, sin embargo, se ha observado que, por ejemplo, las matrices a base de colágeno, se degradan a una velocidad relativamente rápida y por lo tanto cuando se usan como soportes para células transplantadas, a menudo se degradan antes de que las células transplantadas hayan tenido el tiempo necesario de establecerse ellas mismas in vivo y formar la matriz de nuevos tejidos deseada. Incluso en el caso de matrices de larga duración, se ha observado que muchas de ellas dan lugar a efectos secundarios no deseados in vivo, por ejemplo, muchas son inmunogénicas, muchas se contraen y se vuelven rígidas, haciéndolas menos susceptibles de tratamiento quirúrgico, muchas dan lugar a productos de degradación no deseable cuando se biodegradan y muy a menudo la morfología de estas matrices es tal que las células transportadas en la matriz no están lo suficientemente provistas de nutrientes para soportar su crecimiento a largo plazo, ya que la naturaleza porosa de estas matrices es tal que el flujo libre de nutrientes dentro y fuera de la matriz está limitada o restringida, o no soporta la vascularización en la matriz a partir del tejido circundante en el que se implanta la matriz. 50 55 60 65 Las esponjas de polisacáridos de la presente invención dirigen y superan todos los inconvenientes anteriores de las matrices porosas previamente conocidas. Como se ha mencionado anteriormente, las esponjas de polisacáridos de la presente invención pueden comprender muchas clases diferentes de polisacáridos, por ejemplo, los polisacáridos polianiónicos tales como alginatos, gelano, goma de gelano, xantano, quitosano, agar, carragenina y los polisacáridos policatiónicos tales como quitosan. De estos polisacáridos, los preferidos son los alginatos anteriormente mencionados, que provienen de diferentes formas. Por lo tanto, las esponjas preferidas de la presente invención se componen de alginatos, que representa una familia de copolímeros polianiónicos derivados de algas pardas marinas que comprenden residuos de ácidos β-D-manurónico (M) y α-L-gulurónico (G) unidos en 1,4 en proporciones variables. El alginato es soluble en soluciones acuosas a temperatura ambiente, y forma geles estables en presencia de ciertos cationes divalentes tales como calcio, bario y estroncio, así como en la ausencia de tales cationes en ciertas condiciones tales como por ejemplo, pH reducido o condiciones de procesamiento especiales como se ha detallado en esta memoria descriptiva. Además las propiedades únicas de alginato combinadas con su biocompatibilidad (véase Sennerby y col., 1987 y Cohen y col., 1991), y su coste relativamente bajo han hecho que el alginato sea un polímero importante en aplicaciones médicas y farmacéuticas (por ejemplo, vendajes de heridas y materiales de impresión dental). Además numerosas autoridades reguladoras han aprobado el alginato como un vendaje de heridas adecuado y como aditivos de alimentos. 11 ES 2 206 707 T3 Además, los alginatos están comercialmente disponibles de numerosos fabricantes (véase la Tabla 1) para producir los alginatos según los requerimientos farmacéuticos estrictos establecidos por las farmacopeas de Europa y Estados Unidos de América (cuerpos reguladores farmacéuticos). 5 10 15 El uso de diversos tipos de alginatos de acuerdo con la presente invención para preparar las diversas esponjas de la invención ha proporcionado un conjunto de esponjas, cada una siendo una matriz altamente porosa que soporta el crecimiento, proliferación y función biológica de un amplio grupo de células, que incluyen células como hepatocitos, que crecen en agregados o capas gruesas. Estas esponjas porosas son también capaces de asegurar un adecuado suministro de nutrientes a las células desarrolladas en ellas y son susceptibles a la invasión de vasos sanguíneos, es decir, cuando se implantan o transplantan in vivo son susceptibles a la vascularización. Además, en vista del hecho de que el alginato es un polímero hidrófilo, las esponjas de alginato de la presente invencione se humedecen fácilmente, permitiendo una más eficaz penetración de las células en la matriz durante la siembra. Se observará que en los esfuerzos previos para usar alginatos para transplantes de células, se buscó principalmente el desarrollo de una membrana semipermeable hecha de alginatos para el propósito de protección de las células encerradas por esta membrana a partir del sistema inmune del hospedador (véase, por ejemplo, King y col., 1987 y Sun y col., 1987). De esta manera este enfoque esencialmente proporciona perlas de alginato que estaban recubiertas por una membrana semipermeable, por ejemplo, absorbiendo las cabezas de alginato un policatión tal como polilisina, que sin embargo daba como resultado una gran reducción de las perlas o permeabilidad de microcápsulas hacia los nutrientes que posteriormente conduce a la muerte celular de las células encapsuladas en el interior de estas cabezas de alginato o microcápsulas. 20 En contraste, como se ha indicado anteriormente, las esponjas de alginatos de la presente invención son completamente susceptibles al flujo de nutrientes en la matriz de la esponja y también son susceptibles a la vascularización in vivo. 25 30 35 40 45 50 55 60 Como se detallará en esta memoria descriptiva más adelante en los ejemplos, la porosidad y morfología de las esponjas (tamaño de poro y distribución) del polisacárido, por ejemplo, las esponjas de alginato de la invención dependen de la diversa formulación y parámetros del procedimiento, que se pueden controlar fácilmente en el procedimiento de la invención y permite la obtención de un amplio grupo de esponjas macroporosas adecuadas para cultivo, implante y transplante celular. Todas estas esponjas tienen buenas propiedades mecánicas y son adecuadas para soportar el crecimiento y proliferación de diversas células de mamíferos, por ejemplo, fibroblastos y hepatocitos, y, por lo tanto, son aplicables para proporcionar al menos un soporte temporal para estas células cuando se usan, por ejemplo, para transplantes con el fin de reemplazar tejido cutáneo o hepático. Como se ha mencionado anteriormente, las esponjas de la presente invención tienen una amplia serie de usos, por ejemplo, también se pueden usar pata cultivo in vitro de células vegetales y células de algas, en particular las microalgas: para el soporte in vitro de oocitos de mamíferos para los propósitos de fertilización in vitro de estos oocitos, y por lo tanto también para el almacenamiento de estas células vegetales, algas y oocitos fertilizados, en vista del hecho de que las esponjas de polisacáridos de la invención, en particular las esponjas de alginatos, se pueden congelar con gran eficacia hasta aproximadamente -18ºC (nitrógeno líquido), y cuando se descongelan las esponjas proporcionan una matriz muy adecuada para la protección y proliferación renovada de dichas células almacenadas. Además, como se ha mencionado anteriormente, las esponjas de la invención también se pueden usar como vehículos de distribución de fármacos, ya sea por medio del transporte de células modificadas genéticamente o naturales que producen un producto o fármaco deseado que se produce en estas células y se liberan al hospedador desde el sitio en el que se implantó la esponja, o las células son capaces de producir y liberar al tejido circundante una o más proteínas reguladoras que dirigen la producción de un producto celular deseado en las células del tejido que rodea el implante. Del mismo modo las esponjas de la invención también se pueden usar para distribuir diversos vectores virales, vectores no virales, microesferas poliméricas (véase el ejemplo 7), liposomas que bien codifican o contienen productos o fármacos terapéuticos elegidos que se desea administrar al tejido u órgano del hospedador en el que se sitúa el implante. Todos estos vectores virales, vectores no virales, microesferas poliméricas y liposomas, se pueden preparar como se documenta bien en la técnica para codificar o contener un amplio grupo de agentes terapéuticos deseados, por ejemplo, diversas enzimas, hormonas y similares, y se pueden insertar en las esponjas en el momento de la preparación de la esponja o después de la preparación de la esponja. Por ejemplo, como se detalla en el ejemplo 7, es posible encapsular microesferas que contienen proteínas en esponjas de alginatos añadiendo tales microesferas en las esponjas de alginato mediante la adición de dichas microesferas a la solución de alginato en el momento de añadir el reticulante en la fase de gelificación de la solución de alginato de acuerdo con el procedimiento de la invención. Después los geles de alginato resultante que contienen tales microesferas se procesan en las esponjas que contienen lo mismo mediante las etapas de congelación y liofilización del procedimiento de la presente invención. Por lo tanto, las esponjas de la invención son también fácilmente útiles para la distribución de los agentes, que habitualmente no son adecuados para dichos materiales porosos, mediante la introducción de dichos agentes en una forma, por ejemplo, las microesferas que se pueden retener en el interior de la esponja, y facilitan la liberación lenta o controlada del agente terapéutico en el interior de la microesfera. La presente invención se describirá más detalladamente en los siguientes ejemplos no limitantes y las Figuras acompañantes: 65 12 ES 2 206 707 T3 Ejemplo 1 Preparación de esponjas de alginato 5 Como se indicó anteriormente en este documento, los alginatos pertenecen a una familia de copolímeros polianiónicos derivados de las algas marinas marrones y comprenden residuos unidos en 1,4 de ácido β-∆-manurónico (M) y ácido α-L-glucurónico (G) en proporciones variadas. Los alginatos son solubles en disoluciones acuosas a temperatura ambiente y forman geles estables en presencia de ciertos cationes divalentes tales como, por ejemplo, calcio, bario y estroncio. 10 Los alginatos, con una relación comonómero variable, es decir, contenido variable de ácido manurónico (M) y ácido glucurónico (G), y viscosidad variable, se usaron en la preparación de esponjas de alginato de la presente invención. Las propiedades clave de estos alginatos se resumen en la Tabla 1. 15 (Tabla pasa a página siguiente) 20 25 30 35 40 45 50 55 60 65 13 ES 2 206 707 T3 TABLA 1 5 10 15 20 25 30 35 40 45 50 55 60 65 Debería notarse que en los siguientes ejemplos y sus Figuras acompañantes la relación se lleva a cabo sólo en los tres primeros tipos de alginato mencionados anteriormente en este documento por lo que se refiere a las esponjas de alginato, las cuales se prepararon a partir de ellos, y por lo que se refiere a sus características varias. Todos los tipos 14 ES 2 206 707 T3 restantes de alginato que se enumeran en la Tabla I, aunque no se ejemplifique específicamente, se han usado en la preparación de esponjas de alginato en concordancia con la presente invención, proporcionando todos esponjas de las características y propiedades deseadas (los resultados no se muestran). 5 Para la preparación de las varias esponjas de alginato de la invención, varios agentes de entrecruzamiento (entrecruzadores) se usaron al variar las concentraciones en la disolución de entrecruzadores. Estos se resumen en la Tabla 2. TABLA 2 10 15 20 25 30 35 40 45 50 55 60 Debería notarse que muchos otros entrecruzadores son adecuados también para la preparación de esponjas de alginato, de las cuales las tres que se enumeran más arriba en la Tabla 2 justamente representan un ejemplo. Se ha hallado que agentes de entrecruzamiento de una amplia variedad, tales como las sales de calcio, cobre, aluminio, magnesio, estroncio, bario, estaño, cinc, cromo, cationes orgánicos, poli(aminoácidos), poli(etilenoimínico), poli(vinilamina), poli (alquilamina) y polisacáridos son todos adecuados para la preparación de las esponjas de la presente invención. Así, mientras en los siguientes ejemplos y las Figuras acompañantes se han puesto como ejemplo sólo esponjas fabricadas con los entrecruzadores específicos de Tabla 2, los otros agentes de entrecruzamiento indicados anteriormente en este documento también han sido usados exitosamente (resultados no mostrados). Las disoluciones almacenadas de alginato de sodio, a concentraciones de 1- 3% (p/v) se prepararon mediante disolución del polímero en polvo en agua doblemente destilada y mezcla mediante el uso de un homogenizador con una herramienta dispensadora de 10G (Heidolph Elektro Kelheim, Alemania) a 25.000 RPM, durante 30 minutos, a temperatura ambiente. De acuerdo con la presente invención, se ha desarrollado un procedimiento para la preparación de esponjas basado en tres etapas: (i) gelación de una disolución de alginato para formar un hidrogel; (ii) congelación, y (iii) secado mediante liofilización. El esquema de la preparación de esponjas se señala más adelante en la fig. 1, una representación esquemática del procedimiento general para la preparación de esponjas de alginato. Brevemente, se vertieron 0,5-1 cc. de disolución de alginato al 2% p/v en los pocillos de una placa de 24 pocillos (tamaño del pocillo: 16 mm de diámetro, 20 mm de altura), se diluyeron a la concentración final deseada con agua doblemente destilada, y entonces se entrecruzaron para formar un gel mediante la adición a partir de la disolución de entrecruzador, muy despacio, mientras se agita intensivamente usando el homogenizador (herramienta Dispensadora 6G a velocidad de 31.800 RPM) durante 3 minutos. Los geles de alginato mencionados anteriormente en este documento se congelan entonces. Dos conjuntos de condiciones de emplearon para examinar el efecto de la velocidad de congelación en la morfología y las propiedades mecánicas de las esponjas: 1) mediante la colocación de las placas en un estante en un congelado, a entre - 18ºC y -20ºC, durante toda una noche; y 2) en un baño de nitrógeno líquido durante 15 minutos. Los geles congelados se liofilizaron (sistemas de Secado en Frío LABCONCO Co, Kansas City) a 0,007 mm de Hg y a una temperatura de secado en frío de -60ºC. 65 Para el cultivo de tejidos, las esponjas se esterilizaron mediante tratamiento con gas óxido de etileno, mediante el uso de un aparato estándar de esterilización con óxido de etileno. Brevemente, las muestras se expusieron a una atmósfera de óxido de etileno al 100% a una humedad relativa del 70% durante 3,5 horas a 55ºC. Las muestras se 15 ES 2 206 707 T3 airearon entonces con flujo de aire cálido a presión atmosférica durante al menos 48 horas para eliminar el óxido de etileno residual de la esponja de alginato, y las esponjas así esterilizadas se almacenaron en bolsas laminadas, a temperatura ambiente, hasta su uso. 5 10 La tecnología descrita anteriormente en este documento sobre preparación de esponjas de alginato que implica las tres etapas diferentes es de una naturaleza tal que cada una de estas tres etapas puede influir en la morfología, microestructura y propiedades mecánicas de la matriz resultante. Por lo tanto, como se detalla en los siguientes ejemplos, el efecto de variar estas etapas se examinó con el objetivo de obtener una esponja de alginato que será más adecuada para el transplante de células y tejidos. Así, la metodología expuesta anteriormente en este documento es la general para la preparación de esponjas de alginato, mientras que las más específicas se detallan más adelante en este documento. Ejemplo 2 Morfología de esponjas de alginato 15 20 25 30 35 40 45 50 55 60 65 La morfología de las esponjas de alginato se investigó mediante microscopía de escaneo electrónico (SEM, JEOL JSM-35CF). Las muestras de las diversas esponjas de alginato se montaron sobre cabos de aluminio y se recubrieron con una capa ultrafina (100 A) de oro en un aparato de recubrimiento PolaronE 5100. Los parámetros de una microestructura de esponja se investigaron mediante mediadas geométricas en los micrógrafos-SEM. La longitud de poro, anchura, y grosor de pared (es decir, la distancia media entre poros vecinos) se midieron mediante un microscopio estereoscópico (Bausch & Lomb) equipado con un micrómetro óptico. El tamaño específico de los poros se calculó usando la ecuación: d= √ l×h donde l, h - son, respectivamente, la longitud y anchura de los poros, respectivamente. Las medidas del grosor de la pared se llevaron a cabo de manera que este parámetro caracteriza la distancia entre poros, y, por lo tanto, la microestructura de las esponjas. Inicialmente, la forma de las esponjas se determinaba mediante el plato en el cual se llevaba a cabo el procesamiento de la esponja. Así, esponjas con varias formas, por ejemplo, con forma de nariz, forma de tubo y forma de cilindro, de la misma manera que muchas otras, se construyeron fácilmente por simple elección de los vasos en los cuales preparar y procesar las esponjas. Ejemplos de varias esponjas de diferentes formas se muestran en la Figura 2, la cual es una reproducción de una fotografía mostrando esponjas de forma de nariz, de forma de tubo y de forma de cilindro. En la Figura 2 también se muestra una regla para proporcionar una indicación de los tamaños (longitudes, anchuras) de las diversas esponjas en centímetros/pulgadas. Como se ilustra en la fig. 2, las diversas esponjas preferidas de la invención son aquellas que tienen bordes redondeados, esta es la geometría preferida cuando se compara con las matrices de implante previamente conocidas, las cuales tenían ángulos o bordes afilados que son indeseables en vista de que se ha mostrado que tales implantes afilados pueden inducir las respuestas inflamatorias más grandes (véase, por ejemplo, Matlaga y col., 1976). Usando la metodología indicada anteriormente en este documento para la preparación de esponjas de alginato de la presente invención, se han obtenido esponjas altamente porosas bien interconectadas que tienen una organización típica del material polimérico. La morfología de las esponjas de alginato, en términos de tamaño, número y distribución de poro, de la misma manera que la distancia entre los poros, es decir, el grosor de pared, mostró estar de acuerdo con la presente invención, ser altamente dependiente de la concentración y tipo de entrecruzador y la concentración inicial de la disolución de alginato usada en la preparación de las esponjas. La estructura más densa con el número menor de poros por centímetro cúbico (cm3 ) y la pared con mayor grosor se obtuvo en esponjas que se produjeron mediante el procedimiento de secado el frío sin añadir ningún entrecruzador durante el proceso. La morfología de superficie de varias esponjas preparadas mediante el uso de varias clases de alginatos, a varias concentraciones, con o sin varios entrecruzadores y bajo varias condiciones de congelación, se muestra mediante SEM en las Figuras (a)-(k). Cada una de las Figuras (a)-(k) es una reproducción de un microgramo SEM, bajo cada una de las cuales hay indicado el tipo de alginato usado (véase Tabla 1), su porcentaje final en la disolución de esponja (porcentaje p/v), la cantidad y tipo de entrecruzador usado, de la misma manera que el tipo de congelación usada, es decir, donde indicamos “congelador”, se usó un procedimiento de congelación lenta (-20ºC durante 24 horas), o donde no se indicó, se usó congelación rápida, es decir, congelación en nitrógeno líquido (véanse Figuras 3(a)-3(i)). Como se indicó anteriormente en este documento, fue posible mediante la ecuación anteriormente mencionada en este documento calcular los valores actuales de tamaño de poro y grosor de pared a partir de los microgramos SEM, y esto por medio de las barras impresas en cada micrografía, cada barra representa 100 µm, para proporcionar un medio preciso para medir los valores de tamaño de poro y grosor de pared. Estos valores actuales se representan gráficamente en las Figuras 4(a)-(d), las cuales muestran el tamaño de poro (barras abiertas) y el grosor de pared (barras llenas) de los varios tipos de alginatos con y sin entrecruzador y con o sin “congelación” usados en la preparación de las diversas esponjas, como se indicó anteriormente en este documento. De este modo, la morfología de superficie de una esponja representativa sin entrecruzamiento y con un procedimiento rápido de secado por congelación se muestra mediante SEM en la fig. 3(a), y los valores actuales de tamaño 16 ES 2 206 707 T3 de poro y grosor de pared de una esponja tal se muestran mediante las dos barras a mano izquierda (LF1) de la Figura 4(a). También se ha mostrado que esta esponja tiene el grado más alto de encogimiento, probablemente debido a la ausencia de la red de entrecruzamiento. 5 10 15 Cuando, sin embargo, las esponjas se prepararon con un agente de entrecruzamiento, es decir, se prepararon a partir de un hidrogel entrecruzado, la esponja fue altamente porosa, el grado de porosidad y el tamaño del poro dependen del tipo y la concentración del entrecruzador iónico. Usando gluconato de calcio (Ca-Gl) como el entrecruzador da como resultado la formación de esponjas con una microestructura homogénea tanto en términos de distribución como de tamaño de poro, como se ilustra en las Figuras 3(b) y 3(c). El tamaño medio de poro y el grosor medio de la pared fue en este caso de 100 y 50 µm, respectivamente, cuando se usa 0,1% (p/v) Ca-Gl, como se muestra en las Figuras 3 (b) y 4(a) (véanse las barras centrales de la Figura 4(a)) con un descenso en el tamaño medio de poro y en el grosor medio de pared según aumenta la concentración de Ca-Gl (véanse las Figuras 3(c) y 4(a) (las barras a mano derecha)). Las esponjas preparadas con cloruro de calcio o cloruro de estroncio como los entrecruzadores, tenían, en promedio, poros mayores (al comparar las Figuras 3(c), 3(d) y 3(e), en las que las esponjas en la Figura 3(c) se prepararon con Ca-Gl, mientras que las esponjas de la Figura 3(d) se prepararon con SrCl y aquellas de la Figura 3(c) se prepararon con Ca-Gl, mientras que las esponjas de la Figura 3(d) se prepararon con SrCl y aquellas de fig. 3(e) se prepararon con CaCl). En el caso donde CaCl o SrCl se usaron como entrecruzadores, el diámetro medio de los poros fue de 150 y 200 µm, respectivamente, cuando se usaron concentraciones similares (sobre una base molar) del entrecruzador iónico, como se muestra en la Figura 4(b). 20 25 30 35 40 45 50 55 60 65 La viscosidad de la disolución alginato y el tipo de alginato, es decir, la relación comonómero entre el ácido glucurónico (G) y el ácido manurónico (M), tiene también un efecto significativo en la microestructura de la esponja. Usando el polímero LF 20/60 el cual tiene una relación similar entre G y M como el LF 120, pero el cual produce una disolución menos viscosa, a 1% (p/v) de disolución polimérica (véase Tabla 1), dando como resultado la formación de una esponja con microestructura menos homogénea (es decir, una distribución de poros menos homogénea, como se muestra cuando comparamos las Figuras 3(f) y 3(c), en las cuales en ambos casos las esponjas que se muestran se prepararon de la misma manera con el mismo entrecruzador (Ca-Gl) pero diferían por el tipo de alginato usado, es decir, LF 120 frente a LF 20/60). Además, el tamaño del poro fue ligeramente menor en las esponjas preparadas a partir del alginato LF 20/60que en aquellas esponjas obtenidas a partir del alginato LF 120, como se muestra en la Figura 4(b) (comparando la barra a mano izquierda con la barra a mano derecha en esta Figura). Para un tipo de alginato dado, la concentración inicial de la disolución de alginato afectó significativamente la microestructura de la esponja de tal forma que el descenso en la concentración de polímero condujo a la producción de esponjas con un tamaño de poro incrementado y con un grosor de pared disminuido (véase la Figura 3(g) frente a la 3(c) y la Figura 4(c), en la que la única diferencia entre las esponjas se muestra en la Figura 3(c) y aquellas que se muestran en la Figura 3(g) están en la cantidad usada de la disolución de alginato, aquella de la Figura 3(g) preparada a partir de una disolución de alginato pero a la mitad de la concentración p/v de la que se usó para preparar las esponjas que se muestran en la Figura 3(c). El alginato del tipo HVCR, el cual proporciona una disolución de viscosidad similar a aquella de LF 120, pero tuvo un contenido de glucurónico menor (véase Tabla 1), lo cual condujo a la producción de esponjas con tamaños de poro menores que aquellas del alginato LF 120 (véanse Figuras 3(h) y 3(i), frente a las Figuras 3(g) y 3(c), en las que las esponjas de las Figuras 3(h) y 3(i) se prepararon a partir de alginato HVCR con el mismo entrecruzador y la misma concentración de la disolución de alginato y la disolución de entrecruzador como aquellas preparadas a partir del alginato LF 120 que se muestran en las Figuras 3(g) y (c) respectivamente). Los valores actuales de los tamaños de poro y el grosor de pared de las esponjas producidas con HVCR frente a aquellas producidas a partir del alginato LF 120 se señalan en adelante en la Figura 4(d), es decir, al comparar las dos series de barras a mano izquierda con las dos series de barras a mano derecha en esta Figura. Este resultado está de acuerdo con la teoría de la gelación del alginato mediante entrecruzamiento iónico , el cual correlaciona las capacidades formadoras de gel y el tamaño del poro del gel con el contenido de poli-G del polímero. De acuerdo con el modelo de la huevera de Grant y col., (1973), los cationes bivalentes forman puentes con los residuos de ácido glucurónico cargados negativamente en el alginato, y los residuos de manurónico juegan solamente un papel subordinado en la estructura del gel. Así, incrementar el contenido en G da como resultado generalmente un tamaño de poro incrementado (véase Martinsen y col., 1989). El efecto de los procedimientos de congelación, es decir, el tipo y duración de la misma sobre la microestructura de la esponja se examinó también, y se encontró que el proceso de congelación rápida, usando nitrógeno líquido, proporciona esponjas con un menor tamaño de poro y mejores propiedades mecánicas (véase más adelante en este documento) que aquellas obtenidas usando los procedimientos de congelación lenta, es decir, congelar en un congelador a -20ºC, durante 24 horas. Estas diferencias se ilustran claramente en la comparación entre las Figuras 3(c) y 3(g) con las Figuras 3(j) y 3(k), en la cual en las primeras se usó la etapa de congelación en nitrógeno líquido, mientras que en las segundas se usó el procedimiento de congelación lenta. El resto de los constituyentes de la esponja y procedimientos de preparación es el mismo en todos los casos, es decir, en todos los casos el alginato LF 120 se usó a dos concentraciones y se usó el Ca-Gl como entrecruzador. Una comparación de los valores actuales del tamaño de poro y el grosor de pared obtenidos para las esponjas mencionadas anteriormente en este documento preparadas por congelación rápida o congelación lenta se describe en la Figura 4(c) en la que las dos series de barras a mano izquierda representan esponjas preparadas mediante congelación lenta, mientras que las dos series de barras a mano derecha representan esponjas preparadas mediante congelación 17 ES 2 206 707 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 lenta, mientras que las dos series de barras a mano derecha representan esponjas preparadas mediante congelación rápida. Se ha sugerido que las diferencias entre los tamaños de poro de las esponjas preparadas mediante los diferentes procedimientos de congelación refleja las diferencias en las tasas de transferencia de calor durante el proceso de congelación. Cuando la temperatura se baja, el agua, hasta ahora en forma líquida, se superenfría a una temperatura bien por debajo de su punto de fusión. En esta fase, los cristales de hielo empiezan a formarse y se libera el calor de la cristalización, lo cual eleva la temperatura del agua por encima de su punto de fusión, proporcionando una mezcla de agua y hielo. Como un resultado, se producen poros mayores con paredes menos gruesas durante el procedimiento de congelación lenta. Sin embargo, una tasa lo suficientemente rápida de enfriamiento, es decir, el enfriamiento rápido en nitrógeno líquido, se considera que se proporciona para la extracción del calor de la cristalización, lo cual previene la formación de cristales de hielo grandes. Además, siguiendo la congelación del material de la esponja, en material congelado se seca al vacío a una temperatura baja que proporciona la sublimación de los cristales de hielo. Así, la porosidad de las esponjas se controla mediante la porosidad de los cristales formados durante el proceso de congelación, a saber, a una tasa de congelación baja, por ejemplo, congelar en un congelador a entre -18ºC y -20ºC, durante 24 horas, se forman cristales de hielo grandes, lo que conduce a la formación de una esponja con una microestructura quebradiza y paredes destruidas después de la etapa de secado al vacío, es decir, liofilización. En contraste, una etapa de enfriamiento rápido mediante nitrógeno líquido da como resultado la producción de un gran número de pequeños cristales de hielo que tienen una orientación preferida, de este modo mantiene la formación de una esponja con una microestructura homogénea y propiedades mecánicas mejoradas (véase más adelante en este documento). La microestructura de las esponjas de alginato descrita anteriormente en este documento de acuerdo con la presente invención también difiere significativamente de aquella obtenida por los procedimientos conocidos para producir hidrogeles de alginato. En estos procedimientos conocidos (véase Martinsen y col., 1989), los hidrogeles de alginato se producen sin congelación y liofilización y tienen una red de poros con el tamaño de poro que varía entre 50-1000 Å. El tamaño de poro del hidrogel de alginato se controla probablemente principalmente por la densidad del entrecruzamiento de la matriz. Esta microestructura básica experimenta una deformación sustancial causada por los procesos de congelación durante la producción de la esponja de alginato. Durante este proceso de congelación, el crecimiento de los cristales de hielo puede romper los entrecruzamientos de forma que conduce a nuevas microestructuras. La estructura congelada de gel es así un resultado de la formación y destrucción de enlaces intrínsecos. Por lo tanto, la composición del gel (por ejemplo, el tipo de alginato y la presencia o ausencia de entrecruzadores y sus concentraciones relativas) de la misma manera que el grado de congelación usado durante el procedimiento de la preparación de esponja, tiene la mayor influencia en el tamaño y la estructura de los poros formados en el producto esponja final, esto es diferente de los parámetros que normalmente influyen en la microestructura de los hidrogeles de alginato previamente producidos, los cuales se producen sin sujeción a congelación y/o liofilización. Los resultados mencionados anteriormente en este documento que conciernen a la morfología de las esponjas de la invención indican claramente que la microestructura de la esponja de alginato, en particular, el tamaño y distribución de los poros, puede controlarse y manipularse fácilmente al variar la composición y concentración de alginato, el tipo y concentración del entrecruzador iónico, y el procesamiento y velocidad de congelación. La habilidad, de acuerdo con la presente invención, de producir un rango más amplio de diferentes tipos de esponjas de alginato con microestructuras variables es altamente importante para el desarrollo de sustratos de implantación adecuados para transplantes celulares y permite la optimización de tales implantes, por ejemplo, esponjas de variada morfología, lo que incluye microestructura, pueden usarse para diferentes tipos de implantes o transplantes, que dependen del tipo de tejido dentro del cual se sitúan los implantes, o de los tipos de células que se desea transplantar. La estructura de poro de una esponja de alginato impone la interacción de la esponja y las células transplantadas contenidas en ella con el tejido del hospedador dentro del cual se inserta tal esponja. La estructura de los poros se determina por el tamaño, distribución de tamaños, y continuidad de los poros individuales dentro de la esponja. Los materiales porosos se definen típicamente como microporosos (diámetro de poro < 2 nm), mesoporosos (2 nm < diámetro < 50 nm) o macroporosos (d > 50 nm). Sólo las moléculas pequeñas, por ejemplo, varios gases, son capaces de penetrar materiales microporosos. Los materiales mesoporosos permiten el transporte libre de moléculas grandes, y, cuando los poros son lo suficientemente grandes (diámetro > 104 nm), entonces las células son capaces de migrar a través de los poros de tal material. Así, mediante el diseño cuidadoso de una esponja, es posible producir una esponja la cual pueda permitir a señales extracelulares deseables, por ejemplo, un aumento de las concentraciones de azúcar en suero, pasarse a través de los poros dentro de las células transplantadas sujetas en la esponja, mientras que al mismo tiempo pueda excluir señales extracelulares moleculares o celulares más grandes, por ejemplo, moléculas de inmunoglobulina las cuales actúan para causar rechazo de las células transplantadas. Las esponjas de acuerdo con la presente invención pertenecen a los materiales macroporosos, y así pueden permitir la vascularización de la matriz, lo cual es muy importante para el mantenimiento de la viabilidad celular y la función de las células transplantadas sujetas en la matriz (véase, por ejemplo, Mikos y col., 1993). Por medio de los procedimientos expuestos anteriormente en este documento para la fabricación de las esponjas de acuerdo con la invención, es posible también producir esponjas de alginato las cuales tienen una distribución de tamaño de poro unimodal o una estructura de poro continua. Tales esponjas permiten a las moléculas o células transportarse a través de la matriz de la esponja sin limitación (“cuellos de botella”) en la estructura de poro. Finalmente, como está claro a partir de la descripción detallada del procedimiento para producir las esponjas de acuerdo con la invención como se estableció de ahí en adelante anteriormente en este documento, la presente invención proporciona un procedimiento para la producción de esponjas de alginato que es sencillo de llevar a cabo, es altamente reproducible y es fácilmente adecuable para aumentar su escala para la producción comercial de tales esponjas. 18 ES 2 206 707 T3 Ejemplo 3 Propiedades mecánicas y la compresibilidad de poro de las esponjas de alginato 5 10 Las propiedades mecánicas de las esponjas de alginato se determinaron a 22ºC (temperatura ambiente) mediante compresión de la muestra de esponjas a una tasa constante de deformación de 2 mm/min, mediante el uso de un aparato de prueba estándar. Este aparato se ilustra esquemáticamente en la Figura 5 y comprende una célula de carga, una célula de deformación, un indentador, y una mesa. La esponja muestra se sitúa entre el indentador y la mesa y se sujeta a un cargador el cual se mide mediante el aparato de medida al cual la mesa se conecta en su otro extremo (“traslación”). Con un aparato tal, la carga y deformación se supervisan con alta precisión para cargas por debajo de 1 g y deformaciones de menos de 0,05 mm. En este aparato, el diámetro del indentador (7 mm) fue usualmente menor que aquel de la muestra (la muestra de esponjas es usualmente aproximadamente de 15 mm), o mayor cuando se somete a compresión, y así se minimizó la influencia de las variaciones del diámetro de la muestra en los resultados de la prueba. 15 20 25 Estos resultados de las propiedades mecánicas y de la compresibilidad de poro de las esponjas de alginato de la invención son altamente importantes, en vista del hecho de que las esponjas a usar para transplantes o implantes deben tener excelentes propiedades mecánicas y deben mantener su forma durante la fase de cultivo in vitro incluyendo frecuentes reemplazamientos del medio y finalmente, durante el procedimiento quirúrgico en la fase de transplante. Los resultados del análisis de las propiedades mecánicas, en particular la compresibilidad de las diversas esponjas de alginato preparadas de acuerdo con la invención, se describen en las Figuras 6-11, las cuales son representaciones gráficas del estrés (kPa) frente a la distensión de varias esponjas preparadas usando diferentes tipos de alginato, diferentes tipos de entrecruzadores, de la misma manera que al variar las concentraciones de alginato y entrecruzador, y diferentes condiciones de congelación. Las Figuras 6-11 representan así una serie de curvas de deformación en las coordenadas planas de estrés-distensión para los diferentes tipos de esponjas de alginato preparadas de acuerdo con la invención. Cada curva representada en las Figuras 6-11 representa el resultado medio de 7-12 pruebas. En las pruebas, el coeficiente de variación fue del 23 al 41% bajo deformación mínima y del 7 al 12% bajo condiciones de máxima deformación. Los resultados globales de las curvas mostradas en las Figuras 6-11 han sido también resumidas en la Tabla 3. 30 TABLA 3 35 40 45 50 55 60 65 A partir de los resultados indicados anteriormente en este documento representados en las Figuras 6-11 y resumidos en la Tabla 3, es aparente que el comportamiento estrés-distensión de las esponjas de alginato es característico del comportamiento de los materiales porosos en los cuales el coeficiente de elasticidad incrementa con la distensión. En 19 ES 2 206 707 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 la Figura 6, hay una comparación de las curvas de deformación de las esponjas preparadas a partir de una disolución al 1% (p/v) de LF 120 en alginato con y sin entrecruzamiento, usando diferentes concentraciones de disolución de gluconato de calcio. Sin entrecruzamiento (la curva representada con triángulos cerrados) y con entrecruzamiento pero con una pequeña cantidad de gluconato de calcio (CaGl) por encima del 0,1% en peso (curva discontinua con cuadrados cerrados), las esponjas muestran la menor rigidez, es decir, se deforman con cargas relativamente pequeñas. Tras incrementar la concentración de entrecruzador a 0,2% en peso (la curva sólida con cuadrados cerrados), se observó un incremento fuerte en la rigidez de las esponjas. En contraste, el contenido en ácido glucurónico (G) en el alginato en las esponjas no tuvo un efecto significativo sobre las propiedades mecánicas de la esponja, como es patente en las curvas en la Figura 7. El coeficiente de elasticidad de las esponjas de alginato preparadas a partir de disoluciones al 1% (p/v) de LF 120 (curva con triángulos cerrados en la Figura 7) y alginato tipo HVCR (la curva sólida con cuadrados cerrados en la Figura 7), el cual tiene valores de viscosidad similares (150 cP), pero difiere en su contenido en G (LF 120 tiene 65-75% de G, mientras que HVCR tiene 39% de G - véase Tabla 1) son muy similares, como se resume también en la Tabla 3. Este comportamiento, como debería notarse, es, sin embargo, diferente del que se observa para los hidrogeles de alginato previamente conocidos, las propiedades mecánicas las cuales dependen altamente del contenido de residuos G, con un incremento en el contenido de G que da como resultado la formación de hidrogeles que fueron más fuertes (véase Smidsrod y Haug, 1972). Así, los resultados expuestos anteriormente en este documento enfatizan las diferencias estructurales igual que las de comportamiento entre las esponjas de la presente invención y el formato de hidrogel previamente conocido de alginatos. En la Figura 7 se muestra también que la viscosidad de la disolución influye grandemente en la rigidez de al esponja para un alginato dado con un contenido de G dado. Esto se ve a partir de la esponja de alginato LF 20/60 (curva discontinua con cuadrados llenos en la Figura 7) la cual forma esponjas que tienen menos rigidez que aquellas formadas a partir de la disolución de alginato LF 120 (curva con triángulos llenos en la Figura 7), la diferencia en la viscosidad entre el alginato LF 20/60 y el alginato 120 es significativa en que el LF 20/60 forma una disolución menos viscosa de un valor de viscosidad de 100 cP frente a los 150 cP para el LF 120. Así, es patente que la viscosidad de la disolución tiene una influencia principal en la rigidez de la esponja. Otros parámetros los cuales influyen grandemente en las propiedades mecánicas de esponjas de alginato preparadas de acuerdo con la presente invención incluyen el tipo de entrecruzador usado. Como se muestra en la Figura 8, las esponjas preparadas con cloruro de calcio y cloruro de estroncio tienen una rigidez similar (véanse la curva discontinua con cuadrados llenos y la curva continua con cuadrados llenos, respectivamente, en la Figura 8), rigidez la cual fue, no obstante, significativamente más baja que aquella obtenida cuando se usa gluconato de calcio como el entrecruzador (véase la curva con triángulos llenos en la Figura 8). Como se indicó anteriormente en este documento, en lo que se refiere a la morfología de las esponjas, las esponjas preparadas usando gluconato de calcio como el entrecruzador tuvieron poros menores, lo cual puede explicar su rigidez aumentada. La concentración de alginato usada en la preparación de las esponjas tuvo también una influencia significativa sobre la rigidez de las esponjas. Como se representó en la Figura 9, y como se resumió en la Tabla 3, un incremento en la concentración inicial de alginato del 0,5 al 1% (p/v), tanto para alginatos de contenido en G bajo (HVCR) como alto (LF 120) da como resultado que se produzcan esponjas que tienen rigidez incrementada (comparar las curvas continuas con triángulos cerrados y cuadrados cerrados con las curvas discontinuas con triángulos cerrados y cuadrados cerrados en la Figura 9, en las que las curvas continuas indican los alginatos a concentraciones altas mientras que las curvas discontinuas indican los alginatos usados a concentraciones más bajas). Así, a concentración más alta de alginato, mayor carga requerida para deformar las esponjas de ahí preparadas. Además, como se indicó anteriormente en este documento, en lo que respecta a la morfología de las esponjas fabricadas a diferentes concentraciones de alginato, los resultados mostrados en la Figura 9 indican también que las esponjas que tuvieron la rigidez más alta fueron aquellas que tuvieron el menor tamaño de poro. Aún otro parámetro que tuvo marcada influencia sobre la rigidez de las esponjas fue concerniente a la manera en la cual las esponjas se produjeron y procesaron, en particular el grado de congelación de las disoluciones de alginato durante el procedimiento de la preparación de las esponjas. A este respecto, se observó que las esponjas producidas por congelación rápida usando nitrógeno líquido tuvieron las mejores propiedades mecánicas, en particular, mayor rigidez, con el resultado de que las esponjas así producidas se sometieron a mayores cargas para ocasionar deformación de la esponja. Estos resultados se representan en la Figura 10, la cual compara esponjas preparadas por congelación rápida en nitrógeno líquido con aquellas preparadas por congelación lenta en un congelador, como se indicó anteriormente en este documento. Así, para esponjas preparadas a partir de alginato LF 120 a la concentración más alta de 0,1% p/v, y 0,2% en peso de CaGl como entrecruzador, es claramente patente que las esponjas congeladas rápidamente en nitrógeno líquido (curva continua con cuadrados cerrados en la Figura 10) produjo esponjas las cuales fueron significativamente más rígidas que aquellas preparadas a partir del mismo alginato y entrecruzador a las mismas concentraciones de los mismos pero bajo condiciones de congelación lenta (curva discontinua con cuadrados cerrados en la Figura 10). En este análisis también es interesante indicar que para las esponjas preparadas a partir de una concentración menor del alginato, las cuales mostraron de cualquier modo ser menos rígidas que aquellas preparadas a partir de concentraciones más altas de alginato (véase Figura 9), el efecto de la manera diferente de congelación durante la preparación de las mismas no fue distinguible, es decir, en ambos casos, se produjeron esponjas de rigidez grandemente reducida (véanse las dos curvas, una continua y la otra discontinua, con triángulos cerrados en la Figura 10). 20 ES 2 206 707 T3 5 10 15 20 25 Si se estudió otro parámetro por su efecto sobre la rigidez de las esponjas, ese parámetro fue el efecto de la esterilización de las esponjas, la cual se requiere antes del uso de estas esponjas para cultivo celular y subsiguientes propósitos de implante y transplante; los resultados de este análisis indican que la esterilización de las esponjas no cambió sus propiedades mecánicas, como se representa en la Figura 11. Se observó que las esponjas fabricadas a partir de la concentración más alta de alginato LF 120 y CaGl como entrecruzador y sometidas a congelación rápida en nitrógeno líquido, no tuvieron ningún cambio significativo en su rigidez cuando se someten a esterilización mediante gas (comparar la curva continua con los cuadrados cerrados representando las esponjas control no esterilizadas con gas con la curva discontinua con cuadrados cerrados representando las mismas esponjas pero que se sometieron a esterilización con gas, en Figura 11). Este hallazgo, es decir, que la esterilización por gas de la esponja no afecta sus propiedades mecánicas en cualquier forma observable, es de principal importancia para las esponjas de la presente invención en vista de sus aplicaciones médicas deseadas. Además, este hallazgo distingue también las esponjas de la presente invención por encima de las esponjas preparadas a partir de otros materiales, otras esponjas de las cuales se ha sabido que se afectan significativamente cuando se someten a esterilización. En resumen, a partir de los resultados establecidos anteriormente en este documento de ahí en adelante que conciernen las propiedades morfológicas y mecánicas de las diversas esponjas producidas de acuerdo con la presente invención, surge que las esponjas de alginato más preferidas son aquellas que se prepararon a partir de LF 120 a una concentración inicial de disolución de alginato del 1% p/v y se entrecruzaron con gluconato de calcio al 0,2% p/v y las cuales se sometieron a congelación rápida en nitrógeno líquido seguida por liofilización durante el procedimiento de la preparación. Las varias otras esponjas fabricadas con una o más variaciones de los constituyentes y modo de preparación de acuerdo con la presente invención anteriormente mencionados en este documento son también perfectamente útiles para los propósitos deseados de estas esponjas, es decir, para el cultivo celular y aplicaciones de implante o transplante. Así, de acuerdo con la presente invención, es posible preparar una amplia variedad de esponjas que tienen diferentes características morfológicas y mecánicas, todas las cuales son útiles. Las más útiles son las indicadas anteriormente en este documento que tienen la rigidez más alta junto con una distribución de poro más homogénea. Ejemplo 4 Degradación de esponjas de alginato, in vitro 30 35 40 45 50 Con el fin de determinar la degradación de las esponjas de alginato de la presente invención a lo largo de un periodo de tiempo, las esponjas se incubaron en un medio de cultivo completo y las muestras se retiraron a diferentes intervalos de tiempo para los propósitos de ensayar la concentración de alginato soluble por medio de un ensayo calorimétrico. Este ensayo se basó en el cambio metacromático inducido mediante unión de alginato al tinte, azul 1,9-dimetilmetileno (en inglés DMMB) (véase Halle y col., 1993). En este ensayo, las esponjas de alginato se cultivaron en un medio de cultivo estándar, el medio estándar completo se usa usualmente para cultivar células tales como fibroblastos y hepatocitos, a 37ºC. Las esponjas cultivadas fueron de dos clases, una de las clases se ha sembrado con células y la otra está sin células algunas. Los resultados de este ensayo muestran que las esponjas de alginato, con o sin células sembradas, cultivadas en medio de cultivo a 37ºC, mantuvieron su estabilidad física durante periodos de tiempo prolongados. La medición del alginato soluble en el medio, que es indicativa de la degradación de la esponja de alginato, después de un periodo de incubación de un mes con o sin células, mostró una concentración insignificante de alginato soluble en el medio de cultivo (menos del 1% p/v). Un resultado representativo de este análisis se representa en la Figura 12, la cual es una reproducción de una micrografía luminosa de esponjas sembradas con fibroblastos, y fotografiadas y probadas después de un mes de medio de cultivo a 37ºC. En este caso la esponja se preparó a partir de alginato LF 120, 1% p/v de la disolución inicial de alginato y 0,2% p/v de gluconato de calcio como entrecruzador, la preparación de la cual, como se indicó anteriormente en este documento, incluyó la etapa de congelación rápida en nitrógeno líquido. A partir del resultado representativo mostrado anteriormente en este documento en la Figura 12, es patente que las esponjas de alginato mantuvieron su estabilidad física durante el prolongado tiempo de incubación, indicativo además de la utilidad de tales esponjas para cultivo celular prolongado y aplicaciones de implante y transplante. Ejemplo 5 55 60 65 Cultivo de hepatocitos con esponjas de alginato Los hepatocitos se aislaron de ratas macho de la cepa Spague Dawley de 200-250 g mediante el uso de una modificación del procedimiento en tres etapas de Berry y Fried (1969). El hígado se perfundió en dirección retrógrada primero con tampón de perfusión (143 mM de NaCl, 150 mM de KCl, 154 mM de NaHCO3 , pH 7,4 y que contiene un 9% p/v de glucosa) durante 5 minutos, seguido por 100cc de 5 mM de EGTA, y finalmente con el mismo tampón de perfusión pero que contiene 5 mM de CaCl y 60 unidades/cc de colagenasa de tipo 4, durante 20 minutos. El hígado disgregado se dispersó en medio de cultivo químicamente definido libre de suero (medio E de Williams con 10 ng/cc de EGF, 20 mU/cc de insulina, 5 nM dexametazona, 20 mM de piruvato, 2 mM de L-glutamina, 100 U/cc de penicilina/estreptomicina, y 0,2 mM de gentamicina). Este medio se designa en este documento como un “medio completo”. La viabilidad de los hepatocitos después de la dispersión fue del 80-90% como se determinó por el ensayo de exclusión de azul de trifan. Las células muertas y los restos se eliminaron mediante centrifugación en una disolución de Percoll de isodensidad (véase Kreamer y col., 1986) y el sedimento celular resultante se lavó después tres veces con un medio completo. La viabilidad de las células así preparadas al sembrarlas en placa fue 88-89%. 21 ES 2 206 707 T3 Para un cultivo de rutina, las células se sembraron el placa en un medio completo, a una concentración de 3 x 104 células viables /cm2 de área de la superficie de cultivo, o 6 x 105 células por placa, para las placas control de 50 mm. Las placas control se trataron con colágeno tipo I (cobertura de colágeno a una concentración de 1 µg/cm2 ) para mantener el crecimiento de los hepatocitos. 5 10 15 20 25 Para el cultivo de las células en esponjas de alginato, se usan esponjas de la invención con las siguientes dimensiones: 15 x 10 mm (diámetro x altura) y volumen de 1,7 cm3 ; fabricadas a partir de LF 120 (la concentración inicial de la disolución de alginato y la de gluconato de calcio fueron 1 y 0,2% p/v, respectivamente). La esponja se situó en un pocillo de placas de polestireno de 24 pocillos). Los hepatocitos se sembraron a una concentración de 1 x 106 células/cc como sigue: 2 x 105 células suspendidas en doscientos mil cc de medio completo recubrieron la parte superior de las esponjas secas. Debido a su naturaleza hidrofílica, las esponjas se humedecieron instantáneamente por el medio (el aire dentro de los poros se sustituyó por el líquido), tirando así de las células mediante fuerzas de capilaridad al interior de los poros de la esponja. Esto resultó en una distribución más homogénea de las células dentro de la esponja. Las esponjas sembradas se incubaron sin ningún medio adicional, en un incubador al 5% en CO2 , a 37ºC, con una humedad del 99% durante 1 hora, después se añadió 1 cc del medio completo. A continuación de un periodo de acoplamiento de 3 a 5 horas (el acoplamiento máximo a todos los geles de alginato ocurrió en las 3 primeras horas), se cambió el medio para eliminar las células no acopladas, y entonces las células se mantuvieron en medio completo con cambios diarios de medio. A diferentes tiempos de cultivo, el número de células en las placas control (recubiertas de colágeno) y experimentales (esponjas de alginato) se midió por contaje directo o mediante ensayos bioquímicos como se detalla más adelante en este documento, después de que la capa de células o esponja se haya lavado dos veces con PBS. Para cada medida, se usaron placas o esponjas por triplicado. Se llevaron a cabo los siguientes ensayos de contaje directo y bioquímicos: (a) Contaje directo: para el contaje directo, las células se eliminaron de las placas control usando 0,05% de tripsina/EDTA: a partir de esponjas de alginato las células se liberaron después de disolverse las esponjas con 1 cc de tampón citrato al 4% (p/v), pH 7,4. El número de células se determinó mediante contaje directo en un hemacitómetro. 30 35 40 45 50 55 60 65 (b) Mediante prueba con LDH: la actividad lactato deshidrogenasa (en inglés LDH) se determinó al usar el Kit Sigma (LDH/LH Nº DG1340-UV). El número de células se determinó mediante la medida de la actividad enzimática después de la lisis celular mediante tres ciclos de congelar-descongelar (-20ºC-37ºC). Una curva de calibración estándar se construyó mediante el uso de diferentes disoluciones del cultivo de células de reserva. Se observó una relación lineal entre la actividad LDH y el número de células por encima de la concentración celular de 3 x 106 células/cc. (c) Mediante MTT: el ensayo de MTT se basa en la capacidad de las enzimas deshidrogenasas mitocondriales de las células vivas para convertir la sal soluble amarilla MTT (bromuro de 3(4,5-dimetil-tiazol-2-il)-2,5 dip heniltetrazolio) en la insoluble sal formazán púrpura. MTT (Sigma) se preparó como una disolución de reserva de 5 mg/cc en PBS (tampón fosfato salino). Los residuos no disueltos se eliminaron mediante filtración estéril. La disolución de reserva se almacenó en la oscuridad a 4ºC y se usó dentro de las tres semanas siguientes a su preparación. 60 µl de la disolución de reserva de MTT se añadieron dentro de un pocillo de una placa de poliestireno de 24 pocillos, que contiene la esponja en 1cc de medio de cultivo. Siguió un periodo de incubación de 5 horas, a 37ºC, la conversión de MTT se detuvo tras su eliminación, mediante aspiración al vacío del medio que contiene MTT de los pocillos. El producto insoluble formazan se disolvió en 100 ccl de una disolución de isopropanol-HCl 0,04 N (relación de volumen 250:1) y la absorbancia de la disolución se midió a 560 nm contra un blanco de isopropanol-HCl. (d) Mediante DNA: el contenido total de DNA se determinó de acuerdo al procedimiento de Brunk y col. (1979). Este procedimiento puede detectar con precisión la concentración de DNA de un homogenado celular crudo, en el rango de los nanogramos, usando la fluorescencia incrementada de 4’-6-diamino-2-fenilindol (en inglés DAPI) formando complejo con el DNA. Brevemente, las esponjas sembradas con células se trataron con tampón citrato para disolver las esponjas y liberar las células. Las células se lisaron al llevarse a cabo dos ciclos de congelar-descongelar (-20ºC37ºC), seguidos por su dispersión en 25 cc de NaOH 1 M, y el hervido de la mezcla durante 30 minutos. Después de la neutralización con HCl, y el enfriamiento a temperatura ambiente, se añadió el tinte fluorescente, DAPI, a 100 ng/100 cc en tampón Tris, a pH 7,0. La emisión de fluorescencia de las muestras a 540 nm se determinó tras la excitación de las muestras a 286 nm. El número de células se estimó a partir de una curva de calibración usando concentraciones conocidas de células. (e) Determinación de secreción de albúmina: la secreción de albúmina dentro del medio de cultivo se cuantificó mediante un ensayo de sándwich inmunoabsorbente unido a enzimas (Schwerer el al., 1987) que usó anticuerpos específicos para albúmina de rata. Brevemente, se recubrieron placas de poliestireno de 96 pocillos (placa Nunc Immuno) con cien mil cc de anticuerpos de oveja anti-albúmina de rata, a 2 µg/cc, en tampón carbonato de recubrimiento, a pH 9,0, durante toda la noche, a 4ºC. Después de lavar las placas con PBS que contiene 0,05% v/v de Tween 20 (PBS Tween), se bloquearon mediante la adición de cien mil cc de gelatina al 1% (p/v) para reducir la unión inespecífica. Después de incubar durante una hora a temperatura ambiente, las placas se lavaron 3 veces con PBS-Tween, y cien mil cc de las muestras del medio apropiadamente diluidas se añadieron a los pocillos. Tras dos horas de incubación a temperatura ambiente los pocillos se lavaron como se describió anteriormente en este documento, seguido por la adición de cien mil cc del sustrato, 2,2’-azinodi(sulfonato de 3-etilbenzotiazolina) (en inglés ABTS) (1 mg/cc, en 77 22 ES 2 206 707 T3 5 mM de fosfato sódico/61 mM de tampón citrato, pH 4,0, que contiene 0,01% (v/v) de H2 O2 ), se añadió dentro de cada pocillo y se incubó durante 1 hora, a 37ºC. La reacción enzimática se detuvo mediante la adición de 0,32% (p/v) de fluoruro de sodio, y el cambio de color se siguió espectrofotométricamente a 405 mM frente a una referencia a 490 nm usando el lector de ELISA (Denley, WS050 WellScan). Se usó albúmina pura de rata(Cappel) para establecer una curva estándar. Los resultados de los análisis descritos anteriormente en este documento de los hepatocitos cultivados dentro de las esponjas de alginato son como sigue: 10 Inicialmente los hepatocitos cultivados se observaron bajo microscopía óptica para evaluar la morfología celular general y la naturaleza de las células cultivadas en las esponjas de alginato. Una reproducción representativa de unas micrografías ópticas tomadas a diferentes duraciones de la incubación se muestra en la Figura 13, en la cual la micrografía superior muestra células en el momento de su siembra (día 1 de incubación) y la micrografía inferior muestra células después de 10 días en cultivo, el aumento utilizado en ambas micrografías es el mismo. 15 20 25 30 35 A partir de las micrografías ópticas que se muestran en la Figura 13, se han observado varias características únicas, comparadas con el cultivo convencional sobre placas tratadas con colágeno: 1) los hepatocitos se inmovilizan principalmente dentro del poro de la esponja alginato; (2) la morfología de los hepatocitos es esférica por todo el cultivo, en lugar de la forma plana, extendida, tal como usualmente se encuentra en cultivos monocapa; esta morfología esférica es similar a la observada in vivo; y (3) en algunas partes de la esponja se pueden observar esferoides de hepatocitos (véase en particular la micrografía superior en la Figura 13). Además, es claramente patente a partir de ambas micrografías en la Figura 13 que en 10 días de cultivo (comparando la micrografía de arriba con la de abajo), tiene lugar una gran cantidad de proliferación celular. Al analizar el número de hepatocitos dentro de la esponja de alginato, los hepatocitos se liberaron de la matriz al disolverla con tampón citrato. El número de células a diferentes tiempos de incubación se ensayó mediante LDH y contenidos de DNA como se indicó anteriormente en este documento. Los resultados se presentan en la Figura 14, una representación gráfica del número de células en función del tiempo (días de incubación). Estos resultados muestran que las células proliferaron dentro de las esponjas (como vimos principalmente mediante el incremento en síntesis de DNA). Este patrón de función diferenciada mediante células que experimentan síntesis de DNA dentro de esponjas de alginato es similar al comportamiento descrito de hepatocitos en la regeneración del hígado (véase Friedman, 1984). Para examinar como funcionan los hepatocitos dentro de las esponjas de alginato se examinó la capacidad de estas células para secretar albúmina. Los resultados presentados en la Figura 15, una representación gráfica de la cantidad de albúmina secretada (µg/día/106 células) por las células como una función del tiempo (días en incubación). Estos resultados muestran que la secreción de albúmina a partir de los hepatocitos crecidos dentro de las esponjas de alginato fue estable a lo largo de los 10 días de cultivo (véanse los resultados indicados con triángulos llenos en la Figura 15). En contraste, en el cultivo convencional (placas tratadas con colágeno), la secreción de albúmina declinó con el tiempo de cultivo y casi se perdió después de cinco días de cultivo. 40 Ejemplo 6 Cultivo de fibroblastos dentro de esponjas 45 50 55 Las esponjas con un tamaño medio de 15 x 10 mm (diámetro x altura), y un volumen aproximado de 1,7 cm3 , se sembraron en un pocillo de placas de poliestireno de 24 pocillos, con 2 x 105 de fibroblastos dérmicos normales obtenidos de prepucio humano, suspendidos en (doscientos mil de cc) de medio DMEM suplementado con un 10% de suero fetal de ternero (DMEM-FCS). Las esponjas sembradas se incubaron sin ningún medio tradicional, en un incubador con CO2 al 5%, a 37ºC, con un 99% de humedad, durante 1 hora, después se añadió 1 cc de DMEM-FCS. El medio se reemplazó cada tres días. Los fibroblastos sembrados dentro de las esponjas de alginato se analizaron entonces mediante microscopía de escaneo electrónico (SEM). Para este propósito, se tomaron muestras a partir de las esponjas sembradas en incubación y se fijaron para microscopía de escaneo electrónico (SEM). Brevemente, las esponjas se lavaron con PBS y después se fijaron en tampón PBS que contiene un 2% de glutaraldehído (pH 7,4) durante 1 hora a temperatura ambiente, seguida por 24 horas a 4ºC. Después de lavar dos veces con tampón PBS, las esponjas se deshidrataron a través de una serie graduada de baños de etanol (10-99,8% en incrementos del 10%) durante 10 minutos cada uno. Las muestras se secaron y recubrieron hasta un punto crítico con una capa ultrafina de oro (100 Å) como se describió anteriormente en este documento. 60 Usualmente, el ensayo descrito anteriormente en este documento mediante SEM se llevó a cabo después de 5 días de cultivo de las esponjas de alginato sembradas con fibroblastos. 65 Como en el caso de los hepatocitos (véase anteriormente en este documento), los fibroblastos prefirieron los poros de la esponja de alginato (Figura 16). Esto es fácilmente observable en las micrografías de SEM mostradas en la Figura 16, las cuales son menos representativas de un gran número de micrografías similares preparadas a partir de un número de tales muestras de esponjas sembradas con fibroblastos. Las micrografías en la Figura 16 muestran dos niveles de aumento: uno alto (micrografía superior) y otro inferior (micrografía inferior), a partir de las cuales es patente que los 23 ES 2 206 707 T3 5 10 fibroblastos crecen en el interior de los poros de la esponja. Debería notarse en la Figura 16 que ambas micrografías también incluyen una barra impresa la cual proporciona una escala para determinar los tamaños actuales de las células, poros, el grosor de las paredes de los poros, etc. La barra de la micrografía superior representa 10 µM y la barra de la micrografía inferior representa 100 µM. Además, la adhesión de las células y su proliferación con el tiempo de cultivo no tiene efecto significativo en las esponjas, las cuales mantienen sus formas originales (resultados no mostrados). Esto demuestra otra ventaja aún del material de la esponja de alginato sobre las esponjas de colágeno. Estudios previos han mostrado que los fibroblastos crecidos en colágeno contraen la capa de colágeno recién sintetizada en la cual están creciendo, lo que da como resultado un “enrollamiento” de la monocapa de células (véase Rivard y col., 1995).De forma similar, las espumas de colágeno sembradas se contrajeron también, por debajo de aproximadamente el 40% de su volumen inicial, después de 5 semanas de cultivo (Rivard y col.,1995), las cuales se han hecho inapropiadas para el transplante de una gran masa de células. Ejemplo 7 15 20 25 30 35 Encapsulación de las microsferas que contienen proteínas dentro de las esponjas de alginato Para mejorar la vascularización de las esponjas deseada para el crecimiento celular in vivo, los factores de angiogénesis se insertaron dentro de las esponjas. Sin embargo, las esponjas de alginato u otros polisacáridos son demasiado porosas para la encapsulación efectiva de proteínas o péptidos, y estas moléculas escapan rápidamente de la matriz. Para alargar su descarga de la esponja, estos factores pueden ser primero encapsulados dentro de esferas diminutas, biodegradables, de liberación controlada, tales como de ácido poli(láctico/glicólico), las cuales se retendrán entonces dentro de la esponja. Así, las microsferas de ácido poli(láctico/glicólico), que contienen factores de crecimiento de fibroblastos, o cualquier otro factor de angiogénesis, se prepararon mediante el procedimiento de evaporación del disolvente basado en una doble emulsión (Cohen y col.,1991). Las esferas resultantes, que tienen un diámetro en el intervalo de 5-20 µM, se añadieron a la disolución de alginato inmediatamente después de la adición de la disolución de entrecruzamiento, mientras se agita intensivamente usando el procedimiento de la invención (para más detalles, véase el ejemplo 1). Los geles de alginato se congelaron y liofilizaron después como en el ejemplo 1, para producir una esponja que contiene microsferas las cuales contienen en sí mismas los factores anteriormente mencionados en este documento. La Figura 17 es una reproducción de una SEM de la esponja resultante. La micrografía superior es una ampliación inferior y la micrografía inferior es una ampliación superior, que muestran que las microsferas están dentro de los poros de la esponja. Las barras en ambas micrografías representan la escala para determinar los actuales parámetros de tamaño del tamaño del poro y el grosor de la pared del poro de la esponja, y el tamaño de las microsferas dentro de la esponja. Referencias 40 [1]. I. V. Yannas. Biologically active analogues of the extracellular matrix: artificial skin and nerves. Agnew Chem Int. Ed. Eng. 29 (1990) 20-35. [2] T. Natsume, O. Ike, T. Okada, N. Takimoto, Y Shimizu and Y. Ikada, Porous collagen sponge for esophageal replacement. J. Biomed. Mater. Res 27 (1993) 867-875 45 [3] D. A. Grande. M.I. Pitman, L. Peterson, D. Menche and M. Klein, The repair of experimentally produced defects in rabbit articular cartilage by autologous chondrocyte transplantation, J. Orthop. Res. 7 (1989) 208-218. 50 [4] C. A. Vacanti, R. Langer. B. Schioo and J. P. Vacanti. Synthetic Biodegradable Polymers Seeded with Chondro-cytes Provide a Template for New Cartilage Formation In Vivo., J. Pediat Surgery (In Press) (1990) [5] A. G. Mikos, G. Sarakinos. M. D. Lyman. D. E. Ingber, J. P. Vacanti and R. Langer, Prevascularization of porous biodegradable polymers, Biotech. Bioeng. 42 (1993a) 716-723. 55 [6] A. G. Mikos. Y. Bao, L. G. Cima, D. E. Ingber. J. P. Vacanti and R. Langer, Preparation of poly(glycolic acid) bonded fiber structures for cell attachement and transplantation, J. Biomed. Mater. Res. 27 (1993b)11.23. [7] A . G. Mikos, G Sarakinos, S. M. Leite, J. P Vacanti and R. Langer Laminated three-dimensional biodegradable foams for use in tissue engineering, Biomaterials 14 (1993c) 323-330. 60 [8] R. Langer and J. P. Vacanti, Tissue engineering, Science 260 (1993) 920-926. [9] M. K. Jain. R. A. Berg and G. P. Tandon, Mechanical stress and cellular metabolism in living soft tissue composites. Biomaterials 11 (1990) 465-472. 65 [10] K. J. Doane and D. E. Birk, Fibroblasts retain their tissue pheontype when grown in three-dimensional collagen gels. Exp. Cell. Res. 195 (1991) 432-442. 24 ES 2 206 707 T3 [11] J. Folkman and A. Moscona, Role of cell shape in growth control, Nature 273 (1978) 345-349. [12] J.A. Madri and M.D. Basson, Extracellular matrix-cell interactions:dynamic modulators of cell. tissue and organism structure and function, Lab. Invest. 66 (1992) 519-521. 5 [13] L. H. H. Olde Damink, P. J. Dijkstra, M. J. A. Van Luyn. P. B. Van Wachem, P. Nieuwenhuis and J. Feijen. Changes in the mechanical properties of dermal sheep collagen during in vitro degradation. J. Biomed. Mater. Res. 29 (1995) 139-147. 10 [14] A. Ben-Yishay, D. A. Grande. R. E. Schwartz, D. Menche and M. D. Pitman, Repair of articular cartilage defects with collagen-chondrocytes allografts, Tissue Engineering 1 (1995) 119-132. [15] R. Timple, K. Mark and H. Mark, Immunochemistry and Immunohistology of collagens, in: A. Viidik and J. Vuust (Eds.). Biology of Collagen. Academic Press. 1980, pp. 211. 15 [16] T. G. Park Lu, W. and Crotts, G., Importance of in-vitro experimental conditions on protein release kinetics, stability and polymer degradation in protein encapsutated poly(D,L-laclicacid-co-glycolic acid) microspheres., journal of controlled release 33 (1995) 211-222. 20 [17] L. Sennerby, T. Rostlund, B. Albrektsson and T. Albrektsson, Acute tissue reactions to potassium alginate with and without colour/flavor additives, Biomaterials 8 (1987) 49-52. [18] S. Cohen, H. Bernstein, C. Hewes. M. Chow and R. Langer, The pharmacokinetics of and humoral responses to antigen delivered by microencapsulated liposomes, Proc. Natl. Acad. Sci. USA (In Press) (1991) 25 [19] G. A. King, A. J. Daugulis, P. Faulkner and M F. A. Goosen, Alginate-Polylysine Microcapsules of Controlled Membrane Molecular Weight Cutoff for Mammalian Cell Culture Engineering. Biotechnology Progress 3 (1987) 231-240. 30 [20] A. M,-F. Sun, M. F. A. Goosen and G. O’ Shea, Microencapsulated Cells as Hormone Delivery Systems. CRC Crit. Rev. Drug Carriers Sys. 4 (1987) 1-12. [21] J. P. Halle, D. Landry, A. Fournier, M. Beaudry and A. Leblond, Method for the quantification of alginate in microcapsules, Cell Transplantation 2 (1993) 429.436. 35 [22] M. N. Berry and D. S. Friend, High yield preparation of isolated rat parenchymal cells. A biochemical and fine structure study, J. Ceil. Biol. 43 (1969) 506.520 40 [23]B. L. Kreamer, J. L. Stuecker and e. al.: Use of low speed, 150-density Percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations, In Vitro Cell Dev. Biology 22 (1986) 201- 207. [24] C. F. Brunk, K. C. Jones and T. W. James. Assay for nanogram quantities of DNA in cellular homogenates. Analitical Biochem. 92 (1979) 497-500. 45 [25] B. Schwerer, M. Bach and H. Bernheimer. ELISA for determination of albumin in the nanogram range: assay in cerebrospinal fluid and comparison with radial immunodiffusion. Clinical Chim Acta 163 (1987) 237-244. [26] B. F. Matlaga, L. P. Yasenchak and T. N. Salthouse, Tissue response to implanted polymers: the significance of sample shape, J. Biomed. Mater. Res. 10 (1976) 391.397. 50 [27] G. T. Grant, E. R. Morris. D. A. Raes. P. J. C. Smith and D. Thorn, Biological interactions between polysaccharides and divalent ctions: The egg box model.. FEBS Lett. 32 (1973) 195-8. 55 [28] A. Martinsen, G. Skjak-Braek and O. Smidsrod, Alginate as immobilization material 1. correlation between chemical and physical properties of alginate gel beads. Biotechnol. Bioeng. 33 (1989) 79-89. [29] 0. Smidsrod and A. Haug. Properties of poly(1 4-hexuronates) in the gel state. II Comparison of gels of different chemical composition. Acta Chem. Scand. 26 (1972) 79-88. 60 [30] J. M. Friedman. E. Y. Chang and J. Damell J. E., J. Mol. Biol. 179 (1984) 37.53. [31] C. H. Rivard, C. J. Chaput. E. A. DesRosiers. L. H. Yahia and A. Selmani. Fibroblasts seeding and culture in biodegradable porous substrates, J. Appl. Biomater. 6 (1995) 65-68. 65 [32] S. Cohen. T. Yoshioka. M. Lucarelli, L.H. Hwang and R. Langer, (1991) Pharm. Res 8. 713-720. 25 ES 2 206 707 T3 REIVINDICACIONES 5 10 15 20 25 30 1. Una esponja de polisacárido que se caracteriza porque tiene: (i) un tamaño medio de poro en el intervalo entre 10 µm y 300 µm; (ii) una distancia media entre los poros que es el espesor de la pared de los poros en el intervalo entre 5 µm y 270 µm; (iii) un módulo E de elasticidad que es una medida de la rigidez de la esponja en el intervalo entre 50 kPa y 500 kPa. 2. Una esponja de polisacárido según la reivindicación 1, en la que dicha esponja comprende un polisacárido seleccionado del grupo que comprende los polisacáridos polianiónicos: alginatos, gelano, goma de gelano, xantano, agar, carragenina, y el polisacárido policatiónico: quitosano. 3. Una esponja de polisacárido según la reivindicación 1 o reivindicación 2, en la que dicha esponja comprende un alginato seleccionado entre el grupo de alginatos caracterizado porque tiene: (i) un contenido en residuo de ácido manurónico (M) en el intervalo entre 25% y 65% del total de residuos; (ii) un contenido en residuo de ácido gulurónico (G) en el intervalo entre 35% y 75% del total de residuos; (iii) una relación M/G de 1/3 y 1,86/1; y (iv) una viscosidad de la relación de alginato final que tienen 1% p/v de alginato, a partir de la cual la esponja se obtiene en el intervalo entre 50 cP y 800 cP. 4. Una esponja de polisacárido según la reivindicación 3, en la que dicha esponja comprende un alginato derivado de algas pardas marinas seleccionadas del grupo constituido por alginato Protanal™ LF 120 (LF 120) derivado de Laminaria hyperborea, alginato Protanal™ LF 20/60 (LF 20/60) derivado de Laminaria hyperborea, alginato MVG™ (MVG) derivado de Laminaria hyperborea, alginato Protanal™ HF 120 (HF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 (SF 120) derivado de Laminaria hyperborea, alginato Protanal™ SF 120 RB (SF 120 RB) derivado de Laminaria hyperborea, alginato Protanal™ LF 200 RB (LF 200 RB) derivado de Laminaria hyperborea, alginato Manugel™ DMB (DMB) derivado de Laminaria hyperborea, Keltone™ HVCR (HVCR) derivado de Macrocystis pyrifera, y Keltone™ LV (LV) derivado de Macrocystis pyrifera. 5. Una esponja de polisacárido según la reivindicación 4, en la que dicha esponja comprende un alginato seleccionado entre el grupo constituido por dicho LF 120, LF 20/60 y HVCR. 6. Una esponja de polisacárido según las reivindicaciones 3 a 5, en la que dicho alginato se usa en la forma de una solución de alginato sódico que tiene una concentración de alginato entre 1% y 3% p/v para proporcionar una concentración de alginato entre 0,1% y 2% p/v en la solución final a partir de la que se obtiene la esponja. 35 40 45 50 55 60 65 7. Una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 5, en la que dicha esponja además comprende un agente reticulante seleccionado entre el grupo constituido por sales de calcio, de cobre, de aluminio, de magnesio, de estroncio, de bario, de estaño, de cinc, de cromo, de cationes orgánicos, de poli(aminoácidos), de poli (etilenimina), de poli(vinilamina), de poli(alilamina) y de polisacáridos. 8. Una esponja de polisacárido según la reivindicación 7, en la que dicha esponja comprende además un agente reticulante seleccionado del grupo constituido por cloruro de calcio (CaCl2 ), cloruro de estroncio (SrCl2 ) y gluconato de calcio (Ca - Gl). 9. Una esponja de polisacárido según la reivindicación 7 ó reivindicación 8, en la que dicho reticulante se usa en forma de una solución de reticulante que tiene una concentración de reticulante suficiente para proporcionar una concentración de reticulante entre 0,1% y 0,3% p/v en la solución final a partir de la que se obtiene la esponja. 10. Una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 9, en la que dicha esponja se prepara a partir de una solución de polisacárido con o sin la adición de un reticulante. 11. Una esponja de polisacárido según la reivindicación 10, en la que dicha esponja es una esponja de alginato preparada a partir de una solución de alginato con o sin la adición de un reticulante y en la que dicha solución de alginato final con o sin reticulante a partir de la que se obtiene dicha esponja se selecciona del grupo de las soluciones finales, que tienen concentraciones de alginato o de alginato y reticulante, que consiste en: (i) 1% p/v de alginato LF 120 sin reticulante; (ii) 1% p/v de alginato LF 120 y 0,1% p/v de Ca - Gl; (iii) 1% p/v de alginato LF 120 y 0,2% p/v de Ca - Gl; (iv) 1% p/v de alginato LF 120 y 0,15% p/v de SrCl2 ; (vi 1% p/v de alginato LF 120 y 0,1% p/v de CaCl2 ; (vi) 0,5% p/v de alginato LF 120 y 0,2% p/v Ca - Gl; (vii) 1% p/v de alginato LF 20/60 y 0,2% p/v de Ca - Gl; (viii) 0,5% p/v de alginato HVCR y 0,2% p/v Ca - Gl; y (ix) 1% p/v de alginato HVCR y 0,2% p/v de Ca - Gl. 12. Una esponja de polisacárido según la reivindicación 11, en la que dicha esponja se obtiene a partir de una solución final de 1% p/v de alginato LF 120 y 0,2% p/v de reticulante Ca - Gl. 13. Una esponja de polisacárido según la reivindicación 11, en la que dicha esponja se obtiene a partir de una solución final de 1% p/v de alginato HVCR y 0,2% p/v de reticulante Ca - Gl. 14. Una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 para uso en aplicaciones médicas. 26 ES 2 206 707 T3 5 10 15. Uso de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 para la fabricación de una matriz, sustrato o estructura destinada al implante en un paciente para reemplazar o reparar el tejido que se ha extirpado o lesionado, en la que dicha esponja implantada es un sustrato, matriz o estructura destinada a que la invada el tejido circundante, para que prolifere sobre ella y reemplace el tejido lesionado o extirpado, o en la que dicho implante es un sustrato inicial para la vascularización por el tejido hospedador circundante y entonces el implante vascularizado sirve como sustrato para recibir las células inyectadas elegidas provenientes del hospedador, o desarrolladas in vitro, dichas células inyectadas siendo capaces de una aclimatación y proliferación rápida sobre la esponja vascularizada con el fin de reemplazar rápidamente el tejido lesionado o extirpado. 16. Uso de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 para la fabricación de un soporte implantado destinado a la distribución de un fármaco terapéutico en un tejido deseado, dicha distribución de fármaco se hace gracias a la acción de células genéticamente modificadas o células naturales transportadas por dicha esponja y expresando dichos fármacos, dichas células expresando dicho fármaco o expresando proteínas reguladoras para dirigir la producción de fármaco de manera endógena en dicho tejido. 15 17. Uso según la reivindicación 16, en la que dicho fármaco terapéutico expresado por dichas células transportadas en dicha esponja es una proteína terapéutica, en la que dichas células expresan dicha proteína o expresan proteínas reguladoras para dirigir la producción de dicha proteína de manera endógena en el tejido en el que se implanta dicha esponja. 20 18. Uso de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 para la fabricación de una matriz, sustrato o estructura destinada a la distribución in vivo a un tejido u órgano de vectores virales modificados genéticamente, vectores no virales, microesferas poliméricas y liposomas, todos codificando o conteniendo un agente terapéutico para dicho tejido u órgano. 25 19. Uso de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 para la fabricación de una matriz, sustrato o estructura destinada al transplante de células crecidas sobre o en dicha esponja in vitro a un tejido de un paciente en necesidad de dichas células como resultado de lesión, extirpación o disfunción de tejido. 30 20. Un procedimiento para la producción de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 - 19, que comprende: (a) proporcionar una solución de polisacáridos que contiene 1% a 3% p/v de polisacárido en agua. 35 (b) diluir dicha solución de polisacárido con agua adicional cuando se desee para obtener una solución final que tiene 0,5% a 2% p/v de polisacárido, y someter dicha solución de (a) a gelificación, para obtener un gel de polisacárido; (c) congelar el gel de (b); y 40 (d) secar el gel congelado de (c) para obtener una esponja de polisacáridos. 45 21. Un procedimiento según la reivindicación 20, que comprende además la adición de un reticulante a dicha solución de polisacárido de (a) durante la etapa de gelificación (b), dicho reticulante siendo añadido en una cantidad para proporcionar una concentración de reticulante en la solución final que se somete a la gelificación entre 0,1 %y 0,3% p/v. 50 22. Un procedimiento según la reivindicación 20 ó 21, en el que dicha solución de polisacárido de (a) se prepara disolviendo el polisacárido en forma de polvo en agua doblemente destilada en cantidades para producir una concentración entre 1% y 3% p/v de polisacárido en dicha solución, dicha solución de polisacárido estando mezclada en un homogenizador a aproximadamente 25000 rpm durante aproximadamente 30 minutos a temperatura ambiente. 55 23. Un procedimiento según la reivindicación 20 ó 22, en el que la etapa de gelificación (b) se efectúa mediante agitación vigorosa de la solución de polisacárido en un homogenizador a aproximadamente 31800 rpm durante aproximadamente 3 minutos, y en la que cuando se añade un reticulante a la solución, dicho reticulante se añade muy lentamente durante dicha agitación vigorosa de la solución del polisacárido. 24. Un procedimiento según una cualquiera de las reivindicaciones 20 - 23, en la que dicho polisacárido es un alginato de la reivindicación 4. 60 65 25. Un procedimiento según la reivindicación 24, en el que en dicho procedimiento, las soluciones finales sometidas a gelificación en la etapa (b) se seleccionan del grupo constituido por: (i) 1% p/v de alginato LF 120 sin reticulante; (ii) 1% p/v de alginato LF 120 y 0,1% p/v de Ca - Gl; (iii) 1% p/v de alginato LF 120 y 0,2% p/v de Ca - Gl; (iv) 1% p/v de alginato LF 120 y 0,15% p/v de SrCl2 ; (v) 1% p/v de alginato LF 120 y 0,1% p/v de CaCl2 ; (vi) 0,5% p/v de alginato LF 120 y 0,2% p/v Ca - Gl; (vii) 1% p/v de alginato LF 20/60 y 0,2% p/v de Ca - Gl; (viii) 0,5% p/v de alginato HVCR y 0,2% p/v Ca - Gl; y (ix) 1% p/v de alginato HVCR y 0,2% p/v de Ca - Gl. 26. Un procedimiento según una cualquiera de las reivindicaciones 20 - 25, en el que dicha etapa de congelación (c) se efectúa mediante congelación rápida en un baño de nitrógeno líquido durante aproximadamente 15 minutos. 27 ES 2 206 707 T3 27. Un procedimiento según una cualquiera de las reivindicaciones 20 - 25, en el que dicha etapa de congelación (c) se efectúa mediante congelación lenta en congelador a aproximadamente -18ºC durante 8 - 24 horas. 5 10 28. Un procedimiento según una cualquiera de las reivindicaciones 20 - 27, en el que dicha etapa de secado (d) se efectúa mediante liofilización en condiciones de presión de aproximadamente 0,007 mmHg y a aproximadamente -60ºC. 29. Un procedimiento según una cualquiera de las reivindicaciones 20 - 28, en el que la solución de polisacárido final con o sin reticulante se vierte en un recipiente de forma deseada antes de comenzar la agitación vigorosa de la etapa de gelificación (b), dicho recipiente teniendo una forma que se desea para la forma de la esponja de polisacárido. 30. Uso de una esponja de polisacárido según una cualquiera de las reivindicaciones 1 - 13 como matriz, sustrato o estructura para el crecimiento in vitro de células de mamíferos, células vegetales, algas o para la fertilización in vitro de oocitos de mamíferos. 15 31. Uso de una esponja de polisacárido según la reivindicación 30 para el crecimiento in vitro de células de fibroblastos. 32. Uso de una esponja de polisacárido según la reivindicación 30 para el crecimiento in vitro de hepatocitos. 20 33. Piel artificial que comprende una esponja de polisacáridos según una cualquiera de las reivindicaciones 1 a 13 y células de fibroblastos dérmicos cultivadas en dicha esponja in vitro hasta la fase en la que dichas células son una fase de proliferación activa adecuada para el transplante a un paciente en necesidad de dicha piel artificial. 25 34. Un equivalente de órgano artificial que comprende una esponja de polisacárido según una cualquiera de las reivindicaciones 1 a 13 y células representativas de dicho órgano, dichas células que se han cultivado en dicha esponja in vitro hasta la fase en la que dichas células son completamente activas y equivalentes a las células activas de dicho órgano, dicho órgano artificial siendo apropiado para transplante o implante en un paciente en necesidad del mismo después de una lesión, extirpación o disfunción de un órgano. 30 35. Un equivalente de órgano artificial según la reivindicación 34 que es un equivalente de órgano artificial, en el que dichas células cultivadas sobre dicha esponja son hepatocitos en una fase en la que dichos hepatocitos son activos y funcionan de una manera equivalente a los hepatocitos in vivo y son adecuados para transplante o implante en un paciente que padece una disfunción, lesión o al menos extirpación parcial de hígado. 35 40 45 50 55 60 65 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos químicos y farmacéuticos como tales. Esta información no prejuzga que la patente esté o no incluida en la mencionada reserva. 28 ES 2 206 707 T3 29 ES 2 206 707 T3 30 ES 2 206 707 T3 31 ES 2 206 707 T3 32 ES 2 206 707 T3 33 ES 2 206 707 T3 34 ES 2 206 707 T3 35 ES 2 206 707 T3 36 ES 2 206 707 T3 37 ES 2 206 707 T3 38 ES 2 206 707 T3 39 ES 2 206 707 T3 40 ES 2 206 707 T3 41 ES 2 206 707 T3 42 ES 2 206 707 T3 43 ES 2 206 707 T3 44 ES 2 206 707 T3 45