revision virus papiloma humano. biología
Anuncio

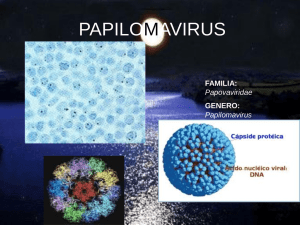
REVISION VIRUS PAPILOMA HUMANO. BIOLOGÍA MOLECULAR, GENÉTICA Y MECANISMO ONCOGÉNICO. PARTE I. Dra. Elizabeth Ball* Dra. Elizabeth Ball. Virus Papiloma Humano. Biología Molecular, Genética y Mecanismo Oncogénico. Parte I. Derm Venez 1998; 37:136141 RESUMEN La biología molecular de la infección por el virus papiloma humano (VPH) y su mecanismo oncogénico es compleja. El genoma y el ciclo de replicación viral han sido bien caracterizados. Los métodos de hibridización molecular y PCR han permitido relacionar al VPH con lesiones premalignas y malignas de piel y mucosas. En los últimos 20 años se han descrito aproximadamente 77 genotipos de VPH y se han clasificado en tres grupos de acuerdo a su potencial oncogénico y al tipo de lesión que producen. En la primera parte de esta revisión, se discutirá la biología molecular del VPH, la biología de la infección, la clasificación del virus y algunas generalidades sobre las lesiones que producen en piel, mucosa oral y anogenital y su potencial oncogénico. ABSTRACT The molecular biology of human papillomavirus (HPV) infection and oncogenesis is complex. The genomic structure and the viral replication cycle are well characterized. The molecular hybridization and PCR methods of HPV detection have suggested the role of the virus in premalignant and malignant lessions of the skin and mucosa. During the past 20 years aproximately 77 genotypes have been described and classified in three groups according to the type of lesion they produce and its oncogenic potential. In the first part of this review we discuss the molecular biology of HPV, the biology of the infection, the classification of the virus and some considerations about the lesions it causes in skin, oral and anogenital mucosa and its oncogenic potential. Palabras clave: Virus papiloma humano-biología molecular-métodos de detección del virus-Tumores de piel y mucosas. INTRODUCCIÓN. El virus papiloma humano (VPH) representa un grupo heterogéneo de agentes que infectan tejidos epiteliales y producen papilomas y tumores benignos. En algunos casos la infección viral puede llevar a una transformación maligna'. La naturaleza infecciosa de los papilomas genitales y cutáneos y su relación con la actividad sexual ha sido reconocida desde la época de 2 los romanos . Sin embargo, no es sino hasta 1949 * 136 Médico Dermatólogo. Docente del Servicio de Dermatología del Hospital Universitario de Caracas DCV. cuando por microscopia electrónica se identificaron partículas virales en verrugas humanas3. Los papilomavirus (PV) han sido aislados en al menos 24 especies de animales incluyendo aves, reptiles y mamíferos y en algunas de estas especies se ha asociado a cáncer (Ca) invasivo. Se han identificado hasta ahora más de 77 tipos de VPH. Los estudios comparativos demuestran que los tipos de VPH en primates se parecen mas a su tipo correspondiente en el humano que los tipos humanos entre sí. Esto sugiere que la separación de los diferentes genotipos humanos ocurrió en el periodo pre-homínido. La diversidad genética del VPH no refleja la adquisición rápida de mutaciones, sino una historia antigua de adaptaciones del virus a diferentes células del huésped y a los mecanismo de control viral desarrollados por el mismo3. Actualmente el mayor aliciente para el interés en el VPH se debe no solo al aumento de la prevalencia de infección por este virus a nivel mundial en los últimos años, sino al descubrimiento de su relación causal con el Ca de cuello uterino, Ca ano-genital y posiblemente otros Ca humanos, entre ellos tumores de piel y 1,2,3 . mucosas Biología molecular del VPH El VPH forma parte de la familia de DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 los papovavirus. Mide 55 nm y tiene una estructura icosaédrica compuesta de 72 proteínas capsométricas que encierran al genoma viral'. El genoma consiste en una molécula de DNA de doble cadena circular cerrada que tiene 7900 pares de bases. Las regiones del genoma que codifican proteínas están localizadas en una de las dos cadenas de DNA y se llaman marcos abiertos de lectura (MAL). Existen aproximadamente 9 a 10 1,5 MAL . El genoma del VPH se ha dividido en 3 regiones: la región E (early o temprana), la región L (late o tardía) y la región LCR (long control región) que no codifica proteínas. La región E contiene MAL que codifican los productos necesarios para la regulación de la replicación y trascripción del DNA (El y E2) o para la transformación e inmortalización de la célula huesped (E5 y E6). Las regiones L consisten en MAL que codifican las proteínas necesarias para la 1,5,6,7 formación de la cápside viral LCR: contiene el sitio donde se inicia la replicación y transcripción del DNA viral, elementos reguladores de la transcripción y un sitio de unión para la proteína E21,2,5 MAL que codifican las proteínas de la cápside: son los genes L1 y L2 que codifican las proteínas del mismo nombre. MAL que codifican productos reguladores virales: son los genes El y E2. E2: codifica a la proteína E2 necesaria para la replicación del DNA viral. La proteína E2 tiene e extremos o dominios con diferentes funciones. El dominio carboxiloterminal se une a la región iniciadora de la replicación en la LCR del DNA viral. El dominio amino-terminal representa el sitio que activa la transcripción del DNA viral, reclutando los factores celulares y estimulando la expresión de genes celulares que codifican proteínas necesarias para activar la maquinaria de transcripción viral. La proteína E2 en su total longitud actúa como estimuladora de la replicación y transcripción del DNA viral. Los fragmentos de proteína E2 actúan como represores de la transcripción viral, compitiendo con la proteína E2 completa para su unión con la LCR, impidiendo la acción estimuladora de la transcripción del DNA viral. El predominio de esta función represora explicaría por qué está reducida la expresión y replicación viral en los estratos 2,6 inferiores de los epitelios E1: es una proteína reguladora que se une en forma específica al sitio de origen de la replicación contenido en la LCR viral. Esta unión es de baja afinidad, pero cuando la proteína E2 se agrega, entonces la unión se hace de alta afinidad. Las mutaciones del gen El aumentan la transcripción viral y la capacidad transformadora e inmortalizadora del genoma viral. Se piensa que ello ocurre porque El es capaz de suprimir al gen p97 promotor de la expresión de los 2,6. oncogenes E6 y E7 MAL que codifican proteínas de función no bien conocida: el gen E4 codifica una proteína que produce un colapso de la red citoplasmática de filamentos de queratina, permitiendo que el virus sea descamado hacia el ambiente o inoculado a otro tejido1,7,8,10. MAL que codifican oncoproteínas: son los oncogenes E5, E6 y E7. E6 y E7: codifican las oncoproteínas E6 y E7, las cuales se unen a proteínas producto de genes supresores de tumores, bloqueando su acción reguladora de la división celular. Los genes E6 y E7 se transcriben a partir de una región promotora, p97 y p103 respectivamente, localizadas en la LCR del genoma viral. La proteína El y posiblemente la E2 pueden interactuar con estos lugares específicos del LCR y modular la actividad del promotor suprimiendo la expresión de los DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 oncogenes E6 y E71,6,7 E5: este gen parece intervenir en los estadios tempranos de la carcinogénesis. La proteína ES es abundante en la luz de los sacos de Golgi de las células infectadas. Esta localización es la misma de los receptores del factor de crecimiento epidérmico y factor de crecimiento derivado de plaquetas. La oncoproteínas E5 impide la baja regulación de estos receptores ya que interfiere con su eliminación lisosomal. Posiblemente E5 no es esencial para el ciclo reproductivo y la acción oncogénica del virus, pero sí provee un ambiente celular más apropiado para la replicación del 1 DNA viral . Biología de la infección por VPH La transmisión ocurre por contacto directo persona a persona, contacto sexual, contacto con fomites contaminados y más recientemente se ha constatado su presencia en algas y aguas marinas9,10 El período de incubación oscila entre 6 semanas y 8 meses1,5. Todos los epitelios son susceptibles, pero las uniones escamocolumnares como las del cuello uterino, son particularmente vulnerables a la infección. Ciertos sitios anatómicos son específicamente más susceptibles de infectarse por determinados tipos de VPH. Por ejemplo, el tracto genital, laringe, mucosa orofaríngea, ano, esófago y el lecho ungueal son más susceptibles a la infección por los VPH del grupo 3 (ver mas adelante). Entrada: el VPH infecta al huésped mediante su implantación directa a través de pequeñas soluciones de continuidad del epitelio. El virus inicialmente infecta las células basales con 1 a 2 copias de DNA viral por célula epitelial. Las células basales infectadas experimentan un retardo en su diferenciación y se dividen lateralmente produciendo un clon de celular basales infectadas. Durante la 137 fase proliferativa de la célula basal, la replicación del DNA viral está restringida y coordinada con la división celular normal (periodo de latencia). Este modo de infección garantiza que 1 célula originalmente infectada produzca toda una población clonal de células infectadas en la superficie de la lesión en desarrollo. Sin embargo si un gran número de células basales son infectadas, la lesión será 1,2,3,10 policlonal Al iniciarse la diferenciación de la célula basal y su viaje a través del epitelio, comienza la replicación y transcripción del DNA viral. Los eventos celulares específicos relacionados con la diferenciación celular traducen señales estimulatorias para la replicación viral. Esta es la paradoja central del VPH: su replicación está detenida en las células basales las cuales se encuentran en división activa y la replicación viral se activa cuando la célula está diferenciándose, por lo tanto las enzimas necesarias para la replicación viral no están presentes. El virus debe movilizar estos factores celulares necesarios para reproducir su genoma viral. Se postula que los oncogenes E5, E6 y E7 engañan a la célula huésped para que ella proporcione los materiales y enzimas necesarias para sintetizar el DNA viral. Mientras que las proteínas El y E2 reclutan estos materiales hacia el DNA viral. El VPH se replica en gran número sólo en células altamente diferenciadas'. Salida: después de que muchas copias del DNA viral circular se han sintetizado en los estratos superiores del epitelio, los genomas son incorporados en una cápside formada por las proteína L1 y L2. El ensamblaje del virión ocurre dentro del núcleo celular. Esta cápside protege al DNA viral durante su trayecto intracelular a través del epitelio. EL virus no se elimina a través de la membrana y no queda recubierto de una envoltura 138 lipidica lo cual lo haría sensible al daño ambiental como el calor, desecación o detergentes. El hecho de que el virus se ensamble en el número de la célula y no se relacione con los receptores de la membrana celular posiblemente hace que sus partículas no sean antigénicas y no sean reconocidas por los mecanismo de vigilancia inmune. Una vez ensamblados, los nuevos virus son llevados por los queratinocitos hasta el estrato córneo de donde son eliminados al ambiente exterior'. Las células ya diferenciadas e infectadas por un gran número de partículas virales experimentan cambios morfológicos. Los núcleos se hacen grandes, hipercromáticos y se rodean de un halo citoplasmático claro, formando el coilocito2. Tipos de VPH, Clasificación En los últimos 20 años se han caracterizado 77 genotipos y en un futuro inmediato este número (Cuadro 1). Los aumentará3 diferentes Cuadro 1. Tipos de VPH y lesiones que producen. Tipo de VPH Tejido infectado o lesión asociada 1 Verrugas palmares y plantares profundas 2*, 4, 29, 57 3, 10, 28 5, 8, 14, 17, 20 Verrugas vulgares y plantares Verrugas planas EV (incluyendo CEC) 6, 11 *, 42, 43, 44, 54 Verruga y condilomas genitales, papilomas larigenos u algunas displasias leves del tracto genital 7 Extensas verrugas en manos de carniceros 9, 12, 15, 19, 12, 25, 36, 40, 46, 47, 50 Lesiones benignas en EV Hiperplasia epitelial focal (enf. de Heck), Ca 13, 32 l genital, papulosis 16* Ca y displasia del tracto 18, 30, 31, 33, 35, 40, 45, 51, 52, 55, 56, 58, 59 bowenoide, algunos Ca larineeos y esofágicos 26, 27, 49 Verrugas en inmunodeficientes 34 Enf. de Bowen de piel y NIC genital 37 Queratoacantomas 38 Melanoma maligno 41 Verrugas diseminadas, CEC 48 CEC 60 Quiste epidérmico 61, 61 b, 62, 64, 67 NIV (neoplasia intraepitelial vulvar) 63 Verruga plantar tipo mirmecia 65 Verruga pigmentada 66 Ca cervical 68 Lesión genital 69 NIC 70 Lesión anogenital: papiloma vulvar 71, 74 Neoplasia anal intraepitelial 72, 73 Papiloma oral (inmunosupresión) 75, 76, 77 Verruga vulgar (inmunosupresión) (Tomado de referencias 4 y 15) * E l VPH 2 se ha encontrado en TU orales benignos y malignos incluyendo el Ca de lengua (4). * VPH 6 y 11 se han aislado de casos de Ca verrugoso genital, Ca de vulva, ano, lengua, CEC de pulmón, papilomas de la cavidad oral, senos nasales y paranasales (4). * VPH 16 se ha encontrado también en enfermedad de Bowen, nevus del pie, queratosis arsenicales, 1 caso de papulosis bowenoide de la cara, CEC del dedo y del labio y queratoacantoma del dedo (4). DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 tipos se discriminan de acuerdo a la similitud de su DNA usando sondas de DNA de VPH conocidos mediante técnicas de hibridización molecular. La complementariedad de la doble cadena de DNA permite que tipos similares de VPH se hibridicen entre si con alta eficacia". De acuerdo con la definición actual, un nuevo tipo de VPH es reconocido si demuestra más de un 10% de diferencia en cuanto a la secuencia de nucleótidos de los genes E6, E7 12 y L1 . Recientemente, se ha concluido que una diferencia de más del 10% en la secuencia de nucleótidos del gen L1 es criterio suficiente para definir un nuevo tipo. Los diferentes tipos de VPH resultan de cambios en la secuencia de aminoácidos de las proteínas virales codificadas; estas variaciones son probablemente las responsables de que cada genotipo tenga diferente tropismo tisular y 13, oncogenicidad Los estudios clínicos, virológicos y epidemiológicos han permitido clasificar los tipos de VPH en 3 grupos1,3,6 Grupo 1: encontrados en lesiones cutáneas (verrugas vulgares y planas). Ejemplo: tipos 1,2,3,4,7. Grupo 2: aislados de las lesiones de pacientes con epidermodisplasia verruciforme (EV). Los dos más importantes son los VPH 5 y 8, pero también el 14, 1 7 y 20. Otros tipos se asocian a lesiones benignas de EV. Grupo 3: afecta mucosas como la orofaringe y la región anogenital. Incluye a los VPH de bajo riesgo 6 y 11 frecuentes en condilomas acuminados y papilomas laríngeos y que raramente producen transformación maligna. Los VPH de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51 y 5 2 ) s e han identificado en Ca de cuello uterino, pene, vulva, ano, papulosis bowenoide, Ca espinocelular, algunos Ca laríngeos y esofágicos y en neoplasias intraepiteliales. Métodos de detección del VPH La mayoría de las infecciones genitales por VPH son subclínicas y pueden ser detectadas aplicando ácido acético al 5% al área a estudiar. El epitelio blanco-acético representa focos de hiperplasia epitelial debidas a infección por VPH. Si la infección es latente no se evidencia el epitelio blanco-acético ya que aún no se ha iniciado la replicación viral y no hay cambios detectables en el tejido. Otro método diagnóstico es la citología; la presencia de coilocitos es altamente sugestiva de infección por VPH. Sin embargo, con frecuencia tejidos infectados por VPH no demuestran coilocitosiss, 10 Los métodos de hibridización del DNA son los más usados actualmente para detectar DNA del VPH en especímenes clínicos y permite diferenciar los diferentes tipos. El principio consiste en que una molécula de DNA que se coloca en contacto con una molécula de DNA igual o parecida, se unirá o hibridizará a esta última y dicha unión puede ser detectada. El método de hibridización "standard de oro" es el Southern Blot. Otras variantes de los métodos de hibridización son las siguientes: hibridización in vitro con filtro (FISH) similar al Southern Blot pero de más fácil realización; hibridización in situ que permite demostrar el DNA del VPH directamente en la pieza histológica y el Dot-Blot. La reacción en cadena de la polimerasa (PCR) es un método exquisitamente 5,10 Este método utiliza sensible "primers" que amplifican la región E6 o L1 del genoma viral millones de veces. Una nueva técnica, sencilla y confiable, es la combinación de PCR e hibridización in situ, en la cual las secuencias del DNA son amplificadas por PCR seguido por el método standard de hibridización in situ 1 5 (Cuadro 2) VPH y lesiones tumorales orales y genitales Las lesiones por VPH más frecuentes del tracto genital son los condilomas acuminados, asociados principalmente con VPH de bajo Cuadro 2 . Pruebas para l a detección de l DNA del V P H Método Ventajas Ventajas Desventajas Southern-Blot Alta especificidad y sensibilidad Detecta 1 molécula de DNA de VPH/10 células Fácil procesamiento Proceso largo y difícil. No permite detectar secuencias de DNA de tipos desconocidos. Baja sensibilidad y especificidad Sensibilidad moderada Requiere bx. Sensibilidad no bien determinada Requiere rigurosidad tecnológica FISH Dot Blot Hibridización in situ PCR DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 Útil en tejidos Sensibilidad. Detecta 1 molécula de DNA de VPH/ 139 riesgo. La transformación maligna puede ocurrir hasta en el 28% de las lesiones genitales de larga evolución si son producidas por VPH de alto riesgo16. Hay evidencias de que el VPH16 puede permanecer latente en la mucosa oral y genital17,18 y de que puede ocurrir la transmisión vertical de la madre al recién nacido''. La infección perinatal es de particular importancia ya que parece ser la causante de papilomas laringeos juveniles y posiblemente de cáncer oral y genital20. Cáncer cervical: las biopsias de Ca cervical son positivas para DNA de VPH en un 90 a 100 %. Los tipos de VPH mas frecuentemente encontrados son el 16 (50%) y el 18 (20%)3.10. En América Latina, 45% de los casos de Ca de cuello uterino están asociados a VPH 16y1821. Cáncer de vulva: la positividad del VPH para Ca de vulva es menor que para el Ca cervical (<50% vs. el 95%). El Ca invasivo es con frecuencia precedido por neoplasia intraepitelial vulvar (NIV). En mujeres jóvenes las lesiones son multifocales y contienen VPH1615. Cáncer de pene: 30% a 54% de las biopsias de Ca de pene son positivas para VPH', 22 VPH 16, 31 y 33 son los tipos más frecuentemente aislados en Ca de pene22. Cáncer anal: la positividad para VPH en neoplasia intraepitelial anal (NIA) y Ca anal y perianal excede el 70% con el uso de técnicas sensibles. El Ca anal se asocia con VPH 16 y 18 mientras que las NIA de bajo grado y los tumores de Buschke-Loewenstein se asocian con VPH de bajo riesgo 6 y 11 3,15,23,24, Papulosis bowenoide: asociada a VPH 16. Su curso en jóvenes es usualmente benigno con regresión espontánea en meses. En personas de mayor edad, no hay tendencia a la regresión espontánea sino al desarrollo de cáncer con rasgos de enfermedad 140 de Bowen25. La coexistencia de papulosis bowenoide y cáncer invasivo de vulva y pene ha sido previamente reportado26, Tumores de la cavidad oral: la cavidad oral puede infectarse con varios tipos de VPH. La mayoría pertenecen al grupo genital y algunos cutáneos15. Dos nuevos tipos, el 72 y 73 han sido aislados de verrugas orales con atipia en pacientes inmunosuprimidos27. Estos tipos de VPH pueden asociarse a lesiones orales benignas, premalignas o malignas. Además, VPH se ha encontrado en mucosa oral normal en 1 %-43% de la población dependiendo de la técnica de detección utilizada28. Por lo tanto, al igual que en la mucosa genital, el VPH está presente en la mucosa oral en forma latente. En estudios recientes con PCR, la prevalencia de VPH en cáncer oral, principalmente VPH 161 varía del 20 al 74% (15). Un 60% de los Ca de amigdalas contienen DNA de VPH 16 o 33. Estos VPH junto con el 2,27 y 57 se han aislado en Ca de lengua, orofaringe y laringe. En conclusión, el DNA de VPH se encuentra en aproximadamente el 10% de todos 3 los cánceres humanos . VPH y Cáncer de Piel En Ca cervical y ano-genital se ha demostrado la integración del genoma viral y la expresión de los oncogenes E6 y E7. Datos comparables en relación a Ca de piel no existente9,29 El VPH 16 se ha demostrado en forma consistente sólo en el Ca espinocelular periungueal, lo que probablemente refleja una transmisión genital del virus. Se ha encontrado VPH en aproximadamente el 10% de los Ca de piel en otras localizaciones, pero sin predominio de ningún tipo particular. Los tipos 16 y 18 se han aislado ocasionalmente en queratoacantomas; tipos 2, 16 y 34 en enfermedad de Bowen, tipos 36 y 41 en queratosis actíneas; tipo 20 en epitelioma basocelular y tipos 5, 11, 16, 18 y 41 en Ca espinocelular9. En individuos inmunocompetentes es rara la presencia de VPH en Ca espinocelulares, basocelulares y Sin lesiones premalignas30. embargo, con técnicas más sensibles de PCR una alta prevalencia de cáncer cutáneo positivo para VPH se ha observado en individuos inmunocomprometidos15-31. No se ha determinado aún en forma precisa el papel del VPH en cáncer de piel en individuos inmunocompetentes, sin embargo, Zur Hausen sugiere que la relación entre cáncer de piel y VPH ha alcanzado la etapa que en 198384 relacionaba al VPH con el cáncer de cuello uterino32. BIBLIOGRAFIA 1. Androphy EJ: Molecular Biology of Human Papillomavirus Infection and Oncogenesis. J. Invest. Dermatol 1994;103(2):248-56. 2. Crum CP, Nouo GL: Genital Papillomavirus and Related Neoplasms. Raven Press. New York 1991. 3. Zur Hausen H, de Villiers EM: Human Papillomaviruses. Ann Rev Microbiol 1994; 48:427-47. 4. de Villiers EM: Human Pahrogenic Papillomavirus Types; An Update. Curr Top in Microbiol Immunol 1994; 186: 1-9 5. Brown D, Fife K: Human Papillomavirus Infection of the Genital Tract. The Medical Clinics of North America 1990; 74(6):1455-85 6. Scheffner M, Romanezuk H, Munger K, et al: Functions of Human Papillomavirus Proteins. Curr Top Microbiol Immunol 1994; 185:83-97 7. Mc Dougall JK: Immortalization and transformation of human cells by human papillomaviruses. Curr Top in Microbiol Immunol 1994; 186:101-19 8. Palefsky J.M., Winkler B, Rabanus JP, et al: Characterization of in vivo expression of the human papillomavirus type 16 E4 protein in cervical biopsy tissues] Clin Invest 1991;87:2132-41. 9. Mac Gregor JM, Rustin MHA: Human papillomavirus and skin cancer. Postgrad Med J 1994; 70:682-5 10. Activación Linfocitaria e Infección por el Virus Papiloma Humano. Curso de Inmunología Básica DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 y Clínica en la Práctica Médica. Comité Editor Baroja Lorea M, Machado I, Spagnuolo, Caldera L, Mondolfi A, Tassinari P. 11. Lowy DR, Androphy EJ: Warts. In: Dermatology in General Medicine. Fitzpatrick TB eds. Volt, cap. 212:2611-21. Cuarta edición 1993. Mc Graw-Hill 12. Chan S-Y, Delius H, Haipern AL, et al: Analysis of genomic secuences of 95 papillomavirus types: uniting typing, phylogeny and taxonomy. J Virol 1995; 69:3074-83 13. Chan S-Y, Bernard H-U, Ong C-K. Phylogenetic analysis of 48 papillomavirus types and 28 subtypes and variants: a showcase for the molecular evaluation of DNA virus J Virol 1992; 66:5714-25. 14. Bernard H-U, Chan S-Y, Delius H. Evaluation of papillomaviruses. Curr Top Microbiol Immunol 1994; 186:33-54. 15. Majewski S, Jablonska S: Human papillomavirusassociated tumors of the skin and mucosa. J. Am Acad Dermatol 1997; 36:659-85 16. Scholefield JH, Wage H, Smith JH et al. Anal intraepithelial neoplasia is part of a multifocal disease process. Lancet 1992; 340:1271-3 17. Bauer HM, Ting Y. Greer OE, et al. Genital human papillomavirus infection in female university students as determinated by a PCRbased method JAMA 1991; 265:472-7 18. Denison SA, Yu XP, Valentine JM, et al. Evidence of prevalent genital type human papillomavirus infections in adults and children J Infec Dis 1990; 162:60-9 transmissión of human papillomavirus from infected mother to their newborn babies and persistence of the virus in childhood. Am J Obstet Gybecol 1996; 1 74:694-9 human papillomavirus type 16 in bowenoid papulosis and invasive carcinoma occurring in the same patient with a history of cervical carcinoma. Arch Dermatol 1988; 124:851-2 20. Smith EM, Johnson SR, Cripe TP, et al. Perinatal vertical transmission of human papillomavirus and subsequent development of respiratory tract papillomatosis. Ann Otol Rhin Laryngol 1991; 100:479-83 27. Mc Gregor JM, Garthing A, Crook T, et al: Postransplant skin cancer: A possible role for p53 gene mutation but not for oncogenic human papillomaviruses. J Am Acad Dermatol 1994; 30:701-6 21. Reeves WC, Brinton LA, García M, Brenes M, et al: Human Papillomavirus Infection and Cervical Cancer in Latin America. N Eng J Med 1989;320:1437-41 28. de Jong-Tieben LM, Berkhout RJM, Smits HLm, et al: High Frecuency of Detection of Epidermodysplasia Verruciformis-Associated Human Papillomavirus DNA in Biopsies from Malignant and Premalignant Skin Lesions from Renal Transplant Recipients. J Invest Dermatol 1995; 105:367-71 22. Suzuki H, Sato N, Kodama T, et al: Detection of human papillomavirus DNA and state of p53 gene in Japanese penile Cancer. Jpn J Clinic Oncol 1 994: 24(1):1-6 23. Palefsky JM, Holly EA, Gonzalez J, et al. Detection of human papillomavirus DNA in intraepithelial neoplasia and anal cancer, Cancer Res 1991; 51:1014-9 29. Shah KV, Gissman L: Experimental evidence on oncogenicity of papillomaviruses. In: Human Papillomavirus and Cervical Cancer. Eds: Muñoz N, Bosch FX, Jensen OM. International Agency for Research on Cancer Lyon 1989. Cap. 5:105-111 24. Zaki SR, JuddR, Coffield LM, et al: Human papillomavirus infection and anal carcinoma: retrospective analysis by in situ hybridization and polymerase chain reaction. Am J Pathol 1992; 140:1345-55. 30. Kawashima M, Favre M, Obalek S, et al. Premalignant lesions and cancer of the skin in the general population: evaluation of the role of human papillomaviruses. J Invest Dermatol 1990; 95:537-42. 25. Obalek S, Jablonska S, Beaudenon MB, et al. Bowenoid papulosis of the male and female genitalia: risk of cervical neoplasi. J Am Acad Dermatol 1986; 14: 433-44 31. Shamanin V, Zur Hausen H, Lavergne D, et al. HPV infections in non-melanoma skin cancers from renal transplant recipients and non-immunosuppressed parients. J Natl Cancer Inst 1996; 88:802-11 26. Kato T, Saijyo S, Hatchome N, et al. Detection of 32. Zur Hausen H. Roots and perspectives of contemporary papillomavirus research J. Cancer Res Clin Oncol 1996; 122:3-13. 19. Puranen M, Yliskoski M, Sarikoski S, et al. Vertical DERMATOLOGIA VENEZOLANA, VOL. 36, Nº 4, 1998 141