Sistemas de liberación modificada de drogas (DDS) FA7:
Anuncio

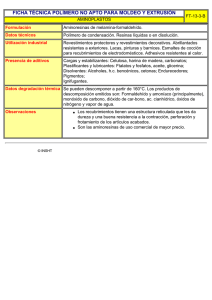
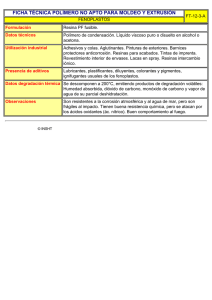
Sistemas de liberación modificada de drogas (DDS) FA8: • Son productos que permiten la liberación del principio con una velocidad predeterminada durante períodos de tiempo prolongados. Se han desarrollado sistemas de liberación para distintas vías de administración, algunos de los cuales se describen a continuación (transdérmico, ocular, intrauterino, apósitos). FC de una ff convencional a dosis única: cp A: administración intravenosa B: extravascular A B FC de ff convencional en dosis repetidas a intervalos regulares: Fig. 1 Theoretical drug concentration profile following multiple dosing of a drug as an immediate-release form every 8 hours (†•) and as an extended-release form once every 24 hours (---). Clasificación de sistemas de liberación modificada: • En relación al aspecto temporal el medicamento de liberación modificada puede ser de acción: – sostenida, prolongada o extendida – repetida o por pulsos – retardada o diferida • En relación al aspecto espacial el medicamento de liberación modificada puede ser de acción: – dirigida. Comprimido de liberación prolongada (FA8): Se formulan de tal manera que la liberación del principio activo se produzca durante un período prolongado de tiempo después de la administración. Las expresiones como liberación extendida, acción prolongada, acción repetida y liberación sostenida también se emplean para describir tales formas farmacéuticas. Sin embargo, el término liberación prolongada se aplica para los fines farmacopeicos y los requisitos para la liberación de los principios activos se especifican en las monografías correspondientes. Cápsulas de liberación prolongada (FA8): Se formulan de tal manera que la liberación del principio activo se produzca durante un tiempo prolongado después de su administración. Las expresiones como acción prolongada, acción extendida y liberación sostenida también se han empleado para describir tales formas farmacéuticas. Sin embargo, para los fines farmacopeicos y requisitos para la liberación de principios activos se emplea el término liberación prolongada. Ventajas y desventajas: • Ventajas: – Efecto terapéutico se mantiene durante más tiempo – Menor frecuencia de dosis (evita olvidos, tomas nocturnas), mayor aceptación y mejor cumplimiento de los tratamientos. – Menor cantidad de droga administrada en el tratamiento total con menores efectos secundarios (evita picos y valles) y menor costo – Nivel plasmático controlado, predecible, constante. – Disminución de trastornos asociados a intolerancia gástrica. • Desventajas: – Peligro de sobredosificación con efectos tóxicos – Difícil interrumpir tratamiento si aparecen efectos colaterales – Variaciones individuales no contempladas Reflexión: Pese a las ventajas mencionadas, no debe perderse de vista que el grupo de drogas para las cuales se han demostrado ventajas clínicas significativas por el uso de sistemas de liberación prolongada es limitado. Tanto los prescriptores como los farmacéuticos deben tener conciencia de los costos de estos productos y seleccionarlos para grupos de pacientes para los que se justifiquen. A veces estas presentaciones sirven más a objetivos de marketing que a los clínicos. Requisitos: • Responder al perfil de liberación deseado. Primero se consideró ideal mantener un nivel constante. Con el conocimiento de cronofarmacología se vio que en muchos casos se deberían acompañar los ritmos circadianos. Hoy se piensa en sistemas inteligentes que respondan a demanda. • Atóxico, no antigénico y biocompatible • Que alcance el estado estacionario en el tiempo deseado • Buena conservación hasta su uso (se debe mantener la funcionalidad) • Tecnológica y económicamente accesible. Otras clasificaciones de sistemas de liberación: • Por vía de administración: – – – – – – – • Vía oral Vía parenteral Percutánea Ocular Vaginal Bucal Nasal Por estructura del sistema: – – Monolíticos o matriciales Reservorio Reservorios: Pueden ser pequeños como microcápsulas o grandes como comprimidos. Membrana polimérica que regula la liberación p.a. en exceso Cinética de liberación: • Se consigue una liberación de orden cero con velocidad constante pues dentro del sistema se mantiene una solución saturada. La expresión matemática de la velocidad de liberación es: dMt = y = A . D . K . dc dt dx Velocidad de liberación liberación inicial cte agotamiento del sistema tiempo Reservorios: • Exteriormente puede poseer una película de recubrimiento con la dosis inicial o de ataque. • La membrana polimérica que regula la liberación es una cubierta fílmica o recubrimiento por compresión. • Material: gelatina, etilcelulosa, hidroxipropilcelulosa, polihidroximetacrilato, PVP, ceras, poliuretano, quitosano. • Si el material de cobertura es soluble la liberación será por disolución como en el caso de los Spansule, cápsulas conteniendo microcápsulas revestidas con distintos espesores de cubierta. • Los sistemas osmóticos pueden considerarse sistemas de reservorio. También los comprimidos con cubierta entérica. Matrices: Matriz polimérica p.a. homogéneamente disperso Cinética de liberación: • La droga se lixivia de la matriz, se va agotando la droga superficial y la interfase avanza hacia adentro como un frente. Velocidad De liberac. La liberación depende de: - la geometría del sistema - tipo de polímero - PM del p.a. tiempo Clasificación: • • • • Según el polímero y su interacción con el medio fisiológico tenemos matrices: Inertes Erosionables Hidrofílicas Lipídicas 1. Matrices intertes: • Sistema Gradumet de Abbott. • Resinas de intercambio iónico en las que va fijada la droga. La liberación posterior depende del medio iónico (pH y composición electrolítica), grado de reticulación (mayor o menor resistencia a la difusión) y del tamaño de las partículas (superficie de difusión). Puede haber un recubrimiento exterior para mayor control de liberación. Generalmente resinas con grupos sulfónicos que intercambian drogas catiónicas. 2. Matrices erosionables: • Combinan difusión y degradación del polímero. Son sistemas controlados químicamente por hidrólisis o mediación enzimática. Mecanismos de liberación: – p.a. unido al polímero, se libera por hidrólisis dejando como residuo fragmentos pequeños del polímero. – Hay una membrana externa que colabora en el control de la liberación: Erosión completa – Sin membrana controladora externa, con erosión posterior o simultánea con la liberación. 3. Matrices hidrofílicas (hidrogeles): • Aumentan de volumen por hinchamiento controlado en contacto con el medio fisiológico, el p.a. difunde, el polímero es biodegradable. Volumen Tiempo • El polímero posee grupos lábiles (policarbonato, poliéster, poliamida, poliuretano, etc.) que sufre degradación hidrolítica o enzimática. • Tipos de polímero: – Naturales o semisintéticos: agar, alginatos, quitosano, almidón modificado. – Esteres de celulosa (de mayor uso): el más usado es HPMC – Derivados del ácido acrílico: Carbopol. • El tiempo de degradación del polímero debe ser mayor que el de liberación de la droga. Está condicionado por el PM del polímero y el grado de entrecruzamiento. 4. Matrices lipídicas: • Base grasa erosionable. Problemas de estabilidad por aparición de formas polimórficas duras que liberan el principio activo a menor velocidad. La liberación depende de la composición del fluido gastrointestinal. Para hacerla más predecible se adiciona lipasa pancreática y carbonato de calcio como promotor de la acción de la lipasa. También se pueden incorporar tensioactivos y polímeros hidrofílicos para facilitar la incorporación de agua. Como excipiente principal se emplean grasas y aceites naturales hidrogenados comestibles de distinto punto de fusión. Otra clasificación: 3. Por el tamaño: • Sistemas grandes • Sistemas particulados: – Micropartículas: – Microesferas – Microcápsulas – Nanopartículas: – Nanoesferas – Nanocápsulas Sistemas osmóticos • SISTEMA OROS (Oral Release Osmotic System): Comprimido desarrollado por la firma Alza, constituido por un núcleo que contiene un fármaco osmóticamente activo (p.a. + electrolitos: cloruro de sodio, de potasio o manitol) y revestido de una membrana semipermeable (ej. Acetato de celulosa, alcohol polivinílico, poliésteres). La membrana permite solo el pasaje de agua. En medio acuoso el sistema incorpora agua, independientemente del pH y de la composición del jugo digestivo. Si la membrana es rígida, el aumento de presión hidrostática dentro del comprimido hace que salga la solución saturada de p.a. por un poro o microorificio practicado en su revestimiento por medio de un láser. Utilizado para indometacina (fue el 1º en aparecer en la década del ´80 pero se retiró del mercado por efectos secundarios), nifedipina (Adalat OROS: la dosis es 1 por día mientras que las cápsulas se administran cada 8 horas), fenilpropanolamina, salbutamol, etc. Sistemas osmóticos • Hay dispositivos bicamerales separados por una barrera elástica o móvil. En una cámara se aloja el p.a., finamente disperso en un hidrogel que en contacto con el agua se fluidifica y puede salir fácilmente por el orificio. En la otra cámara hay una solución osmóticamente activa. La presión que se genera dentro de la cámara osmótica empuja la membrana y fuerza la salida de principio activo de la otra cámara. Este sistema también se puede adaptar para liberar simultáneamente 2 principios activos. Se excreta el sistema agotado. Sistemas osmóticos • Algunos laboratorios crearon un sistema de autoproducción de poros: el revestimiento exterior contiene partículas que al contacto con el agua o a determinados valores de pH se disuelven y dejan en su lugar minúsculos orificios. • Se deben seleccionar sales de la droga de solubilidad adecuada ya que: – si la solubilidad es demasiado baja la presión osmótica resulta insuficiente para originar un flujo efectivo. – Si la solubilidad es demasiado alta la fase de liberación es muy corta. • No se debe obstruir el orificio por precipitación de la droga. Sistemas de liberación continua con tránsito GI retardado • Dada la velocidad de vaciado gástrico y la motilidad gastrointestinal, los sistemas convencionales no pueden programar la liberación para más de 12 horas. Esta es una línea que tiende a aumentar el tiempo de permanencia en el tracto gastrointestinal. – BIOADHESIVOS – FLOTANTES – EXPANDIBLES Sistemas bioadhesivos • Objetivo: aumentar el tiempo de permanencia en el lugar de absorción y lograr mayor BD. • Material del sistema (derivados celulósicos: CMC, HPC, MC, metacrilatos, gelatina, goma tragacanto, goma karaya, goma guar, alginato de sodio, quitosano, carbopol) interacciona con la mucina de la mucosa y forma enlaces que proveen la adhesión. Son polianiones a bajos valores de pH y forman puentes hidrógeno y a altos pH son policationes capaces de interaccionar electrostáticamente. • Sitios potenciales para la adhesión: todo el tracto GI, la mucosa rectal, bucal, nasal, respiratoria, ocular y vaginal. • Configuración: el sistema puede tener la forma de un comprimido, puede estar constituido por partículas pequeñas (micro y nanopartículas) o películas. Sistemas bioadhesivos • El mucus que tapiza las mucosas está constituido en un 95% por agua, entre 0,5 y 5% de proteínas, entre ellas la mucina (glicoproteína de alto PM de naturaleza aniónica a pH neutro) y sales inorgánicas (1%). Esta composición varía según la localización y el estado fisiopatológico. • Lubrica y protege la mucosa y está en constante renovación. Hay que tener en cuenta: la posibilidad de ejercer presión para favorecer la adhesión, la motilidad gástrica que puede producir desprendimiento, las variaciones de pH, la renovación de la mucina. • Son sistemas interesantes para acción local y para principios activos poco solubles. La adhesión colónica puede ser útil para la administración de fármacos protéicos. Sistemas flotantes • Los sistemas, generalmente cápsulas, flotan por tener baja densidad (a base de hidrocoloides como HPC) o por formación in situ de microreservorios de aire o gas. • La posición horizontal del cuerpo favorece el vaciado gástrico y por lo tanto influye en la permanencia. • También influye la presencia de alimento. • Útil para principios activos que deben actuar localmente en el estómago, que son inestables a pH intestinal o cuya ventana de absorción está situada en la primer porción del intestino. Sistemas expandibles e hinchables Sistemas de acción repetida o pulsátiles (Repetab) Comprimidos con cubierta entérica (FA8): • Cuando el principio activo puede destruirse o inactivarse por el jugo gástrico o cuando puede irritar la mucosa gástrica se indica el empleo de los revestimientos entéricos. Estos revestimientos están destinados a retardar la liberación del principio activo hasta que el comprimido haya pasado a través del estómago. En esta Farmacopea se emplea el término “liberación retardada” y las monografías correspondientes incluyen ensayos y especificaciones para la liberación del principio activo. Cápsulas con cubierta entérica (FA8): • Las cápsulas o los gránulos encapsulados pueden recubrirse para resistir la liberación del principio activo en el fluido gástrico cuando es importante evitar problemas potenciales de inactivación del principio activo o la irritación de la mucosa gástrica. El término liberación retardada se emplea en las monografías para las cápsulas y los gránulos con cubierta entérica que están destinados a retardar la liberación del principio activo hasta que las cápsulas y gránulos encapsulados hayan pasado a través del estómago. Pulsincap • Un tipo de sistema diferido es el Pulsincap. Consiste en una cápsula de gelatina recubierta de un polímero insoluble, por lo que pasa en forma inalterada por el estómago. El cuerpo es insoluble y está obturado por un tapón de hidrogel que se pone en contacto con el fluido intestinal al disolverse la tapa de la cápsula. Al alcanzar cierto grado de hinchamiento el tapón es expulsado y el contenido de la cápsula se libera. Sistemas inteligentes: • El sistema cuenta con un biosensor para controlar la liberación según la respuesta terapéutica. Sistema sensible a cambios en el medio. Sistemas de suministro dirigido (vectorización): • Sistemas marcados con moléculas que reconocen el tejido blanco. Los sistemas transportadores pueden ser liposomas o nanopartículas. Liposomas: • Estructuras vesiculares constituidas por uno o más bicapas lipídicas concéntricas que encierran compartimientos acuosos. Se clasifican en: • MLV • UV: SUV y LUV • Las membranas están constituidas por fosfolípidos y colesterol. Se preparan disolviendo en un solvente orgánico (cloroformo) y evaporando a presión reducida en un evaporador rotatorio. De esta manera se forma una película sobre la pared del balón. Se hidrata con solución acuosa tamponada con agitación y se obtienen MLV que por sonicación pueden dar origen a SUV. Los liposomas se incorporan a las células por endocitosis, adsorción superficial, fusión con la membrana plasmática. Pueden asociarse a anticuerpos monoclonales para lograr un direccionamiento específico. Clasificación de partículas poliméricas transportadoras de drogas: ESTRUCTURA TAMAÑO RESERVORIO O CÁPSULA MONOLÍTICO MATRIZ O ESFERA Microcápsulas Microesferas Nanocápsulas Nanoesferas > 1 m < 1 m Según la incorporación del principio activo: • Adsorbido en la superficie • Encapsulado Controles • de la forma farmacéutica • de cesión del principio activo en función del tiempo in vivo e in Vitro (válido cuando se establece la correlación con los ensayos in vivo). • Biocompatibilidad y toxicidad del polímero. Variables a considerar en el diseño: • • • • • Características de la vía de administración Forma farmacéutica Patología a tratar Propiedades del principio activo Niveles de dosis y duración del tratamiento • Excipientes y métodos de obtención • Propiedades del producto elaborado