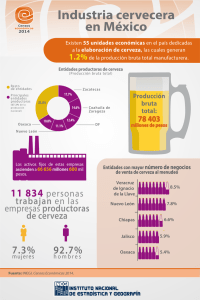
El lúpulo contenido en la cerveza, su efecto antioxidante en un
Anuncio

El lúpulo contenido en la cerveza, su efecto antioxidante en un grupo controlado de población Marzo 2007 Prof. Jesús Román Martínez Álvarez Dra. Victoria Valls Bellés Prof. Dr. Antonio Villarino Marín Sociedad Española de Dietética y Ciencias de la Alimentación (SEDCA). Facultad de Medicina. Universidad de Valencia. Para más información: CENTRO DE INFORMACIÓN CERVEZA Y SALUD Apartado de correos: 61.210 28080 Madrid Tfno: 91 383 30 32 Internet: www.cervezaysalud.com e-mail: [email protected] ©2007 Centro de Información Cerveza y Salud (CICS) Edición y Coordinación: Centro de Información Cerveza y Salud (CICS) Madrid 2007 Reservados todos los derechos. Prohibida la reproducción total o parcial de esta obra por procedimientos electroestáticos, electrónicos, magnéticos, informáticos o por cualquier otro medio sin autorización previa por escrito del editor. El lúpulo contenido en la cerveza, su efecto antioxidante en un grupo controlado de población Este trabajo ha sido realizado por el siguiente grupo de investigación: Prof. Jesús Román Martínez Álvarez Prof. Dr. Antonio Villarino Marín Sociedad Española de Dietética y Ciencias de la Alimentación Dra. Victoria Valls Bellés Dra. Pilar Codoñer Franch Ana Belén López Jaén Simón Yao Lee Facultad de Medicina. Universidad de Valencia Mª Carmen Ambrós Marigómez Hospital de León Agradecimientos: Los autores manifiestan su agradecimiento a las personas que con su colaboración hicieron posible la realización de este Estudio: al Dr. Rafael Pérez Vicente, jefe del servicio de análisis clínicos del Hospital de León, y a las Comunidades Cistercienses de los monasterios de San Miguel de las Dueñas, de Santa María de Carrizo, en Carrizo de la Ribera, y de Santa María la Real en Gradefes (León). SUMARIO 1 INTRODUCCIÓN: CERVEZA, LÚPULO, ACTIVIDAD ANTIOXIDANTE Y SALUD ..........................................................6 1.1. Cerveza con alcohol y cerveza sin alcohol .............................................8 1.2. Lúpulo ...........................................................................................9 2 RADICALES LIBRES Y ESTRÉS OXIDATIVO ..................................................16 2.1. El oxígeno y el daño oxidativo .............................................................16 2.2. Los radicales libres .............................................................................17 2.3. Origen de los radicales libres................................................................20 2.4. Daño oxidativo a las biomoléculas ........................................................22 2.5. Procesos fisiopatológicos relacionados con los radicales libres..................23 2.6. Sistemas de defensa ante el estrés oxidativo..........................................33 2.7. Alimentación y estrés oxidativo ............................................................51 3 OBJETIVOS DEL ESTUDIO .........................................................................59 4 MATERIALES Y MÉTODOS .........................................................................60 4.1. Material.............................................................................................60 4.2. Métodos ............................................................................................61 4.3. Diseño experimental............................................................................68 5 RESULTADOS...........................................................................................70 5.1. Valoración nutricional y energética .......................................................70 5.2. Suplementación dietética: cerveza sin alcohol ........................................72 5.3. Suplementación dietética: lúpulo..........................................................80 5.4. Estudio comparativo entre la suplementación con cerveza sin alcohol y lúpulo...........................................................88 6 DISCUSIÓN.............................................................................................90 6.1. Metabolismo oxidativo.........................................................................90 6.2. Metabolismo lipídico ...........................................................................93 6.3. Parámetros marcadores de inflamación ..................................................95 6.4. Capacidad antioxidante comparada de la cerveza sin alcohol y del lúpulo ........................................................97 7 CONCLUSIONES .............................................................................................99 • BIBLIOGRAFÍA ..................................................................................101 u n o INTRODUCCIÓN: CERVEZA, LÚPULO, ACTIVIDAD ANTIOXIDANTE Y SALUD La cerveza es una bebida fermentada tradicional que está presente en la dieta desde hace miles de años. Es una bebida de baja graduación alcohólica y se produce industrialmente a partir de ingredientes que apenas han cambiado en el transcurso de los siglos: agua, malta y lúpulo. Su posible relación con la salud no ha sido estudiada hasta tiempos muy recientes y sus efectos se achacan, sobre todo, a la presencia en la misma de sustancias antioxidantes como los polifenoles y las melanoidinas, además de otras sustancias nutritivas (folatos, carbohidratos, magnesio, etc.) y no nutritivas (fibra). Dentro de las bebidas que contienen polifenoles destaca la cerveza, cuya actividad antioxidante global oscila entre unos valores mínimos y máximos comprendidos en el intervalo 2 - 56 mg según la capacidad antioxidante equivalente de vitamina C (CEAC). Estos datos indican que se trata de una bebida con una capacidad antioxidante global significativa, ya que posee valores similares a otras bebidas alcohólicas, como el vino, y no alcohólicas, como el mosto. De los estudios realizados se desprende que el tipo de cerveza no influye en el poder antioxidante, ya que cervezas negras, rubias y sin alcohol presentan valores similares (González San José et al., 2001). Los compuestos fenólicos protegen de la oxidación a las lipoproteínas de baja densidad (LDL) desempeñando un papel clave en la prevención de la aterosclerosis. También pueden prevenir la trombosis, inhibiendo la agregación plaquetaria, la permeabilidad y fragilidad capilar (Mazza, 2000). Este efecto se ha demostrado mediante experimentos con animales in vitro e in vivo. En muchos casos se inhibe la AMP cíclico fosfodiesterasa y como resultado se incrementan los niveles de cAMP. Asimismo, se reduce el nivel de calcio, se inhibe el “factor de activación plaquetario”, se promueve la captación de los radicales libres y se reduce la liberación de enzimas que favorecen la agregación plaquetaria (Meltzer y Malterud, 1997; Craig, 1996). Los compuestos fenólicos también son considerados como reguladores del sistema inmune y como antiinflamatorios, probablemente debido a la modulación del 6 u metabolismo del ácido araquidónico, reduciendo los niveles de tromboxano. También modulan la actividad enzimática de la ciclooxigenasa, lipoxigenasa, fosfolipasa A2, hialuronidasa, e inhiben la acción de la angiotensina convertasa, mieloperoxidasa (que produce el hipoclorito y otros prooxidantes) y xantinooxidasa (que produce los radicales superóxido), entre otras. Dichos efectos les otorgan un amplio potencial para su utilización con fines médicos (Craig, 1996). Son numerosos los estudios que han mostrado que este tipo de compuestos poseen propiedades antioxidantes, inhibiendo la peroxidación lipídica y captando radicales libres como hidroxilo, supéroxido y alcoxi radical (Sichel et al., 1991). Igualmente se han descrito efectos antivíricos, antibacterianos y antifúngicos. Se ha observado in vitro el potencial de la epicatequina como agente antivírico y las antocianidinas pueden inhibir las enzimas que intervienen en la replicación del rhinovirus y del virus de la inmunodeficiencia humana (HIV) (Hocman, 1989). Los efectos beneficiosos de la ingesta de un elevado número de alimentos ricos en compuestos fenólicos como cerveza, fresas, espinacas, vino tinto, etc. se pueden evaluar a corto plazo ya que aumentan la capacidad antioxidante en suero (Cao et al., 1998; Velioglu et al., 1998; Kähkönen et al., 1999), lo que avala el creciente interés por el consumo de alimentos ricos en estos compuestos (Hertog et al., 1995). Desde un punto de vista bioquímico, los compuestos fenólicos también tienen un especial interés debido a su potencial anticarcinógeno, bien estimulando el bombeo de ciertos agentes cancerígenos hacia el exterior de las células o bien mediante la inducción de enzimas de detoxificación (Mazza, 2000). En la bibliografía científica son múltiples las referencias que demuestran que los flavonoides tienen efectos citostáticos en varios sistemas in vitro y que son capaces de regular ciertos procesos importantes en el desarrollo del cáncer. Los flavonoides tienen actividad antipromotora, efecto antiinvasivo, e inhiben enzimas como la tirosina proteinkinasa, la ornitin decarboxilasa ATP-dependiente y la DNA topoisomerasa. Numerosos tra- 7 n o u n o bajos de investigación demuestran que los isoflavonoides de la soja, especialmente la genisteína, pueden tener efecto protector frente a diferentes tipos de cáncer (mama, colon y piel). Este hecho, se ha relacionado con el efecto estrogénico de los isoflavonoides, mediante diferentes mecanismos bioquímicos (Barnes, 1995; Herman et al.,1995). En lo que respecta al lúpulo, existen numerosos estudios sobre su papel en diferentes patologías. Así, según los resultados obtenidos por Milligan (Milligan et al., 2002), se encuentra que la humulona del lúpulo inhibe la resorción ósea, lo que produce una elevada protección frente a la osteoporosis, y posee una pronunciada actividad anti-inflamatoria. La humulona inhibe además la angiogénesis, es decir, reduce la formación de nuevos vasos sanguíneos, proceso clave en la proliferación de tumores, así como en el crecimiento descontrolado de células endoteliales, un marcador de riesgo cardiovascular. 1.1. CERVEZA CON ALCOHOL Y CERVEZA SIN ALCOHOL La cerveza es una bebida de baja graduación alcohólica resultante de fermentar el mosto procedente de la malta (usualmente de cebada, aunque pueden participar minoritariamente otros cereales como el arroz, el trigo y el maíz), sólo o mezclado con otros productos amiláceos transformables en azúcares, por digestión enzimática y su cocción. El mosto de la malta se aromatiza con flores de lúpulo. En conclusión, los constituyentes de la cerveza y su valor nutritivo y no nutritivo provienen de sus tres principales ingredientes: malta, lúpulo y agua. En el caso de la cerveza sin alcohol, por diferentes procedimientos tecnológicos se elimina –habitualmente a partir de cerveza completa- el contenido alcohólico. La cerveza sin alcohol es un producto relativamente nuevo en el mercado que satisface las necesidades adicionales de determinados consumidores que desea- 8 u ban disfrutar de una bebida refrescante como es la cerveza sin contenido alcohólico. La legislación española admite esta denominación siempre que el contenido alcohólico sea inferior al 1% en volumen, aunque en el mercado existen actualmente cervezas de tipo Cero. 1.1.1. CONSUMO DE CERVEZA SIN ALCOHOL EN ESPAÑA El crecimiento de la cerveza sin alcohol en nuestro país aumenta progresivamente cada año y representó en 2006 más del 10% del consumo total de cerveza. España se consolida por tanto como el primer consumidor del mundo de cerveza sin alcohol, a gran distancia de Francia, segundo país del mundo en consumo de cerveza sin alcohol. 1.2. LÚPULO El lúpulo (Humulus lupulus L.) se emplea para aromatizar la cerveza y obtener el característico sabor amargo de la bebida. Pertenece a la familia de las cannabáceas, plantas herbáceas carentes de látex, de flores menudas. Planta medicinal silvestre conocida ya en la Antigüedad, unos 6.000 años a. C., el lúpulo se utiliza desde el siglo IX para la obtención de “lupulino”, empleado en la fabricación de cerveza. El lúpulo, además de contribuir a la estabilidad de la espuma, aromatiza y tiene propiedades antisépticas. Las cervezas lupuladas son más resistentes al deterioro microbiológico. En el Diccionario de la Lengua Española de la Real Academia se define esta materia prima de la cerveza como una planta trepadora, muy común en varias partes de España, de la familia de las cannabáceas, con tallos sarmentosos de tres a 9 n o u n o cinco metros de largo, hojas parecidas a las de la vid, flores masculinas en racimo, y las femeninas en cabezuela, y fruto en forma de piña globosa cuyas escamas cubren dos aquenios rodeados de lupulino. Los frutos, desecados, se emplean para aromatizar y proporcionar el sabor amargo a la cerveza. La planta del lúpulo tiene una serie de brotes, a partir de la cepa, que dan lugar a tallos trepadores o sarmientos, sobre los cuales, en cada nudo, se desarrollan dos hojas opuestas, pecioladas y con tres a siete lóbulos, de una forma que recuerda a los pámpanos de la vid. La vida útil de la planta es de diez a quince años, al cabo de los cuales es conveniente arrancarla y sustituirla por otra nueva. El lúpulo es una planta dioica, por lo que las flores masculinas y femeninas se producen en distintos pies. Generalmente, los productores de lúpulo sólo cultivan las plantas hembras. Las flores femeninas se agrupan en conos o piñas, formando verdaderos racimos. En la base de las escamas que forman los conos se encuentra la lupulina, una sustancia amarillenta y amarga que contiene resinas, aceites esenciales y taninos utilizados en la industria cervecera. La lupulina se emplea también para usos médicos e industriales, aunque su función principal es aromatizar la cerveza. Este producto, de aspecto y tacto de polvo, algo grasiento, tiene un aroma Humulus lupulus, reproducción de una lámina del Herborarium Blackwellianum de 1739 10 u característico, más o menos intenso y fino, al igual que los perfumes que combinan intensidad y finura de aroma. El lúpulo florece en verano, y los conos se cogen entre finales de agosto y primeros de septiembre. 1.2.1. USOS TRADICIONALES Tradicionalmente, el lúpulo se ha usado como hipnótico, sedante y diurético (FontQuer, 1983). En la Inglaterra medieval, se rellenaban las almohadas con conos de la planta como remedio contra el insomnio. Santa Hildegarda, le atribuía virtudes contra la “bilis negra” o melancolía. Sin embargo, en la medicina antigua se ignoraba su utilidad (no lo citan ni Galeno ni Dioscórides) aunque Plinio se refiere brevemente a ella considerándola una planta alimenticia (cuyo nombre era lupus). En algunas comarcas españolas, los vástagos tiernos se han consumido de forma similar a la de los espárragos. En 1516 el duque bávaro Guillermo IV aprobó la famosa "Reinheitsgebot" o "Ley de pureza" de la cerveza, que limitaba los ingredientes permitidos en su elaboración a tres: cebada (o trigo), lúpulo y agua. Esta ley continua aún vigente, con escasas modificaciones, en toda Alemania; lo que nos da una idea de la importancia del lúpulo en la elaboración de la cerveza desde hace siglos. 1.2.2. USO INDUSTRIAL DEL LÚPULO Inicialmente, se utilizó el lúpulo silvestre para la cervecería, pero su baja calidad y el volumen de esta industria conllevaron el comienzo del cultivo en España. A estos efectos, el primer intento serio se realizó en La Coruña a principios del siglo XX. Sin embargo, durante la posguerra española, y coincidiendo con la II Guerra Mundial, las fábricas de cerveza tuvieron grandes problemas de abastecimiento de lúpulo, 11 n o u n o debido a la práctica paralización de las importaciones. En consecuencia, el gobierno español promulgó el 23 de mayo de 1945 un decreto por el que se prevé el fomento del cultivo a través de una concesión administrativa que recae en la Sociedad Anónima Española de Fomento del Lúpulo, constituida por casi todas las fábricas de cerveza que existían en ese momento en el país. 1.2.3. EL LÚPULO EN LA PRODUCCIÓN CERVECERA En el lúpulo se han identificado más de 1.000 sustancias entre las que se encuentran múltiples derivados isoméricos (Verzele y Keukeleire, 1991). Todas ellas aportan al lúpulo sus peculiares características que lo convierten en insustituible para la fabricación de la cerveza. Son las resinas, almacenadas en glándulas de lupulina presentes en varias partes de la planta, pero fundamentalmente en los frutos producidos a partir de las flores femeninas. Estas resinas se clasifican en función de su diferente solubilidad y son una mezcla de compuestos químicos análogos que son los precursores de los alfa y beta ácidos, los cuales al cocer con el mosto se isomerizan y se transforman en sustancias amargas. El contenido de estos alfa y beta ácidos (medido como porcentaje en peso) es una característica varietal, si bien pueden verse influidos de una manera importante por la climatología y otros factores. Otros constituyentes importantes son los aceites esenciales (humuleno, farneseno, mirceno, etc.) y los taninos. Los primeros confieren al lúpulo su aroma característico. Tradicionalmente se ha hablado de variedades aromáticas y de variedades amargas, precisamente en función del nivel de alfa ácidos y de aceites esenciales. 1.2.4. COMPONENTES DEL LÚPULO Las flores de la planta del lúpulo (también llamadas conos o piñas) contienen en su interior unas glándulas de color amarillo. Estas glándulas están llenas de una 12 u resina llamada lupulina, que es el principio activo que los cerveceros buscan en el lúpulo. La lupulina aporta: 1.2.4.1. COMPONENTES AMARGOS Los ácidos amargos representan entre el 5% y el 20% aproximadamente del peso del lúpulo maduro según su variedad (Verzele y Keukeleire, 1991). Estos ácidos se clasifican como alfa ácidos y beta ácidos y son derivados del floroglucinol di o triprenilados. Los alfa ácidos se extraen tras la adición de acetato de plomo al extracto crudo, mientras que los beta ácidos permanecen en solución. La calidad del lúpulo viene marcada sobre todo por los alfa ácidos, especialmente por la humulona (35-70% del total de alfa ácidos), la cohumulona (del 20-65%) y la adhumulona (del 10-15%). Los alfa ácidos están presentes en la cerveza en concentraciones de hasta los 4 mg/ml contribuyendo en la misma a la estabilidad de la espuma y aportando sus características antibacterianas y, por lo tanto, de mejora de la conservación. El amargor del lúpulo proporciona el contrapunto adecuado al dulzor de la malta y este sabor amargo se extrae durante la cocción. En ella, los alfa ácidos insolubles se isomerizan en ácidos iso-alfa más solubles que, en la cerveza representan más del 80% de los componentes del lúpulo presentes en la misma. Se han conseguido aislar en el laboratorio cinco alfa ácidos que están presentes en el lúpulo de forma natural, en diferentes proporciones que varían como hemos dicho según la variedad: ■ humulona ■ cohumulona ■ adhumulona ■ prehumulona ■ posthumulona 13 n o u n o Además de alfa ácidos, el lúpulo también contiene beta ácidos, los cuales también añaden amargor a la cerveza cuando se oxidan. Sin embargo, los ácidos beta oxidados no son tan amargos como los ácidos alfa isomerizados y contribuyen mucho menos al amargor final de la cerveza. Los alfa ácidos son muy susceptibles a la oxidación (sobre todo a temperaturas elevadas) y cuando esto ocurre ya no pueden ser isomerizados en ácidos iso-alfa, lo cual merma significativamente su capacidad de amargor. Esta es una característica que hace que su almacenamiento y conservación sean muy delicados. Los cerveceros deben tener esto muy en cuenta y, por ello, tratan de conseguir lúpulos lo más frescos posibles y de guardarlos en frío y en condiciones anaeróbicas. 1.2.4.2. COMPONENTES AROMÁTICOS Los investigadores no han sido capaces, hasta ahora, de reproducir la complejidad de aromas del lúpulo añadiendo componentes químicos sintéticos. Ni tampoco utilizando otro tipo de plantas o especias. Existe un consenso generalizado sobre que son las sinergias que se producen entre los distintos componentes del lúpulo las que le confieren su inimitable capacidad aromatizante. Mediante técnicas cromatográficas se han conseguido identificar más de 250 aceites esenciales y todavía existen otros muchos aún desconocidos. 1.2.4.3. ACEITES ESENCIALES Son extremadamente volátiles y son una razón más para conservar el lúpulo en algún medio anaeróbico, como en recipientes al vacío o en atmósferas modificadas de CO2 o nitrógeno. Tampoco soportan una cocción dilatada. Es por ello que los lúpulos aromáticos se suelen añadir en los últimos minutos de cocción, mientras que los lúpulos amargos se añaden antes para facilitar la isomerización de los áci- 14 u dos alfa. El aceite esencial de lúpulo contiene alkanos, monoterpenos y sesquiterpenos, habiéndose detectado (Eri et al., 2000) doscientas ochenta y seis distintas sustancias en su aceite, más de cien de las cuales ni siquiera han podido ser identificadas actualmente. Como constituyentes volátiles, se han identificado claramente al monoterpeno myrceno y a los sesquiterpenos beta-cariofileno y al humuleno, quienes representan entre el 57-82% del aceite esencial. Este aceite no parece ejercer un papel fitoestrogénico. 1.2.4.4. FLAVONOIDES PRENILADOS Son una mezcla de chalconas, de las que hasta la fecha se han aislado treinta especies, secretadas por las glándulas lupulínicas junto con los ácidos amargos y los aceites volátiles (Milligan et al., 1999). Tienen efecto fitoestrogénico. La chalcona xantohumol es el más abundante flavonoide prenilado en el producto en fresco y en el lúpulo comercial, alcanzando concentraciones de 0.01-0.5% (Stevens et al., 1999). El estrógeno vegetal más potente hoy conocido como 8-prenilnaringenina corresponde con el 1:1 racemato (+)-8-prenilnaringenina o hopeína (según la terminología de Keukeleire et al., 2001). 15 n o d o s RADICALES LIBRES Y ESTRÉS OXIDATIVO 2.1. EL OXÍGENO Y EL DAÑO OXIDATIVO El conocimiento de los efectos biológicos de las especies oxigénicas reactivas corre paralelo al estudio del metabolismo energético de los seres vivos, proceso en el que la presencia de oxígeno es imprescindible. En efecto, hoy sabemos que el oxígeno (uno de los elementos gaseosos más abundantes de la naturaleza) se presenta en forma de gas diatómico. El oxígeno molecular, a pesar de contener un número par de electrones, se presenta como una molécula paramagnética donde dos de sus electrones están localizados en orbitales diferentes y girando en un mismo sentido con espines paralelos. Esto tiene un gran interés en relación con su mecanismo de acción molecular y, especialmente, con su papel oxidativo. Tal vez una de las primeras referencias sobre la toxicidad del oxígeno se la debemos a Lavoisier, quien en 1785 ya sugirió que el exceso de la administración de oxígeno podría ser tan peligroso como su defecto. Más tarde, en el siglo XVIII, se descubrieron otros productos derivados del oxígeno como el H2O2 y el ozono (Bannister, 1986). 2.1.1. EVOLUCIÓN Y OXIDACIÓN La importancia evolutiva del oxígeno fue señalada por Irvin Fridovich en 1978, descubridor de la SOD, quien atribuía a la presencia de oxígeno en la tierra la desaparición de especies orgánicas incapaces de metabolizar y defenderse contra las acciones de aquella molécula y, más concretamente, contra la acción de las especies oxigénicas producidas mediante su oxidación monovalente (Fridovich, 1974). De este modo, sólo aquellos organismos capaces de desarrollar mecanismos enzimáticos reactivos derivados fueron adaptándose paulatinamente a la progresiva oxigenación de la atmósfera. De cualquier forma, independientemente de las teorías evolutivas y sus mecanismos de selección, es evidente que el oxígeno fue seleccionado por la 16 d naturaleza para actuar como aceptor terminal de las oxidaciones celulares, desempeñando así, una función clave en su reacción con la citocromo oxidasa, representando el último eslabón de la cadena de transporte electrónico. Gracias a este mecanismo se produce más del 90% del oxígeno consumido por las células de los animales superiores. Un átomo de oxígeno individual puede adquirir dos electrones para completar los ocho y convertirse en un ión óxido. También pueden unirse dos átomos de oxígeno para compartir un par de electrones cada uno, formándose así la molécula de oxígeno diatómico. Finalmente, si una molécula de oxígeno adquiere un electrón extra en el curso de una reacción, se transforma en otra especie paramagnética y mono. rradical cargada negativamente que se conoce como anión superóxido (O -). Éste 2 es uno de los radicales libres o especies reactivas más importantes en gran parte responsable de la toxicidad del oxígeno. Gracias a los experimentos de Fridovich, el radical superóxido alcanza un enorme interés en el campo de la bioquímica (Fridovich y Handler, 1961) al demostrarse su producción por enzimas celulares tales como la xantina oxidasa y, adicionalmente, al descubrirse la existencia de la enzima superóxido dismutasa (SOD), capaz de transformar el ión superóxido en un producto de menor reactividad como es el H2O2, que a su vez es reducido a agua y oxígeno por la acción de otras enzimas. A partir de ese momento, estas especies (y otras que se irían descubriendo posteriormente) irían cobrando un papel protagonista en la explicación de los mecanismos de acción citotóxica del oxígeno mediante el estrés oxidativo. 2.2. LOS RADICALES LIBRES Son especies moleculares activadas, dotadas de un electrón desapareado en un nivel energético superior y, por lo tanto, dotadas de propiedades paramagnéticas, lo que 17 o s d o s les confiere una alta e indiscriminada reactividad. Actualmente los radicales libres (RL) también son conocidos como especies reactivas oxigénicas, EROs o ROS, así como especies reactivas del nitrógeno ERN o RNS. Cuando se combinan radicales libres procedentes del oxígeno y del nitrógeno se pueden convertir en otras especies reactivas no radicales también llamados ROM (Reactives Oxygen Metabolites) o metabolitos reactivos del oxígeno o AO (Active Oxygen). Las especies oxigénicas reactivas más destacadas se encuentran reflejadas en la Tabla 1: Tabla 1. Resumen de las Especies Reactivas Radicales No Radicales . ROS O EROs Superóxido (O2- ) . Hidroxilo ( OH) Peroxilo (RO2) . Alkoxilo (RO ) Hidroperóxilo (HO2) Peróxido de hidrógeno (H2O2) Ácido hipocloroso (HOCI) Ozono (O3) Oxígeno singlete (1O3) RNS O ERN Óxido nítrico (NO) Dióxido nítrico (NO2) Ácido nitroso (HNO2) Tetróxido de dinitrógeno (N2O4) Trióxido de dinitrógeno (N2O3) Peroxinitrito (ONOO-) Ácido peroxinitroso (ONOOH) Catión nitronio (NO2+) Peroxinitritos alkilos (ROONO) Tanto ROS como RNS son términos genéricos (Halliwell, 1996) que incluyen radicales y algunos no radicales que actuan como agentes oxidantes del oxígeno y del nitrógeno, pudiendo convertirse fácilmente en radicales. Hay que añadir que algunas de estas sustancias pueden clasificarse en ambas categorías y que, además, existen las denominadas especies reactivas del cloro. El término “reactivo” tal vez no sea un término del todo apropiado, ya que hay radicales y no radicales como H2O2, que pueden reaccionar con otras especies y formar otras mucho más reacti. vas como el OH que presenta una alta reactividad. 18 d 2.2.1. CARACTERÍSTICAS BÁSICAS Son muchas las especies oxígenas que actúan como oxidantes biológicos. La capacidad de cada radical (RL) o especie oxigénica reactiva viene determinada, desde el punto de vista químico, por cuatro características básicas: ■ Reactividad ■ Especificidad ■ Selectividad ■ Difusibilidad . El O2 - es la sustancia reductora más potente. Tras la simple adición de un . protón, da lugar a la formación de HO2 - convirtiéndose en un agente oxidante . muy activo, selectivo y específico. El O2 - no es, sin embargo, especialmente reactivo con lípidos, glúcidos o ácidos nucleicos y exhibe una reactividad limi. tada con determinadas proteínas. Sin embargo, el O - sí reacciona con proteí2 nas que contienen metales en su grupo prostético. . El OH , sin embargo, reacciona con cualquier molécula que tenga cerca, sin especificidad alguna. El peligro de su efecto radica, por lo tanto, en la importancia funcional del compartimento celular en el que se origina, así como en la molécula a la que ataca. De este modo, si afectase al ADN podría producir graves efectos. Por el contrario, si la producción del radical tiene lugar en un entorno como el plasma y la molécula dañada es un enzima que se encuentra presente en gran cantidad, el daño biológico real será prácticamente imperceptible. Los . . tres componentes con mayor capacidad de difusión son O - < H O < OH , capa2 2 2 ces de reaccionar con moléculas que se encuentran alejadas de su lugar de origen, incluso contando con capacidad de atravesar las membranas celulares (Figura 1). 19 o s d o s Figura 1. Reactividad de especies oxigénicas . O2 - + H+ + e. . O2 - + HO2 . HO2 + HO2 + H+ . . O2 - + O2 - + H+ . O2 - + H2O2 HO2 H2O2 + O2 H2O2 + O2 H2O2 + O2 . OH + OH- + O2 La producción de los radicales libres tiene que ser controlada continuamente y mantenida a muy bajas concentraciones por parte de los distintos mecanismos disponibles por las células obligadas a desarrollarse en ambientes aeróbicos. Por esta razón, las especies oxigénicas se producen en ambientes suficientemente circunscritos para impedir su difusión o, en su defecto, controlados por la acción de enzimas defensivas sintetizadas por las células aeróbicas encargadas de su rápida conversión en especies más estables o inofensivas. 2.3. ORIGEN DE LOS RADICALES LIBRES Se sabe que los radicales libres se producen de forma natural como intermediarios o productos de numerosas reacciones oxidativas de las células, así como a través de diversos procesos físico-químicos o de biotransformación (Pryor, 1976). También existen fuentes externas. Es decir, se ha de considerar el origen tanto endógeno como exógeno de las especies reactivas oxigénicas y especies reactivas del nitrógeno. Las EROs pueden producirse a través de la exposición a oxidantes medioambientales, tóxicos y metales pesados, que pueden perturbar el equilibrio entre las reacciones de reducción celular y las de oxidación, alterando la normalidad de las funciones biológicas. 20 d 2.3.1. FUENTES ENDÓGENAS Las principales fuentes endógenas de radicales libres en la célula son: ■ La cadena de transporte electrónico. ■ El transporte electrónico microsomal (reacciones de hidroxilación). ■ Las células fagocitarias. ■ La autooxidación de compuestos de carbono reducido. ■ La activación calatalítica de diversos enzimas del metabolismo intermediario: hipoxantina, xantina oxidasa, aldehído oxidasa, monoamina oxidasa, ciclooxigenasa y lipooxigenasa (Beckman y Ames, 1998; Lindsay y Astley, 2002). 2.3.2. FUENTES EXÓGENAS Como se ha citado con anterioridad, los EROs también pueden tener un origen exógeno. Estas fuentes exógenas pueden ser: ■ Ambientales Radiaciones electromagnéticas, luz solar, ozono y tabaco. Los radicales libres se pueden producir en respuesta a radiaciones electromagnéticas, como los rayos gamma, que pueden escindir el agua y producir radicales hidroxilo (Hallywell, 1996; Betteridge, 2000). Los óxidos de nitrógeno presentes en el humo de los cigarrillos, causan la oxidación de las macromoléculas así como la reducción de 21 o s d o s los niveles orgánicos de antioxidantes, lo que contribuye a la aparición de diferentes patologías en el fumador como ciertos tipos de cáncer, especialmente el de pulmón (Ames et al., 1990; Halliwell, 1994; Betteridge, 2000; Muñiz et al., 2001). ■ Farmacológicas Xenobióticos, drogas, etc. (Valls et al., 1994 ; Valls et al., 2004). Éste es el caso de las antraciclinas, que interaccionan con el complejo I de la cadena de transporte electrónico e inducen la formación de radicales libres. ■ Nutricionales Contaminantes, aditivos, etc. Las sales de hierro y de cobre promueven la formación de radicales libres generando H2O2 (reacciones de Fenton). Cuando un individuo absorbe una cantidad significativa de hierro de la dieta debido a un defecto genético (especialmente si se trata de hierro hemo), esto se convierte en un factor de riesgo adicional para contraer enfermedades cardiovasculares así como ciertos tipos de cáncer en hombres sanos (Ames, 1990). 2.4. DAÑO OXIDATIVO A LAS BIOMOLÉCULAS Aunque las EROs se han considerado perjudiciales para la célula, pueden sin embargo haber jugado un papel importante en el origen de la vida y en la evolución biológica. En los últimos años, se ha reconocido el papel de las EROs en la modulación de la expresión génica. De hecho, no es sencillo catalogar a las EROs como moléculas definitivamente beneficiosas o dañinas, dependiendo su efecto del proceso 22 d celular que se analice. Por ejemplo, la muerte celular por necrosis, seguida de isquemia-reperfusión, daña a los tejidos; en este proceso, se cataloga a las EROs como perjudiciales, mientras que en la muerte celular por apoptosis, este punto de vista puede variar dependiendo del sistema celular y del proceso que se esté estudiando. Por otro lado, el papel de las EROs en los procesos de inflamación también puede ser ambivalente, habiéndose calificado como beneficiosos en el aspecto proinflamatorio, ya que proporcionan una mejora en la respuesta inmune tras la infección, pero en otros trastornos, como la artritis reumatoide, la respuesta inflamatoria inapropiada generada por ellos es claramente perjudicial y debe ser restringida. En conclusión, las especies reactivas del oxígeno juegan un papel importante en la modulación de la expresión genética y de la función celular, pudiendo utilizar estos cambios como biomarcadores del estrés oxidativo. Las EROs pueden causar oxidación a biomoléculas como los lípidos poliinsaturados, las moléculas de colesterol, los glúcidos, proteínas y ácidos nucleicos que pueden verse afectadas in vivo por los radicales libres. 2.5. PROCESOS FISIOPATOLÓGICOS RELACIONADOS CON LOS RADICALES LIBRES En la actualidad, son muchos los procesos relacionados con la producción de radicales libres, tales como mutagénesis, transformación celular, cáncer, diabetes, aterosclerosis, infarto de miocardio, procesos de isquemia/reperfusión, enfermedad del neonato (retinopatía neonatal), enfermedades inflamatorias (artritis reumatoide, lupus), desórdenes en el sistema nervioso central (enfermedad de Parkinson, enfermedad de Alzheimer), envejecimiento, etc. En numerosas patologías, se han observado niveles reducidos de las enzimas antioxidantes, o bien de antioxidantes totales. 23 o s d o s 2.5.1. ESTRÉS OXIDATIVO Y PATOLOGÍA CARDIOVASCULAR Las enfermedades cardiovasculares constituyen la primera causa de morbimortalidad en los países desarrollados. En el 2020, según datos de la Organización Mundial de la Salud (OMS), será la primera causa de mortalidad en el mundo. La patología cardiovascular es un proceso multifactorial donde están implicados la obesidad, diabetes, hipertensión, genética, dislipemia, radicales libres, estilo de vida (nutrición, tabaquismo, sedentarismo, etc.), etc., siendo la hiperlipemia uno de los mayores riesgos en los procesos ateroscleróticos. La aterosclerosis es un proceso muy complejo en el que están implicadas las LDL y la proliferación celular en el endotelio (Celermajer et al., 1992). 2.5.1.1. HIPÓTESIS DE LA ATEROSCLEROSIS Existen diferentes hipótesis para explicar los procesos asociados al desarrollo de la aterosclerosis: a) Respuesta al daño. Esta hipótesis se basa en la propuesta de que el paso inicial sería la disfunción endotelial produciendo un número de respuestas compensatorias que alteran las propiedades homeostáticas vasculares normales. Sin embargo, más recientemente se ha visto que una pared celular endotelial intacta puede desarrollar lesiones ateroscleróticas. b) Respuesta a la retención de LDL. Se basa en un aumento en la retención de la LDL dentro de la pared arterial y su asociación con los proteoglicanos. Junto a la unión a proteoglicanos parece jugar un papel importante las enzimas lipolíticas y liposomales en la matriz extracelular. 24 d c) Modificación oxidativa. Se basa en que la LDL atrapada en el espacio subendotelial, es susceptible a la modificación oxidativa. La LDL oxidada estimula la quimiotasis monocítica y favorece la formación de células espumosas a partir de los macrófagos. Una vez formada, la LDL oxidada también provoca la disfunción endotelial y el daño celular. Las células espumosas tienden a la necrosis debido a la estimulación de LDL oxidada originando fibrosis posterior (placa fibrosa), y favoreciendo la trombosis a consecuencia de la agregación plaquetaria y del incremento de citoquinas proinflamatorias (Steinberg et al., 1989) (Figura 2 y 3). Figura 2. Oxidación de las LDL LDL nativas Monocitos circulantes Células endoteliales Macrófago LDL modificadas mediante oxidación Célula espumosa Steinberg et al. N Engl J Med, 1989;320:915-24 En la actualidad, existen muchas evidencias que indican que en el proceso de iniciación de la aterosclerosis están implicados los radicales libres, la peroxidación lipídica y la modificación oxidativa de las LDL (Spiteller, 2005; Zmijewski et al., 2005), dando mayor validez a la última hipótesis descrita. 25 o s d o s 2.5.1.2. OXIDACIÓN DE LAS LDL En las lesiones ateroscleróticas se ha observado la existencia de diferentes modificaciones oxidativas que tienen lugar sobre la lipoproteína, además de la producción de especies reactivas del oxígeno y del nitrógeno por las células vasculares. Por ello, la aterosclerosis se ha representado como un estado de elevado estrés oxidativo caracterizado por la oxidación lipídica y proteica en la pared vascular. Así pues, recientes estudios han establecido la presencia de lípidos oxidados (Carpenter et al., 1994; Heinecke, 2006) en dichas lesiones, como consecuencia de la oxidación lipídica, obteniéndose productos como peróxidos, hidroperóxidos, epóxidos, etc. Del mismo modo, cuando las especies reactivas actúan sobre las moléculas de colesterol producen hidroperóxidos de colesterol y oxisteroles. Además, existen evidencias de la oxidación proteica en tales lesiones (Fu et al., 1998; Heinecke, 1999; Heinecke, 2002). Se ha visto que la aterosclerosis y sus consecuencias anatomopatológicas vasculares, se acentúan con el estrés oxidativo. En los supuestos en que estos fenómenos de oxidación acontecen sobre las lipoproteínas plasmáticas (LDL), éstas aumentan significativamente su poder aterogénico, provocando que la LDL oxidada sea responsable de una serie de efectos como los que se describen a continuación: • Es captada con mayor facilidad por los macrófagos, lo que produce el enriquecimiento de éstos en ésteres de colesterol y la formación de células espumosas. • Es quimiotáctica para los monocitos y los T-linfocitos. • Inhibe la motilidad de los macrófagos en la pared arterial. • Altera la expresión génica, induciendo la producción de citokinas. 26 d • Induce la proliferación de células musculares lisas. • Es inmunogénica y puede provocar la formación de autoanticuerpos. • Es más susceptible a la agregación, lo que estimula la captación por parte de los macrófagos. • Puede alterar de forma perjudicial los procesos de coagulación, como es el caso de la alteración de la agregación plaquetaria. 2.5.1.3. PROGRESIÓN DE LA ATEROSCLEROSIS La progresión de la aterosclerosis se puede caracterizar en 6 tipos de lesiones, que reflejan las fases de inicio, desarrollo y maduración de la enfermedad, que culminaría en la ruptura de la placa de ateroma y la formación de trombos. Los diferentes tipos son: • Tipo I: Zona propensa a lesión, engrosamiento adaptativo de la intima. • Tipo II: Acumulación de lípidos en el macrófago formándose unas áreas nodulares de deposición de lípidos y dan lugar a células espumosas. • Tipo III: La formación continuada de células espumosas y necrosis de macrófagos produce este tipo de lesiones que contienen pequeños depósitos de lípidos extracelulares. Esto representaría el núcleo de la lesión aterosclerótica. • Tipo IV: Se caracteriza por una separación tisular fina del núcleo de lípidos del lumen arterial. 27 o s d o s • Tipo V: Las lesiones muestran tejido fibroso, apareciendo un núcleo cubierto por cápsula fibrosa. • Tipo VI: Se caracteriza por áreas fibrosas calcificadas con visible fisura o rotura de la placa. Finalmente, se produciría la formación de un trombo, que no suele ocluir completamente la arteria, produciéndose una lesión más fibrosa y estenosante. Las lesiones, posteriormente, siguen evolucionando con las consiguientes consecuencias cardiovasculares (Figura 3). Figura 3. Esquema de la progresión de la aterosclerosis Tipo I (zona propensa a la lesión) Tipo II Tipo III (Preateroma) ROS LDL Monocitos Macrófago Media Célula espumosa Tipo IV (Ateroma) Núcleo de lípidos extracelulares 28 Íntima Macrófagos Células espumosas Tipo V (Ateroma fibroso) Tejido fibroso Pequeños depósitos de lípidos extracelulares Tipo VI (Complicaciones de la lesión) Fisura y hematomas Trombos d 2.5.2. ESTRÉS OXIDATIVO Y PROCESOS DE INFLAMACIÓN Desde tiempo atrás se ha manifestado un creciente interés por conocer el papel exacto que los procesos oxidantes juegan en la patogénesis de la inflamación, la artritis reumatoide, el asma, la psoriasis y la dermatitis de contacto entre otras enfermedades (Geronikaki y Gavalas, 2006), todas ellas con un posible vínculo común con el estrés oxidativo. El conjunto de procesos asociados con la respuesta inflamatoria es muy complejo (Geronikaki y Gavalas, 2006) y a menudo conlleva la implicación de las especies oxigénicas reactivas. Se han descrito numerosos mediadores que podrían amplificar la respuesta inflamatoria, como es el caso de la histamina, la serotonina, las citoquinas y el factor de necrosis tumoral. La inflamación juega, en efecto, un papel importante en el desarrollo de numerosas patologías, entre las que podemos citar la diabetes tipo II, así como sus patologías asociadas como la obesidad (Browning y Jebb, 2006). De hecho, la relación entre inflamación, diabetes y dieta ha sido verificada en diferentes estudios realizados tanto en animales como en personas. Así, los marcadores sanguíneos de inflamación, como es el caso de la proteína C reactiva (PCR) y de la interleukina-6, se consideran, a menudo, parámetros predictivos de la diabetes. Un caso específico, que nos ilustrará lo complicado de estos procesos, lo constituye la inflamación prostática que, como sabemos, puede contribuir a la aparición de cáncer en esta glándula, riesgo que disminuye tras la ingestión de drogas antiinflamatorias y de sustancias antioxidantes (Sugar, 2006). Según algunos autores, los antioxidantes podrían reducir la inflamación de las vías aéreas y la reactividad aumentada que existe en los asmáticos (Park y Lee, 2006; Lee et al., 2006). Así, en algunos trabajos se ha demostrado cómo los antioxidantes pueden reducir la expresión de ciertos tipos de citoquinas (interleukina IL-18) en estos procesos asmáticos, inhibiendo la actividad de NF-kappa B, lo que 29 o s d o s sugiere que las especies oxigénicas reactivas podrían regular la expresión de interleukinas (Lee et al., 2006). Existe, desde luego, un interés creciente sobre el papel de los antioxidantes en el control de otras enfermedades con una base inflamatoria, como por ejemplo la alergia. Según se cree, el estatus antioxidante del individuo, está asociado con una respuesta inmune aumentada aunque no hay evidencia de que a niveles más elevados de antioxidantes esté asociada una menor respuesta a los alergenos (Dunstan et al., 2006). La posible acción de los antioxidantes sobre la función inmune también ha despertado el interés de los investigadores sobre su posible efecto en patologías ligadas a alteraciones inmunológicas como podría ser el caso de la esclerosis múltiple (Carlson y Rose, 2006). A este respecto, se han propuesto numerosas sustancias nutritivas con un posible papel modulador de la inflamación y, por lo tanto, del impacto global de ciertas patologías, como la diabetes, sobre el paciente. Asimismo, conocemos factores de la dieta como el ácido oleico, el ácido linolénico y otros antioxidantes (Basu et al., 2006), y su capacidad reductora de los marcadores de inflamación. En esta misma línea, ciertos hallazgos sugieren que la vitamina C tienen efectos antiinflamatorios, estando asociada con una menor disfunción endotelial en varones que no tenían un historial previo de diabetes o de enfermedades cardiovasculares (Wannamethee et al., 2006) o que la quercetina y otros polifenoles antioxidantes tienen una relación directa con la disminución de la inflamación, efecto que estaría mediado por la inhibición de las citoquinas proinflamatorias como el factor de necrosis tumoral (Nair et al., 2006). De este modo, las estrategias dietéticas que se han señalado corrientemente como dieta equilibrada (ingestión adecuada de ácidos grasos omega-3, reducción de grasa saturada y de ácidos grasos trans y, en paralelo, un consumo elevado de frutas, hortalizas, frutos secos y cereales integrales), pueden asociarse con una disminución de la inflamación (Guigliano et al., 2006). En cualquier caso, es evi- 30 d dente que son necesarios estudios adicionales para poder cuantificar el papel preciso de cada una de las diferentes sustancias implicadas en estos procesos. 2.5.3. INFLAMACIÓN Y ATEROSCLEROSIS La inflamación juega un papel fundamental en todas las fases de la enfermedad aterosclerótica. El papel clave de la oxidación, que liga lípidos e inflamación a la aterosclerosis, es convincente y apoyado por numerosas evidencias experimentales (Tardif, 2006; Basu et al., 2006). Como conocemos, los factores de riesgo cardiovascular y el síndrome metabólico están tipificados por un cierto grado de inflamación. Adicionalmente, la reducción de peso hace menores (Basu et al., 2006) los marcadores de inflamación (por ejemplo la proteína C reactiva y la interleukina-6). El conocimiento cada vez más profundo de las implicaciones metabólicas y del papel que ejercen sustancias como las lipoproteínas, nos ha permitido un acercamiento más eficaz a las distintas posibilidades preventivas. Así, era perfectamente conocido cómo, en grandes poblaciones, los niveles de HDL colesterol estaban inversamente relacionados con el riesgo de padecer enfermedades cardiovasculares (Navab et al., 2006); sin embargo, el valor predictivo de estas cifras para un individuo concreto estaba lejos de ser perfecto. En consecuencia, se han investigado otros factores asociados a las HDL, entre los que se incluyen ciertos componentes de estas mismas lipoproteínas. Las HDL son realmente heterogéneas y contienen diferentes sustancias antioxidantes y prooxidantes, lo cual lógicamente repercute en su misma función. Así, diferentes estudios han indicado distintos papeles para las HDL como serían la capacidad de promover el transporte de colesterol y modular la inflamación sistémica. En ausencia de inflamación, las HDL interactuarían con las enzimas antioxidantes para mantener el estatus antiinflamatorio. 31 o s d o s En presencia de inflamación sistémica, estas enzimas antioxidantes pueden verse inactivadas y las HDL podrían acumular lípidos oxidados y proteínas que las convertirían en proinflamatorias. En estas condiciones, la principal proteína de la HDL, la apolipoproteína A-I, puede verse modificada a merced de la acción de las especies oxigénicas reactivas. Esta modificación inhabilita la capacidad de las HDL de vehicular el flujo de colesterol. En consecuencia, la medida de la calidad y de las funciones de las HDL-c puede proporcionar una mejor identificación de aquellas personas con un riesgo aumentado de enfermedad cardiovascular. 2.5.4. RELACIÓN ENTRE ENVEJECIMIENTO E INFLAMACIÓN Y PROCESOS CARDIOVASCULARES El envejecimiento es consustancial al ser humano y, sin embargo, aún son poco conocidos los complejos mecanismos por los que se produce. Se han elaborado al respecto diversas teorías que intentan explicar los mecanismos involucrados en el proceso de envejecer, siendo una de las más aceptadas la teoría de los radicales libres o del estrés oxidativo. Se basa en un fenómeno común que se produce en nuestras células ante la presencia de oxígeno, lo que conlleva reacciones de oxidación que, a su vez, están en el origen de los llamados radicales libres. La consecuencia es que estos agentes oxidantes producen deterioro celular, lo que se traduce en una mayor incidencia de diabetes, alteraciones cardiovasculares, cánceres, etc. Este problema es creciente en una sociedad como la nuestra donde la esperanza de vida es cada vez mayor y, por lo tanto, la trascendencia no sólo sanitaria, sino también económica, de las patologías ligadas al envejecimiento es enorme. Además de las grandes causas de mortalidad ya citadas, otras muchas patologías pueden tener su origen, o su mecanismo iniciador, en un desequilibrio en el estatus antioxidante del sujeto: cataratas, enfermedades neurodege- 32 d nerativas, patologías visuales, etc. Dado que uno de los mecanismos más sencillos y accesibles para mejorar nuestra defensa antioxidante es seguir una dieta adecuada, parece lógico seguir profundizando en el conocimiento de aquellas sustancias presentes en los alimentos que puedan beneficiarnos en este sentido. Teóricamente, unos estilos de vida saludables donde se incorporen unos hábitos dietéticos correctos podrían beneficiar nuestra longevidad y la calidad de vida de estos años vividos. Atendiendo a los datos citados con anterioridad, es comprensible que algunos autores sugieran que la mejora de la función leucocitaria y la restauración del balance redox tras el consumo de niveles adecuados de antioxidantes en adultos, pudiera ser útil para conseguir un envejecimiento más saludable (Alvarado et al., 2006). En cualquier caso, y como conclusión, es evidente que se necesitan investigaciones adicionales para definir el papel de los factores dietéticos sobre los marcadores de inflamación (Basu et al., 2006). 2.6. SISTEMAS DE DEFENSA ANTE EL ESTRÉS OXIDATIVO Frente a la acción tóxica de los radicales libres, los organismos han desarrollado mecanismos de defensa que permiten su eliminación o transformación en moléculas estables (Davies, 1995). Todos los sistemas biológicos están en un estado de equilibrio aproximado entre las fuerzas prooxidantes y la capacidad antioxidante (Sies, 1985), siendo el desequilibrio a favor de la acción prooxidante lo que se conoce como estrés oxidativo. De hecho, el daño oxidativo solamente se produce cuando los mecanismos oxidantes superan la capacidad de los sistemas de defensa. Por lo tanto, la supervivencia de las células aeróbicas precisa de mecanismos que contrarresten los efectos negativos de los radicales libres, permitiendo, los sistemas antio- 33 o s d o s xidantes, el mantenimiento de un balance favorable entre los productos deletéreos y los antioxidantes celulares. Según Halliwell y Gutteridge (1989), antioxidante es cualquier sustancia que en presencia del sustrato oxidable retrasa considerablemente o inhibe la oxidación de tal sustrato. Un buen antioxidante se caracteriza por su alta efectividad, su variabilidad operativa y su versatilidad para combinarse con una importante variedad de especies oxígenas reactivas. Así pues, entre los sistemas antioxidantes cabe destacar: a) A nivel fisiológico: El sistema microvascular, cuya función es mantener los niveles tisulares de O2, siempre dentro de presiones parciales relativamente bajas. b) A nivel bioquímico: La defensa antioxidante puede ser enzimática y no enzimática. 2.6.1. SISTEMA ENZIMÁTICO ANTIOXIDANTE El principal sistema de defensa contra los radicales libres lo constituyen proteínas antioxidantes enzimáticas (Figura 4) que incluyen la enzima superóxido dismutasa (SOD), la catalasa (CAT) y la glutation peroxidasa (GPx), (Betteridge, 2000). La eficacia de esta tríada enzimática reside en una triple acción defensiva al disminuir la producción de estas especies oxigénicas e impedir la interacción de éstas entre sí, para dar lugar a especies más estables de menor reactividad y evitar la peroxidación de las macromoléculas. Hay otros enzimas importantes que también participan en el sistema de defensa, incluidos en las reacciones de la regeneración del Glutation (GSH), como la GSH reductasa, o la NADPH-quinona oxidoreductasa (DT diaforasa). 34 d 2.6.2. SISTEMA NO ENZIMÁTICO ANTIOXIDANTE O “SCAVENGERS” DE RADICALES LIBRES En el sistema antioxidante de defensa no debemos olvidar a las moléculas antioxidantes hidrofílicas o lipofílicas. Como el beta-caroteno, la ferritina, la ceruloplasmina, el selenio, el manganeso, la ubiquinona, el zinc, el ácido úrico. De entre las moléculas hidrofílicas cabe destacar la vitamina C, la vitamina E, el GSH, los flavonoides y las melanoidinas, entre otras. Figura 4. Sistema enzimático antioxidante . (1) 2 O2 - + 2 H+ (2) 2 H2O2 (3) H2O2 + 2 GSH SOD 2 H2O2 + O2 Catalasa 2 H2O + O 2 GPx GSSH + 2 H2O NADPH GR NADP 2 GSH . (4) Q + 2e - + 2 H+ DT-diaforasa QH2 2.6.1.1. GLUTATION REDUCIDO (GSH) Entre las endógenas destacaremos el Glutation (g-Glu-CysH-Gly) es el mayor componente antioxidante intracelular. Es un tripéptido compuesto de cisteína, ácido glutámico y glicina. Su distribución es universal al estar presente tanto en tejidos de plantas como de animales y juega un papel principal en la protección celular contra los efectos dañinos de los radicales libres. Está presente en las células principalmente en su forma reducida y gran parte de sus funciones se deben a la pre- 35 o s d o s sencia del grupo tiólico reducido que le confiere la cisteína y que promueve su estabilidad intracelular. En la defensa celular contra los radicales libres tiene un papel importante como antioxidante al ser capaz de interaccionar y estabilizar radicales hidroxilo, superóxido y peróxidos, además de participar en la reducción de otros antioxidantes (tales como el α-tocoferol) y de donar hidrógenos para reparar el ADN dañado. Por otro lado puede actuar como cosustrato de enzimas antioxidantes como la glutation peroxidasa, como ya hemos mencionado. Del glutation reducido podemos destacar las siguientes características: 1. El GSH es un antioxidante exógeno y endógeno. El GSH de la dieta puede ser absorbido en el intestino delgado y puede ser sintetizado de nuevo. 2. Aunque el radical glutation formado por la oxidación del GSH es un radical prooxidante, este puede reaccionar con otro radical GSH (GS·) y dar como resultado GS-SG que es reducido a GSH por la enzima glutation reductasa dependiente del NADPH. 3. El GSH puede reaccionar con componentes electrofílicos de algunos xenobióticos en la reacción catalizada por la glutation-S-transferasa. 4. El GSH capta las EROs. 5. El GSH puede conjugarse con NO, lo que tiene como consecuencia la formación de GSH nitrosilado, que a través de un sistema de tiol proteínas liberará GSH y NO. 6. El GSH interacciona con ciertas proteínas tiólicas (glutaredoxina y thioredoxina) que pueden jugar un papel importante en la regulación de la homeostasis del sistema de reducción-oxidación celular. 36 d La síntesis del GSH se produce a partir de glutamato, cisteína y glicina en dos etapas: en la primera etapa, se une el ácido glutámico y la cisteína en una reacción catalizada por la γ-glutamil cisteína sintasa. Dicho paso está limitado por la disponibilidad de cisteína. El GSH está unido a γ-glutamil cisteína por la GSH sintasa que suma la glicina (Figura 5). El GSH total está regulado por una reacción de retroalimentación de la γ-glutamil cisteína sintasa. La disponibilidad dietética de los aminoácidos azufrados puede tener influencia en las concentraciones del GSH celular. Figura 5. Síntesis de GSH O O SH S O O N Glutamato N N N cisteína ATP γ-glutamil cisteína sintasa ADP + Pi glutation sintasa ATP ADP + Pi O C NH CH2 C CH2 H C N O C COO- CH2 C NH3+ COO- Entre las exógenas y debido a que se encuentran presentes en la cerveza destacaremos los polifenoles y las melanoidinas. 2.6.1.2. COMPUESTOS FENÓLICOS Estos compuestos, denominados frecuentemente polifenoles, se encuentran muy extendidos por todo el reino vegetal. En los alimentos de este origen, son especialmente abundantes en frutas y verduras, además de en productos como el té, el café, el cacao, la cerveza, el vino y los zumos. 37 o s d o s Una de las razones por las cuales han adquirido gran interés dichos compuestos en los últimos años es debido a su actividad antioxidante. Así pues, su ingestión podría ser de interés en la prevención de los procesos patológicos y fisiopatológicos en los cuales están implicados las especies oxigénicas reactivas (EROs o ROS), como las enfermedades cardiovasculares, cáncer, envejecimiento, enfermedades degenerativas, cataratas, procesos inflamatorios, etc. Sin embargo, hay que tener en cuenta que los polifenoles también pueden tener un efecto prooxidante y, en consecuencia, acabar produciendo daños a las macromoléculas. Figura 6. Estructuras químicas de los diferentes ácidos fenólicos y compuestos polifenólicos de los alimentos. Ácidos Hidroxibenzóicos (Ácido galico) Ácido clorogénico Ácidos Hidroxicinámicos (Ácido cafeínico y felúrico) R1 R1 OH O R2 O OH O O R2 H OH OH R3 OH R3 H OH H O OH OH Lignanos Estilbenos (Resveratrol) Flavonoides . R3 R1 CH3O R2 . OCH3 OCH3 OH OR4 OH OH O A C R5 R4 R3 R3 OCH3 B . R5 R3 OH Los polifenoles en los alimentos se clasifican en diferentes familias (Manach et al., 2004) ordenadas según su estructura química, especialmente según los anillos fenólicos y los sustituyentes de dichos anillos. En consecuencia, se pueden clasificar (Figura 6) como: 38 d 1. Ácidos fenólicos. Entre los que cabe destacar: ácido clorogénico, ácidos hidroxibenzoicos y ácidos hidroxicinámicos. Dichos ácidos se encuentran en cantidades muy pequeñas en el reino vegetal, con excepción de ciertas frutas rojas y en las cebollas. El té es, asimismo, una fuente importante de ácido gálico (4,5 g/Kg) de té fresco). El ácido hidroxibenzoico forma parte de complejas estructuras en las frutas rojas. El ácido hidroxicinámico se encuentra en forma libre en los alimentos, pero si éstos sufren procesos como la congelación, la esterilización o la fermentación se pueden encontrar en su forma glicosilada. 2. Estilbenos. Los estilbenos, se encuentran mayoritariamente en el vino, siendo uno de los más importantes el resveratrol. El vino tinto contiene 0,3 a 7 mg/L de resveratrol en forma libre y 15 mg/L en forma glicosilada (Vitral et al., 2002). 3. Lignanos. Los lignanos están formados por dos unidades de fenilpropano. Se encuentran mayoritariamente en el aceite de linaza y en menor cantidad, en los cereales y las frutas. 4. Flavonoides. Son un grupo de polifenoles muy abundantes en la naturaleza, habiéndose localizado hasta el momento más de 5000 especies diferentes de flavonoides en frutas, verduras, semillas, tallos, cereales y cerveza, siendo, por lo tanto, unos integrantes significativos de la dieta humana. Dentro los flavonoides más importantes cabe destacar: 4.1. Los flavonoles son los más comunes en las frutas y verduras. Estos compuestos se encuentran en los alimentos en forma glicosilada, como 39 o s d o s más representativos cabe destacar la quercitina y kaempferol. Las cebollas contienen aproximadamente 1200 mg/kg, el vino tinto y el té contienen 45 mg/L. Las frutas contienen entre 5 y 10 flavonoles glicosilados diferentes y su concentración esta en función de factores ambientales, tales como la luz solar (Manach et al., 2004). 4.2. Las flavonas se encuentran en cantidades menores que los flavonoles en las frutas y verduras, también se encuentran en forma glicosilada, siendo las principales la luteolina y apigenina, que se encuentran en el perejil. Los cítricos contienen grandes cantidades de flavonas polimetoxiladas tales como: tangeritina, nobiletina y sinensetina, siendo éstas las más hidrofóbicas. La mandarina contiene hasta 6500 mg/L (TomasBarberan y Clifford, 2000). 4.3. Las flavanonas se encuentra generalmente en forma glicosilada por un disacárido en posición 7. Las podemos encontrar en cantidades considerables en el tomate, en los cítricos y ciertas plantas aromáticas, tales como la menta. El zumo de naranja contiene entre 200 y 600 mg de hespiridina/L y de 15 a 85 mg de narirutina/L. Un vaso de zumo de naranja puede contener entre 40 y 140 mg de flavanonas glicosiladas. El contenido mayor de flavanonas en la naranja y mandarina se encuentra en la parte del albedo y las membranas internas de la naranja y mandarina (Tomas-Barberan y Clifford, 2000). 4.4. Los flavanoles se encuentran en forma de monómeros (catequina y epicatequina) y en forma de polímeros (proantocianidinas). Éstos en los alimentos no se encuentran en forma glicosilada. Las catequinas están mayoritariamente presentes en las frutas, en el vino tinto (hasta 300 40 d mg/L), en el té, un vaso de té verde contiene hasta 200 mg de catequinas (Lakenbrink et al., 2000) y en la cerveza con/sin alcohol 401 y 343 mg/L respectivamente (Valls y Belles et al., 2005). Las proantocianidinas forman complejos con proteínas de la saliva los cuales son responsables del carácter astringente de las frutas. Es difícil la cuantificación de las procianidinas en los alimentos ya que según el estado de maduración podemos encontrar diferentes estados de polimerización. 4.5. Las isoflavonas se encuentran principalmente en las plantas leguminosas, siendo la soja la de mayor contenido, podemos encontrar genisteína, daidzeína y gliciteína en una proporción de 1:1:0,2, encontrándose en cuatro formas químicas diferentes: aglicona, 7-O-glicosido, 6”-O-acetil-7-O-glicosido y 6”-O-malonil-7-O-glicosido. La semilla de soja contiene entre 580 y 3800 mg de isoflavones/kg. Son sensibles al calor y en los procesos industriales son hidrolizados a glicosidos tal como ocurre en la producción de la leche de soja, la cual contiene de 30 a 175 mg/L (Cassidy et al., 2000). 4.6. Las procianidinas (Figura 7) son pigmentos que podemos encontrar en el vino tinto, en los cereales y mayoritariamente en las frutas, especialmente en la piel de estas últimas. Además pueden existir bajo diferentes formas químicas, siendo la cianidina la más común. El contenido en los alimentos está en función de la intensidad del color. Puede llegar hasta 2000-4000 mg/kg en las grosellas y fresas. Estos valores aumentan con el proceso de la maduración. El vino tinto contiene entre 200350 mg de antocianinas/L, las cuales se transforman en complejas estructuras con la edad del vino (Clifford, 2000). 41 o s d o s Figura 7. Estructura química de las procianidinas OH OH O OH OH OH OH O OH OH OH OH OH O OH OH OH OH 2.6.1.2.1. FLAVONOIDES Y ACTIVIDAD ANTIOXIDANTE Estructuralmente, los flavonoides son derivados benzo-γ-pirenos, su estructura básica está constituida por dos anillos bencénicos unidos a través de un anillo pirona o pirano heterocíclico (Bravo, 1998) (Figura 6). La estructura química de los compuestos fenólicos es precisamente la que les confiere su capacidad para actuar como captadores de radicales libres (Heim et al., 2002). Esta actividad antioxidante viene marcada por el tipo de compuesto, su grado de metoxilación y el número de grupos hidroxilo. Así, los compuestos con mayor actividad (Rice-Evans et al., 1996) son aquéllos que presentan dos grupos hidroxilo en posición orto en el anillo B, lo que confiere una alta estabilidad al radical que se forma después de la reacción de captura del radical libre. Contienen un doble enlace 2,3 en conjugación con el 4-oxo (C=O) en el anillo C y aquellos compuestos que tienen grupos OH- en 3 y 5 y el grupo oxo (C=O) en 4 anillos A y C. Así pues: 42 d • Pueden actuar directamente como "scavenger" de radicales libres, oxidándose y dando lugar a otros compuestos más estables (Figura 8). • Pueden estabilizar compuestos obtenidos a partir de radicales libres. • Pueden tener un efecto aditivo a la defensa antioxidante endógena, aumentando o manteniendo dicha defensa antioxidante. La hidrofobicidad de los flavonoides es intermedia entre la vitamina C (altamente hidrofílica) y la vitamina E (altamente hidrofóbica). Por lo tanto, actuarán en la interfase agua-lípido, siendo los más hidrofóbicos los glucuronizados y sulfatados. Asimismo, tienen capacidad de quelar iones metálicos (Fe, Cu), . impidiendo la formación del radical hidroxilo (OH ) (Middleton et al., 2000; Ozgova et al., 2003) e inhibiendo determinadas enzimas como ciclooxigenasa (Laughton et al., 1991), lipoxigenasa (Van Hoorn et al., 2002), NADPH oxidasa (Varga et al., 2004), etc. Los efectos de los polifenoles dependen de la cantidad y su biodisponibilidad. Los polifenoles también pueden tener efecto prooxidante (Figura 8). Así, en estudios in vitro, en ciertos flavonoides como los flavanoles con una di-hidroxilación en el anillo B, tienen la habilidad de oxidarse en condiciones concretas (Chan et al., 2003) dando lugar a la formación de derivados semiquinónicos, que en presencia de ión superóxido, dan lugar a la formación de peróxido de hidrógeno. En presencia de metales de transición, tales como el Fe y Cu, este peró. xido formará el radical hidroxilo (OH ). Por otra parte, la semiquinona puede oxidarse a quinona y dañar a las macromoléculas (proteínas, lípidos, DNA, RNA, etc.) (Spencer et al., 2004; Galati y O’brien, 2004). 43 o s s Figura 8. Actividad antioxidante y prooxidante de los polifenoles Flavonoide Antioxidantes (Vitamina C) O- OH Flavonoide OH OH O2.HO. H2O2 H2O OH O . O Flavonoide semiquinónico O R5. OH OH R5. ANTIOXIDANTES o OH O OH O O2 O2.O Flavonoide quinónico Daño celular Derivados quinónicos -2e + 2H+ OH O O R5. PROOXIDANTES d OH OH O El mecanismo a través del cual los flavonoides ejercen sus acciones beneficiosas o tóxicas aun está sin esclarecer. Sin embargo, estudios recientes han especulado que la actividad clásica como antioxidantes de donadores de hidrógenos difiere de la explicación básica para los efectos celulares. Actualmente, se está estudiando la posibilidad de un nuevo mecanismo de actuación no antioxidante y de protección como sería la unión a receptores, funcionando como moléculas señal, así como la modulación de la expresión de genes (Rice-Evans, 2003). Los flavonoides se combinan con azúcares para formar glicósidos, siendo ésta la forma más habitual en la que se encuentran en la naturaleza. Sin embargo, 44 d se ha visto que las agliconas pueden mostrar incluso una actividad antioxidante superior a sus correspondientes glicósidos. 2.6.1.2.2. BIODISPONIBILIDAD DE LOS POLIFENOLES Los mecanismos de absorción gastrointestinal de los polifenoles no están totalmente esclarecidos. Por su naturaleza hidrofílica se piensa que tienen que estar implicados los transportadores de membrana que faciliten su transporte, aunque en la actualidad solamente ha sido identificado un transporte activo dependiente de Na+ en el transporte de ácidos fenólicos (Ader et al., 1996). En el caso de los flavonoides, éstos (con excepción de los flavanoles) se encuentran en forma glicosilada y esta glicosilación influye de forma importante en su absorción. Las agliconas pueden ser absorbidas desde el intestino delgado (Hollman y Katan, 1999) y los glicósidos que resisten la hidrólisis del estómago, no pueden ser absorbidos en su forma nativa por lo que deben de ser hidrolizados por las enzimas intestinales o por la microflora del colon para ser absorbidos (Day et al., 2000). En muchos casos, cuando la flora está implicada, la eficiencia de absorción puede verse reducida porque tiene lugar una degradación de las agliconas que son liberadas en forma de ácidos aromáticos. Una excepción en cuanto a su absorción son aquellos flavonoides conjugados con glucosa que pueden utilizar el sistema de transporte activo de la glucosa dependiente de Na+ (SGLT1) a nivel del enterocito para ser absorbidos, y posteriormente hidrolizados en el interior de las células por una α-glucosidasa (Day et al., 1998). Otra vía implicada en la hidrólisis de algunos glucósidos es a través de una enzima glucosidasa que se encuentra en la membrana de las microvellosidades de las células intestinales, y cataliza la hidrólisis extracelular facilitando la difusión de las agliconas al interior de las células (Day et al., 2000). Las procianidinas difieren de la mayoría de los otros polifenoles por su naturaleza polimérica y alto peso molecular, lo cual limita su absorción a través de la 45 o s d o s barrera gástrica donde los olígomeros de más de tres unidades es improbable que sean absorbidos a nivel del intestino delgado en su forma nativa, (solo dímeros y trímeros son capaces de atravesar el epitelio intestinal). Así, las procianidinas, las cuales son los polifenoles más abundantes de la dieta, son muy pobremente absorbidas, pero pueden ejercer sus efectos localmente en el tracto gastrointestinal o mediar su actividad a través de los ácidos fenólicos producidos resultado de la degradación microbial. Su acción local es muy importante al estar el intestino particularmente expuesto a agentes oxidantes. Los efectos de los otros componentes del alimento sobre la biodisponibilidad de los polifenoles no están estudiados, aunque suponemos que pueden ocurrir interacciones entre los polifenoles y componentes como las proteínas y los polisacáridos que afecten a su absorción. Otros efectos indirectos de la dieta son su efecto sobre el pH, la fermentación intestinal, la excreción biliar, etc. que pueden tener consecuencias sobre la absorción final de los polifenoles. En cuanto al metabolismo de los antioxidantes procedentes de la dieta, éste es complejo y los antioxidantes pueden actuar como sustratos de diferentes enzimas. Así, los compuestos polifenólicos son modificados por enzimas de biotransformación de la fase I y los de la fase II que pueden cambiar considerablemente la función de un componente particular, modificándolo para su eliminación posterior o generando compuestos más bioactivos. La biotransformación en el hígado por medio de reacciones de fase I introduce o expone grupos polares, y la que tiene lugar en el colon mediante reacciones de fase II, en las que los microorganismos degradan los flavonoides no absorbidos. Las reacciones de conjugación de los grupos hidroxilo con el ácido glucurónico, sulfato, glicina o metilación son los pasos más frecuentes en las metabolización de los flavonoides (Stahl et al., 2002) y algunas de estas reacciones afectan a la capacidad antioxidante in vivo. La metilación en la posición 3’ de cianidina-3-glucosida y de la quercitina disminuye su capacidad antioxidante del metabolito. La conjugación con glucu- 46 d rónido o sulfato puede afectar a la capacidad antioxidante dependiendo de la posición en la que tenga lugar la conjugación. La quercitina es posiblemente conjugada durante el proceso de absorción, y parece retener su actividad antioxidante. El transporte de los polifenoles en plasma está asociado a proteínas, no encontrandose libres en sangre, siendo la principal transportadora la albúmina. La concentración plasmática de los polifenoles después de un consumo elevado varía de acuerdo a la naturaleza y fuente de los polifenoles. Con respecto a la eliminación de los metabolitos de los polifenoles, la excreción puede seguir dos vías diferentes, la vía biliar y la urinaria. Los metabolitos conjugados son principalmente eliminados por la bilis mientras que los monosulfatos lo hacen principalmente por orina. A consecuencia de su estructura, presentan importante actividad antioxidante con unos efectos metabólicos importantes. Ya que su solubilidad es intermedia entre la vitamina C y la vitamina E, es de esperar que actúen en la interfase agua/lípido y puedan estar implicadas en la regeneración oxidativa de ambas vitaminas. La glucuronidación y sulfatación ocasiona polifenoles más hidrofílicos, lo que puede afectar su sitio de acción y su interacción con otros antioxidantes. También pueden mostrar efectos indirectos sobre la salud porque son metabolizados por la misma vía que algunos xenobióticos u hormonas endógenas. Tras el consumo de flavonoides presentes en alimentos como la cebolla y el tomate (Boyle et al., 2000), se observa que glucósidos como la quercetina-glucosidada y isorhamnetina-glucosidada incrementan sus niveles en plasma; además, este incremento se asoció con un incremento en la resistencia del ADN de los linfocitos a la escisión de cadena, y a una disminución de los niveles de la base modificada 8-hidroxi 2’-deoxiguanosina en orina después de 4h de haber ingerido cebolla. En el mismo estudio, con una combinación dietética de tomate y cebolla, se observó que la presencia del flavonoide quercetina en plasma tenía 47 o s d o s relación con una disminución en la oxidación de las bases endógenas, sin apreciarse cambios en los niveles de MDA en orina. Otros estudios llevados a cabo por Cao y colaboradores (Cao et al., 1998) en humanos, encontraron que después de una comida con fresas, espinacas o vino desalcoholizado, todos ellos alimentos ricos en antioxidantes de naturaleza fenólica, existió un aumento en la capacidad antioxidante en suero utilizando 3 métodos (ORAC, Trolox y la capacidad de reducir el hierro). Otro estudio (Nagyova et al., 1998) en vegetarianos demostró que los TBARS estaban reducidos y la capacidad antioxidante total en plasma incrementada. 2.6.1.3. MELANOIDINAS Las melanoidinas son unos polímeros formados principalmente partir de las interacciones entre carbohidratos y compuestos que poseen un grupo amino libre (aminoácidos, péptidos y proteínas) a través de la reacción de Maillard (que produce pigmentos marrones). Son un grupo de sustancias con actividad antioxidante que está presente de forma importante en determinados alimentos (café, malta, bollería, cerveza, etc), siendo ingeridos en cantidades considerables en la dieta habitual, con una media de ingestión del orden de varios gramos al día. La reacción de Maillard es una de las más importantes en lo que respecta a los cambios químicos experimentados por los componentes de los alimentos durante el procesado y almacenaje de los mismos (Friedman, 1996). Entre los distintos efectos fisiológicos de las melanoidinas se han descrito los siguientes: capacidad antimicrobiana, antimutagénica, antitumoral, capacidad de actuar como antioxidantes y como prooxidantes, supresión del crecimiento celular tumoral e inhibición de enzimas digestivos. Su papel como antioxidante in vivo no es conocido a fondo aunque distintos estudios in vitro apoyan su papel beneficioso como antioxidante de los radicales 48 d hidroxilo, superóxido y peroxilo, actuando además como quelantes de metales como el zinc y el cobre. Así, algunos autores (Chuyen, 1988) observaron que los niveles de peroxidación lipídica en hígado de ratas wistar alimentadas durante 6 semanas con alimentos ricos en melanoidinas (miso) eran inferiores a los del grupo control. En una línea similar, nuestro grupo de investigación (Valls et al., 2004), utilizando melanoidinas procedentes de síntesis, a partir de glucosa-glicina, encontró efecto como antioxidante frente a la toxicidad inducida en hepatocitos aislados de rata por el agente antitumoral adriamicina. Se observó una disminución en los TBARS y en los niveles de LDH liberados al medio extracelular, a la vez que se producía un incremento en los niveles de ATP. Otros estudios mostraron el papel protector de los productos de Maillard, contra el daño oxidativo al ser capaz de inhibir la oxidación de las lipoproteínas de baja densidad (LDL) humanas in vitro (Dittrich et al., 2003). No se conoce demasiado sobre su biodisponibilidad, pero ciertos estudios en animales han permitido saber que se absorben a través del tracto gastrointestinal. Con respecto a su biotransformación, se cree que las enzimas de la fase II facilitan el tránsito metabólico de las melanoidinas formadas en los alimentos (Faist y Erbersdobler, 2001). No es conocido el mecanismo por el que estos compuestos pueden ejercer sus efectos a nivel celular, aunque sabemos que los compuestos de la reacción de Maillard se absorben por difusión y son captados en el hígado, riñón, músculo y eliminados por la orina (Erbersdobler y Faist, 2001). Por otro lado, distintos trabajos apuntan a que el efecto de las melanoidinas en las células pueda estar mediado por los RAGE (receptor for advanced glycation end products), receptores que fueron originalmente identificados y caracterizados basándose en la capacidad de unir los productos de glicosilación avanzada (AGEs). 49 o s d o s 2.6.3. SISTEMAS REPARADORES Su objetivo consiste en eliminar los posibles productos metabólicos nocivos formados, lo que impediría su acumulación indeseable. Para ello, se ponen en marcha mecanismos enzimáticos de reparación de ADN, así como enzimas proteolíticas y lipolíticas. En estos sistemas están incluidos los siguientes subsistemas: a. Sistema reparador directo Actúa por reducción de los grupos (S-S) de los aminoácidos azufrados de las proteínas gracias a enzimas específicas como son la disulfuro reductasa y la sulfóxido reductasa. Este grupo de enzimas reparadoras son las que catalizan la reducción de grupos (S-S) oxidados en proteínas por la acción de reductasas disulfuro en el interior de las células. Otro grupo de enzimas reparadoras son las proteasas y las fosfolipasas, que actúan sobre proteínas y fosfolípidos, una vez se produce el daño en la molécula y éstas deben ser reemplazadas vía síntesis de novo (Davies, 1995; Sartori y Jiricny, 2003). b. Sistema reparador indirecto Este sistema conlleva, en primer lugar, el reconocimiento del daño molecular (siendo éste eliminado o degradado) y, en segundo lugar, la síntesis de la parte eliminada. Esto ocurre en las proteínas oxidadas y en los peróxidos lipídicos de las cadenas carbonadas, como por ejemplo en las oxidaciones de ADN y ARN (Mataix, 2002). Los ácidos nucleicos que han sido modificados como consecuencia del estrés oxidativo, son reparados principalmente por el sistema REB (reparación por escisión de base) donde intervienen un grupo de enzimas como glicosilasas y endonucleasas AP, siendo el nucleótido dañado repuesto por las polimerasas (Demple y Harrison, 1994). 50 d 2.7. ALIMENTACIÓN Y ESTRÉS OXIDATIVO La composición de la dieta juega, como hemos visto, un papel importante en el desarrollo del estrés oxidativo, ya que puede contribuir tanto sobre el daño oxidativo como sobre los mecanismos de defensa antioxidante, lo que explica, al menos en parte, la relación entre la dieta y algunas enfermedades crónicas o degenerativas como la aterosclerosis y el cáncer. En efecto, durante las últimas décadas, la preocupación de las autoridades sanitarias por la importancia de las enfermedades crónicas y degenerativas ha sido creciente. En efecto, la Organización Mundial de la Salud (OMS) refleja en sus documentos cómo, de no actuar adecuadamente, en el año 2.020 las enfermedades no transmisibles (patologías cardiovasculares, diabetes, hipertensión arterial y ciertos tipos de cáncer) serán la causa del 73% de las defunciones y del 60% de la carga mundial de enfermedad (OMS, 2001). Simultáneamente, la dieta mediterránea es conocida desde hace tiempo como un modo de alimentarse saludablemente (Nestle, 1995). En efecto, la prevalencia de las citadas patologías en los países cuya población sigue la dieta mediterránea es sensiblemente menor, habiéndose achacado este efecto a diferentes factores ambientales y, por supuesto, dietéticos (Keys, 1995). La ventaja, en términos de salud, que supone mantener un estilo de vida que contemple el seguimiento de la dieta mediterránea, ha quedado suficientemente establecido, aunque las causas no están aún lo suficientemente claras: desde el perfil lipídico hasta el contenido en antioxidantes, pasando por la presencia de fibra y de otras sustancias, se han propuesto como fundamento de este vínculo entre la dieta y la salud (Willet, 2006). En los últimos años, el interés en ciertos antioxidantes, ampliamente distribuidos entre los alimentos de origen vegetal, se ha acentuado considerablemente dados los últimos hallazgos clínicos y epidemiológicos (Pitsavos et al., 2005) 51 o s d o s que vinculan la ingestión de alimentos de la dieta mediterránea, ricos en estas sustancias, con la capacidad antioxidante total. Se destacan especialmente los polifenoles. 2.7.1. DIETA RICA EN ANTIOXIDANTES (POLIFENOLES) Y SALUD La ingestión, en el contexto de una dieta equilibrada, de alimentos ricos en antioxidantes y, entre ellos en polifenoles, parece guardar una estrecha relación con una mejor salud. Referencias globales de este tipo se encuentran, por ejemplo, en el estudio epidemiológico de Zutphen, realizado en 552 ancianos entre 50 y 69 años durante un periodo de 5 años, en el que se observó cómo la ingesta de flavonoides estaba inversamente correlacionada con la mortalidad producida por la patología cardiovascular. De este modo, se observó un 60% menos de mortalidad entre la población que ingería un mayor contenido de flavonoides en su dieta (Hertog et al., 1993). Con respecto a esta repercusión fisiológica hay que destacar los siguientes puntos: ■ Ingestión de polifenoles y capacidad antioxidante. Los efectos beneficio- sos de la ingesta de un elevado número de alimentos ricos en compuestos fenólicos como fresas, espinacas, cerveza y vino tinto, se pueden evaluar a corto plazo ya que aumentan la capacidad antioxidante en suero (Cao et al., 1998; Velioglu et al., 1998; Kähkönen et al., 1999), lo que avala el creciente interés por el consumo de alimentos ricos en estos compuestos (Hertog et al., 1995). La relación entre la capacidad antioxidante total de la dieta y los marcadores de inflamación apenas ha sido estudiada in vivo. De entre los datos disponibles, señalamos que parece haber una relación significativa inversa entre la proteína C reactiva del plasma y los antioxidantes totales de la dieta inge- 52 d ridos. La relación es más estrecha precisamente en aquellos sujetos que padecen hipertensión. Además, el valor antioxidante total de la dieta es significativamente mayor en aquellos sujetos que tienen cifras plasmáticas de proteína C reactiva bajas, en comparación con los que las tienen más altas. La conclusión de que la capacidad antioxidante total de la dieta está inversa e independientemente relacionada con las concentraciones plasmáticas de proteína C reactiva, que podría ser uno de los mecanismos que explicaría el efecto protector frente a las enfermedades cardiovasculares de una dieta rica en antioxidantes. Esto, en definitiva, podría ser especialmente significativo para sujetos con hipertensión (Brighenti et al., 2005). En lo que respecta a la capacidad antioxidante total del suero (CAT) en diversas patologías, se ha visto que a menudo disminuye significativamente (por ejemplo, hasta un 24% en la anorexia nerviosa, un 20% en la encefalopatía VIH, un 13% en la polineuropatía diabética y un 17% en la cardiomiopatía). Sin embargo, en el suero de los pacientes afectados por enfermedades renales, la capacidad antioxidante está significativamente elevada. Los datos indican que un estrés oxidativo aumentado puede relacionarse con la patogénesis o la progresión de la polineuropatía diabética así como de la cardiomiopatía. La disminución de la capacidad antioxidante del suero en pacientes con anorexia nerviosa o con encefalopatía VIH se debe, probablemente, en primer lugar a la malnutrición y en segundo lugar a la insuficiencia inmune y a la disminución de la capacidad antioxidante. En la enfermedad renal, sin embargo, la acumulación de urea en plasma parece ser la responsable de esta alta capacidad antioxidante. En contraste, otros autores no han hallado cambios en el valor antioxidante del plasma en la enfermedad de Parkinson, la enfermedad de Alzheimer, en el síndrome depresivo ni en la esquizofrenia (Sofic et al., 2002). 53 o s d o s ■ Polifenoles y cáncer. Desde un punto de vista bioquímico, los compuestos fenólicos revisten un especial interés debido a su potencial anticarcinógeno, bien por estimular el bombeo de ciertos agentes cancerígenos hacia el exterior de las células o bien por actuar mediante la inducción de enzimas de detoxificación (Mazza, 2000). En la bibliografía científica, son múltiples las referencias que demuestran que los flavonoides tienen efectos citostáticos en varios sistemas in vitro y que son capaces de regular ciertos procesos importantes en el desarrollo del cáncer. Los flavonoides tienen actividad antipromotora, efecto antiinvasivo, e inhiben enzimas como la tirosina proteinkinasa, la ornitin decarboxilasa ATP-dependiente y la DNA topoisomerasa. Numerosos trabajos de investigación demuestran que los isoflavonoides de la soja, especialmente la genisteína, pueden tener efecto protector frente a diferentes tipos de cáncer (mama, colon y piel). Este hecho, se ha relacionado con el efecto estrogénico de los isoflavonoides, mediante diferentes mecanismos bioquímicos (Barnes, 1995; Herman et al., 1995). En lo referente al cáncer en aparato digestivo, es necesario tener en cuenta que el tracto gastrointestinal está continuamente expuesto a la acción de los radicales libres por diferentes vías: a. En el estómago: 1) Se producen mezclas de ácido ascórbico con el hierro formando una combinación prooxidante. 2) Las proteínas hemo de la dieta, las cuales son potentes prooxidantes. 3) Peróxidos lipídicos, aldehídos citotóxicos e isoprostanos de la dieta. 4) El nitrito de la saliva y de los alimentos se convierte en HNO2 por el ácido gástrico formando nitrogenados y especies desaminadas del DNA. 5) Aumento de la concentración de H2O2 procedente de ciertas bebidas. 54 d b. En el intestino: 1) La presencia de cantidades de productos oxidables, prooxidantes y compuestos fenólicos tales como hidroxiquinonas. 2) La activación de células inmunes presentes en el intestino por bacterias y toxinas de los alimentos. Estos compuestos y sus derivados producirán efectos sobre el tracto gastrointestinal. Por tanto, los polifenoles pueden actuar inmediatamente en el propio tracto gastrointestinal como “scavengers” de radicales libres, inhibiendo todos los efectos anteriormente mencionados. La absorción del hierro no es completa en el intestino delgado, por tanto en colon y recto puede actuar como un prooxidante, por lo que podría ser el responsable de algunos tipos de cáncer de colon y de recto. Sin embargo, los polifenoles de la dieta que no se absorben pueden quelar dicho metal y reducir así el efecto prooxidante, ejerciendo por lo tanto un efecto positivo que protegería frente a los cánceres gastrointestinales (Babbs et al., 1990; Middleton et al., 2000; Halliwell et al., 2005). ■ Polifenoles y salud cardiovascular. Los compuestos fenólicos protegen de la oxidación a las lipoproteínas de baja densidad (LDL) desempeñando un papel clave para prevenir la aterosclerosis. También pueden prevenir la trombosis, inhibiendo la agregación plaquetaria, la permeabilidad y fragilidad capilar (Mazza, 2000). Este efecto se ha demostrado mediante experimentos con animales in vitro e in vivo. En muchos casos, se inhibe la AMP cíclico fosfodiesterasa y como resultado se incrementan los niveles de cAMP. Asimismo, se reduce el nivel de calcio, se inhibe el factor de activación plaquetario, la captación de radicales libres y se reduce la liberación de enzimas que favorecen la agregación plaquetaria (Meltzer y Malterud, 1997; Craig et al., 1996). 55 o s d o s ■ Polifenoles e inmunidad. Los compuestos fenólicos también son considera- dos como reguladores del sistema inmune y como antiinflamatorios, probablemente debido a la modulación del metabolismo del ácido araquidónico, reduciendo los niveles de tromboxano. También modulan la actividad enzimática de la ciclooxigenasa, lipoxigenasa, fosfolipasa A2, hialuronidasa, e inhiben la acción de la angiotensina convertasa, mieloperoxidasa (que produce el hipoclorito y otros prooxidantes) y xantinooxidasa (que produce los radicales superóxido), entre otras. Dichos efectos les otorgan un amplio potencial para su utilización con fines médicos (Craig et al., 1996). Son numerosos los estudios que han mostrado que este tipo de compuestos poseen propiedades antioxidantes, inhibiendo la peroxidación lipídica y captando radicales libres como hidroxilo, supéroxido y alcoxi radical (Sichel et al., 1991). ■ Polifenoles e infección. También se han descrito efectos antivíricos, anti- bacterianos y antifúngicos. Se ha observado in vitro el potencial de la epicatequina como agente antivírico y las antocianidinas pueden inhibir las enzimas que intervienen en la replicación del rhinovirus y del virus de la inmunodeficiencia humana (HIV) (Hocman, 1989). ■ Polifenoles y salud ósea. Numerosos estudios señalan el papel protector de los polifenoles frente a la osteopenia. Así, se ha encontrado que la rutina inhibe la pérdida de trabéculas óseas en ratas ovariectomizadas por diferentes causas: a) por reducir la resorción ósea y b) por aumentar la actividad osteoblástica (Horcajada-Molteni et al., 2000). ■ Polifenoles y menopausia. Es conocida desde hace tiempo la probable pro- tección ante la aparición de patologías postmenopaúsicas (ECV, osteoporosis…) cuando se suplementa la dieta con fitoestrógenos (Keller et al., 1999). 56 d Estudios más recientes apoyan la teoría de que los fitoestrógenos (isoflavonas y lignanos, entre ellos) podrían tener un papel en la prevención de la osteoporosis tras la menopausia, especialmente en el caso de la soja, las semillas de lino y las ciruelas (Arjmandi, 2001). Estos fitoestrógenos son compuestos de origen vegetal (judías, coles, espinacas, soja, cereales, lúpulo, etc.) con actividad estrogénica o antiestrogénica. Los principales componentes presentes en los alimentos y que tienen esta actividad son los isoflavonoides, los flavonoides y los lignanos. Sin embargo, actualmente no hay evidencias que sugieran beneficios consiguientes a la promoción de modificaciones dietéticas en este sentido. Asimismo, cabe destacar que los fitoestrógenos han producido efectos secundarios negativos en animales de experimentación, como por ejemplo sobre la diferenciación cerebral durante el crecimiento. Tampoco conocemos las posibles dosis tóxicas cuando se ingieren por niños o por adultos. 2.7.2. PRESENCIA DE POLIFENOLES EN LA ALIMENTACIÓN HUMANA No se ha profundizado en estudios que reflejen el consumo real de estas sustancias en la dieta cotidiana. Por el contrario, sí señalaremos algunos datos parciales disponibles en diferentes países: ■ En Australia (Lyons-Wall et al., 2004), la ingestión total de flavonoides en mujeres es de 128 miligramos al día (+/- 19.9 mg/dl). En este grupo, las mayores fuentes dietéticas de este polifenol fueron: cebolla, manzana, té, aceitunas y brécol en lo que respecta a los flavonoles. Para las flavonas, el perejil y el apio son las fuentes alimentarias, siéndolo la naranja, el pomelo y sus zumos para las flavononas y el té, la manzana, el vino tinto, el chocolate negro y el cacao para las catequinas. La catequina es precisamente el tipo de flavonoides 57 o s d o s más presente en este grupo de mujeres (representan el 59% del total), seguida por los flavonoles (un 20%) y las flavononas (un 18%) con una pequeña contribución de las flavonas (3%). Como señala el mismo autor, la ingestión media de catequina en otros países es, a modo de ejemplo, de 14,1 mg en Finlandia, de 25,4 mg en EE.UU y de 72 mg diarios en Alemania. ■ En Estados Unidos (Kuhnau, 1976), el consumo de flavonoides parece estar alrededor de 1 g al día. En Holanda (Hertog et al., 1993), la ingestión de polifenoles se estimó en 23 mg al día. En Dinamarca (Justesen et al., 1997), el valor obtenido fue de 28 mg al día de flavonoides. ■ En el conjunto de los países occidentales (Manach et al., 2004), el consumo total de flavonoides se ha calculado en una cifra que oscilaría entre los 100 y 150 mg diarios. 58 t OBJETIVOS DEL ESTUDIO El objetivo principal de este trabajo de investigación ha consistido en estudiar el efecto de la suplementación dietética de lúpulo a través de una bebida fermentada y de cápsulas o concentrados de lúpulo, con el metabolismo oxidativo y su relación con los marcadores de riesgo cardiovascular y de inflamación en un colectivo de edad avanzada (monjas de clausura). Como objetivos parciales del estudio podemos enumerar el conocimiento de: ■ Los hábitos alimentarios del grupo de población seleccionado y el valor nutritivo de su dieta. ■ Estudiar el efecto de la ingestión de cerveza sin alcohol en el metabolis- mo oxidativo y su relación con el metabolismo lipídico y los procesos de inflamación en un colectivo de edad avanzada (monjas de clausura). ■ Estudiar el efecto de la ingestión de un suplemento de lúpulo en el meta- bolismo oxidativo y su relación con el metabolismo lipídico y los procesos de inflamación en un colectivo de edad avanzada (monjas de clausura). ■ Comprobar el efecto antioxidante de la cerveza sin alcohol y del lúpulo en los procesos patológicos relacionados con el envejecimiento en un colectivo de monjas de clausura. 59 r e s c u a t r o MATERIALES Y MÉTODOS 4.1. MATERIAL 4.1.1. SUPLEMENTOS ■ Lúpulo. Inflorescencias femeninas de lúpulo, encapsuladas en gelatina, propor- cionadas por el laboratorio Dolisos (marca ElusanR). Cada cápsula conteniendo 200 mg. ■ Cerveza sin alcohol. Se ha optado por esta modalidad al tratarse de un grupo de edad avanzada. 4.1.2. REACTIVOS ■ Los reactivos para soluciones tamponadas, enzimas, coenzimas, fueron propor- cionados por Sigma Chemical Co (St Louis, MO, USA) y Boehringer Mannheim (Alemania). ■ Los disolventes y otros reactivos de ScharLau (Barcelona, España) y Merck (Darmstadt, Alemania). ■ Tests enzimáticos y kits para diferentes determinaciones: • Triglicéridos: test enzimático GPO-PAP, comercializado por Roche Diagnostics GMBH, D-68298 Mannheim (Alemania). • Colesterol: test enzimático CHOD-PAP, comercializado por Roche Diagnostics. • HDL colesterol: enzimas modificadas por PEG (polietilenglicol) y sulfato de alfaciclodextrina y dextrano, comercializado por Roche Diagnostics. 60 c • LDL oxidada: inmunoensayo enzimático para la determinación de anticuerpos frente a LDL oxidada en suero humano. Para esta determinación, se utilizó el kit OLAB “anti oxidised LDL” de Biomédica. • Interleukina 1: Kit ELISA, de Diaclone Research. • Interleukina 6: Kit ELISA, de Diaclone Research. • Factor de necrosis tumoral: Kit ELISA, de Diaclone Research. ■ El agua utilizada en todas las determinaciones fue de grado Milli-Q (Millipore). 4.2. MÉTODOS 4.2.1. ANALÍTICAS SANGUÍNEAS Una vez recogidas las muestras de sangre, se trasladan en condiciones de refrigeración al laboratorio para proceder a un tratamiento inicial de las muestras y a las correspondientes determinaciones. 4.2.1.1. PERFIL LIPÍDICO a. Determinación de triglicéridos. Para la determinación de los triglicéridos se utilizó el autoanalizador Modular EDDPP-ROCHE y el test enzimático triglicéridos GPO-PAP. Siendo el rango de normalidad para dicho test de 50-170 mg/dL. Principio del test: el método se basa en las siguientes reacciones acopladas: los triglicéridos se someten a la acción de la lipoprotein lipasa que pro- 61 u a t r o c ud a o t s r o duce una hidrólisis rápida y completa a glicerol. Posteriormente, y tras fosfatación, se produce dihidroxiacetonafosfato y peróxido de hidrógeno, el cual en presencia de un cromógeno, 4–aminofenazona y 4–clorofenol formará un compuesto coloreado (4–fenazona) que es directamente proporcional a la cantidad de triglicéridos presentes en la muestra. b. Determinación de colesterol total. Para la determinación del colesterol total se utilizó el autoanalizador Modular EDDPP-ROCHE y el test enzimático colesterol CHOD-PAP. Siendo el rango de normalidad para dicho test de 70-220 mg/dL. Principio del test: el método está basado en la hidrólisis de los ésteres de colesterol presentes en la muestra por la colesterol esterasa dando lugar a colesterol libre y ácidos grasos. Posteriormente, y tras oxidación enzimática con la colesterol oxidasa, se formará peróxido de hidrógeno y colesterina. Finalmente, este peróxido de hidrógeno se valora por la reacción de Trinder, mediante un cromógeno, fenol y 4-aminofenazona, en presencia de peroxidasa, formando una benzoquinona, cuya coloración es proporcional a la concentración de colesterol presente en la muestra. c. Determinación de HDL colesterol. La determinación directa de colesterol HDL mediante el empleo de enzimas modificadas por PEG (polietilenglicol) y sulfato de alfa-ciclodextrina y dextrano. Se utilizó el autoanalizador Modular EDDPP-ROCHE, siendo el rango 35 – 60 mg/dl. Principio del test: PEG- colesterol esterasa rompe los esteres de colesterol-HDL en colesterol libre y ácidos grasos, que tras oxidación, formará peróxido de hidrógeno, el cual por acción del cromógeno 4- aminofenazona y HSDA (N-(2-hidroxi-3-sulfopropil)-3,5-dimetoxianilina) formará un compuesto coloreado azul-violeta. Dicha coloración es proporcional a la cantidad de HDL-c presente en la muestra. 62 c d. Determinación de LDL colesterol. Para la determinación de las LDL- colesterol se utilizó la fómula de Friedewald: permite derivar el valor de la concentración de LDL-c a partir de la concentración de colesterol total, la de triglicéridos y la de HDL-colesterol, magnitudes todas ellas de más fácil medida que el LDL-c. Fórmula para la determinación de LDL colesterol. LDL-c = Colesterol total – HDl-colesterol – VLDL-colesterol ( TG / 5 o TG / 2, 17) e. Determinación de LDL oxidada. Inmunoensayo enzimático para la determinación de anticuerpos frente a las LDL oxidadas en suero humano. Para esta determinación, se utilizó el kit OLAB anti oxidised LDL de Biomédica. Añadimos 200 µL de tampón de ensayo en los pocillos de la placa incluyendo el blanco y 20 µL de la pre-dilución (1:5) de estándar/muestra/control en cada pocillo excepto el blanco. Cubrimos bien la placa e incubamos a 37 ºC durante 1,5 horas. Transcurrido el tiempo, lavamos los pocillos con tampón de lavado diluido y añadimos 100 µL de conjugado en cada pocillo. Cubrimos bien la placa e incubamos a temperatura ambiente (18-26 ºC) durante 30 minutos. Lavamos y añadimos 100 µL de sustrato en cada pocillo e incubamos durante 15 minutos a temperatura ambiente. Añadimos 50 µL de solución stop y finalmente medimos la absorbencia a 450 nm en un lector de placas. 4.2.1.2. PARÁMETROS MARCADORES DE INFLAMACIÓN a. Determinación de proteína C reactiva. Se utilizó la técnica de inmunoanálisis turbidimétrico de aglutinación. La muestra se coloca en una solución tampón y se mezcla con una suspensión de anticuerpo monoclonal de CRP antihumano de ratón. La CRP se fija al anticuerpo unido al látex y se aglutina. La can- 63 u a t r o c u a t r o tidad de la difusión de luz es proporcional a la concentración de CRP presente en las muestras. Las medidas se realizaron con el autoanalizador: COBAS INTEGRA 800 de ROCHE. Rango de normalidad: 0-5 mg/dl. b. Determinación de factores de complemento C3 y C4. Se utilizó la técnica de nefelometría. Las proteínas contenidas en el suero humano forman en una reacción inmunoquímica con anticuerpos específicos, inmunocomplejos los cuales pueden dispersar un rayo de luz incidente. La intensidad de la luz dispersada depende de la concentración de la correspondiente proteína de la muestra. La valoración se hace por comparación con un estándar de concentración conocida. Las medidas se realizaron con el nefelómetro DADE-BEHRING. El rango de normalidad para el complejo C3 es de 75-140 mg/dL y para el C4 de 10-34 mg/dL. c. Determinación de interleukinas • IL-1. Kit Elisa, de Diaclone Research, para IL-1 humana. Identifica interleukina 1-beta en suero, plasma, soluciones tamponadas o cultivos celulares. El método identifica interleukinas de origen natural (interleukinas pro y maduras) y recombinantes. Principios del método. El kit está basado en un método ELISA en sandwich en fase sólida con un anticuerpo monoclonal específico para la interleukina 1-beta. El proceso incluye una incubación de la muestra a la que se añade, tras el lavado, la enzima streptavidin-peroxidasa, volviéndose a incubar y lavar. La intensidad de la reacción coloreada que se produce finalmente, tras la correspondiente adición del sustrato que actúa sobre la enzima ligada, es directamente proporcional a la concentración de IL-1 presente en las muestras analizadas. 64 c • IL-6. Kit ELISA, de Diaclone Research, para Interleukina-6 humana. Dicho kit permite identificar IL-6 en suero, plasma, soluciones tamponadas y cultivos celulares. El sistema reconoce IL-6 natural y recombinante. Principios del método. El kit está basado en un método ELISA en sandwich en fase sólida con un anticuerpo monoclonal específico para la interleukina 6. El proceso incluye una incubación de la muestra a la que se añade, tras el lavado, la enzima streptavidin-peroxidasa, volviéndose a incubar y lavar. La intensidad de la reacción coloreada que se produce finalmente, tras la correspondiente adición del sustrato que actúa sobre la enzima ligada, es directamente proporcional a la concentración de IL-6 presente en las muestras analizadas. d. Determinación del factor de necrosis tumoral • Kit ELISA, de Diaclone Research, para identificación de factor de necrosis tumoral TNF-α humano. Identifica TNF-α en suero, plasma, soluciones tamponadas y cultivos celulares. El sistema reconoce TNF-α natural y recombinante. Principios del método. El kit está basado en un método ELISA en sandwich en fase sólida con un anticuerpo monoclonal específico para TNF-α. El proceso incluye una incubación de la muestra a la que se añade, tras el lavado, la enzima streptavidin-HRP, volviéndose a incubar y lavar. La intensidad de la reacción coloreada que se produce finalmente, tras la correspondiente adición del sustrato que actúa sobre la enzima ligada, es directamente proporcional a la concentración de TNF-α presente en las muestras analizadas. La reacción se termina mediante la adición de ácido (H2SO4) y la absorbancia se mide a 450 nm. 65 u a t r o c u a t r o 4.2.1.3. PARÁMETROS DEL METABOLISMO OXIDATIVO a. Determinación del contenido de grupos carbonilo en proteínas plasmáticas. La oxidación proteica se mide por la cuantificación de los grupos carbonilo formados durante la incubación con 2,4-dinitrofenilhidrazina (DNFH) en condiciones ácidas, basándose en la reacción equimolar entre ellos, según procedimiento desarrollado por Levine et al. (1980) con algunas modificaciones de Tian et al. (1998). La DNFH unida a proteínas se cuantifica colorimétricamente (ε373=21.10-3 M-1 cm-1 ) tras la separación de las proteínas derivatizadas por precipitación con ácido, lavado y posterior solubilización con guanidina. La cantidad de proteína utilizada oscila entre 0,5–1 mg/mL, añadiendo tampón de conservación de mitocondrias hasta 1 mL de volumen final. Centrifugamos a 13.600 rpm durante 10 minutos y al sobrenadante añadimos estreptomicina sulfato 10% con tampón Hepes 50 mM pH:7,2, en una proporción de 1/9 v/v. Centrifugamos y cogemos 200 µL del sobrenadante y añadimos 400 µL de 2,4 dinitrofenilhidracina (DNFH)10 mM /ClH 2,5 M a las muestras y 400 µL de ClH 2,5 M a los controles. Incubamos 1 hora a temperatura ambiente, con agitación ocasional. Centrifugamos a 12.600 rpm durante 3 minutos y añadimos 1 mL de TCA al 20%. Centrifugamos de nuevo a 12.600 rpm durante 3 minutos. Recogemos el pellet y lo lavamos 3 veces con 1 mL de etanol: acetato de etilo (1:1 v/v). Centrifugamos otra vez a 12.600 rpm durante 3 minutos y recogemos el pellet. Finalmente añadimos 1 mL de guanidina 6 N a pH: 2,3, centrifugamos a 12600 rpm y medimos el sobrenadante a una λ= 366 nm frente a una solución de guanidina. b. Determinación de α-Tocoferol en plasma. Se utlilizó la técnica de HPLC de Arnaud et al., 1991. Se toman 200 µL de plasma y se mezclan con 100 µL de etanol, se añaden 500 µl de hexano, se centrifuga y se recoge la fase orgáni- 66 c ca, la cual se lleva a secado con N2 seco y finalmente se resuspende con 200 µL de fase movil (diclorometano/acetonitrilo/metanol, 20:70:10). Se mide a una λ de 291 nm. c. Tratamiento de la sangre para la determinación de GSH y de hemoglobina en humanos. Se toma una alícuota de sangre heparinizada y se centrifuga a 3.000 rpm durante 10 minutos. Separamos el plasma y lo congelamos a -80º C. Las células se transfieren a un tubo cónico de vidrio, se le añade aproximadamente la misma cantidad de agua MiliQ (1.5 mL células + 1.5 mL agua). Posteriormente, dejamos a 4º C durante 2 h para que se hemolice (determinación de Hemoglobina). A 1.88 mL del hemolizado se añade 0.8 mL de mezcla cloroformo: etanol (3:5 v/v) frío y 0.3 mL agua MiliQ. Se centrifuga a 4.000 rpm durante 10 minutos y del sobrenadante determinamos los niveles de GSH (Maral et al.,1977). Determinación del GSH en sangre. La cuantificación del GSH se llevó a cabo mediante la técnica de Brigelius et al. (1983), de la glutation-s-transferasa (GSHS-T). El complejo formado (GS-DNB) absorbe luz a una longitud de onda de 340 nm, siendo proporcional el cambio de extinción medido espectrofotométricamente a la cantidad de GSH presente en la muestra. d. Determinación de TBARS en plasma. La determinación de las sustancias que reaccionan con el ácido tiobarbitúrico se realizó mediante la técnica de Santos et al. (1980). Pipeteamos en cada tubo 0.1 ml de plasma, y al blanco 0.1 ml de agua miliQ. Añadimos 0.4 ml de suero salino al 0.9% a cada tubo seguido de 1 ml de TCA 100% en HCl 0,6 N y 0,2 ml de TBA 0,12 M en TRIS 0,26 M. Agitamos los tubos en el vórtex, se tapan y se ponen a hervir en un vaso de precipitados durante 30-45 minutos. Transcurrido el tiempo, se dejan enfriar durante 15-20 minutos. Añadimos 2 ml de agua miliQ. Agitamos en vórtex y se centrifugan a 3.000 rpm durante 10 minutos. Se mide la absorbancia a una λ= 532 nm. 67 u a t r o c u a t r o 4.2.2. ANÁLISIS ESTADÍSTICO Las distintas repeticiones enunciadas en los respectivos apartados ponen de manifiesto que se obtuvieron datos suficientes como para poder aplicar distintos tratamientos estadísticos, los cuales se llevaron a cabo con el programa Statgraphcis Plus para Windows (Manugistics Inc, 1997). 4.3. DISEÑO EXPERIMENTAL 4.3.1. SELECCIÓN DE LA MUESTRA Se ha estudiado a una población de cincuenta monjas de clausura pertenecientes a tres monasterios: San Miguel de las Dueñas, Carrizo de la Ribera y Sta. María de Gradefes, todos ellos en la provincia de León. La elección de este grupo de población, institucionalizado y con una libertad de elección reducida en su estilo de vida, es un clásico en los estudios epidemiológicos y de investigación causa-efecto. En este caso, además, la población presenta unas características que la hacen especialmente interesante: su edad media es elevada (con lo que podemos encontrar una mayor prevalencia de determinadas enfermedades ligadas al proceso de envejecimiento y, por lo tanto, al estrés oxidativo) y su estilo de vida es ordenado, reglado y homogéneo. En los resultados del estudio podremos ver cómo la muestra inicial quedó reducida finalmente a 29 monjas, debido a las exclusiones y bajas producidas durante su elaboración, en la fase cerveza y a veinticinco en la fase lúpulo. Por el contrario, la muestra elegida ha sido difícil de seleccionar teniendo en cuenta el reducido número de colectivos religiosos existentes en la actualidad y de involucrar a este colectivo en un estudio dado su rechazo a recibir interven- 68 c ciones externas. Finalmente, tras una amplia búsqueda, se han elegido los tres conventos citados. 4.3.2. DESARROLLO DEL ESTUDIO Se ha procedido de acuerdo a las siguientes fases: ■ Fase I o inicial. Se realiza el “lavado” de alcohol, eliminando el posible consumo de bebidas alcohólicas por completo. Duración: 30 días. Al concluir, se procede a la toma de muestras para realizar la analítica sanguínea y se recopila una historia dietética de cada individuo. ■ Fase II. La dieta normalizada del grupo se ha suplementado con una cantidad dia- ria prefijada de cerveza sin alcohol (250 ml dos veces diarias), durante 45 días. Los pacientes del estudio siguen consumiendo la dieta habitual. Transcurrido el tiempo de suplementación, se procede a una segunda toma de muestras para analítica sanguínea. ■ Fase III. Tras un periodo de seis meses sin consumir cerveza sin alcohol ni nin- gún otro tipo de bebida alcohólica, las integrantes del estudio son sometidas a una nueva analítica de todos los parámetros del estudio. ■ Fase IV. La dieta normalizada del grupo se ha suplementado con lúpulo encapsu- lado durante 30 días a razón de 2 cápsulas diarias de 200 mg cada una de ellas conteniendo inflorescencias femeninas. Al cesar la administración de lúpulo, se realiza una nueva toma de muestras sanguíneas y a su correspondiente analítica. 69 u a t r o c i n c o RESULTADOS Previamente a estos estudios en humanos, nuestro grupo de investigación ha realizado estudios in vitro con hepatocitos aislados de rata, sometidos a un estrés oxidativo con el antibiótico antitumoral adriamicina en presencia y ausencia de la fracción flavonoidea de la cerveza rubia y negra. Posteriormente, se han realizado estudios in vivo, se ha determinado la biodisponibilidad de los compuestos fenólicos y actividad antioxidante total en plasma de ratas tras la administración de cerveza con y sin alcohol a diferentes tiempos. Asimismo, se sometieron las ratas a un estrés oxidativo con el antibiótico antitumoral al mismo tiempo que se suplementó su dieta con cerveza con y sin alcohol. En el presente trabajo, se ha estudiado el efecto de la suplementación de la cerveza y el lúpulo, componente de la cerveza, en un colectivo dietéticamente controlado y su relación con el metabolismo oxidativo, parámetros indicadores de riesgo cardiovascular y de inflamación, propios de la edad avanzada. Tras las correspondientes pruebas y determinaciones analíticas, se han obtenido los resultados que se ofrecen a continuación en las diferentes fases de suplementación con cerveza sin alcohol y con lúpulo. Los resultados se han realizado con muestras apareadas y expresados en porcentajes respecto a su control, estudiando los datos antes (Fase I) y después (Fase II) de la suplementación. 5.1. VALORACIÓN NUTRICIONAL Y ENERGÉTICA En el primer grupo (n = 14), la ingestión energética media es de 2.126 Kcal./día, en el segundo grupo (n = 22) es de 1.601 Kcal./día y en el tercer grupo (n = 14) es de 1.750 Kcal./día. En el primer grupo, la ingestión de nutrientes cubre la recomendación dietética (I.R.) de todos los nutrientes excepto de calcio (89%) y de retinol (61%). La dieta realizada es ligeramente hipercalórica. 70 c En el segundo grupo, la ingestión de nutrientes cubre la recomendación dietética (I.R.) de todos los nutrientes excepto de calcio (88%), de hierro (69%), de retinol (76%) y de ácido fólico (89%). La dieta realizada resulta ser hipocalórica, cubriendo ésta únicamente el 85% de las necesidades diarias. En el tercer grupo, la ingestión de nutrientes cubre la recomendación dietética (I.R.) de todos los nutrientes excepto de retinol (68%). La dieta realizada es ligeramente hipocalórica. La ingestión media de todos los grupos (n=50) es de un 14% en proteínas, de un 40,5% en lípidos y de un 45,5% en carbohidratos (Figura 9). Asimismo, se observa una insuficiente ingestión de fibra (14.5 g diarios de media), siendo el origen de la energía claramente desequilibrado con un exceso de lípidos. Figura 9. Dieta ingerida por los sujetos del estudio: valor medio de los tres grupos. Origen de la energía diaria ingerida (Kcal. en %) 14,0% % kcal. prot 45,5% % kcal. H de C 40,5% % kcal. lip Energía total = 1826 Kcal./día 71 i n c o c i n c o 5.2. SUPLEMENTACIÓN DIETÉTICA: CERVEZA SIN ALCOHOL Los resultados se han obtenido en un colectivo de monjas de clausura a las que se les suplementó diariamente su dieta con 500 ml de cerveza sin alcohol (de fabricación española). Se realizó con cerveza sin debido a que este colectivo suele ser de edad avanzada que toma medicamentos en los que el alcohol está contraindicado. La suplementación tuvo lugar durante un periodo de 45 días sin que se ordenara modificación dietética alguna en paralelo. La dieta de las monjas de clausura era la que seguían motu propio de forma habitual. 5.2.1. METABOLISMO OXIDATIVO: DAÑO A MACROMOLÉCULAS En este estudio hemos valorado la capacidad del aporte suplementario de cerveza sin alcohol en un colectivo de humanos y hemos determinado los niveles de las sustancias que reaccionan con el ácido tiobarbitúrico (TBARS) y contenido en grupos carbonilo antes y después de la suplementación, puesto que es uno de los mejores indicadores de daño oxidativo. El daño oxidativo a lípidos se evaluó mediante la producción de TBARS en plasma, puesto que son productos formados directamente en la reacción de peroxidación lipídica, responsable de la mayoría de los efectos fisiopatológicos relacionados con el estrés oxidativo. En la tabla 2 podemos observar que los valores medios de TBARS antes de la suplementación con cerveza sin alcohol (40,59 ± 8,41) respecto a (33,34 ± 6,20) después de la suplementación. Cuando expresamos los resultados en porcentajes respecto a su control se produce una disminución significativa de un 16% (p<0,005) (Figura 10). Cuando determinamos el contenido en grupos carbonilo, observamos que los valores medios previos a la suplementación son de 4,04 ± 0,79 respecto a 3,32 ± 0,66 después del suplemento con cerveza sin alcohol (Tabla 2). Si expresamos los 72 c resultados en porcentaje se observa una diferencia significativa de un 18% con p<0,005 después del periodo de suplementación (Figura 10), resultados que ponen de manifiesto el efecto que está ejerciendo la cerveza sobre el daño inducido a lípidos y proteínas. Tabla 2. Niveles medios de las sustancias que reaccionan con el ácido tiobarbitúrico procedentes de la peroxidación lipídica (TBARS) y el contenido de grupos carbonilo (GC). Parámetros Valores medios Cerveza sin alcohol TBARS (nmol/mL plasma) Grupos Carbonilo (nmol/mg prot) Fase I Fase II 40,59 ± 8,41 4,04 ± 0,79 33,34 ± 6,20 3,32 ± 0,66 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 29 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con cerveza sin alcohol. Figura 10. Niveles de las sustancias que reaccionan con el ácido tiobarbitúrico procedentes de la peroxidación lipídica (TBARS) y el contenido de grupos carbonilo de las proteínas (GC) antes y después de la suplementación con cerveza sin alcohol. TBARS (nmol/mL plasma) (84)** GC (nmol/mL prot.) (82)** % Respecto a su control 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. **P<0.005 – Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 73 i n c o c i n c o 5.2.2. DEFENSA ANTIOXIDANTE: NIVELES DE GLUTATION REDUCIDO Y α-TOCOFEROL En primer lugar, determinamos los niveles de glutation eritrocitario antes y después de la suplementación. Su principal papel lo ejerce a través de una acción como barredor (scavenger) de los radicales libres ya formados. Su disminución, por lo tanto, nos indica una formación excesiva de radicales oxigénicos que precisan ser contrarrestados con el consiguiente aumento en el consumo orgánico de este antioxidante. En los resultados, podemos observar (Tabla 3) que los valores medios de glutation previos a la suplementación son de 1,30 ± 0,29 respecto a 1,71 ± 0,18 obtenidos después de la suplementación. Cuando determinamos los porcentajes, observamos que se produce un aumento significativo de un 21%, p<0,005 respecto a su control (Figura 11). La vitamina E, en su forma de α-tocoferol, es un antioxidante natural que actúa en fase lipídica. Cuando observamos los resultados medios obtenidos en nuestro estudio, vemos como antes de la suplementación la cifra era de 60,95 ± 13,33, siendo finalmente de 66,94 ± 11,69, lo que representa una variación del 12% (Figura 11). Tabla 3. Niveles medios de glutation (GSH) y α-tocoferol antes y después de la suplementación con cerveza sin alcohol. Parámetros Cerveza sin alcohol GSH (µmol/g Hb) α-tocoferol (nmol/ml plasma) Valores medios Fase I Fase II 1,30 ± 0,29 60,95 ± 13,33 1,71 ± 0,18 66,94 ± 11,69 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 29 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con cerveza sin alcohol. 74 c Figura 11. Niveles de glutatión y a-tocoferol antes y después de la suplementación con cerveza sin alcohol. GSH (µmol/g Hb) (121)** α-tocoferol (nmol/ml plasma) (112)** % Respecto a su control 160 140 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. **P<0.005 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 5.2.3. METABOLISMO LIPÍDICO Respecto al metabolismo lipídico, hemos determinado los niveles medios antes (Fase I) y después de la suplementación (Fase II) (Tabla 4) de los diferentes parámetros estudiados: triglicéridos, colesterol total, HDL-colesterol, LDL-colesterol y LDL oxidada. Asimismo, hemos estudiado separadamente los datos del colesterol total de aquellos sujetos que eran superiores a los 240 mg/dL. En lo referente a los niveles de triglicéridos, los resultados obtenidos nos permiten observar (Figura 12) cómo no se producen cambios significativos al final del periodo de suplementación. Asimismo, tampoco se observan cambios en los niveles de colesterol total; sin embargo, cuando los niveles de colesterol en los sujetos del estudio eran superiores a 240 mg/dL, sí que observamos una disminución 75 i n c o c i n c o significativa (Figura 12) del colesterol total (un 6% con una p<0,05 y unos valores medios iniciales de 265,42 ± 13,53 y de 251,83 ± 19,57 al final del periodo) tras el periodo de suplementación, lo que nos indicaría que la cerveza sin alcohol está ejerciendo un efecto sobre la hipercolesterolemia. No se producen modificaciones significativas en las cifras de HDL-c (Figura 13) ni en las de LDL-c. Sin embargo, se observa una disminución de un 8% (p< 0,05) en el caso de la LDL-c oxidada. Esto nos indica que la cerveza sin alcohol protege a las LDL de su oxidación, lo que puede tener interés dado que se trata de un importante factor de riesgo en la patología cardiovascular. Tabla 4. Suplementación con cerveza sin alcohol: Niveles medios de triglicéridos, colesterol total, HDL-c, LDl-c y LDL oxidada. Parámetros Cerveza sin alcohol Triglicéridos (mg/dL) Colesterol (mg/dL) Colesterol > 240 (mg/dL) HDL (mg/dL) LDL (mg/dL) LDLoxidada (mU/mL) Valores medios Fase I Fase II 93,07 ± 57,30 96,96 ± 37,42 236,79 ± 31,93 236,74 ± 30,21 265,42 ± 13,53 251,83 ± 19,57 75,46 ± 17,28 74,04 ± 19,18 146,00 ± 31,18 147,08 ± 27,35 898,59 ± 192,00 883,84 ± 175,50 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 29 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con cerveza sin alcohol. 76 c Figura 12. Determinación de los niveles de triglicéridos, colesterol total y colesterol > 240 mg/dL antes y después de la suplementación con cerveza sin alcohol. % Respecto a su control Col Total (mg/dL) Col Total > 240 (mg/dL) (100) (94)* TG (mg/dL) (100) 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. *P<0,05 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). Figura 13. Determinación de los niveles de HDL colesterol, LDL colesterol y LDL oxidada antes y después de la suplementación con cerveza sin alcohol. % Respecto a su control HDL (mg/dL) (98) LDL (mg/dL) (95) LDLox (mU/mL) (92)* 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. *P<0,05 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 77 i n c o c i n c o 5.2.4. PARÁMETROS DE INFLAMACIÓN Se ha procedido a determinar los parámetros correspondientes a los complementos C3 y C4, la proteína C reactiva (PCR), las interleukinas 1-α y 6 y el factor de necrosis tumoral (TNF-α). Todos estos datos están disponibles en la Tabla correspondiente (Tabla 5) así como en las figuras (Figuras 14, 15). Tabla 5. Valores medios de los complementos C3 y C4, la proteína C reactiva (PCR), las interleukinas 1-α y 6 y el factor de necrosis tumoral (TNF-α) Parámetros Cerveza sin alcohol C3 (mg/dl) C4 (mg/dL) PCR (mg/dL) IL-1-α (pg/mL) IL-6_ (pg/mL) TNF-α (pg/mL) Valores medios Fase I Fase II 109,04 ± 17,61 21,67 ± 6,09 2,34 ± 1,78 103,93 ± 40,25 3,58 ± 1,58 20,14 ± 5,24 111,74 ± 18,43 21,78 ± 6,04 2,89 ± 1,94 101,87 ± 40,99 3,62 ± 2,02 23,48 ± 5,14 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 29 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con cerveza sin alcohol. No se han encontrado modificaciones significativas, en las diferentes fases, de estos parámetros. Únicamente cabría destacar el aumento (no significativo) de la interleukina 6 (un 17% para valores medios iniciales de 3,58 ± 1,58 y de 3,62 ± 2,02 tras la suplementación) y del factor de necrosis tumoral (un 11% para valores iniciales de 20,14 ± 5,24 y de 23,48 ± 5,14 tras la suplementación). 78 c Figura 14. Niveles de los factores C3, C4 del complemento y PCR antes y después de la suplementación con cerveza sin alcohol. % Respecto a su control C3 (mg/dL) (101) C4 (mg/dL) (99) PCR (mg/dL) (102) 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. Figura 15. Niveles de las interleukinas 1-α, 6 y TNF-α antes y después de la suplementación con cerveza sin alcohol % Respecto a su control IL-1α (pg/mL) (99) IL6 (pg/mL) (117) TNF-α (pg/mL) (111) 180 160 140 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 29 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. 79 i n c o c i n c o 5.3. SUPLEMENTACIÓN DIETÉTICA: LÚPULO Los resultados se han obtenido en un colectivo de monjas de clausura a las que se les suplementó diariamente su dieta con lúpulo (dos cápsulas de 200 mg cada una conteniendo las inflorescencias femeninas). La suplementación tuvo lugar durante un periodo de 30 días. Las correspondientes analíticas sanguíneas nos han permitido estudiar las posibles variaciones de parámetros relacionados con el metabolismo oxidativo, lipídico y parámetros de inflamación. 5.3.1. METABOLISMO OXIDATIVO: DAÑO A MACROMOLÉCULAS Durante la realización de este trabajo, hemos valorado el efecto del aporte suplementario de lúpulo en un colectivo de humanos, determinando para ello los niveles de las sustancias que reaccionan con el ácido tiobarbitúrico (TBARS) así como el contenido en grupos carbonilo antes y después de la suplementación, ya que se trata de uno de los mejores indicadores del daño oxidativo. El daño oxidativo a lípidos se evaluó mediante la producción de TBARS en plasma, puesto que son productos formados directamente en la reacción de peroxidación lipídica, responsable de la mayoría de los efectos fisiopatológicos relacionados con el estrés oxidativo. En la tabla 6 podemos observar que los valores de TBARS antes de la suplementación con lúpulo eran de 37,45 ± 5,61 respecto a un valor de 31,29 ± 5,61 después de la suplementación. Cuando expresamos los resultados en porcentajes respecto a su control, se produce una disminución significativa de un 15% (p<0,005) (Figura 16). Cuando determinamos el contenido en grupos carbonilo, observamos que los valores medios previos a la suplementación eran de 1,69 ± 0,84 respecto a 1,42 ± 0,53 después del suplemento con cerveza sin alcohol (Tabla 6). Si expresamos los 80 c resultados en porcentaje, se observa una diferencia significativa de un 17% con p<0,005 después del periodo de suplementación (Figura 16). Éstos ponen de manifiesto el efecto que está ejerciendo el lúpulo soble el daño inducido a lípidos y proteínas. Tabla 6. Niveles medios de las sustancias que reaccionan con el ácido tiobarbitúrico procedentes de la peroxidación lipídica (TBARS) y del contenido de grupos carbonilo (GC) antes y después de la suplementación con lúpulo Parámetros Valores medios lúpulo TBARS (nmol/mL plasma) GC (nmol/mg prot) Fase I Fase II 37,45 ± 5,61 1,69 ± 0,84 31,29 ± 5,61 1,42 ± 0,53 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 25 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con lúpulo. Figura 16. Niveles de las sustancias que reaccionan con el ácido tiobarbitúrico procedentes de la peroxidación lipídica (TBARS) y el contenido de grupos carbonilo de las proteínas (GC) antes y después de la suplementación con lúpulo. TBARS (nmol/mL plasma) (85)** GC (nmol/mg prot.) (83)** % Respecto a su control 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. **P<0.005 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 81 i n c o c i n c o 5.3.2. DEFENSA ANTIOXIDANTE Hemos procedido a la determinación de glutation eritrocitario antes y después de la suplementación. El papel principal lo ejerce a través de su acción como scavenger de radicales libres. Consecuentemente, su disminución nos indicará una formación excesiva de radicales oxigénicos con el consiguiente aumento del consumo de antioxidantes. Como podemos observar en los resultados, (Tabla 7) los valores medios previos a la suplementación son de 1,51 ± 0,31 respecto a 1,72 ± 0,49 después de la suplementación. Expresado en porcentaje, comprobamos que se produce un aumento significativo de un 16%, p<0,005 respecto a su control (Figura 17). Respecto a los niveles plasmáticos de α-tocoferol observamos los resultados medios (Tabla 7), identificamos unas cifras iniciales de 56,97 ± 10,05 con respecto a unas cifras finales de 63,25 ± 10,48. En consecuencia, el cambio global es del 13% (p<0.005), lo que señala un ahorro en el consumo orgánico de sustancias antioxidantes como el α-tocoferol (Figura 17). Tabla 7. Niveles medios de glutation (GSH) y α-tocoferol antes y después de la suplementación con lúpulo. Parámetros lúpulo GSH (µmol/g Hb) α-Tocoferol (nmol/ml plasma) Valores medios Fase I Fase II 1,51 ± 0,31 56,97± 10,05 1,72 ± 0,49 63,25 ± 10,48 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 25 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con lúpulo. 82 c Figura 17. Niveles de glutation y α-tocoferol antes y después de la suplementación con lúpulo. GSH (µmol/g Hb) (116)** α-tocoferol (nmol/ml plasma) (113)** % Respecto a su control 140 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. **P<0.005 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 5.3.3. METABOLISMO LIPÍDICO Es factible consultar los niveles medios antes y después de la suplementación (Tabla 8) de todos los parámetros estudiados: triglicéridos, colesterol total, HDL-colesterol, LDL-colesterol y LDL oxidada. En lo que respecta a los triglicéridos (Figura 18), los valores iniciales medios (90,56 ± 24,41 mg/dL) se convierten en 75,35 ± 22,86 tras el periodo de suplementación lo que representa una disminución del 16% (p<0.005). En lo que respecta al colesterol total, las cifras iniciales (218,48 ± 34,09) pasan a ser finalmente de 211,00 ± 32,41, lo que significa una disminución del 3% (p<0.05). Se modifican, asimismo, las cifras de HDL-c (Figura 19) (valores iniciales de 72,56 ± 12,09 y finales de 70,96 ± 12,97), lo que no conlleva una variación significativa estadísticamente), de LDL-c (valores iniciales de 127,80 ± 32,50 y finales de 124,97 83 i n c o i n c o ± 29,28), lo que conlleva una disminución del 3% (p<0,05). Respecto a los niveles de anticuerpos frente a las LDL oxidadas, observamos unos valores medios iniciales 700 ± 464 y finales de 602 ± 406, lo que implica, cuando expresamos los resultados en muestras apareadas y porcentajes respecto a su control, una disminución significativa de un 18% (p<0,005) (Figura 19). Tabla 8. Niveles medios de triglicéridos, colesterol total, HDL-c, LDL-c y LDL oxidada antes y después de la suplementación con lúpulo. Parámetros Valores medios lúpulo Triglicéridos (mg/dL) Colesterol (mg/dL) HDL (mg/dL) LDL (mg/dL) LDLoxidada (mU/mL) Fase I Fase II 90,56 ± 24,41 218,48 ± 34,09 72,56 ± 12,09 127,80 ± 32,50 700 ± 464 75,35 ± 22,86 211,00 ± 32,41 70,96 ± 12,97 124,97 ± 29,28 602 ± 406 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 25 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con lúpulo. Figura 18. Determinación de los niveles de triglicéridos y colesterol total antes y después de la suplementación con lúpulo. TG (mg/dL) (84)** Col Total (mg/dL) (97)** 120 % Respecto a su control c 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. **P<0.005 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 84 c Figura 19. Determinación de HDL colesterol, LDL colesterol y LDL oxidasa antes y después de la suplementación con lúpulo. HDL (mg/dL) (98) LDL (mg/dL) (97)* LDLox (mU/mL) (82)* 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. *P<0,05 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 5.3.4. PARÁMETROS DE INFLAMACIÓN Se ha procedido a determinar como marcadores de inflamación los complementos C3 y C4, la proteína C reactiva (PCR), las interleukinas 1-a y 6 y el factor de necrosis tumoral (TNF-a). Los parámetros estudiados reflejan modificaciones en el caso de los factores de complemento C3 (con unos valores iniciales de 121,60 ± 17,30 y unos valores finales de 106,44 ± 13,40) y C4 (con unos valores iniciales de 19,00 ± 7,50 y unos valores finales de 20,00 ± 1,41),(Tabla 9). Cuando expresamos los resultados en porcentajes podemos observar una disminución significativa de un 12%, no siendo significativa (p<0,005) para el C3, ni para el C4 (Figura 20). 85 i n c o c i n c o Destacamos como más significativo lo ocurrido en el caso de la proteína C reactiva (con unos valores iniciales de 3,83 ± 2,63 y unos valores finales de 2,935 ± 1,57), con una disminución (Figura 20) de un 31% (p<0.005). La interleukina 6 (con unos valores iniciales de 2,91 ± 0,85 y unos valores finales de 2,42 ± 0,64) disminuye sus tasas (Figura 21) en un 13% (p<0.005). En el caso de la interleukina 1 (con unos valores iniciales de 77,02 ± 16,28 y unos valores finales de 77,58 ± 10,99) y del factor de necrosis tumoral (con unos valores iniciales de 21,29± 9,4 y unos valores finales de 21,63 ± 6,02), no se han producido cambios significativos (Figura 21). Tabla 9. Valores medios de los complementos C3 y C4, la proteína C reactiva (PCR), interleukinas IL 1- α e IL 6 y el factor de necrosis tumoral (TNF-α) antes y después de la suplementación con lúpulo. Valores medios Parámetros lúpulo C3 (mg/dL) C4 (mg/dL) PCR (mg/dl) IL 1 - α (pg/mL) IL-6 (pg/mL) TNF - α (pg/mL) Fase I Fase II 121,60 ± 17,30 19,00 ± 7,50 3,83 ± 2,63 77,02 ± 16,28 2,91 ± 0,85 21,29± 9,4 106,44 ± 13,40 20,00 ± 1,41 2,935 ± 1,57 77,58 ± 10,99 2,42 ± 0,64 21,63 ± 6,02 Diseño experimental en material y métodos. Los resultados están expresados en media ± SD de 25 experimentos diferentes. Antes (Fase I) y después (Fase II) de la suplementación con lúpulo. 86 c Figura 20. Niveles del factor C3, C4 del complemento y de la proteína C reactiva antes y después de la suplementación con lúpulo. C3 (mg/dL) (88)** C4 (mg/dL) (104) PCR (mg/dL) (69)* 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. *P<0,05 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). **P<0.005 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). Figura 21. Niveles de interleukina 1- α, interleukina 6 y TNF-α antes y después de la suplementación con lúpulo. IL-1α (pg/mL) (99) IL-6 (pg/mL) (87)* TNF-α (pg/mL) (104) 120 100 80 60 40 20 0 Fase I Fase II Diseño experimental en material y métodos. Los resultados están expresados en % respecto a su control (Fase I), de 25 experimentos diferentes. Para el cálculo de la significancia estadística se aplicó el test de la t de Student para muestras apareadas. *P<0,05 Comparando el grupo control antes (Fase I) y después de la suplementación (Fase II). 87 i n c o c i n c o 5.4. ESTUDIO COMPARATIVO ENTRE LA SUPLEMENTACIÓN CON CERVEZA SIN ALCOHOL Y LÚPULO En este estudio hemos puesto en evidencia el efecto de la cerveza sin alcohol y del lúpulo sobre los diferentes parámetros medidos. Cuando hacemos la correlación entre los resultados analíticos obtenidos tras la suplementación con cerveza sin alcohol y con lúpulo (Tabla 10) observamos diferencias que son significativas en varios de los parámetros considerados. Así ocurre en los niveles de triglicéridos y en los parámetros marcadores de inflamación. En el primer caso, la diferencia es claramente significativa (con una p<0,005). En lo que respecta a los datos de inflamación, existen también diferencias en lo relativo al factor C3 del complemento (p<0,005) y a la proteína C reactiva (p<0,005), siempre y en todos los casos de forma favorable al lúpulo. Sin embargo, en lo que respecta a la posible aplicación práctica de estos resultados, lo más sencillo parece decantarse hacia el uso de la cerveza sin alcohol dada la facilidad de su consumo y el volumen que puede ingerirse de la misma sin incomodidad. Además, no presenta prácticamente contraindicaciones en su ingestión por parte de adultos de todas las edades. Por el contrario, el lúpulo únicamente podría formar parte de la dieta en su presentación farmacéutica (cápsulas, etc.) lo que restringiría sin duda su uso. En cualquier caso, dada la cantidad de lúpulo presente en la cerveza (y, por lo tanto, de sus principios activos), es probable que las consecuencias de la ingestión de esta bebida sobre la fisiología se deban más a componentes derivados de los cereales que a los del propio lúpulo, aun siendo estos importantes. Esto no obsta para que sea posible y aún recomendable aumentar la capacidad antioxidante de las cervezas recurriendo a diferentes técnicas cerveceras y a lúpulos especialmente seleccionados con este fin. 88 c Tabla 10. Estudio comparativo entre la cerveza sin alcohol y el lúpulo. Metabolismo oxidativo TBARS ND Grupos carbonilo ND GSH ND α-tocoferol ND Metabolismo lipídico Colesterol total ND Triglicéridos P<0,005 HDL-c ND LDL-c ND LDLoxidada ND Parámetros de inflamación C3 P<0,005 C4 ND PCR P<0,005 IL-1α ND IL-6 ND TNF-α ND Se reflejan en la Tabla lo significativo de la diferencia entre las determinaciones del Estudio tras la suplementación con cerveza sin alcohol y lúpulo. ND: diferencia no significativa. 89 i n c o s e i s DISCUSIÓN En el presente trabajo, se ha estudiado el efecto de la suplementación de la dieta, tanto con cerveza sin alcohol como con cápsulas de lúpulo (Elusan®), en un colectivo dietéticamente controlado, y su relación con el metabolismo oxidativo, y con parámetros indicadores de riesgo cardiovascular y de inflamación propios de la edad avanzada. De los resultados de nuestro trabajo se deduce un papel antioxidante in vivo de la cerveza sin alcohol y del lúpulo. La primera consecuencia que se deriva de ello es que los posibles beneficios obtenidos del consumo moderado de ciertas bebidas alcohólicas fermentadas (cerveza, vino, sidra) que se han referido en estudios anteriores, no se deben exclusivamente a la presencia del alcohol en estas bebidas, si bien están documentados los efectos específicos del alcohol sobre ciertos parámetros, como por ejemplo sobre los marcadores de inflamación en adultos sanos (Mulkamal, 2004). Existen otros compuestos, como los polifenoles y las melanoidinas, en el caso de la cerveza, que son responsables, al menos, de una parte significativa de sus efectos. Es decir, el consumo moderado de las versiones sin alcohol de estas bebidas, en el contexto de una dieta variada y equilibrada, puede tener un efecto beneficioso ante el estrés oxidativo y patologías relacionadas. El envejecimiento es un proceso degenerativo, en el cual participan los radicales libres, y por ello relacionado con patologías tales como problemas cardiovasculares, trastornos neurológicos, procesos inflamatorios, hipertensión, diabetes, cáncer, etc., en las que también está implicado el estrés oxidativo (Dalle-Donne et al., 2006, Sarkar y Fisher, 2006). 6.1. METABOLISMO OXIDATIVO En lo que respecta a los datos obtenidos en este estudio, tras la suplementación con cerveza sin alcohol se produce una disminución significativa en el daño indu- 90 s cido a macromoléculas: lípidos y proteínas, y un aumento significativo en la defensa antioxidante: niveles de glutation reducido (GHS) y alfa-tocoferol. Dichos resultados obtenidos en humanos están corroborados por otros estudios realizados en nuestro grupo, en experimentación animal, con suplementos de cerveza y extractos flavonoideos de la harina de la semilla de uva tras la inducción de un estrés oxidativo a consecuencia de la adriamicina (González-SanJosé et al., 2001; Valls et al., 2005) y a los obtenidos por otros autores (Navarro, 2003; Ameen, 2004; Sahin, 2004; Husain, 2005). Cuando suplementamos con lúpulo obtenemos resultados similares a los de la cerveza, lo que nos indica que existen compuestos con actividad antioxidante que se encuentran específicamente en esta leguminosa. Hay evidencias de que, en animales, los flavonoides se localizan cerca de la superficie de la membrana lipídica para captar los radicales libres y por ello, previenen a ésta de la peroxidación lipídica a consecuencia de radicales oxigénicos acuosos (Terao, 1994). Además, parece demostrada la hipótesis (Verstraeten, 2003) de que las proantocianidinas, precisamente uno de los flavonoides más abundante en la cerveza, podrían ser absorbidas por las membranas celulares, creándose así un medio que limitaría el acceso a las especies radicales a la membrana así como su consiguiente propagación. Esta relación entre el consumo de alimentos o bebidas ricas en polifenoles y el aumento significativo de la capacidad antioxidante del plasma y del contenido de polifenoles en el mismo (Serafini, 1998; Wang, 2000; Rechner, 2002) ha sido previamente documentado por diversos autores, incluyendo su capacidad de inhibir la peroxidación lipídica y de captar radicales libres como el radical hidroxilo, ión supéroxido y radical alcoxilo (Sichel y col., 1991). De hecho, los efectos de la ingestión de alimentos ricos en compuestos fenólicos, como fresas, espinacas, vino tinto, cerveza, etc., se pueden evaluar a corto plazo ya que aumentan de forma evidente la capacidad antioxidante del suero (Cao y col., 1998; Velioglu y col., 1998; Kähkönen y col., 1999), lo que explica en definitiva el creciente interés científico por el papel 91 e i s s e i s dietético de alimentos y bebidas ricos en estos compuestos (Hertog y col., 1995). Dentro de las bebidas que contienen polifenoles hay que destacar la cerveza, cuya actividad antioxidante global oscila entre unos valores mínimos y máximos comprendidos en el intervalo 2-56 mg según la capacidad antioxidante equivalente a la vitamina C (CEAC). Estos resultados indican que se trata de una bebida con una capacidad antioxidante global significativa, ya que posee valores similares a otras bebidas alcohólicas, como el vino, y no alcohólicas, como el mosto. De los estudios realizados se desprende que el tipo de cerveza no influye en el poder antioxidante, ya que cervezas negras, rubias y sin alcohol presentan valores similares (González San José et al., 2001). Cuando nos referimos a la capacidad antioxidante de los polifenoles de la cerveza sin alcohol, es habitual referirse al problema de su biodisponibilidad. En nuestro caso, esta absorción de los polifenoles viene corroborada por trabajos anteriores de nuestro mismo grupo y de otros realizados con cerveza con y sin alcohol. Así, sabemos que los polifenoles junto con alcohol pasan más rápidamente al plasma que cuando proceden de un producto sin alcohol (Lee, 1995; Unno, 1996; Hollman y Katan, 1998; Kivits, 1997; Aziz, 1998; Williamson, 2000). Evaluando la capacidad antioxidante total del plasma en diferentes tiempos (30, 60 y 90 minutos) tras la suplementación con un concentrado de cerveza a animales de experimentación (Valls et al., 2004), se observaba que la actividad antioxidante total era significativamente mayor a los 90 minutos de la ingestión de la cerveza. Estos datos están en concordancia con los datos aportados por Miyagi y colaboradores y Giselli y colaboradores los cuales han demostrado que la cerveza sin alcohol muestra una ligera tendencia a incrementar la actividad antioxidante a los 90 minutos. Sin embargo, durante los primeros 30 minutos, al igual, que ocurre en otros estudios, no existen diferencias entre cerveza con alcohol o sin alcohol. A los 60 minutos hay un menor aumento para la actividad cuando la cerveza es sin alcohol, pero la actividad se recupera e, incluso, aumenta a partir de los 90 minu- 92 s tos (Miyagi, 1997; Ghiselli, 2000; Gorinstein, 2004). Nardini et al. encontraron que esta absorción de ácidos fenólicos se realiza mediante conjugación, dependiendo su grado de la forma química de estos polifenoles: los monohidroxiderivados requieren una conjugación menos intensa que los dehidroxiderivados (Nardini et al., 2006). 6.2. METABOLISMO LIPÍDICO La consecuencia clínica del aumento de lípidos en sangre está relacionada con la posibilidad de desarrollo de lesión vascular. De hecho, el daño vascular puede tener un profundo impacto sobre distintas funciones orgánicas y acabar produciendo numerosas patologías vinculadas a la edad (diabetes, aterosclerosis, hipertensión, etc.). Las células endoteliales de los vasos, debido a su localización, son especialmente vulnerables a las sustancias circulantes agresivas como, por ejemplo, las macromoléculas oxidadas y las citoquinas proinflamatorias. La disfunción endotelial puede aumentar cuando el estrés oxidativo reduce la disponibilidad de óxido nítrico (NO), siendo este un factor esencial para el adecuado tono vascular. En nuestro estudio, observamos que en los niveles de triglicéridos no se producen cambios significativos tras el periodo de suplementación con cerveza sin alcohol. Tampoco se observaron cambios en los niveles de colesterol total, excepto cuando los niveles de colesterol en los sujetos eran superiores a 240 mg/dL, sí podíamos observar una disminución significativa de un 6%, lo que nos indicaría que la cerveza sin alcohol está ejerciendo un efecto sobre la hipercolesterolemia. Resultados que vienen corroborados por otros estudios (Gasowski et al., 2004, Winkler et al., 2006). Para algunos autores, su efecto sería incluso similar al del vino tinto (Kondo, 2004). 93 e i s s e i s En este punto hay que señalar que Degrace et al., en 2006, afirma que dosis moderadas de cerveza ingeridas de forma continuada podía tener un efecto beneficioso frente al desarrollo de la aterosclerosis (Degrace et al., 2006). Adicionalmente a los niveles elevados de colesterol sanguíneo, la presencia de LDL oxidada se ha revelado como la clave del desarrollo de la aterosclerosis (Podrez et al., 2000). Las lipoproteínas oxidadas se han vinculado con la formación de superóxidos. Respecto a los niveles de LDL oxidada, sí que se observaba con la suplementación con cerveza sin alcohol una disminución de un 8% respecto a su control (p<0,05). Esto nos podría indicar que la cerveza sin alcohol protege a las LDL de su oxidación, lo que puede tener interés dado que esta lipoproteína es un importante factor de riesgo en la patología cardiovascular. No conviene olvidar que la capacidad antioxidante de la cerveza sobre las lipoproteínas es mayor que cuando se estudia este efecto con polifenoles extraídos de la cerveza, lo que sugiere una posible sinergia entre las sustancias naturalmente presentes en la bebida, como podrían ser el caso de los folatos (Vinson et al., 2003). Cuando suplementamos con lúpulo, pudimos observar una disminución significativa (p<0,005) en los niveles de triglicéridos y en el colesterol total (p<0,05). Este hallazgo ha sido confirmado por otros autores, como Shimura, que realizaron estudios utilizando animales de experimentación y comprobando en ellos cómo el lúpulo reducía los niveles de triglicéridos plasmáticos (Shimura et al., 2005), sugiriendo incluso que este efecto podría deberse a la acción reguladora del lúpulo sobre la expresión de genes implicados en la oxidación hepática de los lípidos. Las lipoproteínas HDL-c no experimentaban modificaciones significativas, pero sí es cierto que en lo que respecta a las LDL-c hay una disminución significativa (p<0,05) del 3% que llega hasta el 18% cuando se considera a la LDL oxidada (p<0,005). En experimentación animal, este efecto no se ha confirmado por otros autores que sí lo han hecho en relación con el efecto sobre las HDL-c incremen- 94 s tando sus concentraciones (Miura et al., 2005) o, más genéricamente, mejorando el metabolismo lipídico (Kondo, 2004). A este respecto, recordemos que es conocida la habilidad de los polifenoles para reducir la sensibilidad de los lípidos a la oxidación. Así, la ingestión de zumo de uva ha demostrado que reduce la susceptibilidad de la LDL a oxidarse en pacientes con enfermedad coronaria (Stein et al., 1999). También hay evidencias concluyentes, in vitro, del efecto del extracto de vino tinto, vino blanco, mosto y cerveza sobre la inhibición de la oxidación de la LDL-c (Puddey et al., 1998), una inhibición que es proporcional al contenido de polifenoles de las bebidas citadas y que coincide con la hallada por otros autores que detallaron la inhibición de la oxidación de la LDL por el resveratrol (Frankel et al., 1993). Hemos hallado referencias al posible efecto positivo de diferentes tipos de cerveza, incluyendo las cervezas sin alcohol, sobre ciertos parámetros del metabolismo lipídico (Winkler et al., 2006). También en este caso se plantean discordancias al haberse publicado estudios donde no se observaban modificaciones en la oxidación de la LDL pese a la ingestión de polifenoles (Zenebe et al., 2003). Esto nos hace suponer que el efecto de los polifenoles sobre la oxidación de la LDL puede variar en función de su estructura, el tipo de dieta, la dosis ingerida y otros factores aún no bien conocidos. A este respecto, los estudios epidemiológicos han mostrado una correlación inversa entre el contenido en polifenoles de la dieta y un menor riesgo de enfermedades cardiovasculares (Ulbricht y Southgate, 1991; Curin y Andriantsitohaina, 2005). 6.3. PARÁMETROS MARCADORES DE INFLAMACIÓN En personas de edad avanzada se han observado, en plasma, concentraciones más elevadas de sustancias como las interleukinas (IL-1, IL-6) y el factor de 95 e i s s e i s necrosis tumoral (TNF) que en el de personas más jóvenes (Pedersen et al., 2000). En nuestro trabajo, observamos que no se producen cambios significativos en los factores de complemento (C3 y C4), proteína C reactiva (PCR), interleukinas 1-α y 6 y factor de necrosis tumoral (TNF-α), tras la suplementación con cerveza sin alcohol. Cuando la suplementación la realizamos con lúpulo, los parámetros estudiados reflejan modificaciones en el caso de los factores de complemento C3 y C4, significativamente (p<0,005) en el caso del C3, con una disminución del 12%, y no significativamente en el C4. Más significativo aún es lo ocurrido en el caso de la proteína C reactiva, la cual disminuye en un 31% (p<0,005). La interleukina 6 disminuye sus tasas en un 13% (p<0,005) sin que haya cambios apreciables en el resto de los parámetros. Los polifenoles pueden disminuir algunos marcadores de inflamación como son TNF-α, IL-1 e IL-6 (Eugui et al., 1993) o aumentar los antagonistas de ciertos receptores como los de IL-1 (Waters et al., 1993). También que la suplementación mediante extractos vegetales ricos en polifenoles pueden inhibir la formación de TNF-α (Yuan et al., 2006; Zi et al., 1997). En relación con todo esto, sabemos desde tiempo atrás que la presencia en la dieta de ciertos antioxidantes, entre ellos los polifenoles, puede tener una actividad antiinflamatoria (Manthey et al., 2001), tal vez al modular la producción de óxido nítrico a partir del endotelio vascular así como por interferir en los mecanismos de inflamación que conducirían a la disfunción endotelial (Curin y Andriantsitohaina, 2005). De hecho, tanto la ciclooxigenasa (COX) como la lipooxigenasa están implicadas en la liberación de ácido araquidónico, el cual es responsable de la producción, por parte de células inflamatorias como los neutrófilos, de citoquinas como la IL-1. Algunos polifenoles, como la quercetina, han demostrado que son capaces de inhibir la ciclooxigenasa y lipooxigenasa 96 s (Kim et al., 1998). Otro polifenol, como el resveratrol, pueden tener una acción antiinflamatoria al inhibir la síntesis de prostaglandinas (Martínez y Moreno, 2000). En lo que respecta al posible papel de la cerveza sobre los parámetros de inflamación, algunos autores afirman haber encontrado en sus estudios evidencias suficientes (Winkler et al. en 2006 y Gasowski et al. en 2004) de su actuación. Para Levitan et al., el efecto sobre la PCR (en forma de “U” en su representación gráfica de la correlación inversa que se daría entre ingestión de alcohol y PCR) se debería exclusivamente a la presencia de alcohol en la dieta, siendo además este efecto independiente del tipo de bebida (Levitan et al., 2005). Es la misma conclusión a la que llegó Imhof en 2004 al estudiar los marcadores de inflamación en tres diferentes regiones europeas dentro del estudio MONICA (Imhof et al., 2004). Los datos de nuestro trabajo ponen de manifiesto que otros compuestos, diferentes al alcohol, ejercen un papel significativo sobre los marcadores de inflamación, estando estos compuestos, principalmente contenidos en el lúpulo. 6.4. CAPACIDAD ANTIOXIDANTE COMPARADA DE LA CERVEZA SIN ALCOHOL Y DEL LÚPULO Si comparamos ambos resultados, observamos como la suplementación con cerveza sin alcohol modifica los parámetros marcadores del metabolismo oxidativo y lipídico (LDL oxidada), mientras que tras la suplementación con lúpulo se modifican, además, otros parámetros del metabolismo lipídico (triglicéridos, colesterol total y LDL), y parámetros de inflamación, tales como: factor de complemento C3, proteína C reactiva, interleukina 6. Cuando se correlacionan ambos resultados (Tabla 10), se comprueba que la diferencia entre ambos modos es significativa, a favor del lúpulo, únicamente en 97 e i s s e i s lo que respecta a los resultados de triglicéridos, proteína C reactiva y factor C3 del complemento. Dichos resultados nos indican que en el caso del lúpulo, materia prima de la cerveza, existen componentes que no se extraen en el transcurso del proceso tecnológico de producción cervecera. Estas sustancias pueden jugar un papel importante en determinadas patologías. En cualquier caso, las diferencias existentes entre cerveza y lúpulo no son finalmente tan considerables, teniendo en cuenta además que se trata de un proceso de extracción, y que, por otra parte, la cerveza es una bebida de un gran consumo y de más fácil ingestión que el lúpulo. 98 s CONCLUSIONES Basándonos en los datos obtenidos en este estudio estadístico llegamos a las conclusiones que se enumeran a continuación: 1. En las condiciones de nuestra investigación, tanto la ingestión de cerveza sin alcohol como la de lúpulo conllevan beneficios sobre el metabolismo oxidativo, aumentando las concentraciones de GSH y α-tocoferol y disminuyendo el daño inducido a lípidos y proteínas. 2. Respecto al metabolismo lipídico, la ingestión de cerveza sin alcohol disminuye los niveles de colesterol total (en aquellos sujetos que tenían tasas de colesterol, al inicio, superiores a 240 mg/dL) así como los niveles de LDL oxidada. Por su parte, el lúpulo disminuye, además, los niveles de triglicéridos, colesterol total y de las LDL colesterol. 3. En lo que se refiere a los parámetros de inflamación, la ingestión de cerveza sin alcohol no produce ningún efecto. En cambio, la suplementación con lúpulo conlleva beneficios sobre ciertos parámetros marcadores de inflamación, disminuyendo las concentraciones de la fracción C3 del complemento, la proteína C reactiva y la interleukina 6. 4. El consumo regular, en el contexto de una dieta equilibrada, de cerveza sin alcohol puede ser beneficioso al disminuir alguno de los factores de riesgo cardiovascular (LDL-oxidadas). Este beneficio puede manifestarse tanto en el ámbito de la prevención como al incorporarse en la dieta de los pacientes dislipémicos. 99 i e t e s i e t e 5. El efecto beneficioso sobre la salud atribuido a las bebidas tradicionales fermentadas, y en este caso a la cerveza, no se debe únicamente a la presencia de alcohol sino, fundamentalmente, a su contenido en antioxidantes. 6. Para mejorar la capacidad antioxidante de la cerveza sin alcohol, los fabricantes deberían controlar los procesos tecnológicos para obtener una mejor extracción de estos compuestos, con actividad oxidante, procedentes del lúpulo. 7. En una dieta adecuada, el consumo de cerveza sin alcohol por parte de adultos sanos puede contribuir a la reducción de patologías asociadas con la edad y, por lo tanto, conseguir un envejecimiento más saludable. 100 bibliografía BIBLIOGRAFÍA 1 Ader P, Grenacher B, Langguth P, Scharrer E, Wolffram S.Cinnamate uptake by rat small intestine: transport kinetics and transepithelial transfer. Exp Physiol 1996; 81: 9443-55. 2 Alvarado C, Álvarez P, Puerto M, Gausseres N, Jimenez L, De la Fuente M. Dietary supplementation with antioxidants improves functions and decreases oxidative stress of leukocytes from prematurely aging mice. Nutrition. 2006 Jul-Aug;22(7-8):767-77. 3 Ameen M, Ahmad I, Musthapa MS, Rahman Q. Cytotoxic effect and role of exogenous antioxidants in carpet dust mediated toxicity in rat hepatocytes in vitro. Toxicol In Vitro. 2004 Aug;18(4):419-25. 4 Ames BN, Frei B, Stocker R and England L. Ascorbate: the most effective antioxidant in human blood plasma. Adv Exp Med Biol 1990; 264: 155-163. 5 Arjmandi BH. The role of phytoestrogens in the prevention and treatment of osteoporosis in ovarian hormone deficiency. J Am Coll Nutr. 2001 Oct;20(5 Suppl):398S-402S; discussion 417S-420S. 6 Arnaud J, Fortis I, Blachier S, Kia D and Favier A. Simultaneous determination of retinal, alfa-tocopherol and beta-carotene in serun by isocratic high-performance liquid chromatography. J Chromatography (1991), 572:103-116. 7 Aziz AA, Edwards CA, Lean ME, Crozier A. Absorption and excretion of conjugated flavonols, including quercetin-4'-O-beta-glucoside and isorhamnetin-4'-O-beta-glucoside by human volunteers after the consumption of onions. Free Radic Res. 1998 Sep;29(3):257-69. 8 Babbs CF. Free radicals and the etiology of colon cancer. Free Radic Biol Med, 1990;8:191-200. 9 Bannister JV. Foreword. Handbook of methods of oxygen radical research. Boca Ratón,Florida USA: RA Greenwald ed. CRC Press. 1986. 10 Barnes S. Effect of genistein on in vitro and in vivo models of cancer. J. Nutr. 125; 1995: 777S783S. 11 Basu A, Devaraj S, Jialal I. Dietary factors that promote or retard inflammation. Arterioscler Thromb Vasc Biol. 2006 May;26(5):995-1001. Epub 2006 Feb 16. 12 Beckman KB, Ames BN. The free radicals theories of aging matures. Physiol Rev 1998; 547-581. 13 Betteridge DJ. Diabetic dyslipidaemia. Diabetes Obes Metab, 2000; Suppl 1:S31-6. 14 Betteridge J. What is de Oxidative Stress?. Metabolism 2000; 49 (2) S1: 3-8. 15 Bobak M, Skodova Z, Marmot M. Effect of beer drinking on risk of myocardial infarction: population based case-control study. BMJ. 1995; 320: 1378–1379. 101 bibliografía 16 Boyle SP, Dobson VL, Duthie SJ, Kyle JA and Collins AR. Absorption and DNA protective effects of flavonoid glycosides from an onion meal. Eur J Nutr 2000; 39: 213-223. 17 Bravo L. Polyphenols: Chemistry, dietary sources, metabolism and nutritional significance. Nutr Rev 1998; 56: 317-333. 18 Brighenti F, Valtueña S, Pellegrinif N, Ardigó D, Del Río D, Salvatore S, Piatti PM, Serafini M, Zavaroni I. Total antioxidant capacity of the diet is inversely and independently related to plasma concentrations of hig-sensitivity C-reactive protein in adult italian subjets. Br J Nutr. 2005 Jun;93(5):619-625. 19 Browning LM, Jebb SA. Nutritional influences on inflammation and type 2 diabetes risk. Diabetes Technol Ther. 2006 Feb;8(1):45-54. 20 Cao G, Russell RM, Lischner N, Prior RL. Serum antioxidant capacity is increased by consumption of strawberries, spinach, red wine or vitamin C in elderly women. J Nutr 1998; 128: 2383-2390. 21 Carlson NG, Rose JW. Antioxidants in multiple sclerosis: do they have a role in therapy? CNS Drugs. 2006;20(6):433-41. 22 Carpenter KL, Wilkins GM, Fussell B, Ballantine JA, Taylor SE, Mitchinson MJ, Leake DS. Production of oxidized lipids during modification of low-density lipoprotein by macrophages or copper. Biochem J. 1994 Dec 1;304 ( Pt 2):625-33. 23 Cassidy A, Hansley B, Lamuela-Raventos RM. Isoflavones, lignan and stillbenes-origins, metabolism and potential importance to human health. J Sci Food Agric 2000; 80: 1044-1062. 24 Cerveceros de España. Informe económico, datos del sector 2003. [Accedido en mayo 2006] Disponible en URL: http://www.cerveceros.org/cm/resource/doc/dossiercerveceros.pdf. 25 Chan TS, Galati G, Pannala AS, Rice-Evans C and O´Brien PJ. Free Rad Res, 2003; 37:787-794. 26 Chuyen NV. Maillard reaction and food processing. Application aspects. Adv Exp Med Biol 1998; 434: 213-235. 27 Clifford MN. Anthocianidins-nature, ocurrence an dietary burden. A Sci Food Agric 2000; 80: 10631072. 28 Craig WJ 1996. Phytochemicals: guardians of our health. J. Am. Diet. Assoc. 97: S199-S204. 29 Curin Y, Andriantsitohaina R. Polyphenols as potential therapeutical agents againts cardiovascular diseases. Pharmacological reports, 2005, 57, suppl. 97-107. 102 bibliografía 30 Dalle-Donne I, Rossi R, Colombo R, Giustarini D and Milzani A. Biomarkers of oxidative damage in human disease. Clin Chem, 2006; 52:601–623. 31 Davies KJA. Oxidative stress: The paradox of aerobic life. Biochem Soc Symp 1995; 61: 1-31. 32 Day AJ, Canada FJ, Diaz JC. Dietary flavonoid and isoflavona glycosides are hydrolyzed by the lactase site of lactase phlorizinhydrolase. FEBS Letter 2000; 468: 166-170. 33 Day AJ, DuPont MS, Ridley S. Deglycosylation of flavonoid and isoflavonoid glycosides by human small intestine and liver b-glycosidase activity. FEBS Letter 1998; 436: 71-5. 34 Degrace P, Moindrot B, Mohamed I, Gresti J, Clouet P. Moderate consumption of beer reduces liver triglycerides and aortic cholesterol deposit in LDLr-/- apoB100/100 mice. Atherosclerosis, 2006;189(2):328-35. 35 Demple B, and Harrison L. Repair of oxidative damage to DNA: enzymology and biology. Annu Rev Biochem 1994; 63: 915-948. 36 Dittrich R, El-Massry F, Kunz K, Rinaldi F, Peich C, Beckmann MW. Pischetsrieder M. Maillard reaction products inhibit oxidation of human low-density lipoproteins in vitro. J Agric Food Chem 2003; 51: 3900-3904. 37 Domenicali M, Vendemiale G, Serviddio G, Grattagliano I, Pertosa AM, Nardo B, Principe A, Viola A, Trevisani F, Altomare E, Bernardi M, Caraceni P. Oxidative injury in rat fatty liver exposed to ischemia-reperfusion is modulated by nutritional status. Dig Liver Dis. 2005 Sep;37(9):689-97. 38 Dunstan JA, Breckler L, Hale J, Lehmann H, Franklin P, Lyonso G, Ching SY, Mori TA, Barden A, Prescott SL. Associations between antioxidant status, markers of oxidative stress and immune responses in allergic adults. Clin Exp Allergy. 2006 Aug;36(8):993-1000. 39 Eri S, Khoo BK, Lech J, Hartman TG. Direct thermal desorption-gas chromatography and gas chromatography-mass spectrometry profiling of hop (Humulus lupulus L.) essential oils in support of varietal characterization. J Agric Food Chem. 2000 Apr;48(4):1140-9. 40 Escola-Gil JC, Calpe-Berdiel L, Ribas V, Blanco-Vaca F. Moderate beer consumption does not change early or mature atherosclerosis in mice. Nutr J. 2004 Jan 15;3:1. 41 Eugui EM, Delustro B, Rouhafza S, Wilhelm R, Allison AC. Coordinate inhibition by some antioxidants of TNF alpha, IL-1 beta, and IL-6 production by human peripheral blood mononuclear cells. Ann N Y Acad Sci. 1993 Nov 30;696:171-84. 103 bibliografía 42 Faist V, Erbersdobler HF. Metabolic transit and in vivo effects of melanoidins and precursor compounds deriving from the Maillard reaction. Ann Nutr Metab 2001; 45: 1-12. 43 Font Quer P. Plantas medicinales. El Dioscórides renovado. Labor Ed. Barcelona, 1983. 44 Frankel EN, Waterhouse AL, Kinsella JE: Inhibition of human LDL oxidation by resveratrol. Lancet, 1993, 341, 1103–1104. 45 Fridovich I, Handler P. Detection of free radicals generated during enzymic oxidations by the initation of sulfite oxidation. J Biol Chem 1961; 236: 1836-40. 46 Fridovich I. Superoxide and evolution. J. Biochem Biophys,1974; 1: 1-37. 47 Fridovich I. The biology of oxygen radicals. Science 1978; 201: 875-880. 48 Friedman M. Food browning and its prevention: an overview. J Agric Food Chem 1996; 44: 631-653. 49 Frolich S, Schubert C, Bienzle U, Jenett-Siems K. In vitro antiplasmodial activity of prenylated chalcone derivatives of hops Humulus lupulus) and their interaction with haemin. J Antimicrob Chemother. 2005 Jun;55(6):883-7. Epub 2005 Apr 11. 50 Fu X, Mueller DM, Heinecke JW. Generation of intramolecular and intermolecular sulfenamides, sulfinamides, and sulfonamides by hypochlorous acid: a potential pathway for oxidative cross-linking of low-density lipoprotein by myeloperoxidase. Biochemistry. 2002 Jan 29;41(4):1293-301. 51 Galati G, O'Brien PJ. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radic Biol Med, 2004; 37(3):287-303. 52 Gasowski B, Leontowicz M, Leontowicz H, Katrich E, Lojek A, Ciz M, Trakhtenberg S, Gorinstein S. The influence of beer with different antioxidant potential on plasma lipids, plasma antioxidant capacity, and bile excretion of rats fed cholesterol-containing and cholesterol-free diets. J Nutr Biochem. 2004 Sep;15(9):527-33. 53 Gerhauser C. Broad spectrum antiinfective potential of xanthohumol from hop (Humulus lupulus L.) in comparison with activities of other hop constituents and xanthohumol metabolites. Mol Nutr Food Res. 2005 Sep;49(9):827-31. 54 Geronikaki AA, Gavalas AM. Antioxidants and inflammatory disease: synthetic and natural antioxidants with anti-inflammatory activity. Comb Chem High Throughput Screen. 2006 Jul;9(6):425-42. 55 Ghiselli A, Serafini M, Natella F, Scaccini C. Total antioxidant capacity as a tool to assess redox status: critical view and experimental data. Free Radic Biol Med 2000; 29(11): 1106-1114. 104 bibliografía 56 Gille L, Staniek K, Nohl H. Effects of tocopheryl quinone on the heart: model experiments with xanthine oxidase, heart mitochondria, and isolated perfused rat hearts. Free Radic Biol Med. 2001 Apr 15;30(8):865-76. 57 Giugliano D, Ceriello A, Esposito K. The effects of diet on inflammation: emphasis on the metabolic syndrome. J Am Coll Cardiol. 2006 Aug 15;48(4):677-85. Epub 2006 Jul 24. 58 González-San Jose ML, Muñiz P y Valls V. En: Actividad antioxidante de la cerveza: estudios in vitro e in vivo. Madrid: Centro de Información Cerveza y Salud. Monografía. 2001. 59 Gorinstein S, Zemser M, Weisz M, Haruenkit R, Trakhtenberg S. The influence of dry matter of different alcoholic beberages on lipis, proteins and antioxidant activity in serum of rats. J Nutr Biochem 1998; 15(9):131-135. 60 Gunzerath L, Faden V, Zakhari S, Warren K. National Institute on Alcohol Abuse and Alcoholism report on moderate drinking. Alcohol Clin Exp Res. 2004 Jun;28(6):829-47. 61 Halliwell B, Gutteridge JM. Free Radicals in biology and Medicine. Second ed. New York: Oxford University Press. 1989. 62 Halliwell B. Antioxidants in Human Health and Disease. Annual Review Nutrition 1996; 16: 33.50. 63 Halliwell B. Free radicals, antioxidants, and human disease. Curioxity, cause, or consequence?. The Lancet 1994; 334: 721-724. 64 Halliwell B, Rafter J, Jenner A. Health promotion by flavonoids, tocopherols, tocotrienols, and other phenols: direct or indirect effects? Antioxidant or not? Am J Clin Nutr, 2005; 81(1 Suppl):268S276S. 65 Hanneken A, Lin FF, Johnson J, Maher P. Flavonoids protect human retinal pigment epithelial cells from oxidative-stress-induced death. Invest Ophthalmol Vis Sci. 2006 Jul;47(7):3164-77. 66 Heim KE, Tagliaferro AR, Bobilya DJ. Flavonoid antioxidants: chemistry, metabolism and structureactivity relationships. J Nutr Biochem 2002; 13: 572-584. 67 Heinecke JW. Is lipid peroxidation relevant to atherogenesis? J Clin Invest. 1999 Jul;104(2):135-6. 68 Heinecke JW. Lipoprotein oxidation in cardiovascular disease: chief culprit or innocent bystander? J Exp Med. 2006 Apr 17;203(4):813-6. 69 Heinecke JW. Oxidized amino acids: culprits in human atherosclerosis and indicators of oxidative stress. Free Radic Biol Med. 2002 Jun 1;32(11):1090-101. Review. 105 bibliografía 70 Herman C, Adlercreutz H, Goldin BR, Gorbach SL, Höckerstedt KAV, Watanabe S. 1995. Soybean phytoestrogen intake and cancer risk. J. Nutr. 125: 757S-770S. 71 Hertog MG, Feskens EJ, Hollman PC, Katan MB, Kromhout D. Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet. 1993 Oct 23;342(8878):1007-11. 72 Hertog MG, Hollman PC, Katan MB, Kromhout D: Intake of potentially anticarcinogenic flavonoids and their determinants in adults in The Netherlands. Nutr Cancer, 1993, 20, 21–29. 73 Hertog MGL, Kromhout D, Aravanis C, Blackburn H, Bucina R, Fidanza F. 1995. Flavonoid intake in long-term risk of coronary heart disease and cancer in the Seven Countries Study. Arch. Intern. Med. 155: 381-386. 74 Hocman G. Prevention of cancer: vegetables and plants. Comp. Biochem. Physiol. 1989 93B: 201212. 75 Hollman PC, Katan MB. Health effects and bioavailability of dietary flavonol. Free Radic Res 1999; 31S: 75-80. 76 Hollman PCH, Katan MB. Absorption, metabolism and bioactivity of flavonoids. En: Flavonoids in health and disease. New York: Dekker, M., (Ed.)1998. p. 447-467. 77 Horcajada-Molteni MN, Crespy V, Coxam V, Davicco MJ, Remesy C, Barlet JP. Rutin inhibits ovariectomy-induced osteopenia in rats. J Bone Miner Res. 2000 Nov;15(11):2251-8. 78 Husain K, Mejia J, Lalla J, Kazim S. Dose response of alcohol-induced in BP, nitroc oxide and antioxidants in rat plasma. Pharm Res 2005; 337-343. 79 Imhof A, Woodward M, Doering A, Helbecque N, Loewel H, Amouyel P, Lowe GD, Koenig W. Overall alcohol intake, beer, wine, and systemic markers of inflammation in western Europe: results from three MONICA samples(Augsburg, Glasgow, Lille). Eur Heart J. 2004 Dec;25(23):2075-6. 80 Jones DP, Coates RJ, Flagg EW, Eley JW, Block G, Greenberg RS, Gunter EW, Jackson B. Glutathione in foods listed in the National Cancer Institute's Health Habits and History Food Frequency Questionnaire. Nutr Cancer. 1992;17(1):57-75. 81 Justesen U, Knuthsen P, Leth T: Determination of plant polyphenols in Danish foodstuffs by HPLCUV and LC-MS detection. Cancer Lett, 1997, 114, 165–167. 82 Kähkönen MP, Hopia AI, Vuorela HJ, Rauha JP, Pihlaja K, Kujala TS, Heinonen M. 1999. Antioxidant activity of plant extracts containing phenolic compounds. J. Agric. Food Chem. 47: 3954-3962. 106 bibliografía 83 Kamzalov S, Sohal RS. Effect of age and caloric restriction on coenzyme Q and alpha-tocopherol levels in the rat. Exp Gerontol. 2004 Aug;39(8):1199-205. 84 Keller C, Fullerton J, Mobley C. Supplemental and complementary alternatives to hormone replacement therapy. J Am Acad Nurse Pract. 1999 May;11(5):187-98. 85 Keukeleire D, Milligan S.R, Kalita J.C, Pocock V, De Cooman L, Heyerick A, Rong, H., Roelens, F., 2001. Prenylated flavonoids are key agents in relation to health-beneficial properties of beer. Proceedings of the 28th International Congress of the European Brewery Convention, Budapest, Hungary. 86 Keys A. Mediterranean diet and public health: personal reflections. Am J Clin Nutr. 1995 Jun;61(6 Suppl):1321S-1323S. 87 Kim HP, Mani I, Iversen L, Ziboh VA: Effects of naturally-occurring flavonoids and biflavonoids on epidermal cyclooxygenase and lipoxygenase from guineapigs. Prostaglandins Leukot Essent Fatty Acids, 1998, 58, 17–24. 88 Kivits GA, Van der Sman FJP, Tijburg LBM. Analysis of catechins from green and black tea in humans: a specific and sensitive colorimetric assay of total catechins in biologicla fluids. Int J Food Sci Nutr 1997; 48:387-392. 89 Kondo K. Beer and health: preventive effects of beer components on lifestyle-related diseases. Biofactors. 2004;22(1-4):303-10. 90 Kuhnau J: The flavonoids. A class of semi-essential food components: their role in human nutrition. World Rev Nutr Diet, 1976, 24, 117–191. 91 Lakenbrink C, Lapczynski S, Maiwald B, Engelhardt UH. Flavonoids and other polyphenols in consumer brews of tea and other caffeinated beverages. J Agric Food Chem 2000; 48: 2848-52. 92 Laughton MJ, Evans PJ, Moroney MA, Hoult JR, Halliwell B. Inhibition of mammalian 5-lipoxygenase and cyclo-oxygenase by flavonoids and phenolic dietary additives. Relationship to antioxidant activity and to iron ion-reducing ability. Biochem Pharmacol. 1991 Oct 9;42(9):1673-81. 93 Lee KS, Kim SR, Park SJ, Min KH, Lee KY, Jin SM, Yoo WH, Lee YC. Antioxidant down-regulates IL-18 expression in asthma. Mol Pharmacol. 2006 Jul 5; [Epub ahead of print]. 94 Lee MJ, Wang ZY, Li H, Chen L, Sun Y, Gobbo S. et al. Analysis of plasma and urinary tea polyphenols in human subjects. Cancer Epidemol Biomarkers prev 1995; 4(4):393-4. 107 bibliografía 95 Leighton F. [Plant Polyphenols, science and welfare] Biol Res. 2000;33(2):vi. 96 Levine RL, Garland D, Oliver CN, Amici A, Climent I, Lenz A et al. Determination of carbonyl content in oxidatively modified proteins. Ed by: ED. Parker L and Glazer A. in: Methods in Enzymology. 1980. Academic Press, Inc. Vol. 186 pp: 464-479. 97 Levitan EB, Ridker PM, Manson JE, Stampfer MMJ, Buring JE, Cook NR, Liu S Association between consumption of beer, wine, and liquor and plasma concentration of high-sensitivity C-reactive protein in women aged 39 to 89 years. Am J Cardiol. 2005 Jul 1;96(1):83-8. 98 Lindsay DG, Astley SB. European research on the functional effects of dietary antioxidants- EUROFEDA. Mol Aspects Med 2002; 23:1-38. 99 Lyons-Wall P, Autenzio P, Lee E, Moss R, Gie S, Samman S. Catechins are the major source of flavonoids in a group of Australian women. Asia Pac J Clin Nutr. 2004;13(Suppl):S72. 100 Manach C, Scalbert A, Morand C, Rémésy C, Jiménez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr, 2004; 79: 727-47. 101 Manthey JA, Grohmann K, Guthrie N. Biological properties of citrus flavonoids pertaining to cancer and inflammation. Curr Med Chem. 2001 Feb;8(2):135-53. 102 Maral, J., Puget, K., Michelson, A. M. (1977). Comparative study of superoxide dismutase, catalase and glutathione peroxidase levels in erythrocytes of different animals. Biochem Biophys Res Commun, 77 (4): 1525-35. 103 Martinez J, Moreno JJ: Effect of resveratrol, a natural polyphenolic compound, on reactive oxygen species and prostaglandin production. Biochem Pharmacol, 2000, 59, 865–70. 104 Mataix JV. Nutrición y alimentación humana. Situaciones fisiológicas y patológicas. Vol. 2. Ed 1ª. Ergon. Madrid: Majadahonda. 2002. 105 Mazza. Alimentos funcionales. Aspectos bioquímicos y de procesados. Zaragoza, Acribia, 2000. 106 Meltzer HM, Malterud KE. Can dietary flavonoids influence the development of coronary heart disease? Scan. J. Nutr. 1997; 41: 50-57. 107 Middleton E, Kandaswami C, Theoharis CT. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease and cancer. Pharmacol Reviews, 2000; 52:673-751. 108 Milligan S, Kalita J, Pocock V, Heyerick A, De Cooman L, Rong H, De Keukeleire D. Oestrogenic activity of the hop phyto-oestrogen, 8-prenylnaringenin. Reproduction. 2002 Feb;123(2):235-42. 108 bibliografía 109 Miura Y, Hosono M, Oyamada C, Odai H, Oikawa S, Kondo K. Dietary isohumulones, the bitter components of beer, raise plasma HDL-cholesterol levels and reduce liver cholesterol and triacylglycerol contents similar to PPARalpha activations in C57BL/6 mice. Br J Nutr. 2005 Apr;93(4):559-67. 110 Miyagi Y, Miwa K, Inou H. Inhibition of human low-density lipoprotein oxidation by flavonoids in red wine and grape juice. Am J Cardiol 1997; 80(12):1627-1631. 111 Mukamal KJ, Chung H, Jenny NS, Kuller LH, Longstreth WT Jr, Mittleman MA, Burke GL, Cushman M, Psaty BM, Siscovick DS. Alcohol consumption and risk of coronary heart disease in older adults: the Cardiovascular Health Study. J Am Geriatr Soc. 2006 Jan;54(1):30-7. 112 Mukamal KJ, Cushman M, Mittleman MA, Tracy RP, Siscovick DS. Alcohol consumption and inflammatory markers in older adults: the Cardiovascular Health Study. Atherosclerosis. 2004 Mar;173(1):79-87. 113 Muñiz P, Sáez P, Iradi A, Viña J, Oliva MR, Saez GT. Differences between cysteine and homocysteine in the induction of deoxyribose degradation and DNA damage. Free Radic Biol Med 2001; 30(4): 354-362. 114 Nair MP, Mahajan S, Reynolds JL, Aalinkeel R, Nair H, Schwartz SA, Kandaswami C. The flavonoid quercetin inhibits proinflammatory cytokine (tumor necrosis factor alpha) gene expression in normal peripheral blood mononuclear cells via modulation of the NF-kappa beta system. Clin Vaccine Immunol. 2006 Mar;13(3):319-28. 115 Nardini M, Natella F, Scaccini C, Ghiselli A. Phenolic acids from beer are absorbed and extensively metabolized in humans. J Nutr Biochem. 2006 Jan;17(1):14-22. Epub 2005 Oct 19. 116 Navab M, Anantharamaiah GM, Reddy ST, Van Lenten BJ, Ansell BJ, Fogelman AM. Mechanisms of Disease: proatherogenic HDL--an evolving field. Nat Clin Pract Endocrinol Metab. 2006 Sep;2(9):504-11. 117 Navarro A, Gomez C, López - Cepero JM, Boveris A. Beneficial effects of moderate exercise on mice aging: survival, behavior, oxidative stress and mitochondrial electron transfer. Am J Physiol Regul Integr Comp Physiol 2003; 286:R505-R511. 118 Nestle M. Mediterranean diets: historical and research overview. Am J Clin Nutr. 1995 Jun;61(6 Suppl):1313S-1320S. 119 Ozgova S, Hermanek J, Gut I. Different antioxidant effects of polyphenols on lipid peroxidation and hydroxyl radicals in the NADPH-, Fe-ascorbate- and Fe-microsomal systems. Biochem Pharmacol. 2003 Oct 1;66(7):1127-37. 109 bibliografía 120 Park SJ, Lee YC. Antioxidants as novel agents for asthma. Mini Rev Med Chem. 2006 Feb;6(2):23540. 121 Pedersen BK, Bruunsgaard H, Ostrowski K, Krabbe K, Hansen H, Krzywkowski K, Toft A, Sondergaard SR, Petersen EW, Ibfelt T and Schjerling P. Cytokines in aging and exercise. Intl J Sports Med, 2000; 21 Suppl 1:S4-9. 122 Pitsavos C, Panagiotakos DB, Tzima N, Chrysohoou C, Economou M, Zampelas A, Stefanadis C Adherence to the Mediterranean diet is associated with total antioxidant capacity in healthy adults: the ATTICA study. Am J Clin Nutr. 2005 Sep;82(3):694-9. 123 Podrez EA, Abu-Soud HM and Hazen SL. Myeloperoxidase-generated oxidants and atherosclerosis. Free Radic Biol Med, 2000; 28:1717–1725. 124 Pryor WA. Free radicals in Biology. En Pryor, W.A.(Ed.) New York; Academic press . 1976. Vol 1 p. 1277. 125 Puddey IB, Croft KD, Abdu-Amsha Caccetta R, Beilin LJ. Alcohol, free radicals and antioxidants. Novartis Found Symp. 1998;216:51-62; discussion 63-7, 152-8. 126 Rechner AR, Kuhnle G, Hu H, Roedig-Penman A, van den Braak MH, Moore KP, Rice-Evans CA. The metabolism of dietary polyphenols and the relevance to circulating levels of conjugated metabolites. Free Radic Res. 2002 Nov;36(11):1229-41. 127 Rice-Evans C. Flavonoids and Isoflavones: Absorption, Metabolism, and Bioactivty. Free Radic Biol Med 2003; 36(7): 827-828. 128 Rice-Evans CA, Miller NJ, Paganga G. Structure-antioxidant activity relationship of flavonoids and phenolic acids. Free Radic Biol Med 1996; 20: 933-956. 129 Rimm EB, Klatsky A, Grobbee D, Stampfer MJ. Review of moderate alcohol consumption and reduced risk of coronary heart disease: is the effect due to beer, wine, or spirits? BMJ. 1996; 312:731736. 130 Rivero D, Perez-Magarino S, Gonzalez-Sanjose ML, Valls-Belles V, Codoner P, Muniz P. Inhibition of induced DNA oxidative damage by beers: correlation with the content of polyphenols and melanoidins. J Agric Food Chem. 2005 May 4;53(9):3637-42. 131 Sahin E, Gumuslu S. Alterations in brain antioxidant status, protein oxidation and lipid peroxidation in response to different stress models. Behav Brain Res. 2004 Dec 6;155(2):241-8. 110 bibliografía 132 Santos MT, Valle J., Azmar T. Valoración espectrofotométrica del MDA plasmático basal. Rev Diag Biol. Vol 1 pg 57-59 1980. 133 Sarkar D and Fisher PB. Molecular mechanisms of aging-associated inflammation. Cancer Letters, 2006; 236:13-23. 134 Sartori AA, Jiricny J. Enzimology of base excision repair in the hyperthermophilic archaeon Pyrobaculum aerophilum J Biol Chem 2003; 278(27): 24563-76. 135 Sener G, Ozer Sehirli A, Ipci Y, Cetinel S, Cikler E, Gedik N, Alican I. Taurine treatment protects against chronic nicotine-induced oxidative changes. Fundam Clin Pharmacol. 2005 Apr;19(2):15564. 136 Serafini M, Maiani G, Ferro-Luzzi A. Alcohol-free red wine enhances plasma antioxidant capacity in humans. J Nutr. 1998 Jun;128(6):1003-7. 137 Shimura M, Hasumi A, Minato T, Hosono M, Miura Y, Mizutani S, Kondo K, Oikawa S, Yoshida A. Isohumulones modulate blood lipid status through the activation of PPARalpha. Biochim Biophys Acta. 2005 Sep 5;1736(1):51-60. 138 Sichel G, Corsaro C, Scalia M, De Bilio AJ, Bonomo RP. In vitro scavenger activity of some flavonoids and melanins against O2. Free Rad. Biol. Med. 1991; 11: 1-8. 139 Sies H. Oxidative stress: introductory remarks. En: Sies, H. (Ed.) Oxidative stress. Orlando: Academic Press. 1985. p. 1-7. 140 Sofic E, Rustembegovic A, Kroyer G, Cao G. serum antioxidant capacity in neurological, psychiatric, renal diseases and cardiomyopathy. Journal of neural transmission 2002; 109()5-6: 711-719. 141 Spencer JPE, Abd El Mohsen MM, Rice-Evans C. Cellular uptake and metabolism of flavonoids and tjeir metabolites: implications for their bioactivity. Archives Biochem Biophis, 2004; 423:148-161. 142 Spiteller G. The relation of lipid peroxidation processes with atherogenesis: a new theory on atherogenesis. Mol Nutr Food Res. 2005 Nov;49(11):999-1013. 143 Stahl W, van der Berg H, Arthur J, Bast A, Dainty J, Faulks RM. Bioavailability and metabolism. Mol Aspects Med 2002; 23(2): 39-100. 144 Stein JH, Keevil JG, Wiebe DA, Aeschlimann S, Folts JD: Purple grape juice improves endothelial function and reduces the susceptibility of LDL cholesterol to oxidation in patients with coronary artery disease. Circulation, 1999, 100, 1050–1055. 111 bibliografía 145 Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL. Beyond cholesterol. Modifications of low-density lipoprotein that increase its atherogenicity. N Engl J Med. 1989 Apr 6;320(14):915-24. 146 Stevens JF, Taylor AW, Clawson JE, Deinzer ML. Fate of xanthohumol and related prenylflavonoids from hops to beer. J Agric Food Chem. 1999 Jun;47(6):2421-8. 147 Sugar LM. Inflammation and prostate cancer. Can J Urol. 2006 Feb;13 Suppl 1:46-7. 148 Tardif J. Antioxidants: The good, the bad and the ugly. Can J Cardiol. 2006 Feb;22 Suppl B:61B-5B. 149 Terao J, Piskula M, Yao Q. Protective effect of epicatechin, epicatechin gallate, and quercetin on lipid peroxidation in phospholipid bilayers. Arch Biochem Biophys. 1994 Jan;308(1):278-84. 150 Tian L, Cai Q, Wei H. Alterations of antioxidant enzymes and oxidative damage to macromolecules in different organs rats during aging. Free Radical Biol Med. 1991; 24 (9):1477-1484. 151 Tomas-Barberan JJ, Clifford MN. Flavanones, chalcones and dihydrochalcones-nature, occurrence an dietary burden. J Sci Food Agric 2000; 80: 1073-80. 152 Ulbricht TL, Southgate DA. Coronary heart disease: seven dietary factors. Lancet, 1991; 338 (8773):985-92. 153 Unno T, Kondo K, Itakura H, Takeo T. Analysis of (-)-epigallocatechin gallate in human serum obtained after ingesting green tea. Biosci Biotechnol Biochem. 1996 Dec;60(12):2066-8. 154 Valls Bellés V, Codoñer Franch P, González San José ML, Muñiz Rodríguez P. Biodisponibilidad de los flavonoides de la cerveza. Efecto antioxidante "in vivo”: en ratas y en patologías humanas relacionadas con los radicales libres. Monografía ed. Centro de Información Cerveza y Salud, Madrid (en prensa). 155 Valls-Bellés V ,Torres-Rodríguez MC, Muñiz P, Boix L, González-Sanjose ML, Codoñer-Franch P. The protective effects of melanoidins in adriamycin-induced oxidative stress in rat isolated hepatocytes. J Sci Food Agric 2004; 80: 1701-1707. 156 Valls-Bellés V, Castellucio C, Fato R, Genova ML, Bovina C, Saez G et al. Protectove effect of exogenous coenzyme Q against damage by adriamycin in perfused rat liver. Biochem Mol Biol Int 1994; 33(4): 633-642. 157 Van der Gaag MS, van Tol A, Vermunt SH, Scheek LM, Schaafsma G, Hendriks HF. Alcohol consumption stimulates early steps in reverse cholesterol transport. J Lipid Res. 2001 Dec;42(12):2077-83. 112 bibliografía 158 Van Hoorn DE, Nijveldt RJ, Van Leeuwen PA, Hofman Z, M'Rabet L, De Bont DB, Van Norren K. Accurate prediction of xanthine oxidase inhibition based on the structure of flavonoids. Eur J Pharmacol. 2002 Sep 13;451(2):111-8. 159 Velioglu YS, Mazza G, Gao L, Oomah BD. 1998. Antioxidant activity and total phenolics in selected fruits, vegetables and grain products. J. Agric. Food Chem. 46:4113-4117. 160 Verstraeten SV, Keen CL, Schmitz HH, Fraga CG, Oteiza PI. Flavan-3-ols and procyanidins protect liposomes against lipid oxidation and disruption of the bilayer structure. Free Radic Biol Med. 2003 Jan 1;34(1):84-92. 161 Verzele M, De Keukeleire D. Chemistry and Analysis of Hop and Beer Bitter Acids. Developments in Food Science, 1991. Vol. 27 162 Vinson JA, Mandarano M, Hirst M, Trevithick JR, Bose P. J Agric Food Chem. 2003 Aug 27;51(18):5528-33. Phenol antioxidant quantity and quality in foods: beers and the effect of two types of beer on an animal model of atherosclerosis. 163 Vitrac X, Monti JP, Vercauteren J, Deffieux G, Merillon JM. Direct liquid chromatography analysis of resveratrol derivatives and flavanols in wines with absorbance and fluorescence detection. Anal Chim Acta 2002; 458: 103-10. 164 Wang JF, Schramm DD, Holt RR, Ensunsa JL, Fraga CG, Schmitz HH, Keen CL. A dose-response effect from chocolate consumption on plasma epicatechin and oxidative damage. J Nutr. 2000 Aug;130(8S Suppl):2115S-9S. 165 Wannamethee SG, Lowe GD, Rumley A, Bruckdorfer KR, Whincup PH. Associations of vitamin C status, fruit and vegetable intakes, and markers of inflammation and hemostasis. Am J Clin Nutr. 2006 Mar;83(3):567-74; quiz 726-7. 166 Waters RV, Webster D, Allison AC. Mycophenolic acid and some antioxidants induce differentiation of monocytic lineage cells and augment production of the IL-1 receptor antagonist. Ann N Y Acad Sci. 1993 Nov 30;696:185-96. 167 WHO. Informe sobre la salud en el mundo, 2002. Reducir los riesgos y promover una vida sana. OMS. Ginebra, 2002. 168 Willett WC. The Mediterranean diet: science and practice. Public Health Nutr. 2006 Feb;9(1A):10510. 113 bibliografía 169 Williamson G, Scarlbert A. Dietary intake and bioavailability of polyphenols. J Ntr 2000; 130: 2073S-2085S. 170 Winkler C, Wirleitner B, Schroecksnadel K, Schennach H, Fuchs D. Beer down-regulates activated peripheral blood mononuclear cells in vitro. Int Immunopharmacol. 2006 Mar;6(3):390-5. Epub 2005 Sep 29. 171 Yuan GJ, Gong ZJ, Sun XM, Zheng SH, Li X. Tea polyphenols inhibit expressions of iNOS and TNFalpha and prevent lipopolysaccharide-induced liver injury in rats. Hepatobiliary Pancreat Dis Int. 2006 May;5(2):262-7. 172 Zenebe W, Pechanova O and Andriantsitohaina R. Red wine polyphenols induce vasorelaxation by increased nitric oxide bioactivity. Physiol Res, 2003; 52 (4):425-32. 173 Zi X, Mukhtar H, Agarwal R. Novel cancer chemopreventive effects of a flavonoid antioxidant silymarin: inhibition of mRNA expression of an endogenous tumor promoter TNF alpha. Biochem Biophys Res Commun. 1997 Oct 9;239(1):334-9. 174 Zmijewski JW, Landar A, Watanabe N, Dickinson DA, Noguchi N, Darley-Usmar VM. Cell signalling by oxidized lipids and the role of reactive oxygen species in the endothelium. Biochem Soc Trans. 2005 Dec;33(Pt 6):1385-9. 114 El Centro de Información Cerveza y Salud recomienda en todo momento un consumo responsable de cerveza