Hoja 2 - Universidad Autónoma de Madrid
Anuncio

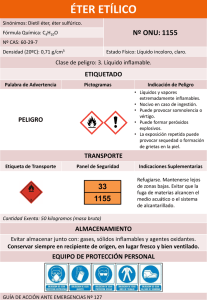
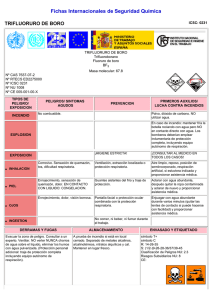
UNIVERSIDAD AUTONOMA DE MADRID Aspectos complementarios de las teorías de enlace Problemas Hoja nº 2 Tema 2 Fuerzas intermoleculares 1. De las dos sustancias, BrI y BrCl una es un sólido a t.a. y la otra es un gas. ¿Cómo podría explicarse este hecho? 2. Para cada una de las siguientes sustancias comentar si el enlace de hidrógeno sería una importante fuerza intermolecular: NH3, CH4, C 6H5OH, CH3COOH, H 2S. 3. ¿Cuál de las sustancias de cada grupo cabe esperar que tenga el mayor P eb.? a) C3H8, CO2, CH3CN. b) Hexano, 1-hexanol c) NH3, H2O, HF d) Hexano, 2,2-dimetil-1-butanol, 1-butanol 4. Algunos productos químicos utilizados como repelentes de polillas son: naftaleno (a veces denominado con el nombre antiguo de naftalina), p-diclorobenceno (1,4diclorobenceno), alcanfor (una terpenocetona bicíclica) y hexacloroetano (1,1,1,2,2,2hexacloroetano). Las formulas químicas y estructurales de estos compuestos se muestran en la Tabla 1. El alcanfor ha sido utilizado para ahuyentar a las polillas desde tiempos históricos. Después del uso de la “naftalina”, cada vez se usa más el pdiclorobenceno. El hexacloroetano ha tenido un uso más limitado. Tabla 1. Algunas sustancias características empleadas como repelentes de polillas. Sustancia antipolilla Fórmula estructural Naftaleno 1,4diclorobenceno Cl Cl Alcanfor H3C Cl Cl Peso molecular (g/mol) Punto de fusión (ºC) Punto de ebullición (ºC) C10H8 128,2 80 218 C6H4Cl2 147,0 53 175 C10H16O 152,2 178 204 C2Cl6 236,7 CH3 H3C Hexacloroetano Fórmula química O Cl C C Cl Cl Cl 187 (sublima) Justifica, de acuerdo con el tipo de fuerzas intermoleculares predominante, por qué los productos antipolilla son sólidos que subliman y tienen un olor penetrante característico. 5. ¿Cuál de las sustancias de cada grupo cabe esperar que tenga el mayor P f.? a) Pentano o dietil éter. b) 1-pentanol o 3,3-dimetilpentano c) Fenol, Metanol, LiOH, NaOH. 6. Indica los tipos de fuerzas intermoleculares que existen entre las moléculas siguientes: a) Benceno b) CH3Cl c) PF3 d) NaCl e) CS2 7. El éter dietílico tiene un Pe de 34ºC y el 1-butanol de 117ºC. Los dos compuestos tienen el mismo número y tipo de átomos. ¿A qué se debe esta diferencia tan acusada en el Pe? 8. El trifluoruro de boro, BF 3, es un gas de punto de ebullición –99.9ºC. Comercialmente se vende como “trifluoruro de boro-eterato”, un compuesto que se forma cuando el trifluoruro de boro se disuelve en éter dietílico. El éter hierve a 35ºC, el “trifluoruro de boro-eterato” hierve a 126ºC. a) ¿Por qué el trifluoruro de boro reacciona tan rápidamente con el éter dietílico? Indica la interacción entre los orbitales implicados. b) ¿Por qué el “trifluoruro de boro-eterato”, tiene un punto de ebullición mucho más alto que los compuestos que se combinan para formarlo?