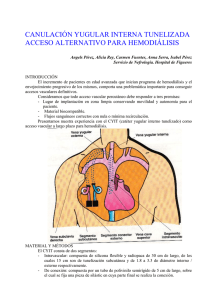
Infecciones relacionadas con cateteres
Anuncio

AVANCES EN ENFERMEDADES INFECCIOSAS Publicado por la Sociedad Andaluza de Enfermedades Infecciosas (http://www.saei.org/) Volumen 12, suplemento 1 2011 DOCUMENTO DE CONSENSO SOBRE INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Coordinadores: José Manuel Lomas Cabezas. Hospital Juan Ramón Jiménez. Huelva. Rafael Luque Márquez. Hospitales Universitarios Virgen del Rocío. Sevilla. Redactores: Francisco Javier Martínez Marcos. Hospital Juan Ramón Jiménez. Huelva. Salvador Pérez Cortés. Hospital del SAS de Jerez. Jerez de la Frontera. Cádiz. Carmen Hidalgo Tenorio. Hospital Universitario Virgen de las Nieves. Granada. Josefa Ruiz Morales. Hospital UniversitarioVirgen de la Victoria. Málaga. Francisco Javier de la Torre Lima. Hospital Costa del Sol. Marbella. Málaga. Mariam Noureddine López. Hospital Costa del Sol. Marbella. Málaga. José María Reguera Iglesias. Hospital Regional Carlos Haya. Málaga. Antonio José Plata Ciézar. Hospital Regional Carlos Haya. Málaga. Juan Gálvez Acebal. Hospital Universitario Virgen Macarena. Sevilla. Radka Ivanova Georgieva. Hospital Universitario Virgen de la Victoria. Málaga. María Victoria García López. Hospital Universitario Virgen de la Victoria. Málaga. Arístides de Alarcón González. Hospitales Universitarios Virgen del Rocío. Sevilla. Grupo para el Estudio de las Infecciones Cardiovasculares de la SAEI. Octubre 2011 Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 2 ______________________________________________________________________________ INDICE 1. OBJETIVOS Y METODOLOGÍA DEL DOCUMENTO……………………………………... 4 2. FUENTES Y ANÁLISIS DE LA INFORMACIÓN CIENTÍFICA ............................................ 4 3. GENERALIDADES Y EPIDEMIOLOGÍA DE LAS INFECCIONES ASOCIADAS A LOS CATÉTERES VASCULARES........................................................................................................ 4 4. ETIOLOGÍA Y PATOGENIA .................................................................................................... 8 5. DIAGNÓSTICO .......................................................................................................................... 8 5a. Toma de muestras, transporte y procesamiento en las BRC .................................................. 9 5b. Criterios diagnósticos microbiológicos.................................................................................. 9 5c. Técnicas microbiológicas utilizadas en las infecciones asociadas a catéter ........................ 9 5d. Recomendaciones................................................................................................................. 11 6. TRATAMIENTO ANTIMICROBIANO .................................................................................. 12 6a. Tratamiento antimicrobiano empírico de la sospecha de bacteriemia asociada a catéter .... 12 6b. Recomendaciones específicas por gérmenes ....................................................................... 15 6b1. Staphylococcus aureus ................................................................................................... 15 6b2. Staphylococcus coagulasa negativo ............................................................................... 17 6b3. Enterococcus spp. ......................................................................................................... 17 6b4. Candida spp. .................................................................................................................. 18 6b5. Bacilos gram negativos .................................................................................................. 19 7. COMPLICACIONES DE LAS INFECCIONES RELACIONADAS CON CATÉTER .......... 22 7a. Tromboflebitis supurada ...................................................................................................... 22 7a1. Definición y clasificación............................................................................................... 22 7a2. Epidemiología y patogenia............................................................................................. 22 7a3. Etiología ......................................................................................................................... 23 7a4. Clínica ............................................................................................................................ 23 7a5. Pruebas diagnósticas....................................................................................................... 23 7a6. Tratamiento .................................................................................................................... 24 8. MANEJO DE LA INFECCIÓN ASOCIADA A CATÉTER VENOSO PERIFÉRICO........... 26 9. MANEJO DE LA INFECCIÓN ASOCIADA A CATÉTERES VENOSOS CENTRALES PERMANENTES........................................................................................................................... 27 9a. Tratamiento de la infección local ......................................................................................... 28 9b. Tratamiento de la infección sistémica.................................................................................. 28 9c. Manejo de la infección sistémica conservando el catéter. Papel del sellado con antimicrobianos y del recambio sobre guía................................................................................ 28 9c1. Experiencia clínica en el tratamiento de la infección del catéter venoso mediante sellado con antimicrobianos ............................................................................................................... 29 9c2. Sellado con antimicrobianos en hemodiálisis ................................................................ 30 9c3. Hemocultivos de control cuando se realiza sellado........................................................ 30 9c4. Renovación del sellado................................................................................................... 30 9c5. Utilización de anticoagulantes en el sellado................................................................... 31 9c6. Efectos adversos asociados al sellado ............................................................................ 31 9c7. Antimicrobianos para el sellado ..................................................................................... 31 9c8. Sellado con antisépticos ................................................................................................. 33 9c9. Manejo específico por microorganismos ....................................................................... 33 10. PREVENCIÓN DE LAS INFECCIONES ASOCIADAS A CATÉTERES VASCULARES 35 10a. Formación y entrenamiento de los profesionales sanitarios............................................... 35 10b. Lugar anatómico de inserción del catéter venoso central .................................................. 35 10c. Material del catéter............................................................................................................. 36 10d. Antisepsia cutánea.............................................................................................................. 36 10e. Métodos barrera (técnica aséptica)..................................................................................... 36 Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 3 ______________________________________________________________________________ 10f. Apósitos .............................................................................................................................. 36 10g. Manejo de conexiones y conectores................................................................................... 37 10h. Manejo de las luces no utilizadas....................................................................................... 37 10i. Heparinización de CVC ...................................................................................................... 37 10j. Catéteres venosos centrales recubiertos de antisépticos y/o antimicrobianos .................... 38 10k. Profilaxis antibiótica sistémica .......................................................................................... 38 10l. Profilaxis con sellado de antimicrobianos .......................................................................... 38 10m. Recambio de catéteres....................................................................................................... 39 10n. Estancia para colocación de catéteres venosos centrales ................................................... 39 BIBLIOGRAFÍA ........................................................................................................................... 42 ÍNDICE DE ABREVIATURAS COMUNES BRC: bacteriemia relacionada con catéter CVC: catéter venoso central CVP: cateter venoso periférico CCIP: catéter central de inserción periférica CCT: catéter venoso central tunelizado SA: sellado con antimicrobianos BGN: bacilos gram negativos SCN: Staphylococcus coagulasa-negativo TSAC: tromboflebitis supurada asociada a catéter AGRADECIMIENTOS Al Dr. José Luis del Pozo, especialista en Enfermedades Infecciosas de la Clínica Universidad de Navarra. Su ayuda en el desarrollo del apartado de sellado con antimicrobianos ha sido muy importante. A los Dres. Jesús Rodríguez Baño, director de la UGC de Enfermedades Infecciosas del Hospital Universitario Virgen Macarena, José Miguel Cisneros Herreros, Jefe de Sección del Servicio de Enfermedades Infecciosas de los Hospitales Universitarios Virgen del Rocío y Manuel Torres Tortosa, Jefe de Sección de Enfermedades Infecciosas del Hospital Punta de Europa. Su revisión crítica del documento lo ha enriquecido notablemente. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 4 ______________________________________________________________________________ 1. OBJETIVOS Y METODOLOGÍA DEL DOCUMENTO El objetivo del documento es facilitar una guía en el manejo de las infecciones relacionadas con catéteres vasculares en la que discutiremos la importancia de lograr un diagnóstico microbiológico correcto y un adecuado tratamiento empírico inicial, las opciones que nos permitirían conservar el catéter y la duración del tratamiento antimicrobiano. Este documento está dirigido al manejo de los pacientes con infecciones relacionadas con los catéteres vasculares, con objeto de reducir la morbimortalidad de esta entidad, además de ayudar a la prescripción racional de la antibioterapia para minimizar los costes ecológicos derivados del uso indiscriminado de los fármacos de amplio espectro. Los usuarios diana de este documento son todos aquellos que participan en la cadena de atención de estos pacientes, especialmente: personal de enfermería, médicos de los Servicios de Cuidados Críticos y Urgencias, Infectólogos, especialistas en Medicina Interna, personal de Unidades de Hospitalización Domiciliaria, especialistas en el uso de Nutrición Parenteral, Oncólogos, Hematólogos, Nefrólogos y Radiólogos Intervencionistas. 2. FUENTES Y ANÁLISIS DE LA INFORMACIÓN CIENTÍFICA Como método de elaboración de esta Guía se propuso un equipo compuesto por especialistas en Medicina Interna, expertos en Enfermedades Infecciosas que forman parte del Grupo para el Estudio de las Infecciones Cardiovasculares de la Sociedad Andaluza de Enfermedades Infecciosas (SAEI). El borrador se elaboró, con un formato y metodología predefinidos, que con fecha 05.05.2011 se difundió a través del portal de Internet de la SAEI, para su estudio por todos los miembros de esta sociedad y el envío de sugerencias al coordinador del documento, mediante correo electrónico. Con las sugerencias recibidas, el grupo de trabajo elaboró el borrador final, que fue debatido en la sesión de trabajo de la SAEI de junio de 2011. La versión actual, documento oficial de la SAEI, se ha finalizado a partir de las modificaciones introducidas a partir de dicha reunión. Este documento está basado en la evidencia científica. Para graduar ésta se han seguido los estándares de calidad propuestos por la Infectious Diseases Society of America 1: 1. Calidad de la evidencia. - Grado I: Evidencia desde al menos un ensayo controlado y aleatorizado, bien diseñado. - Grado II: Evidencia desde al menos un ensayo bien diseñado sin aleatorización, desde estudios analíticos de cohortes o casos y controles (preferiblemente de más de un centro), desde múltiples series temporales, o desde resultados muy evidentes en experimentos no controlados. - Grado III: Evidencia desde las opiniones de expertos respetados, basada en la experiencia clínica, estudios descriptivos, o comités de expertos. 2. Potencia de la recomendación. - Categoría A: Buena evidencia que apoya la recomendación de uso. - Categoría B: Moderada evidencia que apoya la recomendación de uso. - Categoría C: Pobre evidencia para apoyar la recomendación de uso o contra su uso. - Categoría D: Moderada evidencia que apoya la recomendación contra su uso. - Categoría E: Buena evidencia que apoya la recomendación contra su uso. 3. GENERALIDADES Y EPIDEMIOLOGÍA DE LAS INFECCIONES ASOCIADAS A LOS CATÉTERES VASCULARES 3.1. Epidemiologia e incidencia de las infecciones asociadas a los catéteres vasculares Los catéteres venosos son imprescindibles en la práctica médica actual. Sin embargo, su presencia constituye una potencial fuente de infección que puede ocasionar complicaciones locales y sistémicas. Las primeras, comprenden la infección del túnel de inserción y la flebitis supurativa mientras que entre las segundas se incluyen las bacteriemias relacionadas con el catéter (BRC) y las complicaciones metastásicas (endocarditis, osteomielitis, Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 5 ______________________________________________________________________________ abscesos cerebrales o pulmonares, endoftalmitis). Todas estas complicaciones alteran la evolución normal del proceso del paciente, añadiendo morbimortalidad e incrementando la estancia y el gasto sanitario. La mayoría de estudios epidemiológicos acerca de la utilización de catéteres vasculares y sus complicaciones están realizados sobre catéteres venosos centrales (CVC) y en unidades de cuidados intensivos (UCI). En Estados Unidos (EE.UU.) se estima que cada año se colocan 300 millones de catéteres, de los cuales 3 millones son CVC 2, 3. Entre 50.000 y 120.000 pacientes en EE.UU. adquieren un BRC nosocomial anualmente, y dichas tasas se han ido incrementando con el paso de los años 4-6. Las tasas de BRC dependen fundamentalmente del tamaño y tipo de hospital y de la clase de catéter o dispositivo colocado. Un análisis prospectivo de 49 hospitales en EE.UU., desde 1995 a 2002, evaluó 24.179 bacteriemias nosocomiales 7, destacando una incidencia de 60 casos por 10.000 admisiones hospitalarias siendo la presencia de dispositivos intravasculares el factor predisponente más frecuente. Actualmente, cerca del 30% de las infecciones nosocomiales están relacionadas con un catéter intravascular 8. La mayoría de estudios utilizan la BRC como medida de la infección del catéter y se recomienda que las tasas de BRC se expresen en episodios de BRC/1.000 días de catéter. Una reciente revisión sistemática de 200 estudios prospectivos estimó esta tasa de incidencia, que oscilaba entre 0.5 para catéter venoso periférico (CVP), 1.6 para CVC de larga duración, 1.7 para catéteres arteriales, 2.1 para catéteres centrales de inserción periférica (CCIP) y 2.7 para CVC de corta duración 9. La BRC supone el 12% de las bacteriemias nosocomiales en estudios de prevalencia 10 y es la responsable del 10-20% de las infecciones nosocomiales 11,12. El 90% de las bacteriemias nosocomiales son causadas por CVC 13. En nuestro país, según los datos del EPINE 1990-1999, la frecuencia de BRC ha aumentado en los últimos años, convirtiéndose en una de las infecciones nosocomiales con más prevalencia en nuestros hospitales (11-22% de todas las infecciones) 14. El estudio ENVIN, que da información sobre infección nosocomial en pacientes ingresados en Unidades de Cuidados Intensivos (UCI), pone de manifiesto unas tasas de BRC, de 5 episodios/1.000 días de catéter 15. En general los CVP se asocian a un riesgo de infección mucho menor que los CVC, sin embargo ocasionan gran morbilidad por la frecuencia con la que se usan. 3.2. Tipos de catéteres y riesgo de bacteriemia en relación con los mismos Los catéteres de inserción intravascular pueden clasificarse, según su localización, en arteriales o venosos. Los de inserción arterial son más utilizados para la monitorización hemodinámica y la obtención de muestras. Los catéteres venosos se utilizan principalmente para la administración de fármacos, sueroterapia, nutrición parenteral total, derivados hematológicos y hemodiálisis. Con respecto al material, los de teflón o poliuretano se asocian con menos complicaciones infecciosas que los catéteres de clorhidrato de polivinilo o polietileno 16. Se recomienda el uso del menor número de luces suficientes para el manejo del paciente (IB) 17,18. Una segunda forma de clasificar los catéteres diferencia según la ubicación, la cual se correlaciona con el riesgo de bacteriemia. Así se distingue entre periféricos y centrales 19,20. Catéteres periféricos: • Venoso: insertado normalmente desde vena del antebrazo o de la mano estimándose la tasa de bacteriemias en 0.5 por 1000 días de catéter 9,23. Figura 1. Catéter venoso periférico 21,22 . El riesgo de bacteriemia es bajo, Figura 2. Catéter venoso central Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 6 ______________________________________________________________________________ • Arterial: dispositivo de corta duración generalmente usado para la monitorización hemodinámica y para determinar niveles gasométricos en pacientes críticos. Se insertan normalmente a través de arteria braquial, aunque pueden localizarse también en arteria femoral, axilar, braquial o tibial posterior. El riesgo de bacteriemia es similar al de los CVC, 1.7 por cada 1000 días de catéter 9. • Catéter de línea media antecubital: catéter periférico, de tamaño variable aproximado de entre 7.6 y 20.3 cm, que se inserta por vía antecubital hasta el segmento proximal de la vena basílica o cefálica, que no penetra en venas centrales y queda en el segmento distal de las mismas. El más conocido y usado es el Venocath®. Se asocia con bacteriemia con una incidencia de 0.2 por 1000 días de catéter 9,24. Catéteres venosos centrales: definido por los CDC como aquel dispositivo de acceso vascular que termina en el corazón o en una gran vena del tórax 25. • Catéter venoso central no tunelizado: es el más usado dentro de los CVC. Se inserta percutáneamente en venas centrales (yugular interna, subclavia o femoral). Generalmente de longitud superior a 8 cm. Suponen el 90% de las BRC, siendo el riesgo de bacteriemia de 2.7 por 1000 días de catéter 9. La localización yugular aumenta el riesgo de infección aunque presenta menores complicaciones mecánicas 26. La localización en subclavia se relaciona con menor riesgo de infección aunque presenta más complicaciones como neumotórax, punción traqueal, punción arterial y lesión nerviosa periférica 26-28 (IA). La localización femoral se recomienda en niños pues en adultos presenta mayor riesgo de trombosis venosa profunda y complicaciones infecciosas 29. • Catéter arterial pulmonar: insertado a través de un introductor de teflón suelen mantenerse una media de 3 días. Dependiendo de la talla del paciente, suelen medir más de 30 cm. El uso de heparina reduce los eventos trombóticos en el catéter así como la adherencia microbiana al mismo. La incidencia de bacteriemia es similar a la de un CVC, 2.6 por cada 1000 días de catéter en el caso de los heparinizados y de 5.2 en los no heparinizados 9,30 . • Catéter central de inserción periférica (CCIP): alternativa al catéter de subclavia o yugular, su inserción es a través de una vena periférica (cefálica, basílica, radial accesoria) hasta la vena cava superior. Miden por lo general más de 20 cm. El más conocido y usado es el Drum®. Los principales inconvenientes son la dificultad de infundir grandes volúmenes por su estrecha luz y la canalización de una vía venosa de suficiente calibre. Su mantenimiento es más fácil y se asocian con menos complicaciones mecánicas que los CVC no tunelizados, así como menor incidencia de bacteriemia (2.1 por 1000 días de catéter) 9,31. • Catéter venoso central tunelizado (CCT): son de implantación quirúrgica. Algunos ejemplos son los catéteres de silicona de Hickman®, Broviac®, Groshog® o Quinton®. La porción tunelizada está en contacto con la piel y el anillo se sitúa en la salida, de manera que estimula el crecimiento del tejido circundante evitando la progresión de microorganismos. Se usan para proporcionar un acceso vascular en pacientes que requieren quimioterapia intravenosa prolongada, terapias de infusión domiciliaria o hemodiálisis. El riesgo de bacteriemia es menor que CVC (1.6 por 1000 días de catéter) 9,32. Figura 3. Catéter venoso central tunelizado y sellado (“tunneled and cuffed”) Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 7 ______________________________________________________________________________ • Dispositivos subcutáneos de implantación total: el dispositivo se cubre por piel intacta en su superficie. El más conocido es el Port-a-Cath®. Tienen bajo riesgo de infección (0.1 por 1000 días de catéter) 9. Figura 4. Imagen de Porth-a-Cath 3.3. Definiciones de las infecciones asociadas a catéteres y complicaciones asociadas Las complicaciones infecciosas de los catéteres pueden ser locales o sistémicas. Las locales ocurren en ausencia aparente de bacteriemia, pueden estar asociadas al dispositivo intravascular y han sido definidas por los CDC 20: • Catéter colonizado: Crecimiento de más de 15 unidades formadoras de colonias (UFC) en cultivo semicuantitativo o de más de 1000 UFC en cultivo cuantitativo del segmento proximal o distal del catéter en ausencia de síntomas clínicos acompañantes y hemocultivos de sangre periférica negativos. • Flebitis: signos inflamatorios alrededor del punto de salida del catéter. • Infección del lugar de salida: eritema o induración hasta en los 2 últimos centímetros de la salida del catéter, puede estar asociado a otros signos y síntomas de infección, como fiebre o salida de pus por el lugar de salida del catéter, con o sin evidencia de bacteriemia. • Tunelitis: inflamación, eritema o induración a más de 2 centímetros de la salida del catéter, que sigue el trayecto subcutáneo de un catéter tunelizado, en ausencia de hemocultivos positivos. • Infección de la bolsa: infección lecho subcutáneo de un dispositivo de implantación intravascular, con frecuencia asociado a inflamación, eritema y/o induración del tejido de la bolsa, pudiendo haber ruptura espontánea y drenaje o necrosis de la piel que recubre. Puede ocurrir con o sin bacteriemia asociada. • Bacteriemia relacionada con catéter (BRC): aislamiento del mismo microorganismo (especie y antibiotipo) en el cultivo de la punta del catéter y en al menos 1 hemocultivo extraído de sangre periférica, siempre que se excluya otro diagnóstico etiológico alternativo a la bacteriemia. En ausencia de cultivo del catéter se puede considerar también el diagnóstico de BRC probable cuando el cuadro clínico desaparece en las 48 horas siguientes a la retirada del catéter. • Tromboflebitis séptica: infección del trombo alrededor del dispositivo intravascular con extensión a la vena canalizada. La bacteriemia o fungemia se mantiene a pesar de la retirada del catéter. • Complicaciones a distancia: metástasis sépticas, como endocarditis u osteomielitis. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 8 ______________________________________________________________________________ 3.4. Morbimortalidad, prolongación de estancias y costes económicos de las infecciones asociadas a catéteres vasculares El concepto epidemiológico de mortalidad relacionada con las infecciones asociadas a catéteres ha ido avanzando para distinguir entre aquellas muertes directamente atribuibles de las ocasionadas por la enfermedad de base. No hay consenso acerca de si existe una correlación directa entre BRC y mortalidad. En estudios realizados con controles históricos, en los que los pacientes con infección relacionada con catéter se aparean con controles no infectados, el exceso estimado de muertes en UCI fue del 35% 33. Posteriores estudios prospectivos encontraron una mortalidad atribuible que ronda el 12-25% 34,35. Pero otros trabajos no han encontrado dicha asociación y consideran que una pronta retirada del catéter y adecuada antibioterapia son la explicación de la no existencia de mortalidad atribuible a la BRC 36,37. Sí está bien establecido que a consecuencia de la BRC se produce un aumento de morbilidad (medido en incremento de días de UCI, días de ventilación mecánica y necesidad de diálisis) y de costes 36,38. La prolongación de la hospitalización en EE.UU. ha sido cifrada en alrededor de 7-12 días y un incremento de gastos para el sistema de salud de unos 12000-18000 $ por episodio 38,39. Un trabajo español sobre la BRC constata un incremento de estancias de aproximadamente 20 días y un costo adicional por episodio de 3000 € 40. Un reciente estudio ha evaluado este aspecto en países europeos y encuentra que la BRC ocasiona 1000-1584 muertes por año y 15960-261000 días extras de UCI con un costo asociado de 35.9-163.9 millones de € 41. Por tanto, para reducir la gran morbilidad e importante coste sanitario que suponen las BRC, se deben implementar medidas multidisciplinarias destinadas a reducir la incidencia de esta complicación. 4. ETIOLOGÍA Y PATOGENIA Los microorganismos que producen con más frecuencia infecciones asociadas a catéter son aquellos que forman parte de la flora habitual de nuestra piel. Aproximadamente el 60% de estas infecciones están producidas por diferentes especies de gram positivos, representados fundamentalmente por estafilococos aunque con una presencia no despreciable de enterococos. En los últimos años, los bacilos gram-negativos (BGN) (entéricos y no fermentadores) están aumentando considerablemente, llegando a alcanzar en algunas series el 40% del espectro etiológico 42. El aparente motivo de este cambio es la cada vez mayor complejidad de nuestros pacientes, con estancias prolongadas y uso de antibioterapia previo al desarrollo de la bacteriemia. Candida spp., con una tendencia bastante estable, prácticamente completa el espectro etiológico 43. En las infecciones relacionadas con dispositivos intravasculares pueden estar implicados varios mecanismos: (1) contaminación del catéter en el momento de la inserción, debido a una insuficiente asepsia durante el procedimiento, (2) migración de los microorganismos de la piel a través de la superficie exterior del catéter o vía extraluminal, (3) contaminación de las conexiones del dispositivo o vía intraluminal (4) infusión de líquidos contaminados y, (5) colonización durante una bacteriemia originada en un foco séptico distante. Aproximadamente, el 65% de las infecciones relacionadas con catéter se originan a partir de la flora cutánea y el 30% a partir de las manipulaciones de las conexiones. En 1993, Raad y col. demuestran que la colonización del CVC depende del tiempo de permanencia de éste. En los catéteres de corta duración (<14 días), el principal mecanismo patogénico es la vía extraluminal en el 70-90% de los casos. En los de larga duración (>14 días), especialmente los tunelizados, donde existe un mayor número de manipulaciones de las conexiones, la vía de colonización más frecuente es la intraluminal (66%), seguida de la extraluminal (25%) 44. 5. DIAGNÓSTICO El diagnóstico de las infecciones asociadas a dispositivos intravasculares asienta en la valoración clínica y en la confirmación microbiológica. Aunque las manifestaciones derivadas de la bacteriemia son generalmente indistinguibles de la de cualquier otro foco, existen hallazgos sugerentes de que la infección provenga del dispositivo (signos locales de infección, disfunción del catéter, aparición de signos de sepsis que aparecen inmediatamente tras la infusión a través del catéter o la rápida mejoría del paciente al retirar éste). No obstante, los síntomas focales son más evidentes en la infección derivada de un CVP. Es por esto que debe sospecharse siempre un BRC, ante una fiebre de reciente aparición sin foco aparente en un paciente portador de un CVC. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 9 ______________________________________________________________________________ 5a. Toma de muestras, transporte y procesamiento en las BRC Para el estudio de la BRC se pueden procesar catéteres, hisopos y hemocultivos. Catéter La retirada de un catéter, ya sea periférico o central, conlleva la desinfección de la zona de entrada con solución acuosa de clorhexidina al 2% 45, la retirada del catéter con la máxima asepsia y cortar los 5 cm distales del catéter que corresponden a la porción intravascular. Por último, se introduce el segmento de catéter en un recipiente estéril correctamente identificado y se envía al Laboratorio de Microbiología en un periodo inferior a 30 minutos. Cuando ésto no sea posible deberá conservarse en nevera. Hisopos Se deben utilizar torundas de algodón o de alginato cálcico con medios de transporte (Amies®, Stuar®). Si existen signos de infección local, tomar un frotis del exudado cutáneo para realizar una tinción de Gram y cultivo 46,47 . En casos que sea necesario tomar una muestra de la piel pericatéter pasar un hisopo por la piel que rodea la entrada del catéter hasta 1-2 cm de radio. Si no se puede retirar el catéter y se toma una muestra de las conexiones se realizará girando el hisopo de alginato cálcico (humedecido previamente en suero fisiológico estéril) 2 ó 3 veces por la conexión. Las torundas deben enviarse al laboratorio lo más rápido posible. Si el laboratorio está cerrado, mantener en nevera un máximo de 48 horas. Hemocultivos Los hemocultivos deben extraerse antes del inicio del tratamiento antibiótico, o antes de modificar la pauta antimicrobiana si el paciente ya los recibía. Para reducir la contaminación de los hemocultivos, previo a la extracción, se realizará una adecuada desinfección de la piel con clorhexidina 46,48. Se precisa la extracción de dos pares de hemocultivos (aeróbico y anaeróbico) de sangre periférica por distintas venopunciones. En aquellos casos en los que se conserve el catéter, para poder valorar una BRC debe hacerse una extracción pareada y simultánea de sangre a través de catéter y de vena periférica. Las muestras deben ser identificadas correctamente, para reflejar el sitio del que se obtuvieron 47,49,50. Si no se puede obtener una muestra de sangre periférica, se recomienda ≥2 muestras de sangre a través de diferentes luces del catéter 51. Si el recuento de colonias a través de una luz, es por lo menos 5 veces mayor que el recuento de colonias de la sangre obtenida de la segunda luz se debe considerar una BRC como posible. 5b. Criterios diagnósticos microbiológicos La confirmación microbiológica de BRC requiere que el mismo organismo (especie y antibiotipo) crezca al menos en 1 cultivo de sangre periférica y en el cultivo semicuantitativo de la punta del catéter (≥15 ufc), o en dos muestras de sangre (extraídas una por el CVC y la otra de una vena periférica) que cumplan los criterios cuantitativos para diagnostico de BRC (cociente de ufc/mL sangre extraída del CVC vs. sangre periférica ≥3) 52,53. Dado que esta técnica cuantitativa no se encuentra disponible en todos los laboratorios de Microbiología, una alternativa es utilizar la diferencia en el tiempo de crecimiento de los microorganismos. Los hemocultivos sembrados de sangre obtenida a través de la luz del catéter deben tener un tiempo de crecimiento más rápido (al menos 120 minutos) con respecto a aquellos obtenidos por venopunción de una vena periférica 53,54. Independientemente de que se realicen estudios de hemocultivos cuantitativos o de diferencial de tiempo, siempre se debe emplear el mismo volumen de sangre por botella 54,55. 5c. Técnicas microbiológicas utilizadas en las infecciones asociadas a catéter Sólo describiremos aquellas que por disponibilidad universal y/o rentabilidad hemos considerado importantes. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 10 ______________________________________________________________________________ 5c1. Métodos diagnósticos con retirada del catéter Cultivo semicuantitativo de la punta de catéter. Técnica de Maki 4 Consiste en rotar 3 ó 4 veces sobre una placa de agar sangre los 5 cm del extremo distal del catéter. El crecimiento de ≥15 ufc se considera colonización. La sensibilidad es del 100% y su especificidad del 75%, aunque su mayor limitación es que no detecta la infección endoluminal, por lo que su máxima utilidad es en catéteres de corta duración (<15 días). En la actualidad, la mayoría de los laboratorios de microbiología utilizan esta técnica por su sencillez y rapidez. Cultivo cuantitativo de punta de catéter En un meta-análisis realizado por Siegman-Igra y cols. en 1997, se demuestra que los métodos cuantitativos son mejores que los semicuantitativos en el diagnostico de BRC de CVC, ya que presentan una sensibilidad global 94% y una especificidad global de 92% en comparación de los métodos semicuantitativos que es del 85%. También demuestran en el análisis a través de curvas ROC (para comparar exactitud y precisión de cada método), que el método que mejor área bajo la curva presenta, es el método cuantitativo de sonicación 56. En este sentido, tanto la técnica de Cleri 57, como las modificaciones de la misma para conocer la colonización intraluminal (técnicas de Brun-Buisson 58, Liñares 27 y Sherertz 59) presentan una elevada rentabilidad diagnóstica. No obstante, su principal inconveniente es el tiempo que lleva realizarlas, convirtiéndolas en procedimientos no operativos en la rutina de los laboratorios de microbiología. 5c2. Métodos diagnósticos sin retirada del catéter El objeto de estos métodos es evitar la retirada innecesaria del catéter. Por otro lado los catéteres tunelizados y especialmente los reservorios subcutáneos requieren procedimientos quirúrgicos para su retirada, y muchos pacientes inmunocomprometidos no se encuentran en condiciones para implantar otro dispositivo en breve plazo, además del costo que estos procedimientos implican. Hemocultivos cuantitativos pareados Consiste en la obtención de una muestra de sangre por venopunción y, simultáneamente otra a través del catéter. Una vez sembradas las muestras para estudio cuantitativo se obtiene un recuento de ufc/mL de sangre. Posteriormente se calcula el cociente entre el número de ufc del cultivo de sangre central/número de ufc del cultivo de sangre periférica. Un cociente ≥3 es indicativo de BRC 60. La sensibilidad de este método varía según los distintos estudios del 72-80%, con una especificidad del 94-100% 61-63, al compararlo con el método semicuantitativo de Maki. En ocasiones no es posible realizar la extracción de sangre a través de una vena periférica. En pacientes con un CVC de al menos 2 luces, se podría definir una BRC cuando el cociente de ufc/mL entre dos de ellas es ≥5 (S 61.8%, E 93.3%, VPP 92.2)51. Cultivos superficiales (conexiones, pericatéter) semicuantitativos Esta técnica consiste en muestrear con torunda la piel que rodea los 2-3 cm de la inserción del catéter (pericatéter) y con un hisopo de alginato cálcico (por su menor tamaño) las conexiones, girando 2 ó 3 veces en su interior. Recuentos ≥15 UFC son significativos. Ésta, constituye una técnica muy sensible (97%) y con un VPN muy elevado (99%), por lo que un resultado negativo nos permitiría descartar una infección relacionada con el catéter 64. Sin embargo, el VPP es muy limitado y un resultado positivo no es suficiente para confirmar el diagnóstico de BRC, ya que solamente indica colonización significativa y no BRC. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 11 ______________________________________________________________________________ Técnicas cualitativas basadas en la velocidad de crecimiento de hemocultivos pareados Es un método relativamente nuevo que, al asumir un mayor inóculo bacteriano de los hemocultivos extraídos a través del catéter, compara la diferencia en el tiempo de crecimiento de estos hemocultivos frente a aquellos obtenidos por venopunción periférica. Para ello utiliza los sistemas automatizados de hemocultivos, que detectan el tiempo transcurrido desde que se inicia la incubación de los frascos hasta el momento de crecimiento significativo. Blot establece en 120 minutos la diferencia significativa entre las muestras pareadas, en favor del hemocultivo central respecto el periférico (S 94%, E 91% en el diagnóstico de BRC en catéteres de larga duración) 65 . Posteriormente, este método ha sido también validado en catéteres de corta duración, con cifras similares de sensibilidad y especificidad 47,66. Se ha propuesto como estudio rutinario en los hospitales que disponen de sistemas automatizados, pues es un método fácil de realizar, pero hay que tener en cuenta que las muestras deben extraerse simultáneamente, contener el mismo volumen de sangre e incubarse inmediatamente en el laboratorio de microbiología. No está claro el número de luces de un CVC que deben utilizarse para la extracción de hemocultivos en los procedimientos diagnósticos que conservan el catéter (diferencial de tiempo o hemocultivos cuantitativos), aunque hay autores que abogan por el uso de todas las luces funcionantes 67. 5d. Recomendaciones Recomendaciones para el diagnóstico con retirada del catéter - La extracción de hemocultivos ha de realizarse antes de comenzar la terapia antibiótica (AII). - Si existe sospecha de BRC, se debe realizar cultivo del catéter al retirarlo. No se recomienda cultivar los catéteres de forma rutinaria (AII). - El crecimiento de más de 15 ufc de los 5 cm finales de la punta de un catéter mediante técnicas semicuantitativas (rotación placa-Maki), indica colonización del catéter (AI). - Cuando se sospecha infección relacionada con catéter, existe exudado del sitio de salida y se decide no retirar el catéter, se recomienda tomar una muestra con torunda para Gram y cultivo (BIII). - El diagnóstico definitivo de BRC requiere que el mismo organismo (especie y antibiotipo) crezca en al menos 1 cultivo de sangre periférica y uno de la punta del catéter (AI). Recomendaciones para el diagnóstico sin retirada del catéter - La extracción de hemocultivos ha de realizarse antes de comenzar la terapia antibiótica (AII). - Para valorar una BRC sin retirada del mismo, se deben tomar muestras pareadas de sangre, al menos una obtenida del catéter y otra de vena periférica (AII). El diagnóstico definitivo de BRC requiere que el mismo organismo crezca en ambas muestras (AII). - Si no se pudiera extraer sangre periférica, se recomienda más de dos muestras por diferentes luces (BIII). - En caso de realizar cultivos cuantitativos de sangre, el recuento de colonias obtenido a través del catéter debe ser al menos 3 veces mayor, que el recuento de colonias de sangre periférica (AII). Si empleamos el diferencial de tiempo de crecimiento, el periodo significativo se establece en 2 horas (AII). - Alternativamente, se pueden realizar 2 hemocultivos cuantitativos obtenidos a través de 2 luces distintas. Si el recuento de colonias a través de una luz, es por lo menos 5 veces mayor que el recuento de colonias de la sangre obtenida de la segunda luz se debe considerar una posible BRC (BII). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 12 ______________________________________________________________________________ 6. TRATAMIENTO ANTIMICROBIANO 6a. Tratamiento antimicrobiano empírico de la sospecha de bacteriemia asociada a catéter La situación clínica del paciente, el tipo de catéter, los factores de riesgo de infección por determinados patógenos y los patrones de resistencia locales, determinan el esquema de antibioterapia que debemos utilizar empíricamente. La instauración precoz de un tratamiento antimicrobiano eficaz en situaciones de shock séptico condiciona la supervivencia del paciente 68 por lo que, ante signos de gravedad, el régimen antibiótico debe iniciarse de forma muy precoz y considerar, individualizando la situación de cada paciente, la cobertura empírica de los 3 grandes grupos de microorganismos potencialmente responsables de infección en estos pacientes: estafilococos, bacilos gram negativos (BGN) y cándidas. En estas situaciones, la retirada inmediata del catéter debe formar parte inexcusable del abordaje terapéutico. Si el paciente permanece estable, la pauta de antibioterapia a utilizar vendrá determinada por su evolución clínica, la existencia o no de predictores de una bacteriemia complicada 69, la ecología local y la presencia de factores de riesgo de infección por determinados microorganismos. Los SCN y S. aureus son los microorganismos más frecuentemente implicados en la infección del catéter. Muchos de ellos muestran resistencia a la meticilina, cuestión que debe considerarse en el tratamiento empírico inicial. Como comentaremos posteriormente, el tratamiento de elección de una bacteriemia por Staphylococcus spp. sensible a meticilina debe ser cloxacilina. Sin embargo, existen muchas más dudas sobre el tratamiento de una especie meticilin-resistente. Las elevadas tasas de fracaso terapéutico a vancomicina, obligaron a que, en el año 2006, el “Clinical and Laboratory Standard Institute” (CLSI) bajara los puntos de corte de S. aureus. Desde entonces, se considera que una cepa es sensible a vancomicina cuando la concentración mínima inhibitoria (CMI) es ≤2 mcg/mL. Sin embargo, en los últimos años se ha descrito un incremento progresivo (creep) de la CMI, aunque en el rango de la sensibilidad, que parecen asociarse con mayores fracasos a vancomicina 70,71. En caso de infecciones por S. aureus resistente a meticilina con una CMI de vancomicina ≤1 mcg/mL, se recomienda utilizar vancomicina, aunque optimizando su utilización mediante el uso de una dosis inicial de 25-30 mg/Kg y posteriormente dosis de 15-20 mg/Kg cada 8 horas, para buscar concentraciones valle de 15-20 mcg/mL 72. La utilización de estas dosis de vancomicina obliga a monitorizar la aparición de nefrotoxicidad 73. Si la CMI para vancomicina es superior a 1 mcg/mL es improbable alcanzar el objetivo farmacodinámico (ABC/CMI≥400), a pesar de incrementar las dosis habituales 74. Aunque en un futuro próximo debe clarificarse el procedimiento óptimo para determinar la CMI de S. aureus a vancomicina (E-test vs. microdilución) y disponer de información detallada sobre la CMI poblacional de las cepas de cada hospital, en aquellas infecciones donde S. aureus presenta una CMI superior a 1 mcg/mL se deberían considerar otras alternativas a vancomicina. Linezolid no se ha aprobado para el uso de infección asociada a catéter y en pacientes con insuficiencia renal se ha asociado a frecuentes efectos adversos 75. Daptomicina es un lipopéptido cíclico, con efecto bactericida rápido y concentración dependiente, muy activo frente a biopelículas y con escasa toxicidad, que no es útil en infecciones respiratorias, dado que es inactivado por el surfactante pulmonar. A pesar de haber demostrado “no inferioridad” frente al tratamiento estándar en la bacteriemia por S. aureus resistente a meticilina 76, aún no disponemos de evidencias de suficiente peso para asumir una clara superioridad de este fármaco sobre vancomicina, aunque las investigaciones que se están desarrollando en los últimos años nos permiten afirmar que: (1) el perfil PKPD de este fármaco lo hace muy atractivo para el tratamiento de este tipo de infecciones 77,78, (2) los regímenes terapéuticos basados en daptomicina se asocian a tasas inferiores de nefrotoxicidad 79, (3) las dosis a emplear deben ser superiores a las descritas inicialmente (≥8 mg/Kg/d) 80, aunque no estén incluidas en ficha técnica y (4) su uso en combinación con otros fármacos mejora su rendimiento, en términos de sinergia y prevención del desarrollo de resistencias 81-83. Sabemos que vancomicina es notablemente inferior a cloxacilina para el tratamiento de infecciones por S. aureus meticilina-sensible (SAMS) 84 y todavía está por demostrar que daptomicina sea tan eficaz como las penicilinas isoxazólicas. Por esto, consideramos necesario que el tratamiento empírico de una infección grave relacionada con catéter debe incluir la combinación de daptomicina o vancomicina con cloxacilina a dosis altas (2 g/4h i.v.), siempre que no consideremos necesaria la cobertura de BGN. Tradicionalmente, debe considerarse la cobertura frente a BGN ante pacientes neutropénicos, con sepsis grave/shock séptico, cateterización femoral o colonización previamente conocida por dichos gérmenes. No obstante, estamos asistiendo a un incremento Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 13 ______________________________________________________________________________ progresivo de infecciones por estos microorganismos en pacientes con hospitalización prolongada y en aquellos con catéteres centrales de larga duración 42. En estas situaciones, cloxacilina debería sustituirse por un betalactámico con actividad también frente a BGN, evitando el uso de ceftazidima por su asociación a fracasos terapéuticos en pequeñas series de casos 85. Como comentaremos posteriormente, la necesidad de incluir cobertura frente a P. aeruginosa se sustenta en el conocimiento de la ecología local y/o de la colonización previa del paciente, así como de la gravedad del estado clínico. Los pacientes con nutrición parenteral, uso prolongado de antibióticos de amplio espectro o con cateterización femoral, tienen riesgo de padecer infección por Candida spp., por lo que el tratamiento empírico de un paciente con infección grave y alguno de estos factores de riesgo debe incluir un antifúngico. Se debe utilizar una equinocandina o anfotericina B liposomal en pacientes hemodinámicamente inestables, o con criterios de sepsis grave o shock séptico. Fluconazol puede emplearse en pacientes estables, sin exposición previa a azoles o sin factores de riesgo para C. krusei o C. glabrata 86. Peculiaridades del paciente en hemodiálisis. En pacientes incluidos en programas de hemodiálisis, la mayoría de los casos de bacteriemia están ocasionados por cocos grampositivos, en su mayoría Staphylococci spp. Los bacilos gramnegativos ocupan el segundo lugar en frecuencia, aunque un reciente estudio multicéntrico ha observado un incremento en los últimos años tanto por esta etiología como polimicrobianas 87. La hemodiálisis reduce la concentración de los antimicrobianos con bajo volumen de distribución o bajo peso molecular, por ello es necesario administrar el fármaco al finalizar la sesión de hemodiálisis y en algunos casos administrar dosis suplementarias 88,89. En este sentido, en aquellos casos de sepsis grave en los que pueda estar implicado un Staphylococcus spp. sensible a meticilina, podría ser conveniente utilizar un betalactámico como cefazolina 90-92. En un reciente estudio en el que se comparó el tratamiento con vancomicina y cefazolina en pacientes con bacteriemia por S. aureus sensible a meticilina, los tratados con vancomicina tuvieron mayor mortalidad, complicaciones y recidivas 93. A las limitaciones previamente descritas de vancomicina (desarrolladas en el apartado de tratamiento empírico) en estos pacientes, se une la dificultad para obtener niveles séricos adecuados de vancomicina, influyendo factores como la técnica de diálisis, la presencia de función renal residual en el paciente o el momento de administración de fármaco (“intradiálisis” versus “postdiálisis”), además de la presencia de productos de degradación que pueden dar lugar a valores falsamente elevados 94,95. En la tabla 6.1 se detallan las dosis iniciales y postdiálisis de los antimicrobianos más utilizados. Tabla 6.1. Dosificación de antibioterapia de pacientes incluidos en programas de hemodiálisis periódica. Antimicrobiano Cefazolina Ampicilina Ceftriaxona Ceftazidima Cefepima Piperacilina-tazobactam Imipenem Meropenem Gentamicina Tobramicina Vancomicina Daptomicina Dosis recomendada 1000-2000 mg postHD 2000 mg/12 h 2000 mg/24 h 1000 mg/24h 500-1000 mg/24 h 2000/250 mg/8h 500 mg/12h 500 mg/24h 1,5-2 mg/Kg/postHD 1,5-2 mg/Kg/postHD 20 mg/Kg 1,2,3 8-10 mg/Kg/48 h Dosis supletorias posthemodiálisis 750 mg piperacilina 500 mg 2,3 - Notas. 1. Dosis inicial; 2. Infundir en la última hora de diálisis; 3. Monitorizar niveles. Recomendaciones 1. El tratamiento antibiótico empírico de una infección grave asociada a catéter debe iniciarse de forma muy precoz (AII). 2. En estos casos, la retirada inmediata del catéter forma parte del plan terapéutico (AII). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 14 ______________________________________________________________________________ 3. La elección del régimen terapéutico está condicionada por la situación clínica del paciente y la ecología local (AII). 4. El tratamiento empírico de una infección grave se basa en combinaciones de antibióticos que incluya, al menos, cobertura frente a estafilococos meticilin-sensible y meticilin-resistentes (AII). 5. Cloxacilina es el tratamiento de elección frente a estafilococos sensibles a meticilina, por lo que se debe dar preferencia a su inclusión en el esquema terapéutico (AII). 6. En caso de incluir vancomicina, ésta debe iniciarse con una dosis de carga y con el objetivo de alcanzar niveles valle de 15-20 mcg/L (AII). Es obligatorio vigilar la aparición de nefrotoxicidad. Utilizar en combinación con betalactámicos con actividad potente frente a estafilococos sensibles a meticilina, evitando el uso de ceftazidima (BIII). 7. En caso de incluir daptomicina, utilizar dosis de al menos 8-10 mg/Kg/d y en combinación con betalactámicos (BIII). 8. En caso de considerar necesaria la cobertura empírica frente a BGN en un paciente con sepsis grave/shock séptico, el betalactámico que acompañe a vancomicina o daptomicina, debería poseer actividad antipseudomónica (CIII). Tabla 6.2. Recomendaciones para el tratamiento empírico de la bacteriemia relacionada con catéter Bacteriemia relacionada con catéter Pauta A Cloxacilina +/- 1 Daptomicina 2 o Vancomicina 2 +/- 3 Ceftriaxona o Ertapenem Bacteriemia relacionada con catéter junto a alguno de los siguientes: Catéter femoral, colonización previa por BGN o catéteres centrales de larga duración + Cloxacilina 1 Cefepime o o Pauta Daptomicina 2 Meropenem/Doripenem/Imipenem B o o Vancomicina 2 Piperacilina-Tazobactam Bacteriemia relacionada con catéter manifestada como sepsis grave/shock séptico + +/- 4 Cefepime Daptomicina Equinocandina o Pauta o Meropenem/Doripenem/Imipenem C Anfotericina B o liposomal 5 Piperacilina-Tazobactam 1. En situaciones donde no hay sepsis grave ni shock séptico, el paciente no es portador de cardiopatía estructural de riesgo para el desarrollo de endocarditis ni de material protésico endovascular y se puede retirar el catéter de forma precoz (≤48h), no es necesario aportar cobertura empírica para estafilococos resistentes a meticilina. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 15 ______________________________________________________________________________ 2. Se recomienda dar preferencia al uso de daptomicina sobre vancomicina en las siguientes situaciones: sepsis grave/shock séptico, colonización previa por S. aureus resistente a meticilina (SARM), incidencia elevada de SARM en la unidad con CMI>1, imposibilidad para retirar el catéter y existencia de material protésico. 3. La utilización de un antibiótico frente a BGN sin ofertar cobertura a P. aeruginosa podría estar justificada en aquellos pacientes sin signos de gravedad y portadores de catéter periférico aunque con estancias hospitalarias prolongadas (>10 días). En cualquier otra circunstancia que se considere adecuado el tratamiento empírico frente a BGN se debería incluir cobertura para P. aeruginosa. En la pauta A, la inclusión de otro betalactámico debería suponer la exclusión de cloxacilina. 4. Incluir cobertura frente a Candida spp. en caso de nutrición parenteral o antibioterapia previa. 5. Anfotericina B liposomal, por su mayor riesgo de nefrotoxicidad, debería ser una alternativa a fluconazol o caspofungina. 6b. Recomendaciones específicas por gérmenes 6b1. Staphylococcus aureus Los β-lactámicos son el tratamiento de elección en las cepas de S. aureus meticilin-sensibles (SAMS). Cloxacilina y cefazolina (esta última para pacientes incluidos en programas de hemodiálisis), han mostrado mayor eficacia clínica, con menor mortalidad, menos fallos microbiológicos y disminución de la tasa de recidivas cuando se comparan con vancomicina 93,96. En aquellos casos en los que utilicemos cloxacilina debe hacerse a dosis altas, cada 4 horas en caso de infusión intermitente 97. La vancomicina quedaría como opción terapéutica en casos de alergia severa a β-lactámicos o resistencia a meticilina. En este sentido, en los últimos años estamos asistiendo a un aumento importante de bacteriemias por cepas resistentes a meticilina (SAMR) tanto en EE.UU. como en Europa. En el año 2009, el Sistema Europeo de Vigilancia de Resistencias Antimicrobianas (EARSS), comunicó una prevalencia del 25% de resistencia a la meticilina en las cepas de S. aureus aisladas en sangre en nuestro país 98. Como hemos comentado previamente, la sensibilidad disminuida a la vancomicina se asocia a ausencia de eficacia de ésta, incluso con CMI entre 1-2 mcg/l 71. En la publicación de Soriano y cols. 71, la utilización de vancomicina para el tratamiento empírico de cepas de S. aureus con CMI de 2 mcg/L se asoció a mayor mortalidad (OR 6.39). Estos autores recomiendan, que en cepas con CMI a vancomicina >1mcg/mL se utilicen antibióticos alternativos. Daptomicina tiene aprobada la indicación para el tratamiento de bacteriemia por SAMS y SAMR con o sin endocarditis derecha 76. Se han observado fallos terapéuticos con elevación de la CMI a la daptomicina durante el tratamiento con dosis de 6 mg/Kg/día, por lo que, dado que su mecanismo de actuación es concentración dependiente, se recomienda que en infecciones estafilocócicas graves se usen dosis elevadas (10-12 mg/Kg/d) de este fármaco 99,100. Linezolid, pertenece al grupo de oxazolidinas. Es bacteriostático frente a S. aureus y tiene muy buena biodisponibilidad oral. No tiene aprobada la indicación para la bacteriemia asociada a catéter, aunque un estudio reciente en el que evidencia su no inferioridad frente a vancomicina permitiría considerarlo una alternativa a glicopéptidos, daptomicina y β-lactámicos en casos de alergia, resistencia o intolerancia. También tiene posibilidad de uso en terapia secuencial por vía oral, cuando no podamos utilizar cotrimoxazol 101. Trimetroprim-Sulfametoxazol (cotrimoxazol) tiene actividad bactericida 102. En un ensayo clínico, aleatorizado, para el tratamiento de infecciones por S. aureus en adictos a droga por vía parenteral (ADVP), alcanzó una tasa de curación del 86% frente al 98% con la vancomicina 103. En otro reciente estudio retrospectivo sobre bacteriemias por S. aureus resistente a meticilina tuvo un comportamiento similar a vancomicina 104. Probablemente, su uso podría estar reservado para el tratamiento secuencial de bacteriemias asociadas a catéter, no complicadas. Gentamicina se usa, junto a betalactámicos y glicopéptidos, con el fin de reducir la duración de la bacteriemia por S. aureus 105. Sin embargo, este potencial beneficio no está claramente demostrado y el riesgo de nefrotoxicidad hace que su uso conjunto con vancomicina se desaconseje sistemáticamente 106. Cuando se utilice en combinación con cloxacilina debe hacerse a dosis bajas (3mg/Kg/d) y no más de 3-5 días. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 16 ______________________________________________________________________________ La opción de utilizar rifampicina en combinación se basa en su gran actividad anti-estafilocócica y en su elevada biodisponibilidad, que favorecería un tratamiento secuencial precoz 107. Los trabajos más interesantes son aquellos que utilizan combinaciones de rifampicina con fluorquinolonas para el tratamiento v.o. de bacteriemias y endocarditis derecha, producidas principalmente por gérmenes meticilin-sensibles108,109. Se ha detectado desarrollo de resistencia intratratamiento cuando la rifampicina se introducía mientras persistía la bacteriemia 110, por lo que actualmente se recomienda que, de usarse, se haga a partir del 3er-5º día, una vez que el catéter se haya retirado y los hemocultivos se hayan negativizado. No hay consenso en la duración óptima del tratamiento antibiótico en infecciones de catéter por S. aureus no complicadas. Varios estudios han mostrado la importancia de la colonización del CVC por S. aureus como predictor de bacteriemia diferida. Por ello, en los casos en que tras la retirada del catéter se comprueba una colonización por S. aureus, pero sin evidencia de bacteriemia en los hemocultivos iniciales, deberían tratarse tan sólo durante 5-7 días, vigilando siempre signos y síntomas de posible infección oculta y excluyendo esta posibilidad 111. Cuando se detecta bacteriemia se aconseja un mínimo de 10-14 días de tratamiento antibiótico 19,69. Aunque no existen estudios aleatorizados con suficiente poder estadístico, tratamientos inferiores a 10-14 días se han asociado a tasas de fracaso inaceptables (20-40%), mientras que cuando se completa este tiempo las cifras oscilan entre el 2 y el 10% 112. Esta duración de tratamiento se establece para aquellos casos de bacteriemia no complicada, entendiendo como tal aquella que cumple las siguientes condiciones: (1) situación clínica estable y hemocultivos negativos en las primeras 72 horas de inicio del tratamiento eficaz, (2) retirada del catéter en las primeras 72h, (3) ausencia de signos clínicos y radiológicos de infección profunda, (4) ecocardiografía transesofágica (ETE) sin signos de endocarditis, recomendándose realizar la ETE a partir del 7º día desde el inicio de la bacteriemia, para minimizar posibles falsos negativos 69, y (5) ausencia de material protésico intravascular o articular. Cuando no se cumplen todas estas condiciones, estamos hablando de una bacteriemia complicada y el tratamiento debe prolongarse 4-6 semanas 113-116. Algunos autores no consideran necesaria la ETE, cuando no se cumplen ninguno de los otros factores predictores de bacteriemia complicada 117. Dada su escasa sensibilidad para el diagnóstico de vegetaciones, el papel de la ecocardiografía transtorácica (ETT) sería la valoración de una cardiopatía predisponente. En aquellos casos en los que no se realice una ETE, la existencia de cardiopatía predisponente obligaría a prolongar el tratamiento durante al menos 4 semanas. Recomendaciones 1. El tratamiento de elección de la bacteriemia por S. aureus meticilin-sensible (SAMS) es cloxacilina (AI). 2. Para cepas meticilin-sensibles, el uso de vancomicina o daptomicina está reservado para pacientes alérgicos (AII). 3. En los pacientes programas de hemodiálisis periódica, cefazolina es el antibiótico de elección para el tratamiento de la bacteriemia relacionada con catéter (BRC) por SAMS (AII). 4. En el tratamiento de una BRC por un S. aureus meticilin-resistente (SAMR) con una CMI>1 debe considerarse el uso de daptomicina (BII). 5. Si se utiliza gentamicina como tratamiento combinado debe usarse a dosis bajas, exclusivamente durante los 3-5 primeros días y evitarse en caso de utilizar un segundo fármaco potencialmente nefrotóxico (CIII). 6. Fármacos como cotrimoxazol, las combinaciones de fluorquinolonas con rifampicina y, en determinadas circunstancias linezolid, podrían utilizarse como tratamiento secuencial en aquellos casos de bacteriemias no complicadas (BII). 7. El tratamiento de la bacteriemia complicada debe hacerse durante 4-6 semanas (BII). 8. En aquellos casos que cumplan una serie de criterios predefinidos de bacteriemia no complicada, el tratamiento puede reducirse a 10-14 días (AII). 9. Puede valorarse una pauta corta (10-14 días), aún en ausencia de ecocardiografía transesofágica, en aquellos pacientes que cumplen el resto de criterios predictores de bacteriemia no complicada (BII). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 17 ______________________________________________________________________________ 6b2. Staphylococcus coagulasa negativo Los staphylococci coagulasa negativo (SCN) son los microorganismos que se aislan con más frecuencia en la BRC. No hay estudios aleatorizados que evalúen el tratamiento de estos gérmenes y habitualmente nos manejamos con extrapolaciones procedentes de la bacteriemia por S. aureus. Generalmente tienen un curso benigno, sobre todo cuando se retira el catéter de forma precoz, y no suelen asociarse con sepsis o abscesos metastásicos. En caso de BRC no complicada, si el catéter causante se ha retirado, la duración del tratamiento antibiótico no debe ser superior a 5-7 días. De hecho, si el paciente permanece estable y afebril, no hay dispositivos intravasculares ni evidencia de infección profunda metastásica y los hemocultivos posteriores a la retirada del catéter son negativos, no hay necesidad de tratamiento sistémico antiestafilocócico 111. Por el contrario, si el catéter colonizado no se puede retirar, la posibilidad de recurrencia de la bacteriemia es del 20%, recomendándose en estos casos, sellado del catéter y tratamiento sistémico durante 10-14 días 19,118. SCN es también un contaminante común de los hemocultivos, por lo que en muchas ocasiones es difícil distinguir si se trata o no de verdadera bacteriemia. Para esto, consideramos fundamental seguir las recomendaciones que se dan en el procedimiento de recogida de muestras sanguíneas (ver apartado correspondiente). Staphylococcus lugdunensis S. lugdunensis pertenece al grupo Staphylococcus coagulasa negativo (SCN). La BRC por este microorganismo es poco frecuente. Un estudio retrospectivo analizó el papel de la bacteriemia producida por este microorganismo y encontró que el 50% se asociaba con endocarditis y el 85% de los pacientes necesitó cirugía. El 73% de las bacteriemias tenían su origen en catéter u otros dispositivos endovasculares. Por todo ello se recomienda que las bacteriemias por S. lugdunensis deben ser tratadas de forma similar a la producida por S. aureus 119,120. Afortunadamente suele ser sensible a meticilina y ésto lo diferencia también del grupo SCN. Recomendaciones 1. En aquellos casos de BRC no complicada por ECN, se recomienda retirar el CVC transitorio e iniciar tratamiento antibiótico, cuya duración será de 5-7 días (BIII). 2. Si no existen dispositivos intravasculares ni evidencia de infección profunda metastásica y los hemocultivos a las 72h de la retirada del CVC son negativos, el tratamiento antibiótico sistémico puede no ser necesario (CIII). 3. En caso de CVC permanentes se debe intentar conservar el dispositivo. En estos casos, el tratamiento sistémico debe prologarse durante 10-14 y acompañarse del sellado del mismo (BIII). 4. La bacteriemia por S. lugdunensis debe manejarse de la misma manera que la provocada por S. aureus (BII). 6b3. Enterococcus spp. La BRC por Enterococcus spp., se ha incrementado ostensiblemente desde los años 80 en relación con el mayor número de pacientes con elevada comorbilidad y estancia en UCI, la facilidad con la que Enterococcus spp. coloniza los catéteres y el aumento progresivo de resistencia a determinados antibióticos 121,122. En España, en un estudio publicado en 2007, se recogieron 3469 bacteriemias por Enterococcus spp. entre 2001-2006 (80% E. faecalis y 20% E. faecium) y el 65% de los E. faecium fueron resistentes a ampicilina frente al 1.3% de los E. faecalis 123. Con respecto a vancomicina, en el 2005 el EARSS comunicó una prevalencia de infecciones bacteriémicas por E. faecium resistentes a vancomicina >25% en 4 países europeos. En España, afortunadamente, el porcentaje de resistencia a vancomicina es notablemente inferior, 3.9% para E. faecium y 0.4% en E. faecalis 124. En infecciones por cepas resistentes a ampicilina y vancomicina, el linezolid se ha usado con éxito limitado (63%) y la daptomicina, sóla o en combinación con otros antimicrobianos, es una opción, aunque se han publicado cepas tanto de E. faecalis como de E. faecium resistentes a linezolid y daptomicina 125-128. Ampicilina es el antibiótico de elección para Enterococcus spp. sensible 19,127,129. Estos gérmenes, son tolerantes a β-lactámicos por lo que algunos autores recomiendan combinar ampicilina con aminoglucósidos en infecciones intravasculares graves con el fin de alcanzar Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 18 ______________________________________________________________________________ potencia bactericida 126, pero no hay consenso en la necesidad de terapia combinada en bacteriemia sin endocarditis, siempre y cuando el catéter infectado sea retirado. Si el catéter se mantiene, hay evidencias a favor del beneficio de la terapia combinada 130. En aquellas situaciones donde exista alto nivel de resistencia a aminoglicósidos, el régimen de elección debería ser ampicilina y ceftriaxona 131,132. Esta pauta también se ha utilizado para minimizar el riesgo de nefrotoxicidad. Vancomicina se usará si hay resistencia a ampicilina o alergia a β-lactámicos. En terapias de rescate, en casos de resistencia a ampicilina y glicopéptidos y aunque no hay evidencia sólida, se valorará el uso de linezolid o daptomicina. Linezolid mostró eficacia clínica y microbiológica en bacteriemia por Enterococcus faecium resistente a vancomicina (78% y 85% respectivamente), en un estudio no aleatorizado con un pequeño número de casos analizados realizado en 2003. En otro estudio retrospectivo observacional, se evaluó la eficacia de linezolid en bacteriemias primarias o secundarias causadas por diferentes microorganismos gram positivos, entre los que se incluían enterococos sensibles y resistentes a vancomicina. Se obtuvo curación microbiológica, con una mediana de tratamiento de 14 días, en el 84% de los pacientes analizados 133. Daptomicina tiene actividad bactericida rápida y potente frente a Enterococcus spp. 134. Así mismo, “in vitro” es sinérgica con rifampicina, fosfomicina y gentamicina 135,136 . Al igual que ha ocurrido con S. aureus, se han descrito fallos terapéuticos asociados a resistencia a daptomicina con la dosis estándar de 4-6 mg/Kg/d 137, por lo que en infecciones intravasculares graves o en pacientes neutropénicos se recomiendan dosis altas (8-12 mg/Kg/d) y terapia combinada con cualquiera de los otros antimicrobianos con el fin de evitar el desarrollo de resistencias a este fármaco 138. Quinupristina/Dalfopristina (Q/D) es activa frente a E. faecium pero la mayoría de E. faecalis son resistentes. Su eficacia y seguridad se evaluó en un estudio prospectivo y multicéntrico, no comparativo, en tratamiento de rescate de infecciones por E. faecium resistente a vancomicina. Respondieron clínicamente un 72% de bacteriemias de origen no conocido 139. Su uso viene limitado por su eficacia única frente a E. faecium y la necesidad de administrarla por vía central. No hay datos suficientes que avalen el uso de tigeciclina en bacteriemia y endocarditis enterocócica 126. En bacteriemias no complicadas, el tiempo de tratamiento será 7-14 días tras la retirada del catéter 19,129,133. En caso de infección profunda o endocarditis se prolongará el tratamiento en función del diagnóstico. Según las directrices publicadas en el año 2009 sobre abordaje de la bacteriemia asociada a catéter de la Sociedad Americana de Enfermedades Infecciosas (IDSA), estaría indicado realizar un ETE si se cumple alguna de las siguientes circunstancias: a) si hay síntomas o signos de endocarditis; b) bacteriemia o fiebre prolongadas (>72 h) a pesar del tratamiento antibiótico adecuado; c) evidencia radiográfica de fenómenos embólicos pulmonares, y e) presencia de prótesis valvulares o cuerpos extraños intravasculares 19. Recomendaciones 1. Ampicilina es el antibiótico de elección para Enterococcus spp. sensible. Vancomicina es el tratamiento de elección para aquellos casos con resistencia o alergia a betalactámicos (AIII). 2. Se recomienda la retirada del CVC, en especial en BRC por E. faecium y en pacientes con valvulopatía, dispositivo intravascular y/o material protésico (BII). Si se decide mantener el CVC se recomienda tratamiento sistémico y sellado del dispositivo (BIII). 3. No hay evidencias claras sobre el beneficio de la terapia combinada en aquellos casos sin endocarditis (CII), aunque es recomendable cuando se mantiene el catéter (BII). 4. En casos de resistencia a ampicilina y a glicopéptidos, se valorará el uso de linezolid o daptomicina (BII). 5. La duración del tratamiento, en bacteriemias no complicadas, es de 7-14 días (CIII). 6. Si están presentes algunas de las siguientes circunstancias: síntomas o signos de endocarditis, bacteriemia o fiebre prolongada a pesar de tratamiento antibiótico adecuado, evidencia radiográfica de fenómenos embólicos pulmonares o presencia de prótesis valvulares o cuerpos extraños intravasculares, está indicada la realización de una ecocardiografía para el despistaje de endocarditis infecciosa (BIII). 6b4. Candida spp. Los factores favorecedores de infecciones por Candida spp. son: uso previo de antibióticos de amplio espectro, utilización de CVC, alimentación parenteral, neutropenia, terapia inmunosupresora, neoplasias y trasplantes Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 19 ______________________________________________________________________________ 7,140-143 . A la hora de elegir el tratamiento antifúngico hay que tener en cuenta varios factores como: terapia reciente con azoles, especie de Candida y datos de sensibilidad, gravedad de la situación clínica, evidencia de complicaciones metastásicas, existencia de neutropenia y comorbilidades importantes. Fluconazol es la terapia estándar para pacientes con candidemia y es el fármaco de primera línea en pacientes con enfermedad leve a moderada, sin exposición previa a azoles y en los que no pertenecen a un grupo de alto riesgo de infección por C. glabrata (pacientes ancianos, oncológicos y diabéticos) 144,145. Las formulaciones lipídicas de anfotericina B o una equinocandina se recomiendan como terapia inicial en pacientes con inestabilidad hemodinámica, sospecha de afectación endocárdica o del sistema nervioso central (SNC), tratamiento previo con azoles o intolerancia a estos últimos. Tras la terapia inicial se podría cambiar por fluconazol en caso de mejoría clínica y cepas aisladas sensibles a fluconazol 146-151. Para infecciones ocasionadas por C. parapsilosis se recomienda fluconazol basándose en la disminución de la actividad in vitro de las equinocandinas contra este microorganismo 147. Voriconazol es efectivo contra la mayoría de las Candida spp., incluida C. krusei y es tan efectivo para la candidemia y la candidiasis invasiva como la combinación de anfotericina B durante 4 a 7 días seguida de fluconazol 1,152 pero la mala tolerancia y la mayor interacción con otros fármacos lo convierten en una opción menos atractiva como tratamiento inicial. A los pacientes con candidemia se les debe realizar un examen oftalmológico para descartar endoftalmitis. Se recomienda realización de hemocultivos cada 48 horas hasta su negatividad. La duración de la terapia antifúngica, si no hay complicaciones metastásicas es de 14 días tras la resolución de los síntomas atribuibles a la infección y la negativización de los hemocultivos 144,147-150. En caso de candidemia documentada es necesario retirar los catéteres venosos, dado que esta retirada está asociada a una menor duración de la candidemia, mejor pronóstico y reducción de la mortalidad 153-157, aunque en la actualidad existe un debate abierto sobre la obligatoriedad de esta retirada 158,159. En caso de que se decida mantener el CVC, se requiere una vigilancia estrecha y retirarlo en caso de candidemia persistente o deterioro clínico. Si existen datos de endocarditis o tromboflebitis supurativa el tratamiento debe ser prolongado y la retirada del catéter intravascular es inexcusable 19. Recomendaciones 1. Se recomienda tratamiento empírico con fluconazol en pacientes estables, no neutropénicos y que no han sido tratados recientemente con azoles (AIII). 2. En los pacientes con sepsis grave o shock séptico, neutropénicos o tratamiento reciente con azoles se recomienda utilizar empíricamente equinocandinas o una formulación lipídica de anfotericina (AIII). 3. Una vez dispongamos de la identificación de la especie de Candida spp., se recomienda fluconazol para aquellas especies sensibles (AII). 4. Voriconazol se recomienda como tratamiento secuencial para casos seleccionados de candidemia (C. krusei o C. glabrata) sensibles a este fármaco y con actividad reducida o resistencia a fluconazol (BIII). 5. La duración del tratamiento de una candidemia, sin datos de complicaciones, es de dos semanas una vez comprobada la negatividad de los hemocultivos y la resolución de los síntomas atribuibles a la infección (AIII). 6. Siempre que sea posible debe retirarse el CVC (AII). Si se decide mantenerlo se recomienda tratamiento sistémico y sellado del CVC, y vigilancia estrecha. Si se demuestra deterioro clínico, candidemia persistente o una nueva infección metastásica, el CVC debe retirarse. 6b5. Bacilos gram negativos La incidencia de BRC por BGN multirresistentes ha aumentado en los últimos años y se relaciona con una mayor morbi-mortalidad 160-163. Los principales factores relacionados con la presencia de un BGN se han comentado en el apartado de tratamiento empírico. La necesidad de tratar empíricamente un posible BGN multirresistente viene dada por el conocimiento de la ecología local y/o de la colonización previa del paciente, así como de la gravedad del estado clínico 164-166. En estas situaciones y dadas las limitaciones de antimicrobianos existentes en el momento Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 20 ______________________________________________________________________________ actual frente a BGN, se recomienda tratamiento inicial con dos fármacos activos para estos microorganismos y simplificar a monoterapia cuando dispongamos del estudio de sensibilidad 19,167. La IDSA recomienda que la duración mínima del tratamiento debe ser de 10 a 14 días 19. No obstante, sabemos que las bacteriemias no complicadas por BGN en aquellos pacientes en los que se ha retirado el catéter tienen escasa tendencia a causar abscesos secundarios o recidivas por lo que, en estos casos, la duración del tratamiento podría acortarse 5-7 días. Aunque posteriormente le dedicaremos un apartado específico a este asunto, merece la pena resaltar que otro de los criterios mayores para la retirada del catéter debería ser la presencia de un microorganismo multirresistente, de difícil tratamiento. Recomendaciones 1. Los pacientes con sepsis grave, shock séptico y colonización reciente por microorganismos gram negativos multirresistentes deben recibir cobertura inicial con dos fármacos con actividad para gram negativos, que deberá ser optimizada una vez conocida la etiología (AII). 2. Se aconseja un mínimo de tratamiento de 5-7 días en caso de bacteriemia no complicada, siempre que el enfermo no sea portador de un dispositivo intravascular y el catéter causante haya sido retirado (CIII). 3. Los catéteres de larga duración deben ser retirados si existen complicaciones como tromboflebitis supurativa, endocarditis o gérmenes multirresistentes (AII). Tabla 6.3. Recomendaciones sobre el tratamiento antibiótico de elección. Staphylococcus sensible a meticilina Staphylococcus resistente a meticilina Enterococcus sensible a ampicilina Pauta de elección Pauta alternativa Cloxacilina 2g/4h i.v. ± Gentamicina 3 mg/Kg/24h i.v. Cefazolina 2g/8h i.v. (alergia a cloxacilina) ± Gentamicina 3 mg/Kg/24h i.v. Vancomicina Inicial: 25-30 mg/Kg 15-20 mg/Kg/8-12h ó Daptomicina 8-12 mg/Kg/d Ampicilina 2g/4h i.v. ± Ceftriaxona 2g/12h i.v. Enterococcus resistente a ampicilina Vancomicina 15mg/Kg/12h i.v. ± Gentamicina 3 mg/Kg/24h i.v. Enterobacterias Ceftriaxona 2000 mg/24 h i.v. ó Ciprofloxacino 400 mg/12h i.v. Linezolid 600 mg/12h i.v. Comentarios El tratamiento secuencial 1 v.o. se podría hacer con: Levofloxacino 500 mg/12h Moxifloxacino 400 mg/24h Cotrimoxazol 320/1600 mg/12h ± Rifampicina 600 mg/24h El tratamiento secuencial 1 v.o. se podría hacer con: Cotrimoxazol 320/1600 mg/12h Linezolid 600mg/12h Ampicilina 2g/4h i.v. ± Gentamicina 3 mg/Kg/24h i.v. Linezolid 600 mg/12h i.v. ó Daptomicina 8-10 mg/Kg/24h i.v. ± Gentamicina 3 mg/Kg/24h i.v. Aztreonam 1000-2000 mg/8h i.v. Enterobacterias BLEE: Ertapenem 1000mg/24h i.v. Enterobacterias ampC: Ertapenem 1000mg/24h i.v. Cefepime 2000mg/8h i.v. Ciprofloxacino 400 mg/12h i.v. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 21 ______________________________________________________________________________ P. aeruginosa Candida spp. Meropenem 2 1000 mg/8h i.v. ó Imipenem 500-1000mg/6h i.v. ó Piperacilina-tazobactam 2 4000/500 mg/6h i.v. ± Tobramicina 5-7 mg/Kg/24h i.v. ó Amikacina 15 mg/Kg/24h i.v. P. aeruginosa Multirresistente Regímenes basados en Colistina 2-3 MUI/8h i.v. Amikacina ≥15 mg/Kg/24 h i.v. Aztreonam 2000 mg/8h i.v. Fluconazol Inicial: 12 mg/kg i.v. 6 mg/Kg/d i.v. ó v.o. ó Caspofungina Inicial: 70 mg i.v. 50 mg/24h i.v. ó Micafungina 100 mg/24h i.v. ó Anidulafungina Inicial: 200 mg i.v. 100 mg/24h i.v. ó Anfotericina B liposomal 3-5 mg/Kg/24h i.v. ó Voriconazol Inicial 6 mg/kg/12h; 2 dosis 3 mg/Kg/12h i.v. ó v.o. Las peculiaridades de este microorganismo obligan a hacer un “tratamiento a medida”, que en el caso de multirresistencia, suele basarse en combinaciones de los siguientes fármacos: Imipenem 500 mg/6h i.v. Sulbactam 1000mg/6-8h i.v. Colistina 2-3MUI/8h i.v. Tigeciclina 50 mg 3/12h i.v. Rifampicina 600 mg/24 h i.v. Minociclina 100mg 4/12h Acinetobacter baumannii Stenotrophomonas maltophilia Ceftazidima 2000 mg/8h i.v. ó Cefepime 2000 mg/8h i.v. ó Ciprofloxacino 400 mg/8h i.v + Tobramicina 5-7 mg/Kg/24 h i.v. ó Amikacina 15 mg/Kg/24 h i.v. Cotrimoxazol 5/25 mg/Kg/8h i.v. 1. El tratamiento secuencial v.o. debería plantearse una vez cumplidas las siguientes condiciones: pacientes estables clínicamente, hemocultivos de control (72h) negativos, 5-7 días de antibioterapia i.v. ETE negativa o ausencia de material protésico endovascular; 2. En caso de infecciones graves se debe valorar el uso de infusiones extendidas (3-4 horas) de piperacilina-tazobactam (4/0.5 g i.v. cada 8h) y meropenem (1g i.v cada 8h), tras una primera dosis en 30 minutos; 3. Inicial: 100 mg i.v.; 4. Inicial: 200 mg. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 22 ______________________________________________________________________________ 7. COMPLICACIONES DE LAS INFECCIONES RELACIONADAS CON CATÉTER Las infecciones relacionadas con catéteres venosos reciben el nombre de complicadas si provocan tromboflebitis supurada (TS) o complicaciones hematógenas a distancia (principalmente endocarditis, artritis séptica y espondilodiscitis) 19. La incidencia de complicaciones hematógenas a distancia no está bien analizada con estudios prospectivos, salvo en el caso de la BRC por Staphylococcus aureus. Estas complicaciones ocurrieron en el 13% de 324 pacientes consecutivos con esta entidad seguidos durante tres meses, distribuyéndose de la siguiente manera: endocarditis (9.5%), artritis séptica (3.4%), espondilodiscitis (2.1%), y dos o más de estas complicaciones a la vez (1.8%) 168. La incidencia de espondilodiscitis hematógena nosocomial por S. aureus fue del 0.7% en un estudio danés que incluyó 5222 pacientes con bacteriemia nosocomial por dicho microorganismo en un período de 10 años. En una tercera parte de las bacteriemias, el origen fue un catéter intravenoso 169,170. 7a. Tromboflebitis supurada 7a1. Definición y clasificación La tromboflebitis supurada, también denominada “séptica”, es la inflamación de la pared de la vena causada por la presencia de microorganismos, la cual suele asociar trombosis, pus dentro de luz (“vena abscesificada”), inflamación perivascular, bacteriemia persistente y elevada morbimortalidad 171. De igual modo que se afecta la pared de una vena puede afectarse la pared de una arteria (endarteritis supurada o séptica) 172. En este apartado únicamente abordaremos el manejo de la TS asociada a catéter (TSAC), y así, hablaremos de TSAC superficial cuando el catéter está colocado en una vena periférica, y de TSAC profunda si se trata de un CVC. Habitualmente se presenta como una bacteriemia con signos de sepsis franca, que persisten después de la retirada del catéter 173. Por lo tanto, dado que no es infrecuente que aparezca trombosis “no séptica” como complicación de la implantación de catéteres venosos centrales en pacientes con cáncer u otras patologías médicas crónicas 174, y dado que en algunos de estos pacientes puede coexistir una BRC con poca repercusión clínica y de rápida resolución con el manejo apropiado, deberemos distinguir entre la “bacteriemia asociada a trombosis de un catéter” (hemocultivos positivos más evidencia radiológica de trombosis en la vena independientemente del estado clínico del paciente y de la duración de la bacteriemia) de una verdadera TSAC, en la que la bacteriemia se acompaña de: a) marcada afectación del estado general y con frecuencia signos de sepsis grave; y b) persistencia de la bacteriemia varios días tras la retirada del catéter y uso apropiado de antimicrobianos. En un estudio sobre bacteriemia por S. aureus asociada a trombosis de un CVC, la bacteriemia fue persistente (una media de 3.7 días tras el inicio de tratamiento antimicrobiano adecuado) en el 44% de los pacientes con trombosis 175. Es decir, en este estudio, menos de la mitad de los pacientes con trombosis y bacteriemia por S. aureus deberían ser catalogados como portadores de una TSAC. 7a2. Epidemiología y patogenia En una serie de 102 episodios de sepsis relacionada con catéter periférico, sólo el 7% tuvieron TSAC 34. En otro estudio, se detectaron sólo 29 episodios de TSAC superficial entre los pacientes atendidos en un gran hospital en un período de cuatro años 176. Finalmente, se ha estimado una incidencia global de TSAC superficial de 88 casos por cada 100.000 altas hospitalarias 177. La presencia TSAC profunda fue detectada, en un estudio retrospectivo, en el 16.4% de los pacientes con cáncer y BRC asociada a CVC (BRC-CVC) por S. aureus 178. Esta cifra contrasta con la alta incidencia de trombosis encontrada en un reciente estudio de 48 pacientes consecutivos con BRC-CVC por S. aureus, donde todos los pacientes fueron sometidos a ecografía en búsqueda de trombosis asociada. El porcentaje de trombosis radiológica definitiva o probable alcanzó el 71%, aunque en menos del 50% se evidenció persistencia de la bacteriemia 175. La trombosis asociada a un CVC se detecta más frecuentemente en la vena yugular interna que en la vena subclavia) 179. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 23 ______________________________________________________________________________ Clásicamente, la TSAC superficial era una patología que se daba principalmente en pacientes quemados 180. Sin embargo, hoy día la TSAC es una complicación muy rara de los CVP, siendo mucho más frecuente como complicación de un CVC, en pacientes con cáncer 178, en aquéllos en tratamiento con esteroides 183 y en pacientes críticos 184-186. El principal mecanismo patogénico de la TSAC superficial es la migración de microorganismos por vía extraluminal 177. A nivel de los CVC puede ocurrir tanto que la trombosis favorezca la BRC, como el que la infección relacionada con el catéter induzca una respuesta inflamatoria que favorezca la trombosis 179,185. 182 7a3. Etiología En la TSAC, los microorganismos implicados son los mismos que causan las infecciones asociadas a catéter no complicadas 178,184,186-191. 7a4. Clínica La mayoría de los pacientes con TSAC se presentan con fiebre alta y evidencia de sepsis grave, las cuales pueden persistir pese a la instauración de un tratamiento antimicrobiano adecuado 192. Los signos locales inflamatorios aparecen en más del 90% de los pacientes con TSAC superficial 187. Estos signos incluyen el enrojecimiento y dolor a la palpación del trayecto venoso (el cual puede estar tortuoso y engrosado) y, a veces, la presencia de pus drenando por el punto de inserción (espontáneamente o a la presión sobre la vena) o bien, la presencia de un absceso periflebítico 171,187,188,191. La TSAC puede acompañarse de émbolos pulmonares sépticos y otras infecciones metastásicas, constituyendo en ocasiones su forma de presentación 186,192. En un estudio en individuos con cáncer y BRC por S. aureus, 12 pacientes fueron diagnosticados de TSAC. Cinco de ellos desarrollaron complicaciones infecciosas metastásicas en órganos profundos, incluyendo émbolos pulmonares sépticos y endocarditis, en comparación con 2 de 38 pacientes sin TSAC. En esta serie, más de la mitad de los casos fatales presentaban abscesos metastásicos y émbolos pulmonares sépticos 192. Estos datos contrastan con la ausencia de émbolos pulmonares clínicamente significativos en otro estudio sobre 37 pacientes con bacteriemia por S. aureus y trombosis venosa central asociada a catéter 175. En la TSAC profunda el paciente presenta los signos de sepsis grave con escasos síntomas/signos locales de infección, aunque a veces el paciente aqueja dolor en la base del cuello, fosa supraclavicular u hombro 173,193, y se puede apreciar edema distal a la vena comprometida 169,183,194, o disfunción del catéter 185. Cuando la trombosis no es oclusiva puede ser totalmente asintomática 178. Hallazgos del examen físico que pueden indicar la presencia de trombosis son: a) una diferencia ≥2 cm en las circunferencias de los brazos medidas 5 cm por encima del olécranon; b) distensión venosa asimétrica visible del tórax y/o del brazo ipsilateral o contralateral; y c) venas de la mano distendidas persistentemente tras la elevación del brazo ipsilateral o contralateral 175. La sensibilidad de estos hallazgos fue ≤24% en una serie de pacientes con bacteriemia por S. aureus y trombosis venosa asociada a catéter de las venas yugular interna, braquial o subclavia. La TSAC superficial suele aparecer tras más de 3 días de canulación venosa 176,191, con un rango entre 1 y 12 días y una mediana de 4 días 176. Para la TSAC profunda se ha descrito una media de 13-14 días de duración de la canulación venosa central previa a la aparición de la TS, con un rango de 6-30 días 183,184. A veces los síntomas aparecen después de la retirada del catéter implicado (2-10 días), pues el trombo intravascular y el absceso intraluminal pueden permanecer intactos tras su retirada 173,182,184. 176,187 Los pacientes con TSAC causada por un catéter en una arteria periférica pueden presentarse con un pseudoaneurisma o lesiones embólicas de la mano 172,195. 7a5. Pruebas diagnósticas La TSAC debe ser sospechada en cualquier paciente con bacteriemia o funguemia persistente (tras 72 horas de tratamiento antimicrobiano adecuado) que sea portador de un catéter o que lo haya portado recientemente, en Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 24 ______________________________________________________________________________ ausencia de otra infección endovascular (por ejemplo, endocarditis) 19,171,173. Para confirmar la sospecha clínica se requiere la demostración de pus en la vena o la presencia radiológica de un trombo en la misma 19,173. La presencia de pus franco en una vena periférica, que puede ponerse de manifiesto por presión (“ordeñar”) o mediante punción con aguja (de al menos un 18 G) y aspiración con jeringa (manteniendo una presión negativa de 2-3 cc durante al menos 15-20 segundos antes de retirar la aguja), se encuentra en la mitad de los casos, y este hallazgo establece por sí solo el diagnóstico de TSAC superficial 173. El material aspirado se enviará para la realización de tinción de Gram y cultivo. Si no se obtiene pus, se debe proceder a la realización de una ecografíadoppler del territorio venoso sospechoso, en búsqueda de signos de trombosis 19. Si el paciente porta o ha portado un catéter central, el paso siguiente será demostrar el trombo mediante pruebas radiológicas. Se ha utilizado de forma clásica la venografía 183,184,186, la cual ha sido reemplazada en los últimos años por la ecografía-doppler 175,185 y la tomografía computerizada (TC) con contraste 196,197. La ecografía es la primera técnica radiológica a realizar para confirmar la presencia y extensión de la trombosis en la sospecha de TSAC 175,185. Permite diagnosticar la trombosis de la extremidad superior con una sensibilidad del 70-100% y una especificidad del 93% 198. Es la prueba de elección tanto para el diagnóstico de la TSAC superficial como de la TSAC profunda que afecta a las venas centrales “menos profundas”, como yugular interna, axilar, subclavia (menos su parte interna) o femoral 185. El diagnóstico de trombosis “definitiva” se realiza cuando se evidencia la suma de a) un trombo (masa intraluminal ecogénica), más b) la no compresibilidad de la vena o un determinado patrón anormal de flujo venoso. Se considera un diagnóstico de trombosis “posible” si cualquiera de los tres hallazgos mencionados está presente 175. Esta prueba pierde sensibilidad si el trombo no es oclusivo o si se encuentra en regiones más profundas (por debajo de la clavícula) 199,200. En estas situaciones (parte interna de la subclavia, venas innominadas y vena cava superior), ante una ecografía no concluyente o no diagnóstica, para confirmar el diagnóstico hay que recurrir a la TC. Aunque la venografia aporta la mejor definición del trombo y de las anomalías del territorio venoso 201, la TC es probablemente igual de sensible y no invasiva 178,198,200. La TC, además de poner de manifiesto la presencia de defectos de repleción o trombos, evidencia la inflamación de los tejidos blandos adyacentes 198. La resonancia magnética se ha mostrado útil, pero la experiencia es muy limitada 202,203. La gammagrafia con leucocitos marcados con indio y la gammagrafía con galio no parecen muy útiles 183,204. Existe poca experiencia con la tomografía con emisión de positrones, la cual podría además de detectar la trombosis, distinguir entre tromboflebitis supurada y trombosis venosa profunda no supurada 205. El microorganismo responsable de la TSAC se identifica normalmente por los hemocultivos (en el 80-90% de los pacientes con TSAC superficial se detecta bacteriemia). La aspiración con jeringa a nivel de la vena trombosada, o el cultivo directo de la vena extirpada pueden permitir también el aislamiento del microorganismo responsable 175. En una serie, el cultivo de la vena extirpada fue positivo en el 83% 187. La radiografía de tórax puede revelar múltiples infiltrados periféricos (cavitados o no) como expresión de embolismos sépticos, imágenes de abscesos o derrame pleural (empiema). 7a6. Tratamiento Los principios del tratamiento en la TSAC son 173: (1): retirada del catéter; (2): instauración rápida de antimicrobianos por vía intravenosa y a altas dosis; (3): consulta con el cirujano vascular para valorar la venotomía en caso de TSAC superficial y; (4): considerar la anticoagulación. La evidencia para estas recomendaciones es escasa, ya que no existen estudios aleatorizados para guiar la óptima elección o duración del tratamiento antimicrobiano, la resección de la vena comprometida, y el uso de la anticoagulación 19. Ante la sospecha clínica de TSAC, se debe proceder a la retirada del foco que inició la infección 19,168,206. Clásicamente la TSAC superficial se ha considerado una entidad quirúrgica 176,180-184,207. Sin embargo, 17 de 54 pacientes con TSAC superficial fueron tratados de forma conservadora en otro estudio (calor local, elevación del miembro afecto y antibioterapia sin cirugía), sin que hubiese ningún exitus. Los autores de este trabajo aconsejan la resección de la vena implicada sólo si no hay respuesta al tratamiento antibiótico (deterioro clínico o persistencia de los signos de sepsis) 187. En caso de cirugía, se aconseja proceder a la ligadura, drenaje y resección de la vena afecta y de sus tributarias comprometidas, así como al drenaje de los abscesos periflebíticos contiguos 173,208. La ligadura aislada no Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 25 ______________________________________________________________________________ se considera adecuada, ya que no extirpa el foco séptico, y la bacteriemia puede recurrir a través de vasos colaterales 209 . Sin embargo, una cirugía menos radical en la TSAC superficial podría también ser útil. Así, en un estudio compuesto por 8 niños con TSAC superficial, 6 de ellos curaron con incisión local y drenaje del sitio afecto sin resección de la vena, junto con antibioterapia parenteral 176. La resección extensa podría reservarse para pacientes en los que falla esta medida. Aunque es factible hacer exploración quirúrgica con ligadura o resección de la vena yugular interna, como se ha descrito en casos de síndrome de Lèmierre 204,210 y aunque hay alguna experiencia con la ligadura de la vena cava inferior, resección de venas femorales e ilíacas y el uso de catéteres de Fogarty para la extracción de trombos infectados de las grandes venas del tórax 182, el tratamiento de la TSAC profunda se ha basado principalmente en la terapia prolongada con antimicrobianos por vía intravenosa (dado lo agresivo de las técnicas quirúrgicas) con relativamente buenos resultados en series cortas 183,184,208,209,211,212. Por lo tanto, salvo en casos de sepsis refractaria o embolismos pulmonares sépticos recurrentes, no se intentará ninguna de las opciones quirúrgicas mencionadas 173,187. El drenaje quirúrgico de colecciones perivasculares puede ser necesario en la TSAC profunda de las venas del cuello o del tórax. La duración óptima de la terapia antimicrobiana de la TSAC no está establecida. Para la TSAC profunda provocadas por S. aureus o Candida spp., se ha propuesto una terapia intravenosa prolongada (duración mínima de 4-6 semanas tras la retirada del catéter comprometido) con objeto de erradicar posibles focos metastásicos que se hayan producido durante la bacteriemia o fungemia prolongada característica de la TSAC, asemejando la duración del tratamiento al de la endocarditis infecciosa 19,46,113,183,184,192,213. En los casos de TSAC superficial sometidas a resección de la vena implicada, en los que no se hayan producido complicaciones metastásicas, la duración de la terapia antimicrobiana podría ser acortada. Así, en un estudio en niños, la mediana de tratamiento antibiótico empleado tras la cirugía en las TSAC superficial no complicada fue de 11 días (rango 7-21 días) 171. En caso de que el microorganismo implicado sea S. aureus, parece lógico proceder como en cualquier bacteriemia complicada por este microorganismo, prolongar el tratamiento 4 semanas y realización de una ecocardiografía transesofágica para descartar endocarditis 19. Aunque no hay evidencia sobre los beneficios de la anticoagulación con heparina en la TS, al no existir estudios comparativos, ésta ha sido recomendada por algunos autores, sobre todo en presencia de TSAC-profunda, ya que la literatura sugiere que la combinación de heparina (intravenosa o subcutánea) con antibióticos se asocia con baja mortalidad en la TS de las venas pélvicas, yugular interna, subclavia, cava, femoral y/o ilíaca 183,186,207,209,212,214. En un estudio publicado, los pacientes con trombosis central y BRC por S. aureus que no fueron anticoagulados tuvieron una peor evolución (muerte o recurrencia de la bacteriemia) que los anticoagulados (37% vs. 20%), pero estas diferencias no alcanzaron significación estadística. La experiencia con trombolisis en la TSAC es anecdótica 215 . Recomendaciones 1. Ante un paciente con bacteriemia o fungemia persistente portador de un catéter o que lo haya tenido recientemente, sin otro foco evidente de infección endovascular, debe sospecharse la presencia de TSAC (AII). 2. Se debe distinguir una verdadera TSAC (sepsis grave, bacteriemia persistente) del término más amplio “bacteriemia asociada a trombosis de un catéter” (hemocultivos positivos independientemente del estado clínico del paciente y de la duración de la bacteriemia) (CIII). 3. La sospecha de TSAC, debe confirmarse por la demostración de pus en una vena periférica, o bien la demostración por técnicas radiológicas de trombo en la vena afecta (AII). 4. Ante un paciente con un cuadro clínico-radiológico compatible con embolismos pulmonares sépticos debe descartarse la presencia de una TSAC, sobre todo tras haber descartado la presencia de una endocarditis derecha (AII). 5. Para descartar la TSAC superficial debe procederse en primer lugar a la inspección cuidadosa de todas las venas canuladas previamente, ya que es posible que la TSAC superficial pueda manifestarse con escasos signos locales y días después a la retirada del catéter implicado (AII). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 26 ______________________________________________________________________________ 6. Los hallazgos físicos que sugieren la presencia de trombosis de las venas centrales tienen poca sensibilidad, por lo que su ausencia no debe ser impedimento para la realización de pruebas radiológicas para descartar la TSAC (AI). 7. La ecografía-doppler es la técnica inicial para la demostración del trombo en casos de TSAC profunda (AIII). 8. Ante un estudio ecográfico no concluyente o no diagnóstico se debe recurrir a la TC con contraste para confirmar la sospecha de TS (CIII). 9. En caso de TSAC se debe proceder a la retirada inmediata del catéter sospechoso de haber iniciado el cuadro, independientemente del tipo de catéter que porte el paciente y del microorganismo implicado (AII). 10. En caso de TSAC superficial, se puede iniciar un manejo conservador con calor local, elevación del miembro afecto y antibioterapia. Si en 24 horas no hay mejoría (deterioro clínico o persistencia de los signos de sepsis grave) se debe proceder a la cirugía exploradora del trayecto venoso (CIII). 11. En este caso, se debe realizar la resección de la vena afecta y de sus tributarias comprometidas, así como el drenaje de los abscesos periflebíticos contiguos (AIII). 12. En caso de TSAC profunda, la cirugía está indicada sólo para el drenaje de colecciones perivasculares (AII), o en aquellos casos de sepsis refractaria o embolismos pulmonares recurrentes (CIII). 13. La sospecha de TSAC implica el empleo precoz de antimicrobianos por vía intravenosa y a altas dosis (AII). 14. En la TSAC profunda la duración del tratamiento antimicrobiano se debe equiparar al de la endocarditis infecciosa (CIII). 15. En la TSAC superficial por S. aureus parece lógico prolongar el tratamiento antimicrobiano durante al menos 4 semanas como cualquier bacteriemia complicada por este microorganismo (AII). Para otros microorganismos, la duración del tratamiento podría acortarse a 2-3 semanas si se realiza resección de la vena afecta y no hay evidencia de complicaciones metastásicas (CIII). 16. No hay evidencia en el momento actual para recomendar sistemáticamente la anticoagulación con heparina en la TSAC, aunque en la TSAC profunda hay autores que la recomiendan (CIII). 8. MANEJO DE LA INFECCIÓN ASOCIADA A CATÉTER VENOSO PERIFÉRICO Los catéteres venosos periféricos (CVP) son uno de los dispositivos invasivos más frecuentemente empleados en el medio hospitalario, hasta un 70% de los pacientes hospitalizados requieren su inserción 216. A pesar de la enorme experiencia en la utilización de CVP, en la actualidad todavía existe controversia en la relevancia clínica de la bacteriemia relacionada con este dispositivo. La incidencia descrita de BRC asociada a CVP es variable según los trabajos publicados 43,217-219 y, aunque en un meta-análisis compuesto por 200 estudios prospectivos, en el que se analizó el riesgo de bacteriemia en adultos asociada a dispositivos intravasculares, se halló que los CVP eran los de menor riesgo 220, recientemente se han comunicado trabajos en los que CVP y CVC compartían cifras de incidencia similares 43,216. A pesar del menor riesgo individual de bacteriemia del CVP frente al CVC, el uso más frecuente en la práctica clínica de los primeros implica un porcentaje nada despreciable de complicaciones asociadas a estos dispositivos. En un estudio prospectivo multicéntrico de cohortes, que analizaba 127 episodios de endocarditis infecciosa relacionada con la asistencia sanitaria, la principal causa de bacteriemia era la manipulación vascular y entre éstas, el CVP estaba implicado en un 32% de las ocasiones 217 . Aunque existen diferentes publicaciones que muestran una pobre relación entre la aparición de flebitis y BRC 219-221, son cada vez más frecuentes las infecciones profundas, de etiología predominantemente estafilocócica (siendo S. aureus el principal microorganismo implicado), asociadas al desarrollo de flebitis relacionadas con un catéter venoso periférico 217. Si se sospecha BRC se deben extraer hemocultivos y enviar el catéter al laboratorio de Microbiología. En aquellos casos de sepsis grave y/o shock séptico, signos locales de infección supurada, neutropenia u otra inmunodepresión grave o presencia de cualquier material protésico distinto al catéter, iniciar Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 27 ______________________________________________________________________________ además tratamiento empírico intravenoso. En ausencia de estos signos y síntomas de gravedad, la antibioterapia podría demorarse hasta disponer del aislamiento microbiológico 222. Si el cultivo de la punta del catéter muestra una colonización pero los hemocultivos son negativos y desaparecen los síntomas tras la extracción del CVP, se recomienda monitorización clínica ya que, en muchos casos, la retirada del catéter conduce a la curación en ausencia de antibioterapia 219,221. En aquellos pacientes, inmunocompetentes y no portadores de material protésico con manifestaciones exclusivamente locales, sólo es necesario la retirada del catéter pero no se recomienda la extracción de hemocultivos ni el envío sistemático del catéter al laboratorio de Microbiología. El significado clínico de un hemocultivo positivo de SCN es motivo de continua discusión, por la dificultad que supone diferenciar la contaminación de una verdadera bacteriemia 223,224. Este aspecto, junto a la reducida virulencia de estos microorganismos permite recomendar que, si se ha retirado el catéter, el paciente está estable y no es portador de material protésico, la BRC por SCN no requiere tratamiento antibiótico 222. La bacteriemia por S. lugdunensis, que como ya se ha comentado está relacionada con un elevado porcentaje de complicaciones, exige un manejo específico y diferente al resto de especies de SCN 119. Recomendaciones 1. El CVP que presente signos inflamatorios debe ser retirado (AI). 2. Ante la sospecha de BRC debe realizarse un hemocultivo (AII). En pacientes inestables, inmunodeprimidos o portadores de material protésico, se debe iniciar tratamiento antibiótico inmediato (AII). En ausencia de estos factores de mal pronóstico se puede optar por vigilancia sin tratamiento médico, hasta la obtención de los resultados microbiológicos (CIII). 3. En el caso de flebitis sin signos de afectación sistémica en un paciente inmunocompetente y no portador de material protésico, no se extraerán hemocultivos y se reevaluará al paciente en 24-48h (AII). En este tipo de pacientes, ante la presencia de fiebre y signos inflamatorios locales se extraerán hemocultivos y se retirará el CVP, valorando su envío al laboratorio de Microbiología para cultivo del segmento distal (CIII). 9. MANEJO DE LA INFECCIÓN ASOCIADA A CATÉTERES VENOSOS CENTRALES PERMANENTES Estos catéteres pueden dividirse en catéteres centrales tunelizados, en los que existe un extremo abierto al exterior tras una previa tunelización, como los catéteres de Hickman®, Broviac® o Groshong® (Figura 5) y en aquellos dispositivos subcutáneos de implantación completa que disponen de un reservorio subcutáneo, con una membrana para punción, como el Port-a-Cath® (Figura 6). Figura 5. Figura 6. Normalmente se utilizan para quimioterapia y por su propia naturaleza (alto coste, necesidad de implantación quirúrgica y pacientes ya de por sí deteriorados en muchas ocasiones) constituyen un grupo donde es necesario asegurar al máximo el diagnóstico de infección, antes de una retirada no necesaria. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 28 ______________________________________________________________________________ En el tratamiento de las infecciones que afectan a estos dispositivos, debemos tener en cuenta tres aspectos: 1) tipo de infección: local (puerta de entrada o reservorio y túnel) ó sistémica (hemocultivos positivos); 2) infección complicada o no; y 3) etiología microbiana. 9a. Tratamiento de la infección local Infección local no complicada. Signos inflamatorios y/o exudación no purulenta del punto de inserción con cultivos locales positivos, en ausencia de fiebre. Puede intentarse un abordaje local con curas tópicas que incluya el uso de agentes antimicrobianos como la mupirocina en pomada (en casos de S. aureus) o el ketoconazol (Candida spp.) 225. En caso de que no se logre respuesta pueden utilizarse antimicrobianos sistémicos y si esto también falla, entonces debe retirarse el catéter 226. Infección local complicada. Presencia de absceso en el extremo distal (“reservoritis”) o a lo largo del trayecto subcutáneo (“tunelitis”). En estos casos, debido al elevado inóculo, debe retirarse todo el sistema y realizar tratamiento antimicrobiano dirigido durante 7-10 días 227. También se incluye la inflamación del trayecto subcutáneo más allá de los 2 cm circundantes al punto de inserción del CVC, en ausencia de fiebre. Si se acompaña de bacteriemia o candidemia debe tratarse como una infección sistémica. 9b. Tratamiento de la infección sistémica Infección sistémica complicada. Definida por la presencia de uno o varios de los siguientes factores: persistencia de la fiebre o hemocultivos positivos a las 72 h de la retirada del sistema o del inicio del tratamiento, presencia de material protésico implantado previamente (prótesis valvulares o articulares, marcapasos…), shock séptico, tromboflebitis o infecciones metastásicas (embolismos a distancia, endocarditis, osteomielitis, retinitis). En estos casos, el CVC debe retirarse siempre, administrando tratamiento antimicrobiano 4- 6 semanas y hasta 8 en caso de sospecha de osteomielitis 225. No está establecido cuál es el momento más adecuado para la reimplantación de un nuevo catéter, dado que no existen estudios al respecto. Por esto, las recomendaciones actuales se basan en opiniones de expertos 228. Conocemos por estudios descriptivos que el riesgo de infección de un dispositivo intravascular protésico es elevado cuando existe bacteriemia por S. aureus 87,229, por lo que en estos casos parece razonable implantar el nuevo catéter una vez que no exista bacteriemia. Si es posible, usar un acceso contralateral; si no, el trayecto subcutáneo y el punto de acceso vascular tienen que estar separados del acceso vascular previo, al menos 23 cm. Infección sistémica no complicada. Aquella en la que no está presente ninguno de los factores arriba mencionados. Cuando esto se cumple y no hay signos de reservoritis o tunelitis, podría intentarse el tratamiento conservador, especialmente en pacientes en los que la retirada del sistema sea muy dificultosa, bien por razones inherentes al sistema (adherencias intravasculares tras largo tiempo de implantación) o al paciente (coagulopatía, dificultades anatómicas, situación crítica o corta esperanza de vida). Y es que la colocación de estos dispositivos es gravosa y no está exenta de complicaciones 230,231, lo que otorga interés al intento de tratamiento de la infección conservando el catéter, siempre y cuando la probabilidad “a priori” de erradicarla sea razonablemente alta y la de que el paciente desarrolle nuevas complicaciones de la bacteriemia, relativamente baja 19. 9c. Manejo de la infección sistémica conservando el catéter. Papel del sellado con antimicrobianos y del recambio sobre guía La tasa media de éxito en el manejo de la BRC conservando el dispositivo y utilizando antimicrobianos sistémicos administrados por vía intravenosa (generalmente a través del propio catéter infectado) es sólo del 67% 232, variando según los diferentes estudios entre el 32 y el 74%, en función del tipo de germen y de los criterios de respuesta elegidos 233-236. Además, este tipo de tratamiento se asocia a una elevada probabilidad de recurrencia tras suspender el antibiótico, incluso en infecciones por bacterias de menor virulencia como SCN 237,238. La dificultad para erradicar la infección del catéter central se atribuye principalmente a que los microorganismos causantes se ubican en el interior de la biocapa que recubre el catéter. La actividad de los antimicrobianos frente a las bacterias y hongos de la biocapa se reduce notablemente respecto a los mismos gérmenes en situación planctónica, requiriendo una concentración erradicadora del biofilm más de mil veces superiores a los de la CMI, además de tiempos Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 29 ______________________________________________________________________________ prolongados de interacción fármaco-microorganismo 239-242. En los primeros 10 días tras la colocación del catéter, la biocapa bacteriana predomina en la superficie extraluminal del mismo, mientras que a los 30 días su localización es habitualmente intraluminal 44. La ubicación predominantemente intraluminal de la biocapa permite mejorar los resultados del tratamiento en la infección del catéter de larga duración, rellenando la luz del mismo con una solución concentrada del antimicrobiano adecuado durante periodos prolongados, modalidad de tratamiento denominada sellado con antimicrobianos (SA), un término acuñado y comunicado por primera vez por Messing y cols. en 1988 243 . Los estudios sobre recambios a través de una guía han mostrado resultados no concluyentes, probablemente debido a los diferentes criterios utilizados, en cuanto al origen de la bacteriemia y recidivas. Así, un estudio retrospectivo evidenció que el riesgo de recidivas y mortalidad era similar en el grupo tratado con el recambio de catéter mediante guía frente al que se retiraba definitivamente 244, mientras que en otro estudio descriptivo, el 18% de los pacientes a los que se les recambió el catéter desarrollaron recidivas 245. En ambos casos se realizó esta técnica en pacientes clínicamente estables y sin signos de infección del trayecto subcutáneo. En todo caso, siempre que se intente el tratamiento conservador, debe considerarse cada caso de manera individual (situación del paciente y microorganismo aislado) y una vez iniciado el tratamiento, hacer siempre una reevaluación a las 72 h del inicio. En caso de persistencia de la fiebre o positividad de los hemocultivos en este intervalo, la infección debe considerarse “complicada” y retirarse todo el sistema. 9c1. Experiencia clínica en el tratamiento de la infección del catéter venoso mediante sellado con antimicrobianos A pesar de gozar de una sólida base conceptual, los numerosos estudios efectuados sobre la utilidad del SA en el tratamiento de la BRC son en su inmensa mayoría observacionales y/o se caracterizan por una gran heterogeneidad metodológica, lo cual dificulta enormemente extraer recomendaciones generales 246, al contrario de lo que ocurre con su uso en profilaxis, donde su eficacia ha sido bien demostrada 247. Tan solo en cuatro trabajos 248-251 se ha comparado el SA con la administración exclusivamente sistémica de antimicrobianos y sólo uno es un ensayo aleatorizado 249, en el que no se alcanzó el tamaño muestral previamente calculado. En estos cuatro estudios, que incluyeron tanto CCT como dispositivos subcutáneos totalmente implantados, la tasa de éxito del SA (combinando resultados clínicos y microbiológicos) varió entre 67 y el 97%, frente al rango del 43 al 66% obtenido con la administración sistémica de antimicrobianos y sin diferencias en mortalidad atribuible a la BRC. En el campo de los catéteres tunelizados para hemodiálisis no existe ninguna comparación directa entre SA y recambio con guía, una técnica que, en algunos trabajos 233,234, permitió evitar la colocación de un nuevo acceso en más del 80% de los episodios. En 30 estudios no comparativos que evaluaron la efectividad y otros resultados del SA 243,252-263,263-271, la diversidad en tipo de pacientes, clase de catéteres, elección del antimicrobiano, posología y concentración del mismo, criterios de respuesta favorable, etc., resulta impresionante. En este conjunto de trabajos, la efectividad del SA resultó en general elevada, considerándose una tasa de éxito en la BRC superior al 60% en 22 de los 30 y mayor del 80% en 18 de ellos, si bien no puede excluirse el sesgo de inclusión propio de este tipo de estudios. La mortalidad atribuible a la BRC fue nula o muy reducida y la permanencia del catéter se prolongó en 2 meses, como media, en las series que informaron de estos dos resultados 246. En la gran mayoría de los trabajos previamente mencionados (31 de 34) los pacientes recibieron antibióticos sistémicos además del sellado. Las pautas utilizadas fueron asimismo muy diversas en cuanto al fármaco elegido y a su duración, incluyendo la administración oral en algún caso 272. El SA sin antibióticos sistémicos ha dado buenos resultados en casos de colonización, sin bacteriemia, de catéteres tunelizados 273. Varios factores influyen en la efectividad del SA en el tratamiento de la BRC. El más importante es, probablemente, el germen causal. La tasa de éxito descrita para BGN, SCN y Staphylococcus aureus ha sido del 87100%, 75-84% y 40-57%, respectivamente 248,262,274. Además, se han descrito complicaciones serias a distancia hasta en el 10% de los pacientes con infección por Staphylococcus aureus. Aunque no hay datos específicos sobre el tratamiento de la BRC por Staphylococcus lugdunensis mediante SA, ciertos autores aconsejan manejar las infecciones graves por este patógeno de especial virulencia como si se tratara de Staphylococcus aureus 19,119,275. La infección polimicrobiana del catéter se asocia a mayor probabilidad de fracaso del sellado 276. En una serie reciente que incluyó casos de BRC por Enterococcus spp, BGN y bacilos gram positivos la respuesta fue favorable en el 89% Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 30 ______________________________________________________________________________ de los episodios 277. Sin embargo, en otro trabajo sobre 64 episodios de BRC por Enterococcus spp. tratados con SA, la tasa de éxito resultó solo del 61% y aparecieron complicaciones importantes a distancia en el 6% de los casos 278. La experiencia de tratamiento con SA de la BRC por Pseudomonas spp. y otros BGN no fermentadores es escasa. En los pocos casos descritos se obtuvo una respuesta favorable en la mitad de los episodios 248,261. Debido a que la retención del catéter se ha asociado a mayor mortalidad en la candidemia, la recomendación habitual en casos de BRC por Candida spp. es la retirada del catéter responsable 146. No obstante, no todos los autores están de acuerdo con ello 279,280 y hay informes sobre un reducido número de pacientes tratados eficazmente mediante SA con antifúngicos (habitualmente anfotericina B convencional o liposómica) 281-284. Aunque una vez más los datos son escasos, el fracaso del SA ha resultado, en algunas series, más frecuente en bacteriemias asociadas a dispositivos subcutáneos de implantación completa (75-82%) que en las originadas en catéteres centrales tunelizados (25-50%) 257,285. Otro factor que influye en el resultado del SA es la precocidad con la que éste se inicia respecto a la detección de la BRC: en una serie de 264 episodios, se obtuvo el éxito en el 83% de los casos cuando el sellado se empezó recién diagnosticada la bacteriemia, disminuyendo la tasa hasta un 57% cuando se esperaron de 3 a 7 días para iniciarlo, una vez comprobada la ineficacia del tratamiento sistémico 276. Los pacientes con signos de sepsis grave en el momento de la detección de la BRC no han sido incluidos en los trabajos de SA, al igual que aquellos que presentan datos de infección del trayecto subcutáneo del CCT o de la bolsa donde se ubica, pues este tipo de tratamiento carece de sentido cuando la biocapa es de situación extraluminal. 9c2. Sellado con antimicrobianos en hemodiálisis Actualmente se está incrementando el número de pacientes hemodializados a través de catéteres centrales tunelizados, lo que supone un mayor riesgo para la infección frente a los que se dializan por fístulas arteriovenosas naturales o protésicas 286,287. En estos pacientes, la necesidad de mantener un acceso vascular permanente y cuidar accesos futuros, condiciona los intentos de conservación del catéter, más aún cuando en muchas ocasiones no existen signos clínicos locales que aseguren el origen de la bacteriemia, aunque este sea el más común 226. En pacientes en hemodiálisis, los estudios publicados en los que se ha utilizado el SA interdiálisis son en su mayoría descriptivos y con escaso número de pacientes, existiendo sólo un ensayo clínico, que incluye a pacientes portadores de diferentes tipos de catéteres permanentes 274. Los resultados, similares entre los diferentes tipos de catéteres permanentes, muestran en su mayoría una eficacia entre el 44% y el 100%, dependiendo fundamentalmente del tipo de microorganismo causal 248. Así, los resultados fueron del 40-55% para Staphylococcus aureus, próximos al 60% para Enterococci, y hasta el 87% en enterobacterias 113,278. Las infecciones causadas por SCN son las que alcanzan mejores resultados (75-100%) 248. 9c3. Hemocultivos de control cuando se realiza sellado No existen trabajos que determinen la necesidad de obtener sistemáticamente hemocultivos de control, aunque algunos estudios descriptivos los han utilizado en su protocolo para valorar la eficacia de conservar el catéter 232,248 o del tratamiento antibiótico con sellado del mismo 278. Sin embargo, en otras circunstancias, como BRC causada por Staphylococcus aureus, se ha demostrado que uno de los factores de riesgo para el desarrollo de complicaciones es la persistencia de la bacteriemia a las 72 horas del inicio del tratamiento antimicrobiano 113,288, por lo que la obtención de hemocultivos de control se considera necesaria siempre que S. aureus sea el agente etiológico. Dado que se trata de un técnica sencilla parece razonable recomendarla en todas las situaciones, especialmente cuando el microorganismo causal sea de mayor virulencia o difícil tratamiento, como S aureus, Candida spp. o, P. aeruginosa 19. Consideramos adecuada también, la realización de hemocultivos de control a la semana de finalizar el tratamiento y siempre que reaparezca la fiebre, u otro signo sugestivo de infección, durante el sellado. 9c4. Renovación del sellado El tiempo diario de permanencia del SA en el interior del catéter infectado debe ser el mayor posible, pero en la práctica está en función del uso que se necesite hacer del dispositivo. En los catéteres de nutrición parenteral o quimioterapia es frecuente que el sellado no pueda mantenerse más de 8-12 horas diarias 272,277,285, mientras que en los de hemodiálisis lo habitual es dejar el sellado desde una sesión hasta la siguiente (48-72 horas) 248,251,276,278,289. Cuando la permanencia diaria del sellado tenga que ser menor de 12 horas, algunos expertos recomiendan utilizar antibióticos de actividad dependiente de la concentración, como quinolonas y aminoglucósidos 290. La renovación del Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 31 ______________________________________________________________________________ sellado debe hacerse con la suficiente frecuencia como para garantizar la bioactividad de la solución en la luz del catéter. En este sentido, se han efectuado ensayos in vitro en los que se ha comprobado la conservación de la actividad de distintos antibióticos mezclados con heparina o citrato sódico a 37ºC durante periodos de 3-10 días y hasta de 4 semanas 291-295. Sin embargo, in vivo los hechos son diferentes. En un estudio español se comprobó que la concentración de vancomicina se redujo en un 50% en el segmento distal del catéter de diálisis a las 48 horas del sellado, fenómeno más acusado en un catéter femoral que en un catéter de subclavia 296. 9c5. Utilización de anticoagulantes en el sellado En la mayoría de los trabajos que hemos citado, la solución de sellado contenía un anticoagulante además del antimicrobiano, aunque en 7 de las series 252,255,257,265,269-271 no se utilizó ningún anticoagulante y no se apreció una incidencia aumentada de trombosis, por lo que algunos expertos consideran opcional su utilización 19,290, lo que puede ser de interés para usar antibióticos que a concentraciones altas son físicamente incompatibles con la heparina, como ciprofloxacino y levofloxacino 277,292. Las concentraciones de heparina correspondientes en la solución de sellado van de 0 a 5000 UI/mL, pero hay que ser muy cuidadosos a la hora de seguir las pautas recomendadas en la literatura americana 19, pues con frecuencia utilizan heparina sódica al 10%, que no está comercializada en España. En nuestro país se suele utilizar heparina al 1% ó al 5%, con lo que la concentración en el sellado es habitualmente de 100-500 UI/mL. Otros anticoagulantes como citrato sódico y EDTA, que al contrario que la heparina potencian la actividad de los antimicrobianos contra la biocapa, se han utilizado en el SA de los catéteres para la prevención de la BRC 297,298, pero no en su tratamiento. 9c6. Efectos adversos asociados al sellado Salvando ocasionales molestias locales en el momento del sellado, el principal efecto adverso del SA es la aparición de complicaciones derivadas de la persistencia de la bacteriemia que eventualmente podrían haberse evitado con la retirada precoz del catéter. Otro potencial riesgo, es la teórica inducción de resistencias a los antimicrobianos utilizados. En un estudio sobre prevención de la BRC mediante SA con gentamicina en catéteres de diálisis se apreció un aumento de la tasa de resistencia de SCN 299. Esta posibilidad no ha sido estudiada sistemáticamente en los estudios de tratamiento. Por último, la aparición de microembolias por el paso a la circulación sistémica de micropartículas producidas por precipitación de los fármacos durante el sellado, es una complicación que podría tener efectos adversos graves. Este fenómeno, aunque posible, no ha sido descrito hasta la fecha durante el tratamiento de la BRC con SA 300. 9c7. Antimicrobianos para el sellado Existe una notable diversidad en los antimicrobianos elegidos y sus concentraciones a la hora de preparar la solución del sellado. Una vez más, la heterogeneidad de los diseños no permite efectuar comparaciones de efectividad. No obstante, en el caso de S. aureus y SCN hay datos in vitro sobre la mayor actividad de teicoplanina en la erradicación de la biocapa del catéter respecto a vancomicina 301. Los resultados de la mayor serie de infecciones de catéteres centrales permanentes por SCN publicada recientemente apoyan esta observación de laboratorio: se conservaron todos los catéteres tratados mediante SA con teicoplanina (10 mg/mL) frente al 77% de los tratados con vancomicina (2 mg/mL) 272. No obstante, la concentración de vancomicina elegida en este último estudio pudiera ser la causa de su menor efectividad, ya que en un modelo de biocapa de S. aureus y S. epidermidis, la mínima concentración erradicadora de la misma fue de 5 mg/mL tanto para vancomicina como para teicoplanina 302 . Solo en 6 de los 34 estudios de SA comentados previamente se utilizó una concentración de vancomicina de 5 mg/mL o superior 265,268,271,276,278. La actividad de algunos antibióticos introducidos recientemente ha sido estudiada en modelos experimentales de infecciones de catéteres, pero la experiencia clínica es mínima. In vitro, la eficacia de linezolid sobre las biocapas de S. aureus y SCN es superior a la de los glicopéptidos 303-306 y ha sido utilizada con éxito en el SA (2 mg/mL) de pacientes con BRC en los que la vancomicina había fracasado 307,308. Daptomicina (5 mg/mL con calcio 0.045 mg/mL) y tigeciclina (1 mg/mL) también han mostrado buena actividad en los modelos de biocapa 309311 , así como eficacia en algunos pacientes 312,313. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 32 ______________________________________________________________________________ Los antimicrobianos y concentraciones más utilizadas en la literatura se describen en la siguiente tabla del Pozo, comunicación personal). 19,313 (Dr. JL Tabla 9.1. Sellado con antimicrobianos. Microorganismo Staphylococcus sp MS Sellado Cefazolina 10 mg/mL con heparina 100 UI/mL Teicoplanina 10 mg/mL con heparina 100 UI/mL Staphylococcus sp MR Daptomicina 5 mg/mL con calcio 0,45 mg/mL y heparina 100 UI/mL Vancomicina 2 mg/mL con heparina 100 UI/mL Levofloxacino 5 mg/mL sin heparina Bacilos gram negativos Ceftazidima 10 mg/mL con heparina 100 UI/mL Piperacilina/Tazobactam 10 mg/mL con heparina 100 UI/mL Enterococcus sp PS Ampicilina 10 mg/mL con gentamicina (si sinergia+) 2 mg/mL y heparina 100 UI/mL Enterococcus sp PR Vancomicina 2 mg/mL con gentamicina 2 mg/mL sin heparina Preparación Un vial de 1000 mg Cefazolina se reconstituye con 4 mL de agua para inyección (API) (250 mg/mL). Se aspiran 0,5 mL de esta solución a una jeringuilla de 10 mL que luego se completa aspirando 8,5 mL de suero fisiológico (SF). Finalmente se aspira con la misma jeringuilla 1 mL de heparina sódica al 1 %, obteniendo 10 mL de la solución definitiva. Un vial de 200 mg de Teicoplanina se reconstituye con 3 mL de API (66,6 mg/mL). Se aspira 1 mL de esta solución a una jeringuilla de 10 mL que luego se completa aspirando sucesivamente 5,5 mL de SF y 0,6 mL de heparina sódica al 1%. Un vial de 500 mg de Daptomicina se reconstituye con 10 mL de Ringer-lactato (50 mg/mL). Se aspira 1 mL de esta solución a una jeringuilla de 10 mL que luego se completa aspirando sucesivamente 8 mL de Ringer-lactato y 1 mL de heparina sódica al 1%. Un vial de 500 mg de Vancomicina se reconstituye con 10 mL de API. (50 mg/mL). Tomando un frasco de 50 mL de SF se extraen del mismo 7 mL que se desechan. A continuación se inyectan en el frasco sucesivamente 2 mL de la solución de Vancomicina y 5 mL de heparina sódica al 1%. De un frasco de 500 mg y 100 mL (5 mg/mL) se toma directamente el volumen necesario de solución de sellado. Un vial de 1000 mg de Ceftazidima se reconstituye con 10 mL de API (100 mg/mL). Se aspira 1 mL de esta solución a una jeringuilla de 10 mL que luego se completa aspirando sucesivamente 8 mL de SF y 1 mL de heparina sódica al 1%. Un vial de 4000 mg de Piperacilina/Tazobactam se reconstituye con 20 mL de API o SF (200 mg/mL). Se aspiran 0,5 mL de esta solución a una jeringuilla de 10 mL que luego se completa con 8,5 mL de SF y 1 mL de heparina sódica al 1%. En un frasco de 50 mL de SF del que previamente se han extraído y desechado 10 mL se inyectan sucesivamente 2 mL de solución de Ampicilina (un vial de 1000 mg reconstituido con 4 mL de API), 2,5 mL de Gentamicina tal como viene en el vial y 5 mL de heparina sódica al 1%. En un frasco de 50 mL de SF del que previamente se han extraído y desechado 4,5 mL se inyectan sucesivamente 2 mL de solución de Vancomicina (un vial de 500 mg reconstituido con 10 mL de API) y 2,5 mL de Gentamicina tal como viene en el vial. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 33 ______________________________________________________________________________ Como en cualquier manipulación del catéter vascular, el SA debe hacerse en condiciones de máxima asepsia, utilizando una jeringuilla y aguja diferentes para cada luz del catéter. Si a la hora de instilar el sellado se encuentra aún presente el líquido del sellado anterior, éste debe ser extraído. En función de la organización del centro, la solución de sellado puede ser preparada en la farmacia o en la unidad de hospitalización. La cantidad de líquido a introducir depende del tipo y el modelo del catéter. El volumen de la luz de los catéteres de Broviac va de 0.15 mL en los modelos pediátricos hasta 0.7 mL en los de adultos. Los de Hickman y Leonard tienen un volumen entre 0.6 y 1.8 mL (en los de varias luces cada una de ellas puede tener volúmenes diferentes). El conjunto del reservorio y el catéter de los CCRS tiene un volumen de 2 mL en los de una luz y de 1.2 mL por canal en los de 2 luces. Debe siempre consultarse este dato en la documentación del catéter para decidir el volumen a inyectar. 9c8. Sellado con antisépticos El sellado de los catéteres con fármacos antisépticos goza de ciertas ventajas teóricas: amplio espectro y ausencia de inducción de resistencia a los antibióticos. Algunas de las substancias estudiadas in vitro como etanol 314, EDTA 315, taurolidina o la combinación citrato/azul de metileno/parabens 316 han mostrado excelente actividad frente a biocapas bacterianas y fúngicas, así como eficacia en la profilaxis de la infección del catéter. Existe experiencia clínica limitada en el tratamiento de la BRC con sellados de taurolidina 317 y más abundante con etanol. En tres estudios con este último agente 318-320 en un total de 109 episodios de bacteriemia asociada a catéteres centrales permanentes, con predominio de SCN, la tasa de éxito terapéutico fue del 67 al 88% (75% en infección polimicrobiana). La concentración de alcohol fue del 70%, no se utilizaron anticoagulantes, el sellado se mantuvo de 4 a 24 horas/día, el tratamiento se prolongó solo 5 días y resultó bien tolerado. Todos los catéteres eran de silicona y no hay datos in vivo sobre la compatibilidad del etanol con los de poliuretano. Los pacientes con BRC y sellado con antisépticos deben recibir además antibióticos por vía sistémica. 9c9. Manejo específico por microorganismos La duración del tratamiento con SA (y de la antibioterapia sistémica concomitante) también ha sido variable diferentes trabajos (5-21 días), predominando las pautas de entre una y dos semanas 249,255,257,260,262,263,269,274,276,278,312 . en los Estafilococos coagulasa negativo. Son los agentes etiológicos más frecuentes y raramente producen (salvo en el caso de S. lugdunensis) un cuadro séptico grave, por lo que son los más idóneos para intentar en ellos una actitud conservadora con cierta seguridad. Sin embargo no debe olvidarse su facilidad para adherirse a los materiales protésicos y su capacidad para producir biopelículas. Si se decide conservar el sistema (casos no complicados), pueden administrarse dos semanas de tratamiento antimicrobiano por vía sistémica convencional (infundiéndolo lógicamente a través del sistema), con cifras observadas de curación de más del 60% 321-330. Sin embargo, es preferible combinar el tratamiento sistémico con el sellado antibiótico simultáneo del sistema durante dos semanas, que ha mostrado porcentajes de curación cercanos al 80% 252,263,270,331-333. En el caso de que se utilice el sellado como tratamiento fundamental, la administración de antimicrobianos sistémicos puede hacerse durante un breve tiempo (47 días) hasta la desaparición de la fiebre y/o negativización de los hemocultivos, pero algunos autores prolongan este periodo hasta 2 semanas si el paciente ha presentado bacteriemia persistente, alguna situación de inmunodepresión o implantes protésicos 263. Como ya hemos comentado, Staphyloccocus lugdunensis, por su especial agresividad, debe manejarse de manera similar a S. aureus 119 . Staphylococcus aureus. Su capacidad para producir sepsis, a menudo mortales, y su tendencia a desarrollar complicaciones a distancia, no hace aconsejable como regla general un manejo conservador salvo en casos muy seleccionados. En casos muy concretos (bacteriemia no complicada, paciente estable y serias dificultades para la retirada del sistema), puede intentarse la conservación del catéter con tratamiento antimicrobiano sistémico y sellado durante al menos 4 semanas 248,334, pero es imprescindible una vigilancia estrecha y una reevaluación del tratamiento a las 72 horas, y si no hay respuesta (desaparición de la fiebre y hemocultivos negativos) debe retirarse el sistema ya que el riesgo de desarrollo de sepsis grave o complicaciones a distancia (endocarditis, osteomielitis) es muy alto. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 34 ______________________________________________________________________________ Enterococcus spp. Es un microorganismo de virulencia “intermedia” y si bien no es proclive a generar cuadros de sepsis grave, su tolerancia a los beta-lactámicos hace que sea difícil erradicarlo mediante tratamientos que no sean prolongados. Deben seguirse las mismas recomendaciones indicadas para S. aureus, retirando el sistema siempre que sea posible 335,336. Si se decide una actitud conservadora, es recomendable administrar tratamiento antimicrobiano prolongado (4-6 semanas) combinado con el sellado 274. Bacilos gram negativos. La evidencia disponible en estos casos es más limitada y en general procedente de series de pacientes neutropénicos. Las recomendaciones son similares a las dadas para S. aureus 248,250,337. Candida spp. Aunque es preciso aclarar que los datos provienen fundamentalmente de pacientes pediátricos, las recomendaciones son también válidas para el resto de pacientes. Debe retirarse el sistema siempre que sea posible, ya que las tasas de curación con los métodos de conservación del catéter no logran más de un 30% de éxito y la incidencia de complicaciones es mayor si decide conservarse el sistema 153,154,338. Tras retirar el sistema, debe administrarse siempre tratamiento antifúngico, inclusive si desaparecen tras la retirada los signos y síntomas de infección (por ejemplo la fiebre) para evitar la aparición de complicaciones diferidas (retinitis o artritis) 100,279,339,340. Se han descrito casos aislados de pacientes curados con la administración IV de antifúngicos (2 semanas después del último cultivo negativo) combinados con el sellado del sistema, que puede prolongarse otras dos semanas. Recomendaciones 1. En caso de infección local, no complicada, puede intentarse un abordaje con tratamiento tópico (BIII). En caso de que no se logre respuesta pueden utilizarse antimicrobianos sistémicos y si esto también falla, entonces retirar el catéter (BII). 2. Si existe “reservoritis” o “tunelitis”, debe retirarse todo el sistema y realizar tratamiento antimicrobiano durante 7-10 días (AII). 3. Ante una infección sistémica complicada, el sistema debe retirarse siempre y cuanto antes (AII). 4. Ante una sospecha de BRC, en pacientes estables, sin datos de gravedad y sin signos locales de infección, el catéter puede conservarse hasta disponer de los estudios microbiológicos. Si se confirma y se aíslan microorganismos virulentos como Staphylococcus aureus o Candida spp. el catéter debe retirarse (BII). 5. En los casos en los que se intente la conservación del catéter deben administrarse antimicrobianos tanto por vía sistémica como local (sellado), que deben iniciarse precoz y simultáneamente (BII). La persistencia de la fiebre y/o la bacteriemia tras 48-72 horas de tratamiento obliga a reconsiderar la decisión de mantener el catéter y a descartar la existencia de complicaciones a distancia (BII). 6. En los pacientes con bacteriemia no complicada por estafilococos coagulasa negativo (excepto S. lugdunensis) originada en un catéter venoso central de corta duración sin indicación de retirada y si se decide intentar su conservación deben utilizarse sellado antibiótico y tratamiento antibiótico sistémico durante 7-14 días (BII). 7. En los pacientes con bacteriemia no complicada por estafilococos coagulasa negativo (excepto S. lugdunensis) o bacilos gram negativos fermentadores originada en un acceso venoso central de larga duración (tunelizado o con reservorio subcutáneo) sin indicación de retirada y si se decide intentar su conservación deben utilizarse sellado antibiótico y tratamiento antibiótico sistémico durante 14 días (BII). 8. En los pacientes con bacteriemia/funguemia no complicada por S. aureus, S. lugdunensis, bacilos gram negativos no fermentadores o Candida spp. originada en un acceso venoso central debe siempre retirarse el catéter responsable. Si ello fuera imposible puede intentarse su conservación mediante sellado antibiótico/antifúngico y tratamiento antibiótico/antifúngico sistémico prolongado, manteniendo una estricta vigilancia clínica del paciente (AII). Si se opta por mantener el CVC en bacteriemia no complicada por Enterococcus spp., donde se obtienen resultados peores que en el caso de infecciones por estafilococos coagulasa negativo, deben mantenerse pautas prolongadas de 21 días (BII). 9. El tiempo diario de permanencia de la solución de sellado en el catéter será lo más prolongado posible (idealmente 24 horas). Cuando el catéter infectado tenga que ser utilizado para infundir quimioterapia o nutrición Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 35 ______________________________________________________________________________ parenteral, se intentará que el sellado se mantenga un mínimo de 8-12 horas cada día (BII). El tiempo entre la instilación de la solución de sellado y su renovación no debe ser mayor de 48 horas. En CVC femorales de pacientes que deambulan no debe superar 24 horas. En los catéteres de hemodiálisis la solución puede ser renovada tras cada sesión (BII). 10. El sellado con etanol al 70% puede ser útil en pacientes con bacteriemia originada en catéteres de larga duración, pero aún no hay datos suficientes para hacer recomendaciones firmes respecto a su uso. 11. El recambio del catéter a través de una guía, es una opción válida en pacientes con dificultades para obtener nuevos accesos vasculares, en ausencia de signos locales de infección (BII). 12. En el caso de retirar el catéter, la implantación de uno nuevo debe llevarse a cabo preferentemente una vez resuelta la bacteriemia, aunque esta decisión podría individualizarse en función del tipo de microorganismo y respuesta clínica al tratamiento (BIII). 10. PREVENCIÓN VASCULARES DE LAS INFECCIONES ASOCIADAS A CATÉTERES La prevención de la infección relacionada con los catéteres intravasculares (CIV) tiene un triple interés: (1) la notable morbimortalidad que la infección supone para el paciente; (2) los costes derivados del diagnóstico y tratamiento y; (3) el riesgo de complicaciones que supone la colocación de un nuevo catéter. La aplicación de guías clínicas específicas para la prevención de dichas infecciones contribuye a su disminución 20,341. 10a. Formación y entrenamiento de los profesionales sanitarios Este entrenamiento debe asegurar que los profesionales adquieran y mantengan, mediante evaluaciones periódicas, un conocimiento adecuado de las medidas de control recomendadas para prevenir las infecciones asociadas a catéteres vasculares. Diversos estudios han puesto de manifiesto que los programas educacionales logran disminuir la incidencia de infecciones 342,343, además de llevar consigo una reducción sustancial del gasto sanitario 344 . Es necesario que los servicios dispongan de protocolos para la inserción y mantenimiento de catéteres, cuyo grado de cumplimiento debe ser evaluado de forma periódica. De la misma forma, es imprescindible la existencia de un sistema de vigilancia prospectivo para la valoración de las infecciones asociadas a catéteres vasculares. Un estudio, controlado y aleatorizado, ha demostrado que los equipos de enfermería dedicados a la inserción y mantenimiento de los CVP se asocian con una disminución del número de infecciones 345. 10b. Lugar anatómico de inserción del catéter venoso central El lugar de inserción del CVC de corta duración influye de manera decisiva en la aparición de complicaciones infecciosas, mecánicas y trombóticas. En la actualidad son escasos los estudios que hayan explorado de forma específica las diferencias en las tasas de infecciones en general y de bacteriemias en particular de los CVC en los diferentes lugares de inserción (yugular, subclavio y femoral). En el único estudio controlado y aleatorizado realizado en UCI, el acceso femoral se acompañaba de un mayor porcentaje de complicaciones infecciosas (19.8% vs. 4.5%) y trombóticas (21.5% vs. 1.9%) con respecto al acceso subclavio 28. En un estudio observacional más reciente, la incidencia de bacteriemia asociada a catéter femoral fue casi el doble de la asociada a la inserción yugular (9.52 vs. 4.85/1000 días de catéter) 346. En los últimos años se han publicado diferentes estudios que comparan los tres accesos vasculares. Lorente y cols. demuestran una mayor incidencia de bacteriemias asociadas a catéter en el acceso femoral frente al acceso yugular y subclavio 347. En un estudio de similares características no se encontraron tales diferencias, resaltando que Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 36 ______________________________________________________________________________ los resultados son consecuencia de la elección del óptimo lugar de inserción, realización por personal experimentado, cumplimiento de la normas de asepsia de forma estricta y unos cuidados de los catéteres por personal de enfermería entrenado 348. El acceso subclavio para hemodiálisis se ha asociado a mayor tasa de estenosis significativa u oclusión completa de la vena subclavia por trombosis en comparación al acceso por vía yugular interna. Este fenómeno impide la realización de una fístula arteriovenosa en la extremidad ipsilateral en un futuro y hace recomendable evitar esta vía en estas situaciones 349. Con respecto al acceso yugular o femoral, un reciente estudio aleatorizado llevado a cabo en pacientes de UCI que requerían diálisis, no demostró diferencias en la incidencia de complicaciones infecciosas entre ambos tipos de acceso, salvo cuando existía un elevado índice de masa corporal, en cuyo caso era preferible el acceso yugular 350. El empleo de equipos de ultrasonidos para la canalización de CVC ha sido valorado por un reciente metaanálisis, que demuestra una disminución de las complicaciones mecánicas, sobre todo en el acceso yugular. Sin embargo en dicho estudio no se lleva a cabo una valoración de las complicaciones infecciosas 351. 10c. Material del catéter Hoy en día la mayor parte de los catéteres que se utilizan son de poliuretano o teflón, debido a que se ha asociado en estudios no comparativos a una menor frecuencia de infecciones que los catéteres de PVC (cloruro de polivinilo) o polietileno. Además estos últimos catéteres son muy rígidos y con mayor riesgo trombótico 342. 10d. Antisepsia cutánea La flora cutánea puede ser arrastrada hacia el interior del tejido subcutáneo y el torrente sanguíneo durante la inserción de un catéter, por tanto, es obvio suponer la gran importancia de la antisepsia cutánea durante este procedimiento. En 1991, un estudio prospectivo y aleatorizado demostró que la clorhexidina en solución acuosa al 2% aplicada sobre el punto de inserción de CVC y arteriales, se asociaba a una menor tasa de bacteriemia asociada a catéter que la povidona-yodada al 10% en solución acuosa y el alcohol al 70%352. Aunque algún trabajo posterior no ha encontrado beneficios en la utilización de soluciones de clorhexidina al 0.5% 353, son varios los estudios bien diseñados que demuestran que la antisepsia cutánea con gluconato de clorhexidina a diversas concentraciones (0.5 y 2%) se asocia a reducciones en las tasas de colonización y de BRC cuando se compara con povidona yodada al 10% 45,354 . Una vez colocado el antiséptico, éste debe dejarse secar durante un par de minutos antes de colocar el catéter, de acuerdo con los protocolos estandarizados 352,353. 10e. Métodos barrera (técnica aséptica) Para realizar una técnica totalmente aséptica debemos comenzar siempre con el lavado de manos con preparados de base alcohólica 355. El lavado de manos sigue siendo la medida más eficaz para la prevención y control de las infecciones nosocomiales y aún más, en aquellas relacionadas con procedimientos invasivos. El empleo de métodos de barrera completa en la inserción de catéteres centrales ha demostrado reducciones significativas de las tasas de BRC 356,357 y de infección del punto de inserción 358. Las guías del CDC no consideran la necesidad de máximas precauciones de barrera para la inserción CVP excepto los guantes, que pueden ser no estériles si no se vuelve a palpar la zona de inserción una vez desinfectada. Un buen lavado de manos podría ser suficiente en estos casos 20. No se recomienda la realización de incisiones en la piel para facilitar la canalización venosa, no disminuye el número de complicaciones infecciosas y se aumenta el tiempo de inserción 359,360. 10f. Apósitos La principal duda a la hora de elegir qué apósito utilizar es si decidirse por uno convencional (gasa y Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 37 ______________________________________________________________________________ esparadrapo) o uno transparente (poliuretano). Los apósitos de poliuretano permiten la inspección continua de la inserción del catéter sin necesidad de manipulaciones innecesarias, permiten a los pacientes bañarse o ducharse sin mojar el apósito y requieren menos cambios que los apósitos convencionales con gasa y esparadrapo, por lo que el uso de los mismos ahorra tiempo al personal sanitario. No obstante, los estudios que disponemos no evidencian diferencias en las tasas de infección que aparecen cuando se comparan ambos tipos de apósitos 361,362. La elección de un tipo u otro depende de las características del paciente, siendo necesarios más estudios para obtener alguna conclusión válida. Los apósitos de gasa deberían cambiarse cada 48-72 horas y los semipermeables transparentes al menos cada 7 días. El cambio debe ser inmediato siempre que el apósito esté húmedo, aflojado/despegado o sucio (BI) 363,364. El uso de apósitos impregnados en clorhexidina está sustentado en estudios con resultados prometedores (reducción del riesgo de colonización y de bacteriemia relacionada) 365-367. Sin embargo, un meta-análisis que valoraba la eficacia de este dispositivo, matiza los resultados descritos y subraya la necesidad de nuevos ensayos clínicos aleatorizados, con mayor número de pacientes para comprobar si efectivamente es coste-efectivo 368. Se ha intentado el uso de varios preparados/ungüentos aplicados en el lugar de inserción con el fin de prevenir la BRC. El uso de povidona iodada ha mostrado su efectividad en catéteres de hemodiálisis 369. La mupirocina, aunque puede disminuir la BRC 370 podría promover la resistencia a este antibiótico 371 e incluso puede afectar a la integridad de los catéteres de poliuretano 372. También se ha experimentado con la aplicación local de otros antibióticos aunque con resultados no concluyentes. 10g. Manejo de conexiones y conectores Los distintos tipos de conectores/llaves de paso “sin aguja” fueron creados con el fin de disminuir los accidentes por pinchazos en los trabajadores de la salud. Han sido relacionados con aumento de la incidencia de BRC, especialmente al introducirlos en hospitales sin una educación adecuada que reforzara el adecuado manejo de los mismos, ya que se ha visto que la principal causa de la infección de estos sistemas es la baja adherencia a la desinfección previo a su uso 373-375. Sin embargo cuando estos dispositivos son usados de acuerdo con las normas del fabricante no elevan el riesgo de BRC 374. 10h. Manejo de las luces no utilizadas Clásicamente el uso de catéteres de múltiples luces comparado con una sola luz tiene mayor riesgo de infección 375,376. Sin embargo, en un estudio aleatorizado y controlado en pacientes con nutrición parenteral seguidos durante 24 meses que comparó catéteres venosos centrales de doble y triple luz no encontró una diferencia significativa en la incidencia de infección asociada a catéter 377. En esta misma línea, otro estudio aleatorizado y controlado que comparaba catéteres de una sola luz frente a los de triple luz tampoco encontró diferencias 378. Estos resultados contrastan con un reciente estudio prospectivo llevado a cabo en ambiente quirúrgico y donde cada luz adicional que tuviera el catéter, incrementaba el riesgo de infección 4.4 veces (IC 95%: 2.5-7.7; p<0.001) 18. Por otra parte, el sellado de las luces sin uso se comportó como un factor protector de infección. Parece por tanto que la infección no depende tanto del número de luces como del manejo de las mismas, de tal forma que si seguimos las normas de manejo apropiadas, sobre todo a nivel de conexiones y manipulación, los catéteres de una, dos o tres luces pueden ser igual de seguros y el número de luces sólo dependerá de las necesidades del paciente. 10i. Heparinización de CVC Analizar las ventajas de la heparinización o salinización es difícil porque los estudios son muy heterogéneos, sobre todo en lo que a la dosis a administrar se refiere 379-381. Por otra parte, no existe información suficiente acerca de la efectividad de la heparina en la prevención de la infección. Su cuestionable seguridad, con un riesgo de trombocitopenia estimado en torno al 0.5% 382, hace que la implantación de esta medida de manera rutinaria deba ser revisada precisando ensayos clínicos bien diseñados para esclarecer estos aspectos. El empleo de uroquinasa, tanto para el sellado como para el lavado, también ha sido empleado para prevenir Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 38 ______________________________________________________________________________ la trombosis y secundariamente la infección. En una revisión sistemática sobre cinco estudios se concluye que la uroquinasa podría reducir el riesgo de bacteriemia relacionada con CVC de larga duración, aunque los estudios presentaban importantes limitaciones metodológicas 383. 10j. Catéteres venosos centrales recubiertos de antisépticos y/o antimicrobianos Con la intención de hacerlos más resistentes a la colonización microbiana, los CVC han sido recubiertos de numerosas sustancias, las más usadas son los antisépticos como clorhexidina/sulfadiazina-argéntica, antimicrobianos como minociclina/rifampicina e iones como la plata. De forma habitual, estas técnicas se han utilizado en CVC de corta duración. Catéteres recubiertos de clorhexidina/sulfadiazina-argéntica. Aunque son múltiples los estudios llevados a cabo con catéteres recubiertos de la asociación clorhexidina/sulfadiazina-argéntica, existen dificultades para demostrar descensos significativos de la BRC, lo cual podría estar relacionado con la falta de poder de los trabajos para demostrar dicha diferencia (OR 0,47; IC 95%: 0,20-1,10) 2,384-386. Todos los estudios, por el contrario, sí demuestran un descenso significativo de la colonización, la cual puede ser considerada el preludio de la bacteriemia. La limitación fundamental de estos catéteres, es la pérdida de efectividad a partir de la semana 387, lo cual reduce su uso a CVC de corta duración. Se han notificado algunos casos de reacción anafilactoide, fundamentalmente en Japón 388 y no se han registrado gérmenes resistentes a ninguna de las dos sustancias 389. Catéteres recubiertos de minociclina/rifampicina. Son los únicos catéteres recubiertos de antimicrobianos aprobados por la FDA y presentan una vida media de actividad antibacteriana de aproximadamente 25 días 389,390. Un meta-análisis publicado recientemente sobre cinco estudios prospectivos y aleatorizados ha puesto de manifiesto una disminución significativa de la colonización (OR 0.39; IC 95%: (0,27-0,55)) y de la bacteriemia (OR 0.29; IC 95%: (0.16-0.52)) asociada al uso de estos catéteres 2. Aunque no se han descrito resistencias bacterianas asociadas al uso de estos dispositivos recubiertos de antibióticos 391, es un tema que preocupa y que requiere futuras evaluaciones. A día de hoy los resultados conseguidos con estos catéteres son mejores que los obtenidos con catéteres recubiertos de antisépticos. Catéteres impregnados de plata. Los iones metálicos tienen una amplia actividad antimicrobiana y están siendo usados tanto en catéteres como en manguitos (cuffs). La gran parte de estudios no han sido capaces de demostrar disminuciones significativas de la colonización y de las bacteriemias asociadas al uso de estos catéteres impregnados de iones de plata 2. 10k. Profilaxis antibiótica sistémica En el momento actual, los estudios disponibles no han demostrado que la administración profiláctica de antibióticos en la colocación de CVC de larga duración, disminuya de manera significativa el número de infecciones relacionadas con estos catéteres 392. 10l. Profilaxis con sellado de antimicrobianos Un meta-análisis reciente sobre siete estudios controlados y aleatorizados, en pacientes con CVC de larga duración, demostró una disminución significativa de las bacteriemias asociadas a catéter 393. En dichos estudios la comparación se realizaba entre la solución de heparina y una solución de antibiótico que, en todos los casos fue vancomicina a dosis de 25 mcg/mL. A pesar de que no se ha detectado resistencia a vancomicina, su limitada actividad a nivel del biofilm, hace necesarios más estudios que confirmen los hallazgos actuales. Además de la heparina, se han utilizado diversos sustancias quelantes como EDTA o citrato, que realzan la actividad del antimicrobiano sobre los gérmenes del biofilm 297,298. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 39 ______________________________________________________________________________ Otras sustancias empleadas en el sellado han sido minociclina + EDTA 394, taurolidina 395 o etanol a diversas concentraciones 319. El CDC recomienda el uso de “sellado profiláctico” en aquellos pacientes con CVC de larga duración que siguen presentando episodios de infección, a pesar de seguir estrictamente las normas preventivas habituales 20. 10m. Recambio de catéteres Catéteres venosos periféricos (CVP). Basándose en un trabajo de principio de los años 90 23, los CDC proponen el cambio programado de los CVP cada 72 horas. Sin embargo, un estudio prospectivo posterior no observó un incremento en las tasas de flebitis a las 96 horas y una revisión sistemática no ha encontrado evidencia científica suficiente para realiza este recambio programado 396,397. En aquellas situaciones donde no se puede asegurar una técnica aséptica en la inserción del catéter, como puede ocurrir en situaciones de urgencias, se aconseja el cambio precoz. En estas situaciones sí se ha observado más frecuentemente la aparición de bacteriemia asociada a CVP 43. El recambio sistemático del CVP es un tema controvertido que podría resumirse en la necesidad de realizar un recambio programado a las 72-96 horas, aunque considerando otros aspectos tales como la asepsia de la técnica durante el procedimiento de inserción, dificultad para otros accesos vasculares, duración estimada de la cateterización intravascular, etc… Catéteres venosos centrales (CVC). Estudios controlados no han demostrado una disminución del riesgo de infección al comparar un esquema fijo de cambio (cada 7 días) con el reemplazo según las necesidades y complicaciones del paciente 398,399. En una revisión sistemática, el cambio programado sobre guía por la técnica de Seldinguer, evidenció un incremento de las complicaciones infecciosas y una disminución de las mecánicas, comparado con el recambio en una nueva localización 400. Por tanto, el recambio mediante guía quedaría restringido a catéteres malfuncionantes y a situaciones de sepsis sin clara causa evidente, en un paciente con malos accesos vasculares. Si se demuestra que el catéter retirado estaba colonizado, con independencia del germen, habrá que retirar el colocado con la guía 401. Catéteres centrales insertados periféricamente (CCIP). Existen numerosos estudios, de carácter descriptivo, que ponen de manifiesto unas tasas de bacteriemias asociadas a estos catéteres que son netamente inferiores a las de los CVC convencionales. Esta diferencia ha sido atribuida a la distinta densidad de colonización de gérmenes del brazo, que es muy inferior a la del cuello, parte superior del tórax e ingle 402,403. Por el contrario, en un estudio aleatorizado realizado en pacientes ingresados, las tasas de bacteriemias fueron similares entre CCIP y CVC convencionales 404 y en un reciente trabajo prospectivo, donde las tasas de bacteriemias fueron igualmente similares, sí fue significativamente más largo el periodo de tiempo hasta su aparición en los CCIP (13 vs. 23 días; p=0,03), considerándose una vía más segura en pacientes que necesiten accesos vasculares entre 14 y 30 días 405. 10n. Estancia para colocación de catéteres venosos centrales Durante los años 90 algunos autores propusieron la colocación de CVC de larga duración tipo Hickman en la cama de los pacientes, argumentando que era un método seguro, con bajas tasas de infección y más económico, permitiendo una mayor disponibilidad de quirófanos 406. A pesar de todo, esta forma de colocación de CVC no ha sido muy aceptada, y a los quirófanos habituales, han sido sustituidos por las salas de radiología intervencionista. En dichas salas las tasas de complicaciones infecciosas son similares a las de quirófanos y el porcentaje de éxito en la colocación superior, dado el control de imagen 407. No existen estudios sobre el mejor lugar para la colocación de los CVC convencionales. Por tanto su colocación se puede llevar a cabo en un lugar donde se puedan asegurar las medidas de asepsia y el profesional tenga la comodidad necesaria. Recomendaciones 1. El personal sanitario involucrado en la inserción y el mantenimiento de los catéteres vasculares, debe estar perfectamente capacitado y entrenado en el manejo de las medidas generales de prevención de las infecciones asociadas (AI). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 40 ______________________________________________________________________________ 2. Es recomendable la puesta en marcha de paquetes de medidas extrapolados del programa “bacteriemia zero” para disminuir la tasa de infecciones asociadas al manejo de dispositivos intravasculares (AI). 3. El acceso femoral no es recomendable nunca como primera opción de un CVC de corta duración, dado la mayor frecuencia de complicaciones infecciosas y mecánicas (AI). No existe evidencia de una mayor incidencia de complicaciones infecciosas en CVC de canalización yugular frente subclavia, por lo que la elección del acceso dependerá de la experiencia del médico (AII). Los pacientes en hemodiálisis no deben tener acceso subclavio. 4. El empleo de la ecografía durante la colocación de CVC disminuye las complicaciones mecánicas e intentos fallidos, pero no se conoce su influencia en las complicaciones infecciosas (AI). 5. La antisepsia cutánea se debe realizar siempre antes de la inserción de un catéter utilizando de forma preferente una solución alcohólica al 2% de gluconato de clorhexidina (AI). Permitir siempre que el antiséptico seque antes de introducir el catéter, generalmente entre 2 y 3 minutos (BI). 6. La higiene de manos es imprescindible para la inserción, mantenimiento y reemplazamiento de cualquier catéter con independencia del uso de guantes (AI). 7. Se recomienda el empleo de métodos de barrera que garanticen una máxima esterilidad (guantes estériles, bata, mascarilla, gorro y un amplio paño estéril que cubra la mayor parte del campo posible) para la canalización de CVC, CCCIP y catéteres arteriales (AI). 8. Usar apósito con gasa estéril o apósito estéril transparente semipermeable para cubrir el lugar de inserción del catéter (AI). Si el paciente está sudoroso o si el punto es sangrante es preferible el apósito de gasa que el transparente (BII). Los apósitos de gasa deberían cambiarse cada 2 días y los semipermeables transparentes al menos cada 7 días. El cambio debe ser inmediato siempre que el apósito esté húmedo, aflojado/despegado o sucio (BI). 9. No usar antibióticos tópicos en el lugar de inserción por la potencial capacidad de crear resistencias o infecciones fúngicas (AI). 10. El uso de apósitos impregnados en clorhexidina es prometedor, siendo necesarios más estudios para conocer la utilidad de los mismos (BII). 11. Limpiar los puertos de inyección con povidona iodada, clorhexidina 2% ó alcohol 70% antes de cada uso del sistema y acceder a los conectores sólo con dispositivos estériles (AI). Cubrir las llaves de paso con tapones cuando no estén en uso (BI). Recambiar los tapones a partir de las 72 horas (BII). Reemplazar los conectores cada 72 horas (como el resto del set de infusión) (BII). 12. El número de luces está dictado por las necesidades del paciente. El riesgo de colonización o infección aumenta con el grado de manipulación de las conexiones y no necesariamente por el número de luces del catéter (AI). En pacientes con catéteres multilumen, la correcta manipulación de las luces en uso, así como el sellado del resto de luces sin uso, se asocia a una menor incidencia de infección; recomendándose por tanto el sellado de las luces no usadas (AII). 13. Actualmente, el uso de heparina en catéteres de corta duración no es una estrategia recomendada para prevenir infecciones (BII). 14. Los catéteres recubiertos de antisépticos y antimicrobianos disminuyen el número de infecciones en CVC de corta duración (AI). A la luz de los datos existentes en la literatura, los catéteres recubiertos de minociclina/rifampicina deben ser usado de forma preferente sobre el resto de catéteres impregnados (CII). 15. El “sellado” con antimicrobianos disminuye de manera significativa las bacteriemias asociadas a CVC de larga duración (AI). El empleo de estas soluciones debe estar limitado a CVC de larga duración con dificultades para el control de las infecciones y/o accesos vasculares complicados (BII). 16. Cuando no exista la seguridad de que la inserción de un CVP se ha realizado mediante una técnica aséptica (p.e. área de urgencias), se recomienda el cambio de forma precoz (72-96 horas), dado el incremento de las complicaciones infecciosas que ocurren en estas circunstancias (AII). En aquellos casos con dificultad para nuevos accesos vasculares y/o cuando la duración estimada de la cateterización intravascular no va a Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 41 ______________________________________________________________________________ prolongarse más allá de otras 24-48 horas, el recambio puede no realizarse de manera programada a las 7296 horas, aunque en estas situaciones el CVP debe ser vigilado de manera estricta (BI). 17. No se recomienda los cambios programados de CVC para prevenir episodios de infección (AII). El recambio sobre guía del CVC mediante la técnica de Seldinger queda restringido a catéteres malfuncionantes y situación de sepsis sin signos locales de infección en pacientes con dificultades de acceso vascular (BI). 18. Los CCIP constituyen una alternativa a los CVC convencionales, sin que su uso conlleve un mayor riesgo de infección, incluso podrían ser de elección frente a CVC de duración intermedia (14-30 días) (AII). Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 42 ______________________________________________________________________________ BIBLIOGRAFÍA 1. Gross PA, Barrett TL, Dellinger EP, et al. Purpose of quality standards for infectious diseases. Infectious Diseases Society of America. Clin Infect Dis 1994; 18:421. 2. Casey AL, Mermel LA, Nightingale P, Elliott TS. Antimicrobial central venous catheters in adults: a systematic review and meta-analysis. Lancet Infect Dis 2008; 8:763-76. 3. Hockenhull JC, Dwan K, Boland A, et al. The clinical effectiveness and cost-effectiveness of central venous catheters treated with anti-infective agents in preventing bloodstream infections: a systematic review and economic evaluation. Health Technol Assess 2008; 12:iii-xii, 1. 4. Mermel LA. Prevention of intravascular catheter-related infections. Ann Intern Med 2000; 132:391-402. 5. Raad II, Bodey GP. Infectious complications of indwelling vascular catheters. Clin Infect Dis 1992; 15:197-208. 6. Martone WJ, Gaynes RP, Horan TC, et al. National Nosocomial Infections Surveillance (NNIS) semiannual report, May 1995. A report from the National Nosocomial Infections Surveillance (NNIS) System. Am J Infect Control 1995; 23:377-85. 7. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis 2004; 39:309-17. 8. Siegman-Igra Y, Fourer B, Orni-Wasserlauf R, et al. Reappraisal of community-acquired bacteremia: a proposal of a new classification for the spectrum of acquisition of bacteremia. Clin Infect Dis 2002; 34:1431-9. 9. Maki DG, Kluger DM, Crnich CJ. The risk of bloodstream infection in adults with different intravascular devices: a systematic review of 200 published prospective studies. Mayo Clin Proc 2006; 81:1159-71. 10. Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995; 274:639-44. 11. Eggimann P. Prevention of intravascular catheter infection. Curr Opin Infect Dis 2007; 20:360-9. 12. Pittet D, Harbarth S, Ruef C, et al. Prevalence and risk factors for nosocomial infections in four university hospitals in Switzerland. Infect Control Hosp Epidemiol 1999; 20:37-42. 13. File TM, Jr., Abell VL. Prevention of bloodstream infections: basics and beyond. Crit Care Med 2009; 37:375-6. 14. Vaque J, Rossello J, Arribas JL. Prevalence of nosocomial infections in Spain: EPINE study 1990-1997. EPINE Working Group. J Hosp Infect 1999; 43 Suppl:S105-11. 15. Alvarez-Lerma F, Olaechea-Astigarraga PO, Palomar-Martínez M, Insausti-Ordenana J, López-Pueyo MJ, Estudio ENVIN-HELICS G. Epidemiología de las bacteriemias primarias y relacionadas con catéteres vasculares en pacientes críticos ingresados en servicios de medicina intensiva. Med Intensiva 2010; 34:437-45. 16. Perencevich EN, Pittet D. Preventing catheter-related bloodstream infections: thinking outside the checklist. JAMA 2009; 301:1285-7. 17. Clark-Christoff N, Watters VA, Sparks W, Snyder P, Grant JP. Use of triple-lumen subclavian catheters for administration of total parenteral nutrition. JPEN J Parenter Enteral Nutr 1992; 16:403-7. 18. Yeung C, May J, Hughes R. Infection rate for single lumen v triple lumen subclavian catheters. Infect Control Hosp Epidemiol 1988; 9:154-8. 19. Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 49:1-45. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 43 ______________________________________________________________________________ 20. O'Grady NP, Alexander M, Burns LA, et al. Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis 2011; 52:e162. 21. Band JD, Maki DG. Steel needles used for intravenous therapy. Morbidity in patients with hematologic malignancy. Arch Intern Med 1980; 140:31-4. 22. Maki DG, Goldman DA, Rhame FS. Infection control in intravenous therapy. Ann Intern Med 1973; 79:867-87. 23. Maki DG, Ringer M. Risk factors for infusion-related phlebitis with small peripheral venous catheters. A randomized controlled trial. Ann Intern Med 1991; 114:845-54. 24. Goetz AM, Miller J, Wagener MM, Muder RR. Complications related to intravenous midline catheter usage. A 2-year study. J Intraven Nurs 1998; 21:76-80. 25. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. Am J Infect Control 1988; 16:128-40. 26. Goetz AM, Wagener MM, Miller JM, Muder RR. Risk of infection due to central venous catheters: effect of site of placement and catheter type. Infect Control Hosp Epidemiol 1998; 19:842-5. 27. Linares J, Sitges-Serra A, Garau J, Pérez JL, Martín R. Pathogenesis of catheter sepsis: a prospective study with quantitative and semiquantitative cultures of catheter hub and segments. J Clin Microbiol 1985; 21:357-60. 28. Merrer J, De JB, Golliot F, et al. Complications of femoral and subclavian venous catheterization in critically ill patients: a randomized controlled trial. JAMA 2001; 286:700-7. 29. Trottier SJ, Veremakis C, O'Brien J, Auer AI. Femoral deep vein thrombosis associated with central venous catheterization: results from a prospective, randomized trial. Crit Care Med 1995; 23:52-9. 30. Rello J, Coll P, Net A, Prats G. Infection of pulmonary artery catheters. Epidemiologic characteristics and multivariate analysis of risk factors. Chest 1993; 103:132-6. 31. Safdar N, Maki DG. Risk of catheter-related bloodstream infection with peripherally inserted central venous catheters used in hospitalized patients. Chest 2005; 128:489-95. 32. Elishoov H, Or R, Strauss N, Engelhard D. Nosocomial colonization, septicemia, and Hickman/Broviac catheterrelated infections in bone marrow transplant recipients. A 5-year prospective study. Medicine (Baltimore) 1998; 77:83-101. 33. Pittet D, Tarara D, Wenzel RP. Nosocomial bloodstream infection in critically ill patients. Excess length of stay, extra costs, and attributable mortality. JAMA 1994; 271:1598-601. 34. Arnow PM, Quimosing EM, Beach M. Consequences of intravascular catheter sepsis. Clin Infect Dis 1993; 16:778-84. 35. Soufir L, Timsit JF, Mahe C, Carlet J, Regnier B, Chevret S. Attributable morbidity and mortality of catheterrelated septicemia in critically ill patients: a matched, risk-adjusted, cohort study. Infect Control Hosp Epidemiol 1999; 20:396-401. 36. Blot SI, Depuydt P, Annemans L, et al. Clinical and economic outcomes in critically ill patients with nosocomial catheter-related bloodstream infections. Clin Infect Dis 2005; 41:1591-8. 37. Renaud B, Brun-Buisson C. Outcomes of primary and catheter-related bacteremia. A cohort and case-control study in critically ill patients. Am J Respir Crit Care Med 2001; 163:1584-90. 38. Warren DK, Quadir WW, Hollenbeak CS, Elward AM, Cox MJ, Fraser VJ. Attributable cost of catheterassociated bloodstream infections among intensive care patients in a nonteaching hospital. Crit Care Med 2006; 34:2084-9. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 44 ______________________________________________________________________________ 39. Perencevich EN, Stone PW, Wright SB, Carmeli Y, Fisman DN, Cosgrove SE. Raising standards while watching the bottom line: making a business case for infection control. Infect Control Hosp Epidemiol 2007; 28:1121-33. 40. Rello J, Ochagavia A, Sabanes E, et al. Evaluation of outcome of intravenous catheter-related infections in critically ill patients. Am J Respir Crit Care Med 2000; 162:1027-30. 41. Tacconelli E, Smith G, Hieke K, Lafuma A, Bastide P. Epidemiology, medical outcomes and costs of catheterrelated bloodstream infections in intensive care units of four European countries: literature- and registry-based estimates. J Hosp Infect 2009; 72:97-103. 42. Marcos M, Soriano A, Inurrieta A, et al. Changing epidemiology of central venous catheter-related bloodstream infections: increasing prevalence of Gram-negative pathogens. J Antimicrob Chemother 2011; 66:2119-25. 43. Pujol M, Hornero A, Saballs M, et al. Clinical epidemiology and outcomes of peripheral venous catheter-related bloodstream infections at a university-affiliated hospital. J Hosp Infect 2007; 67:22-9. 44. Raad I, Costerton W, Sabharwal U, Sacilowski M, Anaissie E, Bodey GP. Ultrastructural analysis of indwelling vascular catheters: a quantitative relationship between luminal colonization and duration of placement. J Infect Dis 1993; 168:400-7. 45. Valles J, Fernández I, Alcaraz D, et al. Prospective randomized trial of 3 antiseptic solutions for prevention of catheter colonization in an intensive care unit for adult patients. Infect Control Hosp Epidemiol 2008; 29:847-53. 46. Mermel LA, Farr BM, Sherertz RJ, et al. Guidelines for the management of intravascular catheter-related infections. J Intraven Nurs 2001; 24:180-205. 47. Bouza E, Alvarado N, Alcalá L, Pérez MJ, Rincón C, Muñoz P. A randomized and prospective study of 3 procedures for the diagnosis of catheter-related bloodstream infection without catheter withdrawal. Clin Infect Dis 2007; 44:820-6. 48. Mimoz O, Karim A, Mercat A, et al. Chlorhexidine compared with povidone-iodine as skin preparation before blood culture. A randomized, controlled trial. Ann Intern Med 1999; 131:834-7. 49. DesJardin JA, Falagas ME, Ruthazer R, et al. Clinical utility of blood cultures drawn from indwelling central venous catheters in hospitalized patients with cancer. Ann Intern Med 1999; 131:641-7. 50. Martínez JA, DesJardin JA, Aronoff M, Supran S, Nasraway SA, Snydman DR. Clinical utility of blood cultures drawn from central venous or arterial catheters in critically ill surgical patients. Crit Care Med 2002; 30:7-13. 51. Franklin JA, Gaur AH, Shenep JL, Hu XJ, Flynn PM. In situ diagnosis of central venous catheter-related bloodstream infection without peripheral blood culture. Pediatr Infect Dis J 2004; 23:614-8. 52. Raad I, Hanna HA, Alakech B, Chatzinikolaou I, Johnson MM, Tarrand J. Differential time to positivity: a useful method for diagnosing catheter-related bloodstream infections. Ann Intern Med 2004; 140:18-25. 53. Safdar N, Fine JP, Maki DG. Meta-analysis: methods for diagnosing intravascular device-related bloodstream infection. Ann Intern Med 2005; 142:451-66. 54. Rijnders BJ, Verwaest C, Peetermans WE, et al. Difference in time to positivity of hub-blood versus nonhubblood cultures is not useful for the diagnosis of catheter-related bloodstream infection in critically ill patients. Crit Care Med 2001; 29:1399-403. 55. Chatzinikolaou I, Hanna H, Hachem R, Alakech B, Tarrand J, Raad I. Differential quantitative blood cultures for the diagnosis of catheter-related bloodstream infections associated with short- and long-term catheters: a prospective study. Diagn Microbiol Infect Dis 2004; 50:167-72. 56. Siegman-Igra Y, Anglim AM, Shapiro DE, Adal KA, Strain BA, Farr BM. Diagnosis of vascular catheter-related bloodstream infection: a meta-analysis. J Clin Microbiol 1997; 35:928-36. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 45 ______________________________________________________________________________ 57. Cleri DJ, Corrado ML, Seligman SJ. Quantitative culture of intravenous catheters and other intravascular inserts. J Infect Dis 1980; 141:781-6. 58. Brun-Buisson C, Abrouk F, Legrand P, Huet Y, Larabi S, Rapin M. Diagnosis of central venous catheter-related sepsis. Critical level of quantitative tip cultures. Arch Intern Med 1987; 147:873-7. 59. Sherertz RJ, Heard SO, Raad II. Diagnosis of triple-lumen catheter infection: comparison of roll plate, sonication, and flushing methodologies. J Clin Microbiol 1997; 35:641-6. 60. Capdevila JA, Planes AM, Palomar M, et al. Value of differential quantitative blood cultures in the diagnosis of catheter-related sepsis. Eur J Clin Microbiol Infect Dis 1992; 11:403-7. 61. Fan ST, Teoh-Chan CH, Lau KF. Evaluation of central venous catheter sepsis by differential quantitative blood culture. Eur J Clin Microbiol Infect Dis 1989; 8:142-4. 62. Quilici N, Audibert G, Conroy MC, et al. Differential quantitative blood cultures in the diagnosis of catheterrelated sepsis in intensive care units. Clin Infect Dis 1997; 25:1066-70. 63. Bouza E, Alvarado N, Alcalá L, et al. A prospective, randomized, and comparative study of 3 different methods for the diagnosis of intravascular catheter colonization. Clin Infect Dis 2005; 40:1096-100. 64. Cercenado E, Ena J, Rodríguez-Creixems M, Romero I, Bouza E. A conservative procedure for the diagnosis of catheter-related infections. Arch Intern Med 1990; 150:1417-20. 65. Blot F, Schmidt E, Nitenberg G, et al. Earlier positivity of central-venous- versus peripheral-blood cultures is highly predictive of catheter-related sepsis. J Clin Microbiol 1998; 36:105-9. 66. Catton JA, Dobbins BM, Kite P, et al. In situ diagnosis of intravascular catheter-related bloodstream infection: a comparison of quantitative culture, differential time to positivity, and endoluminal brushing. Crit Care Med 2005; 33:787-91. 67. Guembe M, Rodríguez-Creixems M, Sánchez-Carrillo C, Pérez-Parra A, Martín-Rabadán P, Bouza E. How many lumens should be cultured in the conservative diagnosis of catheter-related bloodstream infections? Clin Infect Dis 2010; 50:1575-9. 68. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006; 34:1589-96. 69. Naber CK, Baddour LM, Giamarellos-Bourboulis EJ, et al. Clinical consensus conference: survey on Grampositive bloodstream infections with a focus on Staphylococcus aureus. Clin Infect Dis 2009; 48 Suppl 4:S26070. 70. Steinkraus G, White R, Friedrich L. Vancomycin MIC creep in non-vancomycin-intermediate Staphylococcus aureus (VISA), vancomycin-susceptible clinical methicillin-resistant S. aureus (MRSA) blood isolates from 2001-05. J Antimicrob Chemother 2007; 60:788-94. 71. Soriano A, Marco F, Martínez JA, et al. Influence of vancomycin minimum inhibitory concentration on the treatment of methicillin-resistant Staphylococcus aureus bacteremia. Clin Infect Dis 2008; 46:193-200. 72. Rybak MJ, Lomaestro BM, Rotschafer JC, et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis 2009; 49:325-7. 73. Lodise TP, Patel N, Lomaestro BM, Rodvold KA, Drusano GL. Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients. Clin Infect Dis 2009; 49:507-14. 74. Jeffres MN, Isakow W, Doherty JA, et al. Predictors of mortality for methicillin-resistant Staphylococcus aureus health-care-associated pneumonia: specific evaluation of vancomycin pharmacokinetic indices. Chest 2006; 130:947-55. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 46 ______________________________________________________________________________ 75. Wu VC, Wang YT, Wang CY, et al. High frequency of linezolid-associated thrombocytopenia and anemia among patients with end-stage renal disease. Clin Infect Dis 2006; 42:66-72. 76. Fowler VG Jr., Boucher HW, Corey GR, et al. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med 2006; 355:653-65. 77. Marco F, de la María CG, Armero Y, et al. Daptomycin is effective in treatment of experimental endocarditis due to methicillin-resistant and glycopeptide-intermediate Staphylococcus aureus. Antimicrob Agents Chemother 2008; 52:2538-43. 78. García de la María C, Marco F, Armero Y, et al. Daptomycin is effective for treatment of experimental endocarditis due to methicillin-resistant and glycopeptide-intermediate Staphylococcus epidermidis. Antimicrob Agents Chemother 2010; 54:2781-6. 79. Chaftari AM, Hachem R, Mulanovich V, et al. Efficacy and safety of daptomycin in the treatment of Grampositive catheter-related bloodstream infections in cancer patients. Int J Antimicrob Agents 2010; 36:182-6. 80. Bassetti M, Nicco E, Ginocchio F, Ansaldi F, De FD, Viscoli C. High-dose daptomycin in documented Staphylococcus aureus infections. Int J Antimicrob Agents 2010; 36:459-61. 81. Yang SJ, Xiong YQ, Boyle-Vavra S, Daum R, Jones T, Bayer AS. Daptomycin-oxacillin combinations in treatment of experimental endocarditis caused by daptomycin-nonsusceptible strains of methicillin-resistant Staphylococcus aureus with evolving oxacillin susceptibility (the "seesaw effect"). Antimicrob Agents Chemother 2010; 54:3161-9. 82. Entenza JM, Giddey M, Vouillamoz J, Moreillon P. In vitro prevention of the emergence of daptomycin resistance in Staphylococcus aureus and enterococci following combination with amoxicillin/clavulanic acid or ampicillin. Int J Antimicrob Agents 2010; 35:451-6. 83. Rand KH, Houck HJ. Synergy of daptomycin with oxacillin and other beta-lactams against methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2004; 48:2871-5. 84. Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, Karchmer AW, Carmeli Y. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a metaanalysis. Clin Infect Dis 2003; 36:53-9. 85. Francioli P, Clement M, Geroulanos S, et al. Ceftazidime in severe infections: a Swiss multicentre study. J Antimicrob Chemother 1983; 12 Suppl A:139-46. 86. Phillips P, Shafran S, Garber G, et al. Multicenter randomized trial of fluconazole versus amphotericin B for treatment of candidemia in non-neutropenic patients. Canadian Candidemia Study Group. Eur J Clin Microbiol Infect Dis 1997; 16:337-45. 87. Alexandraki I, Sullivan R, Zaiden R, et al. Blood culture isolates in hemodialysis vascular catheter-related bacteremia. Am J Med Sci 2008; 336:297-302. 88. Allon M. Treatment guidelines for dialysis catheter-related bacteremia: an update. Am J Kidney Dis 2009; 54:13-7. 89. Azanza JR, García-Blázquez E, Sádaba B, Manubens A. Uso de antimicrobianos en pacientes con insuficiencia renal o hepática. Enferm Infecc Microbiol Clin 2009; 27:593-9. 90. Fogel MA, Nussbaum PB, Feintzeig ID, Hunt WA, Gavin JP, Kim RC. Cefazolin in chronic hemodialysis patients: a safe, effective alternative to vancomycin. Am J Kidney Dis 1998; 32:401-9. 91. Tokars JI. Vancomycin use and antimicrobial resistance in hemodialysis centers. Am J Kidney Dis 1998; 32:521-3. 92. Marx MA, Frye RF, Matzke GR, Golper TA. Cefazolin as empiric therapy in hemodialysis-related infections: efficacy and blood concentrations. Am J Kidney Dis 1998; 32:410-4. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 47 ______________________________________________________________________________ 93. Stryjewski ME, Szczech LA, Benjamin DK Jr., et al. Use of vancomycin or first-generation cephalosporins for the treatment of hemodialysis-dependent patients with methicillin-susceptible Staphylococcus aureus bacteremia. Clin Infect Dis 2007; 44:190-6. 94. Pallotta KE, Manley HJ. Vancomycin use in patients requiring hemodialysis: a literature review. Semin Dial 2008; 21:63-70. 95. Smith PF, Morse GD. Accuracy of measured vancomycin serum concentrations in patients with end-stage renal disease. Ann Pharmacother 1999; 33:1329-35. 96. Chang FY, Peacock JE Jr., Musher DM, et al. Staphylococcus aureus bacteremia: recurrence and the impact of antibiotic treatment in a prospective multicenter study. Medicine (Baltimore) 2003; 82:333-9. 97. Ulldemolins M, Roberts JA, Wallis SC, Rello J, Lipman J. Flucloxacillin dosing in critically ill patients with hypoalbuminaemia: special emphasis on unbound pharmacokinetics. J Antimicrob Chemother 2010; 65:1771-8. 98. Antimicrobial resistance surveillance in Europe 2009. Annual report of the European Antimicrobial resistance Surveillance Network (EARS-Net). 2009. Ref Type: Electronic Citation. 99. Mensa J, Barberan J, Llinares P, et al. [Guidelines for the treatment on infections caused by methicillin-resistant Staphylococcus aureus]. Rev Esp Quimioter 2008; 21:234-58. 100. Almirante B, Rodríguez D, Park BJ, et al. Epidemiology and predictors of mortality in cases of Candida bloodstream infection: results from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol 2005; 43:1829-35. 101. Wilcox MH, Tack KJ, Bouza E, et al. Complicated skin and skin-structure infections and catheter-related bloodstream infections: noninferiority of linezolid in a phase 3 study. Clin Infect Dis 2009; 48:203-12. 102. Kaka AS, Rueda AM, Shelburne SA III, Hulten K, Hamill RJ, Musher DM. Bactericidal activity of orally available agents against methicillin-resistant Staphylococcus aureus. J Antimicrob Chemother 2006; 58:680-3. 103. Markowitz N, Quinn EL, Saravolatz LD. Trimethoprim-sulfamethoxazole compared with vancomycin for the treatment of Staphylococcus aureus infection. Ann Intern Med 1992; 117:390-8. 104. Goldberg E, Paul M, Talker O, et al. Co-trimoxazole versus vancomycin for the treatment of methicillinresistant Staphylococcus aureus bacteraemia: a retrospective cohort study. J Antimicrob Chemother 2010; 65:1779-83. 105. Korzeniowski O, Sande MA. Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts: A prospective study. Ann Intern Med 1982; 97:496-503. 106. Cosgrove SE, Vigliani GA, Fowler VG Jr., et al. Initial low-dose gentamicin for Staphylococcus aureus bacteremia and endocarditis is nephrotoxic. Clin Infect Dis 2009; 48:713-21. 107. Dworkin RJ, Lee BL, Sande MA, Chambers HF. Treatment of right-sided Staphylococcus aureus endocarditis in intravenous drug users with ciprofloxacin and rifampicin. Lancet 1989; 2:1071-3. 108. Schrenzel J, Harbarth S, Schockmel G, et al. A randomized clinical trial to compare fleroxacin-rifampicin with flucloxacillin or vancomycin for the treatment of staphylococcal infection. Clin Infect Dis 2004; 39:1285-92. 109. Heldman AW, Hartert TV, Ray SC, et al. Oral antibiotic treatment of right-sided staphylococcal endocarditis in injection drug users: prospective randomized comparison with parenteral therapy. Am J Med 1996; 101:68-76. 110. Riedel DJ, Weekes E, Forrest GN. Addition of rifampin to standard therapy for treatment of native valve infective endocarditis caused by Staphylococcus aureus. Antimicrob Agents Chemother 2008; 52:2463-7. 111. Cosgrove SE, Fowler VG Jr. Management of methicillin-resistant Staphylococcus aureus bacteremia. Clin Infect Dis 2008; 46 Suppl 5:S386-93. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 48 ______________________________________________________________________________ 112. Jernigan JA, Farr BM. Short-course therapy of catheter-related Staphylococcus aureus bacteremia: a metaanalysis. Ann Intern Med 1993; 119:304-11. 113. Fowler VG Jr., Olsen MK, Corey GR, et al. Clinical identifiers of complicated Staphylococcus aureus bacteremia. Arch Intern Med 2003; 163:2066-72. 114. Mitchell DH, Howden BP. Diagnosis and management of Staphylococcus aureus bacteraemia. Intern Med J 2005; 35 Suppl 2:S17-S24. 115. Sochowski RA, Chan KL. Implication of negative results on a monoplane transesophageal echocardiographic study in patients with suspected infective endocarditis. J Am Coll Cardiol 1993; 21:216-21. 116. Rosen AB, Fowler VG Jr., Corey GR, et al. Cost-effectiveness of transesophageal echocardiography to determine the duration of therapy for intravascular catheter-associated Staphylococcus aureus bacteremia. Ann Intern Med 1999; 130:810-20. 117. Pigrau C, Rodríguez D, Planes AM, et al. Management of catheter-related Staphylococcus aureus bacteremia: when may sonographic study be unnecessary? Eur J Clin Microbiol Infect Dis 2003; 22:713-9. 118. Raad I, Davis S, Khan A, Tarrand J, Elting L, Bodey GP. Impact of central venous catheter removal on the recurrence of catheter-related coagulase-negative staphylococcal bacteremia. Infect Control Hosp Epidemiol 1992; 13:215-21. 119. Zinkernagel AS, Zinkernagel MS, Elzi MV, et al. Significance of Staphylococcus lugdunensis bacteremia: report of 28 cases and review of the literature. Infection 2008; 36:314-21. 120. Frank KL, Del Pozo JL, Patel R. From clinical microbiology to infection pathogenesis: how daring to be different works for Staphylococcus lugdunensis. Clin Microbiol Rev 2008; 21:111-33. 121. Raad II, Hanna HA, Boktour M, Jabbour N, Hachem RY, Darouiche RO. Catheter-related vancomycinresistant Enterococcus faecium bacteremia: clinical and molecular epidemiology. Infect Control Hosp Epidemiol 2005; 26:658-61. 122. McBride SJ, Upton A, Roberts SA. Clinical characteristics and outcomes of patients with vancomycinsusceptible Enterococcus faecalis and Enterococcus faecium bacteraemia-a five-year retrospective review. Eur J Clin Microbiol Infect Dis 2010; 29:107-14. 123. Oteo J, Cuevas O, Navarro C, Aracil B, Campos J. Trends in antimicrobial resistance in 3469 enterococci isolated from blood (EARSS experience 2001-06, Spain): increasing ampicillin resistance in Enterococcus faecium. J Antimicrob Chemother 2007; 59:1044-5. 124. Martínez-Odriozola P, Muñoz-Sánchez J, Gutiérrez-Macías A, et al. [An analysis of 182 enterococcal bloodstream infections: epidemiology, microbiology, and outcome]. Enferm Infecc Microbiol Clin 2007; 25:503-7. 125. Poutsiaka DD, Skiffington S, Miller KB, Hadley S, Snydman DR. Daptomycin in the treatment of vancomycin-resistant Enterococcus faecium bacteremia in neutropenic patients. J Infect 2007; 54:567-71. 126. Arias CA, Contreras GA, Murray BE. Management of multidrug-resistant enterococcal infections. Clin Microbiol Infect 2010; 16:555-62. 127. Zimmer SM, Caliendo AM, Thigpen MC, Somani J. Failure of linezolid treatment for enterococcal endocarditis. Clin Infect Dis 2003; 37:e29-e30. 128. Gonzales RD, Schreckenberger PC, Graham MB, Kelkar S, DenBesten K, Quinn JP. Infections due to vancomycin-resistant Enterococcus faecium resistant to linezolid. Lancet 2001; 357:1179. 129. Maki DG, Agger WA. Enterococcal bacteremia: clinical features, the risk of endocarditis, and management. Medicine (Baltimore) 1988; 67:248-69. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 49 ______________________________________________________________________________ 130. Sandoe JA, Witherden IR, Au-Yeung HK, Kite P, Kerr KG, Wilcox MH. Enterococcal intravascular catheterrelated bloodstream infection: management and outcome of 61 consecutive cases. J Antimicrob Chemother 2002; 50:577-82. 131. Mainardi JL, Gutmann L, Acar JF, Goldstein FW. Synergistic effect of amoxicillin and cefotaxime against Enterococcus faecalis. Antimicrob Agents Chemother 1995; 39:1984-7. 132. Gavalda J, Torres C, Tenorio C, et al. Efficacy of ampicillin plus ceftriaxone in treatment of experimental endocarditis due to Enterococcus faecalis strains highly resistant to aminoglycosides. Antimicrob Agents Chemother 1999; 43:639-46. 133. Cannon JP, Pachucki CT, Aneziokoro CO, Lentino JR. The Effectiveness and safety of oral linezolid as primary or secondary treatment of bloodstream infections. Infectious Diseases in Clinical Practice 2006; 14:2216. 134. Cha R, Rybak MJ. Daptomycin against multiple drug-resistant staphylococcus and enterococcus isolates in an in vitro pharmacodynamic model with simulated endocardial vegetations. Diagn Microbiol Infect Dis 2003; 47:539-46. 135. Pankey G, Ashcraft D, Patel N. In vitro synergy of daptomycin plus rifampin against Enterococcus faecium resistant to both linezolid and vancomycin. Antimicrob Agents Chemother 2005; 49:5166-8. 136. Snydman DR, McDermott LA, Jacobus NV. Evaluation of in vitro interaction of daptomycin with gentamicin or beta-lactam antibiotics against Staphylococcus aureus and Enterococci by FIC index and timed-kill curves. J Chemother 2005; 17:614-21. 137. Warren RE. Daptomycin in endocarditis and bacteraemia: a British perspective. J Antimicrob Chemother 2008; 62 Suppl 3:iii25-iii33. 138. Arias CA, Torres HA, Singh KV, et al. Failure of daptomycin monotherapy for endocarditis caused by an Enterococcus faecium strain with vancomycin-resistant and vancomycin-susceptible subpopulations and evidence of in vivo loss of the vanA gene cluster. Clin Infect Dis 2007; 45:1343-6. 139. Linden PK, Moellering RC Jr., Wood CA, et al. Treatment of vancomycin-resistant Enterococcus faecium infections with quinupristin/dalfopristin. Clin Infect Dis 2001; 33:1816-23. 140. Weinstein RA, Fridkin SK. The changing face of fungal infections in health care dettings. Clin Infect Dis 2005; 41:1455-60. 141. Tortorano AM, Peman J, Bernhardt H, et al. Epidemiology of candidaemia in Europe: results of 28-month European Confederation of Medical Mycology (ECMM) hospital-based surveillance study. Eur J Clin Microbiol Infect Dis 2004; 23:317-22. 142. Marr KA, Seidel K, White TC, Bowden RA. Candidemia in allogeneic blood and marrow transplant recipients: evolution of risk factors after the adoption of prophylactic fluconazole. J Infect Dis 2000; 181:309-16. 143. Viscoli C, Girmenia C, Marinus A, et al. Candidemia in cancer patients: a prospective, multicenter surveillance study by the Invasive Fungal Infection Group (IFIG) of the European Organization for Research and Treatment of Cancer (EORTC). Clin Infect Dis 1999; 28:1071-9. 144. Rex JH, Pappas PG, Karchmer AW, et al. A randomized and blinded multicenter trial of high-dose fluconazole plus placebo versus fluconazole plus amphotericin B as therapy for candidemia and its consequences in nonneutropenic subjects. Clin Infect Dis 2003; 36:1221-8. 145. Reboli AC, Rotstein C, Pappas PG, et al. Anidulafungin versus fluconazole for invasive candidiasis. N Engl J Med 2007; 356:2472-82. 146. Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 48:503-35. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 50 ______________________________________________________________________________ 147. Krause DS, Simjee AE, van RC, et al. A randomized, double-blind trial of anidulafungin versus fluconazole for the treatment of esophageal candidiasis. Clin Infect Dis 2004; 39:770-5. 148. Kuse ER, Chetchotisakd P, da Cunha CA, et al. Micafungin versus liposomal amphotericin B for candidaemia and invasive candidosis: a phase III randomised double-blind trial. Lancet 2007; 369:1519-27. 149. Pappas PG, Rotstein CM, Betts RF, et al. Micafungin versus caspofungin for treatment of candidemia and other forms of invasive candidiasis. Clin Infect Dis 2007; 45:883-93. 150. Kullberg BJ, Sobel JD, Ruhnke M, et al. Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial. Lancet 2005; 366:1435-42. 151. Walsh TJ. Echinocandins-an advance in the primary treatment of invasive candidiasis. N Engl J Med 2002; 347:2070-2. 152. Espinel-Ingroff A, Barchiesi F, Cuenca-Estrella M, et al. International and multicenter comparison of EUCAST and CLSI M27-A2 broth microdilution methods for testing susceptibilities of Candida spp. to fluconazole, itraconazole, posaconazole, and voriconazole. J Clin Microbiol 2005; 43:3884-9. 153. Rex JH, Bennett JE, Sugar AM, et al. Intravascular catheter exchange and duration of candidemia. NIAID Mycoses Study Group and the Candidemia Study Group. Clin Infect Dis 1995; 21:994-6. 154. Nguyen MH, Peacock JE Jr., Tanner DC, et al. Therapeutic approaches in patients with candidemia. Evaluation in a multicenter, prospective, observational study. Arch Intern Med 1995; 155:2429-35. 155. Luzzati R, Amalfitano G, Lazzarini L, et al. Nosocomial candidemia in non-neutropenic patients at an Italian tertiary care hospital. Eur J Clin Microbiol Infect Dis 2000; 19:602-7. 156. Liu CY, Huang LJ, Wang WS, et al. Candidemia in cancer patients: impact of early removal of non-tunneled central venous catheters on outcome. J Infect 2009; 58:154-60. 157. Rodríguez D, Park BJ, Almirante B, et al. Impact of early central venous catheter removal on outcome in patients with candidaemia. Clin Microbiol Infect 2007; 13:788-93. 158. Luzzati R, Allegranzi B, Pecorari E, Concia E. Central venous catheter removal from patients with candidaemia. Clin Microbiol Infect 2008; 14:516-7. 159. Koh GC, Luong ML. Early removal of central venous catheters and outcomes from candidemia. Clin Infect Dis 2010; 51:1347-50. 160. Bouza E, Burillo A, Muñoz P. Empiric therapy for intravenous central line infections and nosocomiallyacquired acute bacterial endocarditis. Crit Care Clin 2008; 24:293-2ix. 161. Jacoby GA, Muñoz-Price LS. The new beta-lactamases. N Engl J Med 2005; 352:380-91. 162. Raymond DP, Pelletier SJ, Crabtree TD, Evans HL, Pruett TL, Sawyer RG. Impact of antibiotic-resistant Gram-negative bacilli infections on outcome in hospitalized patients. Crit Care Med 2003; 31:1035-41. 163. Paterson DL, Ko WC, Von GA, et al. Outcome of cephalosporin treatment for serious infections due to apparently susceptible organisms producing extended-spectrum beta-lactamases: implications for the clinical microbiology laboratory. J Clin Microbiol 2001; 39:2206-12. 164. Lorente L, Jiménez A, Santana M, et al. Microorganisms responsible for intravascular catheter-related bloodstream infection according to the catheter site. Crit Care Med 2007; 35:2424-7. 165. Muñoz-Price LS, Weinstein RA. Acinetobacter infection. N Engl J Med 2008; 358:1271-81. 166. Friedman ND, Korman TM, Fairley CK, Franklin JC, Spelman DW. Bacteraemia due to Stenotrophomonas maltophilia: an analysis of 45 episodes. J Infect 2002; 45:47-53. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 51 ______________________________________________________________________________ 167. Micek ST, Welch EC, Khan J, et al. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to Gram-negative bacteria: a retrospective analysis. Antimicrob Agents Chemother 2010; 54:1742-8. 168. Fowler VG Jr., Justice A, Moore C, et al. Risk factors for hematogenous complications of intravascular catheter-associated Staphylococcus aureus bacteremia. Clin Infect Dis 2005; 40:695-703. 169. Jensen AG, Espersen F, Skinhoj P, Rosdahl VT, Frimodt-Moller N. Increasing frequency of vertebral osteomyelitis following Staphylococcus aureus bacteraemia in Denmark 1980-1990. J Infect 1997; 34:113-8. 170. Jensen AG, Espersen F, Skinhoj P, Frimodt-Moller N. Bacteremic Staphylococcus aureus spondylitis. Arch Intern Med 1998; 158:509-17. 171. Khan EA, Correa AG, Baker CJ. Suppurative thrombophlebitis in children: a ten-year experience. Pediatr Infect Dis J 1997; 16:63-7. 172. Maki DG, McCormick RD, Uman SJ, Wirtanen GW. Septic endarteritis due to intra-arterial catheters for cancer chemotherapy. I. Evaluation of an outbreak. II. Risk factors, clinical features and management, III. Guidelines for prevention. Cancer 1979; 44:1228-40. 173. Andes DR, Urban AW, Acher CW, Maki DG. Septic thrombosis of the basilic, axillary, and subclavian veins caused by a peripherally inserted central venous catheter. Am J Med 1998; 105:446-50. 174. Verso M, Agnelli G. Venous thromboembolism associated with long-term use of central venous catheters in cancer patients. J Clin Oncol 2003; 21:3665-75. 175. Crowley AL, Peterson GE, Benjamin DK Jr., et al. Venous thrombosis in patients with short- and long-term central venous catheter-associated Staphylococcus aureus bacteremia. Crit Care Med 2008; 36:385-90. 176. Johnson RA, Zajac RA, Evans ME. Suppurative thrombophlebitis: correlation between pathogen and underlying disease. Infect Control 1986; 7:582-5. 177. Fowler VG Jr., Scheld WM, Bayer AS. Endocarditis and intravascular infections. In: Mandell GL, Bennett JE, Dolin R, editors. Mandell, Douglas and Bennett's. Principles and Practice of Infectious Diseases. 7th ed. Philadelphia: Churchill Livingstone; 2010 p. 1067-112. 178. Ghanem GA, Boktour M, Warneke C, et al. Catheter-related Staphylococcus aureus bacteremia in cancer patients: high rate of complications with therapeutic implications. Medicine (Baltimore) 2007; 86:54-60. 179. Timsit JF, Farkas JC, Boyer JM, et al. Central vein catheter-related thrombosis in intensive care patients: incidence, risks factors, and relationship with catheter-related sepsis. Chest 1998; 114:207-13. 180. Stein JM, Pruitt BA Jr. Suppurative thrombophlebitis. A lethal iatrogenic disease. N Engl J Med 1970; 282:1452-5. 181. Munster AM. Septic thrombophlebitis. A surgical disorder. JAMA 1974; 230:1010-1. 182. Pruitt BA Jr., McManus WF, Kim SH, Treat RC. Diagnosis and treatment of cannula-related intravenous sepsis in burn patients. Ann Surg 1980; 191:546-54. 183. Strinden WD, Helgerson RB, Maki DG. Candida septic thrombosis of the great central veins associated with central catheters. Clinical features and management. Ann Surg 1985; 202:653-8. 184. Kaufman J, Demas C, Stark K, Flancbaum L. Catheter-related septic central venous thrombosis-current therapeutic options. West J Med 1986; 145:200-3. 185. van Rooden CJ, Schippers EF, Barge RM, et al. Infectious complications of central venous catheters increase the risk of catheter-related thrombosis in hematology patients: a prospective study. J Clin Oncol 2005; 23:265560. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 52 ______________________________________________________________________________ 186. Verghese A, Widrich WC, Arbeit RD. Central venous septic thrombophlebitis-the role of medical therapy. Medicine (Baltimore) 1985; 64:394-400. 187. Baker CC, Petersen SR, Sheldon GF. Septic phlebitis: a neglected disease. Am J Surg 1979; 138:97-103. 188. Garrison RN, Richardson JD, Fry DE. Catheter-associated septic thrombophlebitis. South Med J 1982; 75:917-9. 189. Torres-Rojas JR, Stratton CW, Sanders CV, et al. Candidal suppurative peripheral thrombophlebitis. Ann Intern Med 1982; 96:431-5. 190. Fry DE, Fry RV, Borzotta AP. Nosocomial blood-borne infection secondary to intravascular devices. Am J Surg 1994; 167:268-72. 191. Walsh TJ, Bustamente CI, Vlahov D, Standiford HC. Candidal suppurative peripheral thrombophlebitis: recognition, prevention, and management. Infect Control 1986; 7:16-22. 192. Raad I, Narro J, Khan A, Tarrand J, Vartivarian S, Bodey GP. Serious complications of vascular catheterrelated Staphylococcus aureus bacteremia in cancer patients. Eur J Clin Microbiol Infect Dis 1992; 11:675-82. 193. Constans J, Salmi LR, Sevestre-Pietri MA, et al. A clinical prediction score for upper extremity deep venous thrombosis. Thromb Haemost 2008; 99:202-7. 194. Gressianu MT, Dhruva VN, Arora RR, et al. Massive septic thrombus formation on a superior vena cava indwelling catheter following Torulopsis (Candida) glabrata fungemia. Intensive Care Med 2002; 28:379-80. 195. Falk PS, Scuderi PE, Sherertz RJ, Motsinger SM. Infected radial artery pseudoaneurysms occurring after percutaneous cannulation. Chest 1992; 101:490-5. 196. Albertyn LE, Alcock MK. Diagnosis of internal jugular vein thrombosis. Radiology 1987; 162:505-8. 197. Mori H, Fukuda T, Isomoto I, Maeda H, Hayashi K. CT diagnosis of catheter-induced septic thrombus of vena cava. J Comput Assist Tomogr 1990; 14:236-8. 198. Mustafa BO, Rathbun SW, Whitsett TL, Raskob GE. Sensitivity and specificity of ultrasonography in the diagnosis of upper extremity deep vein thrombosis: a systematic review. Arch Intern Med 2002; 162:401-4. 199. Golpe R, Marin B, Alonso M. Lemierre's syndrome (necrobacillosis). Postgrad Med J 1999; 75:141-4. 200. Haire WD, Lynch TG, Lund GB, Lieberman RP, Edney JA. Limitations of magnetic resonance imaging and ultrasound-directed (duplex) scanning in the diagnosis of subclavian vein thrombosis. J Vasc Surg 1991; 13:3917. 201. Martin EC, Koser M, Gordon DH. Venography in axillary-subclavian vein thrombosis. Cardiovasc Radiol 1979; 2:261-6. 202. Auber AE, Mancuso PA. Lemierre syndrome: magnetic resonance imaging and computed tomographic appearance. Mil Med 2000; 165:638-40. 203. Braun IF, Hoffman JC Jr., Malko JA, Pettigrew RI, Dannels W, Davis PC. Jugular venous thrombosis: MR imaging. Radiology 1985; 157:357-60. 204. Sinave CP, Hardy GJ, Fardy PW. The Lemierre syndrome: suppurative thrombophlebitis of the internal jugular vein secondary to oropharyngeal infection. Medicine (Baltimore) 1989; 68:85-94. 205. Miceli M, Atoui R, Walker R, et al. Diagnosis of deep septic thrombophlebitis in cancer patients by fluorine18 fluorodeoxyglucose positron emission tomography scanning: a preliminary report. J Clin Oncol 2004; 22:1949-56. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 53 ______________________________________________________________________________ 206. Fowler VG Jr., Miró JM, Hoen B, et al. Staphylococcus aureus endocarditis: a consequence of medical progress. JAMA 2005; 293:3012-21. 207. Falagas ME, Vardakas KZ, Athanasiou S. Intravenous heparin in combination with antibiotics for the treatment of deep vein septic thrombophlebitis: a systematic review. Eur J Pharmacol 2007; 557:93-8. 208. Villani C, Johnson DH, Cunha BA. Bilateral suppurative thrombophlebitis due to Staphylococcus aureus. Heart Lung 1995; 24:342-4. 209. Kniemeyer HW, Grabitz K, Buhl R, Wust HJ, Sandmann W. Surgical treatment of septic deep venous thrombosis. Surgery 1995; 118:49-53. 210. Chirinos JA, Lichtstein DM, García J, Tamariz LJ. The evolution of Lemierre syndrome: report of 2 cases and review of the literature. Medicine (Baltimore) 2002; 81:458-65. 211. Slagle DC, Gates RH Jr. Unusual case of central vein thrombosis and sepsis. Am J Med 1986; 81:351-4. 212. Topiel MS, Bryan RT, Kessler CM, Simon GL. Treatment of silastic catheter-induced central vein septic thrombophlebitis. Am J Med Sci 1986; 291:425-8. 213. Chang FY, MacDonald BB, Peacock JE Jr., et al. A prospective multicenter study of Staphylococcus aureus bacteremia: incidence of endocarditis, risk factors for mortality, and clinical impact of methicillin resistance. Medicine (Baltimore) 2003; 82:322-32. 214. Goldenberg NA, Knapp-Clevenger R, Hays T, Manco-Johnson MJ. Lemierre's and Lemierre's-like syndromes in children: survival and thromboembolic outcomes. Pediatrics 2005; 116:e543-8. 215. Schranz D, Haugwitz D, Zimmer B, Schumacher R. [Successful lysis of a septic thrombosis of the superior vena cava using recombinant tissue-plasminogen activator]. Klin Padiatr 1991; 203:363-5. 216. Zingg W, Pittet D. Peripheral venous catheters: an under-evaluated problem. Int J Antimicrob Agents 2009; 34 Suppl 4:S38-S42. 217. Lomas JM, Martínez-Marcos FJ, Plata A, et al. Healthcare-associated infective endocarditis: an undesirable effect of healthcare universalization. Clin Microbiol Infect 2010; 16:1683-90. 218. Van DP, Rickard CM, McGrail MR, Doolan G. Routine replacement versus clinical monitoring of peripheral intravenous catheters in a regional hospital in the home program: A randomized controlled trial. Infect Control Hosp Epidemiol 2009; 30:915-7. 219. Bregenzer T, Conen D, Sakmann P, Widmer AF. Is routine replacement of peripheral intravenous catheters necessary? Arch Intern Med 1998; 158:151-6. 220. Hershey CO, Tomford JW, McLaren CE, Porter DK, Cohen DI. The natural history of intravenous catheterassociated phlebitis. Arch Intern Med 1984; 144:1373-5. 221. Fortun J. [Infections related to intravascular devices used for infusion therapy]. Enferm Infecc Microbiol Clin 2008; 26:168-74. 222. León C, Ariza J. [Guidelines for the treatment of short-term intravascular catheter-related infections in adults; SEIMC-SEMICYUC Consensus Conference]. Enferm Infecc Microbiol Clin 2004; 22:92-101. 223. Beekmann SE, Diekema DJ, Doern GV. Determining the clinical significance of coagulase-negative staphylococci isolated from blood cultures. Infect Control Hosp Epidemiol 2005; 26:559-66. 224. Favre B, Hugonnet S, Correa L, Sax H, Rohner P, Pittet D. Nosocomial bacteremia: clinical significance of a single blood culture positive for coagulase-negative staphylococci. Infect Control Hosp Epidemiol 2005; 26:697702. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 54 ______________________________________________________________________________ 225. Mayhall CG. Diagnosis and management of infections of implantable devices used for prolonged venous access. Curr Clin Top Infect Dis 1992; 12:83-110. 226. Beathard GA, Urbanes A. Infection associated with tunneled hemodialysis catheters. Semin Dial 2008; 21:528-38. 227. Ingram J, Weitzman S, Greenberg ML, Parkin P, Filler R. Complications of indwelling venous access lines in the pediatric hematology patient: a prospective comparison of external venous catheters and subcutaneous ports. Am J Pediatr Hematol Oncol 1991; 13:130-6. 228. El-Ahdab F, Benjamin DK Jr., Wang A, et al. Risk of endocarditis among patients with prosthetic valves and Staphylococcus aureus bacteremia. Am J Med 2005; 118:225-9. 229. Chamis AL, Peterson GE, Cabell CH, et al. Staphylococcus aureus bacteremia in patients with permanent pacemakers or implantable cardioverter-defibrillators. Circulation 2001; 104:1029-33. 230. Biffi R, de BF, Orsi F, et al. Totally implantable central venous access ports for long-term chemotherapy. A prospective study analyzing complications and costs of 333 devices with a minimum follow-up of 180 days. Ann Oncol 1998; 9:767-73. 231. Yildizeli B, Lacin T, Batirel HF, Yuksel M. Complications and management of long-term central venous access catheters and ports. J Vasc Access 2004; 5:174-8. 232. Marr KA, Sexton DJ, Conlon PJ, Corey GR, Schwab SJ, Kirkland KB. Catheter-related bacteremia and outcome of attempted catheter salvage in patients undergoing hemodialysis. Ann Intern Med 1997; 127:275-80. 233. Saad TF. Bacteremia associated with tunneled, cuffed hemodialysis catheters. Am J Kidney Dis 1999; 34:1114-24. 234. Mokrzycki MH, Zhang M, Cohen H, Golestaneh L, Laut JM, Rosenberg SO. Tunnelled haemodialysis catheter bacteraemia: risk factors for bacteraemia recurrence, infectious complications and mortality. Nephrol Dial Transplant 2006; 21:1024-31. 235. Ashby DR, Power A, Singh S, et al. Bacteremia associated with tunneled hemodialysis catheters: outcome after attempted salvage. Clin J Am Soc Nephrol 2009; 4:1601-5. 236. Hanna H, Afif C, Alakech B, et al. Central venous catheter-related bacteremia due to gram-negative bacilli: significance of catheter removal in preventing relapse. Infect Control Hosp Epidemiol 2004; 25:646-9. 237. Raad I, Kassar R, Ghannam D, Chaftari AM, Hachem R, Jiang Y. Management of the catheter in documented catheter-related coagulase-negative staphylococcal bacteremia: remove or retain? Clin Infect Dis 2009; 49:118794. 238. Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev 2002; 15:167-93. 239. von EC, Jansen B, Kohnen W, Becker K. Infections associated with medical devices: pathogenesis, management and prophylaxis. Drugs 2005; 65:179-214. 240. Ceri H, Olson ME, Stremick C, Read RR, Morck D, Buret A. The Calgary Biofilm Device: new technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. J Clin Microbiol 1999; 37:1771-6. 241. Hoiby N, Bjarnsholt T, Givskov M, Molin S, Ciofu O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents 2010; 35:322-32. 242. Kuhn DM, George T, Chandra J, Mukherjee PK, Ghannoum MA. Antifungal susceptibility of Candida biofilms: unique efficacy of amphotericin B lipid formulations and echinocandins. Antimicrob Agents Chemother 2002; 46:1773-80. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 55 ______________________________________________________________________________ 243. Messing B, Peitra-Cohen S, Debure A, Beliah M, Bernier JJ. Antibiotic-lock technique: a new approach to optimal therapy for catheter-related sepsis in home-parenteral nutrition patients. JPEN J Parenter Enteral Nutr 1988; 12:185-9. 244. Tanriover B, Carlton D, Saddekni S, et al. Bacteremia associated with tunneled dialysis catheters: comparison of two treatment strategies. Kidney Int 2000; 57:2151-5. 245. Robinson D, Suhocki P, Schwab SJ. Treatment of infected tunneled venous access hemodialysis catheters with guidewire exchange. Kidney Int 1998; 53:1792-4. 246. Korbila IP, Bliziotis IA, Lawrence KR, Falagas ME. Antibiotic-lock therapy for long-term catheter-related bacteremia: a review of the current evidence. Expert Rev Anti Infect Ther 2007; 5:639-52. 247. Yahav D, Rozen-Zvi B, Gafter-Gvili A, Leibovici L, Gafter U, Paul M. Antimicrobial lock solutions for the prevention of infections associated with intravascular catheters in patients undergoing hemodialysis: systematic review and meta-analysis of randomized, controlled trials. Clin Infect Dis 2008; 47:83-93. 248. Poole CV, Carlton D, Bimbo L, Allon M. Treatment of catheter-related bacteraemia with an antibiotic lock protocol: effect of bacterial pathogen. Nephrol Dial Transplant 2004; 19:1237-44. 249. Rijnders BJ, Van WE, Vandecasteele SJ, Stas M, Peetermans WE. Treatment of long-term intravascular catheter-related bacteraemia with antibiotic lock: randomized, placebo-controlled trial. J Antimicrob Chemother 2005; 55:90-4. 250. Fortun J, Grill F, Martin-Davila P, et al. Treatment of long-term intravascular catheter-related bacteraemia with antibiotic-lock therapy. J Antimicrob Chemother 2006; 58:816-21. 251. Beigi AA, Khansoltani S, Masoudpour H, Atapour AA, Eshaghian A, Khademi EF. Influence of intralumenal and antibiotic-lock of vancomycin on the rate of catheter removal in the patients with permanent hemodialysis catheters. Saudi J Kidney Dis Transpl 2010; 21:54-8. 252. Messing B, Man F, Colimon R, Thuillier F, Beliah M. Antibiotic-lock technique is an effective treatment of bacterial catheter-related sepsis during parenteral nutrition. Clin Nutr 1990; 9:220-5. 253. Williams N, Carlson GL, Scott NA, Irving MH. Incidence and management of catheter-related sepsis in patients receiving home parenteral nutrition. Br J Surg 1994; 81:392-4. 254. Cuntz D, Michaud L, Guimber D, Husson MO, Gottrand F, Turck D. Local antibiotic lock for the treatment of infections related to central catheters in parenteral nutrition in children. JPEN J Parenter Enteral Nutr 2002; 26:104-8. 255. Guedon C, Nouvellon M, Lalaude O, Lerebours E. Efficacy of antibiotic-lock technique with teicoplanin in Staphylococcus epidermidis catheter-related sepsis during long-term parenteral nutrition. JPEN J Parenter Enteral Nutr 2002; 26:109-13. 256. Santarpia L, Pasanisi F, Alfonsi L, et al. Prevention and treatment of implanted central venous catheter (CVC) - related sepsis: a report after six years of home parenteral nutrition (HPN). Clin Nutr 2002; 21:207-11. 257. Reimund JM, Arondel Y, Finck G, Zimmermann F, Duclos B, Baumann R. Catheter-related infection in patients on home parenteral nutrition: results of a prospective survey. Clin Nutr 2002; 21:33-8. 258. Capdevila JA, Segarra A, Planes AM, et al. Long-term follow-up of patients with catheter-related bacteremia treated without catheter removal. Clinical Microbiology and Infection 1998; 4:472-6. 259. Boorgu R, Dubrow AJ, Levin NW, et al. Adjunctive antibiotic/anticoagulant lock therapy in the treatment of bacteremia associated with the use of a subcutaneously implanted hemodialysis access device. ASAIO J 2000; 46:767-70. 260. Bailey E, Berry N, Cheesbrough JS. Antimicrobial lock therapy for catheter-related bacteraemia among patients on maintenance haemodialysis. J Antimicrob Chemother 2002; 50:615-7. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 56 ______________________________________________________________________________ 261. Krishnasami Z, Carlton D, Bimbo L, et al. Management of hemodialysis catheter-related bacteremia with an adjunctive antibiotic lock solution. Kidney Int 2002; 61:1136-42. 262. Vardhan A, Davies J, Daryanani I, Crowe A, McClelland P. Treatment of haemodialysis catheter-related infections. Nephrol Dial Transplant 2002; 17:1149-50. 263. Rao JS, O'Meara A, Harvey T, Breatnach F. A new approach to the management of Broviac catheter infection. J Hosp Infect 1992; 22:109-16. 264. Piketty C, Hoi AB, Gilquin J, et al. Failure of antibiotic therapy in Staphylococcus epidermidis infection of implantable venous access devices in patients with AIDS, as documented by molecular typing. Clin Microbiol Infect 1999; 5:190-4. 265. Longuet P, Douard MC, Arlet G, Molina JM, Benoit C, Leport C. Venous access port-related bacteremia in patients with acquired immunodeficiency syndrome or cancer: the reservoir as a diagnostic and therapeutic tool. Clin Infect Dis 2001; 32:1776-83. 266. De SL, Jenkner A, Milano GM, et al. Antibiotic lock with vancomycin and urokinase can successfully treat colonized central venous catheters in pediatric cancer patients. Pediatr Infect Dis J 2004; 23:963-5. 267. Bernardi M, Cavaliere M, Cesaro S. [The antibiotic-lock therapy in oncoematology pediatric unit]. Assist Inferm Ric 2005; 24:127-31. 268. Sánchez-Muñoz A, Aguado JM, López-Martín A, et al. Usefulness of antibiotic-lock technique in management of oncology patients with uncomplicated bacteremia related to tunneled catheters. Eur J Clin Microbiol Infect Dis 2005; 24:291-3. 269. Johnson DC, Johnson FL, Goldman S. Preliminary results treating persistent central venous catheter infections with the antibiotic lock technique in pediatric patients. Pediatr Infect Dis J 1994; 13:930-1. 270. Krzywda EA, Andris DA, Edmiston CE Jr., Quebbeman EJ. Treatment of Hickman catheter sepsis using antibiotic lock technique. Infect Control Hosp Epidemiol 1995; 16:596-8. 271. Viale P, Pagani L, Petrosillo N, et al. Antibiotic lock-technique for the treatment of catheter-related bloodstream infections. J Chemother 2003; 15:152-6. 272. Del Pozo JL, García CM, Hernáez S, et al. Effectiveness of teicoplanin versus vancomycin lock therapy in the treatment of port-related coagulase-negative staphylococci bacteraemia: a prospective case-series analysis. Int J Antimicrob Agents 2009; 34:482-5. 273. Diamanti A, Basso MS, Castro M, Calce A, Gambarara M. Antibiotic-lock therapy in central venous catheter colonization in patients with intestinal failure. J Infect 2007; 54:415-6. 274. Fernández-Hidalgo N, Almirante B, Calleja R, et al. Antibiotic-lock therapy for long-term intravascular catheter-related bacteraemia: results of an open, non-comparative study. J Antimicrob Chemother 2006; 57:1172-80. 275. Cercenado E. [Staphylococcus lugdunensis: a unique coagulase-negative Staphylococcus]. Enferm Infecc Microbiol Clin 2009; 27:139-42. 276. Onder AM, Chandar J, Billings AA, et al. Comparison of early versus late use of antibiotic locks in the treatment of catheter-related bacteremia. Clin J Am Soc Nephrol 2008; 3:1048-56. 277. Del Pozo JL, Alonso M, Serrera A, Hernáez S, Aguinaga A, Leiva J. Effectiveness of the antibiotic lock therapy for the treatment of port-related enterococci, Gram-negative, or Gram-positive bacilli bloodstream infections. Diagn Microbiol Infect Dis 2009; 63:208-12. 278. Peterson WJ, Maya ID, Carlton D, Estrada E, Allon M. Treatment of dialysis catheter-related Enterococcus bacteremia with an antibiotic lock: a quality improvement report. Am J Kidney Dis 2009; 53:107-11. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 57 ______________________________________________________________________________ 279. Nucci M, Anaissie E. Should vascular catheters be removed from all patients with candidemia? An evidencebased review. Clin Infect Dis 2002; 34:591-9. 280. Pasqualotto AC, Severo LC. The importance of central venous catheter removal in patients with candidaemia: time to rethink our practice? Clin Microbiol Infect 2008; 14:2-4. 281. Viale P, Petrosillo N, Signorini L, Puoti M, Carosi G. Should lock therapy always be avoided for central venous catheter-associated fungal bloodstream infections? Clin Infect Dis 2001; 33:1947-8. 282. Castagnola E, Marazzi MG, Tacchella A, Giacchino R. Broviac catheter-related candidemia. Pediatr Infect Dis J 2005; 24:747. 283. Angel-Moreno A, Boronat M, Bolaños M, Carrillo A, González S, Pérez Arellano JL. Candida glabrata fungemia cured by antibiotic-lock therapy: case report and short review. J Infect 2005; 51:e85-7. 284. Buckler BS, Sams RN, Goei VL, et al. Treatment of central venous catheter fungal infection using liposomal amphotericin-B lock therapy. Pediatr Infect Dis J 2008; 27:762-4. 285. Megged O, Shalit I, Yaniv I, Fisher S, Livni G, Levy I. Outcome of antibiotic lock technique for persistent central venous catheter-associated coagulase-negative Staphylococcus bacteremia in children. Eur J Clin Microbiol Infect Dis 2010; 29:157-61. 286. Taylor G, Gravel D, Johnston L, Embil J, Holton D, Paton S. Incidence of bloodstream infection in multicenter inception cohorts of hemodialysis patients. Am J Infect Control 2004; 32:155-60. 287. Hoen B, Paul-Dauphin A, Hestin D, Kessler M. EPIBACDIAL: a multicenter prospective study of risk factors for bacteremia in chronic hemodialysis patients. J Am Soc Nephrol 1998; 9:869-76. 288. Hill EE, Vanderschueren S, Verhaegen J, et al. Risk factors for infective endocarditis and outcome of patients with Staphylococcus aureus bacteremia. Mayo Clin Proc 2007; 82:1165-9. 289. Maya ID, Carlton D, Estrada E, Allon M. Treatment of dialysis catheter-related Staphylococcus aureus bacteremia with an antibiotic lock: a quality improvement report. Am J Kidney Dis 2007; 50:289-95. 290. Sociedad Española de Qumioterapia, Asociación Española de Hematología y Hemoterapia, Sociedad Española de Oncología Médica, Sociedad Española de Medicina Interna. Tratamiento de las infecciones relacionadas con catéteres venosos de larga duración. Rev Esp Quimioter 2003; 16:343-60. 291. Anthony TU, Rubin LG. Stability of antibiotics used for antibiotic-lock treatment of infections of implantable venous devices (ports). Antimicrob Agents Chemother 1999; 43:2074-6. 292. Vercaigne LM, Sitar DS, Penner SB, Bernstein K, Wang GQ, Burczynski FJ. Antibiotic-heparin lock: in vitro antibiotic stability combined with heparin in a central venous catheter. Pharmacotherapy 2000; 20:394-9. 293. Droste JC, Jeraj HA, MacDonald A, Farrington K. Stability and in vitro efficacy of antibiotic-heparin lock solutions potentially useful for treatment of central venous catheter-related sepsis. J Antimicrob Chemother 2003; 51:849-55. 294. Bastani B, Amin K, Herr A. Prolonged stability of stored vancomycin, gentamicin, and heparin for use in the antibiotic-lock technique. ASAIO J 2005; 51:761-3. 295. Battistella M, Walker S, Law S, Lok C. Antibiotic lock: in vitro stability of vancomycin and four percent sodium citrate stored in dialysis catheters at 37 degrees C. Hemodial Int 2009; 13:322-8. 296. Soriano A, Bregada E, Marques JM, et al. Decreasing gradient of antibiotic concentration in the lumen of catheters locked with vancomycin. Eur J Clin Microbiol Infect Dis 2007; 26:659-61. 297. Dogra GK, Herson H, Hutchison B, et al. Prevention of tunneled hemodialysis catheter-related infections using catheter-restricted filling with gentamicin and citrate: a randomized controlled study. J Am Soc Nephrol 2002; 13:2133-9. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 58 ______________________________________________________________________________ 298. Bleyer AJ, Mason L, Russell G, Raad II, Sherertz RJ. A randomized, controlled trial of a new vascular catheter flush solution (minocycline-EDTA) in temporary hemodialysis access. Infect Control Hosp Epidemiol 2005; 26:520-4. 299. Abbas SA, Haloob IA, Taylor SL, et al. Effect of antimicrobial locks for tunneled hemodialysis catheters on bloodstream infection and bacterial resistance: a quality improvement report. Am J Kidney Dis 2009; 53:492502. 300. Morales-Molina JA, Mateu-de AJ, Grau S, Segura M, Acosta P. [Stability: a factor to consider in antibioticlock solutions]. Enferm Infecc Microbiol Clin 2010; 28:104-9. 301. Kropec A, Huebner J, Wursthorn M, Daschner FD. In vitro activity of vancomycin and teicoplanin against Staphylococcus aureus and Staphylococcus epidermidis colonizing catheters. Eur J Clin Microbiol Infect Dis 1993; 12:545-8. 302. Lee JY, Ko KS, Peck KR, Oh WS, Song JH. In vitro evaluation of the antibiotic lock technique (ALT) for the treatment of catheter-related infections caused by staphylococci. J Antimicrob Chemother 2006; 57:1110-5. 303. Drago L, De VE, Valli M, Nicola L, Gismondo MR. Effect of linezolid in comparison with that of vancomycin on glycocalix production: in vitro study. Antimicrob Agents Chemother 2002; 46:598-9. 304. Gander S, Hayward K, Finch R. An investigation of the antimicrobial effects of linezolid on bacterial biofilms utilizing an in vitro pharmacokinetic model. J Antimicrob Chemother 2002; 49:301-8. 305. Curtin J, Cormican M, Fleming G, Keelehan J, Colleran E. Linezolid compared with eperezolid, vancomycin, and gentamicin in an in vitro model of antimicrobial lock therapy for Staphylococcus epidermidis central venous catheter-related biofilm infections. Antimicrob Agents Chemother 2003; 47:3145-8. 306. Rodríguez-Martínez JM, Ballesta S, García I, Conejo MC, Pascual A. [Activity and penetration of linezolid and vancomycin against Staphylococcus epidermidis biofilms]. Enferm Infecc Microbiol Clin 2007; 25:425-8. 307. Castagnola E, Moroni C, Gandullia P, et al. Catheter lock and systemic infusion of linezolid for treatment of persistent Broviac catheter-related staphylococcal bacteremia. Antimicrob Agents Chemother 2006; 50:1120-1. 308. Fennell JP, O'Donohoe M, Cormican M, Lynch M. Linezolid lock prophylaxis of central venous catheter infection. J Med Microbiol 2008; 57:534-5. 309. LaPlante KL, Mermel LA. In vitro activity of daptomycin and vancomycin lock solutions on staphylococcal biofilms in a central venous catheter model. Nephrol Dial Transplant 2007; 22:2239-46. 310. Raad I, Hanna H, Jiang Y, et al. Comparative activities of daptomycin, linezolid, and tigecycline against catheter-related methicillin-resistant Staphylococcus bacteremic isolates embedded in biofilm. Antimicrob Agents Chemother 2007; 51:1656-60. 311. Bookstaver PB, Williamson JC, Tucker BK, Raad II, Sherertz RJ. Activity of novel antibiotic lock solutions in a model against isolates of catheter-related bloodstream infections. Ann Pharmacother 2009; 43:210-9. 312. Aslam S, Trautner BW, Ramanathan V, Darouiche RO. Pilot trial of N-acetylcysteine and tigecycline as a catheter-lock solution for treatment of hemodialysis catheter-associated bacteremia. Infect Control Hosp Epidemiol 2008; 29:894-7. 313. Grau S, Gil MJ, Mateu-de AJ, Pera M, Marin-Casino M. Antibiotic-lock technique using daptomycin for subcutaneous injection ports in a patient on home parenteral nutrition. J Infect 2009; 59:298-9. 314. Qu Y, Istivan TS, Daley AJ, Rouch DA, Deighton MA. Comparison of various antimicrobial agents as catheter lock solutions: preference for ethanol in eradication of coagulase-negative staphylococcal biofilms. J Med Microbiol 2009; 58:442-50. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 59 ______________________________________________________________________________ 315. Raad II, Hachem RY, Hanna HA, et al. Role of ethylene diamine tetra-acetic acid (EDTA) in catheter lock solutions: EDTA enhances the antifungal activity of amphotericin B lipid complex against Candida embedded in biofilm. Int J Antimicrob Agents 2008; 32:515-8. 316. Sauer K, Steczko J, Ash SR. Effect of a solution containing citrate/Methylene Blue/parabens on Staphylococcus aureus bacteria and biofilm, and comparison with various heparin solutions. J Antimicrob Chemother 2009; 63:937-45. 317. Koldehoff M, Zakrzewski JL. Taurolidine is effective in the treatment of central venous catheter-related bloodstream infections in cancer patients. Int J Antimicrob Agents 2004; 24:491-5. 318. Dannenberg C, Bierbach U, Rothe A, Beer J, Korholz D. Ethanol-lock technique in the treatment of bloodstream infections in pediatric oncology patients with broviac catheter. J Pediatr Hematol Oncol 2003; 25:616-21. 319. Onland W, Shin CE, Fustar S, Rushing T, Wong WY. Ethanol-lock technique for persistent bacteremia of long-term intravascular devices in pediatric patients. Arch Pediatr Adolesc Med 2006; 160:1049-53. 320. Broom J, Woods M, Allworth A, et al. Ethanol lock therapy to treat tunnelled central venous catheterassociated blood stream infections: results from a prospective trial. Scand J Infect Dis 2008; 40:399-406. 321. Wurzel CL, Halom K, Feldman JG, Rubin LG. Infection rates of Broviac-Hickman catheters and implantable venous devices. Am J Dis Child 1988; 142:536-40. 322. Shapiro ED, Wald ER, Nelson KA, Spiegelman KN. Broviac catheter-related bacteremia in oncology patients. Am J Dis Child 1982; 136:679-81. 323. Press OW, Ramsey PG, Larson EB, Fefer A, Hickman RO. Hickman catheter infections in patients with malignancies. Medicine (Baltimore) 1984; 63:189-200. 324. Prince A, Heller B, Levy J, Heird WC. Management of fever in patients with central vein catheters. Pediatr Infect Dis 1986; 5:20-4. 325. King DR, Komer M, Hoffman J, et al. Broviac catheter sepsis: the natural history of an iatrogenic infection. J Pediatr Surg 1985; 20:728-33. 326. Flynn PM, Shenep JL, Stokes DC, Barrett FF. In situ management of confirmed central venous catheterrelated bacteremia. Pediatr Infect Dis J 1987; 6:729-34. 327. Rotstein C, Brock L, Roberts RS. The incidence of first Hickman catheter-related infection and predictors of catheter removal in cancer patients. Infect Control Hosp Epidemiol 1995; 16:451-8. 328. Reilly JJ Jr., Steed DL, Ritter PS. Indwelling venous access catheters in patients with acute leukemia. Cancer 1984; 53:219-23. 329. Hickman RO, Buckner CD, Clift RA, Sanders JE, Stewart P, Thomas ED. A modified right atrial catheter for access to the venous system in marrow transplant recipients. Surg Gynecol Obstet 1979; 148:871-5. 330. Lazarus HM, Lowder JN, Herzig RH. Occlusion and infection in Broviac catheters during intensive cancer therapy. Cancer 1983; 52:2342-8. 331. Capdevila JA, Segarra A, Planes AM, et al. Successful treatment of haemodialysis catheter-related sepsis without catheter removal. Nephrol Dial Transplant 1993; 8:231-4. 332. Benoit JL, Carandang G, Sitrin M, Arnow PM. Intraluminal antibiotic treatment of central venous catheter infections in patients receiving parenteral nutrition at home. Clin Infect Dis 1995; 21:1286-8. 333. Douard MC, Arlet G, Leverger G, et al. Quantitative blood cultures for diagnosis and management of catheterrelated sepsis in pediatric hematology and oncology patients. Intensive Care Med 1991; 17:30-5. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 60 ______________________________________________________________________________ 334. Kuizon D, Gordon SM, Dolmatch BL. Single-lumen subcutaneous ports inserted by interventional radiologists in patients undergoing chemotherapy: incidence of infection and outcome of attempted catheter salvage. Arch Intern Med 2001; 161:406-10. 335. Diaz Granados CA, Jernigan JA. Impact of vancomycin resistance on mortality among patients with neutropenia and enterococcal bloodstream infection. J Infect Dis 2005; 191:588-95. 336. Vergis EN, Hayden MK, Chow JW, et al. Determinants of vancomycin resistance and mortality rates in enterococcal bacteremia. A prospective multicenter study. Ann Intern Med 2001; 135:484-92. 337. Chee L, Brown M, Sasadeusz J, MacGregor L, Grigg AP. Gram-negative organisms predominate in Hickman line-related infections in non-neutropenic patients with hematological malignancies. J Infect 2008; 56:227-33. 338. Hung CC, Chen YC, Chang SC, Luh KT, Hsieh WC. Nosocomial candidemia in a university hospital in Taiwan. J Formos Med Assoc 1996; 95:19-28. 339. Karlowicz MG, Hashimoto LN, Kelly RE Jr., Buescher ES. Should central venous catheters be removed as soon as candidemia is detected in neonates? Pediatrics 2000; 106:E63. 340. Rex JH, Walsh TJ, Sobel JD, et al. Practice guidelines for the treatment of candidiasis. Infectious Diseases Society of America. Clin Infect Dis 2000; 30:662-78. 341. Pronovost P, Needham D, Berenholtz S, et al. An intervention to decrease catheter-related bloodstream infections in the ICU. N Engl J Med 2006; 355:2725-32. 342. Sherertz RJ, Ely EW, Westbrook DM, et al. Education of physicians-in-training can decrease the risk for vascular catheter infection. Ann Intern Med 2000; 132:641-8. 343. Eggimann P, Harbarth S, Constantin MN, Touveneau S, Chevrolet JC, Pittet D. Impact of a prevention strategy targeted at vascular-access care on incidence of infections acquired in intensive care. Lancet 2000; 355:1864-8. 344. Warren DK, Zack JE, Mayfield JL, et al. The effect of an education program on the incidence of central venous catheter-associated bloodstream infection in a medical ICU. Chest 2004; 126:1612-8. 345. Soifer NE, Borzak S, Edlin BR, Weinstein RA. Prevention of peripheral venous catheter complications with an intravenous therapy team: a randomized controlled trial. Arch Intern Med 1998; 158:473-7. 346. Lorente L, Jiménez A, García C, et al. Catheter-related bacteremia from femoral and central internal jugular venous access. Eur J Clin Microbiol Infect Dis 2008; 27:867-71. 347. Lorente L, Henry C, Martín MM, Jiménez A, Mora ML. Central venous catheter-related infection in a prospective and observational study of 2,595 catheters. Crit Care 2005; 9:R631-5. 348. Deshpande KS, Hatem C, Ulrich HL, et al. The incidence of infectious complications of central venous catheters at the subclavian, internal jugular, and femoral sites in an intensive care unit population. Crit Care Med 2005; 33:13-20. 349. Cimochowski GE, Worley E, Rutherford WE, Sartain J, Blondin J, Harter H. Superiority of the internal jugular over the subclavian access for temporary dialysis. Nephron 1990; 54:154-61. 350. Parienti JJ, Thirion M, Megarbane B, et al. Femoral vs jugular venous catheterization and risk of nosocomial events in adults requiring acute renal replacement therapy: a randomized controlled trial. JAMA 2008; 299:241322. 351. Hind D, Calvert N, McWilliams R, et al. Ultrasonic locating devices for central venous cannulation: metaanalysis. BMJ 2003; 327:361. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 61 ______________________________________________________________________________ 352. Maki DG, Ringer M, Alvarado CJ. Prospective randomised trial of povidone-iodine, alcohol, and chlorhexidine for prevention of infection associated with central venous and arterial catheters. Lancet 1991; 338:339-43. 353. Humar A, Ostromecki A, Direnfeld J, et al. Prospective randomized trial of 10% povidone-iodine versus 0.5% tincture of chlorhexidine as cutaneous antisepsis for prevention of central venous catheter infection. Clin Infect Dis 2000; 31:1001-7. 354. Chaiyakunapruk N, Veenstra DL, Lipsky BA, Saint S. Chlorhexidine compared with povidone-iodine solution for vascular catheter-site care: a meta-analysis. Ann Intern Med 2002; 136:792-801. 355. Pittet D, Hugonnet S, Harbarth S, et al. Effectiveness of a hospital-wide programme to improve compliance with hand hygiene. Infection Control Programme. Lancet 2000; 356:1307-12. 356. Raad II, Hohn DC, Gilbreath BJ, et al. Prevention of central venous catheter-related infections by using maximal sterile barrier precautions during insertion. Infect Control Hosp Epidemiol 1994; 15:231-8. 357. Mermel LA, McCormick RD, Springman SR, Maki DG. The pathogenesis and epidemiology of catheterrelated infection with pulmonary artery Swan-Ganz catheters: a prospective study utilizing molecular subtyping. Am J Med 1991; 91:197S-205S. 358. Lee DH, Jung KY, Choi YH. Use of maximal sterile barrier precautions and/or antimicrobial-coated catheters to reduce the risk of central venous catheter-related bloodstream infection. Infect Control Hosp Epidemiol 2008; 29:947-50. 359. Arrighi DA, Farnell MB, Mucha P Jr., Iistrup DM, Anderson DL. Prospective, randomized trial of rapid venous access for patients in hypovolemic shock. Ann Emerg Med 1989; 18:927-30. 360. Ahmed Z, Mohyuddin Z. Complications associated with different insertion techniques for Hickman catheters. Postgrad Med J 1998; 74:104-7. 361. Hoffmann KK, Weber DJ, Samsa GP, Rutala WA. Transparent polyurethane film as an intravenous catheter dressing. A meta-analysis of the infection risks. JAMA 1992; 267:2072-6. 362. Gillies D, O'Riordan L, Carr D, Frost J, Gunning R, O'Brien I. Gauze and tape and transparent polyurethane dressings for central venous catheters. Cochrane Database Syst Rev 2003;CD003827. 363. Laura R, Degl'Innocenti M, Mocali M, et al. Comparison of two different time interval protocols for central venous catheter dressing in bone marrow transplant patients: results of a randomized, multicenter study. The Italian Nurse Bone Marrow Transplant Group (GITMO). Haematologica 2000; 85:275-9. 364. Vokurka S, Bystricka E, Visokaiova M, Scudlova J. Once- versus twice-weekly changing of central venous catheter occlusive dressing in intensive chemotherapy patients: results of a randomized multicenter study. Med Sci Monit 2009; 15:CR107-CR110. 365. Maki DG, Mermel LA, Kluger D, et al. The efficacy of a chlorhexidine-impregnated sponge (Biopatch) for the prevention of intravascular catheter-related infection - a prospective, randomized, controlled, multicenter study. Abstr Intersci Conf Antimicrob Agents Chemother Intersci Conf Antimicrob Agents Chemother 2000; Sep 17-20; 40:422. 366. Ruschulte H, Franke M, Gastmeier P, et al. Prevention of central venous catheter related infections with chlorhexidine gluconate impregnated wound dressings: a randomized controlled trial. Ann Hematol 2009; 88:267-72. 367. Timsit JF, Schwebel C, Bouadma L, et al. Chlorhexidine-impregnated sponges and less frequent dressing changes for prevention of catheter-related infections in critically ill adults: a randomized controlled trial. JAMA 2009; 301:1231-41. 368. Ho KM, Litton E. Use of chlorhexidine-impregnated dressing to prevent vascular and epidural catheter colonization and infection: a meta-analysis. J Antimicrob Chemother 2006; 58:281-7. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 62 ______________________________________________________________________________ 369. Levin A, Mason AJ, Jindal KK, Fong IW, Goldstein MB. Prevention of hemodialysis subclavian vein catheter infections by topical povidone-iodine. Kidney Int 1991; 40:934-8. 370. Sesso R, Barbosa D, Leme IL, et al. Staphylococcus aureus prophylaxis in hemodialysis patients using central venous catheter: effect of mupirocin ointment. J Am Soc Nephrol 1998; 9:1085-92. 371. Zakrzewska-Bode A, Muytjens HL, Liem KD, Hoogkamp-Korstanje JA. Mupirocin resistance in coagulasenegative staphylococci, after topical prophylaxis for the reduction of colonization of central venous catheters. J Hosp Infect 1995; 31:189-93. 372. Rao SP, Oreopoulos DG. Unusual complications of a polyurethane PD catheter. Perit Dial Int 1997; 17:410-2. 373. Rupp ME, Sholtz LA, Jourdan DR, et al. Outbreak of bloodstream infection temporally associated with the use of an intravascular needleless valve. Clin Infect Dis 2007; 44:1408-14. 374. Seymour VM, Dhallu TS, Moss HA, Tebbs SE, Elliot TS. A prospective clinical study to investigate the microbial contamination of a needleless connector. J Hosp Infect 2000; 45:165-8. 375. Cookson ST, Ihrig M, O'Mara EM, et al. Increased bloodstream infection rates in surgical patients associated with variation from recommended use and care following implementation of a needleless device. Infect Control Hosp Epidemiol 1998; 19:23-7. 376. Johnson BH, Rypins EB. Single-lumen vs double-lumen catheters for total parenteral nutrition. A randomized, prospective trial. Arch Surg 1990; 125:990-2. 377. McCarthy MC, Shives JK, Robison RJ, Broadie TA. Prospective evaluation of single and triple lumen catheters in total parenteral nutrition. JPEN J Parenter Enteral Nutr 1987; 11:259-62. 378. Ma TY, Yoshinaka R, Banaag A, Johnson B, Davis S, Berman SM. Total parenteral nutrition via multilumen catheters does not increase the risk of catheter-related sepsis: a randomized, prospective study. Clin Infect Dis 1998; 27:500-3. 379. López-Briz E, Ruiz-García V. [Effectiveness of heparin versus NaCl 0.9% in central venous catheter flushing. A systematic review]. Farm Hosp 2005; 29:258-64. 380. Rabe C, Gramann T, Sons X, et al. Keeping central venous lines open: a prospective comparison of heparin, vitamin C and sodium chloride sealing solutions in medical patients. Intensive Care Med 2002; 28:1172-6. 381. Smith S, Dawson S, Hennessey R, Andrew M. Maintenance of the patency of indwelling central venous catheters: is heparin necessary? Am J Pediatr Hematol Oncol 1991; 13:141-3. 382. Rice L. Heparin-induced thrombocytopenia: myths and misconceptions (that will cause trouble for you and your patient). Arch Intern Med 2004; 164:1961-4. 383. Kethireddy S, Safdar N. Urokinase lock or flush solution for prevention of bloodstream infections associated with central venous catheters for chemotherapy: a meta-analysis of prospective randomized trials. J Vasc Access 2008; 9:51-7. 384. Brun-Buisson C, Doyon F, Sollet JP, Cochard JF, Cohen Y, Nitenberg G. Prevention of intravascular catheterrelated infection with newer chlorhexidine-silver sulfadiazine-coated catheters: a randomized controlled trial. Intensive Care Med 2004; 30:837-43. 385. Rupp ME, Lisco SJ, Lipsett PA, et al. Effect of a second-generation venous catheter impregnated with chlorhexidine and silver sulfadiazine on central catheter-related infections: a randomized, controlled trial. Ann Intern Med 2005; 143:570-80. 386. Ostendorf T, Meinhold A, Harter C, et al. Chlorhexidine and silver-sulfadiazine coated central venous catheters in haematological patients-a double-blind, randomised, prospective, controlled trial. Support Care Cancer 2005; 13:993-1000. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 63 ______________________________________________________________________________ 387. Logghe C, Van OC, D'Hoore W, Ezzedine H, Wauters G, Haxhe JJ. Evaluation of chlorhexidine and silversulfadiazine impregnated central venous catheters for the prevention of bloodstream infection in leukaemic patients: a randomized controlled trial. J Hosp Infect 1997; 37:145-56. 388. Oda T, Hamasaki J, Kanda N, Mikami K. Anaphylactic shock induced by an antiseptic-coated central venous [correction of nervous] catheter. Anesthesiology 1997; 87:1242-4. 389. Marik PE, Abraham G, Careau P, Varon J, Fromm RE Jr. The ex vivo antimicrobial activity and colonization rate of two antimicrobial-bonded central venous catheters. Crit Care Med 1999; 27:1128-31. 390. Raad I, Darouiche R, Hachem R, Mansouri M, Bodey GP. The broad-spectrum activity and efficacy of catheters coated with minocycline and rifampin. J Infect Dis 1996; 173:418-24. 391. Sampath LA, Tambe SM, Modak SM. In vitro and in vivo efficacy of catheters impregnated with antiseptics or antibiotics: evaluation of the risk of bacterial resistance to the antimicrobials in the catheters. Infect Control Hosp Epidemiol 2001; 22:640-6. 392. van dW, van Woensel JB. Prophylactic antibiotics for preventing early central venous catheter Gram positive infections in oncology patients. Cochrane Database Syst Rev 2007;CD003295. 393. Safdar N, Maki DG. Use of vancomycin-containing lock or flush solutions for prevention of bloodstream infection associated with central venous access devices: a meta-analysis of prospective, randomized trials. Clin Infect Dis 2006; 43:474-84. 394. Chatzinikolaou I, Zipf TF, Hanna H, et al. Minocycline-ethylenediaminetetraacetate lock solution for the prevention of implantable port infections in children with cancer. Clin Infect Dis 2003; 36:116-9. 395. Jurewitsch B, Lee T, Park J, Jeejeebhoy K. Taurolidine 2% as an antimicrobial lock solution for prevention of recurrent catheter-related bloodstream infections. JPEN J Parenter Enteral Nutr 1998; 22:242-4. 396. Lai KK. Safety of prolonging peripheral cannula and i.v. tubing use from 72 hours to 96 hours. Am J Infect Control 1998; 26:66-70. 397. Idvall E, Gunningberg L. Evidence for elective replacement of peripheral intravenous catheter to prevent thrombophlebitis: a systematic review. J Adv Nurs 2006; 55:715-22. 398. Eyer S, Brummitt C, Crossley K, Siegel R, Cerra F. Catheter-related sepsis: prospective, randomized study of three methods of long-term catheter maintenance. Crit Care Med 1990; 18:1073-9. 399. Cobb DK, High KP, Sawyer RG, et al. A controlled trial of scheduled replacement of central venous and pulmonary-artery catheters. N Engl J Med 1992; 327:1062-8. 400. Cook D, Randolph A, Kernerman P, et al. Central venous catheter replacement strategies: a systematic review of the literature. Crit Care Med 1997; 25:1417-24. 401. Timsit JF. Scheduled replacement of central venous catheters is not necessary. Infect Control Hosp Epidemiol 2000; 21:371-4. 402. Graham DR, Keldermans MM, Klemm LW, Semenza NJ, Shafer ML. Infectious complications among patients receiving home intravenous therapy with peripheral, central, or peripherally placed central venous catheters. Am J Med 1991; 91:95S-100S. 403. Duerksen DR, Papineau N, Siemens J, Yaffe C. Peripherally inserted central catheters for parenteral nutrition: a comparison with centrally inserted catheters. JPEN J Parenter Enteral Nutr 1999; 23:85-9. 404. Janes M, Kalyn A, Pinelli J, Paes B. A randomized trial comparing peripherally inserted central venous catheters and peripheral intravenous catheters in infants with very low birth weight. J Pediatr Surg 2000; 35:1040-4. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 64 ______________________________________________________________________________ 405. Al RB, Fakih MG, Bryan-Nomides N, et al. Peripherally inserted central venous catheters in the acute care setting: A safe alternative to high-risk short-term central venous catheters. Am J Infect Control 2010; 38:149-53. 406. Finney R, Albrink MH, Hart MB, Rosemurgy AS. A cost-effective peripheral venous port system placed at the bedside. J Surg Res 1992; 53:17-9. 407. Cil BE. Radiological placement of chest ports in pediatric oncology patients. Eur Radiol 2004; 14:2015-9. Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 65 ______________________________________________________________________________ NOTAS Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 66 ______________________________________________________________________________ NOTAS Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 67 ______________________________________________________________________________ NOTAS Octubre 2011 INFECCIONES RELACIONADAS CON CATÉTERES VASCULARES Pág. 68 ______________________________________________________________________________ Sociedad Andaluza de Enfermedades Infecciosas, Avda. de la Aeronáutica 10, edificio Helios, 2ª planta, módulo 8, 41020 Sevilla. Teléfono 954389553 Fax 954375351. Correo electrónico: [email protected] Avances en Enfermedades Infecciosas es un boletín de comentarios independientes sobre avances notables y de difusión reciente en Enfermedades Infecciosas, publicado 6 veces al año por la Sociedad Andaluza de Enfermedades Infecciosas (SAEI). Pretende facilitar el conocimiento de lo publicado en la literatura científica, pero el tratamiento de los pacientes o la metodología de los procedimientos diagnósticos no pueden estar basados exclusivamente en estos comentarios. Tampoco lo divulgado en Avances en Enfermedades Infecciosas pretende sustituir el contenido de la publicación original, sino por el contrario, estimular su lectura. Los comentarios pueden reflejar opiniones personales de cada Redactor que no tienen porqué coincidir con las de SAEI. Depósito Legal: SE-99-2000. ISSN: 1576-3129. Todos los derechos reservados. En la edición de esta publicación han colaborado como Socios Protectores de SAEI los Laboratorios Abbott, Gilead, y ViiV y como Socios Patrocinadores de SAEI los Laboratorios Astellas, Janssen-Cilag y Merck Sharp & Dohme.