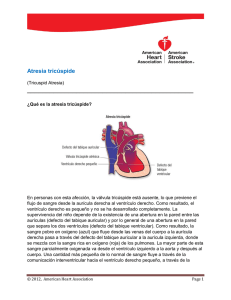
Capítulo 28: Atresia tricúspide y corazón univentricular
Anuncio

Capítulo 28 Atresia tricúspide y corazón univentricular Atresia tricúspide Mario Cazzaniga1, J.L. Vázquez Martínez2 1 Servicio de Cardiología Pediátrica; 2 Servicio de Pediatría. Hospital Universitario Ramón y Cajal. Madrid DEFINICIÓN, APUNTES HISTÓRICOS Y CLASIFICACIÓN Se define como atresia tricúspide la agenesia completa de la válvula tricúspide e inexistencia concomitante del orificio correspondiente –a su nivel sólo se visualiza una estructura fibromuscular que impide la conexión entre el atrio y el ventrículo derechos–. Empleando la terminología que describe la segmentación cardiaca, se trata de una ausencia completa de conexión entre la aurícula derecha y el ventrículo derecho. Es, por tanto, una anomalía que se inscribe en el conjunto de malformaciones cuyo modo de conexión atrioventricular es univentricular. Normalmente, por el contrario, es biventricular(1-4). De los antecedentes históricos se deduce que fue descrita por Kreysig en 1817 y que el término atresia lo acuña Schuberg en 1861. Khune, en 1906, describe dos tipos esenciales tomando como referencia la conexión de las grandes arterias: 1) con vasos normalmente relacionados –concordancia ventrículo-arterial–, y 2) conectados en transposición –discordancia ventrículo-arterial–. Esta información previa sustenta la clasificación propuesta por Edwards en 1949, quien añade subtipos dependientes del grado de obstrucción pulmonar: a) con atresia pulmonar; b) con hipoplasia o estenosis pulmonar, y c) sin obstrucción pulmonar. Vlad y Rao, en 1978 y 1982, respectivamente, la amplían, al incorporar casos con malposición de grandes vasos y potenciar el impacto del tamaño de la comunicación interventricular. Debido a la diversidad en lo morfológico, las citadas clasificaciones deben entenderse como orientativas. Es probablemente más apropiado en cada caso un enfoque descriptivo riguroso que pondere los detalles anatómicos y fisiopatológicos a los que se accede de forma fiable desde la ecocardiografía(3,5-8). INCIDENCIA Y PREVALENCIA Estudios epidemiológicos, tanto antiguos como más recientes, sitúan la incidencia de cardiopatía congénita en una horquilla que oscila entre el 4 y el 10‰ de recién nacidos 377 28.Cazzaniga.indd 377 8/10/10 12:37:27 Atresia tricúspide y corazón univentricular vivos. Dentro de este escenario, la atresia tricúspide está representada con una proporción próxima al 0,06-0,07‰ según datos del New England Regional Infant Cardiac Program. La prevalencia en series clínicas y estudios necrópsicos oscila entre el 0,5 y el 4%, y entre el 4 y el 6%, respectivamente. El diagnóstico ecocardiográfico prenatal es posible ya desde las semanas 16-18, y su presencia está representada entre un 4 y un 8% del total de las cardiopatías detectadas con este método. Los estudios fetales evolutivos demuestran que la tasa de interrupción del embarazo decidida por las parejas puede alcanzar hasta un 60%, mientras que la muerte intrauterina y la del recién nacido se registran en alrededor del 3% y 5%, respectivamente. La carencia de estudios amplios referentes a mortalidad inmediata del recién nacido impide advertir su frecuencia como causa de la misma. En cualquier caso, es probable que exista una subestimación de la incidencia tradicionalmente admitida para esta entidad(9-14). DESCRIPCIÓN MORFOLÓGICA, FISIOPATOLOGÍA Y ASOCIACIONES El situs visceroatrial y la posición del corazón en el tórax son usualmente las habituales –solitus y levocardia, respectivamente–, y todos los subtipos morfológicos tienen en común la ausencia de comunicación directa entre la aurícula y el ventrículo derecho. En la denominada atresia tricúspide clásica, el orificio tricuspídeo ausente se traduce en un suelo auricular muscular ciego en el que puede observarse una pequeña excavación central como rastro del sitio donde debió formarse la válvula correspondiente. El miocardio atrial está separado del ventricular por un tejido fibroadiposo, de manera que el ventrículo derecho no posee entrada, sólo reduce sus componentes a las porciones trabeculada y de salida, y por ello se le denomina incompleto (Figura 1). Si bien esta descripción básica es mayoritaria, en ocasiones –infrecuentes, por cierto– se visualiza una membrana imperforada ocluyendo el orificio tricúspide, subtipo que se describe en corazones univentriculares, enfermedad de Ebstein o atípicas formas de canal aurículo-ventricular (AV)(3,4). La aurícula derecha está dilatada y la izquierda tiene un tamaño normal o aumentado en relación con la cuantía del flujo pulmonar. Invariablemente existe una comunicación interauricular genuina o un foramen oval permeable abierto hacia la aurícula izquierda. Una u otra son esenciales debido a que constituyen el obligado cortocircuito derecha-izquierda que permite el vaciado auricular derecho. Cuanto mayor es la comunicación, mejor el desagüe venoso hacia las cavidades izquierdas y su contribución al volumen minuto. Cuando es restrictiva, la circulación venosa sistémica remansa en el hígado provocando hepatomegalia y disminución variable del gasto cardiaco. La mezcla proporcional que tiene lugar en la aurícula izquierda entre la sangre enteramente oxigenada que procede de las venas pulmonares y la normalmente desaturada proveniente de las venas cavas condiciona el grado de hipoxemia arterial: a mayor proporción procedente de las venas pulmonares, menor cianosis, y viceversa. La aurícula izquierda conecta normalmente a través de un orificio mitral amplio con un ventrículo izquierdo tanto más dilatado cuanto mayor es el flujo pulmonar. Aproximadamente en el 80% de los enfermos la conexión ventrículo-arterial es concordante, de modo que la arteria pulmonar emerge del incompleto e hipoplásico ventrículo derecho. En un 10-15% tal conexión es discordante y, como consecuencia, es 378 28.Cazzaniga.indd 378 8/10/10 12:37:34 M. Cazzaniga, J.L. Vázquez AD VD AP AD AI VI VD AD AI Ao VD CIV restrictiva (estenosis “subAo”) Ao AI VI AP VI Ao AP CoAo Figura 1. Tipos de atresia tricúspide. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; AP: arteria pulmonar; CIV: comunicación interventricular; CoAo: coartación aórtica; VD: ventrículo derecho; VI: ventrículo izquierdo. la aorta la que nace del ventrículo derecho –transposición–. La proporción restante corresponde a casos con malposición de grandes vasos, como la emergencia izquierda de aorta (L posición). Habitualmente existe, a su vez, una comunicación interventricular de localización perimembranosa, muscular pura, o consecuencia de alineación defectuosa de los componentes septales. En cualquier caso, esta comunicación es el único camino a través del cual una parte del volumen sistólico ventricular izquierdo accede al ventrículo derecho y a la arteria que de él emerge. En buena medida, de su tamaño depende la amplitud y el desarrollo de ambas estructuras. Se deduce entonces que el flujo a través del defecto interventricular regula la cuantía del volumen circulatorio pulmonar cuando la conexión de grandes vasos es normal, o del correspondiente sistémico en casos con transposición. Cuanto más pequeño es este defecto, más reducido es el tamaño ventricular y la arteria correspondiente, hasta el punto de que la porción de salida del ventrículo derecho se reduce a una zona estrecha y obstructiva. Llegados a este extremo, existirá, por tanto, obstrucción subpulmonar o subaórtica según el modo de conexión de las grandes arterias. En la última categoría no es infrecuente la presencia de coartación aórtica asociada. Si, por el contrario, la comunicación interventricular es amplia, las porciones trabeculada y de salida ventricular suelen estar mejor desarrolladas del mismo modo que lo está la arteria emergente. Es frecuente que el defecto reduzca su tamaño con el tiempo o lo haga de forma espasmódica. Debido a ello, y cuando la conexión de las grandes arterias es normal, 379 28.Cazzaniga.indd 379 8/10/10 12:37:35 Atresia tricúspide y corazón univentricular el flujo pulmonar disminuye progresivamente, llegando al extremo de provocar crisis hipóxicas similares a las que se describen en la tetralogía de Fallot. El tabique interventricular raramente está intacto. En esta condición, de ordinario con vasos normales, la atresia valvular pulmonar es común y la circulación pulmonar depende entonces sólo de la permeabilidad ductal. Otras anomalías cardiovasculares que acompañan a la atresia tricúspide son el ductus arterioso, la coartación y la hipoplasia o interrupción del arco aórtico, que predominan en presencia de transposición de grandes arterias. Con vasos normalmente conectados, se observa con cierta frecuencia atresia sigmoidea y, en menor proporción, agenesia valvular. La estenosis semilunar pura y aislada es rara. Es excepcional la presencia de tronco arterial común asociado, del mismo modo que lo son las anomalías cromosómicas, músculo-esqueléticas y/o gastrointestinales(2,3). Como puede apreciarse, la variabilidad morfológica es diversa y conviene su descripción detallada para interpretar mejor la fisiología circulatoria. Una vez hecho el diagnóstico, y debido al impacto terapéutico que tiene, centramos nuestra atención en la valoración de la circulación pulmonar. La cuantía de la misma define la modalidad de presentación clínica: si está muy disminuida o decrece en exceso con el tiempo, predomina una cianosis intensa y progresiva; si, por el contrario, existe hiperaflujo pulmonar, la aparición de insuficiencia cardiaca acompañada de cianosis poco manifiesta o ausente es la norma. Con menor frecuencia se encuentran, entre estos extremos, niños que presentan hipoxemia leve o moderada debido a una modesta obstrucción pulmonar que regula la cuantía del flujo pulmonar. EXÁMENES COMPLEMENTARIOS PARA EL DIAGNÓSTICO Y SEGUIMIENTO La radiografía de tórax no contribuye al diagnóstico diferencial entre atresia tricúspide u otras malformaciones. La silueta puede ser normal o presentar cardiomegalia a expensas de una dilatada aurícula derecha o simplemente en relación con el volumen circulatorio pulmonar. Es en realidad el electrocardiograma el que orienta al diagnóstico, debido a la presencia de crecimiento ventricular izquierdo, fuerzas derechas escasas o ausentes y un eje QRS izquierdo con o sin patrón de hemibloqueo anterior izquierdo. La ecocardiografía 2-D define de forma fiable la malformación y sus asociaciones, mientras que la fisiología circulatoria se comprende más claramente con la contribución de la técnica Doppler con mapeo en color; por todo ello, ambas técnicas son imprescindibles para el diagnóstico y constituyen a la vez el pivote desde donde se plantean las decisiones terapéuticas iniciales(3,15). El cateterismo cardiaco diagnóstico se realiza de forma excepcional; sin embargo, su indicación es relevante para evaluar datos hemodinámicos y angiográficos esenciales como paso previo a la cirugía de Glenn y/o modificada de Fontan y sus variantes. Las intervenciones con catéter no son infrecuentes. En general pueden ser necesarios cuatro procedimientos: 1. Septostomía atrial (técnica de Rashkind) con cuchilla y/o balón cuando la comunicación interauricular es restrictiva; 380 28.Cazzaniga.indd 380 8/10/10 12:37:36 M. Cazzaniga, J.L. Vázquez 2. Angioplastia (dilatación con balón) y/o implante de dispositivo metálico (stent) cuando un segmento vascular de arterias pulmonares, venas sistémicas o conductos protésicos presenta estenosis localizada nativa o debida a cirugía paliativa previa; 3. Oclusión con dispositivos –pre/postoperatoria, o en combinación integrada secuencial con la cirugía– de fístulas que hubieran quedado permeables, arterias colaterales sistémico-pulmonares, venas sistémicas de escape, cerclaje pulmonar estrecho, o fenestración del conducto intra o extracardiaco; y 4. Ablación electrofisiológica de vías anómalas inductoras de taquiarrtimias. Más recientemente se ha explorado la posibilidad de efectuar el denominado segundo tiempo de Fontan mediante el implante de un conducto intraatrial por cateterismo(3,16-18). El ecocardiograma –transtorácico o intraesofágico– con o sin técnicas de contraste es vital en el seguimiento postoperatorio; sin embargo, en no pocas ocasiones su información es limitada, por lo que es necesario recurrir a otras exploraciones, entre las que destacan la resonancia magnética nuclear (RMN) y la medicina isotópica. La RMN es un aliado clínico muy útil que aporta datos relevantes, especialmente en niños mayores o jóvenes adultos operados en quienes es importante vigilar áreas del árbol vascular pulmonar, descartar sospecha de obstrucciones en los empalmes quirúrgicos o simplemente valorar flujos vasculares y/o función ventricular. Las técnicas isotópicas durante el seguimiento tienen un papel importante en tres áreas definidas: a) evaluación de la perfusión pulmonar para controlar su distribución segmentaria antes o después de intervenciones con catéter sobre las ramas pulmonares; b) determinación sistemática de la función ventricular para detectar precozmente disfunción miocárdica, y c) localización de cortocircuitos intrapulmonares post-Glenn bidireccional (fístula arteriovenosa pulmonar) o intracardiacos post-Fontan o variantes (fugas localizadas en la anastomosis atriopulmonar o en el túnel intraatrial cavopulmonar)(19,20). HISTORIA NATURAL Y OBSERVACIONES CLÍNICAS No existe una predominancia significativa de género en esta malformación. La cianosis y el soplo cardiaco en el primer día de vida se presentan en más del 50% de los afectados, y cerca del 90% de los enfermos están ya diagnosticados en los 2 primeros meses de vida; menos del 10% de ellos puede sobrevivir más allá de los 10 años sin cirugía. En alrededor del 80% de los niños, la cianosis es el eje central de su cuadro clínico, y su precocidad, intensidad o progresión se deben a una disminución del volumen circulatorio pulmonar y a predominio, a su vez, del obligado cortocircuito atrial derecha-izquierda. La aparición temprana en la primera semana de vida nos advierte de la severa reducción del flujo pulmonar. En no pocos neonatos coexiste atresia infundibular y valvular pulmonar(2,3,21,22). Contrariamente, en un 10-15% de los casos, la insuficiencia cardiaca es el marco clínico habitual. Su presentación puede retrasarse más allá del periodo neonatal en enfermos con transposición de grandes vasos e hipertensión pulmonar; ello se debe al pausado descenso que sufre la resistencia vascular pulmonar y a su consecuencia: el aumento paulatino del flujo circulatorio. El cuadro es más grave y precoz, llegando incluso al colapso circulatorio en presencia de coartación de aorta y/o estenosis suba381 28.Cazzaniga.indd 381 8/10/10 12:37:37 Atresia tricúspide y corazón univentricular órtica severa. Estas lesiones requieren un tratamiento médico-quirúrgico agresivo para eliminar con premura la obstrucción al flujo sistémico y proteger el lecho pulmonar. Sin tratamiento alguno, los niños con transposición e hipertensión pulmonar evolucionan a la enfermedad vascular obstructiva, que con el tiempo acentúa la cianosis y a su vez impide dirigir al enfermo hacia la estrategia quirúrgica univentricular(2,3,21). La atresia tricúspide es una malformación que requiere cirugía para la supervivencia. Debido a ello, la historia “natural” se ve modificada sustancialmente, de modo que en la actualidad los efectos clínicos derivados de prolongados periodos de cianosis, insuficiencia cardiaca o hipertensión pulmonar se neutralizan de forma conveniente. También se refieren en la literatura, aunque son menos frecuentes en la actualidad, crisis hipóxicas –especialmente en lactantes con defecto interventricular muscular pequeño–, cifoescoliosis en relación con prolongada hipoxemia o toracotomías de cirugías paliativas, poliglobulia intensa y sus consecuencias, accidente cerebrovascular, absceso cerebral, endocarditis bacteriana y pobre crecimiento ponderal. La función ventricular izquierda también sufre deterioro con el tiempo, y su origen se percibe como multifactorial: hipoxemia, largos periodos de precarga aumentada, insuficiencia mitral, o anormal mioarquitectura intrínseca del músculo cardiaco; en este contexto no faltan asimismo los trastornos del ritmo cardiaco(3,23). ESTRATEGIAS TERAPÉUTICAS El tratamiento farmacológico contribuye a controlar y estabilizar condiciones clínicas específicas o graves, tanto pre como postoperatorias. La administración de prostaglandina inicia la primera fase terapéutica de estabilización, que se completa con la intervención quirúrgica apropiada en cada caso. Hemos de puntualizar que todas la técnicas operatorias tienen carácter paliativo, ya que no existe una corrección completa que restituya la normalidad anatómica biventricular. Asimismo, las modalidades de tratamiento quirúrgico del denominado genéricamente corazón univentricular –la atresia tricúspide también lo es desde la perspectiva funcional– se vienen modificando constantemente con la incorporación de novedosas técnicas y diferentes enfoques en los protocolos de manejo; aun así, existen controversias e incógnitas que todavía quedan por resolver. Puede afirmarse que el que nos ocupa es un capítulo no cerrado en la cardiología infantil. Debido a ello, y contando con que este informe está dirigido al ámbito pediátrico menos familiarizado con el tema, parece prudente ir desgranando aquéllos con alguna amplitud. En el pasado sólo se contaba con los procedimientos tradicionales para mejorar cuadros clínicos definidos: cerclaje del tronco pulmonar para los casos con hiperaflujo e insuficiencia cardiaca, fístula sistémico-pulmonar –Waterston-Cooley, Potts, BlalockTaussig– y/o anastomosis de Glenn clásica (unidireccional) para niños muy hipóxicos. Estas intervenciones no estaban exentas de morbimortalidad, y con el paso del tiempo propiciaban deterioro de la función ventricular y secuelas anatómicas –estenosis, distorsiones– o funcionales importantes en el lecho vascular pulmonar –hiperresistencia arteriolar–. En la actualidad, se evitan tales alteraciones con técnicas más refinadas, prótesis más pequeñas –conducto de 3,5 o 4 mm de diámetro (fístula de Blalock382 28.Cazzaniga.indd 382 8/10/10 12:37:38 M. Cazzaniga, J.L. Vázquez Taussig modificada)–, y acortando a su vez el tiempo de transición entre los tiempos quirúrgicos. Aún así, la mortalidad con estas técnicas ronda el 10%(3,24). En la década de los setenta –con el antecedente de la investigación animal–, se incorpora en humanos la anastomosis atriopulmonar o conexión entre la aurícula derecha y la arteria pulmonar, técnica diseñada por Fontan que establece con éxito por vez primera un modelo de circulación univentricular en el que está ausente el ventrículo derecho. A partir de entonces, se incorporan variantes técnicas (Kreutzer, Bjork) y diferentes estrategias de manejo con el doble objetivo de reducir la morbimortalidad global y prolongar la longevidad del modelo circulatorio resultante. Justamente por ello, resulta complicado armonizar los resultados operatorios publicados por diferentes grupos; con todo y a la fecha, los primeros supervivientes irrumpen ya en su 3.ª4.ª década(25-29). La circulación univentricular –también denominada principio de Fontan– se caracteriza por la presencia de una sola bomba –el ventrículo izquierdo– que debe impulsar su volumen sistólico con la energía suficiente para vencer las resistencias vasculares en serie a las que se enfrenta: primero el lecho vascular sistémico, y luego –con el mismo impulso sistólico inicial– el pulmonar; asimismo, debe poseer óptimas propiedades elásticas diastólicas para recibir con holgura (“efecto succión”) el volumen circulatorio que regresa desde este último circuito. Se deduce entonces que una reserva funcional ventricular óptima, la ausencia de lesiones vasculares obstructivas –sistémicas y pulmonares–, y baja resistencia arteriolar pulmonar son al menos tres de las exigencias esenciales para que el modelo circulatorio funcione correctamente. Choussat describió en 1978 hasta 10 requisitos para seleccionar los mejores enfermos susceptibles de ser paliados con la técnica de Fontan. La violación de los mismos deviene en un fracaso terapéutico. La mortalidad global de la técnica atriopulmonar aplicada en la década de los setenta-ochenta resultó elevada, y por tanto se fueron incorporando innovaciones técnicas y estratégicas diversas en el manejo médico-quirúrgico. Como consecuencia, aquel decálogo ha sufrido importantes modificaciones, en especial en lo referido a la edad operatoria(30,31). En 1988, de Leval demuestra que la anastomosis cavopulmonar total proporciona una eficiencia hidro-hemodinámica superior a la atriopulmonar. Al tiempo se presupone que la incidencia de arritmias cardiacas será menor con el tiempo. Se trata de una cirugía combinada simultánea –en un mismo tiempo operatorio– que, por un lado, anastomosa la vena cava superior con la arteria pulmonar derecha (Glenn bidireccional), mientras que, a través de un túnel lateral intraatrial construido con parte de la pared auricular, se deriva la circulación de la vena cava inferior a la arteria pulmonar. Más recientemente se prefiere el implante de un conducto extracardiaco protésico para este menester. La fenestración del conducto o del túnel constituye otra innovación importante aplicada por determinados grupos quirúrgicos en niños con o sin factores de riesgo. Si bien esta comunicación creada por el cirujano induce cierto grado de cianosis al permitir que parte de la sangre venosa sistémica pobre en oxígeno transite hacia la circulación general, propicia una mejor adaptación circulatoria en el postoperatorio inmediato al mantener un gasto cardiaco adecuado. Ello se traduce en una significativa reducción de la morbimortalidad hospitalaria. La posibilidad de efec383 28.Cazzaniga.indd 383 8/10/10 12:37:39 Atresia tricúspide y corazón univentricular tuar dichas técnicas sin circulación extracorpórea o con un mínimo soporte circulatorio fue explorada también con éxito(32-38). A principios de los noventa ya se concibe la estrategia de efectuar la anastomosis cavopulmonar total en dos tiempos quirúrgicos bien diferenciados en niños con factores de riesgo: primero Glenn bidireccional, y luego anastomosis cava inferior-arteria pulmonar; todo ello bajo el amparo de la doctrina tradicional con actuaciones terapéuticas según la demanda clínica. En la actualidad se va imponiendo aquel protocolo pero efectuado a edades más tempranas con independencia de los signos o síntomas clínicos. Las siguientes observaciones argumentan tal conducta: 1. La edad no constituye un factor de riesgo, como preconizaba Choussat. 2. La preservación de una óptima reserva funcional del ventrículo izquierdo se logra reduciendo precozmente su precarga con el Glenn bidireccional aboliendo al tiempo todo flujo pulsátil adicional. 3. Acortar los tiempos de transición entre las intervenciones optimiza la hemodinamia univentricular. La propuesta de diferentes grupos es, por tanto, la realización de un primer tiempo quirúrgico precoz con la anastomosis de Glenn bidireccional a una edad que oscila entre los 3 y los 9 meses suprimiendo en lo posible otros afluentes de flujo pulmonar (fístula previa, permeabilidad nativa o tras cerclaje de la arteria pulmonar). Con este protocolo se pretende anular o atenuar muchos de los factores de riesgo descritos por Choussat que en esencia son ventrículo y/o cirugía paliativa tiempo-dependientes, esta disciplina tiene como objetivo reclutar intencionadamente un grupo numeroso de enfermos que se tornan “con bajo riesgo y hemodinamia favorable” para completar la univentricularización en un segundo tiempo operatorio a efectuar entre los 2 y los 4 años de edad (Figura 2 y Tabla 1)(39-46). A pesar de esta secuencia de precocidad, en determinados niños persisten parámetros hemodinámicos inapropiados; por ello, cuando el nivel de riesgo deducido de una estratificación hemodinámica se considera moderado, es posible completar la anastomosis cavopulmonar si a su vez se efectúa una fenestración de “descarga”. Para niños con riesgo elevado, lo mejor es no continuar por el camino univentricular e intentar preservar la supervivencia con intervenciones paliativas o mediante trasplante cardiaco o cardiopulmonar según sea apropiado. En resumen, la combinación de una estrategia de precocidad operatoria y de selección rigurosa del candidato mejora los resultados inmediatos, si bien queda por ratificar que este protocolo expande la longevidad y la calidad de la vida de los supervivientes (esta perspectiva está aún en discusión). Expuesto de forma esquemática, dos o tres fases terapéuticas quirúrgicas pueden identificarse en las estrategias actuales según el modo de presentación clínica (Figuras 3 y 4). En la primera de ellas (fase A) se trata de balancear o regular de inmediato el flujo pulmonar implantando una fístula sistémico-pulmonar de tipo Blalock-Taussig modificada pequeña (conducto de GORE-TEX® de 3,5-4 mm) en neonatos o lactantes menores de 2-3 meses muy hipóxicos (saturación de oxígeno < 75-80%). No será preciso efectuar cirugía alguna en esta fase en aquellos niños con flujo naturalmente balanceado (saturación de oxígeno ≥ 75-80%). Entre los 3 y los 9 meses de edad se realizará el primer tiempo operatorio (fase B), ocluyendo en lo posible la fís384 28.Cazzaniga.indd 384 8/10/10 12:37:40 M. Cazzaniga, J.L. Vázquez VCS VCS Glenn bidireccional APD VCI APD API API Conducto extracardiaco AI AI VI VCS VI VCI APD API Túnel lateral intraatrial AI VI VCI Figura 2. Técnicas quirúrgicas actuales de univentricularización. AI: aurícula izquierda; APD: arteria pulmonar derecho; API: arteria pulmonar izquierda; VCI: vena cava inferior; VCS: vena cava superior; VI: ventrículo izquierdo. tula previamente implantada y/o al tiempo el propio tronco pulmonar proximal si está permeable; de forma concomitante, si fuera necesario, se corregirán las distorsiones o estenosis que pudieran estar presentes en las ramas pulmonares. Finalmente, entre los 2 y los 4 años se procede a completar el segundo tiempo (fase C) con la anastomosis de la vena cava inferior con la arteria pulmonar; durante el periodo de transición entre ambas intervenciones, el niño cursa un periodo relativamente corto con cianosis de escaso significado clínico. Entre tales etapas se recurrirá al cateterismo interven- Tabla 1. Estratificación de riesgo hemodinámico-angiográfica pre-2.º tiempo Bajo Medio Alto PMAP (mmHg) ≤ 15 15-19 ≥ 20 PTDVI (mmHg) ≤ 10 10-13 > 14 RVP (U/m2) <2 2-4 >4 FE (%) > 60 40-60 ≤ 40 Insuficiencia mitral No Moderada Severa Distorsiones en ramas pulmonares No Sí Discontinuas FE: fracción de eyección; PMAP: presión media de la arteria pulmonar; PTDVI: presión telediastólica ventricular izquierda; RVP: resistencias vasculares pulmonares 385 28.Cazzaniga.indd 385 8/10/10 12:37:41 Atresia tricúspide y corazón univentricular Flujo pulmonar Disminuido Balanceado Aumentado sin obstrucción sistémica PGE FASE A Estabilización Rashkind si procede Cerclaje Fístula S-P Cateterismo pre-Glenn bidireccional FASE B (1.er tiempo) Univentricularización parcial GLENN BIDIRECCIONAL 3-9 meses CATETERISMO PRE-CAVOPULMONAR TOTAL Intervencionsimo si procede FASE C ( 2.º tiempo) Univentricularización total 2-4 años RIESGO II RIESGO III RIESGO I CAVOPULMONAR CAVOPULMONAR FENESTRACIÓN NO CANDIDATO Fuera de protocolo Figura 3. Esquema de manejo terapéutico en relación con el flujo pulmonar. PGE: prostaglandinas; S-P: sistémico-pulmonar. cionista para solventar secuelas o residuos con impacto hemodinámico significativo. En niños rigurosamente seleccionados con óptima hemodinamia –natural o secundaria a la fase A– puede obviarse la etapa de Glenn bidireccional y decididamente efectuar directamente la anastomosis cavopulmonar total a los 2-3 años de edad, tal como se propone en algunos informes. Excepto en lo que concierne a la fase A, la misma secuencia descrita se aplica a neonatos o lactantes pequeños con atresia tricúspide y transposición de grandes arterias e hipertensión pulmonar. El cerclaje pulmonar será la primera intervención para regular el flujo y normalizar la presión en ambos pulmones. A partir de esta intervención el protocolo es igual al descrito en niños con hipoaflujo pulmonar, asociando la coartectomía según sea necesario. Sin embargo, esta población no es homogénea y el inicio de las decisiones quirúrgicas estará condicionado por la edad y la presencia actual o potencial de obstrucción sistémica (coartación y/o comunicación interventricular pequeña –“estenosis subaórtica”–). La dimensión de la comunicación es el sustrato de la obstrucción subaórtica y puede anticiparse con la medición ecocardiográfica del defecto. Puede ser inequívocamente restrictiva o reducir su tamaño como consecuencia de los cambios geométricos que induce la hemodinamia post-cerclaje sobre el ventrículo izquierdo: disminución drástica de la precarga y del tamaño cameral debido a la merma significativa del hiperaflujo pulmonar. En el primer caso, se evitará el cerclaje eligiendo una técnica que tendrá como objetivo sortear la obstrucción y asegurar 386 28.Cazzaniga.indd 386 8/10/10 12:37:42 M. Cazzaniga, J.L. Vázquez Flujo pulmonar aumentado con obstrucción sistémica Coartación aórtica y/o estenosis “subaórtica” PGE FASE 1 Estabilización Rashkind si procede Cerclaje y coartectomía J atene + cerclaje o Norwood o Álvarez-Stansel + fístula S-P Cateterismo Intervencionismo si procede FASE 2 (1. er tiempo) Univentricularización parcial Glenn bidireccional 3-6 meses Cateterismo Intervencionismo si procede FASE 3 (2.º tiempo) Univentricularización total 2-4 años RIESGO I CAVOPULMONAR RIESGO II CAVOPULMONAR FENESTRACIÓN RIESGO III NO CANDIDATO Fuera de protocolo Figura 4. Esquema de manejo terapéutico en presencia de obstrucción sistémica. PGE: prostaglandinas; S-P: sistémico-pulmonar. un flujo sistémico adecuado; de forma concomitante se procede a regular el flujo pulmonar con una fístula pequeña. Para aquel menester, se recurre a la actuación sobre las grandes arterias tomando como base el tamaño de la aorta: si es pequeña (≤ 3 mm) se prefiere el procedimiento de Norwood modificado; si es > 3 mm, se propone la técnica conocida como Damus-Kaye-Stansel-Álvarez Díaz; y si es normal, puede plantearse la transferencia arterial (operación de Jatene). Las dos primeras anastomosan la arteria pulmonar con la aorta, y la última reemplaza una estenosis subaórtica por una pulmonar postoperatoria. La técnica de Damus-Kaye-Stansel-Álvarez Díaz no sólo se plantea en el neonato, sino también en lactantes, con lo que tiene como ventaja añadida la posibilidad de realizarse concomitantemente con el Glenn bidireccional. La obstrucción subaórtica también se puede soslayar ampliando la comunicación, pero esta técnica induce bloqueo AV y, en todo caso, se reserva con preferencia para niños mayores. En resumen, los niños portadores de atresia tricúspide con transposición de grandes arterias tienen una anatomía ciertamente variable y compleja, que requiere técnicas quirúrgicas diversas, lo que añade riesgo operatorio. La mortalidad global es elevada en este singular subgrupo de niños y puede alcanzar hasta un 40%(47-51). No hay que olvidar que entre un 10 y un 30% de los neonatos con atresia tricúspide no logran encaminarse a la vía quirúrgica univentricular, ya por óbito neonatal inmediato o secundario a las intervenciones de la fase A, o incluso debido a las propias secuelas no deseadas de estas operaciones. La información actual destaca que, con el 387 28.Cazzaniga.indd 387 8/10/10 12:37:43 Atresia tricúspide y corazón univentricular protocolo de precocidad operatoria y una rigurosa selección del enfermo, la mortalidad inmediata del Glenn bidireccional se reduce a un 2-5%, y la del segundo tiempo disminuye drásticamente hasta valores por debajo del 5%. Asimismo, la comunidad científica espera que la longevidad del modelo univentricular sea más duradera, que la incidencia de complicaciones y/o reintervenciones disminuya y que la aptitud psicofísica del enfermo durante el seguimiento sea óptima. La supervivencia del sistema univentricular total a 30 años oscila entre el 50 y el 80% en distintas series, si bien en ellas se mezclan pacientes operados en diferentes periodos y con diversos protocolos o variantes técnicas. Las reintervenciones para solucionar secuelas o residuos quirúrgicos obstructivos con impacto hemodinámico no son infrecuentes y pueden alcanzar hasta un 40% de enfermos. El implante de marcapaso para tratar problemas eléctricos tampoco es excepcional. La fenestración deliberada y las comunicaciones residuales –“fugas”– en el túnel lateral intraatrial, o en la septación auricular que le es propia a la técnica atriopulmonar, serán debidamente ocluidas cuando se proceda mediante cateterismo intervencionista. La conversión de técnica atriopulmonar a cavopulmonar para optimizar la energía cinética del sistema univentricular y reducir el impacto eléctrico negativo de la atriomegalia crónica es una reintervención que en pacientes seleccionados tiene beneficios inmediatos debidamente demostrados(52-55). COMPLICACIONES El Glenn bidireccional es mayoritariamente bien tolerado, y las complicaciones son poco frecuentes; contrariamente, la operación modificada de Fontan y sus variantes no está exenta de aquéllas. Obedecen a los efectos derivados de la propia fisiología no pulsátil del principio de Fontan que se caracteriza por hipertensión venosa sistémica crónica, gasto cardiaco en límites inferiores y lenta velocidad circulatoria. La hipertensión venosa propia de esta modalidad circulatoria (hasta el doble o más de la presión considerada normal en corazones biventriculares) expone a los subsistemas linfático, vascular esplácnico, neurohumoral y endocrino a una función límite que se traduce en anormalidades de laboratorio y/o a través de manifestaciones clínicas definidas(56-58). En el postoperatorio inmediato del segundo tiempo operatorio, el derrame pleural es una constante ocasionalmente acompañada de derrame pericárdico; perdura entre 1 y 3 semanas y muy raramente más allá del mes; por ello, de rutina se utiliza dieta baja en grasas en los primeros meses posteriores a la operación. Pueden llegar a ser necesarias pericardiectomía y/o pleurodesis para paliar esta complicación(59-60). Durante el seguimiento, alrededor del 50% de los supervivientes presenta un aumento de las enzimas hepáticas propiciadas por la congestión crónica del hígado. Alrededor de un 10-15% de los enfermos tiene anormalidades de la concentración de albúmina hasta el extremo de desarrollar enteropatía pierdeproteína. Este dramático síndrome acontece en un 6-10% de los enfermos según diferentes estudios. Se admite que la determinación sistemática de δ-antitripsina en heces anticipa su aparición. Unos valores elevados conjuntamente con otros datos clínicos y de laboratorio ratifican el diagnóstico. Carece de terapéutica específica, aun cuando se han ensayado 388 28.Cazzaniga.indd 388 8/10/10 12:37:43 M. Cazzaniga, J.L. Vázquez diferentes tratamientos (heparina, corticoides, fenestración diferida); no obstante, es esencial corregir secuelas obstructivas si las hubiere, por lo que el cateterismo cardiaco diagnóstico y/o intervencionista ocupa un lugar preferente en el manejo del síndrome. Cuando las acciones terapéuticas no controlan el cuadro, la inevitable alternativa es el trasplante cardiaco(61-64). La deficiencia de los factores de coagulación y la propia hemodinamia univentricular explican los fenómenos tromboembólicos que pueden observarse hasta en un 25% de los supervivientes. Existe controversia al respecto, pero creemos necesaria la anticoagulación con dicumarínicos al menos durante el primer semestre del postoperatorio para continuar con antiagregantes en el seguimiento. Alrededor del 50-60% de los enfermos precisan tratamiento farmacológico, que se administrará según proceda durante las revisiones anuales periódicas (cardiotónicos, vasodilatadores, anticongestivos, antialdosterónicos o antiarrítmicos). Las taqui o bradiarritmias son frecuentes con la técnica atriopulmonar, apreciándose un incremento de las mismas cuanto mayor es el tiempo de seguimiento. En menor proporción, se presentan con la técnica del túnel intraatrial. Su incidencia aun parece menor en el conducto externo; no obstante, el paso del tiempo asignará a esta variable su verdadero peso clínico en cada una de las técnicas empleadas. Aún así, puede presentarse muerte súbita por arritmia reconocida previa o tromboembolismo(65-68). La clase funcional de los supervivientes es mayoritariamente buena. Algo más del 60% de los niños se sitúan en el grado I-II de la clasificación publicada por la New York Heart Association (NYHA). La estrategia de intervenciones tempranas mejora la capacidad aeróbica con el ejercicio durante el seguimiento; asimismo, no se detectan trastornos en el neurodesarrollo de estos enfermos, si bien se admite que la performance persiste por debajo de los límites alcanzados por la población normal. El embarazo es posible en mujeres con un excelente estado clínico postoperatorio, siempre bajo la supervisión de unidades obstétricas para alto riesgo. La información actual –reducida por cierto– confirma el éxito de la gestación y del parto en alrededor del 50% de los embarazos, pero a su vez ratifica que la mortalidad fetal, el crecimiento intrauterino retardado y la prematuridad no son infrecuentes. Todavía, aunque no está inequívocamente comprobado, parece aceptarse que el modelo circulatorio univentricular en humanos tiene vida limitada y que el trasplante cardiaco será la última estación para prolongar la vida en estos enfermos(69-77). CONTRIBUCIÓN DEL PEDIATRA La labor del pediatra es esencial para un óptimo seguimiento del niño con atresia tricúspide. El seguimiento se basa en el conocimiento de las necesidades del niño con cianosis crónica y de las complicaciones específicas de la cirugía de Fontan modificada. La cianosis condiciona una auténtica enfermedad multisistémica con repercusiones clínicas que el pediatra debe conocer. La hipoxia crónica condiciona eritrocitosis secundaria, que a su vez necesita una adecuada ingesta de hierro, sin aportes adecuados. Es frecuente la aparición de ferropenia, la cual empeora la hipoxia tisular al originar hematíes pequeños y poco deformables. La carencia de hierro se manifies389 28.Cazzaniga.indd 389 8/10/10 12:37:44 Atresia tricúspide y corazón univentricular ta por mialgias, debilidad muscular, cefalea, disminución de la capacidad para realizar ejercicio, disturbios visuales y parestesias, y debe ser tratada con ferroterapia (a dosis bajas, 1 mg/kg/día). La poliglobulia (secundaria a hipoxia) da lugar a un síndrome de hiperviscosidad que empeora la hipoxia y cuya sintomatología puede ser indistinguible y agravada por la presencia concomitante de ferropenia. En general, puede afirmarse que la clínica de este síndrome sólo ocurre con hematocrito del 70%. De especial importancia resulta evitar precozmente situaciones de deshidratación que conducirían a un agravamiento del síndrome de hiperviscosidad. Puede presentarse un aumento de la producción de bilirrubina no conjugada, lo que pude inducir cólicos biliares o colecistitis aguda; asimismo, la uricemia aumenta por incremento de la producción y disminución del aclaramiento. El retraso del crecimiento es más frecuente en estos niños que en cardiópatas no cianóticos, por lo que la ingesta calórica debería alcanzar los 150 kcal/kg/día. La alimentación debería suplementarse con hidratos de carbono y/o grasas de tipo triglicéridos de cadena media (MCT) cuando el volumen de la ingesta no permita alcanzar las calorías requeridas. En caso de dietas hiperosmolares, se ofrecerá agua entre las tomas para evitar la hiperviscosidad. Sólo se aconseja restricción de líquidos y sal cuando los niños están en situación de insuficiencia cardiaca. En el resto de las situaciones, se permite una ingesta moderada de sal, añadiéndose diuréticos en los casos necesarios. En el postoperatorio del Fontan y/o existencia de quilotórax, la ingesta de grasa deberá realizarse únicamente en forma de MCT. Se deberá evitar el deporte competitivo, pero no debe restringirse la educación física en el colegio. Los propios pacientes deberán establecer sus límites de tolerancia. Es aconsejable que practiquen ejercicios isotónicos y no isométricos y que eviten los deportes de contacto en el caso de que estén anticoagulados o de que sean portadores de marcapasos. Los niños deben seguir el calendario de vacunación normal, siendo muy aconsejable añadir la vacunación frente al neumococo, meningococo, virus sincitial respiratorio y varicela. Resulta muy útil administrar de forma profiláctica paracetamol para evitar la reacciones vacunales febriles. En el caso de pacientes con anticoagulación, se evitará la administración intramuscular de las vacunas. No se debe desaconsejar el viaje en avión, ya que, si bien la mayoría de los vuelos (6.000-8.000 pies de altitud) producen un descenso discreto de la presión parcial de oxígeno, es bien tolerado por el enfermo. La profilaxis antibacteriana será indicada según las pautas habituales. Asimismo, muchos niños reciben inotrópicos, diuréticos, inhibidores de la enzima de conversión de la angiotensina, anticoagulación con dicumarínicos o antiagregación con ácido acetilsalicílico, por lo que el pediatra deberá conocer los posibles efectos secundarios así como las interacciones farmacológicas de dichos fármacos. BIBLIOGRAFÍA 1. Freedom RM, Benson LN. Tricuspid atresia. En: Freedom RM, Benson LN, Smallhorn JF (eds.). Neonatal Heart Disease. Berlín: Springer-Verlag; 1992. p. 269-84. 2. Sade R, Fyfe D. Tricuspid atresia: current concepts in diagnosis and treatment. En: Gillette P (ed.). Congenital Heart Disease. The Pediatric Clinics of North America. WB Saunders Company; 1990. Volume 37. p. 151-69. 390 28.Cazzaniga.indd 390 8/10/10 12:37:45 M. Cazzaniga, J.L. Vázquez 3. Rosenthal A, Dick II Mc. Tricuspid atresia. 61 902-18. En: Emmanouilides G, Riemenscneider T, Allen H, Gutgesell H (eds.). Heart Disease in Infants, Children and Adolescents. Including the Fetus and Young Adult. Moss and Adams. 5th ed. Williams & Wilkins; 1995. Section III. Part D, Tricuspide valve abnormalities. 4. Anderson R, McCartney F, Shinebourne E, Tynan M (eds.). Tricuspid atresia. En: Pediatric Cardiology. Edinburgh: Churchill Livingstone; 1987. p. 675-97. 5. Kuhne M. Uber swei Falle Kongenitaler Atresia des ostium venosum dextrum. Jahrb Kinderheildd Physi Erziehung 1906; 63: 235-38. 6. Edwards JE, Burchell HB. Congenital tricuspid atresia: a classification. Med Clin North Am 1949; 33: 1117-9. 7. Rao RS. Demographic features of tricuspid atresia. En: Rao PS (ed.). Tricuspid Atresia. NY: Futura; Mount Kisco 1982; 13-24. 8. Vlad P. Tricuspid atresia. En: Keith JD, Rowe RD, Vlad P (eds.). Heart Disease in Infancy and Childhood. 3rd ed. New York: Macmilan; 1978. p. 518-41. 9. Fyler D, Buckley G, Hellenbrand W, Cohn H. Report of the New England Regional Infant Cardiac Care Program. Pediatrics 1980; 65: 376. 10. Hoffman JI. Congenital heart disease. En: Gillette P (guest ed.). Congenital Heart Disease. The Pediatric Clinics of North America. WB Saunders Company; 1990; 37. p. 25-43. 11. Hoffman JI. Incidence of conegenital heart disease: I Postnatal incidence. Pediatr Cardiol 1995; 16: 103-13. 12. Hoffman JI. Incidence of congenital heart disease. II Prenatal incidence. Pediatr Cardiol 1995; 16: 155-65. 13. Sharland G. Tricuspid valve abnormalities. En: Allan L, Hornberger L, Sharland G. Textbook of fetal cardiology. Greenwich Medical Media; 2000. Chapter 8a. p. 133-8. 14. Garne E and the Eurocat Working Group. Prenatal diagnosis of six major cardiac malformations in Europe: a population based study. Acta Obstet Gynecol Scand 2001; 80: 224-28. 15. Orie JD, Anderson C, Ettedgui JA, Zuberbuhler JR, Anderson RH. Echocardiographic-morphological correlations in tricuspid atresia. Am J Cardiol 1995; 26: 750-58. 16. Bridges N, Lock JE, Castaneda A. Baflle fenestration with subsequent transcatheter colsure: modification fo the Fontan operation for patients at increased risk. Circulation 1990; 82: 1681-9. 17. Betts T, Roberts P, Allen S, et al. Elcetrophyiological mapping and ablation of intra-atrail reentry tachyicardia after Fontan surgery with the use of a noncontact mapping system. Circulation 2000; 102: 419-25. 18. Hausdorf G, Schneider M, Konertz W. Surgical preconditioning and completion of total cavopulmonary connection by interventional cardiac catheterisation: a new concept. Heart 1996; 75: 403-9. 19. Chung T. Assessment of cardiovascular anatomy in patients with congenital heart disease by magnetic resonance imaging. Pediatr Cardiol 2000; 21: 18-26. 20. Cazzaniga M, Paz Núñez B, Castro Beiras JM. Aplicación clínica de la cardiología nuclear en el ámbito de la cardiología pediátrica. En: Castro Beiras JM (ed.). Cardiología Nuclear y Otras Técnicas no Invasivas de Imagen en Cardiología. Madrid: Meditécnica; 2005. Cap 42. p. 559-65. 21. Scott D, Rigby M, Miller G, Shinebourne E. The presentation of symptomatic heart disease in infancy based on 10 years experience (1973-1982). Implications for the provision of services. Br Heart J 1984; 52:248-57. 391 28.Cazzaniga.indd 391 8/10/10 12:37:46 Atresia tricúspide y corazón univentricular 22. Cazzaniga M. Cardiopatías congénitas más frecuentes en el neonato. En: Sola A, Rogido M (eds.). Cuidados especiales del feto y el recién nacido. Buenos Aires: Científica Americana; 2001. Vol II. Cap. 4. p. 1274-314. 23. Sanchez Quintana D, Climent V, Ho SY, Anderson R. Myoarchitecture and connective tissue in hearts with tricuspid atresia. Heart 1999; 81: 182-91. 24. Glenn WWL. Circulatory bypass of the right side of the heart New Engl J med 1958; 259: 117-20. 25. Hurwitt ES, Young D, Escher DJ. The rational anastomosis of the right auricular appendage to the pulmonary artery in tricuspid atresia J Thorac Cardiovasc 1955; 30: 503-8. 26. Warden HE, DeVall RA, Varco RL. Use the right auricle as a pump for the pulmonary circuit. Surg Forum 1954; 5: 16-21. 27. Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax 1971; 26: 240-8. 28. Kreutzer G, Galindez E, Bono H et al. An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg 1973; 66: 613-21. 29. Bjork VO, Olin C, Bjarke BB, Thoren C. Right-atrial-right ventricular anastomosis for correction tricuspid atresia. J Thorac Cardiovasc Surg 1979; 66: 613-21. 30. Choussat A, Fontan F, Besse P, et al. Selection criteria for Fontan’s procedure. En: Anderson RH, Shinebourne EA (eds.). Pediatric Cardiology. Edinburgh: Churchill Livingstone; 1978. p. 559-66. 31. Mayer J, Helgason H, Jonas R, et al. Extending the limits for modified Fontan procedures. J Thorac Cardiovasc Surg 1986; 92: 1021-8. 32. de Leval M, Kilner Ph, Gewillig M, et al. Total cavopulmonary conecction: a logical alternative to atriopulmonary connection for complex Fontran operations. J Thorac Cardiovasc Surg 1988; 96: 682-95. 33. Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonaryextracradiac conduit: a new form of right ventricular by-pass. J Thorac Cardiovasc Surg 1990; 100: 228-32. 34. Burke R, Jacobs J, Ashraf M, et al. Extracardiac Fontan operation without cardiopulmonary bypass. Ann Thorac Surg 1997; 63: 1175-7. 35. Amodeo A, Galleti L, Marianeschi S, et al. Extracardiac Fontan operation for complex cardiac anomalies: seven years’ experience. J Thorac Cardiovasc Surg 1997; 114: 1020-30. 36. Bridges N. Effect of baflle fenestration on outcome of the modiefied Fontan operation. Circulation 1992; 86: 1762-9. 37. Jacobs M, Norwood W. Fontan operation: influence of modifications on morbidity and mortality. Ann Thorac Surg 1994; 58: 945-51. 38. Jonas R, Castaneda A. Modified Fontan procedure: atrial baffle and systemic venous to pulmonary artery anastomotic techniques. J Cardiovasc Surg 1988; 3: 91-6. 39. Bridges N, Jonas R, Mayer R, et al. Bidirectional cavopulmonary anastomosisas interim palliation for high risk Fontan candidates. Circulation 1990; 82: 1681-9. 40. Norwood W, Jacobs M. Fontan’s operation in two stages. Am J Surg 1993; 166: 548-51. 41. Reddy VM, McElhinney DB, Moore P, et al. Outcomes after bidirectional cavopulmonary shunt in infants less than 6 months old. J Am Coll Cardiol 1997; 29: 1365-70. 42. Fernandez Pineda L, Cazzaniga M, Villagrá F, et al. La operación de Glenn bidireccional en 100 casos con cardiopatías congénitas complejas. Factores del determinante del resultado quirúrgico. Rev Esp Cardiol 2001; 54: 1061-74. 392 28.Cazzaniga.indd 392 8/10/10 12:37:47 M. Cazzaniga, J.L. Vázquez 43. Petrossian E, Reddy V, McElhinney D, et al. Early results of the extracardiac conduit Fontan operation. J Thorac Cardiovasc Surg 1999; 117: 688-96. 44. Cazzaniga M, Fernandez Pineda L, Villagrá F, et al. Operación modificada de Fontan o variantes efectuadas en un solo tiempo quirúrgico. Determinantes de mortalidad. Rev Esp Cardiol 2002; 55: 391-412. 45. Kirklin JW, Barrat-Boyes BG. Tricuspid atresia and the Fontan operation. En: Cardiac Surgery. 2nd ed. London: Churchill Livingstone; 199. p.; 1055-104. 46. Maroto Monedero C, Camino Lopez M, Girona JM, Malo Concepción P. Guías de práctica clínica de la Sociedad Española de Cardiología en las cardiopatías congénitas del recién nacido. Rev Esp Cardiol 2001; 54: 49-66. 47. Jenson R, Williams R, Laks H, et al. Usefulness of banding of the pulmonary trunk with single ventricle physiology at risk for subaortic obstruction. Am J Cardiol 1996; 77: 1089-93. 48. Mosca RS, Hennein H, Kulik T, et al. Modified Norwood operation for single left ventricle and ventriculoarterial discordance: an improved surgical technique. Ann Thorac Surg 1997; 64: 1126-32. 49. Caffarena JM Jr, Gómez Ullate JM. Corazón univentricular con estenosis subaórtica. Paliación en el recién nacido. Cir Cardiov 1997; 4: 48-55. 50. Lan Y, Chang R, Laks H. Outcome of patients with double-inlet left ventricle or tircuspid atresia with transposed greart arteries. JACC 2004; 43: 113-9. 51. Alvarez Díaz F, Hurtado E, Perez de León J, et al. Técnica de corrección anatómica de la transposición compleja de grandes arterias. Rev Esp Cardiol 1975; 28: 255-7. 52. Mair D, Puga F, Danielson G. The Fontan procdedure for tricuspid atresia: early and late results of a 25-year experience with 216 patients. JACC 2001; 37: 933-9. 53. Sittiwangkul R, Azakie A, Van Ardsell G, et al. Outcomes of tricuspid atresia in the Fontan era. Ann Thorac Surg 2004; 77: 889-94. 54. Kaulitz R, Ziemer G, Paul Th, et al. Fontan-type procedures: residual lesions and late interventions. Ann Thorac Surg 2002; 74: 778-85. 55. Marcelletti C, Hanley F, Mavroudis C, et al. Revision of previous Fontan connections to total extracardiac cavopulmonary anastomosis: a multicenter experience. J Thorac Cardiovasc Surg 2000; 199: 340-6. 56. Bull K. The Fontan procedure: lessons from the past. Heart 1998; 79: 213-4. 57. Quero Jiménez M, Maitre Azcárate MJ, Brito Perez J, et al. Anastomosis cavo-atriopulmonar. Rev Esp Cardiol 1993; 46: 101-17. 58. Hsia TY, Khambadkone S, Deanfield J, et al. Subdiaphragmatic venous hemodynamics in the Fontan circulation. J Thorac Cardiovasc Surg 2001; 121: 436-47. 59. Durairaj M, Sharma R, Choudary SK, et al. Diaphragmatic fenestration for resistent pleural effusions after univentricular repair. Ann Thorac Surg 2002; 74: 931-2. 60. Torres Borrego J, Martínez Gil N, Perez Ruiz J, et al. Pleurodesis con tetraciclina post operación de Fontan. Ann Esp Pediatr 2001; 55: 76-9. 61. Maertens L, Hagler D, Sauer U, et al. Proteing-losing enteropathy after the Fontan operation: an international multicenter study. PLE study group. J Thorac Cardiovasc Surg 1998; 115: 1063-73. 62. Rodriguez M, Cazzaniga M, Camarero C, et al. Enteropatía pierde proteínas como complicación de la cirugía modificada de Fontan y sus variantes. I Congreso Nacional de Cardiología Pediátrica 2003; Poster CP-61: 79. 393 28.Cazzaniga.indd 393 8/10/10 12:37:48 Atresia tricúspide y corazón univentricular 63. Bendayán I, Casaldáliga J, Castelló F, et al. Heparin thetrapy and reversal of protein losing enteropathy in a case with congenital heart disease. Pediatr Cardiol 2000; 21: 267-8. 64. Thorne SA, Hooper J, Kemp M, Somerville J. Gastro-intestinal protein loss in late survivors of Fontan surgery and other congenital heart disease. Eur Heart J 1998; 19: 514-20. 65. Van Nieuwenhuizen R, Peteres M, Lubbers L, et al. Abnormalities in liver function and coagulation profile following the Fontan procedure. Heart 1999; 82: 40-6. 66. Odegard K, McGowan F, Zurakowski D, et al. Procoagulant and anticoagulant factor abnormalities following the Fontan procedure: increased factor VIII may predispose to thrombosis. J Thorac Cardiovasc Surg 2003; 125: 1260-7. 67. Kaulitz R, Ziemer G, Bergmann F, et al. Atrial thrombus after the Fontan-operation. Predisposing factors, treatment and prophylaxis. Cardiol Young 1997; 7: 37-43. 68. Durongpisitkul K, Porter C, Cetta F, et al. Predictors of early and late-onset supraventricular tachyarrhythmias after Fontan operation. Circulation 1998; 98: 1099-107. 69. Cannobio MM, Mair D, van del Velde M, Koos B. Pregnancy outcomes after Fontan repair. J Am Coll Cardiol 1996; 28: 1126-32. 70. Gentles T, Mayer JE Jr, Gauvreau K, et al. Fontan operation in five hundred consecutive patients. Factors influencing early and late outcome. J Thorac Cardiovasc Surg 1997; 30: 1032-38. 71. Troutman W, Barstow T, Galindo A, Cooper D. Abnormal dynamic cardiorespiratory responses to excercise in pediatric patients after Fontan procedure J Am Coll Cardiol 1998; 31: 668-73. 72. Forbess J, Visconti K, Bellinger D, Jonas R. Neurodevelopmental outcomes in children after de Fontan operation. Circulation 2001; 104: I-127-32. 73. Azakie A, McCrindle B, Ardsell GV, et al. Extracardiac conduit versus lateral tunnel cavopulmonary anastomosis connections at a single institution: impact and outcomes J Thorac Cardiovasc Surg 2001; 122: 1219-28. 74. Freedom R, Hamilton R, Yoo Shi-J, et al. The Fontan procedure:analysis of cohorts and late complications. Cardiol Young 2000; 10: 307-33. 75. Heh Th, Williams W, McCrindle B, et al. Equivalent survival following cavopulmonary anastomosis shunt: with or without procedure. Eur J Cardiothorac Surg 1999; 16: 111-6. 76. Stamm C, Friehs I, Mayer JE, et al. Long-term results of the lateral tunnel opration. J Thorac Cardiovasc Surg 2001; 121: 28-41. 77. Cohen M, Bush D, Ferry RJ, et al. Somatic growth failure after then Fontan operation. Cardiol Young 2000; 10: 438-9. 394 28.Cazzaniga.indd 394 8/10/10 12:37:50 El corazón univentricular Mario Cazzaniga Servicio de Cardiología Pediátrica. Hospital Universitario Ramón y Cajal. Madrid ANATOMÍA UNIVENTRICULAR Los vocablos “corazón univentricular” o “ventrículo único” se utilizan indistintamente ante un grupo de malformaciones cardiacas congénitas complejas que se caracterizan por la presencia de un único ventrículo útil para sustentar la fisiología circulatoria –sea ésta cámara anatómica y/o genuinamente única, o sólo funcionalmente única–. Es necesario realizar una descripción detallada segmentaria del corazón para comprender la variedad anatómica subyacente(1-3). Independientemente del situs viscero-atrial (habitual –usual–, invertido –imagen en espejo de lo usual–, o ambiguo/indeterminado –ambas aurículas tienen la misma morfología–) y la posición del corazón en el tórax (levo, meso o dextrocardia) que pudieran acompañar a estos complejos defectos, es en la modalidad de la conexión aurículo-ventricular (AV) (cómo se relacionan las aurículas con los ventrículos) donde se define el criterio del problema anatómico. La unión AV puede contener una conexión con dos ventrículos (conexión AV biventricular) o, por el contrario, sólo con uno (conexión AV univentricular). Es posible admitir con fines didácticos que entre ambas existen formas intermedias. En la condición biventricular se dan dos posibilidades de orientación orificial en el espacio: 1. Orificios AV paralelos conectando separadamente con cada ventrículo –la normalidad es uno de los ejemplos–. 2. Orificios AV cruzados (“criss-cross” –“corazón en dos pisos”). Las formas intermedias estarían representadas por el desplazamiento lateral de uno de los anillos valvulares, de manera que el orificio “desplazado” conecta en parte con el ventrículo opuesto –cabalgamiento–, incluso ancla en el mismo su aparato subvalvular –straddling–. Cuando existen orificios cruzados o formas intermedias, es inherente una amplia comunicación interventricular “de entrada” para que sean posibles. En el cabalgamiento y/o straddling es habitual que la cámara ventricular que deja de recibir toda la circunferencia orificial sea pequeña, hipoplásica o incompleta (volumen diastólico ≤ 75%) y “poco útil” para su función de bomba. Corazones con conexión AV cruzada y una importante proporción de formas intermedias no tienen opción quirúrgica biventricular. 395 28.Cazzaniga.indd 395 8/10/10 12:37:50 Atresia tricúspide y corazón univentricular A partir de la categorización inicial, se identifican las siguientes modalidades de conexión AV: 1. Concordante: cada aurícula conecta con el ventrículo que le corresponde. Representa la normalidad. 2. Discordante: cada aurícula conecta con el ventrículo opuesto –transposición anatómicamente corregida de grandes arterias (L-TGA) o discordancia AV aislada–. 3. Ambigua o indeterminada: las dos aurículas son de la misma morfología –isomerismo derecho o izquierdo–, pero conectan a dos ventrículos diferenciados. 4. Doble entrada: las dos aurículas conectan a una sola cámara ventricular dominante o principal (doble entrada izquierda cuando la dominante es de morfología izquierda, o doble entrada derecha cuando ocurre lo opuesto). 5. Entrada única: contiene dos subtipos: a) Una aurícula no se relaciona con el miocardio ventricular (un orificio está permeable normal y el otro imperforado, ausente o atrético: “atresia tricúspide” o “mitral”), o b) Las dos aurículas (diferenciadas o isoméricas) conectan a través de un orificio único –una sola válvula AV– a un ventrículo anatómicamente indiferenciado y solitario (verdadero ventrículo único) o a dos ventrículos de similar o diferente tamaño (defecto atrioventricular –balanceado o disbalanceado–). La corrección quirúrgica biventricular no es posible en la doble entrada, en la atresia de válvula AV derecha o izquierda, ni en buena parte de las malformaciones con entrada única no balanceada. En la modalidad de doble entrada existen en realidad dos ventrículos en la masa miocárdica: el principal o dominante, y uno rudimentario hipoplásico e incompleto (configurado con ausencia de su porción de entrada –bipartito–). Tal rudimento se sitúa superior en la doble entrada izquierda (se trata entonces de un ventrículo derecho [VD]) o inferior en la doble entrada derecha (se trata de un ventrículo izquierdo [VI]). Acompañando a la descripción segmentaria realizada, las grandes arterias pueden emerger concordantes o discordantes, o estar ambas conectadas con la misma cámara dominante principal. Al tiempo, pueden presentar estenosis de grado variable o atresia valvular. Un problema médico-quirúrgico acontece cuando es la aorta y/o su unión ventrículo-arterial la estructura afectada (hipoplasia “anular”, estenosis subvalvular o valvular y/o coartación aórtica)(4). Existen además otras malformaciones que, aun teniendo conexión AV biventricular, tampoco son susceptibles de corrección a dos ventrículos: • Enfermedad de Ebstein severa • Hipoplasia aislada de VD • Atresia pulmonar con tabique interventricular íntegro y extrema hipoplasia de VD • Variantes complejas de TGA o doble salida ventricular derecha • Síndrome del corazón izquierdo hipoplásico (coexisten atresia o severa estenosis de las válvulas mitral y/o aórtica y un VI anatómico y funcionalmente inútil). De todo lo comentado se deduce que la reparación paliativa –no curativa– a un solo ventrículo o a un ventrículo y medio es la única cirugía convencional posible para 396 28.Cazzaniga.indd 396 8/10/10 12:37:51 M. Cazzaniga Tabla 1. Cardiopatías congénitas no susceptibles de corrección biventricular Paliación a un ventrículo • Doble entrada izquierda • Doble entrada derecha • Entrada AV única: – Atresia tricúspide – Atresia mitral – Defecto AV disbalanceado – VU indeterminado • Criss-cross-straddling-cabalgamiento • Síndrome de hipoplasia de cavidades izquierdas Paliación a un ventrículo o 1 ½ • Variantes de: – Enfermedad de Ebstein – Transposición/Doble salida de grandes arterias: - CIV - Straddling-cabalgamiento - Hipoplasia ventricular (volumen ≤ 75%) – Atresia pulmonar con septo íntegro y VD hipoplásico – Hipoplasia aislada de VD AV: aurículo-ventricular; CIV: comunicación interventricular; VD: ventrículo derecho; VU: ventrículo único estos defectos, excluyendo, claro está, el trasplante cardiaco, operación no convencional con solución biventricular. En la Tabla 1 se reflejan las cardiopatías congénitas no susceptibles de corrección quirúrgica convencional a dos ventrículos. Cabe comentar que, en general, el diagnóstico morfológico detallado ha sido bien definido en la infancia mediante ecocardiografía Doppler color u otros métodos de imagen. ACTUACIONES QUIRÚRGICAS POSIBLES La supervivencia del “corazón univentricular” no operado –“historia natural”– es muy reducida en la vida adulta (mortalidad del 5% anual). Los pocos enfermos que alcanzan esta etapa de la vida (alrededor de 40-50 años) presentan uno o más de los siguientes problemas clínicos: cianosis crónica, hipertensión arterial pulmonar, disfunción ventricular, arritmia e incapacidad funcional manifiesta. Dos conceptos condicionan la diversidad de las manifestaciones clínicas postoperatorias: a) la evolución que han seguido estas técnicas desde su incorporación inicial, y b) los cambios estratégicos en la cronología operatoria; configurado ello con el único objetivo de reducir la morbimortalidad y optimizar el modelo circulatorio final resultante(5-9). La exclusión del VD de la circulación pulmonar –“bypass de VD”– es compatible con la vida. Ésta es la base en la que se asientan estas operaciones. El prototipo de cardiopatía inicialmente elegida para aplicar las diferentes técnicas operatorias ha sido la clásica atresia tricúspide, si bien muy pronto se extendió a las malformaciones expuestas(10-12). 397 28.Cazzaniga.indd 397 8/10/10 12:37:52 Atresia tricúspide y corazón univentricular Historia de la cirugía univentricular A finales de los años cuarenta, se utilizaron diferentes tipos de anastomosis sistémicopulmonar (fístula) en pacientes con ventrículo único y estenosis pulmonar para paliar la cianosis: • Blalock-Taussig: – Clásica: entre la subclavia y la rama de la arteria pulmonar (AP), o – Modificada: implante de un conducto protésico entre aquéllas. • Waterston-Cooley: entre la aorta ascendente y la arteria pulmonar derecha (APD). • Potts: entre la aorta torácica descendente y la arteria pulmonar izquierda (API). • Anastomosis tronco-tronco. Con el tiempo se constató que no eran infrecuentes las complicaciones: distorsiones y estenosis de la AP secundarias a la fístula, hipertensión pulmonar y sobrecarga de volumen del ventrículo dominante (la utilización de fístulas pequeñas implantadas durante corto periodo de tiempo reduce estas complicaciones). La incidencia de estenosis pulmonar asociada predomina en estas malformaciones, pero existen enfermos que no tienen protección pulmonar (ausencia de estenosis), por lo que precisan del cerclaje pulmonar (banding) para controlar un flujo pulmonar excesivo, normalizar la presión pulmonar y reducir la precarga ventricular(13,14). El bypass parcial del VD En 1958 Glenn incorpora la anastomosis entre la vena cava superior (VCS) y la APD –inicialmente término-terminal– separando el origen de esta rama del tronco pulmonar, de modo que el flujo venoso superior accede sólo al lecho del pulmón derecho (“bypass parcial” del VD –Glenn clásico unidireccional no pulsátil–). La rama izquierda mantiene su relación con el corazón, de modo que el pulmón izquierdo recibe flujo pulsátil. Esta técnica fue muy útil para paliar la cianosis, por cuanto la permeabilidad de la anastomosis durante largos años está suficientemente contrastada. La aparición a medio-largo plazo de fístulas arteriovenosas pulmonares supuso su desaparición transitoria. Años más tarde se rescata del arsenal terapéutico con una modificación –anastomosis término-lateral (Glenn bidireccional)–, de manera que el flujo de la VCS (representa alrededor del 30-40% del volumen circulatorio total en el adolescente y el adulto) se distribuye simultáneamente en ambas ramas pulmonares. Una variante recientemente incorporada consta de un parche que ocluye la entrada de la VCS en la aurícula derecha (AD) al tiempo que se realiza la anastomosis laterolateral de aquélla con la rama pulmonar derecha (hemi-Fontan). El Glenn bidireccional o el hemi-Fontan pueden efectuarse dejando permeable la vía de salida pulmonar –natural o cerclada– y/o una fístula previamente implantada (Glenn con flujo pulsátil) o, por el contrario, anulando en la misma operación toda otra fuente de flujo adicional al pulmón (Glenn no pulsátil). Esta última es la estrategia más utilizada en la actualidad, aun cuando la evidencia actual es discordante en este punto(15-19). 398 28.Cazzaniga.indd 398 8/10/10 12:37:53 M. Cazzaniga El bypass total del VD La operación original de Fontan –anastomosis atriopulmonar– aparece alrededor de los años setenta y se aplicó inicialmente a enfermos con atresia tricúspide y Glenn clásico. Consistía en el cierre de la comunicación interauricular y del tronco de la AP, y anastomosis entre la AD y la AP distal implantando dos conductos valvulados a la entrada y salida de la AD, de manera que todo el flujo venoso sistémico accedía al pulmón sin impulso ventricular. Sin embargo, debido a problemas tromboembólicos, esta versión original fue suplantada de inmediato por una conexión directa entre la AD y la AP sin interposición de dispositivos mecánicos y sin Glenn previo. Kreutzer introduce una modificación efectuando la anastomosis entre la orejuela derecha y el tronco pulmonar distal una vez separado del segmento proximal. El concepto hemodinámico que sustentó estas operaciones se basaba en la presunta eficacia de la contracción atrial como bomba pulsátil para que la circulación sanguínea pudiera fluir por el lecho pulmonar. Este argumento se ha demostrado erróneo, ya que con el tiempo la AD desarrolla una atriomegalia severa que promueve al arritmia auricular y favorece un remanso circulatorio ineficaz. Por ello, la anastomosis atriopulmonar ya no se utiliza, quedando, eso sí, los supervivientes, que requieren una estrecha evaluación(20,21). A finales de los ochenta, De Leval incorpora la anastomosis bicavopulmonar (ambas cavas se conectan con la AP), basado en un concepto hemodinámico diferente: la energía cinética hidráulica o el flujo venoso pasivo que circula en una estructura tubular es superior a la que puede ofrecer una aurícula dilatada. Se trata de una técnica conjunta que en un solo estadio operatorio combina el Glenn bidireccional y la anastomosis entre la vena cava inferior (VCI) con la APD proximal mediante una tunelización por dentro de la aurícula derecha (túnel lateral). La pared de este túnel se construye entonces en parte por material protésico (hemiconducto) y en parte por el propio miocardio atrial. La hemodinamia es más ventajosa que la que aporta la anastomosis atriopulmonar, pero, debido a las frecuentes arritmias atriales, se propuso como alternativa un conducto intraauricular protésico completo(22,23). En los años noventa, Marcelletti explora la cirugía “por fuera del corazón”: Glenn bidireccional e implante de un conducto protésico extracardiaco desde la VCI a la APD. Los beneficios de esta estrategia combinada son: 1. No precisa ninguna línea de sutura en la pared atrial, sino sólo en el cierre de la unión VCI-AD. 2. El miocardio auricular derecho no sufre aumento de la presión venosa. Todo ello en favor de disminuir la incidencia de arritmias. Asimismo, se van imponiendo dos estrategias operatorias para una adaptación más pausada de los cambios volumétricos que sobre el corazón condiciona el modelo circulatorio final: a) Efectuar la univentricularización total en dos tiempos operatorios diferenciados (Glenn bidireccional, primer tiempo, con el implante posterior del conducto externo o túnel lateral, segundo tiempo). b) Reducir la edad de los dos tiempos quirúrgicos (el primer tiempo a los 4-6 meses, y el segundo tiempo, alrededor de los 2 años). 399 28.Cazzaniga.indd 399 8/10/10 12:37:54 Atresia tricúspide y corazón univentricular Todas estas técnicas (“operación de Fontan modificada”) conllevan la anulación concomitante de cualquier otra fuente pulsátil de flujo pulmonar. A la fisiología que se obtiene se la conoce como “principio de Fontan”(24-27). También en los años noventa se han explorado otras iniciativas operatorias no menos importantes para reducir la morbimortalidad inmediata. Entre ellas se cuentan: evitar o reducir el tiempo de la circulación extracorpórea (CEC), realizar una fenestración regulada y utilizar la hemo/ultrafiltración para neutralizar el efecto inflamatorio precoz y deletéreo de la CEC. La aplicación de la fenestración es la innovación de mayor impacto en la evolución inmediata de la cirugía bicavopulmonar. Se construye creando un orificio pequeño (de unos 4 mm) en el túnel lateral –es más fácil de realizar en el conducto intraauricular que en el extracardiaco– que, al permitir el desvío de una parte del volumen circulatorio venoso hacia la aurícula izquierda (AI), reduce la presión venosa y mejora el gasto cardiaco. Como contrapartida, el enfermo soporta una leve cianosis. La fenestración se puede ocluir en diferido mediante intervención con catéter, aunque con cierta frecuencia se cierra espontáneamente(28-32). La denominada cirugía 1 ½ ventricular Existen otras estrategias operatorias aplicadas a determinadas malformaciones –usualmente con un VD funcional o anatómicamente insuficiente (hipoplasia aislada de VD, enfermedad de Ebstein), que combinan Glenn bidireccional y el cierre de la comunicación interauricular –usual en estos casos–, de tal modo que la circulación derecha e izquierda quedan definitivamente separadas. El flujo de la VCS avanza directamente hacia el lecho pulmonar por el Glenn, y el de la VCI lo hace a través de la cámara ventricular. Con ello se reduce la precarga del pequeño VD y se logra una funcionalidad de bomba más adaptada al tamaño ventricular. Este enfoque terapéutico se conoce como corrección 1 ½ ventricular. Este mismo concepto de reparación quirúrgica se emplea también en variantes de transposición o doble salida de grandes arterias que admiten una corrección quirúrgica biventricular pero asociando Glenn bidireccional(33-35). Otras técnicas desarrolladas Con la idea que un VD hipoplásico podría crecer en su tamaño si se aumenta el flujo en su entrada. Bowman y Börjk introdujeron técnicas que anastomosaban la AD con el VD interponiendo un conducto protésico o construido artesanalmente con pericardio. Los resultados fueron desalentadores y ya no se utilizan dichas técnicas. En pacientes con continuidad cava inferior-ácigos-cava superior derecha con frecuencia asociada a heterotaxia y persistencia de cava superior izquierda, Kawashima introdujo el doble Glenn sin interrumpir la continuidad de las ramas pulmonares; al tiempo dejaba las venas hepáticas conectadas a la aurícula –implantadas en su sitio natural–, de manera que el flujo hepático es el único que no accede al circuito pulmonar(36-38). Los neonatos con síndrome del corazón izquierdo hipoplásico requieren de inicio una técnica operatoria especial –Norwood– que, con las modificaciones más recien400 28.Cazzaniga.indd 400 8/10/10 12:37:55 M. Cazzaniga VCS VCS VCS AP AP AP AD AD Glenn clásico Glenn bidireccional VCS Hemi-Fontan VCS VCS AP AD AD Atriopulmonar Fontan-Kreutzer AP AD Bicavopulmonar Túnel lateral fenestrado AP Bicavopulmonar Conducto externo VCS VCS VCS AP AP AD 1 VCS Ao AD VU VD ventricular Álvarez-DKS Glenn bidireccional VH Continuación VCI-ácigos Kawashima-“tricavopulmonar” Figura 1. Diagramas que ilustran las diferentes técnicas quirúrgicas para paliación univentricular o 1 ½ ventricular. AD: aurícula derecha; Ao: aorta; AP: arteria pulmonar; DKS: Damus-Kaye-Stansel; VCI: vena cava inferior; VCS: vena cava superior; VH: venas hepáticas; VU: ventrículo único. tes, consiste en: anastomosis de aorta (siempre hipoplásica y con diámetro ≤ 4-5 mm) con AP proximal para obtener una salida única y sistémica para el VD, al tiempo que se cierra totalmente el segmento distal del tronco pulmonar y se implanta un conducto pequeño entre el VD y la APD o la API para crear una vía de flujo indispensable hacia el lecho pulmonar (Sano)(39,40). Otras formas de corazón univentricular, como la atresia tricúspide con TGA y la estenosis severa subaórtica, precisan de inicio corregir un flujo sistémico disminuido. Se recurre entonces al switch arterial (Jatene) con transferencia coronaria (la AP queda ahora relacionada con la obstrucción), a la anastomosis de la AP proximal con aorta (Álvarez, Damus-Kaye-Stansel) o, con menor frecuencia, se amplía la comunicación interventricular desde la aorta o por ventriculotomía. En la Figura 1 se muestran las técnicas operatorias más frecuentes(41-45). FISIOLOGÍA POSTOPERATORIA La fisiología resultante del modelo circulatorio univentricular total se refleja en la Figura 2, en la que se compara con el biventricular normal (los dibujos están modificados a partir de la publicación de Bull)(46). 401 28.Cazzaniga.indd 401 8/10/10 12:37:56 Atresia tricúspide y corazón univentricular Modelo circulatorio biventricular Ao Modelo circulatorio univentricular RVS Ao AP RVP VI AD VD RVS VI AI AD VI AP RVP AI VI Figura 2. Diagrama que ilustra los modelos circulatorios uni y biventricular. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; AP: arteria pulmonar; RVP: resistencia vascular pulmonar; RVS: resistencia vascular sistémica; VD: ventrículo derecho; VI: ventrículo izquierdo. Fuente: modificado de K. Bull(46). El sistema circulatorio biventricular normal consiste en un doble circuito vascular –pulmonar y sistémico– conectado en serie, a través del cual la sangre impulsada por dos cámaras ventriculares diferenciadas –bien desarrolladas y con potencia contráctil suficiente– satisface las necesidades metabólicas del organismo en reposo y en esfuerzo. En el modelo univentricular, el flujo de las venas sistémicas accede a las AP sin impulso ventricular. Se trata, por tanto, de un flujo pasivo, lento y laminar, si bien se consigue una energía cinética óptima con la técnica bicavopulmonar. Criterios de riesgo y selección de candidatos para la cirugía de Fontan Para seleccionar los mejores candidatos, Choussat propuso en 1987 un decálogo de factores de riesgo deducidos de los resultados observados con la técnica atriopulmonar; tras unos años de experiencia con la bicavopulmonar fueron reevaluados y se concluyó que algunos estaban obsoletos y otros debían modificarse. Desde entonces se consideran indispensables los siguientes requerimientos cardiopulmonares: función sistólica (fracción de eyección ≥ 60%) y diastólica ventricular normal (presión de fin de diástole ventricular ≤ 10 mmHg), ausencia de estenosis y/ o insuficiencia valvular AV, ausencia de obstrucción subaórtica y/o desmesurada hipertrofia parietal, presión media en AP ≤ 17-18 mmHg, buen tamaño (valor Z 402 28.Cazzaniga.indd 402 8/10/10 12:37:57 M. Cazzaniga Tabla 2. Requerimientos cardiopulmonares para indicar cirugía univentricular • Función ventricular normal (FE ≥ 60%) • Presión ventricular diastólica final normal (≤ 10 mmHg) • Presión media de la arteria pulm+onar ≤ 17-18 mmHg • Resistencia arteriolar pulmonar < 2 U/m2 • Ausencia de estenosis y/o insuficiencia valvular AV significativa • Ausencia de obstrucción subaórtica y/o hipertrofia parietal significativa • Ausencia de distorsión – estenosis de arterias pulmonares • Arterias pulmonares de buen calibre (valor Z < 2,5) • Ausencia de obstrucción de las venas pulmonares AV: aurículo-ventricular; FE: fracción de eyección < –2,5) y a la vez ausencia de distorsión de ramas pulmonares, resistencia arteriolar pulmonar normal (< 2 U/m2), ausencia de obstrucción en las venas pulmonares (Tabla 2). Bien cumplidas todas estas exigencias, y efectuadas las cirugías precedentes –“Fontan perfecto”–, la presión auricular derecha o venosa sistémica es usualmente el doble de lo normal (alrededor de 14 mmHg). Si tales parámetros cardiopulmonares no se cumplen –parcial o totalmente–, el modelo circulatorio fracasa de inmediato o lo hace más tarde de forma crónica y solapada durante la evolución a medio o largo plazo(47-49). La comunidad médica internacional ratifica que las resistencias arteriolares pulmonares bajas (< 2 U/m2) constituyen la esencia de la fisiología univentricular. Su impacto hemodinámico en la modulación del gasto cardiaco es aún mayor que la propia fracción de eyección ventricular. Debido a que la aplicación de estrategias operatorias precoces en dos tiempos atenúa, neutraliza o impide la aparición o progresión de la mayoría de los factores negativos, la estratificación de riesgo para la cirugía univentricular ha evolucionado adquiriendo un perfil hemodinámico. Incluso en casos bien seleccionados, no es necesario recurrir al cateterismo cardiaco pre-2.º tiempo, sino que basta con un minucioso seguimiento clínico y con datos bien precisos derivados de la ecocardiografía o resonancia magnética. La excepción se encuentra en pacientes adultos supervivientes con sólo una fístula o estenosis pulmonar óptima, en quienes para la indicación de este tipo de cirugía es indispensable un estudio hemodinámico y angiográfico previo(12,16,25,49,50). Supervivencia quirúrgica La mortalidad operatoria inmediata (< 30 días) de la técnica atriopulmonar osciló en su fase inicial alrededor del 15-30%, pero descendió rápidamente con una estricta selección de candidatos, mientras que la supervivencia a más de 30-35 años no suele ser mayor del 50%, incluyendo incluso al denominado “Fontan perfecto”. La anastomosis bicavopulmonar tiene en la actualidad una tasa de mortalidad quirúrgica menor del 5%, y la supervivencia tardía se sitúa alrededor del 80-90% a más de 20 años de seguimiento (Figura 3). Los enfermos con atresia tricúspide y doble entrada izquierda, en los que el VI es el único soporte del sistema circulatorio, tienen mejor pronóstico(12,16,23,51-62). 403 28.Cazzaniga.indd 403 8/10/10 12:37:58 Atresia tricúspide y corazón univentricular Curva actuarial de supervivencia Cavop 31 días 88% Atriop 51% 72 104 0 5 54 89 36 65 33 5 10 15 9 25 años Figura 3. Curva actuarial de supervivencia con técnica atrio (Atriop) y cavopulmonar (Cavopu). Fuente: datos del Hospital Universitario Ramón y Cajal. Los datos expuestos no son sustancialmente diferentes cuando se realiza la operación de Fontan modificada en adultos. Las series publicadas incluyen un número relativamente reducido de pacientes operados con diferentes técnicas y afirman que la capacidad funcional mejora respecto del estado clínico previo y se mantiene favorable durante años; sin embargo, pueden surgir complicaciones a partir de los 10 años de seguimiento(63-65). COMPLICACIONES Y REINTERVENCIONES Las complicaciones a medio-largo plazo del modelo circulatorio univentricular son frecuentes y suelen definirse como Fontan fracasado (“failing Fontan” en la literatura inglesa). La incidencia aumenta conforme pasa el tiempo de seguimiento. El carácter crónico del bajo gasto cardiaco y la congestión venosa sistémica son el sustrato hemodinámico habitual. Las complicaciones más frecuentes se enumeran en la Tabla 3. Algunas son patrimonio exclusivo del Glenn clásico o de la anastomosis atriopulmonar, y un mismo enfermo puede presentar más de una. Es esencial que, ante cualquier complicación, se realicen exploraciones específicas (resonancia magnética, tomografía multicorte y/o cateterismo cardiaco) para descartar y/o indicar cirugía o intervención con catéter a toda anomalía potencialmente reparable(62-67). Obstrucciones en las anastomosis quirúrgicas Las obstrucciones de las anastomosis quirúrgicas son en general secuelas operatorias que, si son severas, se reconocen de inmediato. Las moderadas tienen un cur404 28.Cazzaniga.indd 404 8/10/10 12:37:59 M. Cazzaniga Tabla 3. Complicaciones • Atriomegalia • Dilatación del seno coronario • Disfunción hepática • Disfunción miocárdica • Obstrucción y/o cortocircuito residual en las anastomosis • Recanalización del tronco pulmonar • Tromboembolismo • Fístulas arteriovenosas pulmonares • Colateralización de venas sistémicas • Circulación colateral sistémico-pulmonar • Arritmias atriales • Disfunción del nódulo sinusal • Estenosis subaórtica • Enteropatía pierdeproteína • Bronquitis plástica • Estenosis y/o compresión de venas pulmonares so clínico solapado, pueden tolerarse durante años y su expresión clínica se manifiesta en la evolución a través de algunas de las complicaciones que se describen en este apartado. Las arritmias, la enteropatía pierdeproteína y la hepatomegalia severa o cianosis pueden expresar una hemodinamia desfavorable del modelo circulatorio provocado por una estenosis moderada en algún punto del sistema. El mecanismo de la obstrucción es variable y puede deberse a acodaduras, retracción cicatricial de suturas o reducción del calibre en conducto protésico por proliferación neointimal, entre otras. Es habitual que no se logre registrar un gradiente > 13 mmHg en la zona afectada, y en no pocas ocasiones es sólo la imagen angiográfica y/o de resonancia magnética la que nos alerta de su presencia. Por ello, algunos grupos sugieren una conducta agresiva –angioplastia, implante de stent, o cirugía– ante imágenes susceptibles de ser consideradas obstructivas (a nivel de la anastomosis de Glenn o de la conexión atriopulmonar, en segmentos de ramas pulmonares estrechos, y/o en la unión del conducto externo o túnel lateral con la VCI o AP[68,69]). Arritmias Las arritmias atriales rápidas –flutter o fibrilación auricular– son mayoritarias y se presentan con cualquier tipo de anastomosis. Causan un gran deterioro hemodinámico, pueden originar muerte súbita e inesperada, y precisan tratamiento de inmediato. Son más prevalentes en la atriopulmonar (25-35%) respecto de la bicavopulmonar (12-18%), siendo a su vez menor su incidencia con la técnica del conducto externo que con el túnel lateral. Pueden ser precoces –periodo preoperatorio–, o aparecer de novo conforme avanza el seguimiento. En este último caso su prevalencia anual 405 28.Cazzaniga.indd 405 8/10/10 12:38:0 Atresia tricúspide y corazón univentricular estimada puede alcanzar el 20%. Los factores de riesgo vinculados son: edad operatoria tardía, técnica atriopulmonar, presencia precoz de arritmia (pre o postoperatoria inmediata), longitud del seguimiento y regurgitación AV con disfunción ventricular. Tales arritmias pueden fomentar la aparición de trombos, especialmente en presencia de atriomegalia severa en pacientes operados con la técnica atriopulmonar. Las opciones para corregir los trastornos rápidos del ritmo cardiaco son: cardioversión eléctrica previa exclusión de trombos intracavitarios, fármacos antiarrítmicos, ablación con catéter –usualmente poco efectiva– o implante de marcapaso con objetivo antiarrítmico. Ante una arritmia controlada pero no revertida a ritmo sinusal se debe asociar anticoagulación al manejo clínico general. La reconversión quirúrgica de la anastomosis atriopulmonar por otra bicavopulmonar con implante de conducto externo actuando concomitantemente sobre los anómalos circuitos eléctricos de reentrada (empleando procedimiento Maze) es una alternativa muy eficaz para este problema. La mortalidad de la reoperación es < 1-2%, y la recurrencia de arritmia parece infrecuente (< 10%), con un seguimiento máximo de 5-7 años(63,66,70-75). También se observan arritmias lentas en estos enfermos. La enfermedad del nodo y el bloqueo AV completo son las más representativas. Deben tratarse recurriendo al implante de marcapaso epicárdico secuencial. Aunque infrecuente, no ha de sorprender la presencia de conducción AV acelerada (“PR corto” –síndrome de Wolff-Parkinson-White–) pre o postoperatoria. Tromboembolismo La incidencia es variable en diferentes informes. Los fenómenos tromboembólicos son relativamente poco frecuentes y más prevalentes con la técnica atriopulmonar. Pueden ser precoces (se estima una incidencia del 3% en los 2 primeros años del postoperatorio) o más tardíos durante el seguimiento (15-20%). Los problemas embólicos pueden afectar al pulmón o al circuito sistémico, y la tasa anual de eventos se sitúa alrededor del 3,9/100 pacientes/año. Se pueden observar trombos en los primeros días del postoperatorio (una localización es la VCI inducida por catéteres) o durante la evolución promovidos por arritmia (aurícula derecha y/ o izquierda). La ecocardiografía intraesofágica cumple aquí un papel esencial en el diagnóstico. Se produce un asentamiento peculiar de trombo entre la válvula pulmonar y el tronco pulmonar ciego (cerrado en la cirugía de Glenn bidireccional). La circulación univentricular fomenta la hipercoagulabilidad, ya por la lenta velocidad del flujo venoso (usualmente se visualiza autocontraste con ecografía) o por factores específicos procoagulantes inducidos por la disfunción hepática. En los fenómenos agudos se utilizan heparina y trombolíticos específicos, y se recomienda la anticoagulación con dicumarínicos durante el primer año del Glenn y/ o del Fontan modificado, ante la presencia de fenestración permeable, ante episodios bien definidos de tromboembolismo y en enfermos operados a edad avanzada. En los pacientes sin trastornos tromboembólicos manifiestos se aconseja la terapia antiagregante(76-78). 406 28.Cazzaniga.indd 406 8/10/10 12:38:1 M. Cazzaniga Enteropatía pierdeproteína La enteropatía pierdeproteína es un síndrome grave que no siempre remite, a pesar de la restricción de grasa en la dieta y de la administración de múltiples fármacos (esteroides, heparina, inotrópicos, antialdosterónicos o inhibidores de la enzima de conversión de la angiotensina [IECA]). Se inicia con una fase clínica de edemas, ascitis, diarrea crónica y derrame pleural y/o pericárdico. La certeza diagnóstica se basa en demostrar un nivel de albúmina en sangre < 3 g y elevados niveles de αantitripsina en heces. Se atribuye a una elevación crónica de la presión venosa sistémica, estasis portal y linfangiectasia intestinal cuya consecuencia es una constante pérdida de albúmina, proteínas, inmunoglobulinas y linfocitos en el tracto gastrointestinal. Ante este síndrome, lo aconsejable es una exploración hemodinámicaangiográfica inmediata para detectar y tratar si procede lesiones no advertidas en exámenes rutinarios. En determinados enfermos el problema sólo se corrige con el trasplante cardiaco, creando una fenestración en el sistema, o reparando lesiones no detectadas previamente (repermeabilización de una AP ligada –no seccionada–, estenosis localizada en la conexión atrio o bicavopulmonar). Es una complicación grave que tiene una supervivencia a 5 años no mayor del 60%. Cabe resaltar que el estudio hemodinámico no siempre revela una presión venosa elevada, probablemente debido a la presión oncótica vascular disminuida secundaria a la hipoalbuminemia(79-81). Bronquitis plástica Es una complicación grave pero infrecuente que se presenta en algo menos del 1% de los casos. Los enfermos presentan tos y episodios de asfixia, tras lo cual expulsan moldes mucinosos configurados a semejanza de la traquea y los bronquios. Puede tratarse con éxito variable mediante aerosoles de urocinasa u otras actuaciones, pero ante su presencia se debe estudiar al completo la hemodinamia del enfermo con vistas a decidir una terapéutica apropiada(82,83). Estenosis de venas pulmonares Se trata de una condición infrecuente cuya incidencia es < 1-3%. Usualmente el mecanismo de la obstrucción es compresivo pero puede existir una genuina estenosis de venas pulmonares. En la técnica atriopulmonar, las venas pulmonares derechas quedan constreñidas por una severa atriomegalia, mientras que en enfermos con bicavopulmonar, el fenómeno compresivo se produce entre el conducto externo (o túnel lateral) y la aorta torácica descendente cuando ambas son homolaterales –posicionados en el mismo lado–. El mecanismo de la compresión-obstrucción puede ser constante o dinámico, comportamiento que puede registrarse con ecocardiografía Doppler o visualizarse con resonancia magnética. La estenosis genuina de una o más venas pul407 28.Cazzaniga.indd 407 8/10/10 12:38:2 Atresia tricúspide y corazón univentricular monares es excepcional y condiciona de forma muy negativa la hemodinamia univentricular. El tratamiento del problema incluye el implante de stent en las venas constreñidas o la creación de una fenestración para descomprimir el sistema venoso(66,84,85). Atriomegalia, dilatación del seno coronario y disfunción hepática En la anastomosis atriopulmonar, la AD crece de forma aneurismática con el transcurso del tiempo, involucrando al seno coronario y a las venas coronarias. El remanso circulatorio atrial –ineficaz desde el punto de vista hemodinámico– se asocia a elevación de la presión venosa, aparición de arritmias y fenómenos trombóticos. El impacto de la presión venosa coronaria elevada sobre la circulación coronaria y la función ventricular no está aún bien definido. Existe hepatomegalia secundaria a congestión venosa en el examen clínico, tanto en enfermos con atrio como con bicavopulmonar. La disfunción hepática, con enzimas elevadas y trastornos de coagulación, no es infrecuente (más del 50% de enfermos tienen trastornos de esta naturaleza). El tiempo de seguimiento es un factor de riesgo. La evolución a cirrosis y/o a tumor hepático son excepcionales(66,67,86). Cianosis y colateralización venosa La mayoría de los enfermos tienen una saturación de oxígeno arterial superior al 95%. Valores por debajo obligan a investigar la etiología de la desaturación. Generalmente se debe a un cortocircuito derecha-izquierda inducido por un gradiente elevado entre las venas cavas y la AP, por aumento de la resistencia arteriolar pulmonar o por otros factores. La presencia de una fenestración quirúrgica intencionada explica sobradamente la cianosis, pero en ausencia de la misma deben estudiarse otras posibilidades: comunicación residual interauricular (leaks), permeabilización o colateralización de venas sistémicas infra/supra diafragmáticas preexistentes no funcionales que conectan con la AI o la vena pulmonar, fístulas arteriovenosas pulmonares, o patología pulmonar intrínseca (fisiología restrictiva por deformidades torácicas, parálisis del diafragma, neumonía, embolia pulmonar). En la patogenia de las fístulas arteriovenosas pulmonares influye la ausencia de flujo hepático (“factor hepático”) en el circuito pulmonar, por lo que esta patología es más prevalente en enfermos con Glenn clásico o en hetrotaxias intervenidas con técnica de Kawashima. Una buena proporción de estas estructuras vasculares repermeablizadas o comunicaciones residuales localizadas pueden ocluirse de forma percutánea con dispositivos mecánicos(61). Disfunción ventricular El ventrículo único como tal o sus variantes tiene de inicio un inconveniente respecto de la normalidad, tal vez relacionado con mecanismos de adaptación: carece de la función del tabique interventricular normal y prevalece en él la orientación circular de las fibras miocárdicas en detrimento de las orientadas longitudinalmente. La mioarquitectura normal –orientación longitudinal inversa entre fibras endo/epicárdicas y 408 28.Cazzaniga.indd 408 8/10/10 12:38:3 M. Cazzaniga circulares mediales– es esencial para que la función de bomba sea armónica y eficaz. Si la carencia de esta configuración es o no determinante en la fisiología postoperatoria del corazón univentricular a largo plazo es todavía especulación teórica; sin embargo, anomalías funcionales detectadas por ecocardiografía pueden apoyar esta hipótesis. No se duda de que en estas malformaciones se debe proteger al músculo cardiaco ya desde el periodo neonatal evitándole periodos prolongados de hipoxemia o sobrecarga volumétrica. Aun a pesar de la vigilancia a la que sometemos al corazón univentricular –antes y después de la cirugía–, se sospecha que la función del ventrículo, aun en las mejores condiciones posibles, acabará fracasando con el tiempo. En determinadas publicaciones no aparece la morfología ventricular dominante como factor de riesgo, pero es verdad que hasta el momento la doble entrada izquierda y/o la atresia tricúspide tienen mayor longevidad(87,88). Obstrucción subaórtica Dos patologías tienen el sustrato morfológico ideal que condiciona la aparición de obstrucción subaórtica: la doble entrada izquierda y la atresia tricúspide, ambas con TGA asociada y usualmente con historia de cerclaje pulmonar en los primeros meses de vida. En tales malformaciones, una comunicación interventricular (foramen ventrículo-cameral) muscular es la única salida del ventrículo dominante hacia la aorta; si es irrefutablemente grande, no existe obstrucción; si, por el contrario, es pequeña, la estenosis subaórtica suele estar ya presente en el periodo preoperatorio, lo que obliga a introducir variantes quirúrgicas para solventar el problema. La presentación postoperatoria se ve favorecida por los cambios geométricos y volumétricos (reducción) que conlleva el principio de Fontan. Puede aparecer precozmente en el periodo inmediato o de forma lenta durante el seguimiento tardío. En ambos casos es necesaria una reintervención quirúrgica –ampliación de la comunicación– para evitar una hipertrofia parietal desmesurada. El uso prolongado de IECA puede contribuir a acelerar la obstrucción subaórtica debido a una relación masa/volumen inapropiada y a un comportamiento diastólico alterado del ventrículo único(53,89,90). Otros problemas conocidos Durante el seguimiento puede aparecer una insuficiencia aórtica leve o moderada. Es más frecuente en los operados tardíos o en los portadores de técnicas operatorias específicas. En la evolución puede aparecer la regurgitación atrioventricular debida a una anormal anatomía valvular o secundaria a dilatación ventricular crónica. Se deben vigilar estas dos condiciones en el seguimiento postoperatorio, ya que la sobrecarga volumétrica que imponen perjudica la función ventricular(91). Dos problemas infrecuentes pueden alterar la normal fisiología del “principio de Fontan”: la repermeabilización de una AP no dividida en la cirugía (sólo ligada y no seccionada) y la aparición/progresión de circulación colateral aortopulmonar secundaria a toracotomías y/o debida a factores de crecimiento vascular endotelial fibroblástico. Ambos problemas aumentan el volumen circulatorio y acaban por inducir 409 28.Cazzaniga.indd 409 8/10/10 12:38:4 Atresia tricúspide y corazón univentricular disfunción ventricular si no son neutralizados a tiempo. Se debe indicar la oclusión quirúrgica o mediante catéter del orificio pulmonar recanalizado y el implante de coils en los vasos colaterales aortopulmonares(53,54,62). REINTERVENCIONES Las reintervenciones tanto quirúrgicas como con catéter no son infrecuentes durante el seguimiento de estos enfermos. Son necesarias para corregir o paliar secuelas hemodinámicas, anatómicas o para tratar trastornos del ritmo cardiaco. En cualquier caso, si son efectivas mejoran el estado clínico. La tasa de enfermos libres de reintervenciones en conjunto oscila entre el 30 y el 40% a 30 años. Cabe afirmar que son más frecuentes en los portadores de la técnica atriopulmonar. Estos datos los confirma Freedom, quien refiere que un 54% de los enfermos está libre de reintervenciones a 15 años. Es esperable que la anastomosis bicavopulmonar aplicada precozmente disminuya drásticamente dicha tasa. El trasplante cardiaco es una alternativa final ante complicaciones que no sean susceptibles de reparación, como la disfunción ventricular, la hiperresistencia arteriolar pulmonar y la enteropatía pierdeproteína. Mención especial en este apartado merecen las intervenciones extracardiacas, en especial la cirugía ortopédica prolongada (deformidades torácicas o de columna vertebral secundarias a cirugías previas) en pacientes con gasto cardiaco límite. Todas ellas requieren de asistencia especializada para evitar eventos graves(53,62,92,93). EVOLUCIÓN CLÍNICA GLOBAL Es recomendable una revisión semestral o anual en enfermos con cirugía de Fontan o sus variantes. A pesar de todos los problemas que presentan los enfermos con la circulación univentricular, y que alrededor del 60% de ellos precisa medicación cardiológica de por vida, el grado funcional estimado con los parámetros de la New York Heart Association demuestra que la gran mayoría se sitúa entre los grados I y II. La capacidad funcional deducida de las pruebas de esfuerzo consigna una reducción significativa en los operados antes de los años noventa, de mayor calado cuanto más alejado es el seguimiento. Datos recientes confirman que la estrategia de precocidad proporciona una ventaja manifiesta en este sentido(94-96). En general, los enfermos no tienen soplo cardiaco en la exploración. Su presencia o progresión debe hacer pensar en estenosis subaórtica, repermeabilización de AP, regurgitación AV y/o aórtica. Cabe consignar en este apartado clínico que el edema agudo de pulmón no se presenta en el modelo circulatorio univentricular porque no existe bomba pulsátil “subpulmonar”; por ello, ante un cuadro catalogado como “pulmonar” se debe descartar neumopatía o embolismo. La endocarditis bacteriana está descrita en enfermos adultos, por lo que existe unanimidad en indicar la profilaxis antibacteriana de por vida. El embarazo es posible, pero, debido al mayor volumen circulatorio inherente a la propia gestación, el ventrículo único está obligado a gestionar un incremento de precarga que le es inusual. Por ello, y por otros factores gestacionales, el principio de 410 28.Cazzaniga.indd 410 8/10/10 12:38:5 M. Cazzaniga Fontan es propenso a la aparición de arritmias, tromboembolismo, dilatación ventricular con deterioro de la función, congestión venosa sistémica y embolismo paradojal si existe fenestración intencionada o comunicación atrial residual. Es indispensable alertar de estos problemas a las gestantes, desaconsejar el embarazo en enfermas con situación hemodinámica límite, o supervisarlo muy estrechamente con la ayuda del obstetra(97-99). Otros problemas menos frecuentes pero de interés y que están en la actualidad bajo observación son: disminución del crecimiento somático, alteración del control autonómico cardiaco con reducción de la variabilidad de la frecuencia cardiaca y de la sensibilidad barorrefleja y un déficit del neurodesarrollo con impacto social. Dichos problemas deberán atenderse con estrategias específicas por grupos especializados en cardiopatía congénita del adulto(100-103). BIBLIOGRAFÍA 1. The univentricular heart. En: Perloff JK. The clinical recognition of congenital heart disease. 4th ed. Philadelphia: WB Saunders Company; 1994. Chapter 26. p. 635-57. 2. Anderson RH, Ho SY. Which hearts are unsuitable for biventricular correction? Ann Thorac Surg 1998; 66: 621-6. 3. Quero M, Maitre MJ, Brito JM, et al. Anastomosis cavo-atriopulmonar. Rev Esp Cardiol 1993; 46: 101-18. 4. Ho SY. Cardiac morphology and nomenclature. En: Gatzoulis M, Webb G, Daubeney P (eds.). Diagnosis and management of adult congenital heart disease. Churchill Livingstone; 2003. p. 7-18. 5. Ammash NM, Warnes CA. Survival into adulthood of patients with unoperated single ventricle. Am J Cardiol 1996; 77: 542-4. 6. Moodie DS, Ritter DG, Tajik AJ, et al. Long-term follow up in the unoperated univentricular heart. Am J Cardiol 1984; 53: 1124-8. 7. Moodie DS, Ritter DG, Tajik AJ, et al. Long-term follow up after palliative operation for univentricular heart. Am J Cardiol 1984; 63: 1649-51. 8. Gatzoulis M, Munk M, Williams GW, Webb G. Definitive palliation with cavopulmonary shunts for aduts with single ventricle physiology. Heart 2000; 83: 51-7. 9. Yeh Jr Th, Williams GW, McCrindle B, et al. Equivalent survival following cavopulmnary shunt: with or whithout the Fontan procedure. Eur J Cardiothorac Surg 1999; 16: 111-6. 10. Glenn WWL, Ordway NK, Talner NS, Call E. Circulatory bypass of the right side of the heart. Circulation 1965; 31: 172-89. 11. Robicsek F. The history of right heart bypass before Fontan. Herz 1992; 17: 199-212. 12. Mayer J, Helgason H, Jonas R, et al. Extending the limits for the modified Fontan procedures. J Thorac Cardiovasc Surg 1986; 92: 1021-8. 13. Taussig H. Long-term observations on the Blalock-Taussig operation. Johns Hopkins Med J 1976; 139: 69-76. 14. Serraf A, Taghavi I, Zurakowski D, et al. Pulmonary artery banding in the treatment of univentricular heart. Arch Mal Coeur Vaiss 1995; 88: 717-24. 15. Glenn WW. Circulatory bypass of the right side of the heart: shunt between superior vena cava and distal right pulmonary artery: report of clinical application. N Engl J Med 1958; 259: 117-20. 411 28.Cazzaniga.indd 411 8/10/10 12:38:6 Atresia tricúspide y corazón univentricular 16. Castaneda A. From Glenn to Fontan: a continuing evolution. Circulation 1992; 86: 80-4. 17. Mainwarning RD, Uzak K, Lamberti JJ, Spicer RL. Bidirectional Glenn: is accessory pulmonary blood flow good or bad? Circulation 1995; 92: 294-7. 18. Fernández Pineda L, Cazzaniga M, Villagrá F, et al. La operación de Glenn en 100 casos con cardiopatías congénitas complejas: factores determinantes del resultado quirúrgico. Rev Esp Cardiol 2001; 54: 1061-74. 19. Douville EC, Sade RM, Fyfe DA. Hemi-Fontan operation in surgery for single ventricle: a preliminary report. Ann Thorac Surg 1991; 51: 983-900. 20. Fontan F, Boudet E. Surgical repair of tricuspid atresia. Thorax 1971; 26: 240-8. 21. Kreutzer G, Galindez E, Bono H, et al. An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg 1973; 66: 613-21. 22. de Leval M, Kilner P, Gewillig M, Bull C. Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations (experimental studies and early clinical experience). J Thorac Cardiovasc Surg 1988; 96: 682-95. 23. Stam C, Friehs I, Mayer J, et al. Long-term results of the lateral tunnel Fontan operation. J Thorac Cardiovasc Surg 2001; 121: 28-41. 24. Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonary artery extracardiac conduit: a new form of right heart bypass. J Thorac Cardiovasc Surg 1990; 100: 228-32. 25. Norwood W, Jacobs M. Fontan’s procedure in two stages. Am J Surg 1993; 166: 548-51. 26. Jacobs M, Norwood W. Fontan operation: influence of modifications on morbidity and mortality. Ann Thorac Surg 1994; 58: 945-52. 27. Bartmus D, Driscoll D, Offord K, et al. The modified Fontan operation for children less than 4 years old. JACC 1991; 15: 429-35. 28. Burke R, Jacobs M, Ashraf M, et al. Extracardiac Fontan operation without cardiopulmonary bypass. Ann Thorac Surg 1997; 63: 1175-7. 29. Villagra F, Gomez R, Herraiz I, et al. Derivación cavo-pulmonar (Glenn) bidireccional sin circulación extracorpórea. Rev Esp Cardiol 2000; 53: 1406-9. 30. Koutlas TC, Gaynor W, Nicolson SC, et al. Modified ultrafiltration reduces postoperative morbility after cavopulmonary connection. Ann Thorac Surg 1997; 64: 37-43. 31. Bridges N, Lock J, Castañeda A. Baffle fenestration with subsequent transcatheter closure. Circulation 1990; 82: 1681-9. 32. Hiramatsu T, Imai Y, Kurosawa H, et al. Effects of dilutional and modified ultrafiltration in plasma endothelin-1 and pulmonary vascular resistance after the Fontan procedure. Ann Thorac Surg 2002; 73: 862-5. 33. Mavroudis C, Backer CL, Kohr LM, et al. Bidirectional Glenn shunt in association with congenital heart repairs: the 1½ ventricular repair. Ann Thorac Surg 1999; 68: 976-82. 34. Van Arsdell GS, Williams WG, Freedom RM. A practical approach to 1½ ventricle repairs. Ann Thorac Surg 1998; 66: 678-80. 35. Van Arsdell GS, Williams WG, Maser CM, et al. Superior vena cava to pulmonary artery anastomosis: an adjunct to biventricular repair. J Thorac Cardiovasc Surg 1996; 112: 1143-9. 36. Bowman FO, Malm JR, Hayes CJ, et al. Physiological approach to surgery for tricuspid atresia. Circulation 1978; 58: 1. 37. Björk VO, Olin CL, Bjarke BB, et al. Right atrial-right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg 1979; 77: 452-8. 412 28.Cazzaniga.indd 412 8/10/10 12:38:7 M. Cazzaniga 38. Kawashima Y, Kitamura S, Matsuda H, et al. Total cavopulmonary shunt operation in complex cardiac anomalies. J Thorac Cardiovasc Surg 1984; 8: 74-81. 39. Norwood WI, Lang P, Hansen DD. Physiologic repair of aortic-hypòplastic left harte syndrome. N Eng J Med 1983; 308: 23-6. 40. Sano S, Ishino K, Kado H, et al. Outcome of right ventricle-to-pulmonary artery shunt in first stage palliation of hyplopastic heart syndrome: a multi-institutional study. Ann Thorac Surg 2004; 78: 1951-7. 41. Alvarez Díaz E, Hurtado E, Perez de León J, et al. Técnica de corrección anatómica de la transposición completa de grandes arterias. Rev Esp Cardiol 1975; 28: 255-7. 42. Damus PS. Correspondence. Ann Thorac Surg 1975; 20: 724-5. 43. Kaye MP. Anatomical correction of transposition of the great arteries. Mayo Clin Proc 1975; 50: 638-40. 44. Stansel Jr HC. A new technique for d-loop transposition of the great vessels. Ann Thorac Surg 1975; 19: 565-7. 45. Karl TR, Cochrane AD, Brizard CP. Arterial switch operation. Surgical solutions to complex problems. Tex Heart Inst J 1997; 24: 322-33. 46. Bull K. The Fontan procedure: lessons from the past. Heart 1998; 79: 213-4. 47. Gewillig M. The Fontan circulation. Heart 2005; 91: 839-46. 48. de Leval M. The Fontan circulation: what have we learned? What to expect? Pediatr Cardiol 1998; 19: 316-20. 49. Choussat A, Fontan F, Besse F, et al. Selection criteria for Fontan’s procedure. En: Anderson R, Shinebourne E (eds.). Pediatric Cardiology. Edinburgh: Churchill-Livingstone; 1978: 559-66. 50. Cazzaniga M, Vázquez Martínez JL. Atresia tricúspide. En: Zabala JI (coord.). Protocolos diagnósticos y terapéuticos en cardiología pediátrica. Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas. Capítulo 14. www.secardioped.org 51. Driscoll D, Oxford K, Feldt R, et al. Five to fifteen years after de Fontan operation. Circulation 1992; 85: 429-35. 52. Cetta F, Feldt R, O’Leary P, et al. Improved early morbidity and mortality after Fontan operation: the Mayo Clinic experience, 1987-1992. JACC 1996; 28: 480-6. 53. Cazzaniga M, Fernández Pineda L, Villagrá F, et al. Operación modificada de Fontan o variantes efectuadas en un solo tiempo quirúrgico. Determinantes de la mortalidad. Rev Esp Cardiol 2002; 55: 391-412. 54. Cazzaniga M. Acerca de la circulación univentricular. 4th International Congress of Cardiology in Internet. Pediatric Cardiology Forum. www.fac.org.ar 55. Oliver JM. La circulación de Fontan en el adulto. An Cirug Card Vasc 2002; 8: 158-64. 56. Azakie A, McCrindle B, van Arsdell G, et al. Extracardiac conduit versus lateral tunnel cavopulmonary anastomosis connections at a single institution: impact on outcomes. J Thorac Cardiovasc Surg 2001; 122: 1219-28. 57. Gentles TH, Mayer J, Gauvreau K, et al. Fontan operation in five hundred consecutive patients. J Thorac Cardiovasc Surg 1997; 114: 376-91. 58. Knott-Craig C, Danielson G, Schaff H, et al. The modified Fontan operation: an analysis of risks factors for early postoperative death or takedown in 702 consecutive patients from one institution. J Thorac Cardiovasc Surg 1995; 109: 1237-43. 413 28.Cazzaniga.indd 413 8/10/10 12:38:8 Atresia tricúspide y corazón univentricular 59. Mair D, Puga F, Danielson G. The Fontan procedure for tricuspide atresia: early and late results of a 25-year experience with 216 patients. JACC 2001; 37: 933-9. 60. Fontan F, Kirklin J, Fernández G, et al. Outcome after a perfect Fontan operation. Circulation 1990; 81: 1520-36. 61. Gamboa R, Mollon P, Rios Mendez R, et al. Fontan pulsátil: oclusión transcatéter de la arteria pulmonar permeable. Arch Cardiol Mex 2008; 78: 293-9. 62. Freedom R, Hamilton R, Yoo SJ, et al. The Fontan procedure: analysis of cohorts and late complicactions. Cardiol Young 2000; 10: 307-31. 63. Veldtman GR, Nishimoto SS, Freeman R, et al. The Fontan procedure in adults. Heart 2001; 86: 330-5. 64. Gates RN, Laks H, Drinkwater DC, et al. The Fontan operation in adults. Ann Thorac Surg 1997; 63: 1085-90. 65. Burkhart H, Dearani J, Mair D, et al. The modified Fontan operation: early and late results adult patients. J Thorac Cardiovasc Surg 2003; 125: 1252-9. 66. Freedom RM, Li J, Yoo SJ. Late complications following the Fontan operation. En: Gatzoulis M, Webb G, Daubeney P (eds.). Diagnosis and Management of Adult Congenital Heart Disease. Churchill-Livingstone; 2003. p. 85-92 . 67. Leung M, Benson L, Smallhorn J, et al. Abnormal cardiac signs after Fontan type of operation: indicators of residual and sequelae. Br Heart J 1989; 61: 52-8. 68. Fernandez G, Costa F, Fontan F, Naftel DC, et al. Prevalence of reoperation for pathway obstruction after Fontan operation. Ann Thorac Surg 1989; 48: 654-9. 69. Oliver JM. Cardiopatías congénitas del adulto: residuos, secuelas y complicaciones de las cardiopatías congénitas operadas en la infancia. Rev Esp Cardiol 2003; 56: 73-88. 70. Durongpisitkul K, Porter CJ, Cetta F, et al. Predictors of early- and late-onset supraventricular tachyarrhythmias after Fontan operation. Circulation 1998; 98: 1099-107. 71. Peters NS, Somerville J. Arrhythmias after the Fontan procedure. Br Heart J 1992; 68: 199-204. 72. Balaji S, Gewillig M, Bull C, et al. Arrhytmias after the Fontan procedure: comparison of total cavopulmonary connection and atriopulmonary anastomosis. Circulation 1991; 84: 162-7. 73. Gardiner H, Dhillon R, Bull C, et al. Prospective study of the incidence and determinant of arrhythmia after total cavopulmonary connection. Circuation 1996; 94: 17-21. 74. Mavroudis C, Backer C, Deal B, Johnsrude C. Fontan conversion to cavopulmonary connection and arrhythmia circuit cryoablation. J Thorac Cardiovasc Surg 1998; 115: 547-56. 75. Marcelletti C, Hanley F, Mavroudis C, et al. Revision of previous Fontan connections to total extracardiac cavopulmonary anastomosis: a multicenter experience. J Thorac Cardiovasc Surg 2000; 119: 340-6. 76. Rosenthal DN, Friedman AH, Kleinman CS, et al. Thromboembolic complications after Fontan operations. Circulation 1995; 92: II287-93. 77. Monagle P, Cochrane A, McCrindle B, et al. Thromboembolic complications after fontan procedures: the role of prophylactic anticoagulation (editorial; comment). J Thorac Cardiovasc Surg 1998; 115: 493-8. 78. Balling G, Vogt M, Kaemmerer H, et al. Intracardiac thrombus formation after the Fontan operation. J Thorac Cardiovasc Surg 2000; 119: 745-52. 79. Mertens L, Hagler DJ, Sauer U, et al. Protein-losing enteropathy after the Fontan operation: an international multicenter study. PLE study group. J Thorac Cardiovasc Surg 1998; 115: 1063-73. 414 28.Cazzaniga.indd 414 8/10/10 12:38:9 M. Cazzaniga 80. Camarero C, Tamariz R, García Trujillo JA, Villagrá F, Escobar H, Suárez L, et al. [Protein-losing enteropathy after Fontan’s operation]. An Pediatr (Barc) 2001; 54: 39-42. 81. Benayan I, Casaldáliga J, Protein losing entropathy. Pediatr Cardiol 2002; 23: 249. 82. Mendoza Soto, A, Galletti L, Gómez de Quero MV, et al. Bronquitis plástica. A propósito de un caso y revisión de los casos asociados a cirugía de Fontan. An Pediatr 2005; 62: 72-5. 83. Tzifa A, Robards M, Simpson JM. Plastic bronchitis: a serious complication of the Fontan operation. Int J Cardiol 2005; 101: 513-4. 84. Kawahira Y, Kadoba K, Matsuda H. Compression of the pulmonary veins by the descending aorta in patients corrected surgically by the Fontan procedure. Cardiol Young 1998; 8: 86-9. 85. O’Donnell CP, Lock JE, Powell AJ, Perry SB. Compression of pulmonary veins between left atrium and the descending aorta. Am J Cardiol 2003; 91: 248-51. 86. Van Nieuwenhuizen, Peters M, Lubbers L, et al. Abnormalities in liver function and coagulation profile following the Fontan procedure. Heart 1999; 82: 40-6. 87. Corno A, Hocica M, Torrent Guasp F. The helicoidal ventricular myocardial band of Torrent Guasp: potencial implications in congenital heart defects. Eur J Cardio Thoracic Surg 2006; 295: 561-8. 88. Penny DJ, Rigby ML, Redington AN. Abnormal patterns of intraventricular flow and diastolic filling after Fontan operation: evidence for incoordinate ventricular wall motion. Br Heart J 1991; 66: 375-8. 89. Freedom RM, Benson L, Smallhorn JF, et al. Subaortic stenosis: an analysis of courses of 43 patients with univentricular heart palliated by pulmonary artery banding. Circulation 1986; 73: 758-64. 90. Razzouk AJ, Freedom RM, Cohen AJ. The recognition, identification of morphologic substrate, and treatment of subaortic stenosis after a Fontan operation. An analysis of twelve patients. J Thorac Cardiovasc Surg 1992; 104: 938-44. 91. Vargas FJ, Mayer JE Jr, Jonas RA, Castaneda AR. Atrioventricular valve repair or replacement in atriopulmonary anastomosis: surgical considerations. Ann Thorac Surg 1987; 43: 403-5. 92. Colman J. Noncardiac surgery in adult congenital heart disease. En: Gatzoulis M, Webb G, Daubeney P (eds.). Diagnosis and Management of Adult Congenital Heart Disease. ChurchillLivingstone; 2003. p. 99-104 . 93. Jayakumar KA, Addonizio LJ, Kichuk-Chrisant M, et al. Cardiac transplantation after the Fontan or Glenn procedure. JACC 2004; 44: 2065-72. 94. Mahle W, Wernovsky G, Bridges N, et al. Impact of early ventricular unloading on exercise performance in preadolescents with single ventricle Fontan physiology. JACC 1999; 34: 1637-43. 95. Fredriksen PM, Therrien J Veldtman G, et al. Lung function and aerobic capacity in adults patients following modified Fontan procedure. Heart 2000; 85: 295-9. 96. van des Bosch AE, Roos-Hesselink JW, van Domburg R, et al. Long-term outcome and quality of life in adult patients after the Fontan operation. Am J Cardiol 2002; 93: 1141-5. 97. Canobbio MM, Mair DD, van der Velde M, Koos BJ. Pregnancy outcomes after the Fontan repair. JACC 1996; 28: 763-7. 98. Drenthen W, Pieper PG, Roos-Hesselink JW, et al. Pregnancy and delivery in women after Fontan palliation. Heart 2006; 92: 1290-4. 99. De la Fuente MA, Garcia Algas F, Gopegui R, Cazzaniga M. Gestación en pacientes con cardiopatías congénitas complejas. IV Congreso Nacional de Cardiología Pediátrica y Cardiopatías Congénitas. La Coruña; 2006: CP-40. 415 28.Cazzaniga.indd 415 8/10/10 12:38:10 Atresia tricúspide y corazón univentricular 100. Cohen MI, Bush DM, Ferry Jr RJ, et al. Somatic growth failure after the Fontan operation. Cardiol Young 2000; 10: 447-57. 101. Davos CH, Francis DP, Leenarts MFE, et al. Global impairment of cardiac autonomic nervous activity late alter the Fontan operation. Circulation 2003; II-180-5. 102. McCrindle BW, Williams RV, Mitchell PD, et al. Relationship of patient and medical characteristics to health status in children and adolescents after the Fontan procedure. Circulation 2006; 113: 1123-9. 103. Cazzaniga M. Cardiopatías congénitas que no pueden optar a cirugía biventricular. Monocardio 2007-volumen IX; 1: 94-108. 416 28.Cazzaniga.indd 416 8/10/10 12:38:11