termoquímica - problemas resueltos de acceso a la universidad
Anuncio

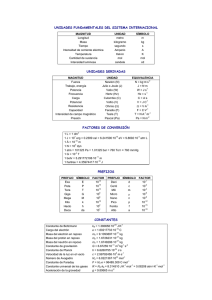
QUÍMICA de 2º de BACHILLERATO TERMOQUÍMICA PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 − 2010) VOLUMEN II DOMINGO A. GARCÍA FERNÁNDEZ DEPARTAMENTO DE FÍSICA Y QUÍMICA I.E.S. EMILIO CASTELAR MADRID Estos volúmenes I y II comprenden 34 problemas resueltos de TERMOQUÍMICA que han sido propuestos en 34 exámenes de Química de las Pruebas de acceso a estudios universitarios en la Comunidad de Madrid entre los años 1996 y 2010, en las siguientes convocatorias: AÑO EXAMEN Modelo 1996 SEPTIEMBRE 1 1 1997 1 1998 1 1999 1 1 2000 1 1 1 2001 1 1 1 1 1 2002 2003 1 1 1 2004 1 1 1 2005 1 1 1 2006 1 1 1 2007 1 2008 1 2009 2010 JUNIO Fase General Fase Específica 1 1 1 1 1 1 Para poder acceder directamente a la resolución de un ejercicio hay que colocarse en la fecha que aparece después de su enunciado y, una vez allí, pulsar: CTRL + “CLIC” con el ratón. Página 2 ENUNCIADOS VOLUMEN I 1− La entalpía para la reacción de obtención de benceno líquido a partir de etino gaseoso: 3 C2H2 → C6H6 −1 es −631 kJ∙mol . En todo el proceso la temperatura es 25 ºC y la presión 15 atm. Calcule: a) Volumen de etino necesario para obtener 0,25 L de benceno líquido. b) Cantidad de calor que se desprende en dicho proceso. c) Densidad del etino en dichas condiciones. Datos: R = 0,082 atm∙L∙mol−1∙K−1 ; densidad (benceno) = 0,874 g∙cm−3 Masas atómicas (u): H = 1 , C = 12 . Junio 2004 2− Calcule: a) El calor de la reacción de hidratación de la cal viva. b) El calor desprendido cuando se apaga, añadiendo suficiente cantidad de agua, una tonelada de cal viva. Datos: ΔH f H 2 O (l) = −285,5 kJ/mol ΔH f CaO (s) = −634,9 kJ/mol ΔH f Ca(OH) 2 = −985,6 kJ/mol Masas atómicas (u): O = 16 , Ca = 40 . Septiembre 1997 3− Sabiendo que la combustión de 1 g de TNT libera 4.600 kJ y considerando los valores de las entalpías de formación que se proporcionan, calcule: a) la entalpía estándar de combustión del CH 4 ; b) el volumen de CH 4 , medido a 25 ºC y 1 atm de presión, que es necesario quemar para producir la misma energía que 1 g de TNT. Datos: ΔH 0f CH 4 = −75 kJ∙mol−1 = −394 kJ∙mol−1 ΔH 0f CO 2 ΔH 0f H 2 O (g) = −242 kJ∙mol−1 Junio 2006 4− Utilizando los datos siguientes: Sustancia ΔH 0f (kJ∙mol−1) a) b) C2H6 (g) −84,7 CO 2 (g) H 2 O (l) C (s) O 2 (g) −394,0 −286,0 0,0 0,0 Calcule las entalpías de combustión del carbón: C (s) y del etano: C 2 H 6 (g). A partir de los resultados del apartado anterior, calcule qué sustancia produce más energía por gramo de combustible y por mol de dióxido de carbono formado. Datos: Masas atómicas (u): H = 1,0 , C = 12,0. Modelo 2001 Página 3 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 5− Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso se realiza a presión constante a 1 atmósfera y temperatura constante de 25 ºC. Datos: ΔH 0f CO 2 (g) = −393,13 kJ∙mol−1 ΔH 0f H 2 O (l) = −285,8 kJ∙mol−1 49 kJ∙mol−1 ΔH 0f C 6 H 6 (l) = R = 8,3 x 10−3 kJ∙mol−1∙K−1 . Junio 1996 6− Utilizando los datos que precise de la tabla adjunta, calcule: Sustancia C 4 H 8 (g) ΔH 0f (kJ∙mol−1) 28,4 C 4 H 10 (g) −124,7 CO (g) CO 2 (g) H 2 O (g) −110,5 −393,5 −241,8 a) La cantidad de calor desprendido en la combustión de 14,5 kg de n-butano. b) La variación de energía interna del sistema, considerando 25 ºC de temperatura. Datos: R = 8,30 J∙mol−1∙K−1 ; masas atómicas (u): H = 1,0 , C = 12,0. Septiembre 2000 7− En la reacción de combustión del metanol líquido se produce CO 2 (g) y H 2 O (l). Sabiendo que el metanol tiene una densidad de 0,79 g∙cm−3, calcule: a) la entalpía estándar de combustión del metanol líquido; b) la energía desprendida en la combustión de 1 L de metanol; c) el volumen de oxígeno necesario para la combustión de 1 L de metanol, medido a 37 ºC y 5 atm. Datos: R = 0,082 atm∙L∙mol−1∙K−1 ; masas atómicas (u): H = 1 , C = 12 , O = 16 Entalpías estándar de formación, en kJ∙mol−1: metanol (l) = −239 , CO 2 (g) = −393 , H 2 O (l) = −294. Modelo 2010 8− En una fábrica de cemento es necesario aportar al horno 3.300 kJ por cada kilogramo de producto. La energía se obtiene por combustión de gas natural (que puede considerarse que es metano puro) con aire. Se pide: a) Formula y ajuste la reacción de combustión del gas natural. b) Determine el calor de la combustión completa del gas natural. c) Calcule, por tonelada de cemento producido, la cantidad necesaria de gas natural, expresada en kilogramos. d) ¿Cuántos metros cúbicos de aire, medidos a 1 atm y 25 ºC, serán necesarios para la combustión completa de la cantidad de gas natural del apartado c)?. Considere que la combustión del gas natural se realiza en condiciones estándar (1 atm y 25 ºC) y que el aire contiene un 21 % en volumen de oxígeno. Datos: Entalpías estándar de formación: ΔH f0 : metano (g) = −74,8 kJ∙mol−1 CO 2 (g) = −393,5 kJ∙mol−1 H 2 O (l) = −285,8 kJ∙mol−1 R = 0,082 atm∙L∙mol−1∙K−1 ; masas atómicas (u): H = 1,0 , C = 12,0, O = 16,0 . Septiembre 1998 ( ) Página 4 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 9− Sabiendo que se desprenden 890,0 kJ por cada mol de CO 2 producido según la siguiente reacción: CH 4 (g) + 2 O 2 (g) → CO 2 (g) + 2 H 2 O (l), calcule: a) La entalpía de formación del metano. b) El calor desprendido en la combustión completa de 1 kg de metano. c) El volumen de CO 2 , medido a 25 ºC y 1 atm, que se produce en la combustión completa de 1 kg de metano. Datos: R = 0,082 atm∙L∙mol−1∙K−1 ; masas atómicas (u): H = 1 , C = 12 −1 Entalpías de formación estándar (kJ∙mol ): H 2 O (l) = −285,8 ; CO 2 (g) = −393,5 . Junio 2010 (Fase General) 10 − Si se dispone de naftaleno (C 10 H 8 ) como combustible: a) Calcule su entalpía molar estándar de combustión. b) Calcule la energía que se desprenderá al quemar 100 g de naftaleno. c) Calcule el volumen que ocupará el CO 2 desprendido en la combustión de los 100 g de naftaleno, si se recoge a temperatura de 25 ºC y presión de 1,20 atm. ; Datos: ΔH 0f (C 10 H 8 ) = −58,6 kJ∙mol−1 ΔH 0f (CO 2 ) = −393,6 kJ∙mol−1 ; R = 0,082 atm∙L∙mol−1∙K−1 ΔH 0f (H 2 O) = −284,7 kJ∙mol−1 Masas atómicas (u): H = 1 , C = 12, O = 16 . Modelo 2004 11 − Los combustibles de automóvil son mezclas complejas de hidrocarburos. Supongamos que la gasolina responde a la fórmula: C 9 H 20 , cuyo calor de combustión es: ΔH c = −6.160 kJ∙mol−1, mientras que el gasoil responde a la fórmula: C 14 H 30 , cuyo calor de combustión es: ΔH c = −7.940 kJ∙mol−1. a) Formule las reacciones de combustión de ambos compuestos y calcule la energía liberada al quemar 10 L de cada uno. b) Calcule la masa de dióxido de carbono liberada cuando se queman 10 L de cada uno. Datos: Masas atómicas (u): H = 1 , C = 12, O = 16 Densidades: gasolina = 718 g∙L−1 ; gasoil = 763 g∙L−1 . Junio 2010 (Fase Específica) 12 − Uno de los métodos de propulsión de misiles se basa en la reacción de la hidracina: N 2 H 4 (l) y el peróxido de hidrógeno: H 2 O 2 (l) para dar nitrógeno molecular y agua líquida, siendo la variación de entalpía del proceso: −643 kJ∙mol−1. a) Formule y ajuste la reacción que tiene lugar. b) ¿Cuántos litros de nitrógeno, medidos a 20 ºC y 50 mm de mercurio, se producirán si reaccionan 128 g de N 2 H 4 (l)?. c) ¿Qué cantidad de calor se liberará en el proceso?. d) Calcule la entalpía de formación de la hidracina: N 2 H 4 (l). Datos: ΔH 0f [H 2 O 2 (l)] = −187,8 kJ∙mol−1 ; ΔH 0f [H 2 O (l)] = −285,83 kJ∙mol−1 R = 0,082 atm∙L∙mol−1∙K−1 ; masas atómicas (u): H = 1 , N = 14 . Septiembre 2009 Página 5 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 13 − En el proceso de descomposición térmica del carbonato de calcio se forma óxido de calcio y dióxido de carbono. Sabiendo que el horno en el que ocurre el proceso tiene un rendimiento del 65 %, conteste a los siguientes apartados: a) Formule la reacción y calcule su variación de entalpía. b) Calcule el consumo de combustible (carbón mineral), en toneladas, que se requiere para obtener 500 kg de óxido de calcio. Datos: ΔH 0f (carbonato de calcio) = −1.206,9 kJ∙mol−1 = −393,1 kJ∙mol−1 ΔH 0f (óxido de calcio) ΔH 0f (dióxido de carbono) = −635,1 kJ∙mol−1 1 kg de carbón mineral desprende 8.330 kJ Masas atómicas (u): O = 16 , Ca = 40 . Junio 2005 14 − La reacción de descomposición del clorato de potasio produce cloruro de potasio y oxígeno. a) Escriba la reacción, calcule la variación de entalpía estándar e indique si el proceso es exotérmico o endotérmico. b) Calcule la energía intercambiada si se obtienen 25 L de oxígeno a 25 ºC y 750 mm de mercurio. Datos: ΔH 0f (KClO 3 ) = −391,2 kJ∙mol−1 ; ΔH 0f (KCl) = −435,9 kJ∙mol−1 R = 0,082 atm∙L∙mol−1∙K−1 . Modelo 2006 15 − La urea: H 2 N(CO)NH 2 es una sustancia soluble en agua que sintetizan multitud de organismos vivos, incluyendo los seres humanos, para eliminar el exceso de nitrógeno. A partir de los datos siguientes: a) Ajuste la reacción de formación de la urea: H 2 N(CO)NH 2 (s), a partir de amoníaco: NH 3 (g) y dióxido de carbono: CO 2 (g), sabiendo que en la misma también se produce H 2 O (l). Obtenga la entalpía de formación de la misma. b) Calcule la entalpía del proceso de disolución de la urea en agua. c) Razone si un aumento de temperatura favorece o no el proceso de disolución de la urea. Datos: Entalpías de formación estándar (en kJ/mol): NH 3 (g) = −46,11 H 2 N(CO)NH 2 (s) = −333,19 H 2 N(CO)NH 2 (aq) = −319,2 CO 2 (g) = −393,51 H 2 O (l) = −285,83 . Modelo 2008 Página 6 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 16 − El proceso Deacon para la obtención de cloro (gaseoso) se basa en hacer reaccionar cloruro de hidrógeno y oxígeno (gaseosos). a) Formule la ecuación ajustada del proceso, sabiendo que además de cloro se obtiene también vapor de agua. b) Determine la variación de entalpía por mol de cloro formado, interpretando el resultado obtenido, a partir de los valores siguientes de las entalpías de enlace: Datos: Entalpía de enlace H−Cl: 432 kJ∙mol−1 Entalpía de enlace O=O: 499 kJ∙mol−1 Entalpía de enlace Cl−Cl: 243 kJ∙mol−1 Entalpía de enlace O−H: 460 kJ∙mol−1 . Modelo 1999 17 − La entalpía de combustión del butano es: ΔH c = −2.642 kJ∙mol−1, si todo el proceso tiene lugar en fase gaseosa. a) Calcule la energía media del enlace O−H. b) Determine el número de bombonas de butano (6 kg de butano / bombona) que hacen falta para calentar una piscina de 50 m3 de 14 a 27 ºC. Datos: R = 0,082 atm∙L∙mol−1∙K−1 ; masas atómicas (u): H = 1 , C = 12 , O = 16 c e (calor específico del agua) = 4,18 kJ∙kg−1∙K−1 ; ρ (densidad del agua) = 1 kg∙L−1 Energías medias de enlace: E(C−C) = 346 kJ∙mol−1 ; E(C=O) = 730 kJ∙mol−1 E(O=O) = 487 kJ∙mol−1 ; E(C−H) = 413 kJ∙mol−1 . Junio 2003 18 − Sabiendo que las entalpías de combustión del etanol y del ácido etanoico (ácido acético) en condiciones estándar son, respectivamente: −1.372,9 kJ∙mol−1 y −870,5 kJ∙mol−1 y que las entalpías normales de formación del agua líquida y del dióxido de carbono son, respectivamente: −285,5 kJ∙mol−1 y −393,04 kJ∙mol−1, calcule: a) La entalpía de la reacción correspondiente al proceso: C 2 H 5 OH (l) + O 2 (g) → ← CH 3 −COOH (l) + H 2 O (l) . b) La entalpía de formación del etanol. Modelo 2007 19 − a) b) Calcule la variación de entalpía de la reacción: C 2 H 4 (g) + H 2 (g) → C 2 H 6 (g) a partir de los siguientes datos: C 2 H 4 (g) + 3 O 2 (g) → 2 CO 2 (g) + 2 H 2 O (l) ΔH0 = −1.386,09 kJ 7 C 2 H 6 (g) + O 2 (g) → 2 CO 2 (g) + 3 H 2 O (l) ΔH0 = −1.539,9 kJ 2 ΔH 0f H 2 O (l) = −285,8 kJ∙mol−1 . Calcule el calor puesto en juego cuando 11,2 litros de H 2 (g) a 1 atm y 0 ºC hidrogenan la correspondiente cantidad de etileno. Septiembre 1996 Página 7 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 20 − Sabiendo que las entalpías estándar de combustión del hexano (líquido), carbono (sólido) e hidrógeno (gas) son: −4.192,0 kJ∙mol−1 , −393,1 kJ∙mol−1 y −285,8 kJ∙mol−1 , respectivamente, calcule: a) la entalpía de formación del hexano (líquido) a 25 ºC; b) el número de moles de hidrógeno consumidos en la formación del hexano (líquido) cuando se han liberado 30 kJ. Junio 2000 21 − El benceno (C 6 H 6 ) se puede obtener a partir del acetileno (C 2 H 2 ) según la reacción siguiente: 3 C 2 H 2 (g) → C 6 H 6 (l) . Las entalpías de combustión, a 25 ºC y 1 atm, para el acetileno y el benceno son, respectivamente: −1.300 kJ∙mol−1 y −3.267 kJ∙mol−1. a) Calcule ΔH0 de la reacción de formación del benceno a partir del acetileno y deduzca si es un proceso endotérmico o exotérmico. b) Determine la energía (expresada en kJ) que se libera en la combustión de 1 gramo de benceno. Datos: Masas atómicas (u): H = 1,0 , C = 12,0. Septiembre 2001 Página 8 Ejercicios de acceso a la Universidad − Problemas de Termoquímica VOLUMEN II 22 − Para la reacción: 2 NO (g) + O 2 (g) → 2 NO 2 (g) Calcule la entalpía de reacción a 25 ºC. Calcule hasta qué temperatura la reacción será espontánea, sabiendo que para esta reacción ΔS0 = −146,4 J∙K−1. c) Si reaccionan 2 L de NO, medidos a 293 K y 1,2 atm, con exceso de O 2 , ¿cuánto calor se desprenderá?. Datos: ΔH 0f NO (g) = 90,25 kJ∙mol−1 33,18 kJ∙mol−1 ΔH 0f NO 2 (g) = R = 0,082 atm∙L∙mol−1∙K−1 . Junio 2009 a) b) 23 − Utilizando los valores que aparecen en la tabla, todos CO (g) ellos obtenidos a la temperatura de 25 ºC, y considerando Cl 2 (g) la reacción: COCl 2 (g) CO (g) + Cl 2 (g) → COCl 2 (g) a) Calcule ΔS0 de la reacción. b) Calcule ΔH0 de la reacción. c) Calcule ΔG0 de la reacción. d) Razone si la reacción es o no espontánea. ΔH f0 (kJ∙mol−1) S0 (J∙K−1∙mol−1) −110,4 197,7 0,0 222,8 −222,8 288,8 Junio 2001 24 − Determine la energía libre de Gibbs a 25 ºC para la reacción de combustión de 1 mol de monóxido de carbono e indique si es o no un proceso espontáneo. Datos: ΔH 0f CO 2 (g) = −393,5 kJ∙mol−1 ΔH 0f CO (g) = −110,5 kJ∙mol−1 S0 CO 2 (g) = 213,6 J∙K−1∙mol−1 S0 CO (g) = 197,9 J∙K−1∙mol−1 S0 O 2 (g) = 205,0 J∙K−1∙mol−1 . Junio 1999 Página 9 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 25 − Para la siguiente reacción: CH 3 −CH 2 OH (l) + O 2 (g) → CH 3 −COOH (l) + H 2 O (l) Calcule: a) La variación de entalpía de la reacción a 25 ºC, en condiciones estándar. b) La variación de entropía a 25 ºC, en condiciones estándar. c) La variación de energía de Gibbs a 25 ºC, en condiciones estándar. d) La temperatura teórica para que la energía de Gibbs sea igual a cero. ΔH 0f (kJ∙mol−1) S0 (J∙K−1∙mol−1) Etanol (l) −227,6 160,7 Ácido etanoico (l) −487,0 159,9 O 2 (g) 0 205,0 H 2 O (l) −285,8 70,0 Datos a 25 ºC: Septiembre 2005 26 − 27 − Calcule para la formación del etanol: a) la energía libre estándar; b) la entropía estándar. Datos (todos a 25 ºC): ΔH 0f (CH 3 −CH 2 OH) (l) 0 (CO 2 ) (g) ΔG f 0 (H 2 O) (l) ΔG f 0 (O 2 ) (g) ΔG f 0 ΔG combustión (CH 3 −CH 2 OH) (l) = −277,3 kJ∙mol−1 = −394,0 kJ∙mol−1 = −236,9 kJ∙mol−1 = 0 = −1.282,5 kJ∙mol−1 . Modelo 2003 El ciclohexano se puede obtener por hidrogenación catalítica del benceno. Teniendo en cuenta la estequiometría de la reacción, calcule: a) las variaciones de entalpía y energía libre de Gibbs de reacción para dicho proceso; b) el calor desprendido si se emplean 10 L de hidrógeno, medidos a 1 atm y 298 K, para hidrogenar benceno. Datos: R = 0,082 atm∙L∙mol−1∙K−1 Compuesto Benceno Ciclohexano ΔH 0f (kJ∙mol−1) ΔG 0f (kJ∙mol−1) 49 124 −156 27 Modelo 2005 Página 10 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 28 − Para la reacción de hidrogenación del eteno: CH 2 =CH 2 , determine: a) La entalpía de reacción a 298 K. b) El cambio de energía de Gibbs de reacción a 298 K. c) El cambio de entropía de reacción a 298 K. d) El intervalo de temperaturas para el que dicha reacción no es espontánea. Datos a 298 K: −1 ΔH (kJ∙mol ) 0 f −1 ΔG (kJ∙mol ) 0 f CH 2 =CH 2 CH 3 −CH 3 52,3 −84,7 68,1 −32,9 Septiembre 2008 29 − El clorato de potasio (sólido) se descompone, a altas temperaturas, para dar cloruro de potasio (sólido) y oxigeno molecular (gas). Para esta reacción de descomposición, calcule: a) La variación de entalpía estándar. b) La variación de energía de Gibbs estándar. c) La variación de entropía estándar. d) El volumen de oxígeno, a 25 ºC y 1 atm, que se produce a partir de 36,8 g de clorato de potasio. Datos: Masas atómicas (u): O = 16,0 , Cl = 35,5 , K = 39,1 . ΔH 0f (kJ∙mol−1) ΔG 0f (kJ∙mol−1) S0 (J∙K−1∙mol−1) KClO 3 (s) −391,2 −289,9 143,0 KCl (s) −435,9 −408,3 82,7 O 2 (g) 0 0 205,0 Septiembre 2004 30 − Para la reacción de combustión del etanol: C 2 H 5 OH, que es un líquido a 25 ºC, conteste a las siguientes preguntas con ayuda de los datos de la tabla que se adjunta: a) Escriba la reacción y calcule su ΔG a 25 ºC. b) Calcule la variación de energía interna a 25 ºC. c) Explique si la reacción sería o no espontánea a 727 ºC (supóngase que ΔH 0f y S0 son independientes de la temperatura). Datos: R = 8,31 J∙mol−1∙K−1 C 2 H 5 OH (l) −1 ΔH (kJ∙mol ) 0 f −1 −1 S (J∙mol ∙K ) 0 O 2 (g) CO 2 (g) H 2 O (l) −277,3 0,0 −393,5 −285,8 160,5 205,0 213,6 69,9 Septiembre 2003 Página 11 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 31 − La descomposición del tetraóxido de dinitrógeno: N2O4 → ocurre ← 2 NO 2 espontáneamente a temperaturas altas. Los datos termodinámicos, a 298 K, se incluyen en la tabla adjunta. Determine para dicha reacción: a) ΔH0 y ΔS0 a 298 K. b) La variación de energía interna a 298 K. c) Si la reacción es espontánea a 298 K en condiciones estándar. d) La temperatura a partir de la cuál el proceso es espontáneo (considere que ΔH0 y ΔS0 son independientes de la temperatura). Datos: R = 8,31 J∙mol−1∙K−1 Compuesto ΔH 0f (kJ∙mol−1) S0 (J∙K−1∙mol−1) N2O4 9,2 304 NO 2 33,2 240 Junio 2002 32 − La tabla adjunta suministra datos termodinámicos, a 298 K y 1 atm, para el agua en estado líquido y gaseoso. a) Calcule ΔH0 , ΔS0 y ΔG0 para el proceso de vaporización del agua. b) Determine la temperatura a la que las fases líquida y gaseosa se encuentran en estado de equilibrio (considere que ΔH0 y ΔS0 no cambian con la temperatura). Datos: Compuesto ΔH 0f (kJ∙mol−1) S0 (J∙K−1∙mol−1) H 2 O (l) −286 70 H 2 O (g) −242 188 Septiembre 2002 33 − Sabiendo que la temperatura de ebullición de un líquido es la temperatura a la que el líquido puro y el gas puro coexisten en el equilibrio a 1 atm de presión, es decir: ΔG = 0, y considerando el siguiente proceso: Br 2 (l) → ← Br 2 (g) : 0 a) Calcule ΔH a 25 ºC. b) Calcule ΔS0. c) Calcule ΔG0 a 25 ºC e indique si el proceso es espontáneo a dicha temperatura. d) Determine la temperatura de ebullición del Br 2 , suponiendo que ΔH0 y ΔS0 no varían con la temperatura. Datos a 25 ºC: 30,91 kJ∙mol−1 ΔH 0f [Br 2 (g)] = 0 ΔH 0f [Br 2 (l)] = 0 S [Br 2 (g)] = 245,4 J∙K−1∙mol−1 0 S [Br 2 (l)] = 152,2 J∙K−1∙mol−1 Septiembre 2006 Página 12 Ejercicios de acceso a la Universidad − Problemas de Termoquímica 34 − La tostación de la pirita (FeS 2 ) se produce, en presencia de oxígeno, dando como productos el óxido de hierro (III) y el dióxido de azufre. a) Escriba la reacción ajustada. b) ¿Cuántos kilogramos de óxido de hierro (III) se obtienen al tratar media tonelada de una pirita del 80 % de riqueza en FeS 2 ?. c) ¿Qué volumen de aire, medido en c. n. (273 K y 1 atm) se necesita para tostar dicha cantidad de pirita, sabiendo que el aire contiene un 21 % en volumen de O 2 ?. (Suponga que el resto de los componentes de la pirita no consumen oxígeno). Datos: Masas atómicas (u): O = 16,00 , S = 32,06 , Fe = 55,85. Modelo 2000 Página 13 PROBLEMAS RESUELTOS VOLUMEN II Ejercicios de acceso a la Universidad − Examen de junio de 2009 − Opción A − Problema 1 Página 15 Ejercicios de acceso a la Universidad − Examen de junio de 2009 − Opción A − Problema 1 Página 16 Ejercicios de acceso a la Universidad − Examen de junio de 2001 − Opción A − Problema 2 Página 17 Ejercicios de acceso a la Universidad − Examen de junio de 2001 − Opción A − Problema 2 Página 18 Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Opción A − Problema 1 Página 19 Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Opción A − Problema 1 Página 20 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Opción A − Problema 1 Página 21 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Opción A − Problema 1 Página 22 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Opción B − Problema 1 Página 23 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Opción B − Problema 1 Página 24 Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Opción A − Problema 1 Página 25 Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Opción A − Problema 1 Página 26 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Opción A − Problema 1 Página 27 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Opción A − Problema 1 Página 28 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Opción A − Problema 1 Página 29 Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Opción A − Problema 1 Página 30 Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Opción A − Problema 1 Página 31 Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Opción A − Problema 1 Página 32 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Opción A − Problema 1 Página 33 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Opción A − Problema 1 Página 34 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Opción A − Problema 1 Página 35 Ejercicios de acceso a la Universidad − Examen de junio de 2002 − Opción B − Problema 1 Página 36 Ejercicios de acceso a la Universidad − Examen de junio de 2002 − Opción B − Problema 1 Página 37 Ejercicios de acceso a la Universidad − Examen de junio de 2002 − Opción B − Problema 1 Página 38 Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Opción B − Problema 2 Página 39 Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Opción B − Problema 2 Página 40 Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Opción A − Problema 1 Página 41 Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Opción A − Problema 1 Página 42 Ejercicios de acceso a la Universidad − Modelo de examen para 2000 − Opción B − Problema 2 Página 43 Ejercicios de acceso a la Universidad − Modelo de examen para 2000 − Opción B − Problema 2 Página 44