Métodos turbidimétricos
Anuncio

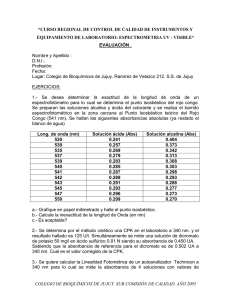
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA DE ALIMENTOS NOMBRE: IvonneVásquez CURSO: 9º Alimentos FECHA: Lunes 18-04-2011 LABORATORIO DE BIOTECNOLOGIA CONSULTA: “DENSIDAD OPTICA (ABSORBANCIA) Y TURBIDIMETRIA PARA CUANTIFICACIÓN DE BIOMASA” Métodos turbidimétricos (ópticos). Son métodos indirectos de medición de masa celular. La base común de estos métodos consiste en la medición de la cantidad de luz dispersada o transmitida a través de un cultivo bacteriano. Las suspensiones bacterianas dispersan la luz, al igual que cualquier partícula pequeña suspendida en agua (efecto Tyndall). La dispersión de la luz es, dentro de ciertos límites, proporcional a la masa del cultivo. a) Espectrofotómetro: Mide la densidad óptica (D.O.), es decir la absorbancia (una medida de la luz transmitida a través de la suspensión). - Hay que realizar una curva estándar para relacionar los valores de A con la masa bacteriana en una muestra problema. - La cantidad de luz dispersada es proporcional al cociente entre el tamaño de la partícula y la longitud de onda incidente; la sensibilidad de la técnica aumenta pues a longitudes de onda (l) cortas. La proporcionalidad entre A y masa bacteriana sólo es válida para >107céls/ml. b) Nefelómetro: mide la luz dispersada por una solución de partículas. Posee mayor sensibilidad que el espectrofotómetro Las fases de crecimiento de una población bacteriana pueden determinarse midiendo la turbidez del cultivo. Aunque dicha turbidez no es una medida directa del número de células, su incremento es una indicación del crecimiento bacteriano. El cambio de luz se registra en el espectrofotómetro como porcentaje de transmisión (cantidad de luz transmitida) y absorbancia o densidad óptica (D.O.), valor derivado del porcentaje de transmisión, correspondiente al log del cociente entre la intensidad de luz incidente sobre la suspensión (Io) y la de la luz transmitida por la suspensión A = log Io/I Turbidimetría: La turbidimetría mide la reducción de la transmisión de luz debido a partículas de una suspensión y cuantifica la luz residual transmitida. Estudios teóricos y experimentales han mostrado que soluciones diluidas de diferentes tipos de bacterias, independientemente del tamaño celular, tienen casi la misma absorbancia por unidad de concentración de peso seco. Esto quiere decir que, en soluciones diluidas, la absorbancia es directamente proporcional al peso seco, independientemente del tamaño celular del microorganismo. Sin embargo, se encuentran absorbancias muy diferentes por partícula o por UFC cuando los tamaños de las células bacterianas son diferentes. Por esta razón, para estimar el número de microorganismos totales o el número de microorganismos viables de una suspensión bacteriana debe realizarse una "curva de calibración" con cada tipo de microorganismo, sólo de esta forma es posible relacionar Absorbancia (Densidad Óptica) con el número de microorganismos totales o con UFC. Peso seco: Concentración celular bacteriana expresada en unidades de peso seco (µg/ml-mg/ml). La relación directa entre la absorbancia y el peso seco sólo se aplica para suspensiones diluidas de bacterias. Estas suspensiones no deben tener una absorbancia mayor a 0.3, ya que valores mayores producen desviaciones de la ley de Beer. Sin embargo, el inconveniente de utilizar suspensiones diluidas puede involucrar un mayor error de pipeteo y menor sensibilidad por el bajo nivel de absorción. VENTAJAS Y DESVENTAJAS DEL METODO DE CUANTIFICACION DE BIOMASA Los métodos de dispersión de la luz son las técnicas más utilizadas para monitorear el crecimiento de los cultivos bacterianos. Son muy útiles y poderosos pero pueden llevar a resultados erróneos. Principalmente, dan información sobre el peso seco (contenido macromolecular). Ventajas - Son métodos rápidos. - La turbidimetría puede realizarse en espectrofotómetros de radiación visible o UV. - La fuente de radiación más frecuentemente usada es la lámpara de wolframio, pero pueden utilizarse otras fuentes de radiación visible. Desventajas - Cuantificar microorganismos vivos y muertos. - Útil para densidades microbianas bajas de microorganismos unicelulares y tamaños de unos cuantos micrómetros. - Para microorganismos más grandes y productores de polisacáridos esta metodología no es adecuada. BIBLIOGRAFÍA: 1. http://www.ucm.es/info/mfar/pdfs/guias/Guia_Indus.pdf 2. http://www.microinmuno.qb.fcen.uba.ar/SeminarioRecuento.htm 3. http://www.ugr.es/~eianez/Microbiologia/12crecimiento.htm#_Toc58934319