MALARIA VACUNAS - Sabin Vaccine Institute
Anuncio

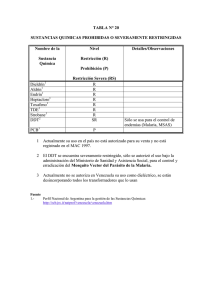
MALARIA VACUNAS Alejandro Llanos Cuentas, MD, PhD Universidad Peruana Cayetano Heredia Curso de Vacunología, Lima, 21-23 Octubre 2013 Malaria: Etiología 4 especies del género Plasmodium infectan humanos. 3 causan malarias mal llamadas “benignas”: P. vivax, P. ovale, P. malariae. 1 asociada a malaria maligna: P. falciparum (responsable de la mayoría de muertes y casos severos). Ciclo de vida de P. falciparum Ref. White N. et al. www.thelancet.com htpp://dx.doi.org/10.1016/S0140-6736(18) 60024-0 Diferencias Biológicas de los parásitos de la malaria humana Characteristics Exoerythrocytic hepatic phase (days) Erythrocytic cycle Hypnozoites (relapses) No. Merozoites per hepatic schizont Erythrocyte preference Maximun duration of untreated infection (years) P.falciparum P.vivax P.ovale P.malarie 5.5 8 9 15 2 No 30,000 2 Yes 10,000 2 Yes 15,000 3 No 2,000 Young RBC 2 Reticul. 4 Reticul. 4 Old RBCs 40 Diferencias biológicas entre P. falciparum y P.vivax Tienen origen filogenético diferente. P. vivax proviene de una especie que infecta macacos en el Sud-oeste asiático hace 45,680 a 81,607 años. P. falciparum proviene de una especie de que infecta gorilas en África, ± 60,000 años. Epidemiologia de la malaria Situación de la malaria en el Mundo y el Perú Incidencia Global – P. falciparum WHO, 2005 Distribución Geográfica de Malaria: endemicidad en 2010 65%) 4.5% 10-20% 12.5% Gething P.W. et al. PLOS Neg. Trop. Dis. 6(9): e1814, 2012 Diferencias Epidemiológicas P. vivax Carga total mundial 132-391 millones 80-90% casos fuera de África Asia, Américas, África e Islas del Pacífico. Américas (2008): 560,298 casos, 96% vivax. Enfermedad afecta todas las edades. Epidemiología pobremente entendida (hipnozoitos, rol asintomáticos, efecto desordenes hereditarios). P. falciparum Carga mundial 150-180 millones > 80% casos en África Afecta principalmente niños (< 3 años), gestantes y ancianos. Causa > 90% muertes por malaria en el mundo. Mayor conocimiento biológico Fuerza infección es mejor conocida Epidemiologia de la Malaria en las Américas Nivel de endemicidad, estacionalidad y tendencias en la última década en relación a intervenciones. El patrón de transmisión de malaria en América Latina (AL) es inestable, estacional, con meses de alta transmisión, con variaciones geográficas en la región, aún en cada país (gran importancia de los factores climatológicos). 21 países de AL han reportado malaria in 2008, con un total de 560.298 casos, 89% de la malaria está concentrada en la región Amazónica. En la última década la tendencia es disminuir: De 1'187,591 casos en el 2000 a 560.298 casos en el 2008 Representa una reducción de aproximadamente 47% (53% of P.f y 43% of P.v) Desde el 2005 la reducción es mayor (implementó los programas apoyados por el FG), aproximadamente 30% entre 2005-2008. Epidemiología de la Malaria en LA Endemicidad: 80% de la malaria in LA es de origen rural, concentrada en focos. En 2008: 1.963 municipios reportaron ≥ 1 caso de malaria, 933 (47.5%) de ellos reportaron > 10 cases. La focalización es mayor en malaria por P. falciparum (Pf), donde 394 municipios reportaron > 10 casos y solo 109 > 250 casos. 50% de la carga de la enfermedad esta concentrada en 44 municipios, la mayoría localizados en Brasil, Colombia, Guyana, Haití, Perú y Venezuela. 9 países (42.8%) han reportado incidencias > 1%. Epidemiología de la Malaria en LA Diferencias de edad de los cuadros de malaria clínica según la especie de Plasmodium. El 66% de los casos de malaria ocurren > 15 años y solo el 11% en niños <5 años, el 23% en niños entre 5 a 15 años. Hay una marcada diferencia con P.f. en África, donde el 80% casos ocurren < 3 años. Mortalidad por P. falciparum / P. vivax. La mortalidad por malaria en la región es muy baja. Ha disminuido el 75% entre el 2000 al 2008 > 2005 la reducción ha sido aún más acentuada (52%). Por lo tanto, la Estrategia de vacunación en las Américas debería ser diferente al África; todos los grupos edad deberían de ser vacunados. Problema de malaria por F. falciparum 90% de la malaria en el mundo ocurre en al África sub- Sahariana. Niños africanos son los que tienen mayor riesgo de desarrollar malaria severa. Este es el grupo priorizado en la vacunación Estimado que un millón de niños mueren por malaria en África. En promedio, cada niño africano experimenta un ataque de malaria por año. Representa 200 millones de episodios por año. De ellos, 4 a 6 millones desarrollan malaria severa. Tasa de letalidad en niños hospitalizados en 10% a 50%. Cada episodio de malaria la tasa de letalidad es 0.5 a 2% Ref. White N. et al. www.thelancet.com htpp://dx.doi.org/10.1016/S0140-6736(18) 60024-0 Estrategias de control de malaria en el Perú El PAMAFRO ha sido un programa integral de control de malaria, con estrategias de control focalizadas en comunidades según sus niveles de endemicidad. Incluye: Entrenamiento del personal de salud y promotores de salud en el diagnóstico y tratamiento precoz de malaria a nivel rural y en áreas remotas. Mejoría de la red de diagnóstico e implementación de pruebas rápidas en lugares de pobre accesibilidad. Mejoría de la logístico y distribución y almacenamiento del tratamiento. Distribución de mosquiteros impregnados, prioridad niños y gestantes y intentando tener coberturas > 80%. Mejoría del sistema de reporte. Activa participación de las poblaciones afectadas por malaria a través de sus municipalidades u organizaciones comunales, desarrollo de planes de salud e implementación de acciones para el control de malaria por l población. FORTALECIMIENTO DE SERVICIOS DE SALUD OBJETIVO 1 Encuesta CAP Estudio social Capacitación PROM Y PREV Planes y Proyectos participativos Protección: Mosquiteros OBJETIVO 3 TCS SICOVE Sistema de vigilancia comunitario CAPACITACION (Prom, Prev, Dx, Tto) Vigi Epid. INVESTIGACION -Ministerio -Localidades Sist. Referencia GIS Salas de Situaciones Boletines Epidemiológicos de zonas homogéneas Notificación oportuna Tele educación OBJETIVO 4 Red comunicaciones Articulación Serv. Salud y Comunidad CONTROL MALARIA PAMAFRO TS OBJETIVO 2 Mejorar capacidad diagnóstica (Microsc. y PDR). Insumos de Dx Medicamentos DESARROLLO COMUNITARIO MODELO PLATAFORMA DEL PAMAFRO CIMDER FUNSAD DESARROLLO COMUNITARIO OPERACIONALIDAD MINSA / COMUNIDAD SOSTENIBILIDAD COMUNIDAD / MINSA Organización Regional MINSA ORGANIZACIÓN DE SERVICIOS (inadecuada, impacto limitado) FORTALECIMIENTO DE LOS SERVICIOS DE SALUD CAB MINSA PAMAFRO PU FO EHAS ISPM CAPACITACION RRHH (insuficiente e incompleta) DIAGNOSTICO Y TRATAMIENTO IDENTIFICACION (“filosofía”) VIGILANCIA EPIDEMIOLOGICA MEDIOS DE COMUNICACION REPORTE Y COMUNICACIÓN (extemporánea, sin impacto) Cambio en la concepción de prevención Y promoción control sostenido DESARROLLO COMUNITARIO Indicadores Epidemiológicos (IPA, IVA e IFA) de la malaria en Perú Reducción 80% Tendencia de malaria en Loreto, Perú, 2002-2010 El problema: El resurgimiento Resumen Las vacunas son un componente más en el control y eliminación de la malaria. Como medida única es muy difícil que consiga el control y/o eliminación malaria. No es una justificación para el desarrollo de vacunas antimaláricas: Que las medidas de control progresivamente son menos efectivas, aunque si inestables y se requiere estrategias diferenciadas según escenarios. El incremento de la resistencia de los parásitos a las drogas antimaláricas. El incremento de la resistencia de los mosquitos a los insecticidas. Desarrollo de vacunas antimaláricas Marco Mucho tiempo, esfuerzo y dinero se ha gastado en obtener una vacuna para malaria. 1910 – 1950: Numerosos intentos en modelos humanos, primates y aves 1967: Ruth Nussenzweig - inmunización de roedores inoculados con esporozoítos de P. berghei irradiados 1980: Los Nussenzweig describieron una proteína que recubre al parásito (componente fundamental de mitad de las futuras vacunas) Vacunas para malaria Objetivo en producción : desarrollar una vacuna con eficacia al 80% y que brinde protección por al menos 4 años al 2025. Objetivo principal a corto plazo : desarrollar una vacuna que tenga protección por lo menos del 50% y proteja de la enfermedad severa y muerte más de un año. Desafíos para la vacuna para malaria Científicos: No existe aún vacuna contra algún protozoario Plasmodium sp tiene > 6000 genes Aún no hay forma de predecir éxito en un candidato Comerciales: Sólo para países pobres Producto de alto costo y alto riesgo Proceso invasión del Esporozoíto y Merozoíto a las células blanco Patarroyo M.E., et al. Expert Rev. Vaccines 11(9): 1057-1070, 2012 Infección de Plasmodium falciparum a los glóbulos rojos Protección La inmunidad en malaria es específica contra especie y cepa. Diversidad del repertorio genético de los diferentes estadios del parásito. Polimorfismo de las proteínas parasitarias. Por lo tanto, se requiere Supervacuna para generar inmunidad por encima de la inmunidad natural. Consideraciones para el desarrollo de vacunas Diversidad del parásito El objetivo inmunológico de la vacuna anti-parásito – dirigida al origen (parásito) Inmunidad anti-tóxica – dirigida a los síntomas Inmunidad Blancos potenciales. Mezcla de componentes – efecto aditivo o sinérgico. Conservación y adyuvantes. Estrategias Vacunas pre eritrocíticas Vacunas para bloquear la transmisión Vacunas contra los Estadios hemáticos Reproduced from the Malaria Vaccine Initiative website at www.malariavaccine.org, [06Jul2010]. Vacunas Pre-Eritrociticas Objetivo: Proteger contra los estadios tempranos de la infección Dirigidas contra los esporozoítos y las formas asexuadas que se alojan en el hígado. Evitar la liberación de merozoítos primarios hacia la circulación interrumpiendo el proceso infeccioso y las manifestaciones clínicas de la enfermedad. Incluyen: Proteínas recombinantes o desarrolladas genéticamente o antígenos de superficie del parásito o de células hepáticas infectadas. Vacunas de DNA con información genética para producir antígenos de la vacuna en el receptor de esta. Vacunas vivas atenuadas con una forma atenuada del parásito (esporozoíto) como principal componente. Vacunas Pre-Eritrocíticas Esta vacuna induce anticuerpos contra la proteína circumesporozoito (CS) Produce una respuesta inmune no protectora debido a la variabilidad entre cepas Base de la vacuna RTS, S/ASO2A Candidatos contra los estadios Hemáticos Objetivo: Dirigido contra el Plasmodium en su estadio más destructivo, de rápida replicación en el hepatocito, que liberan a los merozoítos. No bloquea la infección. Disminuye el número de parásitos en sangre con lo cual se reduce la severidad de la enfermedad. Incluyen: Antígenos o proteínas de superficie del estadio hematógeno del parásito (merozoito) que permitiría desarrollar inmunidad natural con menor riesgo de enfermedad. Candidatos que bloquean la transmisión Objetivo: Interrumpir el ciclo de vida del parasito, induciendo anticuerpos que previenen su maduración en el mosquito (fase sexuada), impidiendo la formación de esporozoítos infecciosos en las glándulas salivales del anopheles. No previene la enfermedad Limita la transmision de malaria Se espera que reduzca la morbimortalidad asociada a malaria en comunidades de alto riesgo. Incluyen: Gametocitos para prevenir la fertilización: Ags Pfs 48/45 y Pf 230 Zigotos y oocinetos para prevenir el desarrollo posfertilización: Pfs 25 y 28 PENETRACION EN ESTOMAGO DEL OOCISTO DESARROLLO DE OOCISTOS ESPOROCISTO RUPTURA DEL ESPOROCISTO DESENVOLVIMENTO DE OOCISTOS ESPOROCISTOE LOCALIZACION DE ESPOROZOITOS EN LAS GLÁNDULAS SALIVALES AC Vacunas Existen al menos 58 vacunas diferentes 17 están/tienen estudios clínicos Mayoría tienen antígenos de esporozoítos / merozíotos. Vacuna SPf66 Primera vacuna multiepítope, químicamente sintetizada que contiene 3 proteínas derivadas del merozoito y una del esporozoito. Selecciona como candidatos a vacuna aquellas regiones que el parásito utiliza para adherirse e invadir al eritrocito. Problema: moléculas de alta capacidad de adherirse de unión en las células blanco y que a su vez son conservadas entre las cepas del Plasmodium no suelen despertar respuestas inmunológicas fuertes. En estudios poblacionales controlados: no eficacia Vacuna RTS,S/ASO2A Desarrollada por Pedro Alonso y col. Principal candidato contra P. falciparum Ensayo clínico Fase III, para demostrar eficacia Objetivo: Proteger infantes y niños de zonas endémicas de África Sub-Sahariana. Dirigida contra la CSP cepa NF54 de P. Falciparum Ensayo clínico Fase IIb en Mozambique en 2,022 niños* Reduce la malaria clínica en un 29.9% (p=0.004) Reduce la malaria severa: 57.7% (p=0.019) *Alonso et al, Lancet. 2004;364(9443):1411-20. Vacuna RTS,S/ASO2A Sus componentes principales son: RTS (polipéptido de cadena simple de la proteína CS) y S (polipéptido de 226 aminoácidos) HBsAg como portador ASO2A – emulsión de lípidos (adyuvante) => ASO1A (vehículo liposomal) – ha demostrado inducir mayores niveles de Ac y respuesta Th1 contra CSP AS02A IFN∂ AC RTS AC HBAgs LT IFN∂ hellper AC IFN∂ S AC PERFIL RST Una vacuna que protegerá contra malaria clínica y las formas severas de malaria por Plasmodium falciparum niños residentes en zonas endémicas Generalmente bien tolerada y segura Compatible con esquemas de vacunación (DTPw , HBV , Hib, OPV…) Complemento de las otras estrategias de control de malaria 7 países africanos 11 centros Enrolados: 15,460 niños 6-12 sem: 6,537 niños 5-17 meses: 8,923 niños RTS,S Phase 3 trial network 3 dosis vacuna Intervalo 1 mes Refuerzo 18 meses Eficacia de la vacuna RTS,S/AS01 en malaria clínica por P. falciparum en niños africanos Año Análisis Edad Eficacia Seguimiento 55.8% 12 m A. Malaria Clínica 2011(a) Primer episodio 5-17 meses (i95%IC: 50.6-60.4) Todos los episodios 5-17 meses 55.1% 12 m (95%IC: 50.5-59.3%) 2012(b) Primer episodio 6 – 12 sem. 31.3% 14 m (95%IC: 23.6-38.3) Todos los episodios 6 – 12 sem. 32.9% (95%IC:26.3-38.8%) a. b. N Eng J Med 2011; 365:1863-75 N Eng J Med 2012; 367:2284-95 14 m Eficacia de la vacuna RTS,S/AS01 en malaria severa por P. falciparum en niños africanos Año Análisis Edad Eficacia Seguimiento 47.3% 12 m B. Malaria Severa 2011(a Per protocol 5-17 meses (95%IC: 22.4-64.2%) Intention-to-treat 5-17 meses 45.1% 12 m (95%IC: 23.8-60.5%) 2012(b) Per protocol 6 – 12 sem. 36.6% 14 m (95%IC: -7.4-48.6%) Intention-to-treat 6 – 12 sem. 26.0% (95%IC: -1.9-49.4%) a. b. N Eng J Med 2011; 365:1863-75 N Eng J Med 2012; 367:2284-95 14 m 5 a 17 meses 6 a 12 semanas Since 338:871-872, 16 Nov. 2012 Eficacia de la vacuna RTS-S = 31% en niños de 6 a 12 meses Vacunas para P. vivax Ciclo biológico de la infección por P.vivax Infección de Plasmodium vivax a los reticulocitos Figura 2. El rol de la proteína “Duffy-Binding Protein” (DBP), en la invasión de reticulocitos por merozoitos de P. vivax. (A) El merozoito se pega a la superficie de la célula, la DBP, es localizado en los micronemas del parásito (en color verde). Luego de una reorientación del merozoito, se libera la DBP. (B) Modelo de unión entre PvDPB y el antígeno/receptor Duffy para quimoquinas “Duffy antigen/receptor for chemokines” (DARC) presente en el reticulocito (Figura tomado de Beeson y Crabb, 2007). Vacuna contra P.vivax Los estudios a nivel mundial durante últimos 30 años han estado orientados al estudio de la biología de P. falciparum, lo cual ha permitido profundizar en el desarrollo de una vacuna. P. vivax es un parásito olvidado, solo en la última década se ha tomado conciencia sobre el pobre conocimiento que se tiene en su biología. En el intento de crear una vacuna contra P. vivax, se han implementado diferentes metodologías: la inmunización con esporozoítos irradiados la expresión de antígenos parasitarios de manera recombinante el uso de péptidos sintéticos. Vacuna contra P.vivax 2 La principal limitación en el desarrollo de una vacuna para P. vivax ha sido la dificultad de mantener un sistema de cultivo continuo in vitro dado su tropismo por los reticulocitos. Con la publicación de la secuencia genómica completa de P. vivax, y los estudios orientados a comparar su perfil de transcripción genético con P. falciparum durante su ciclo de vida intraeritrocítico, han surgido nuevas posibilidades para encontrar antígenos candidatos para una vacuna en P. vivax. Candidatos a la vacuna pre-eritrocítica A la fecha, se ha evaluado el potencial como candidatos a vacuna de varias proteínas de los distintos estadios de vida del parásito (pre-eritrocítico, sanguíneo y sexual); A. Candidatos a la vacuna pre-eritrocítica: mediante este método se pretende prevenir la invasión de los esporozoitos a los hepatocitos, o impedir el desarrollo del parásito dentro de la célula hepática. En P. vivax, solo 2 antígenos han sido evaluados como candidatos a vacuna pre-eritrocítica: CSP (Circumsporozoite Surface Protein) SSP2 (Sporozoite Surface Protein 2) mejor conocida como TRAP (Thrombospondin Related Adhesive Protein). Candidatos a la vacuna pre-eritrocítica CSP es uno de los antígenos más estudiados, en el cual se han identificado tres péptidos que causan una fuerte respuesta humoral en el modelo Aotus. Las pruebas clínicas de fase 1 han mostrado que los péptidos estudiados son inmunogénicos, y se pretende evaluar su eficacia protectiva en pruebas de fase 2. Candidatos a la vacuna pre-eritrocítica SSP2 es una proteína de superficie del esporozoíto que media la adhesión del parásito a las células del huésped y la invasión celular a los hepatocitos. Recientemente, se ha encontrado que la inmunización de monos Aotus con péptidos localizados en la región N-terminal del antígeno SSP2 proveen protección parcial en el modelo animal; sin embargo, los resultados de protección no fueron estadísticamente significativos cuando se compararon con el grupo control. b. Candidatos a vacuna de estadio asexual Finalidad es el bloqueo de la invasión a los reticulocítos (posible relación con severidad clínica). Antígenos candidatos, que están siendo evaluados: DBP (Duffy Binding Protein), es importante en la interacción de los merozoítos con el antígeno Duffy de los reticulocitos. Este antígeno es conservado funcionalmente y pertenece a la familia de proteínas de unión al eritrocito EBP (Erythrocyte Binding Proteins). La inmunización con fragmentos recombinantes de la proteína en el modelo Aotus bloquea eficientemente la unión a los reticulocítos. Candidatos a vacuna de estadio asexual MSP-1 (Merozoite SurfaceProtein 1), es una proteína de membrana que media la interacción parásito-hospedador. Se ha demostrado una fuerte respuesta humoral en animales inmunizados MSP-1, que los protege parcialmente de la infección. Estudios realizados en la Fundación Instituto de Inmunología de Colombia (FIDIC) han mostrado en modelo Aotus, que la mezcla de dos proteínas recombinantes derivadas de MSP-1 emulsificadas en Adyuvante de Freund, induce una respuesta inmune protectiva que oscila entre el 50% y 80% en los animales inmunizados Candidatos a vacuna de estadio asexual AMA-1 (Apical Merozoite Antigen 1), es una proteína que participa en el proceso de reorientación apical del parásito y posterior formación del tight junctione invasion. La inmunogenicidad de este antígeno ha sido evaluada en primates de la especie Macaca mulatta, con producción de títulos altos de anticuerpos, mostrando el potencial de esta proteína como candidato a vacuna RBP-1 (Reticulocyte Binding Protein 1) RAP-2 (Rhoptry-Associated Protein 2), MSP-9 MSP-10 c. Candidatos a Vacuna de bloqueo de transmisión Han sido usados como estrategia para el control de la transmisión de la malaria en áreas de baja intensidad de transmisión. Los principales antígenos de superficie que presentan niveles altos de expresión en el estadio de ooquineto, y además se encuentran altamente conservados en diversos aislados clínicos, corresponden a Pvs25 y Pvs28. Se conoce que estas proteínas presentan un sitio de anclaje a GPI y 4 dominios del factor de crecimiento epidémico (EGFlikedomain). Proteínas recombinantes de Pvs25 y Pvs28 muestran ser altamente inmunogénicas e inducen anticuerpos que bloquean la invasión en ratones y monos. Candidatos a Vacuna de bloqueo de transmisión Recientemente, se identificó una proteína de superficie de gametos denominada Pvs230. Ratones inmunizados con la región I-IV de la molécula emulsificada en Vaxfectin, han desarrollado anticuerpos que reducen significativamente el desarrollo de oocitos formados dentro del intestino del mosquito. Resumen Con este panorama, se muestra el limitado avance en el desarrollo de una vacuna contra P. vivax. Se resalta la necesidad de desarrollar una metodología más eficiente. De acuerdo a reportes recientes, una vacuna antimalárica efectiva debe contener varias proteínas de merozoíto y esporozoíto que se encuentren involucradas en la invasión a sus células blanco. Se establece que el conocimiento de los antígenos que interactúan con los eritrocitos, es importante al desarrollar una vacuna completamente efectiva contra esta enfermedad. Aún no hay vacuna efectiva contra malaria, sin embargo no hay que descorazonarse!! Gracias