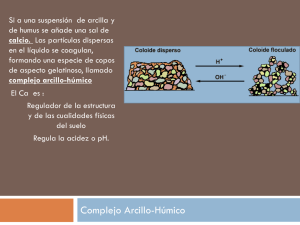
COORDINACIÓN IÓNICA TAMAÑO DEL IÓN O2- The glass
Anuncio
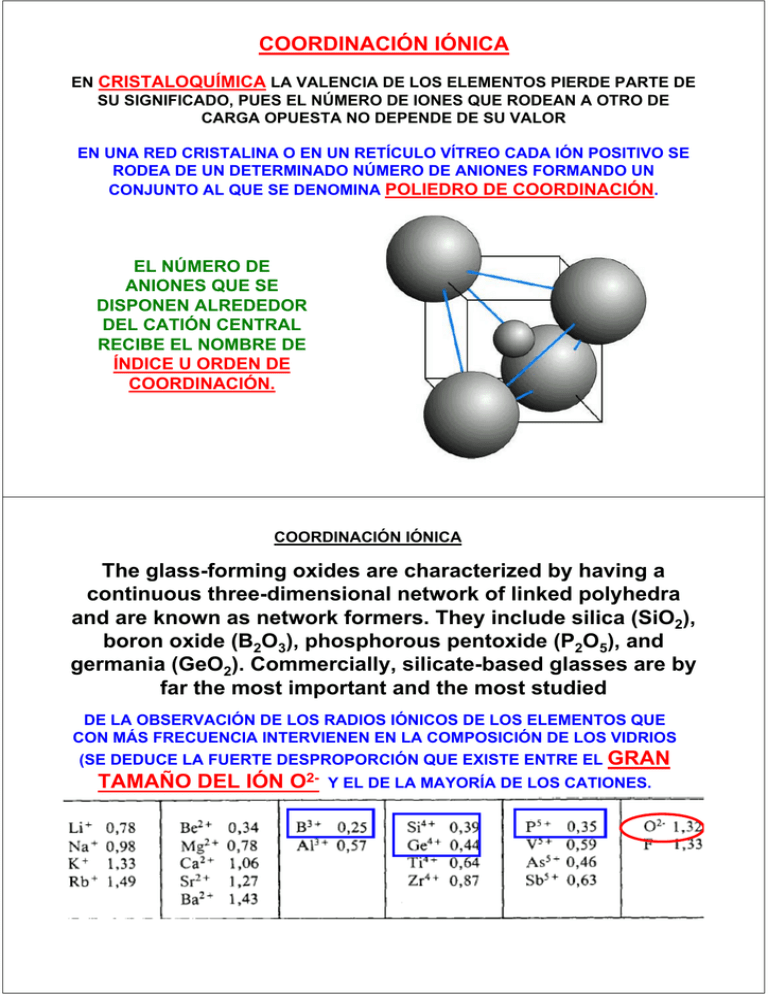
COORDINACIÓN IÓNICA EN CRISTALOQUÍMICA LA VALENCIA DE LOS ELEMENTOS PIERDE PARTE DE SU SIGNIFICADO, PUES EL NÚMERO DE IONES QUE RODEAN A OTRO DE CARGA OPUESTA NO DEPENDE DE SU VALOR EN UNA RED CRISTALINA O EN UN RETÍCULO VÍTREO CADA IÓN POSITIVO SE RODEA DE UN DETERMINADO NÚMERO DE ANIONES FORMANDO UN CONJUNTO AL QUE SE DENOMINA POLIEDRO DE COORDINACIÓN. EL NÚMERO DE ANIONES QUE SE DISPONEN ALREDEDOR DEL CATIÓN CENTRAL RECIBE EL NOMBRE DE ÍNDICE U ORDEN DE COORDINACIÓN. COORDINACIÓN IÓNICA The glass-forming oxides are characterized by having a continuous three-dimensional network of linked polyhedra and are known as network formers. They include silica (SiO2), boron oxide (B2O3), phosphorous pentoxide (P2O5), and germania (GeO2). Commercially, silicate-based glasses are by far the most important and the most studied DE LA OBSERVACIÓN DE LOS RADIOS IÓNICOS DE LOS ELEMENTOS QUE CON MÁS FRECUENCIA INTERVIENEN EN LA COMPOSICIÓN DE LOS VIDRIOS (SE DEDUCE LA FUERTE DESPROPORCIÓN QUE EXISTE ENTRE EL GRAN TAMAÑO DEL IÓN O2- Y EL DE LA MAYORÍA DE LOS CATIONES. COORDINACIÓN IÓNICA CARACTERÍSTICAS DE LOS IONES QUE DETERMINAN LA ESTRUCTURA CRISTALINA: 1.- EL VALOR DE LA CARGA ELÉCTRICA DE LOS IONES COMPONENTES 2.-TAMAÑOS RELATIVOS DE CATIONES Y ANIONES CON RESPECTO A LA PRIMERA CARACTERÍSTICA, EL CRISTAL DEBE SER ELÉCTRICAMENTE NEUTRO, O SEA, TODAS LAS CARGAS POSITIVAS DE LOS CATIONES DEBEN SER EQUILIBRADAS POR UN NÚMERO IGUAL DE CARGAS NEGATIVAS DE LOS ANIONES. LA FÓRMULA QUÍMICA DE UN COMPUESTO INDICA EL COCIENTE ENTRE LOS CATIONES Y LOS ANIONES, O SEA, LA COMPOSICIÓN PARA LA CUAL SE PRODUCE ESTE EQUILIBRIO. EN EL FLUORURO DE CALCIO, CADA IÓN DE CALCIO TIENE UNA CARGA DE +2 (Ca2+) MIENTRAS QUE CADA IÓN DE FLÚOR TIENE ASOCIADA UNA BOLA CARGA NEGATIVA (F-). POR CONSIGUIENTE, EL NUMERO DE IONES FDEBE SER EL DOBLE DEL DE IONES Ca2+, LO CUAL SE REFLEJA EN LA FORMULA QUÍMICA CaF2. RADIO IONICO EL VALOR DEL RADIO DE UN IÓN DEPENDE EN PRIMER LUGAR DEL SIGNO DE SU CARGA. LOS IONES POSITIVOS (CATIONES) SON SIEMPRE MÁS PEQUEÑOS QUE EL ÁTOMO NEUTRO Y, TANTO MÁS, CUANTO MÁS ELEVADA SEA SU CARGA, DEBIDO A LA CONTRACCIÓN ORBITAL PRODUCIDA POR EFECTO DEL EXCESO DE LA CARGA POSITIVA CONTENIDA EN EL NÚCLEO. LA AUSENCIA DE UNO O VARIOS ELECTRONES DISMINUYE LA FUERZA ELÉCTRICA DE REPULSIÓN MUTUA ENTRE LOS ELECTRONES RESTANTES, PROVOCANDO EL ACERCAMIENTO DE LOS MISMOS ENTRE SÍ Y AL NÚCLEO POSITIVO DEL ÁTOMO, DE LO QUE RESULTA UN RADIO IÓNICO MENOR QUE EL ATÓMICO. F =k q +q − d2 RADIO IONICO EN EL CASO DE LOS IONES NEGATIVOS (ANIONES). EL FENÓMENO ES EL CONTRARIO, EL EXCESO DE CARGA ELÉCTRICA NEGATIVA OBLIGA A LOS ELECTRONES A ALEJARSE UNOS DE OTROS PARA RESTABLECER EL EQUILIBRIO DE FUERZAS ELÉCTRICAS, DE MODO QUE EL RADIO IÓNICO ES MAYOR QUE EL ATÓMICO LOS IONES NEGATIVOS SON SIEMPRE MÁS VOLUMINOSOS QUE EL ÁTOMO NEUTRO ORIGINAL. F =k q +q − d2 LA NUBE ELECTRÓNICA DE UN ÁTOMO O SU IÓN NO ES RÍGIDA, POR LO TANTO, SON SUSCEPTIBLES A SER POLARIZADAS O DEFORMADAS POR UNA FUERZA EXTERNA Y EN ESTE CASO, POR LA FUERZA GENERADA POR EL NÚCLEO DE OTRO ÁTOMO O ION LOS CATIONES DEBIDO A LA ALTA CONCENTRACIÓN DE CARGA ELÉCTRICA, SON MÁS EFECTIVOS EN LA DEFORMACIÓN DE UNA NUBE ELECTRÓNICA VECINA, ESPECIALMENTE LA DE LOS IONES NEGATIVOS, DEBIDO A SU GRAN TAMAÑO Cuando un anión es suficientemente grande y el núcleo no atrae los electrones externos (alta carga y radio grande) se considera que es polarizable “blando” Al unirse el anión electrostáticamente con una catión que tiene alta carga y pequeño tamaño, por lo que es polarizante (ablandador), se deforma su nube de electrones y se forma en cierto grado una superposición (enlace covalente) que reduce la energía de red cristalina. POLARIZABILIDAD. TENDENCIA RELATIVA DE LA NUBE ELECTRÓNICA DE UN ÁTOMO O IÓN A DISTORSIONAR SU FORMA NORMAL POR LA PRESENCIA DE UN IÓN O UN DIPOLO CERCANO, ES DECIR POR LA PRESENCIA DE UN CAMPO ELÉCTRICO EXTERNO. PODER POLARIZANTE. CAPACIDAD QUE TIENEN UN CATIÓN DE DEFORMAR UNA NUBE ELECTRÓNICA VECINA REGLAS DE FAJANS ELEMENTOS DE TRANSICIÓN ENTRE DOS CATIONES CON UNA RELACIÓN DE CARGA/RADIO SIMILAR, SERÁ MÁS POLARIZANTE EL QUE PRESENTE UNA CONFIGURACIÓN ELECTRÓNICA TÍPICA DE LOS ELEMENTOS DE TRANSICIÓN ◦ Ejemplo. El Hg2+ es más polarizante que el Ca2+ siendo que tienen prácticamente el mismo radio (102 y 100 pm respectivamente). CONFIGURACIÓN ELECTRÓNICA DEL CATIÓN LOS CATIONES DE LOS METALES DE TRANSICIÓN SON MÁS POLARIZANTES QUE LOS DE LOS GRUPOS PRINCIPALES REGLAS DE FAJANS EN EL CASO DE LOS ANIONES, SON MÁS POLARIZABLES (SE ABLANDAN MÁS) CUANDO : ◦ LA CARGA NEGATIVA ES MAYOR ◦ EL RADIO ES MAYOR EFECTOS DE LA POLARIZACIÓN (a) PAR IÓNICO IDEALIZADO SIN POLARIZAR. (b) PAR IÓNICO POLARIZADO. CATIÓN Y ANIÓN, SE POLARIZAN MUTUAMENTE. SIN EMBARGO, LA POLARIZACIÓN SIGNIFICATIVA PARA EL GRADO DE COVALENCIA ES LA DEL ANIÓN POR EL CATIÓN (c) POLARIZACIÓN SUFICIENTE PARA FORMAR UN ENLACE. EL CATIÓN HA DEFORMADO TANTO AL ANIÓN QUE SE HA FORMADO UN ENLACE COVALENTE. LAS LINEAS PUNTEADAS SIMBOLIZAN IONES HIPOTÉTICOS NO POLARIZADOS. COORDINACIÓN IÓNICA CARACTERÍSTICAS DE LOS IONES QUE DETERMINAN LA ESTRUCTURA CRISTALINA: 1.- EL VALOR DE LA CARGA ELÉCTRICA DE LOS IONES COMPONENTES 2.- LOS TAMAÑOS RELATIVOS DE LOS CATIONES Y ANIONES EL SEGUNDO CRITERIO DEPENDE DEL TAMAÑO DE LOS RADIOS IÓNICOS DE LOS CATIONES Y ANIONES, rC Y rA. COMO LOS CATIONES SON GENERALMENTE MENORES QUE LOS ANIONES, EL COCIENTE rC rA ES MENOR QUE LA UNIDAD CADA CATIÓN PREFIERE TENER A SU ALREDEDOR TANTOS ANIONES VECINOS MAS PRÓXIMOS COMO SEA POSIBLE. LOS ANIONES TAMBIÉN DESEAN UN NÚMERO MÁXIMO DE CATIONES COMO VECINOS MÁS PRÓXIMOS. LAS ESTRUCTURAS ESTABLES DE LOS MATERIALES SE FORMAN CUANDO LOS ANIONES QUE RODEAN UN CATIÓN ESTÁN TODOS EN CONTACTO CON EL CATIÓN CATION CATION COORDINACIÓN IÓNICA COORDINACIÓN ADOPTADA POR LOS CATIONES EN FUNCIÓN DE LA RELACIÓN DE RADIOS NÚMEROS Y GEOMETRÍAS DE COORDINACIÓN PARA VARIOS COCIENTES ENTRE LOS RADIOS DEL CATIÓN Y DEL ANIÓN COORDINACIÓN TRIANGULAR cos30 = r AB = A OA rC + rA AM = rA AD = 2rA AM AD = AO AC rC cos30 = rA (1 − cos30) AO = rA + rC ( AN = AD 2 − AD 2) 2 rC 1 − cos30 = ≈ 0.155 rA cos30 COORDINACIÓN TETRAEDRICA 2rA rA + rC = AC rA = 4rA2 − rA2 = rA 3 MN = AN 2 − AM 2 = 3rA2 − rA2 = rA 2 Luego: AC = AD 2 + MN 2 = (2rA )2 + 2rA2 = 6rA2 = rA 6 r +r 2rA = A C rA rA 6 r +r 2 = A C rA 6 rC 6 −2 6 = = − 1 ≈ 0.225 2 2 rA ( rA + rC ) cosα = rA rA α β rA + rC 1 − cosα = cosα rA rC β= 109.5 = 54.75 2 α = 90 − β = 90 − 54.75 = 35.25 rC 1 − cos(35.25) = = 0.225 cos(35.25) rA COORDINACIÓN OCTAEDRICA cos 45 = r AB = A OA rC + rA rC cos 45 = rA (1 − cos 45) rC 1 − cos 45 = ≈ 0.414 rA cos 45 COORDINACIÓN CUBICA ( rA + rC ) cosα = rA 1 − cosα = cosα rA rC cosα = 2rA LCUBO 3 = 2rA 1 = 2rA 3 3 1 − ⎛⎜ 1 ⎞⎟ rC 3⎠ = ⎝ = 3 −1 1 rA 3 rC rA = 3 − 1 ≈ 0.732 α COORDINACIÓN ICOSAEDRICA ( rA + rC ) cosα = rA L 2rA cosα = = D D D = rA 10 + 2 5 2rA + 2rC = D D = d 2 + L2 = d 2 + 4rA2 ( 2) d1 = L2 + L d= ( ) ( 2 ( 4 ) = L 25 2 = L2 + L ) ( 2r L L 5 L + = 1 + 5 = A 1 + 5 = rA 1 + 5 2 2 2 2 ) ( ) 2 D = d + 4r = r 1 + 5 + 4rA2 = rA 10 + 2 5 2 2 A 2 A 2rA + 2rC = D rA 10 + 2 5 = 2rA + 2rC 2rC = rA ( 10 + 2 5 − 2) rC 10 + 2 5 = − 1 ≈ 0.902 2 rA REGLAS CRISTALOQUIMICAS DE PAULING Cada catión se sitúa en el centro de un poliedro coordinado de aniones, en el que la distancia entre el catión y el anión viene dada por la suma de ambos radios, y su índice de coordinación, por la relación de éstos. EXAMPLE What coordination (number and geometry) is Li+ expected to adopt in LiCl ? rLi+ = 76.0 pm; rCl- = 181.0 pm r+ rLi+ 76.0 pm = = = 0.420 r− rCl- 181.0 pm Answer: Li+ is expected to show octahedral coordination in LiCl. Li+ is isostructural to NaCl and therefore its structure can be described as a CCP array of Cl- anions with Li+ occupying ALL octahedral holes REGLAS CRISTALOQUIMICAS DE PAULING REGLA II/PRINCIPIO ELECTROSTATICO DE VALENCIA “FUERZA DE ENLACE” PARA QUE UNA ESTRUCTURA DE COORDINACIÓN IÓNICA SEA ESTABLE, LA CARGA ELECTROSTÁTICA DE CADA CATIÓN (ANION) DEBE ESTAR NEUTRALIZADA O COMPENSADA POR LA SUMA DE LAS FUERZAS DE VALENCIA O DE ENLACE ELECTROSTÁTICO (F.E.E.) DE TODOS LOS ANIONES (CATIONES) UNIDOS AL CATIÓN (ANION), SEGÚN SU POLIEDRO DE COORDINACIÓN. DE ACUERDO CON ESTA REGLA, CONOCIDA COMO REGLA DE LA VALENCIA ELECTROSTÁTICA, LA CARGA DE CADA CATIÓN DEBE DISTRIBUIRSE POR IGUAL ENTRE TODOS LOS ANIONES A LOS QUE SE HALLE UNIDO, DANDO LUGAR A UNA DISTRIBUCIÓN SIMÉTRICA DE LAS FUERZAS DE ENLACE. POR FUERZA DE ENLACE ELECTROSTATICO (f.e.e.) SE ENTIENDE LA RELACIÓN QUE EXISTE ENTRE LA CARGA DEL CATIÓN (ANIÓN) Y SU ÍNDICE DE COORDINACIÓN Fuerza enlace = CARGA CATION ( ANION ) INDICE COORDINACION CATION ( ANION ) REGLAS CRISTALOQUIMICAS DE PAULING REGLA II LA FUERZA DE UN ENLACE ELECTROSTATICO (f.e.e.) SE DEFINE COMO: f .e.e. = m i (C arg a ion) nci (Numero coordinacion ion) REGLAS CRISTALOQUIMICAS DE PAULING REGLA II PARA CADA CATION LA SUMA DE LAS f.e.e. DE LOS ANIONES QUE LE RODEAN DEBE COMPENSAR LA CARGA POSITIVA SOBRE EL CATION, ES DECIR f1 + f2 + f3 + ......... + fn = m cc Y COMO: f1 = f2 = f3 = ......... = fn = SE TIENE cc ncc C arg a del anion x = Numero coordinacion del anion nca x ∑n =m i =1 ca DE DONDE ncc x =m nca ncc nca = m x REGLAS CRISTALOQUIMICAS DE PAULING REGLA II PARA CADA ANION LA SUMA DE LAS f.e.e. DE LOS CATIONES QUE LE RODEAN DEBE COMPENSAR LA CARGA NEGATIVA SOBRE EL ANION, ES DECIR f1 + f2 + f3 + ......... + fn ca Y COMO: f1 = f2 = f3 = ......... = fn ca SE TIENE nca m ∑n = x i =1 cc DE DONDE nca m=x ncc ncc nca = m x = =x C arg a del cation m = Numero coordinacion del cation ncc EXAMPLE In TiO2, what is the coordination number of O2- ? From Pauling’s first rule rTi4+ rO2− = 0.61 A = 0.44 1.40 A CN(Ti4+ ) = 6 e.b.s. (cation)= e.b.s. (anion) e.b.s.(Ti4+ ) = e.b.s.(O2− ) 2 m 4 2 e.b.s.(Ti4+ ) = = = = e.b.s(O2− ) = n 6 3 CN(O2− ) 2 2 3 2− = ; CN ( O ) = ×2 = 3 2− CN(O ) 3 2 REGLA III PAULING /// COMPARTICION DE POLIEDROS LA ESTABILIDAD DE ESTRUCTURAS CON DIFERENTES TIPOS DE UNIONES ENTRE POLIEDROS ES: VERTICE COMPARTIDO > ARISTA COMPARTIDA > CARA COMPARTIDA LA EXISTENCIA DE ARISTAS Y DE CARAS COMUNES A DOS POLIEDROS ANIÓNICOS DISMINUYE LA ESTABILIDAD ESTRUCTURAL. ESPECIALMENTE APRECIABLE: CATIONES DE CARGA ELEVADA Y PEQUEÑO ÍNDICE DE COORDINACIÓN. COMO CONFIRMACIÓN DE ESTA REGLA PUEDE CITARSE EL HECHO DE QUE LOS TETRAEDROS [SiO4] Ó [AlO4], QUE CORRESPONDEN A CATIONES DE CARGA ELEVADA E ÍNDICE DE COORDINACIÓN RELATIVAMENTE PEQUEÑO, SÓLO FORMAN ESTRUCTURAS ESTABLES CUANDO SE UNEN ENTRE SÍ MEDIANTE COMPARTICIÓN DE VÉRTICES. EN CAMBIO LAS COORDINACIONES OCTAÉDRICAS [TiO6] PUEDEN COMPARTIR ARISTAS Y LAS [AlO6] PUEDEN TENER INCLUSO CARAS COMUNES. 3 Influence of the polyhedra connectivity on the stability of the structure The sharing of geometric elements between polyhedra reduces the stability of the structure ABX3 NaCl > Vertex-sharing NiAs > Edge-sharing Face-sharing The distance between the cations should be as large as possible and the cations should be shielded as much as possible from one another REGLA IV PAULING /// EVASION DE CATIONES EN UNA ESTRUCTURA CRISTALINA QUE CONTIENE VARIOS CATIONES, AQUELLOS CON VALENCIA ELEVADA Y PEQUEÑO ÍNDICE DE COORDINACIÓN TIENDEN A ADOPTAR CONFIGURACIONES GEOMÉTRICAS QUE COMPARTAN ENTRE SÍ LO MENOS POSIBLE SUS ELEMENTOS POLIÉDRICOS EL EFECTO ES MAYOR CUANTO MAYOR SEA LA CARGA DEL CATION Y MENOR EL NUMERO DE COORDINACIÓN ESTRUCTURA CRISTALINA DE LA PEROVSKITA BaTiO3 Ti4+ 6-coordinate Ti-O octahedra share only VERTICES Ca2+ 12-coordinate Ca-O cuboctahedra share FACES REGLA V // PRINCIPIO DE PARSIMONIA (HOMOGENEIDAD AMBIENTAL) EN UNA ESTRUCTURA RETICULAR EL NÚMERO DE CONFIGURACIONES GEOMÉTRICAS DIFERENTES TIENDE A SER LO MÁS PEQUEÑO POSIBLE. (ENTORNOS SIMILARES PARA ATOMOS QUIMICAMENTE SIMILARES) All ions of the same type in the crystal should have the similar coordination spheres. For example, we don't expect to see a structure with aluminum ions in both octahedral and tetrahedral coordination DE ACUERDO CON EL PRINCIPIO DE MÍNIMA ENERGÍA ES LÓGICO QUE UNA ESTRUCTURA SEA TANTO MÁS ESTABLE CUANTO MÉNOR SEA EL NÚMERO DE CONFIGURACIONES QUE COEXISTAN EN ELLA. POR LA MISMA RAZÓN QUE ESTO CONSTITUYE UN FACTOR DE INESTABILIDAD CRISTALINA, FAVORECE CONTRARIAMENTE LA VITRIFICACIÓN, PUES, COMO ES SABIDO, UN VIDRIO ES TANTO MÁS ESTABLE CUANTO MÁS COMPLEJA SEA SU COMPOSICIÓN TODAS LAS REGLAS TIENDEN A MAXIMIZAR LAS ATRACCIONES CATION-ANION Y A MINIMIZAR LAS REPULSIONES ANION-ANION Y CATION-CATION rC 0,39 = = 0,295 rA 1,32 COORDINACIÓN TETRAÉDRICA 1s2 2s2 2p6 3s2 3p2 1s2 2s2 2p6 3s2 3p2