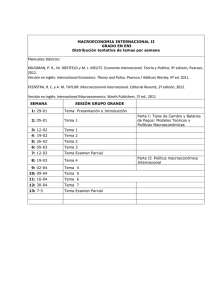
Capt. 9 Enlace Químico
Anuncio

2/2/2015
Capítulo 9
Enlaces Químicos
Fuerzas de atracción que mantiene unidos a dos o
más átomos.
El enlace químico reduce la energía potencial (EP)
entre partículas con cargas diferentes.
EP(átomo enlazado) < EP(átomo separado)
EP se calcula considerando:
Repulsión
o núcleo–núcleo
ú l
ú l
o electrón–electrón
Atracción
o núcleo–electrón
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Las teorías de enlaces
• Explican:
Cómo y por qué se enlazan los átomos y forman
moléculas.
La estabilidad de ciertas combinaciones sobre
otras.
Ejemplo: H2O, no HO o H3O
• Se usan para predecir:
geometría molecular
propiedades físicas y químicas de compuestos.
Tro: Chemistry: A Molecular Approach, 2/e
2
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
1
2/2/2015
Tipos de enlaces químicos
Se clasifican dependiendo de los tipos de átomos que se enlazan:
Enlace iónicoiónico- transferencia electrónica entre un metal y un no metal
Metal PI
AEbaja
bajo
Catión PI
AEbaja
bajo
No-Metal PI alta
AE
alto
Anión PI
AEalta
alto
Enlace covalentecovalente- comparte electrones entre átomos (generalmente
no metales)
Copyright 2011 Pearson Education, Inc.
Clasificación o Tipos de Enlaces
Tipos
metal con no-metal
no-metal con no-metal
metal
t l con metal
t l
Enlace
Características
Iónico
Electrones transferidos
(cationes y aniones)
Covalente
Electrones compartidos
(baja energía potencial)
M táli
Metálico
Electrones agrupados
g p
delocalizados*
delocalizados
* Los metales liberan sus e− de valencia, están delocalizados por toda la
estructura y se comparten en una “piscina” o “mar
mar” a través de todos los
átomos/iones en el metal
Tro: Chemistry: A Molecular Approach, 2/e
4
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
2
2/2/2015
Tipos de Enlaces
Enlaces covalente
Enlaces iónico
Enlace Metálico
mar de
d e−
mar de e−
H2O
Compuesto
covalente
NaCl
Compuesto
iónico
Tro: Chemistry: A Molecular Approach, 2/e
• Sencilla
NaCl
Sólido
iónico
5
Copyright 2011 Pearson Education, Inc.
Teoría de enlace de Lewis
Énfasis en los
e-
X
de valencia para explicar enlaces.
• Los átomos se enlazan:
G.N. Lewis
transfiriendo o compartiendo electrones.
(1875--1946)
(1875
para adquirir una configuración electrónica más estable.
Estabilidad = energía potencial menor
• Generalmente habrá ocho e- en la capa externa:
Regla del octeto
Adquirir la configuración de gas noble
Excepciones
Copyright 2011 Pearson Education, Inc.
3
2/2/2015
Estructura de Lewis
• Representa e- valencia como:
estructuras electrónicas de puntos alrededor del
átomo.
puntos aislados los que están disponibles para el
enlace.
• Para moléculas, Lewis permite predecir su:
estabilidad
forma
tamaño
polaridad
Tro: Chemistry: A Molecular Approach, 2/e
.. .. .
F
..
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
7
Símbolos de puntos de Lewis del 2do periodo (n = 2)
Li
Be
B
C
N
O
F
Ne
Método:
parear los primeros dos puntos que representan los e− del orbital s.
Colocar un punto en cada lado disponible del símbolo para los primeros
tres e−’s p.
Parear el resto de los puntos de los e−’s p restantes.
Copyright 2011 Pearson Education, Inc.
4
2/2/2015
Práctica – Escriba la estructura de Lewis
para arsénico
Elementos
Representativos
Elementos
de Transición
Elementos
Representativos
As
Periodo
Número de
grupo
33
As
Tro: Chemistry: A Molecular Approach, 2/e
9
Copyright 2011 Pearson Education, Inc.
Regla del Octeto
• Los átomos forman enlaces cuando ganan
ganan, pierden o
comparten electrones que resultan en OCHO e− de
valencia
• ns2np6
Configuración de gas noble
• Excepciones
H, Li
Li, Be
Be, B adoptan la configuración electrónica de He
Expansión del octeto para los elementos en el periodo 3 en
adelante
Se usa los orbitales d de valencia
Tro: Chemistry: A Molecular Approach, 2/e
10
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
5
2/2/2015
Excepciones a Regla del Octeto
Excepciones a la
número
par de e-
Text
Molécula con
menos de
8e-
Regla del
Octeto
molécula con
más de 8e-
11
www.raulher.wordpress.com
Química
Copyright 2011 Pearson Education, Inc.
Excepciones de la Regla del Octeto
• H, Li, Be, B adoptan la configuración electrónica de He:
He = dos electrones de valencia, un dueto
Li - pierde su único electrón de valencia
H - (1) comparte o gana un electrón.
(2) pierde un electrón para convertirse en H+
Be - (1) pierde dos electrones para convertirse en Be2+
(2) comparte sus 2 e− en enlaces covalentes que resulta en
cuatro electrones de valencia.
valencia
B - (1) pierde tres electrones para convertirse en B3+
(2) comparte sus tres electrones en enlaces covalentes, que
resulta en seis electrones de valencia.
Tro: Chemistry: A Molecular Approach, 2/e
12
© 2015Ileana
Nieves
Martínez
Copyright
2011 Pearson
Education,
Inc.
6
2/2/2015
a) Enlace Iónico
Copyright 2011 Pearson Education, Inc.
Estructura de Lewis de Iones
• Elemento se oxida, pierde e−’s y forma cationes cuya
estructura de Lewis carece e−’s de valencia
• Elemento se reduce, gana e−’s y forma aniones
cuya estructura de Lewis tiene ocho e−’s de valencia
Tro: Chemistry: A Molecular Approach, 2/e
14
Copyright 2011 Pearson Education, Inc.
7
2/2/2015
Teoría de Lewis y Enlace Iónico
+
• Representar la transferencia de e− de un metal
a un no-metal que producen iones que se
atraen
y por lo
enlaces
iónicos.
t
l tanto
t t forman
f
l
ió i
Tro: Chemistry: A Molecular Approach, 2/e
15
Copyright 2011 Pearson Education, Inc.
Predicción de fórmulas Iónica
usando símbolos Lewis
Li2O
• Los e− se transfieren hasta que los metales pierden
•
todos sus e− de valencia y los no metales adquieren
su octeto.
octeto
El # de átomos se ajustan hasta que la tranferencia
de e− se iguala.
Tro: Chemistry: A Molecular Approach, 2/e
16
Copyright 2011 Pearson Education, Inc.
8
2/2/2015
Ejemplo 9.1: Use la teoría de Lewis para
predecir la fórmula de compuestos iónicos
Transfiera todos los e− de
valencia del metal al no-metal,
añadiendo más átomos hasta
que todos los e− se transfieran
del metal al no-metal y todos los
no-metales completen su octeto.
·· ··
Dibuje los puntos de los elementos con sus
e de valencia.
· Cl ··
· ·
·· ·· · ·
Prediga la fórmula del compuesto que se forma entre
calcio (Ca
Ca)) y cloro (Cl
Cl)).
Cl
· · · ··
Ca·
· Cl ··
·
Ca
Ca2+
CaCl2
Tro: Chemistry: A Molecular Approach, 2/e
17
Copyright 2011 Pearson Education, Inc.
Práctica—Use Lewis para predecir la fórmula de un
compuesto iónico de un metal, M, con dos e−’s de
valencia con un no-metal, X, con cinco e−’s de valencia
M3X2
Tro: Chemistry: A Molecular Approach, 2/e
18
Copyright 2011 Pearson Education, Inc.
9
2/2/2015
Compuestos iónicos
Energía de la Red Cristalina
“Lattice Energy”
“Lattice
Energy
Copyright 2011 Pearson Education, Inc.
Propiedades de los compuestos iónicos
Compuestos cristalinos
El orden de lo iones se repite periódicamente en el espacio
Altos puntos de fusión y de ebullición por alta fuerza de
unión (Ered cristalina)
Duros, rígidos y quebradizos (no de deforman al romperse).
Conducen electricidad en el estado fundido o de disolución
Fuerza
externa
Sólido
iónico
Sólido iónico
fundido
Fuerza
repulsiva
Fractura
del cristal
Sólido iónico
disuelto en agua
Copyright 2011 Pearson Education, Inc.
10
2/2/2015
Red Cristalina de compuestos iónicos
Los iones gaseosos “coalecen”.
Se libera energía
Na+(g) + Cl−(g) → NaCl
NaCl(s)
(s)
H0 = Energía de la red cristalina
• Atracción Electrostática es no-direccional
No hay un par específico de anión–catión
• Por lo tanto NO hay molécula iónica
La fórmula química es empírica, dando la razón
entre los iones basada en su balance de carga
Tro: Chemistry: A Molecular Approach, 2/e
21
Copyright 2011 Pearson Education, Inc.
Enlace Iónico
y Energía de la Red Cristalina
• Energía adicional debido a la formación de la red
cristalina:
en la
l estructura
t t
cada
d catión
tió está
tá rodeado
d d de
d aniones
i
y viceversa.
resulta de fuerzas de atracción entre los cationes y los
aniones circundantes.
minimiza las atracciones entre cationes y aniones,
para alcanzar el arreglo más estable
estable.
exotérmica
difícil de medir directamente,
directamente
se puede calcular con procesos conocidos.
Tro: Chemistry: A Molecular Approach, 2/e
22
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
11
2/2/2015
Determación de la Energía de la Red Cristalina
Ciclo de Born
Born–
–Haber
• El ciclo de Born–Haber −
una serie de reacciones hipotéticas que repesentan la
formación de compuestos iónicos de sus elementos en
su estado patrón
patrón.
• Reacciones de entalpías conocidas:
Ley de Hess
Tro: Chemistry: A Molecular Approach, 2/e
©
2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
23
Na+(g) + Cl
Cl(g)
(g)
Entalpía, H
Ionización de
Na(g)
Adición de un
electrón a Cl(g)
Na+(g) + Cl−(g)
Na(g) + Cl
Cl(g)
(g)
Formación de Cl(g)
atómico de Cl2(g)
{molecular}
Na(g) + ½ Cl2(g)
Formación de
Na(g) de Na(s)
Formación de sólido cristalino
de iones gaseosos
Na(s) + ½ Cl2(g)
Cambio en entalpía
para la formación de
NaCl(s) de sodio y
cloro en estado patrón
NaCl(s)
NaCl
(s)
Tro: Chemistry: A Molecular Approach
24
Copyright 2011 Pearson Education, Inc.
12
2/2/2015
Na+(g) + Cl
Cl(g)
(g)
Ionización de
Na(g)
Adición de un
electrón a Cl(g)
Na+(g) + Cl−(g)
Entalpía, H
Na(g) + Cl
Cl(g)
(g)
Formación de Cl(g)
atómico de Cl2(g)
{molecular}
Na(g) + ½ Cl2(g)
Formación de sólido cristalino
de iones gaseosos
Formación de
Na(g) de Na(s)
Na(s) + ½ Cl2(g)
Cambio en entalpía
para la formación de
NaCl(s) de sodio y
cloro
NaCl(s)
NaCl
(s)
Tro: Chemistry: A Molecular Approach
25
Copyright 2011 Pearson Education, Inc.
Ciclo de Born–Haber
• Ley de Hess: Na(s) + ½ Cl2(g)
Na s Na g
1
2
Cl2 g Cl g
At
Atomización
i ió
H 0f Na g
Disociación
H 0f Cl g
Ionización
H 0f Na g IP1
Afinidad electrónica
H 0f Cl g AE
Na g Na g
Cl g Cl g
NaCl(s)
Na g Cl g NaCl
N
N Cl s Red
R d cristalina
i t li H 0f NaCl
N Cl s EL
Na s 1 2 Cl2 g NaCl s
Tro: Chemistry: A Molecular Approach, 2/e
H 0f NaCl s
26
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
13
2/2/2015
Ciclo de Born–Haber
Na s Na g
1
2
0
H atom
108 kJ
Cl2 g Cl g
0
H atom
1
2
244 kJ
Na g Na g
PI1 496 kJ
Cl g Cl
AE 349 kJ
Na
g Cl
g
g NaCl s
EL ?
Na s 1 2 Cl2 g NaCl s
H 0f 411 kJ
0
0
1
PI1 Na( g ) AE Cl g EL
H 0f NaCl s H Na
( s ) atom 2 H Cl2 atom
EL H 0f NaCl s H Na0 ( s ) atom 1 2 H Cl0 atom PI1 Na( g ) AE Cl g
2
EL 411 108 kJ 1 2 244 kJ 496 kJ 349 kJ
Tro: Chemistry: A Molecular Approach, 2/e
27
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Práctica –Dada la información a continuación,
determine la energía de la red cristalina de MgCl2
Mg(s) Mg(g)
Sublimación H1°f = +147.1 kJ/mol
½ Cl2(g) Cl(g) Di
Disociación
i ió H2°f = +122 kJ/mol
Mg(g) Mg+(g)
PI1
H3°f = +738 kJ/mol
Mg+(g) Mg2+(g)
PI2
H4°f = +1450 kJ/mol
Cl(g) Cl−(g)
AE
H5°f = −349 kJ/mol
Mg(s) + Cl2(g) MgCl2(s)
Tro: Chemistry: A Molecular Approach, 2/e
28
H6°f = −641 kJ/mol
Copyright 2011 Pearson Education, Inc.
14
2/2/2015
Solución para formar MgCl2
Mg(s) Mg(g)
Sublimación
H1°f = +147.1 kJ/mol
2{½ Cl2(g) Cl(g)}
Disociación
2H2°f = 2(+122 kJ/mol)
M ( ) Mg
Mg(g)
M +(g)
( )
PI1
H
H3°f = +738
38 kJ/
kJ/moll
Mg+(g) Mg2+(g)
PI2
H4°f = +1450 kJ/mol
2{Cl(g) Cl−(g)}
AE
2H5°f = 2(−349 kJ/mol)
Mg2+(g) + 2 Cl−(g) MgCl2(s)
H°energía de la red = ? kJ/
kJ/mol
mol
Mg(s) + Cl2(g) MgCl2(s)
H6°f = −641 kJ/mol
Tro: Chemistry: A Molecular Approach, 2/e
29
Copyright 2011 Pearson Education, Inc.
Solución (alterna)
energía de la red
Mg(s) Mg(g)
2{½ Cl2(g) Cl(g)}
Mg(g) Mg+(g)
Mg+(g) Mg2+(g)
2{Cl(g) Cl−(g)}
Mg2+(g) + 2 Cl−(g) MgCl2(s)
Mg(s) + Cl2(g) MgCl2(s)
Tro: Chemistry: A Molecular Approach, 2/e
H1°f = +147.1 kJ/mol
2H2°f = 2(+122 kJ/mol)
H3°f = +738 kJ/mol
H4°f = +1450 kJ/mol
2H5°f = 2(−349 kJ/mol)
H° energía de la red = ? kJ/mol
H6°f = −641 kJ/mol
30
Copyright 2011 Pearson Education, Inc.
15
2/2/2015
Energía de la red vs
tamaño de ión
Cloruro ERed Cristalina
kJ/mol
Metálico
LiCl
-834
NaCl
-787
KCl
-701
C C
CsCl
-657
• La estabilidad del compuesto iónico, (Ered)
depende inversamente de:
la distancia entre iones.
F a tra cc ió n
ell tamaño
t
ñ de
d llos iones
i
Tro: Chemistry: A Molecular Approach, 2/e
31
1
r
Copyright 2011 Pearson Education, Inc.
Tendencias la Ered cristalina y carga iónica
•
Fatracción q q
• Cargas altas
Energía de la Red =
−910 kJ/mol
Atracción más fuerte
Mayor energía de la red cristalina
• La carga iónica es el factor más
importante
Energía de la Red =
−3414 kJ/mol
Tro: Chemistry: A Molecular Approach, 2/e
32
Copyright 2011 Pearson Education, Inc.
16
2/2/2015
Ejemplo 9.2: Ordene los siguientes compuestos iónicos en
forma ascendente en magnitud de energía de la red cristalina.
CaO, KBr, KCl, SrO
1) Examinar primero las cargas
2) Ordenar por la suma de las cargas
Ca2+ & O2- ; K+ & Br─
K+ & Cl─ ; Sr2+ & O2─
Ered: (KBr,
(KB KCl) < (C
(CaO,
O SrO)
S O)
1) Examinar el tamaño iónico de cada grupo.
2) Ordenar de según radio: [Ered menor (rmayor)] < Ered mayor (rmenor).
(a) (KBr, KCl) mismo catión,
Ered: KBr < KCl < (CaO, SrO)
(b) radio(Br─) > radio(Cl─) (el mismo grupo)
Ered: KBr < KCl < SrO < CaO
(c) (CaO, SrO) mismo anión
2+
2+
(d) radio(Sr ) > radio(Ca )(el mismo grupo)
Tro: Chemistry: A Molecular Approach, 2/e
33
Copyright 2011 Pearson Education, Inc.
Enlace Covalente
Copyright 2011 Pearson Education, Inc.
17
2/2/2015
Teoría de Lewis de enlace covalente
• Compartir e−’s
de valencia forma enlace covalente
es otra manera de alcanzar el octeto.
Tro: Chemistry: A Molecular Approach, 2/e
35
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Enlace Covalente:
Electrones enlazantes & solitarios
Pares enlazantes
..
..
..
.. O .... S .. O ..
..
Pares solitarios
• Los e−’s que:
• se comparten son pares enlazantes
• no se comparten son pares solitarios
Tro: Chemistry: A Molecular Approach, 2/e
36
Copyright 2011 Pearson Education, Inc.
18
2/2/2015
Enlace covalente sencillo
• Enlace covalente sencillo
Se comparte un (1) par de e−’s ≡ 2 electrones
••
••
F
••
F
Tro: Chemistry: A Molecular Approach, 2/e
37
Copyright 2011 Pearson Education, Inc.
Enlace covalente
• Triple
• Doble
Se comparten dos pares
de e−’s ≡ 4 electrones
•
•
••
•N
•
N ••
•• N
O ••
•• O
Tro: Chemistry: A Molecular Approach, 2/e
Se comparten tres pares
de e−’s ≡ 6 electrones
••
•N
•
••
•O
••
•
•
••
•O
••
••
• O •H
••
••
H O H
••
••
F
••
••
F
••
• F
••
••
••
••
••
H•
•
F •
••
••
••
••
38
Copyright 2011 Pearson Education, Inc.
19
2/2/2015
Predicciones de las fórmulas
moleculares por la teoría de Lewis
Hidrógeno es más estable con enlace sencillo
H2
+
+
HCl
Tro: Chemistry: A Molecular Approach, 2/e
39
Copyright 2011 Pearson Education, Inc.
Predicciones de Fórmulas moleculares
por la teoría de Lewis
Oxígeno es más estable con enlace sencillo con dos átomos
+
+
o con enlaces dobles con otro átomo
O2
+
Tro: Chemistry: A Molecular Approach, 2/e
H2 O
40
Copyright 2011 Pearson Education, Inc.
20
2/2/2015
Electronegatividad
La electronegatividad es una medida de la habilidad de un
elemento de atraer e─ cuando está enlazado a otro elemento
elemento..
Un elemento electronegativo atrae e─.
Un elemento electropositivo dona e─
Escala de electronegatividad
Li
Be
B
C
N
O
F
1.0
1.5
2.0
2.5
3.0
3.5
4.0
Na
Mg
Al
Si
P
S
Cl
0.9
1.2
1.5
1.8
2.1
2.5
3.0
www.raulher.wordpress.com
Química
Copyright 2011 Pearson Education, Inc.
41
Generalización
Mayor diferencia en enlectronegatividad, (E) entre dos átomos;
MÁS POLAR es el enlace.
H
..
..
:
C
:
O
..
..F
H O
.. H
Los enlaces polares conectan átomos
de diferente electronegatividad
H —H
..
: ..F
..
:
..F
:N
O
.. :
N:
Enlaces no
no--polares conectan dos átomos
de igual electronegatividad
42
www.raulher.wordpress.com
Química
Copyright 2011 Pearson Education, Inc.
21
2/2/2015
Enlace Polar Covalente
• Enlace donde los e- se comparten de forma no equitativa
dipolo..
por átomos diferentes y se produce un dipolo
Un átomo es más eficiente atrayendo e Un extremo del enlace tiene mayor densidad electrónica y
otro menor por lo que se exhibe:
Polaridad de enlace:
o Carga parcial negativa (─)para el que tenga mayor densidad
electrónica
l tó i
o Carga parcial positiva (+) para el que esté deficiente de e-
Tro: Chemistry: A Molecular Approach, 2/e
43
Copyright 2011 Pearson Education, Inc.
HF
EN 2.1 H
F
EN 4.0
H •• F
Dipolo
Las moléculas de HF
se alinean con el
campo eléctrico
Tro: Chemistry: A Molecular Approach, 2/e
44
Copyright 2011 Pearson Education, Inc.
22
2/2/2015
E y tipo de enlace
• E = 0 enlace es puramente covalente
• 0.1
0 1 ≤ E ≤ 0.4,
0 4 enlace es covalente no-polar
• 0.5 ≤ E ≤ 1.9, enlace es polar covalente
• E ≥ 2.0, enlace es iónico
Por ciento de Carácter Iónico
51%
Polar covalente
iónico
0
0.4
2.0
Covalente no─polar
Diferencia en Electronegatividad
4%
Tro: Chemistry: A Molecular Approach, 2/e
45
“100%”
4.0
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Polaridad de enlace
ENCl = 3.0
30
3.0 − 3.0 = 0
Covalente Puro
Tro: Chemistry: A Molecular Approach, 2/e
ENCl = 3.0
30
ENH = 2.1
3.0 – 2.1 = 0.9
Polar Covalente
46
ENCl = 3.0
30
ENNa = 0.9
3.0 – 0.9 = 2.1
Iónico
Copyright 2011 Pearson Education, Inc.
23
2/2/2015
Agua – Molécula Polar
Corriente
de agua
se atrae
hacia un
cristal
cargado
Corriente
de hexano
no se atrae
hacia un
cristal
cargado
Tro: Chemistry: A Molecular Approach, 2/e
47
Copyright 2011 Pearson Education, Inc.
Porr ciento de caráctter iónico
Iónico
Covalente
No polar
Polar Covalente
Iónico
Diferencia en electronegatividad
Tro: Chemistry: A Molecular Approach, 2/e
48
Copyright 2011 Pearson Education, Inc.
24
2/2/2015
Ejemplo 9.3(c): Determine si el enlace N―O
es iónico, covalente, o polar covalente.
• Determine la electronegatividad de cada elemento:
N = 3.0; O = 3.5
• Reste las electronegatividades,
(3.5) − (3.0) = 0.5
• Si E ≥ 2.0, enlace es iónico
Pero como E = 0.5 ≤ 2.0, es covalente
• Si 0.5 ≤ E ≤ 1.9, enlace es polar covalente
Como E = 0.5 está en el intervalo de polar covalente
Tro: Chemistry: A Molecular Approach, 2/e
49
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Estructuras de Lewis de Moléculas
• Para moléculas, predice:
la distribución de e−’s de valencia
Geometría molecular
Propiedades
Interacción
Tro: Chemistry: A Molecular Approach, 2/e
50
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
25
2/2/2015
Estructuras Lewis
• Patrón de enlace general:
C
B
átomo
enlaces
Pares solitarios
C
4
0
O
2
2
N
3
1
H &X
1
Be
2
0
B
3
0
N
O
F
• Estructuras fuera de los patrones comunes de
enlaces pueden tener cargas formales
Tro: Chemistry: A Molecular Approach, 2/e
Copyright 2011 Pearson Education, Inc.
51
Enlaces: patrones comunes
C
B
N
F
O
Enlaces: patrones no-comunes
cargas formales
B
−
+
C
+
N
−
−
C
Tro: Chemistry: A Molecular Approach, 2/e
N
52
+
O
O
−
F
F
+
−
Copyright 2011 Pearson Education, Inc.
26
2/2/2015
Ejemplo: Estructura de Lewis de HNO3
1. Escribir la estructura esqueleto de HNO3:
O
Átomo central es el menos electronegativo.
H O N O
N es el central
nunca H
H siempre es terminal.
H terminal enlazado a los O en oxi-ácidos.
2. Contar los e─ de valencia:
N
=
5 e−
H
=
1 e−
O3 = 36 = 18 e−
Total =
24 e−
Molécula neutral
Sumar los e─ s de valencia para cada átomo.
Para moléculas que son iones
iones:
sumar un e─ por cada carga negativa (aniones).
restar un e─ por cada carga positiva (cationes).
Tro: Chemistry: A Molecular Approach, 2/e
53
Copyright 2011 Pearson Education, Inc.
Ejemplo: Estructura de Lewis de HNO3
3. Enlazar átomos con pares de e─ s, restarlos del
total
No olvidar que una linea representa 2 e─ s
H O
O
N O
Tro: Chemistry: A Molecular Approach, 2/e
54
e─s
Inicial
24
Usados ─ 8
Restantes 16
Copyright 2011 Pearson Education, Inc.
27
2/2/2015
Ejemplo: Estructura de Lewis de HNO3
4. Completar los octetos con los e− s
restantes, de afuera hacia adentro
adentro.
H ya está
tá completo
l t con 2 e─
1 enlace
O
H O N O
5. Re-contar e─ s.
e─ s
e─ s
N
=
5 e−
Inicial
24
H
=
1 e−
Enlaces ─ 8
O3 = 36 = 18 e−
Restantes 16
Total =
24 e−
Tro: Chemistry: A Molecular Approach, 2/e
55
e─ s
Inicial
16
octeto ─ 16
Restantes 0
Copyright 2011 Pearson Education, Inc.
Ejemplo: Estructura de Lewis de HNO3
5. Si todos los octetos se completan,
añadir los e─ s extra (de haberlos) al
átomo central:
elementos con orbitales d pueden
tener mas de 8 e─ s.
O
H O N O
Periodo 3 o mayor.
6. Si el átomo central no tiene octeto,
usar los e─ s de los átomos externos
para compartir.
compartir.
Siguir patrones usuales si es posible.
O
H O N O
Tro: Chemistry: A Molecular Approach, 2/e
56
Copyright 2011 Pearson Education, Inc.
28
2/2/2015
Carga Formal (CF) HNO3
O
24eO
- 8
H O N O
16
H O N O
• Carga Formal:
Formal:
- 16
0
Resulta de la carencia o el exceso de e─ s de valencia
al completar el octeto.
CF evalencia
eno
enlazante # enlaces
Suma de todas las cargas formales en una molécula = 0
en un ión = carga del ión
Tro: Chemistry: A Molecular Approach, 2/e
57
Copyright 2011 Pearson Education, Inc.
Carga formal de HNO3
7. Asignar cargas formales (cf)
a) cf = e− valencia − e− par solitario − # enlaces
b) siga patrones comunes de enlaces.
0
+1
−1
Cálculo de cargas formales para HNO3
H
O(1)
N
O(2)
O(3)
cf =
0
0
++1
1
─1
-1
00
0
−1
(2)
0
(1)
+1
(3)
0
valencia ─ solitario ─ enlaces
= 1
─ 0
─ 1
= 6
─ v4
─ 2
= 5
─ 0
─ 4
= 6
─ 6
─ 1
= 6
─ 4
─ 2
cfMolécula= 0
Tro: Chemistry: A Molecular Approach, 2/e
58
Copyright 2011 Pearson Education, Inc.
29
2/2/2015
Carga formal de HNO3
7. Asigne cargas formales (cf)
−1
a) cf = e− valencia − e− par solitario − enlaces
b) o siga patrones comunes de enlaces
0
0
+1
−1
Cálculo de cargas formales para HNO3
H
O(1)
N
O(2)
O(3)
cf =
0
0
++1
1
1−1
00
(2)
0
(1)
+1
(3)
0
valencia ─ solitario ─ enlaces
= 1
─ 0
─ 1
= 6
─ 4
─ 2
= 5
─ 0
─ 4
= 6
─ 6
─ 1
= 6
─ 4
─ 2
cfMolécula= 0
Tro: Chemistry: A Molecular Approach, 2/e
59
Copyright 2011 Pearson Education, Inc.
Resonancia
Híbrido
(a)
Tro: Chemistry: A Molecular Approach, 2/e
Estructura híbrida resonante
(b)
60
Copyright 2011 Pearson Education, Inc.
30
2/2/2015
Estructuras Resonantes
• Resonancia - delocalización de e─ s.
• Estructura Resonante ≡
estructura de Lewis que se diferencia solo por la
posición de los e─ s.
• Híbrido resonante –
combinación de las formas resonantes.
delocalización de las cargas.
estabiliza la molécula.
Tro: Chemistry: A Molecular Approach, 2/e
61
Copyright 2011 Pearson Education, Inc.
Reglas para estructuras resonantes
• Deben tener:
el mismo número de e−.
la misma conetividad.
solo cambia la posición de los e─ s
• Los elementos de:
la segunda fila tienen un máximo de 8 e enlazantes y no enlazantes.
la tercera fila pueden expandir el octeto.
octeto
• Las cargas formales deben sumar lo mismo.
Tro: Chemistry: A Molecular Approach, 2/e
62
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
31
2/2/2015
Dibujar Estructuras Resonantes, HNO3
1. Dibujar la estructura Lewis para máximizar
el octeto.
−1
(2)
2. Asignar cargas formales:
CF evalencia
eno
enlazante # enlaces
0
3. Mover pares de electrones de átomos con
carga formal (−) hacia los de carga formal (+)
0
0
(1)
(3)
+1
4. Si la CF (+) es del átomo de la 2da fila
fila,
mueva e─ s siempre y cuando pueda mover
pares de e─ s de un enlace múltiple.
5. Si la CF (+) de átomo de la 3ra fila o mayor,
traiga pares de e─ s para reducir la carga
forma aunque expanda el octeto.
−1
+1
híbridos resonantes
Tro: Chemistry: A Molecular Approach, 2/e
63
Copyright 2011 Pearson Education, Inc.
Dibujar Estructuras Resonantes, (NO
NO3−)
1.
Dibujar la estructura Lewis para máximizar
el octeto.
2.
Asignar cargas formales:
−1
−1
CF evalencia
eno
enlazante # enlaces
3.
Mover pares de electrones de átomos con
carga formal (−) hacia los de carga formal (+)
4.
da fila
Si la CF (+) es del átomo de la 2da
fila,
─
mueva e s siempre y cuando pueda mover
pares de e─ s de un enlace múltiple.
5.
−1
−1
3ra
Si la CF (+) de átomo de la
fila o mayor,
traiga pares de e─ s para reducir la carga
forma aunque expanda el octeto.
Tro: Chemistry: A Molecular Approach, 2/e
+1
64
+1
híbridos resonantes
Copyright 2011 Pearson Education, Inc.
32
2/2/2015
Ejemplo de práctica
1) Estructura Lewis
2) Carga formal
3) Estructura resonante
Copyright 2011 Pearson Education, Inc.
Estructura y Carga Formal (SO32─)
6x4 = 24e─ totales
+
2e─ carga ión
─
6e─ (enlace)
20
─18
−1
1
2
O6e
O S O
-
6e-
6e-
6e-
O−1
+1
−1
Calcule y Asigne Carga Formal (SO32─)
e va
len cia e n o en laza nte
= 6
−
6
= 6
−
2
= 6
−
6
= 6
−
6
# en la ces
izquierda O
−
1 = −1
S
−
3 = +1
derecha
O
−
1 = −1
1
arriba
O
−
1 = −1
−2
• Suma de todas las cargas formales del ión = ─ 2.
CF
CF
CF
CF
CF
Tro: Chemistry: A Molecular Approach, 2/e
66
Copyright 2011 Pearson Education, Inc.
33
2/2/2015
Estructura resonante (SO32─)
1. Mover pares de
de átomos
con CF (−) hacia los de CF (+).
2. Si la CF (+) es del átomo de la
2da fila,
fila mueva e─ s para formar
un enlace múltiple
3 Si lla CF ((+)) dde átomo
3.
á
d lla 3ra
de
fila o mayor, traiga pares de e─ s
para reducir la carga forma
aunque expanda el octeto.
−1
0
O
−1
0
O −1
−1
−1
O
e─ s
+1
−1
O
−1
0
0
0
Tro: Chemistry: A Molecular Approach, 2/e
67
−1
0
−1
Copyright 2011 Pearson Education, Inc.
Evaluar Estructuras Resonantes
• Las mejores estructuras resonantes poseen:
Menos cargas formales distribuidas en la
molécula.
lé l
Cargas formales con:
valores menores
valores negativos en los átomos más electronegativos
Tro: Chemistry: A Molecular Approach, 2/e
68
© 2015 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
34
2/2/2015
Excepciones a la Regla del Octeto
• Octetos Expandidos
elementos con orbitales d vacíos puenden
tener más de ocho electrones
• Número impar de electrones e.g.: NO
Tendrán electrones sin parear
Radicales libres
uy reactivos
eac os
Muy
• Octetos Incompletos
B, Al
Tro: Chemistry: A Molecular Approach, 2/e
69
© 2011 Ileana
NievesEducation,
Martínez
Copyright
2011 Pearson
Inc.
Ejercicios de práctica
Estructura Lewis
Carga formal
Estructura resonante
Copyright 2011 Pearson Education, Inc.
35
2/2/2015
Estructura y Carga Formal (SO2)
O S
O
6e-
6e-
6e-
18e-4
14
-12
2- 2 = 0
0
−1
+1
• Calcule y asigne CF
CF evalencia
eno
enlazante # enlaces
izquierda O
CF = 6 − 4 − 2 = 0
S
CF = 6 − 2 − 3 = +1
derecha O
CF = 6 − 6 − 1 = −1
• Suma de todas las cargas formales en una molécula = 0
en un ión = carga del ión
71
Tro: Chemistry: A Molecular Approach, 2/e
Copyright 2011 Pearson Education, Inc.
Estructura resonante (SO2)
0
−1
+1
−1
+1
1
−1
1
0
0
+1
....O ......S .. ..O ..
..
0
0
....O .. ..S .... ..O ..
..
híbrido resonante
Tro: Chemistry: A Molecular Approach, 2/e
72
Copyright 2011 Pearson Education, Inc.
36
2/2/2015
Práctica – Dibujar estructuras de Lewis
para:
CO2
H3PO4
SeOF2
SO32−
NO2−
P2H4
Tro: Chemistry: A Molecular Approach, 2/e
73
Copyright 2011 Pearson Education, Inc.
Respuestas ─ Práctica de Estructuras
O C O
16 e−
CO2
16e-4
12
-12
0
H3PO4
32 e−
SeOF2
SO32−
NO2−
P2H4
26 e−
18
26 e−
e−
Tro: Chemistry: A Molecular Approach, 2/e
14 e−
74
Copyright 2011 Pearson Education, Inc.
37
2/2/2015
Práctica – Estructuras-respuestas
CO2
16 e−
H3PO4
32 e−
SeOF2
SO32−
NO2−
P2H4
26 e−
26 e−
18 e−
14 e−
Tro: Chemistry: A Molecular Approach, 2/e
75
Copyright 2011 Pearson Education, Inc.
Práctica – Asignar
carga formal
CF evalencia eno enlazante # enlaces
CO2
H3PO4
SeOF2
SO32−
NO2−
P2H4
Tro: Chemistry: A Molecular Approach, 2/e
76
Copyright 2011 Pearson Education, Inc.
38
2/2/2015
Respuesta – Asignar carga formal
CF evalencia
eno
enlazante # enlaces
CO2
H3PO4
todo 0
P = +1
resto 0
SO32−
SeOF2
S = +1
Se = +1
NO2−
P2H4
todo 0
Tro: Chemistry: A Molecular Approach, 2/e
77
Copyright 2011 Pearson Education, Inc.
Respuesta – Asignar carga formal
CF evalencia
eno
enlazante # enlaces
CO2
H3PO4
todo 0
P = +1
resto 0
SO32−
SeOF2
S = +1
Se = +1
NO2−
P2H4
todo 0
Tro: Chemistry: A Molecular Approach, 2/e
78
Copyright 2011 Pearson Education, Inc.
39
2/2/2015
Práctica – Identifique las estructuras con
mejor formas resonantes y dibújelas
CO2
H3PO4
toda 0
P = +1
resto 0
SO32−
SeOF2
S = +1
Se = +1
NO2−
P2H4
toda 0
Tro: Chemistry: A Molecular Approach, 2/e
79
Copyright 2011 Pearson Education, Inc.
Práctica – Identifique las estructuras con
mejor formas resonantes y dibújelas
CO2
H3PO4
Toda 0
ninguna
SO32−
SeOF2
−1
Toda 0
S =0
+1
P2H4
NO2−
En tres de las
Formas resonantes
ninguna
none
Tro: Chemistry: A Molecular Approach, 2/e
80
Copyright 2011 Pearson Education, Inc.
40
2/2/2015
Respuestas – Identifique las estructuras con
mejor formas resonantes y dibújelas
CO2
H3PO4
Toda 0
ninguna
SO32−
SeOF2
−1
Toda 0
S =0
+1
En todas las
Formas resonantes
P2H4
NO2−
ninguna
none
Tro: Chemistry: A Molecular Approach, 2/e
81
Copyright 2011 Pearson Education, Inc.
Largo de Enlaces
• La distancia entre los núcleos de
átomos enlazados es largo
g de enlace
Promedio de enlaces similares de
muchos compuestos
Tro: Chemistry: A Molecular Approach, 2/e
82
Copyright 2011 Pearson Education, Inc.
41