nomenclatura quimica - Tongoy - Universidad Católica del Norte
Anuncio

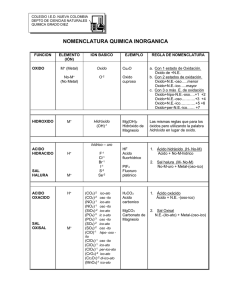
Departamento de Química Practica Nº 2 Universidad Católica del Norte NOMENCLATURA QUIMICA Nomenclatura química Objetivos 1. Familiarizar a los estudiantes con las funciones químicas como son: óxidos, hidróxidos, ácidos y sales. 2. Demostrar mediante distintas experiencias las principales propiedades de las funciones químicas. 3. Identificar comportamientos esenciales de las funciones químicas Los elementos químicos al combinarse forman compuestos los cuales pueden clasificarse de acuerdo a sus funciones, las cuales estarán predeterminadas por su composición elemental. Entre estos compuestos podemos identificar los óxidos, ácidos, hidróxidos y sales. FUNDAMENTO TEORICO (Compuestos inorgánicos) OXIDOS También conocidos como compuesto binarios oxigenados, formados por la combinación del oxígeno con otro elemento, si el elemento es un METAL se le conoce como OXIDO METALICO o también como OXIDO BASICO. Su representación en ecuación puede resumirse como: 2M+ O2 2MO (Donde M es un Metal, en este caso Grupo 2) En el caso de que fuera un NO METAL se le denomina OXIDO NO METALICO u OXIDO ACIDO, y en ocasiones a algunos se les puede denominar ANHIDRIDOS. Su representación en ecuación puede resumirse como: NM+ O2 NMO2 Donde NM es un No Metal y el balance estequiométrico dependerá del número de oxidación del no metal. Departamento de Química Practica Nº2 Universidad Católica del Norte FUNDAMENTO TEORICO HIDROXIDO ACIDO También conocidos como compuesto ternarios oxigenados e hidrogenados, formados por la combinación de un OXIDO BASICO (Metal + oxígeno) con una molécula de agua. Se caracteriza por tener un pH mayor a 7 (entre 8 y 14). Así como los óxidos de los metales con agua forman hidróxidos, LOS OXIDOS DE LOS NO METALES (ANHIDRIDOS) con agua forman los ácidos también conocidos como oxácidos. Estas sustancias se caracterizan por tener un pH menos a 7 (entre 1 y 6). MO + H2O M(OH)2 NM+ H2O NM(OH)2 La nomenclatura de estos compuestos (Óxidos e hidróxidos) puede ser: La nomenclatura de estos compuestos (ácidos) puede ser: Tradicional: se escribe el tipo de compuesto (oxido o anhídrido; hidróxido), seguido del metal o no metal utilizando sufijos y prefijos según el número de oxidación.de menor a mayor respectivamente: Tradicional: se escribe el tipo de compuesto (acido), seguido del no metal utilizando sufijos y prefijos según el número de oxidación. De menor a mayor respectivamente: hipo-oso, oso, ico, per-ico hipo-oso, oso, ico, per-ico IUPAC: se escribe la palabra oxido o hidróxido, seguido metal o no metal utilizando entre paréntesis el número en romano de su estado de oxidación en ese compuesto Ejemplo: 2Mg + O2 2MgO Oxido Magnésico Oxido de magnesio (II) Ejemplo: SO2 + H2O H2SO3 Ácido sulfuroso HIDRACIDO Compuesto binario hidrogenado, formado por la combinación de un no metal proveniente de una sal (de los grupos 16 y 17) con hidrogeno aportado por oxácido generalmente. La nomenclatura de los Hidrácidos puede ser: S + O2 SO2 Anhídrido Sulfuroso Oxido de azufre (IV) MgO + H2O Mg(OH)2 Hidróxido magnésico Hidróxido de magnesio (II) Tradicional: se escribe el tipo de compuesto (ácido), seguido del no metal utilizando el sufijo hídrico. IUPAC: Se escribe el elemento más Electronegativo con la terminación URO, se escribe después “de” el otro elemento (H). 2NaCl+H2SO4 2HCl + Na2SO4 Acido Clorhídrico Cloruro de hidrogeno Departamento de Química Practica Nº2 Universidad Católica del Norte SALES BINARIAS Compuestos no oxigenados ni hidrogenados, se forman por la combinación de un no metal con un metal. IUPAC: Se escribe el elemento no metálico con la terminación URO, se escribe después el elemento metálico y entre paréntesis el número de oxidación La nomenclatura de estos compuestos (Sales) puede ser: Ejemplo: Zn + 2HCl ZnCl2 + H2 Tradicional: Se escribe el elemento no metálico con la terminación URO, luego se escribe el elemento metálico utilizando sufijos y prefijos según el número de oxidación. De menor a mayor respectivamente Acido Clorhídrico Cloruro de hidrogeno hipo-oso, oso, ico, per-ico MATERIALES Y REACTIVOS * Tubo de ensayo (15) * Mechero * Gradilla * Crisol (1) * NaCl * Azul de timol Ácidos concentrados: *Cápsula (1) * Termómetros (1) *Cinta Mg * Pinzas para crisol * Papel filtro * papel tornasol *fenolftaleína *Piseta * HCl * Azufre *NaOH 0.1M * Verde bromocresol * H2SO4 *Mortero * CH3COOH * espátula *Sodio metálico *goteros (5) *Amoniaco *HNO3 Departamento de Química Practica Nº2 Universidad Católica del Norte PROCEDIMIENTO: Óxidos e Hidróxidos Óxido Básico: 1. Tome con una pinza para crisol un trozo de cinta de magnesio 2. Hágala arder en la llama del mechero (no observe de forma continua el destello que se produce en la reacción) 3. Recolecte el producto obtenido (ceniza en un tubo de ensayo) 4. Agréguele 4ml de agua destilada, agite hasta disolver completamente la ceniza. 5. Divida esta solución en dos tubos de ensayo, al primero adiciónele gotitas de fenolftaleína y al segundo azul de timol Óxidos ácidos: anhídridos (DEMOSTRATIVO) Hidróxido (DEMOSTRATIVO) 11. Su profesor con ayuda de una espátula tomará una cantidad inferior a 0.5g de sodio metálico. 12. La depositara en un barco de papel 13. Lo llevará a un mortero con agua más fenolftaleína. (OBSERVE LAS REACCIONES) No demostrativo 14. Con ayuda de una espátula tome una lentejuela de NaOH y deposite en un tubo de ensayo. 15. Disuélvala con 5ml de agua destilada. 16. Divida esta solución en dos tubos de ensayo. 17. Al primero adicione gotas de fenolftaleína y al segundo gotas de azul de timol 6. Su profesor con ayuda de una espátula tomara una cantidad inferior a 0.5g de azufre. 7. La depositara en una crisol limpio y seco 8. Con ayuda de una pinza para crisol, lo llevara a la llama del mechero para hacerlo arder (azufre). 9. Una vez se observe la aparición de un “gas” se procederá a colocar una capsula previamente humedecida. 10. Posteriormente se retirará esta cápsula y se añadirá unas gotitas de azul de timol. Departamento de Química Practica Nº2 Universidad Católica del Norte PREGUNTAS 1.- Complete la siguiente tabla teniendo en cuenta las reacciones que se llevaron a cabo Ecuación de la reacción Oxido Básico Numeral 1-2 Oxido Básico Numeral 3-5 Oxido ácidos ANHIDRIDO Numeral 6-8 Oxido ácidos ANHIDRIDO Numeral 9-10 Hidróxido (demostrativo) Numeral 11-13 Hidróxido (no demostrativo) Numeral 14-17 Nombre del producto Reconocimiento con indicador Departamento de Química Practica Nº2 Universidad Católica del Norte PROCEDIMIENTO: Ácidos, Sales Binarias e hidrácidos Disociación de ácidos 1. 2. 3. 4. 5. 6. Llene con 5ml de aguas destilada 4 tubos de ensayo. Mida la temperatura del agua con ayuda de un termómetro. Adicione al primer tubo 2mL de acido sulfúrico concentrado, y mida la temperatura. Al segundo tubo adiciones 2ml de acido nítrico y mida la temperatura Al tercero incorpore 2ml de acido clorhídrico y mida la temperatura Y al último 2ml de acido acético y mida la temperatura NOTA. En cada medición recuerde bajar la temperatura del termómetro con agua potable en el lavandino. Reconocimiento de los ácidos 7. Tome una gota de la solución de cada tubo de ensayo. 8. Colóquela sobre un trozo de papel tornasol azul, y verifique el color. 9. Distribuya las soluciones anteriores en 2 tubos cada una (debe quedar con un total del 8 tubos de ensayo dos por cada acido). 10. Agregue a cuatro de ellos 2 gotas de fenolftaleína y a los restantes 2 gotas de verde de bromocresol Formación de Sales Binarias 13. Tome dos tubos de ensayo, y deposite en cada uno de ellos una granalla de zinc 14. Al primer adicione 2mL de ácido clorhídrico, observe la reacción 15. Al segundo adicione 2mL de acido sulfúrico, observe la reacción Formación de Hidrácidos 11. En un tubo de ensayo coloque con ayuda de una espátula 0,5g de NaCl 12. Adicione 1 ml de ácido sulfúrico e inmediatamente cubra la boca de este con un papel filtro previamente humedecido con amoniaco y fenolftaleína. Puede también colocar papel tornasol azul Departamento de Química Practica Nº2 Universidad Católica del Norte PREGUNTAS 2.- Complete la siguiente tabla teniendo en cuenta las reacciones que se llevaron a cabo Ecuación de la reacción Disociación ácidos Numeral 1-10 Sales binarias Numeral 11-13 Hidrácido Numeral 14-15 Nombre del producto Reconocimiento con indicador