Continuación y bibliografía
Anuncio
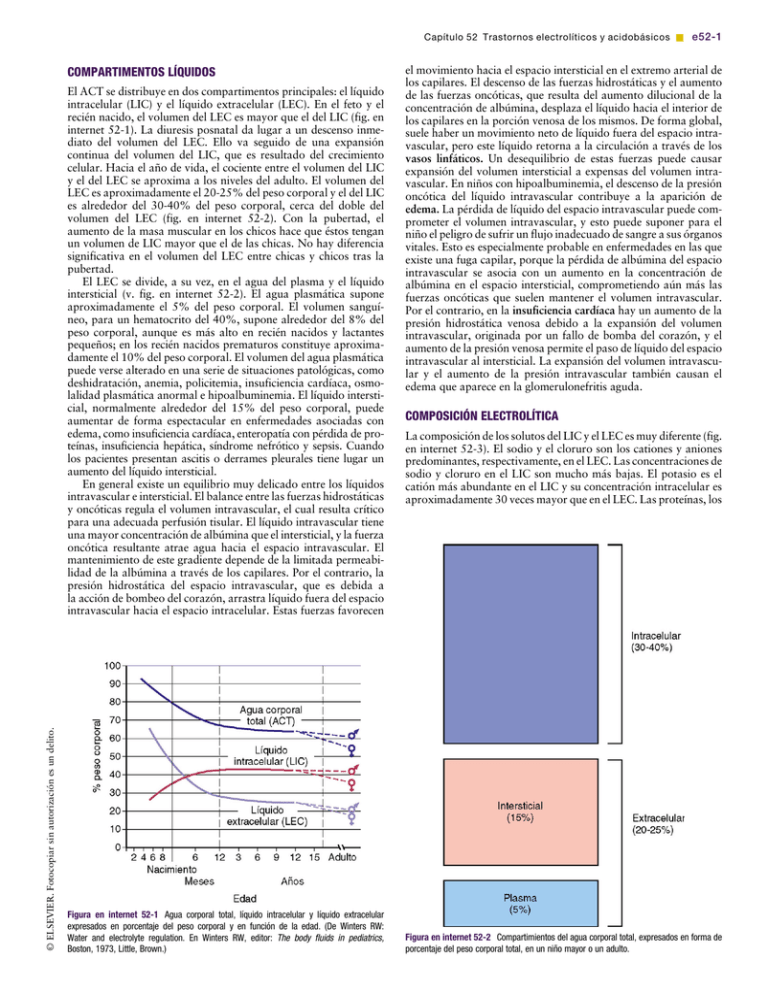
Capítulo 52 Trastornos electrolíticos y acidobásicos & e52-1 el movimiento hacia el espacio intersticial en el extremo arterial de los capilares. El descenso de las fuerzas hidrostáticas y el aumento de las fuerzas oncóticas, que resulta del aumento dilucional de la concentración de albúmina, desplaza el líquido hacia el interior de los capilares en la porción venosa de los mismos. De forma global, suele haber un movimiento neto de líquido fuera del espacio intravascular, pero este líquido retorna a la circulación a través de los vasos linfáticos. Un desequilibrio de estas fuerzas puede causar expansión del volumen intersticial a expensas del volumen intravascular. En niños con hipoalbuminemia, el descenso de la presión oncótica del líquido intravascular contribuye a la aparición de edema. La pérdida de líquido del espacio intravascular puede comprometer el volumen intravascular, y esto puede suponer para el niño el peligro de sufrir un flujo inadecuado de sangre a sus órganos vitales. Esto es especialmente probable en enfermedades en las que existe una fuga capilar, porque la pérdida de albúmina del espacio intravascular se asocia con un aumento en la concentración de albúmina en el espacio intersticial, comprometiendo aún más las fuerzas oncóticas que suelen mantener el volumen intravascular. Por el contrario, en la insuficiencia cardíaca hay un aumento de la presión hidrostática venosa debido a la expansión del volumen intravascular, originada por un fallo de bomba del corazón, y el aumento de la presión venosa permite el paso de líquido del espacio intravascular al intersticial. La expansión del volumen intravascular y el aumento de la presión intravascular también causan el edema que aparece en la glomerulonefritis aguda. COMPARTIMENTOS LÍQUIDOS El ACT se distribuye en dos compartimentos principales: el líquido intracelular (LIC) y el líquido extracelular (LEC). En el feto y el recién nacido, el volumen del LEC es mayor que el del LIC (fig. en internet 52-1). La diuresis posnatal da lugar a un descenso inmediato del volumen del LEC. Ello va seguido de una expansión continua del volumen del LIC, que es resultado del crecimiento celular. Hacia el año de vida, el cociente entre el volumen del LIC y el del LEC se aproxima a los niveles del adulto. El volumen del LEC es aproximadamente el 20-25% del peso corporal y el del LIC es alrededor del 30-40% del peso corporal, cerca del doble del volumen del LEC (fig. en internet 52-2). Con la pubertad, el aumento de la masa muscular en los chicos hace que éstos tengan un volumen de LIC mayor que el de las chicas. No hay diferencia significativa en el volumen del LEC entre chicas y chicos tras la pubertad. El LEC se divide, a su vez, en el agua del plasma y el líquido intersticial (v. fig. en internet 52-2). El agua plasmática supone aproximadamente el 5% del peso corporal. El volumen sanguíneo, para un hematocrito del 40%, supone alrededor del 8% del peso corporal, aunque es más alto en recién nacidos y lactantes pequeños; en los recién nacidos prematuros constituye aproximadamente el 10% del peso corporal. El volumen del agua plasmática puede verse alterado en una serie de situaciones patológicas, como deshidratación, anemia, policitemia, insuficiencia cardíaca, osmolalidad plasmática anormal e hipoalbuminemia. El líquido intersticial, normalmente alrededor del 15% del peso corporal, puede aumentar de forma espectacular en enfermedades asociadas con edema, como insuficiencia cardíaca, enteropatía con pérdida de proteínas, insuficiencia hepática, síndrome nefrótico y sepsis. Cuando los pacientes presentan ascitis o derrames pleurales tiene lugar un aumento del líquido intersticial. En general existe un equilibrio muy delicado entre los líquidos intravascular e intersticial. El balance entre las fuerzas hidrostáticas y oncóticas regula el volumen intravascular, el cual resulta crítico para una adecuada perfusión tisular. El líquido intravascular tiene una mayor concentración de albúmina que el intersticial, y la fuerza oncótica resultante atrae agua hacia el espacio intravascular. El mantenimiento de este gradiente depende de la limitada permeabilidad de la albúmina a través de los capilares. Por el contrario, la presión hidrostática del espacio intravascular, que es debida a la acción de bombeo del corazón, arrastra líquido fuera del espacio intravascular hacia el espacio intracelular. Estas fuerzas favorecen COMPOSICIÓN ELECTROLÍTICA La composición de los solutos del LIC y el LEC es muy diferente (fig. en internet 52-3). El sodio y el cloruro son los cationes y aniones predominantes, respectivamente, en el LEC. Las concentraciones de sodio y cloruro en el LIC son mucho más bajas. El potasio es el catión más abundante en el LIC y su concentración intracelular es aproximadamente 30 veces mayor que en el LEC. Las proteínas, los [(Figura_2)TD$IG] © ELSEVIER. Fotocopiar sin autorización es un delito. [(Figura_1)TD$IG] Figura en internet 52-1 Agua corporal total, líquido intracelular y líquido extracelular expresados en porcentaje del peso corporal y en función de la edad. (De Winters RW: Water and electrolyte regulation. En Winters RW, editor: The body fluids in pediatrics, Boston, 1973, Little, Brown.) Figura en internet 52-2 Compartimientos del agua corporal total, expresados en forma de porcentaje del peso corporal total, en un niño mayor o un adulto. e52-2 & Parte VII Fisiopatología de los líquidos corporales y tratamiento hidroelectrolítico [(Figura_3)TD$IG] punto de congelación. La osmolalidad del plasma también puede calcularse según la siguiente ecuación: Osmolalidad ¼ 2 [Na] þ [glucosa]/18 þ [BUN]/2,8 Figura en internet 52-3 Concentraciones de los principales cationes y aniones del espacio intracelular y del plasma, expresadas en mEq/l. aniones orgánicos y los fosfatos son los aniones más abundantes del LIC. Esta disparidad entre los aniones del LIC y el LEC está determinada en gran parte por la presencia de moléculas intracelulares que no atraviesan la membrana celular, la barrera que separa el LEC del LIC. Por el contrario, la diferencia en la distribución de los cationes —sodio y potasio— se debe a la actividad de la bomba Na þ ,K þ -ATPasa, que utiliza energía de la célula para extraer sodio de las células e introducir potasio en las mismas. El gradiente químico entre la concentración de potasio intracelular y la extracelular crea un gradiente eléctrico a través de la membrana celular. La salida de potasio de la célula dependiente de concentración hace que el espacio intracelular sea eléctricamente negativo en relación con el espacio extracelular. La diferencia en las composiciones electrolíticas del LEC y el LIC tiene importantes implicaciones al evaluar y tratar los trastornos electrolíticos. La concentración sérica de un electrólito, medida clínicamente, no siempre refleja el contenido corporal. Ello se debe al mayor volumen del LIC comparado con el LEC y a la variación de las concentraciones de electrólitos entre ambos compartimentos. La concentración intracelular de potasio es mucho mayor que la concentración sérica. Un desplazamiento de potasio desde el espacio intracelular puede mantener una concentración normal o incluso elevada de potasio sérico, a pesar de las pérdidas masivas de potasio del espacio intracelular. Esto se ve de forma llamativa en la cetoacidosis diabética, en la que a menudo se enmascara una situación de depleción significativa de potasio debido a un desplazamiento transmembrana de éste del LIC al LEC. Para el potasio y el fósforo, electrólitos con una alta concentración intracelular, el nivel sérico puede no reflejar el contenido corporal total. De forma similar, la concentración sérica de calcio no predice el contenido corporal de éste, que se encuentra fundamentalmente en el hueso. OSMOLALIDAD El LIC y el LEC están en equilibrio osmótico porque la membrana celular es permeable al agua. Si la osmolalidad de uno de los compartimentos cambia, el movimiento del agua igualará rápidamente la osmolalidad. Esto puede dar lugar a movimientos significativos de agua entre el espacio intracelular y el extracelular. Clínicamente, el proceso primario suele ser un cambio en la osmolalidad del LEC, con un movimiento resultante de agua hacia el LIC si disminuye la osmolalidad del LEC o fuera del LIC si la osmolalidad del LEC aumenta. La osmolalidad del LEC puede calcularse y suele ser igual a la del LIC. La osmolalidad normal del plasma es de 285-295 mOsm/kg, y se mide a través del grado de depresión del La glucosa y el nitrógeno ureico en sangre (BUN) se miden en mg/dl. La división entre 18 y 2,8, respectivamente, convierte estas unidades en mmol/l. La multiplicación del sodio por 2 obedece a sus aniones acompañantes, sobre todo cloruro y bicarbonato. La osmolalidad calculada suele ser ligeramente inferior a la osmolalidad medida. La glucosa y la urea normalmente contribuyen poco a la osmolalidad plasmática; la multiplicación por 2 del sodio proporciona una aproximación de la osmolalidad. La urea no está confinada al espacio extracelular, porque atraviesa con facilidad las membranas celulares y su concentración intracelular iguala aproximadamente a su concentración extracelular. Mientras que una elevada concentración de sodio causa desplazamiento de agua desde el espacio intracelular, con la uremia no hay gradiente osmolar entre los dos compartimentos y en consecuencia no hay movimiento de agua. La única excepción se produce durante la hemodiálisis, cuando el descenso de la urea extracelular es tan rápido que la urea intracelular no tiene tiempo para equilibrar. Esto puede dar lugar al síndrome de desequilibrio, en el cual el agua se desplaza al interior de las neuronas, y puede causar síntomas graves. El etanol, al cruzar libremente las membranas celulares, es otro osmol inefectivo. La osmolalidad efectiva puede calcularse de la siguiente manera: Osmolalidad efectiva ¼ 2 [Na] þ [glucosa]/18 La osmolalidad efectiva (también llamada tonicidad) determina la fuerza osmótica que media los desplazamientos de agua entre el LEC y el LIC. La hiperglucemia incrementa la osmolalidad plasmática porque la glucosa no está en equilibrio con el espacio intracelular. Durante la hiperglucemia se produce un desplazamiento de agua desde el espacio intracelular al extracelular. Esto es clínicamente relevante en niños con hiperglucemia durante la cetoacidosis diabética. El desplazamiento del agua causa dilución del sodio en el espacio extracelular y da lugar a hiponatremia a pesar de una elevada osmolalidad plasmática. La magnitud de este efecto se calcula de la siguiente forma: [Na]corregido ¼ [Na]medido þ 1,6 ([glucosa] 100 mg/dl)/100 donde el [Na]medido es igual a la concentración de sodio medida por el laboratorio clínico y el [Na]corregido es igual a la concentración de sodio corregida (la concentración de sodio si la concentración de glucosa fuese normal y si el agua acompañante regresara al interior de la célula). La [Na]corregida es el indicador más fiable del índice verdadero del sodio corporal total del paciente en relación con el ACT, el determinante normal de la concentración de sodio. En general, la osmolalidad medida y la calculada difieren en unos 10 mOsm/kg. Sin embargo, hay algunas situaciones clínicas en las que esto no ocurre. La presencia de «osmoles no medidos» hace que la osmolalidad medida esté significativamente elevada en comparación con la calculada. Esa diferencia es el hiato osmolal, que está presente cuando la osmolalidad medida supera en más de 10 mOsm/kg a la calculada. Algunos ejemplos de osmoles no medidos son el etanol, el etilenglicol, el metanol y el manitol. Estas sustancias aumentan la osmolalidad medida pero no forman parte de la ecuación de la osmolalidad calculada. La presencia de un hiato osmolal es una pista clínica de la presencia de osmoles no medidos y puede ser útil desde el punto de vista diagnóstico cuando hay sospecha clínica de intoxicación con metanol o etilenglicol. La seudohiponatremia es la segunda situación en la cual existe discordancia entre la osmolalidad medida y la calculada. Los lípidos y las proteínas son los sólidos del suero. En pacientes con elevación de los lípidos o las proteínas séricas, el contenido en agua del suero disminuye porque el agua se ve desplazada por la mayor cantidad de sólidos. Algunos laboratorios clínicos miden la concentración de sodio determinando la cantidad de sodio por litro de suero, inclu- Capítulo 52 Trastornos electrolíticos y acidobásicos & e52-3 © ELSEVIER. Fotocopiar sin autorización es un delito. yendo el componente sólido. Cuando éste aumenta, se produce un descenso en la concentración de sodio por litro de suero, a pesar de la concentración normal de sodio en base a la cantidad de sodio por litro de agua sérica. Es la concentración de sodio en el agua sérica la que tiene relevancia fisiológica. En esas situaciones, la osmolalidad plasmática es normal a pesar de la presencia de seudohiponatremia debido a que el método para medir la osmolalidad no se ve influido de forma apreciable por el porcentaje de suero que está compuesto por lípidos y proteínas. La seudohiponatremia se diagnostica encontrando una osmolalidad plasmática medida normal a pesar de la hiponatremia. Este artefacto de laboratorio no ocurre si la concentración de sodio en agua se mide de manera directa con un electrodo específico de iones, como los instrumentos utilizados para determinar los gases en sangre arterial. Cuando no hay osmoles no medidos y la seudohiponatremia no es una preocupación, la osmolalidad calculada proporciona una estimación precisa de la osmolalidad del plasma. La medición de la osmolalidad plasmática es útil para detectar o monitorizar osmoles no medidos y confirmar la presencia de hiponatremia verdadera. Mientras muchos niños con una osmolalidad plasmática alta están deshidratados, como se ve en la deshidratación hipernatrémica o en la cetoacidosis diabética, la osmolalidad plasmática alta no siempre equivale a deshidratación. Por ejemplo, un niño con intoxicación por sal o uremia tiene una osmolalidad plasmática elevada, pero puede estar sobrecargado de volumen. En muchas ocasiones es mejor centrarse en los componentes de la osmolalidad plasmática y analizarlos de manera individual para sacar una conclusión clínica correcta. BIBLIOGRAFÍA Garibaldi BT, Cameron SJ, Choi M: Pseudohyponatremia in a patient with HIV and hepatitis C coinfection, J Gen Intern Med 23:202-205, 2008. Nguyen MK, Ornekian V, Butch AW, et al: A new method for determining plasma water content: application in pseudohyponatremia, Am J Physiol Renal Physiol 292:F1652-F1656, 2007. Pellegrino B, Parravani A, Cook L, et al: Ethylene glycol intoxication: disparate findings of immediate versus delayed presentation, W V Med J 102:32-34, 2006.