REACCIONES DE LOS ALCOHOLES. Las reacciones
Anuncio
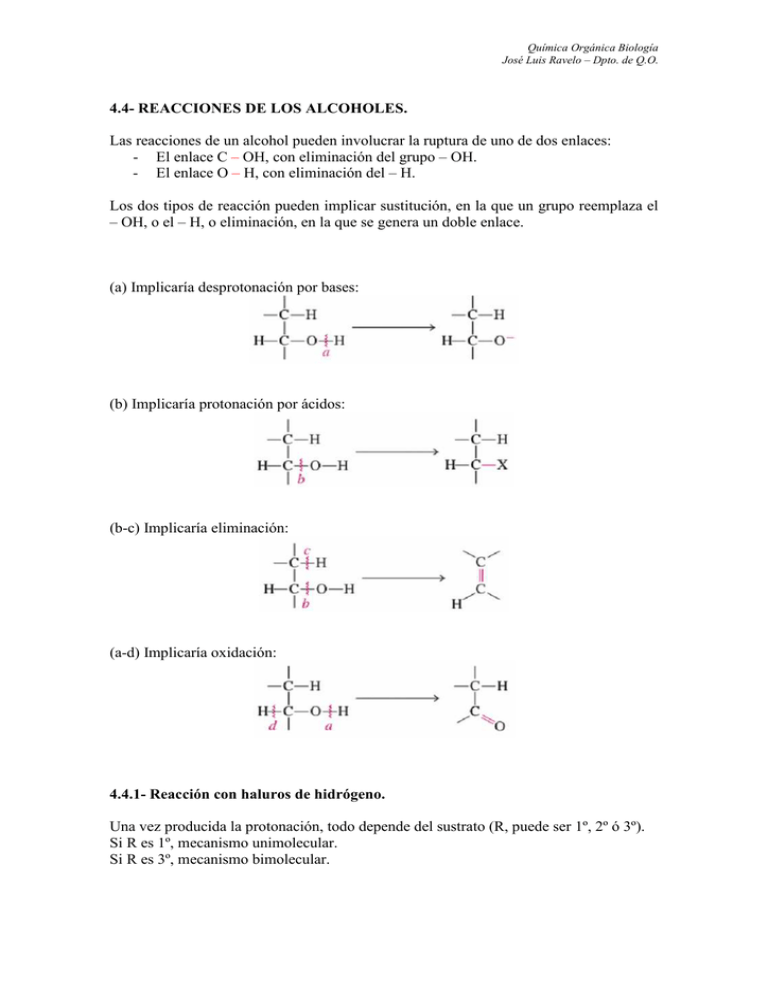
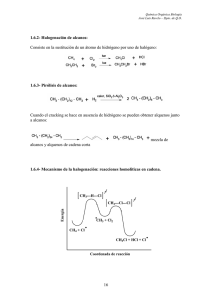
Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. 4.4- REACCIONES DE LOS ALCOHOLES. Las reacciones de un alcohol pueden involucrar la ruptura de uno de dos enlaces: - El enlace C – OH, con eliminación del grupo – OH. - El enlace O – H, con eliminación del – H. Los dos tipos de reacción pueden implicar sustitución, en la que un grupo reemplaza el – OH, o el – H, o eliminación, en la que se genera un doble enlace. (a) Implicaría desprotonación por bases: (b) Implicaría protonación por ácidos: (b-c) Implicaría eliminación: (a-d) Implicaría oxidación: 4.4.1- Reacción con haluros de hidrógeno. Una vez producida la protonación, todo depende del sustrato (R, puede ser 1º, 2º ó 3º). Si R es 1º, mecanismo unimolecular. Si R es 3º, mecanismo bimolecular. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. Ejemplos: Se trata de un sustrato terciario, luego el mecanismo va vía carbocatión terciario, mecanismo por etapas, SN1. Mecanismo: Veamos el caso de un sustrato primario, y por lo tanto mecanismo concertado, SN2. Ejemplo de eliminación, mecanismo por etapas, E1. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. 4.4.2- Reacción con trihalogenuros de fósforo. Mecanismo: Primer paso: Segundo paso: El ácido fosforoso (HOPBr2) continúa reaccionando sucesivamente con dos moléculas más de alcohol, convirtiéndolos también en haloalcano. 4.4.3- Reacción con cloruro de tionilo. En el primer paso, el grupo hidroxi ha sido transformado en un mejor grupo saliente. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. En el segundo paso se produce el desplazamiento mediante un nucleófilo, el ión cloruro. 4.4.4- Reacciones con sulfonatos de alquilo. Los sulfonatos de alquilo son, con frecuencia, sólidos cristalinos que pueden aislarse y purificarse antes de someterlos a reacciones posteriores. Los grupos sulfonato se desplazan fácilmente con iones haluro (Cl-, Br-, I-). Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. 4.4.5- Reacción de deshidratación. Para evitar las transposiciones se convierte el alcohol primario o secundario en un sulfonato de alquilo (mesilato o tosilato) y se trata con una base fuerte y voluminosa. 4.5- REACCIONES DE LOS FENOLES. Los fenoles no sólo dan las reacciones de sustitución electrofílica típicas en la mayoría de los compuestos aromáticos, sino también muchas otras, que son posibles gracias a la reactividad excepcional del anillo. Estas reacciones serán estudiadas cuando veamos los anillos aromáticos y derivados. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. 4.6- REACCIONES DE LOS ÉTERES. Los éteres son estables a bases y agentes oxidantes y reductores, sólo pueden ser atacados en medios fuertemente ácidos. La síntesis de Williamson: Los éteres cíclicos también pueden prepararse mediante síntesis de Williamson intramolecular. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. Uno de estos anillos pueden ser los epóxidos (anillos de tres miembros): La apertura de un epóxido asimétrico tiene una regioquímica diferente según el medio de reacción empleado, pero el carbono que es atacado siempre sufre inversión de su configuración. Veamos en primer lugar la apertura en medio básico: Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. Veamos ahora la apertura en medio ácido: 4.7- REACCIONES DE LOS TIOLES. La reactividad de tioles y sulfuros es muy parecida a la de alcoholes y éteres, respectivamente. Química Orgánica Biología José Luis Ravelo – Dpto. de Q.O. La diferencia más significativa, y de importancia biológica es la facilidad de oxidación de los tioles.