Lectura Periodicidad
Anuncio

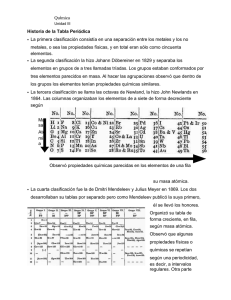
UNIDAD DE APRENDIZAJE: 3 “ELEMENTOS QUÍMICOS Y PERIODICIDAD” LECTURA: PERIODICIDAD QUIM. GABRIEL JIMENEZ ZERON El Sistema periódico o Tabla periódica es el esquema de todos los elementos químicos dispuestos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos. La tabla periódica es la forma que tienen los científicos de almacenar la información relacionada con los elementos para una fácil consulta de la misma. Es como una enciclopedia de los elementos que existen en nuestro planeta, sólo que la información está resumida en números y, según nuestro conocimiento, de estos números podemos inferir las propiedades de cada elemento. La forma en que está organizada la tabla periódica se basa en el número atómico del elemento. La clasificación periódica de los elementos que actualmente se conoce, se desarrolló como consecuencia de tres ideas básicas de la química del siglo XIX, las cuales fueron: 1. El intento de llegar a una clasificación natural y ordenada de los elementos conocidos. 2. La aceptación de que hay una relación estrecha entre una cantidad fundamental y característica de cada elemento (masa atómica) y ciertas propiedades del mismo. 3. El reconocimiento de que la periodicidad de las propiedades del comportamiento químico de los elementos son dependientes de esa cantidad fundamental y característica de cada elemento. Características y propiedades de los Metales y No metales: Metales. ♦ Son sólidos a temperatura ambiente, excepto el Mercurio (Hg) que es liquido. ♦ La mayor parte son más densos que el agua exceptuando el Litio (Li), el sodio (Na) y el potasio (K). ♦ Presentan brillo metálico. ♦ Son maleables, es decir, se les puede convertir en láminas, por ejemplo, el Oro (Au), es el más maleable. ♦ Son dúctiles, es decir, se pueden hacer con ellos hilos o conductores. Ejemplo: Cobre (Cu), y Aluminio (Al). ♦ Son buenos conductores del calor. No Metales. ♦ Algunos son sólidos, otros son gaseosos y el único que es liquido es el Bromo (Br) a temperatura ambiente. ♦ En general son menos densos que el agua. ♦ No brillan. ♦ No son maleables, los que son sólidos se pulverizan al golpearlos. ♦ No son dúctiles. ♦ No son buenos conductores del calor. ♦ Son buenos conductores de la electricidad la Plata (Ag), es el mejor conductor, también esta el Cobre (Cu). ♦ No son buenos conductores de la electricidad. ♦ Su molécula es monoatómica ♦ Sus moléculas no son monoatómicas, es decir, en su mayoría son diatómicas, triatómicas o poliatómicas. ♦ Sus átomos tienen uno, dos o tres electrones en el ultimo nivel energético. ♦ Sus átomos al combinarse pierden electrones convirtiéndose en iones positivos (Cationes). ♦ Se combinan con el Oxígeno para formar Óxidos Básicos como el Oxido de Fierro y otros. ♦ Sus átomos tienen cinco, seis o siete electrones en su último nivel energético. ♦ Sus átomos al combinarse ganan electrones convirtiéndose en iones negativos (Aniones). ♦ Se combinan con el Oxígeno para formar Óxidos Ácidos o Anhídridos como el Dióxido de Azufre y otros. PROPIEDADES PERIÓDICAS Las propiedades periódicas siguen una tendencia definida por la estructura de la tabla periódica de Mendeleiev, es decir, que varían más o menos continuamente a lo largo de un periodo y de un grupo. Además la formación del Enlace Químico esta en estrecha relación con las propiedades periódicas tales como; valencia principal, energía de ionización, afinidad electrónica, tamaño atómico y electronegatividad. Energía de Ionización. Una propiedad periódica muy importante para entender la química es la de la energía de ionización (I), que se define como: La energía necesaria para eliminar un electrón de un átomo en estado y formar un ion gaseoso. Como el electrón más externo es el que se encuentra más débilmente unido al átomo, es el primero en perderse y el resto del átomo es el que se le conoce comúnmente como catión; un ion con carga positiva, debido a que ahora el átomo tiene más protones que electrones. Átomo + energía de ionización catión + electrón La forma de expresar el ion es escribiendo el símbolo del elemento con un signo positivo + y un número que represente la cantidad de electrones perdidos por el átomo, por ejemplo: Na + 8.24 x 10-19 J Na+ + 1 electrón. La siguiente tabla muestra la energía de ionización en MJ / mol. En un periodo Símbolo I Li 0.520 Be 0.899 B 0.801 C 1.086 N 1.402 O 1.134 F 1.681 Ne 2.081 En una familia o grupo Símbolo I Li 0.520 Na 0.496 K 0.419 Rb 0.403 Cs 0.376 Los elementos de la misma familia (grupo) tienen una energía de ionización similar, aunque decrece ligeramente de arriba hacia abajo en la tabla periódica larga. En un periodo la energía de ionización tiende a crecer, de izquierda a derecha, lo que significa que aumenta la dificultad para eliminar un electrón. Al principio del periodo se encuentran los elementos fácilmente ionizables (los metales alcalinos) y a la derecha de la tabla periódica los más difíciles de ionizar (los no metales). ELEMENTOS IMPORTANTES Y SUS USOS SÍMBOLO NOMBRE CARACTERÍSTICAS Y USOS Metal ligero, resistente a la corrosión, se puede laminar e hilar por lo Al Aluminio que se emplea en construcción, en partes para vehículos, de aviones y utensilios domésticos. No-metal sólido de color amarillo. Se emplea en la elaboración de S Azufre fertilizantes, medicamentos, insecticidas, productos químicos y petroquímicos. Metal de color blanco que se emplea en la elaboración de acero, Co Cobalto especialmente debido a su alta resistencia al calor, corrosión y fricción. También se emplea como pigmento azul para el vidrio. Metal de color rojo que se emplea principalmente como conductor eléctrico, en la elaboración de monedas y aleaciones como el latón Cu Cobre y el bronce. Metal dúctil, maleable de color gris negruzco que se oxida fácilmente al contacto con el aire húmedo. Se emplea principalmente como Fe Hierro materia prima de la elaboración del acero. No-metal, que está contenido en la fluorita (CaF2) de donde se obtiene el ácido fluorhídrico el cuál se emplea para grabar vidrio y en F Flúor la industria química. Se presenta en forma alotrópica como fósforo blanco, rojo y negro. P Fósforo Este se emplea como fosfato en la elaboración de fertilizantes, detergentes, lacas, cerámicas etc. Metal líquido a temperatura ambiente, de color blanco brillante, Hg Mercurio resistente a la corrosión y buen conductor eléctrico que se emplea en la fabricación de termómetros, amalgamas dentales, baterías. Metal de color blanco. Su uso principal, elaboración de monedas, vajillas y joyas. También se emplea en fotografía, aparatos Ag Plata eléctricos, aleaciones, soldaduras etc. Metal blanco, resistente a la corrosión que se emplea en la Pb Plomo fabricación de baterías, acumuladores, pinturas, soldaduras, tuberías etc. Metal de color amarillo, dúctil brillante y de gran valor. Se emplea en joyería, piezas dentales, aunque formando aleaciones con otros Au Oro elementos. Elemento raro en la naturaleza que no se presenta en estado libre, U Uranio es radiactivo y forma isótopos que pueden producir energía nuclear por lo que se utiliza como combustible nuclear. ELEMENTOS TOXICOS SÍMBOLO NOMBRE CONSECUENCIAS El envenenamiento se produce por ingestión, inhalación vapores principalmente por un gas llamado estibina SbH3. de Sb Antimonio As Arsénico S Azufre Es uno de los elementos más venenosos, así como sus compuestos Sus compuestos como el SO2 y el SO3 contaminan el aire y el agua y producen la lluvia ácida. El gas H2S es sumamente tóxico. Br Bromo Sus vapores contaminan el aire, además sus compuestos derivados son lacrimógenos y venenosos. Cl Cloro Cr Cromo P Fósforo Pb Plomo Hg Mn Cd Los vapores de compuestos orgánicos clorados como insecticidas anestésicos, solventes, dañan el hígado y el cerebro. Algunos medicamentos que contienen cloro afectan el sistema nervioso. El cromo y sus compuestos son perjudiciales al organismo, pues destruyen todas las células. El fósforo blanco o amarillo es muy venenoso, el rojo no lo es pero se encuentra contaminado por el blanco. También son venenoso los vapores de gas PH3. Sus sales son muy venenosas para el organismo. Este elemento se inhala del aire o se ingiere con los alimentos y el agua. Elemento tóxico que contamina el agua, el aire y causa envenenamiento La inhalación de humos y polvos conteniendo manganeso causa Manganeso envenenamiento. También contamina el agua y atrofia el cerebro. Mercurio Cadmio Metal tóxico, contenido en algunos fertilizantes y contamina el suelo TABLA PERIÓDICA Información • • • • • • • • • • • • • • • • • • • • • • • Símbolos. Numero Atómico (Z). Masa Atómica. (uma) Valencia. Distribución electrónica. Niveles de Energía. Subniveles de Energía Estados de Agregación. Electronegatividad (pauling). Punto de Fusión. Punto de Ebullición. Isótopos. Densidad (m/v). Radio Atómico. (A°) Volumen Atómico. Energía de Ionización. Afinidad Electrónica. Calor de vaporización. Conductividad Térmica. Conductividad Eléctrica. Carácter Metálico. Elementos Sintéticos. Elementos Radiactivos. Tabla periódica moderna • • • • • • • • Dalton. Johann W. Döbereiner. A.Reina Newlands. Juluis Lothar Meyer Dimitri Mendeleiev. Meyer – Mendeliev Alfred Werner. H. G. J. Moseley Primeras Descripción Grupos. Grupo o Familia “A” Grupo o Familia “B” Periodo 1 Periodo 2 Periodo 3 Periodo 4 Periodo 5 Periodo 6 Periodo 7 Bloques. Bloque “s” Bloque “p” Bloque “d” Bloque “f” La parte separada Nombres y Simbología de los elementos Químicos Serie de los Lantanidos. Serie de los Actinidos Elemento Peso atómico Valencia Hidrogeno 1.0007 1 Berilio 9.013 2 Boro 10.82 3 Carbono 12.011 4 Nitrógeno 14.008 5 Oxígeno 16.000 2 Flúor 19.000 1 Sodio 22.991 1 Magnesio 24.320 2 Aluminio 26.980 3 Tabla periódica Meyer - Mendeleiev periodos grupos I 1 H 2 Li 3 4 R b 6 7 Be III B Na Mg Al A B A B A B K 5 II C s Fr IV C Si A B V N O VI VII VIII F P S Cl A B A B A B Fe Co Ni Ru Rh Pd Os Ir Pt C a Sr DESCRIPCIÓN DE LA TABLA PERIÓDICA PERIODO METALES GRUPOS NO METALES METALOIDES Se representan con números romanos. Ocho del “A” Ocho del “B” Se representan con números arábigos. (del 1 al 7). Periodo 1: dos elementos. Periodo 2: ocho elementos. Periodo 3: ocho elementos. Periodo 4: agrupa 18 elementos. Periodo 5: tiene 18 elementos. Periodo 6 consta de 32 elementos Periodo 7 con 28 elementos. •Metales Estado natural. • Propiedades físicas. • Propiedades químicas. • Aleaciones. • Procesos metalúrgicos. • Beneficio. • Refinado. • Laminado. • Usos metales •NoEstado natural. • Propiedades físicas. • Propiedades químicas. • Formas alotrópicas. • Usos. Grupo o familia “A” llamados elementos representativ os o normales Grupos o Familia “B” Llamados elementos de transición