CONCEPTOS Y ECUACIONES BÁSICAS 0,1 mol AcH en 1 L de
Anuncio

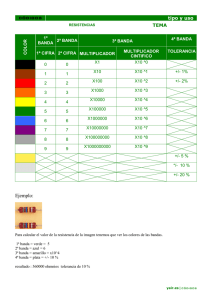
Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 1 CONCEPTOS Y ECUACIONES BÁSICAS 0,1 mol AcH en 1 L de solución. Se sabe que 1,34 % de las moléculas reaccionan con el agua. Por lo tanto: [Ac-] = [H+] = 0,00134 M AcH + OH2 = Ac- + H3O+ Ca = 0,1M se denomina concentración analítica de AcH. [AcH] es la concentración molar de AcH en el equilibrio. Quedan sin disociar 0,1 – 0,00134 = 0,09866 = [AcH] • Balance Molar del Material (B.M.) Con referencia al número de partículas antes y después de las reacciones químicas: Ejemplo anterior 0, 1M = [AcH] + [Ac-] Otro ejemplo PO4H3 0,1 M = [PO4H3] + [PO4H2-] + [PO4H-2] + [PO4-3] • Balance Eléctrico (B.E.) Cloruro de sodio en agua. ClNa + H2O Æ Na+ + Cl- H2O ↔ H+ + OH- B.E. [H+] + [Na+] = [OH-] + [Cl-] Acido fosfórico en agua. PO4H3 ↔ H+ + PO4H2- PO4H3 ↔ 2H+ + PO4H-2 PO4H ↔ 3H+ + PO4-3 H2O ↔ H+ + OH- B. E. [H+] = [PO4H2-] +2 [PO4H-2] +3 [PO4-3] + [OH-] Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 2 • Balance protónico ó Condición protónica Puede deducirse a partir de las ecuaciones de BM y BE 1. Señalar las especies que se encuentran presentes en el punto de partida ó nivel cero. Agua y las moléculas ó iones que participan en reacciones protolíticas. Ejemplo: NaCl en agua, no figuran ni Cl- ni Na+ NaAc en agua, solo participará el ión AcNH4Ac en agua, participarán Ac- y NH4+ 2. Formular todas las ecuaciones de las reacciones protolíticas posibles, a partir de las especies presentes en el “nivel cero”. 3. Escribir el B.P. teniendo en cuenta que [H + ] = ∑ [H + ] producidos − ∑ [H + ]consumidos Tener presente siempre que computadas las reacciones de protólisis, cada una debe ir multiplicada por un factor igual al número de H+ implicado en la reacción en cuestión. Ejemplos: • Solución de ácido monoprótico débil (AcH) → + H 2 O← H + OH − → + AcH ← H + Ac − B.P. [H + ] = [OH − ] + [Ac − ] • Solución de ácido catiónico (NH4Cl) → + H 2 O← H + OH − → NH 4+ ← H + + NH 3 B.P. [H + ] = [OH − ] + [NH 3 ] • Solución de base aniónica y ácido catiónico (NH4Ac) Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 → + H 2 O← H + OH − → Ac − + H + ← AcH → NH 4+ ← H + + NH 3 [H + ] = [OH − ] + [NH 3 ] − [ AcH ] B.P. • Solución de base aniónica (Na2S, dibásica) → + H 2O← H + OH − → S − 2 + H + SH − ← → S − 2 + 2 H + ← SH 2 [H + ] = [OH − ] - ([SH - ] + 2[SH 2 ]) B.P. • Solución de ácido poliprótico débil (H2S, diprótico) → + H 2 O← H + OH − − + SH 2 → ← SH + H −2 SH 2 → + 2H + ←S [H + ] = [OH − ] + [SH - ] + 2 [S -2 ] B.P. • Solución de anfolito (Na2PO4H) → + H 2 O← H + OH − → HPO4−2 ← PO4−3 + H + → HPO4−2 + H + ← H 2 PO4− → HPO4−2 + 2 H + ← H 3 PO4 B.P. [H + ] = [OH − ] + [PO 4 3- ] − ( [H 2 PO -4 ] + 2[H 3 PO 4 ]) 3 Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 4 DISTRIBUCIÓN de las ESPECIES ÁCIDO – BASE con el pH Qué ocurre si se agrega un ácido fuerte a una solución de ácido débil (o una base fuerte) OHCH3-COOH CH3-COO- + H+ H+ Acido monoprótico débil AH → ← B.M . C a = [ A − ] + [AH ] − [ A − ][ H + ] (1) K a = [AH ] + A ( ac ) + H ( ac ) [ AH ] = [ A − ][ H + ] Ka de Ka en [ A − ][ H + ] + [ A − ]K a [ A − ][ H + ] − B.M . C a = + [A ] = Ka Ka de donde [ A − ] = C a y [ AH ] = C a Ka + Ka + [H ] [H + ] [H + ] + K a ( ( ) = f Ca , K a , [ H + ] ) = f Ca , K a , [ H + ] Las funciones anteriores pueden representarse como fracciones: [ AH ] α0 = Ca [ A− ] y α1 = Ca (α: coeficiente de distribución de especies) De acuerdo con el B.M. α 0 + α1 = 1 y, cuando [H+] = Ka , pH = pKa α0 = α1 = 0,5 Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 DIAGRAMA DE DISTRIBUCION DE ESPECIES 1.0 0.8 pKa = 5 α0 α1 Buffer? α 0.6 0.4 pH = pKa 0.2 0.0 0 2 4 6 8 10 12 14 pH Acido diprótico débil [ AH − ][ H + ] = [AH 2 ] AH 2 → ← AH (ac) + H (ac) (1) K a1 AH − → ← A− 2 (ac) + H + (ac) (2) K a 2 = B.M . − + [ A− 2 ][ H + ] [AH − ] Ca = [ A− 2 ] + [AH − ] + [ AH 2 ] + 2 ⎛ [ H + ]2 [A - 2 ] [ H + ][A - 2 ] [ H + ] ⎞⎟ −2 −2 ⎜ [H ] Ca = + + [A ] = [A ] + +1 = ⎜K K ⎟ K a1K a 2 Ka2 ⎝ a1 a 2 K a 2 ⎠ ⎛ [ H + ]2 + K a1[ H + ] + K a1K a 2 ⎞ ⎟ = [ A− 2 ]⎜ ⎟ ⎜ K K a a1 2 ⎝ ⎠ K a1K a 2 → ∴ [ A− 2 ] = C a = f (Ca , K a1, K a 2 ,[ H + ]) + 2 + [ H ] + K a1[ H ] + K a1K a 2 [ AH − ] = Ca [ AH 2 ] = Ca K a1[ H + ] [ H + ]2 + K a1[ H + ] + K a1K a 2 [ H + ]2 [ H + ]2 + K a1[ H + ] + K a1K a 2 5 Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 α1 = [AH-]/Ca α0 = [AH2]/Ca 6 α2 = [A2-]/Ca Se muestra para el caso del ácido oxálico: 1,0 0,8 0,6 OX α OXH 2 OXH pKa1 = 1,2 pKa2 = 4,2 = - 0,4 α0 α1 α2 0,2 0,0 0 2 4 6 8 10 pH pK 1 pK 2 Cálculo de [H+] en soluciones acuosas Se consigue aplicando el B.P., las ecuaciones de distribución de especies en función del pH y de Kw • Acidos monopróticos → + H 2 O← H + OH − → + AH ← H + A− B.P. [H + ] = C a [H + ] = [OH − ] + [A − ] Ka [H + ] + K a + Kw [H + ] Para ácidos monopróticos fuertes o débiles, diluídos ó concentrados Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 7 • Acidos fuertes: Ka >> [H+] [H + ] = Ca + Kw [H + ] [H + ]2 − Ca [H + ] - K w = 0 En soluciones diluídas de ácidos fuertes 1/ 2 ⎞ C ⎛ C2 [H ] = a + ⎜ a + K w ⎟ ⎟ 2 ⎜⎝ 4 ⎠ + 1/ 2 -6 Si Ca ≥ 10 M C ⎛ C2 ⎞ [H ] = a + ⎜ a ⎟ 2 ⎜⎝ 4 ⎟⎠ + =2 Ca 2 [H + ] = Ca ≥ 10 − 6 M Equilibrios ácido – base en sistemas múltiples Acidos: H3PO4; H2S; H2Se; H2CO3 Ka2 ≈ 10− 4 − 10− 6 K a1 Succínico HCOO-(CH2)2-COOH, adípico HCOO-(CH2)4-COOH H4P2O7 pK1 = 1,52 pK2 = 2,36; Ka2 ≈ 10−1 K a1 pK3 = 6,60; pK3 = 9,25 Si contiene solamente AHn generalmente puede considerarse solo la primera ionización. → + H 2O← H + OH − − + AH 2→ ← AH + H → AH − ← A− 2 + H + Kw (1) K1 (2) K2 (3) 5 ecuaciones, 5 incógnitas Æ la solución exacta es de cuarto grado en H+ Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 8 [H + ] = [AH - ] + 2[A -2 ] + [OH - ] (4) B.P. [H + ]K 1 + 2 K1 K 2 + [H ] = C a + 2 + [H ] + [H ]K1 + K1 K 2 + Kw + [H ] (5) se Kw desprecia + [H ] (la solución es ácida) a ) y si K 2 << [H + ] [H + ] = C a b) si K 2 > [H + ] [H + ] = C a K1 + [H ] + K1 ( 6) Acido monoprótico débil Se desprecia Kw / [H+] ∴ K1 > [H + ] K 2 K1 K 2 K w + + = 2C a + w+ K1 K 2 [H ] [H ] Acido diprótico fuerte Cálculo de la concentración de todas las especies de ácido oxálico 0.001M!! Ka1 = 0.065 (pKa1 = 1,19) [H+] = [AH-] K a1 = Ca = [AH2] + [AH-] + [A=] [H + ]2 + Ca − [H ] [AH2 ] = Ca Ka2 = 6,1 x 10-5 (pKa2 = 4,21) [H + ]2 + K a1[H + ] - K a1Ca = 0 [H + ]2 + 2 + [H ] + K a1[H ] + K a1K a 2 ⇒ La condición protónica lleva a: ∴ [AH2] = Ca – [H+] [H + ] = 9,85x10- 4 M [AH 2 ] = 1,41x10-5 M Química Anlítica (9123) titulacciones ácido-base - SUBTEMA 2 ⎛ ⎛ 2K ⎞ ⎞ [H]´= [OH - ] + [AH - ] + 2[A - ] ⇒ [H]´= ⎜ K w + K a1 [AH 2 ]⎜⎜1 + +a2 ⎟⎟ ⎟ ⎜ ⎟ ⎝ [H ] ⎠ ⎠ ⎝ ⎛ −14 2x6.1x10 -5 ⎞ ⎞⎟ + −5 ⎛ ⎜ ⎜ ⎟ [H ]´= 10 + 0.065 x1.41x10 ⎜1 + −4 ⎟ ⎟ ⎜ 9.85 x10 ⎠ ⎠ ⎝ ⎝ 9 1/ 2 1/ 2 = 1.01x10 −3 M compare con C a con esta [H+ ] ⇒ [AH2] = 1,44x10-5 M ⇒ [H+ ]´´= 1,02x10-3 M [OH-]= 10-14/1,02x10-3 = 9,8 x 10-12 M α AH − = [AH2]= 1,44 x 10-5 M 0.065 x1.02 x10−3 (1.02 x10 −3 ) 2 + 0.065 x1.02 x10−3 + 0.065 x6.1x10 −5 = 6.63 x10−5 7.13 x10−5 = 0.93 [AH- ] = 0.93x10-3 M = 9.3 x10− 4 M α A− 2 = 0.065 x6.1x10−5 7.13 x10 −5 y [A - 2 ] = 5.6 x10−5 M = 0.056 C = 1.44 x10 −5 + 9.3 x10− 4 + 5.6 x10 −5 = 1x10−3 M 1.4% 93% 5.6% [AH- ] [AH2 ] [A - 2 ] [H+] en H2SO4 1 M − + SO4 H 2→ ← HSO4 + H → HSO4− ← SO4− 2 → H 2O← HO − +H +H + + K a1 = 1000 K a 2 = 0.01 K w10 −14 − [H + ] = [HSO-4 ] + 2[SO-2 4 ] + [HO ] [H + ] ≈ [HSO-4 ] = 1M (1) Química Anlítica (9123) α SO4− 2 = K a1K a 2 [H + ]2 + [H + ]K a1 + K a1K a2 titulacciones ácido-base - SUBTEMA 2 = 10 = 0.01 1 + 1000 + 10 Ca = 1M = [SO-42 ] + [HSO-4 ] + [H 2SO 4 ] 10 1M H2SO4 [H 2SO 4 ] despreciable ∴ [HSO-4 ] = 1 - [SO-42 ] = 1 - 0.01 = 0.99 M (1) [H + ] = [HSO-4 ] + 2[SO-42 ] = 1.01M de 1% de contribución del 2do protón. [H+] en H2SO4 0.01 M − [H + ] = [HSO-4 ] + 2[SO-2 4 ] + [HO ] [H + ] ≈ [HSO-4 ] = 0.01M α SO = −2 4 + 2 K a1 K a 2 + [H ] + [H ]K a1 + K a1 K a2 = 10 10 −4 C a = 0.01M = [SO -42 ] + [HSO -4 ] + [H 2 SO 4 ] ∴ [SO -42 ] = 0.5 x 0.01M = 0.005 M y + 10 + 10 = 0.5 [H 2 SO 4 ] despreciable [SO H ] = 0,005 M − 4 (1) [H + ] = [HSO -4 ] + 2[SO -42 ] = 0.005 + 2 x 0.005 = 0.015 M de Si ahora con esta [H+] vuelvo a calcular α SO = −2 4 K a1 K a 2 [H + ]2 + [H + ]K a1 + K a1 K a2 ∴ [SO -42 ] = 0.40 x 0.01M = 0.004 M α1 = 1 − 0.40 = 0.60 de = 10 (1.5x10 ) −2 2 + 15 + 10 = 0.40 α2 = [SO42-] / Ca = 0,004 / 0,01 = 0,4 α1 + α2 1 α0 0 (1) [H + ] = [HSO -4 ] + 2[SO -42 ] = 0.60 x10 −2 + 2 x 0.40 x10 −2 = 1.4 x10 −2 M Si con esta concentración se vuelve a calcular el alfa (= 0.42), se llega a: 5% de diferencia en el valor de α2 y 1,4% de [H ] = 1,42 x 10-2 M diferencia en la [H+] + (40%