Aspectos elementales en la Nomenclatura de sustancias
Anuncio

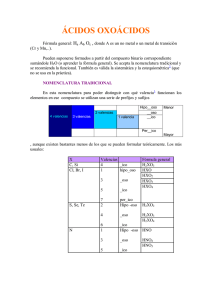
Nomenclatura de sustancias inorgánicas Aspectos elementales en la NOMENCLATURA de sustancias INORGANICAS MC. Mario Alberto Romero Bojórquez Edición del DDTEE - FCQB - UAS Diseño y Edición: IQ. Jorge Luis García Valenzuela PRIMERA EDICION DG-PEQB-001-95 Notas obtenidas de http://uas.uasnet.mx/fcqb/ Versión ampliada por: Q. Alejandro Solano Peralta FES-Cuautitlán, UNAM 1 Nomenclatura de sustancias inorgánicas INDICE I.- Prologo. 3 II.- Introducción. 4 III.- Generalidades. 5 1. Los elementos químicos 7 2. Especies Iónicas 9 3. Familias de Compuestos 10 IV.- Clasificación Periódica de los elementos: “La Tabla Periódica” 15 Metales, no metales y metaloides 16 Los números de oxidación en la tabla periódica 20 V.- Nomenclatura. 22 Nomenclatura moderna 22 Una nomenclatura común o trivial 23 Una nomenclatura sistematizada 24 Nomenclatura de compuestos con oxigeno 25 Nomenclatura de compuestos sin oxigeno 32 Nomenclatura de compuestos de coordinación 34 VI.- Bibliografía 36 Apéndice A. Algunos Prefijos y sufijos mas usuales 37 Apéndice B. Algunos Prefijos y sufijos mas usuales 43 Apéndice C. Nomenclatura de los principales ácidos 46 Apéndice D. Nomenclatura de los principales iónes 48 Apéndice E. Nomenclatura de principales radicales inorgánicos 48 Apéndice F. Nomenclatura de algunos ligantes comunes en compuestos de coordinación 49 2 Nomenclatura de sustancias inorgánicas PROLOGO Lenguaje y sistematización son medios de comunicación y esquemas de racionalidad propios del desarrollo individual y social. El dominio de un área del conocimiento se expresa cuando se alcanzan cotas elevadas de sistematización. A partir de ésta, el lenguaje cumple, además de su papel plástico y antropológico, una función tecnológica en la innumerable recreación de insumos necesarios para la creación de riquezas y el aprovechamiento y dominio de una parcela de la naturaleza. Lo Elemental en la NOMENCLATURA de las sustancias INORGANICAS es un intento plausible de poner a disposición de estudiantes y profesionales de la química información mínima de base necesaria en el tema. Esta obra constituye la continuación de un viaje que ha iniciado la Unidad Editorial del Departamento de Divulgación Tecnológica y Estudios Estratégicos. Aspiramos a una producción editorial regular que sea coadyuvante en la formación profesional de compromiso que tiene la Facultad de Ciencias Químico Biológicas. En esta aspiración, quijotesca por cierto, el trabajo, que no por sencillo menos valioso, del Maestro Mario Alberto Romero Bojórquez, docente de dedicación y productividad singular, es una contribución que con seguridad será de utilidad a estudiantes y profesionales de la química. MC. Martín M. Trejo Burgueño Unidad Editorial Departamento de Divulgación Tecnológica y Estudios Estratégicos. 3 Nomenclatura de sustancias inorgánicas INTRODUCCION Sin duda, en cualquier disciplina, el hablar un mismo idioma facilita grandemente el entendimiento. En la QUIMICA, comunicarse requiere de la homogeneización en los nombres asignados a cada una de las sustancias para así lograr un mismo idioma que nos permita identificarlas con el solo hecho de mencionar ese nombre asignado. La necesidad de un sistema general en la NOMENCLATURA química, se hizo sentir de manera muy notoria cuando el número de sustancias conocidas fue en aumento así como también las personas que trabajaban con ellas en las diferentes partes del mundo; de no lograrse, era prácticamente imposible el entendimiento y el intercambio de conocimientos. Bien podría darse el caso de personas hablando de un mismo compuesto pero con distintos nombres y por ello dar la sensación de referirse a algo diferente. La NOMENCLATURA SISTEMATIZADA ha logrado avances muy significativos, sin embargo se puede apreciar lo fuerte de las costumbres, con lo que se vuelve muy difícil erradicar algunos nombres triviales que han debido ser aceptados. Por ejemplo el TETRA OXO SULFATO DE HIERRO (II), SULFATO FERROSO Y SULFATO DE HIERRO (II); nombres que corresponden a la fórmula FeSO4, ¿Tres nombres para una misma fórmula? ¡ Aceptado ! Con cualquiera de los nombres se caracteriza al compuesto por lo tanto puede considerarse como apropiado; mas este ejemplo puede servirnos para mencionar el hecho de que bien podemos aceptar dos o más nombres para una misma fórmula pero jamás dos fórmulas corresponden a un mismo nombre. 4 Nomenclatura de sustancias inorgánicas GENERALIDADES La QUIMICA tiene como objetivo el estudio de la MATERIA, su naturaleza, estructura, propiedades y transformaciones que en ella pueden ocurrir. Entendemos por MATERIA como todo aquello que existe, encontrándonos que regularmente siempre está formando MEZCLAS de distintos tipos de materiales que podemos separar y diferenciar de acuerdo a su comportamiento y referirnos a ellas con el término SUSTANCIAS. SUSTANCIA es pues, una muestra de materia en estado de pureza. Material de un mismo tipo que por lo tanto debemos diferenciar de otros mediante un nombre; este nombre será asignado procurando dar con él la mayor información posible sobre la sustancia referida. Existe una gran diversidad de sustancias las cuales pueden ser agrupadas en familias de acuerdo a su composición y propiedades, estableciendo así una SISTEMATIZACION de todas ellas que nos permita facilitar su NOMENCLATURA. Dentro de la gran diversidad de sustancias existentes podemos formar dos grupos; uno reúne a poco más de un centenar de SUSTANCIAS SIMPLES o ELEMENTALES y el otro, al gran número de SUSTANCIAS COMPUESTAS, formadas precisamente por combinaciones que se dan entre las sustancias elementales. Una SUSTANCIA es SIMPLE cuando no puede ser descompuesta en otra más sencilla al aplicar algún método físico o químico reconocido como de uso común. Las sustancias simples son llamadas también ELEMENTOS y se representan mediante SIMBOLOS que siempre es la primera letra del nombre escrita en mayúscula pudiendo estar acompañada de una segunda letra en minúscula. Las SUSTANCIAS COMPUESTAS pueden descomponerse en sustancias simples y son propiamente llamados COMPUESTOS, se representan mediante FORMULAS las cuales están constituidas por los símbolos de las sustancias elementales que forman al compuesto así como números que especifiquen la proporción de cada uno de los elementos, suerte tal, que la fórmula nos brinde información tanto cualitativa como cuantitativa sobre la composición de la sustancia. La FORMULA de un compuesto se escribe colocando inicialmente el símbolo del elemento menos electronegativo. Sustancias Simples H Hidrógeno Ca Calcio K Potasio O Oxígeno Pb Plomo P Fósforo C Carbono Na Sodio Au Oro Sustancias Compuestas H2O Agua Na2O óxido de Sodio NH3 Amoníaco CaS Sulfuro de Calcio CO Monóxido de Carbono KBr Bromuro de Potasio Existen porciones mínimas de las sustancias que no pueden fraccionarse más sin que pierdan las 5 Nomenclatura de sustancias inorgánicas características de las sustancias; en el caso de los ELEMENTOS se le conoce como ATOMO y en los COMPUESTOS se le denomina MOLECULA. Las fórmulas de las sustancias compuestas nos dicen claramente si el compuesto está formado por átomos de un sólo elemento, de dos, tres o más; de acuerdo a esto podemos clasificarlas en: COMPUESTOS BINARIOS cuando son dos elementos diferentes los que lo integran, COMPUESTOS TERNEARIOS al ser tres y COMPUESTOS POLI-ATOMICOS en el caso de que los constituyentes sean más de tres ; esta diferenciación guarda también regular importancia en la NOMENCLATURA. MOLECULAS SENCILLAS: están formadas por un átomo o por la asociación de átomos de un sólo tipo. O2 molécula de Oxígeno He molécula de Helio O3 molécula de Ozono Na molécula de Sodio Cl2 molécula de Cloro C molécula de Carbono * La condición de una molécula es que pueda existir en forma libre por ello es que si un átomo puede cumplir con esto se le considera una molécula. MOLECULAS COMPUESTAS: son las formadas por asociación entre átomos de elementos diferentes; y se pueden clasificar en: COMPUESTOS BINARIOS: están formados por átomos de dos elementos diferentes. Se escribe primero el menos electronegativo. H2O Agua K2O óxido de Potasio NaCl Cloruro de Sodio LiI Yoduro de Litio COMPUESTOS TERNARIOS: formados por tres elementos diferentes. En este tipo de compuestos suelen formarse grupos de elementos que deben escribirse encerrados en paréntesis para representar el número de veces que se repita dicho grupo, al igual que en los BINARIOS se escribe primero el elemento o grupo de elementos menos electronegativo. (NH4)2S Sulfuro de Amonio Ca(OH)2 Hidróxido de Calcio Al2(SO4)3 Sulfato de Aluminio COMPUESTOS POLIATOMICOS: constituidos por más de tres elementos diferentes. (NH4)2CO3 Carbonato de Amonio KNaLiPO4 Fosfato de Litio Sodio y Potasio 6 Nomenclatura de sustancias inorgánicas * En este caso, la escritura de las formulas sigue los mismos criterios que en los anteriores, pero existen algunos en que es necesario modificarlos para que la fórmula sea más representativa de la forma en que los átomos se encuentran unidos en la molécula. Son ejemplos de fórmulas de compuestos diferentes aunque formados por los mismos elementos. HOCN ácido isociánico HNCO ácido ciánico HONC ácido fulmínico LOS ELEMENTOS QUÍMICOS. Los elementos, sus nombres Los nombres de los elementos proveen un fascinante "glimpse" en la historia de la química. Así, el sistema de notaciones, y símbolos, para designar los 106 elementos químicos y sus combinaciones, que forman gran número de compuestos. Este sistema consta de letra, números y marcas que sirven para denotar el elemento químico y la fórmula o estructura de la molécula o compuesto formado. De esta manera, los nombres, junto con sus símbolos, ofrecen una descripción instantáneamente reconocible del elemento o compuesto. En muchos casos, mediante los esfuerzos de las conferencias internacionales, los símbolos se reconocen en todo el mundo científico y simplifican notablemente el lenguaje universal de la química. El Oro, la plata y otros elementos han sido conocidos desde la antigüedad y su nombre refleja lo que los Romanos observaron de ellos. Por ejemplo el oro fue llamado Aurum que significa "aurora resplandeciente"; mercurio era hydroargyrum que significa "Plata liquida" y plomo proviene de Plumbum el cual en latín significaba "pesado". Algunos otros ejemplos son : Fe (de ferrum), hierro; Na (de natrium), sodio y K (de Kalium), potasio.1 Elementos conocidos en la antigüedad Antimonio Hierro Mercurio Carbón Plomo Plata Cobre Azufre Estaño Oro En el siglo XVIII, los químicos estaban intrigados en estudiar la atmósfera y los gases que ahí descubrieron fueron dado sus nombres en lo que se conocía de su química. Así hidrógeno es de la palabra griega que significa "formador de agua" y nitrógeno y oxigeno proviene del griego las cuales significan formador de soda (soda cáustica) y formador de ácido, respectivamente. 1 Si te interesa conocer un poco mas sobre los nombres y símbolos de los elementos, información mas amplia se encuentra en el apéndice A. 7 Nomenclatura de sustancias inorgánicas Los nombres de los metales, excepto para aquellos conocidos desde la antigüedad, todos terminan en -io. Por ejemplo, "Aluminio" fue el primer nombre dado al metal llamado aluminio en los estados unidos y muchas partes del mundo. Los nombres de algunos otros elementos honorífica el lugar de donde fueron descubiertos, Californio, Berkelio, Europio, Americio, Francio y Germanio. así también los cuatro hermanos, Terbio, Erbio, Yterbio e Itrio son metales y fueron aislados de minerales encontrados en Yterbia, Suiza. En años recientes, una serie de elementos hechos por el hombre tienen su nombre en honor a famosos científicos: Einstenio (Albert Einstein), Fermio (Enrico Fermi), Mendelevio (Dimitri Mendeleev), Nobelio (Alfred Nobel) y Laurencio (Ernest Lawrence). Cuando los científicos decidieron cambiar la forma de los nuevos elementos, cambiaron la vista hacia el cielo para Plutonio, Uranio, Cerio (para Ceres, un asteroide descubierto al mismo tiempo que el elemento) y por supuesto Helio (elemento descubierto en el sol, Helius), o bien en la mitología para Torio (Thor, el dios escandinavo de la guerra) y Prometio (Prometheus, el que trajo el fuego a los hombres). El honor de nombrar un elemento ha ido tradicionalmente a su descubridor. El prestigio asociado con el descubrir un elemento es reflejado en un argumento que ha perdido por años sobre como nombrar los elementos 104 y 105. En los años de 1960, equipos de Rusia y de E.U. clamaron descubrir en forma independiente los elementos 104 y 105. Los rusos sugirieron el nombre de Kurchatovio (un científico ruso) y los Estadounidenses sugirieron el nombre de Rutherfodio (Lord Ernest Rutherford) Esta controversia duro, y fue resuelta parcialmente, hasta 1978. La Unión Internacional de Química Pura y Aplicada (IUPAC por sus siglas en ingles) recomendó, que al menos por ahora, los elementos mayores al 103 serán llamados por un sistema basado mediante palabras de raíces numéricas así el elemento 104 se nombrara Unniqualdio ("un" para 1, "nil" para cero, "qual" para 4 y la terminación -io) de esta forma el elemento 105 será Unnilpentio, el 106 será Unnilhexio y así sucesivamente. los símbolos de estos elementos consistirán ahora, dentro de este sistema, de tres letras (104, Unq; 105, Unp y 106, Unh, etc.) Los elementos, sus símbolos Como mencionamos en un principio, la nomenclatura química no solo consiste en la forma de nombrarlos sino también en la forma de escribirlos. De los elementos encontrados en la tabla periódica 30 tienen la primer letra de su nombre moderno o antiguo en tanto que otros tienen dos letras. Los símbolos de los elementos en su mayoría tienen dos letras, de estas la primer letra siempre se escribe en mayúsculas y la segunda es minúscula, cuando se tiene una sola letra, como K para potasio, se acostumbra escribir en mayúsculas Algunos de los elementos tienen símbolos que no parecen estar relacionados con sus nombres, muchos de estos elementos han sido conocidos desde tiempos ancestrales y sus símbolos son derivados de sus nombres en latín, ejemplos de ello se muestran en la siguiente tabla 8 Nomenclatura de sustancias inorgánicas Nombre moderno Símbolo Derivación del símbolo Antimonio Sb Stibium Cobre Cu Cuprum Oro Au Aurum Hierro Fe Ferrum Plomo Pb Plumbun Mercurio Hg Hydrargyrum Potasio K Kalium Plata Ag Argentum Sodio Na Natrium Estaño Sn Stannum Tungsteno W wolfram Todos estos elementos excepto tungsteno (descubierto en 1783), potasio y sodio (ambos descubiertos en 1807) han sido conocidos desde la antigüedad. Todos estos símbolos son basados en nombres provenientes del latín excepto para tungsteno, W, el cual deriva del nombre del mineral Wolfram. ESPECIES IONICAS Existen fórmulas representativas de átomos o grupos de átomos que por la pérdida o ganancia de electrones han adquirido cierta carga eléctrica a la cual se le conoce como ELECTROVALENCIA, estas especies iónicas o simplemente IONES, pueden presentar carga positiva al originarse por la pérdida de electrones en átomos regularmente de elementos de baja electronegatividad como los METALES; a este tipo de ION se le conoce como CATION. Los NO METALES generalmente tienden a ganar electrones ya que presentan una gran electronegatividad; estos originan iones negativos conocidos con el nombre de ANION. La escritura de las fórmulas para los iones se hace siguiendo los mismos criterio que antes se mencionan para sustancias compuestas, agregando un signo y número alusivo a la cantidad de electrones ganados o perdidos para indicar al catión o al anión. Esta distinción se coloca en la parte superior y a la derecha de la fórmula. (SO4)-2 Anión Sulfato Mg+2 Catión Magnesio (OH)-1 Anión Hidróxido (NH4)+1 Catión Amonio (PO4)-3 Anión Fosfato K+1 Catión Potasio 9 Nomenclatura de sustancias inorgánicas * Los iónes Hidróxido y Amonio son excepción ya que primero está escrito el símbolo del elemento más electronegativo. FAMILIAS DE COMPUESTOS Si bien hemos visto alguna forma de clasificar a los compuestos agrupándolos en moléculas simples o compuestas; en compuestos binarios, ternarios o poliatómicos, estas clasificaciones nos sirven de gran ayuda en la escritura de las fórmulas, pero es poca la información que nos brindan sobre las propiedades tanto físicas como químicas de un compuesto, es por ello que resulta indispensable una clasificación que los agrupe de acuerdo a sus propiedades químicas; para tal efecto surgen las siguientes familias: OXIDOS: son compuestos binarios formados por la combinación del oxígeno con otro elemento, si el elemento es un METAL se le conoce como OXIDO METALICO o también como OXIDO BASICO. En el caso de que fuera un NO METAL se le denomina OXIDO NO METALICO u OXIDO ACIDO, y en ocasiones a algunos se les puede denominar ANHIDRIDOS. ACIDOS: compuestos que al ser disueltos en agua tienen la capacidad de aumentar l concentración de IONES HIDRONIO (H3O)+1 BASES: estas sustancias se caracterizan por aumentar la concentración de IONES HIDROXIDO (OH)-1 cuando están en solución con agua. Si en su fórmula contienen el anión (OH)-1 se les conoce como HIDROXIDOS. SALES: estos compuestos se obtienen como producto de la NEUTRALIZACION de un ACIDO o de una BASE, ya sea por reacción entre ellos mismos o con algún METAL. Estas FAMILIAS de compuestos se han establecido en base a la FUNCION QUIMICA que cada uno de ellos desarrollan al ponerse en contacto con otras sustancias. EJEMPLOS: Los OXIDOS, siendo compuestos BINARIOS se combinan con el agua para producir compuestos TERNARIOS. Los OXIDOS METALICOS producen BASES de ahí el nombre alterno de OXIDOS BASICOS. MgO + H2O ---> Oxido de Magnesio K2O Oxido de Potasio Mg(OH)2 Hidróxido de Magnesio + H2O ---> 2 KOH Hidróxido de Potasio Los OXIDOS ACIDOS reciben este nombre porque al reaccionar con el agua producen sustancias con características ACIDAS. 10 Nomenclatura de sustancias inorgánicas SO3 + H2O ---> H2SO4 Oxido de azufre VI Anhídrido sulfúrico Trióxido de azufre ácido sulfúrico CO2 + H2O ---> H2CO3 Oxido de carbono IV Anhídrido carbónico Bióxido de carbono ácido carbónico P2O5 + 3 H2O ---> Oxido de fósforo V Anhídrido fosfórico Pentaóxido de difósforo 2 H3PO4 ácido ortofosfórico o ácido fosfórico * Estos ácidos son conocidos como OXIACIDOS por la presencia del oxígeno. Un gran número de OXIDOS ACIDOS pueden también ser llamados ANHIDRIDOS dado que se obtienen mediante la deshidratación de algún OXIACIDO al ser sometido a calentamiento. ---> 2 HNO3 Ácido Nítrico N2O5 + H2O Anhídrido nítrico H2SO3 ---> Acido Sulfuroso SO2 + H2O Anhídrido sulfuroso * La DESHIDRATACION es eliminación del Agua. Por eso el nombre de ANHIDRIDO que significa SIN AGUA. Los ACIDOS pueden ser compuestos binarios o ternarios. Formados por la combinación del HIDROGENO con otro elemento o grupos de elementos de gran electronegatividad cuya principal característica es el aumento de IONES HIDRONIO (H3O)+1 al ser disueltos en agua. Esto les confiere la propiedad de neutralizar los IONES HIDROXIDO (OH)- liberados en las soluciones de las BASES formándose AGUA, además de una SAL producto de la combinación del ION negativo (ANION) y el positivo (CATION) liberados por el ACIDO y la BASE respectivamente. H2SO4 ácido + Mg(OH)2 base ---> MgSO4 sal + 2 H2O Agua 11 Nomenclatura de sustancias inorgánicas HCl + ácido NaOH ---> NaCl base sal + H2O Agua Otra característica de los ACIDOS es la liberación del HIDROGENO presente en ellos cuando reaccionan con algún METAL formándose también una SAL. Zn + H2SO4 metal Fe ---> ZnSO4 ácido + HCl metal + sal ---> Hidrógeno + FeCl2 ácido H2 H2 sal Hidrógeno Las BASES o HIDROXIDOS al ser liberadoras del ANION HIDROXIDO (OH)-1 serán capaces de neutralizar a los ACIDOS quienes liberan el CATION de HIDROGENO (H)+1 formando AGUA, por lo que MUTUAMENTE SE NEUTRALIZAN originando sustancias de una relativa estabilidad. 2 Fe(OH)3 + 3 H2SO4 base ---> Fe2(SO4)3 ácido Al(OH)3 + base 3 HCl + 6 H2O Sal ---> ácido AlCl3 sal Agua + 3 H2O Agua Como podemos apreciar, las bases son compuestos TERNARIOS con la participación de un METAL quien es realmente el que cede el electrón que le confiere la carga negativa al ANION (OH)-1, quedando él como un CATION. Esto origina que en interacciones entre compuestos que por su fórmula sean llamados hidróxidos, alguno de ellos tenga un comportamiento ACIDO, lo cual depende de la capacidd de ceder electrones de los metales. Aquel que tenga una mayor electronegatividad se comportara como NO METAL y el compuesto que lo posea se comportara como un ACIDO. 3 NaOH base + Al(OH)3 ácido ---> Na3AlO3 sal + 3 H2O agua A los elementos que dependiendo de las condiciones pueden adquirir características de METAL o de NO METAL se le conoce como METALOIDE o ANFOTERO. Ejemplo: Zn, Mn, Al, Cr, W, As, Sb, etc. Las SALES son sustancias de una relativa estabilidad cuya solubilidad y actividad química 12 Nomenclatura de sustancias inorgánicas depende de los elementos que la integran. Están formados por un CATION el cual proviene de una BASE y de un ANION cuyo origen quizá sea un ACIDO, de los cuales se ha obtenido por NEUTRALIZACION de las características de ACIDO y BASE. Pueden ser compuestos BINARIOS, TERNARIOS o POLIATOMICOS. K2SO4 NaI KNaLiPO4 sal ternaria sal binaria Poliatómica Las sales pueden reaccionar entre sí para dar productos de mayor estabilidad: AgNO3 + KCl ---> AgCl + KNO3 * Reacción entre sales en solución, donde se aprecia un desplazamiento de los componentes originándose sales de una mayor estabilidad. En compuestos con CATIONES o ANIONES multivalentes es posible que se den neutralizaciones parciales y por lo tanto las sales que así se originen podrán tener características ácidas o básicas. NaOH + H2CO3 ---> NaHCO3 + H2O sal ácida Mg(OH)2 + HCl ---> Mg(OH)Cl + H2O sal básica Este tipo de sales pueden ser neutralizadas con un ion diferente originando SALES MIXTAS. NaHCO3 + sal ácida Mg(OHCl sal básica KOH ---> base + HBr ácido KNaCO3 + H2O sal mixta ---> MgBrCl + H2O sal mixta En ocasiones las sales cristalizan absorbiendo moléculas de agua; a estas se les conoce cómo SALES HIDRATADAS, su fórmula se escribe anexándole el número de moléculas de agua a la cual se le conoce como AGUA DE CRISTALIZACION. CaSO4 . 2 H2O Sulfato de Calcio dihidratado CuSO4 . 5 H2O Sulfato cúprico pentahidratado 13 Nomenclatura de sustancias inorgánicas SALES DOBLES. Algunas sales se depositan formando cristales de dos tipos de sustancias; como ejemplo citaremos los compuestos llamados ALUMBRES cuya formación contiene SULFATOS DE CATIONES MONOVALENTES Y TRIVALENTES. K2SO4 · Al2(SO4)3 · 24 H2O sulfato doble de aluminio y potasio hidratado COMPUESTOS DE COORDINACION. También conocidos como compuestos complejos; consisten regularmente en un elemento METALICO CENTRAL al cual se unen varios aniones y/o moléculas llamados LIGANTES. Se dice que los ligantes están coordinados alrededor del METAL CENTRAL en la primera esfera de coordinación la cual se indica por paréntesis rectangulares. Estos compuestos de coordinación puede ser CATION o ANION. K3[Fe(CN)6] [Fe(CN)6]-3 Hexaciano ferrato (III) de potasio Anión Hexaciano ferrato (III) [Cu(NH3)4]Cl [Cu(NH3)4]+1 cloruro de tetrammincobre (I) Catión tetraammincobre (I) Se puede apreciar que en la escritura de la fórmula de un complejo también se escribe primero el CATION seguido del ANION. 14 Nomenclatura de sustancias inorgánicas ESQUEMA GENERAL DE LA NOMENCLATURA INORGÁNICA Metal Oxígeno Compuestos binarios Hidrógeno Sales Compuestos ternarios Óxidos básicos Peróxidos, superoxidos y ozonidos No metal Óxidos ácidos (Anhídridos) Metal Hidruros metálicos No metal Haluros de hidrógeno (hidrácidos) Semi metal Hidruros volátiles Metal + no metal Sales neutras No metal + no metal Sales volátiles Oxácidos Óxidos básicos + H2O Hidróxidos (bases) Óxidos ácidos + H2O Sales neutras (oxísales) Sales ácidas Compuestos cuaternarios Sales básicas Un anión con dos cationes Sales Dobles Un catión con dos aniones CLASIFICACION PERIODICA DE LOS ELEMENTOS: LA TABLA PERIODICA Después de conocer diferentes clasificaciones que existen sobre las distintas sustancias, resulta de gran interés y de singular importancia para una buena NOMENCLATURA de los compuestos, el conocer ciertas características de los elementos de acuerdo al acomodo que guardan en la TABLA PERIODICA. El ordenamiento de los elementos en la tabla periódica no fue hecho al azar, sino más bien es el fruto de un gran número de intentos por agruparlos en función de sus propiedades y el orden seguido es en base a un NUMERO ATOMICO que viene siendo la 15 Nomenclatura de sustancias inorgánicas cantidad de protones existentes en el NUCLEO del átomo. Tal vez la tabla periódica que resulte más común sea la conocida como de "e; DIECIOCHO COLUMNAS "e;, en esta podemos apreciar 7 renglones horizontales llamados PERIODOS, además de 18 columnas verticales llamadas GRUPOS. El nombre de TABLA PERIODICA la recibe precisamente porque cada cierto número de elementos las propiedades químicas se repiten; quedando colocados uno bajo el otro todos aquellos elementos que presentan propiedades con similitud para formarse así un GRUPO. Los PERIODOS están formados por un conjunto de elementos que teniendo propiedades químicas diferentes, mantienen en común el presentar igual número de niveles con electrones en su envoltura, correspondiendo el número de PERIODO al total de niveles. Las propiedades químicas de los elementos dependen de la distribución electrónica en los diferentes niveles, por ello; todos aquellos que tienen igual número de electrones en su último nivel presentan propiedades químicas similares, correspondiendo el número de período en que se encuentra ubicado, al del último nivel con electrones y el número de grupo guarda relación con la cantidad de electrones en la última capa. La tabla periódica suele dividirse en diversas formas según las propiedades que se deseen estudiar, de tal suerte que se agrupan conjuntos de elementos con características comunes. METALES, NO METALES Y METALOIDES Aún antes de establecerse la tabla periódica; ya el creador de la SIMBOLOGIA de los elementos J. J. BERZELIUS publicó en 1814 una clasificación sistemática en donde agrupaba dos tipos: los METALES y los NO METALES. Las características de los elementos METALICOS son: 16 Nomenclatura de sustancias inorgánicas 1. Conducen con facilidad el calor y la electricidad. 2. Presentan brillo metálico 3. Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD. 4. Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr. 5. Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES). Los NO METALES presentan las siguientes características: 1. Son malos conductores del calor y la electricidad. 2. No son maleables ni dúctiles. 3. Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES). Algunos elementos suelen comportarse según las condiciones como metales o como no metales; a estos se les conoce como METALOIDES. En la clasificación periódica de DIECIOCHO columnas podemos apreciar a estos grupos de 17 Nomenclatura de sustancias inorgánicas elementos claramente delimitados, lo cual nos parece razonable si pensamos que las características de ellos dependen de la distribución electrónica, entre más próximos estén los elementos, mayor semejanza tendrán en sus propiedades y esto se debe a que la distribución electrónica presenta también una gran semejanza. Si admitimos que las propiedades químicas de los elementos dependen de la ubicación de los electrones en su envoltura, tenemos una CLASIFICACION DE ELEMENTOS EN FUNCION DE SU DISTRIBUCION ELECTRONICA. En esta clasificación los elementos se agruparon en cuatro bloques según el tipo de orbital atómico en que se ubique su electrón diferencial. A los bloques s y p se les conoce como elementos REPRESENTATIVOS mientras que a los d y f se les denomina elementos de TRANSICION. El bloque s está formado por dos columnas, el P por seis, en el D se observan diez y el F presenta un total de 14. Como se puede observar, el número de columnas corresponde al máximo de electrones que se pueden acomodar en esos tipos de orbitales, los elementos colocados en una misma columna o grupo tendrán igual cantidad de electrones en el nivel más externo y su electrón diferencial estará en el mismo tipo de orbital. Otra clasificación que resulta importante conocer y es de gran utilidad en la NOMENCLATURA es la que nos brinda información sobre la capacidad de combinación de los elementos o sea su VALENCIA así como su ESTADO o NUMERO DE OXIDACION. 18 Nomenclatura de sustancias inorgánicas Existe una clasificación que ubica a los elementos representativos en ocho grupos identificados como A y a los de transición en B. Los elementos representativos son conocidos así porque el número de grupos representa la cantidad de electrones en su CAPA DE VALENCIA o sea el ULTIMO NIVEL y la cantidad de electrones en esa capa nos indica la valencia máxima que el elemento puede presentar. La VALENCIA de un elemento se refiere a la capacidad de combinación que presenta; en el caso de los NO METALES se relaciona con el número de átomos de hidrógeno con que se puede enlazar y en los METALES con cuántos átomos de cloro se une. Ejemplos: El Calcio se puede unir a dos átomos de Cloro por lo que su valencia es dos. CaCl2 El Oxígeno forma agua uniéndose a dos hidrógenos, su valencia también será dos. H2O El Nitrógeno se une a tres Hidrógenos en la formación de Amoníaco, su valencia es tres. NH3 En la NOMENCLATURA DE LAS SUSTANCIAS INORGANICAS resulta de mayor importancia aún conocer el ESTADO DE OXIDACION, este regularmente es la valencia con un signo que expresa la carga adquirida por el elemento al enlazarse con otros diferentes a él; es decir, átomos de distinta electronegatividad. El ESTADO o NUMERO DE OXIDACION generalmente expresa la cantidad de electrones que un átomo aporta en la formación de enlaces con otros átomos de elementos diferentes. Ejemplos: El CALCIO se une al CLORO formando el compuesto CaCl2; en este caso el Calcio tiene estado de oxidación +2 ya que emplea dos electrones al unirse con el Cloro quien presenta -1, al emplear sólo un electrón. El OXIGENO forma Agua al unirse con un estado de oxidación de -2 con el HIDROGENO que presenta +1. Existen compuestos que nos permiten establecer diferencias entre VALENCIA y NUMERO DE OXIDACION. Ejemplos: El OXIGENO al formarse el PEROXIDO DE HIDROGENO presenta valencia DOS mientras que su número de oxidación es -1; su fórmula es H2O2 y puede representarse con una estructura en donde se aprecia que cada Oxígeno solo emplea un electrón para unirse al Hidrógeno quien sería el átomo diferente; aún sin embargo son dos los enlaces que forma. Caso similar podemos observar en el Benceno cuya fórmula es C6H6 y los estados de oxidación del Hidrógeno es +1 y para el carbono -1. 19 Nomenclatura de sustancias inorgánicas Aquí observamos que el carbono forma cuatro enlaces por lo que su VALENCIA es cuatro; su NUMERO DE OXIDACION es -1 ya que sólo con un enlace se une a otro elemento diferente. LOS NUMEROS DE OXIDACION EN LA TABLA PERIODICA El conocer la posición del elemento en la Tabla Periódica nos resulta de gran utilidad para determinar su NUMERO DE OXIDACION; Los METALES presentan CARGAS POSITIVAS y los NO METALES suelen presentar NEGATIVAS aunque también pueden ser POSITIVOS dependiendo del compuesto que forme. ELEMENTOS REPRESENTATIVOS: estos elementos suelen presentar número de oxidación de acuerdo al grupo en que se ubican; el número de grupo nos dice el estado de oxidación máximo del elemento. Los elementos pueden presentar varios estados de oxidación y estos dependen del número de grupo; si el grupo es PAR, los elementos tendrán CARGAS POSITIVAS PARES desde el CERO hasta el NUMERO DE GRUPO. Si es IMPAR, las CARGAS serán IMPARES. Los elementos NO METALICOS al combinarse con elementos de menor electronegatividad 20 Nomenclatura de sustancias inorgánicas tienden a adquirir CARGAS NEGATIVAS, y esta será en un número que permita completar OCHO, al sumar el número de grupo con la cantidad de carga. Así tenemos que: el grupo VII A adquieren -1, en el VI A -2, los del V A -3 y algunos del IV A -4. Los ELEMENTOS DE TRANSICION regularmente presentan estado de oxidación +3; los grupos I y II suelen tener +1 y +2 como ocurre en Cu+1, Ag+1, Au+1 en el grupo I B y Zn+2, Cd+2 y Hg+2 del II B; también suele presentarse Cu+2, Au+3 y Hg+1. Los elementos de transición pueden adquirir números de oxidación positivos de acuerdo también al número de grupo como máximo. LOS NUMEROS DE OXIDACION EN UN COMPUESTO Los elementos que integran un compuesto presentan un estado de oxidación que puede determinarse de acuerdo al conocimiento que tenemos de su colocación en la tabla, algunos elementos suelen presentar sólo un estado de oxidación, pero otros se comportan de manera diferente dependiendo de las características de los elementos con que se combinen o también de las condiciones de reacción o ambientales en que se encuentre. Lo anterior se toma en consideración para determinar que número de oxidación presenta cada elemento en un compuesto. REGLAS ARBITRARIAS PARA ASIGNAR NUMEROS DE OXIDACON 1. Los elementos libres o moleculares que no estén combinados con otro diferente presentan carga cero. 2. La suma algebraica de los números de oxidación en los integrantes de un compuesto debe ser igual a cero. En un ion será igual a la carga del ion. 3. Los elementos del grupo I A, II A y III A invariablemente presentan carga de +1, +2 y +3 respectivamente. 4. Generalmente la carga negativa corresponde al elemento más electronegativo y todos lo demás serán positivos. 5. En el Oxígeno es -2, con excepción de los peróxidos por existir enlace entre los oxígenos, será -1. 6. En el Hidrógeno es +1, con la salvedad de combinaciones con elementos de menor electronegatividad que él, como en el caso de los hidruros. Ejemplos: FeCl3 El Cl es -1 por ser más electronegativo y el Fe es +3 al establecer la suma (-1)3 + 3 = 0. Bajo otras condiciones el Fe será +2 con la fórmula FeCl2. KMnO4 El K es +1 ya que su grupo es IA. El O es -2 ya que es el más electronegativo; mientras tanto al Mn le corresponde +7. La suma algebraica será +1+7+(-2)4 = +1+78=0. H2O2 El O será negativo por ser el más electronegativo, pero será -1 ya que existe un enlace t l í Al H l d +1 ú l (+1)2 + ( 1)2 0 21 Nomenclatura de sustancias inorgánicas entre los oxígenos. Al H le corresponde +1 según la suma (+1)2 + (-1)2 = 0. LiH Caso en el cual el H por ser más electronegativo que el metal presentará estado de oxidación de -1 y el Li +1 NOMENCLATURA NOMENCLATURA MODERNA La IUPAC (International Union Pure and Aplicated Chemistry) mediante la comisión encargada de revisar constantemente la NOMENCLATURA no ha dejado de presentar modificaciones tratando de perfeccionar reglas para un mejor uso de la NOMENCLATURA QUIMICA; estas reglas se van integrando gradualmente para facilitar su aceptación a un corto plazo. Ejemplos: En un compuesto poliatómico, el grupo electronegativo debe nombrarse usando la terminación ATO" después de la raíz de átomo central. Terminados en "o", señalando con prefijos griegos la cantidad de ellos se menciona a los ligantes". Na2CO3 Los iones (CO3)-2 y Na+1 que integran al compuesto se nombran "Tri-oxocarbonato de Sodio". El nombre CARBONATO se deriva del átomo central de CARBONO, y Trioxo indica la presencia de tres átomos de oxígeno, después de nombrado el anión, señalamos la presencia del sodio. Sin embargo el nombre de carbonato de sodio es aceptado. Ejemplos: compuesto IUPAC Tradicional K2SO4 Tetraoxo sulfato de potasio Sulfato de potasio (Lo acepta la IUPAC) Na2SO3 Trioxosulfato de sodio sulfito de sodio CuClO2 di oxoclorato de cobre (I) clorito de cobre (I) Cu(ClO2)2 Bis-dioxoclorato de cobre (II) clorito de cobre (II) Muchos nombres triviales son aceptados por la IUPAC como necesarios en el proceso de adaptación de las reglas para una NOMENCLATURA MODERNA. En el caso de los compuestos del tipo A NXn, donde N es un no metal y X es un halógeno se suele utilizar esta forma para dar el nombre del compuesto Ejemplos: compuesto IUPAC 22 Nomenclatura de sustancias inorgánicas K2SF5 Pentafluorosulfato de potasio NaPF6 Hexafluorofosfato de sodio NH4BF4 Tetrafluoroborato de amonio Ba(ZnCl4) Tetraclorozincato de Bario UNA NOMENCLATURA COMUN O TRIVIAL. Cabe hacer notar que antes de existir la idea de socializar de manera reglamentada los nombres de las sustancias, fueron apareciendo un alto número de compuestos con nombres usuales o comunes los cuales se aprendían más por la práctica que por sistematización alguna, siendo este motivo la causa de que el NOMBRE TRIVIAL no señale ninguna característica del compuesto. Estos compuestos tienen nombres especiales admitidos por la IUPAC, que son los mas utilizados por los químicos y aparecen con mucha frecuencia en la literatura científica. Algunos ejemplos: BH3 Borano CH4 Metano NH3 Amoníaco SiH4 Silano PH3 Fosfina AsH3 Arsina B2H6 diborano C2H6 Etano N2H4 Hidracina H2O Agua SbH3 Estibina P2H4 difosfina Otros ejemplos tenemos: O2 oxigeno (di oxígeno) S8 α-, β- o γ-azufre (ciclooctasulfuro) O3 ozono (catena-trioxígeno) P4 fósforo blanco (tetrafosforo) Existen otros nombres que son aplicados a presentaciones industriales de algunos compuestos. Ejemplos: ácido muriático, para el ácido clorhídrico Sosa cáustica, nombre del hidróxido de sodio Vinagre es el ácido acético Potasa cáustica, para hidróxido de potasio 23 Nomenclatura de sustancias inorgánicas UNA NOMENCLATURA SISTEMATIZADA Actualmente existe la tendencia a adoptar un sistema de nombres que permita al máximo caracterizar las propiedades de la sustancia. Para ello se da un nombre genérico correspondiente a la familia que agrupe al compuesto según su FUNCION QUIMICA, posteriormente se especifica que elemento presenta determinada FUNCION e incluso el estado de oxidación de éste, lo cual se logra con un manejo de terminaciones y de prefijos según sea requerido. Mas recientemente la NOMENCLATURA STOCK reglamenta el uso del nombre genérico (óxido, hidróxido, ácido, etc.) seguido del elemento que pertenece a determinada familia y con un número romano encerrado en paréntesis le especifica el estado de oxidación. Otra nomenclatura también aceptada aunque más antigua y tradicional (semi-sistematizada), emplea en lugar de números romanos las terminaciones -ICO para el estado de oxidación mayor y -OSO para el menor. En los metales estas terminaciones son suficientes ya que presentan uno o dos estados de oxidación solamente, pero en el caso de los NO METALES y METALOIDES que suelen presentar más de dos, debemos diferenciarlos con los prefijos HIPO- para el estado de oxidación más pequeño o el PER- en la carga mucho mayor. El prefijo HIPO- se conjuga con la terminación -OSO y el prefijo PER- con la de -ICO satisfaciendo así la necesidad de diferenciar hasta cuatro compuestos formados por un mismo elemento con distintos estados de oxidación. Otra sistema alterno a la nomenclatura de Stock para indicar la proporción de los componentes de un compuesto es el numero de Ewens- Bassett. Este fue diseñado para sistemas iónicos y es simplemente la cantidad de carga de un ión, en números arábigos, seguido por el signo de la misma. Este sistema tiene la ventaja de ser un numero medido experimentalmente mientras que el numero de oxidación es un concepto teórico. El cero no es usado en el sistema de Ewens-Bassett dado que es usado en el sistema Stock Ejemplos: Compuesto Ewens-Bassett FeF3 fluoruro de hierro (3+) (PF6)- Ion Hexafluorofosfato (1-) [Ni(CN)4]2- Ion Tetraciano niquelato (2-) NOMBRE DE SUSTANCIAS SENCILLAS. 24 Nomenclatura de sustancias inorgánicas Para simplificar la tarea de asignar nombres a los compuestos, es prudente agrupar a las familias según contengan o no oxígeno. CON OXIGENO: óxidos, hidróxidos, ácidos oxigenados (oxiácidos) y sales oxigenadas (oxísales). SIN OXIGENO: hidruros, hidroácidos, sales neutras (saluros o haloideas) y sales volátiles NOMENCLATURA DE COMPUESTOS CON OXIGENO OXIDOS: Esta familia de sustancias reúne sólo a compuestos binarios. Son OXIDOS BASICOS cuando el segundo elemento es un METAL. Algunos ejemplos: Compuesto Nomenclatura Stock Semi-sistematizada Al2O3 óxido de aluminio Na2O óxido de sodio FeO óxido de fierro (II) óxido ferroso CrO3 óxido de cromo (VI) óxido crómico CuO óxido de cobre (II) óxido cúprico Hg2O óxido de mercurio (I) óxido mercuroso Son OXIDOS ACIDOS cuando el segundo elemento es un NO METAL. Compuesto Stock IUPAC CO óxido de carbono (II) monóxido de carbono N2O3 óxido de nitrógeno (III) trióxido de dinitrógeno Cl2O3 óxido de cloro (III) trióxido de dicloro SO2 óxido de azufre (IV) dióxido de azufre P2O5 óxido de fósforo (V) pentaóxido de difósforo Br2O7 óxido de bromo (VII) heptaóxido de dibromo Podemos notar que el nombre de este grupo de compuestos precisa la palabra OXIDO que es el nombre genérico de la familia. Casi la totalidad de elementos presentan la FUNCION QUIMICA de reaccionar con el oxígeno para formar algún tipo de óxido. La nomenclatura se completa especificando el elemento formador del óxido al cual se le añade con número romano al estado de oxidación en caso de que dicho elemento pueda asumir más de uno. 25 Nomenclatura de sustancias inorgánicas La gran mayoría de los óxidos ácidos también son conocidos por el término genérico ANHIDRIDO. CO anhídrido carbonoso CO2 anhídrido carbónico SO anhídrido hiposulfuroso SO2 anhídrido sulfuroso SO3 anhídrido sulfúrico Cl2O anhídrido hipocloroso Cl2O3 anhídrido cloroso Cl2O5 anhídrido clórico Cl2O7 anhídrido perclórico La expresión anhídrido implica la carencia de agua en estos compuestos lo cual ocurre precisamente en algunos ácidos con oxígeno quienes son deshidratados mediante calentamiento dando lugar a la formación de estos óxidos o anhídridos. H2SO4 ---> SO3 Ácido sulfúrico 2HNO3 ---> N2O5 + H2O anh. Nítrico ---> Ácido fosfórico H2O anh.Sulfúrico Ácido nítrico 2H3PO4 + P2O5 + 3 H2O anh. fosfórico Algunos OXIDOS ACIDOS no pueden nombrarse anhídrido precisamente por no existir ácido alguno que lo produzca por deshidratación. Ejemplos: NO óxido de nitrógeno (II) N2O2 NO2 óxido de nitrógeno (IV) N2O4 Se puede observar que los estados de oxidación del nitrógeno es +2 en NO y de +4 en NO2, los cuales no son comunes para los elementos que integran ese grupo (normalmente +5, +3, +1) 26 Nomenclatura de sustancias inorgánicas característica que podría sernos útil en la nomenclatura de los anhídridos. Los OXIDOS siendo compuestos binarios tienen la FUNCION QUIMICA de reaccionar con agua para formar compuestos ternarios. MgO + H2O ---> Mg(OH)2 Oxido de Magnesio Hidróxido de Magnesio Fe2O3 + 3 H2O ---> Hidróxido férrico Hidróxido de fierro (III) Oxido férrico Oxido de fierro (III) N2O5 + H2O ---> H2NO3 Anh. nítrico Cl2O 2 Fe(OH)3 Acido nítrico + H2O ---> Anh. Hipocloroso 2 HClO Acido hipocloroso Los OXIDOS BASICOS reaccionan con agua originando a los HIDROXIDOS quienes presentan características BASICAS, mientras que los OXIDOS ACIDOS dan origen a sustancias con características ACIDAS. HIDROXIDOS: son compuestos ternarios con características básicas (colorean de azul el papel tornasol) que presentan en su fórmula el anión monovalente oxidrilo (OH)-1. Fórmula Nomenclatura Stock Nomenclatura Común NaOH hidróxido de sodio KOH hidróxido de potasio Cu(OH)2 hidróxido de cobre (II) hidróxido cúprico Cr(OH)3 hidróxido de cromo (III) hidróxido cromoso Podemos observar en su nomenclatura, primero al nombre genérico HIDROXIDO seguido del elemento al cual se le añade un número romano que especifica su estado de oxidación cuando sea necesario diferenciar compuestos formados por el mismo elemento. Otro modo de diferenciarlos es utilizando la terminación OSO para el estado de oxidación menor o ICO para el mayor. 27 Nomenclatura de sustancias inorgánicas CuOH hidróxido cuproso o hidróxido de cobre (I) Cr(OH)6 hidróxido crómico o hidróxido de cromo (VI) Fe(OH)2 hidróxido ferroso o hidróxido de fierro (II) Fe(OH)3 hidróxido férrico o hidróxido de fierro(III) El grado de basicidad de los hidróxidos depende de la electronegatividad del metal. ACIDOS OXIGENADOS (OXIACIDOS): son compuestos ternarios con características ácidas (colorean de rojo el papel tornasol). Estos compuestos además del oxígeno presentan en su estructura átomos de HIDROGENO el cual al disolverse el compuesto en agua aumentando la concentración de iónes hidronio (H3O)+1 en la solución. Según la cantidad de hidrógenos (H)+ presentes en su estructura se clasifican en: MONOPROTICOS con uno, DIPROTICOS con dos y POLIPROTICOS con tres o más. Su nomenclatura es similar a la de los anhídridos pero en estos se usa el nombre genérico ACIDO, después se nombra el no metal con la terminación OSO o ICO según sea su estado de oxidación y de ser requerido, los prefijos HIPO o PER antepuestos al nombre del no metal. H2SO4 ácido sulfúrico HClO3 ácido clórico H2SO3 ácido sulfuroso HClO ácido hipocloroso H2SO2 ácido hiposulfuroso HClO4 ácido perclórico HBrO2 ácido bromoso H3PO4 ácido fosfórico En estos compuestos no empleamos los números romanos ni tampoco los prefijos alusivos a la cantidad de átomos presentes como se hizo en los óxidos ácidos. Cabe recordar que los no metales de los grupos VII A, VI A y V A suelen presentar varios estados de oxidación por lo que las terminaciones OSO e ICO en ocasiones deben de conjuntarse con los prefijos HIPO o PER para lograr la correcta diferenciación de compuestos integrados por los mismos elementos. HClO4 ácido PERclórICO H2SO4 ácido sulfúrICO HClO3 ácido clórICO H2SO3 ácido sulfúrOSO HClO2 ácido clórOSO H2SO2 ácido HIPOsulfúrOSO HClO ácido HIPOclórOSO Existen ácidos que se forman bajo condiciones especiales originando compuestos diferentes donde participan los mismos elementos con igual estado de oxidación. HPO3 H3PO4 H4P2O7 En los tres casos el fósforo tiene estado de oxidación +5, el oxígeno -2 y el hidrógeno +1, el 28 Nomenclatura de sustancias inorgánicas fósforo determina el nombre de los ácidos como FOSFORICO, pero... ¿ los tres igual ? ¡ No ! se puede diferenciar apoyándonos con prefijos alusivos a condiciones de reacción que determinan el compuesto formado. P2O5 + H2O ---> 2 HPO3 Anh. fosfórico Acido META*fosfórico *META: más pequeño reacción que ocurre limitado a la cantidad mínima de agua por lo que el ACIDO posee una menor cantidad de HIDROGENO que la presentada por el más común. P2O5 + 3 H2O ---> 2 H3PO4 Acido ORTO*fosfórico *ORTO: el más común, lo correcto. Los ácidos orto-, en estos compuestos se consideran como los correspondientes ácidos normales; cuando hablamos del ácido fosfórico, nos estamos refiriendo al ácido orto-fosfórico, aunque no se indique explícitamente. Observe que la cantidad de agua es mayor. El ácido ortofosfórico por calentamiento, puede sufrir una parcial deshidratación: 2 H3PO4 ---> Acido fosfórico H4P2O7 + H2O Acido PIRO*fosfórico *PIRO: Fuego (por el calentamiento) P2O3 + H2O ---> P2O3 + 3H2O ---> 2 HPO2 Acido META-fosfóroso 2 H3PO3 Acido ORTO-fosfóroso Anh. fosfóroso En ocasiones, los ácidos sufren una auto-deshidratación originando una polimerización del ácido, en estos caso casos se usa los prefijos di, tri-, tetra- para indicar el grado de polimerización. 2 H2SO4 ---> Acido sulfúrico 3 H2PO4 Acido fosfórico H2S2O7 + H2O Acido di-sulfúrico ---> H5P3O10 + 2 H2O Acido tri-fosfórico 29 Nomenclatura de sustancias inorgánicas CrO3 + H2O ---> H2CrO4 2 H2CrO4 ---> H2Cr2O7 + H2O Acido dicrómico Acido crómico El ácido di-crómico es un ácido hipotético, se hace referencia a el dada la importancia que tiene su sal. Los Tio-ácidos (del griego theion= azufre) son ácidos que se obtienen a partir de los oxiácidos correspondientes, sustituyendo átomos de oxigeno por átomos de azufre adicionando al nombre el prefijo tioH2SO4 ---> Ácido sulfúrico H2SO3 H2S2O3 Ácido tiosulfúrico ---> Ácido sulfúroso H2S2O2 (S2O3)2- ---> Ion tiosulfato (S2O2)2- ---> Ácido tiosulfúroso Ion tiosulfito Esta nomenclatura se aplica no solo al átomo de azufre, también puede aplicarse adicionando otros átomos indicando en el nombre el prefijo correspondiente El nombre genérico ACIDO implica la disociación del compuesto aumentando en las soluciones la concentración de iónes (H3O)+. Por lo que, al no estar en solución, no está disociado ni presenta las características ácidas. En ese caso la nomenclatura como ACIDOS sería incorrecta y el nombre más apropiado es como el de una SAL. SALES OXIGENADAS (OXISALES): Son compuestos ternarios o poliatómicos neutros; es decir, no presentan propiedades básicas ni ácidos y tampoco reaccionan con el agua para producir sustancias con esas propiedades. Se producen mediante reacciones de neutralización de ACIDOS OXIGENADOS con HIDROXIDOS o con METALES. Mg(OH)2 base + H2SO4 ---> ácido Zn metal + H2SO4 ácido MgSO4 + 2 H2O sulfato de Magnesio ---> ZnSO4 + H2 sulfato de Zinc En la nomenclatura de este tipo de sales observamos que las terminaciones OSO e ICO empleados en el nombre de los anhídridos y oxiácidos se sustituyen por ITO y ATO, siendo estas 30 Nomenclatura de sustancias inorgánicas terminaciones aplicadas en el no metal lo que va a caracterizar a las OXISALES. El resto de la nomenclatura sigue igual, en el METAL tendrá que especificarse el estado de oxidación ya sea con números romanos o con terminación OSO o ICO. compuesto tradicional Fe2 (SO4)3 sulfato férrico KClO hipoclorito de potasio CuNO2 nitrito cuproso Ca3(PO4)2 fosfato de calcio NaIO2 yodito de sodio Fe(BrO4)2 perbromato ferroso Stock sulfato de fierro (III) nitrito de cobre (I) perbromato de fierro (II) Recordemos de la existencia de los METALOIDES Li3AlO3 aluminato de litio KMnO4 permanganato de potasio FeCrO4 cromato de fierro (II) o cromato ferroso K2Cr2O7 dicromato de potasio LiCrO2 cromito de litio Na2ZnO2 zincato de sodio Cuando vimos los nombres de OXIACIDOS se mencionó la nomenclatura de ellos como OXISAL si estos no están en solución acuosa. H2SO4 sulfato de hidrógeno HPO3 metafosfato de hidrógeno H4P2O7 pirofosfato de hidrógeno HNO3 nitrato de hidrógeno La existencia de ácido dipróticos y polipróticos permite que ocurran neutralizaciones parciales de estos originando SALES ACIDAS así como también a partir de hidróxidos con múltiples (OH)-1 se pueden formar SALES BASICAS. Estas sales pueden en posterior reacción ser neutralizadas por completo pudiendo dar lugar a la formación de SALES MIXTAS. SALES ACIDAS: NaHCO3 carbonato ácido de sodio o bicarbonato de sodio 31 Nomenclatura de sustancias inorgánicas Mg(HSO4)2 sulfato ácido de magnesio o bisulfato de magnesio SALES BASICAS: Al(OH)2Cl clordihidróxido de aluminio o dihidroxi cloruro de aluminio Al(OH)Cl2 diclorhidróxido de aluminio o hidroxidicloruro de aluminio SALES MIXTAS: NaKCO3 carbonato de potasio y sodio KNaLiPO4 fosfato de litio, sodio y potasio NOMENCLATURA DE COMPUESTOS SIN OXIGENO HIDRUROS METALICOS: Son compuestos caracterizados por la presencia del Hidrógeno combinado con un metal. Ya que el hidrógeno es más electronegativo que los metales, necesariamente su estado de oxidación será negativo. LiH hidruro de litio CaH2 hidruro de calcio MgH2 hidruro de magnesio Para darles nombre se menciona la palabra HIDRURO que será el nombre genérico para todos aquellos compuestos donde el hidrógeno presente carga negativa. Después se especifica el nombre del metal que interviene. HIDRUROS VOLATILES: Estos compuestos se caracterizado por la presencia del Hidrógeno combinado con un no metal al cual esta unido por enlaces covalentes poco polares y se diferencian de los hidrácidos en que sus disoluciones acuosas no tienen propiedades ácidas y mas bien se consideran bases. Los elementos que forman estos compuestos son: nitrógeno, fósforo, arsénico, antimonio, carbono, silicio y boro. En las formulas de estos compuestos, el símbolo del hidrógeno se coloca a la derecha. (Para ejemplos véase nomenclatura común o trivial) HIDROACIDOS: Sustancias que en solución acuosa son capaces de liberar el ión H+; para ello se requiere que el HIDROGENO esté unido covalentemente con elementos de alta electronegatividad como los halógenos. Para nombrarlos se antepone la palabra ACIDO al no metal y se reemplaza su última vocal por la terminación HIDRICO. HCl ácido clorhídrico HBr ácido bromhídrico H2S ácido sulfhídrico 32 Nomenclatura de sustancias inorgánicas Existen algunas conformaciones entre el carbono con otros elementos de alta electronegatividad que forman también sustancias con características ácidas. HCN ácido cianhídrico HSCN ácido sulfocianhídrico Algunos elementos como el Nitrógeno, el Oxígeno y el Fósforo; aún siendo de alta electronegatividad presentan una covalencia con el hidrógeno que no permite formar ácidos. NH3 amoníaco PH3 fosfina H2O agua SALES HALOIDEAS O SALUROS: Estos compuestos son conformaciones atómicas entre METALES y NO METALES, generalmente producidos por neutralización de ACIDOS y BASES, o por la acción directa de estos compuestos sobre los METALES. Su nombre se establece mencionando al NO METAL con la terminación URO seguido del METAL. También aquí es necesario determinar estados de oxidación, los cuales estarán señalados por la terminación OSO o ICO en caso de nomenclatura común; o bien los NUMEROS ROMANOS empleados para la NOMENCLATURA STOCK. FeCl2 cloruro ferroso o cloruro de fierro (II) MgS sulfuro de magnesio CuBr2 bromuro cúprico o bromuro de cobre (II) También podemos decir que la terminación HIDRICO que caracteriza a los hidroácidos es sustituida por URO que será lo que identifique la nomenclatura de un SALURO. Fe(CN)3 cianuro férrico o cianuro de fierro (III) KSCN sulfocianuro de potasio PbI2 yoduro plumboso o yoduro de plomo (II) SALES VOLATILES: estos compuestos surgen de la combinación entre no metales. Para este tipo de sustancias, la IUPAC establece que se coloque a la izquierda de la formula el elemento que figure antes en la siguiente relación: B, Si, C, Sb, As, P, N, Te, Se, S, I, Br, Cl, F De igual forma se le adiciona la terminación –URO al elemento cuyo símbolo esta colocado a la derecha en la fórmula. Fórmula IUPAC Stock BrF3 Trifloruro de bromo fluoruro de bromo (III) BrCl Cloruro de bromo Cloruro de bromo (I) SeI2 Yoduro de selenio Yoduro de selenio (II) CCl4 Tetracloruro de carbono Cloruro de carbono (IV) CS2 Disulfuro de carbono Sulfuro de carbono (IV) 33 Nomenclatura de sustancias inorgánicas BrF5 Pentafluoruro de bromo Fluoruro de bromo (IV) IF7 Heptafluoruro de Iodo Fluoruro de yodo (VII) As2Se3 Triselenuro de diarsénico Selenuro de arsénico (III) NOMENCLATURA DE COMPUESTOS DE COORDINACION Los también conocidos como COMPUESTOS COMPLEJOS se nombran al igual que los BINARIOS y TERNARIOS mencionando primero al ANION y posteriormente el CATION, independientemente quien sea el ION COMPLEJO. Ya que la cantidad de este tipo de compuestos se multiplica por el fenómeno de ISOMERIA es prudente señalar que aquí se presenta un resumen de las reglas más importantes de su nomenclatura, los cuales nos sirven para nombrar los complejos más simples y comunes (para mas información al respecto véase, Huheey, et al, ref 9). Si el ión complejo es un anión, se utilizará la terminación -ATO. Si es catión o neutro, el nombre no cambia. Los constituyentes del complejo se nombran primero los aniónicos, moléculas neutras, las especies positivas y al final el ión metálico central. A los ligantes aniónicos se les da terminación en "o". Ejemplo: OH-1 hidroxo S-2 Tio Cl-1 cloro CO3-2 carbonato CN-1 ciano C2O4-2 oxalato F-1 fluoro NO3-1 nitrato CNO-1 cianato S2O3-2 tiosulfato O-2 oxo NO2-1 nitro O2-2 peroxo SO4-2 sulfato Los nombres de ligantes neutros se les da la terminación -il, ejemplos: NO nitrosil CO carbonil Como excepción a esta regla tenemos NH3 ammin H2O agua (acuo) El número de ligantes simples es indicado por los prefijos di-, tri-, tetra-, penta-, hexa-. Para los ligantes complejos, como la etilendiamina o dietilentriamina, se emplean bis-, tris, tetrakis, pentakis, etc. 34 Nomenclatura de sustancias inorgánicas El número de oxidación del ion metálico central es indicado por un número romano encerrado en paréntesis. K4[Fe(CN)6] Hexacianoferrato (II) de potasio K+1 [Fe(CN)6]-4 catión anión [Co(NH3)4(H2O)Cl]Cl2 Cloruro de cloro-acuo-tetrammincobalto (III) [Pt(NH3)4][PtCl6] Hexacloroplatinato (IV) de Tetramminplatino (II) [Cu(en)2]SO4 Sulfato de bis(etilendiamino)cobre (II) [Ni(CO)4] Tetracarbonilniquel (0) [Ag(NH3)2]Cl Cloruro de diamminplata (I) [Co(NH3)3Cl3] Triclorotriamminocobalto (III) K3[Al(C2O4)3] Tris oxalato aluminato de potasio [Fe2(CO)12] Dodecacarbonildihierro(0) Existen nombres triviales que se imponen sobre el nombre moderno. Ejemplo: K4[Fe(CN)6] K3[Fe(CN)6] Ferrocianuro de potasio Ferricianuro de potasio Trivial Hexaciano Ferrato (II) de potasio Hexaciano Ferrato (III) de potasio Moderno La nomenclatura de iónes complejos es similar pero anteponiendo la palabra ión. Ejemplo: CATION [Pt(H2O)2Cl2]+2 ión dicloro di-acuo platino (IV) ANION [Pt(NH3)2(CN)6]-2 ión hexaciano diamminplatinato (IV) ANION [CoF4]-1 ión tetrafluoro cobaltato (III) CATION [Cr(H2O)6]+3 ión hexa acuo cromo (III) 35 Nomenclatura de sustancias inorgánicas BIBLIOGRAFIA 1.- Villarreal, F., Nomenclatura inorgánica para sustancias sencillas. 2.- Revista de la Sociedad Química de México 3.- Mortimer Ch. E., Química 4.- García- Pérez, J. A., Teijon- Rivera, J. M. y, “Formulación y nomenclatura de Química Inorgánica; Normas”, Tebar-Flores, España, 1993 5.- Blasco, V., Cotanda, V, Ferrer, E., García, B. y Latre, F., “Formulación y nomenclatura de Química Inorgánica y Organica”, Tebar-Flores 6.- Andrés, J., López, E., Llopis, R. y Nieves, M., “Formulación y Nomenclatura Química”, Univ. Politécnica de Valencia, 1992. 7.- Cotton, F. A. & Wilkinson, “Química Inorgánica Avanzada”, Limusa, 1975. 8.- Block, B.P., Powell, W. D., Fernelius, W. C., “Inorganic chemical nomenclature; principles and practice”, ACS PROF. REF. BOOK, 1990 9.- Huheey, J. E., Keater, E. A. & Keater, R. L., "Inorganic chemistry; principles of structure and reactivity", 4th Edic., Harper Collins, 1993 36 Nomenclatura de sustancias inorgánicas APENDICE A; Procedencia de los nombres de algunos elementos químicos Los nombres de algunos elementos más “curiosos” se encuentran en rojo. Nombres de elementos en honor a planetas y asteroides: Cerio (Ce): por el asteroide Ceres, descubierto en 1801, dos años antes de que se descubriera el metal.2 Mercurio, su nombre se debe al planeta del mismo nombre, pero su abreviatura es Hg debido a que Dioscórides lo llamaba plata acuática (en griego hydrárgyros). hydra=agua, gyros= plata. Neptunio (Np): del planeta Neptuno. Plutonio (Pu): del planeta Plutón. Titanio(Ti): de los Titanes, los primeros hijos de la Tierra según la mitología griega. Uranio (U): del planeta Urano. Nombres de lugares y similares: Magnesio (Mg): de Magnesia, comarca de Tesalia (Grecia). Escandio (Sc) Scandia, Escandinavia. Cobre (Cu): cuprum, de la isla de chipre. Galio (Ga): de Gallia, Francia. Germanio (Ge): de Germania, Alemania. Selenio (Se):de Selene, la Luna. Estroncio (Sr): Strontian, ciudad de Escocia. Itrio (Y): de Ytterby, pueblo de Suecia. Rutenio (Ru): del latín Ruthenia, Rusia. Terbio (Tb): de Ytterby, pueblo de Suecia. Europio (Eu): de Europa. Holmio (Ho): del latín Holmia, Estocolmo. 2 ¿Sabías que el cerio metálico se encuentra principalmente en una aleación de hierro que se utiliza en las piedras de los encendedores? 37 Nomenclatura de sustancias inorgánicas Tulio (Tm): de Thule, nombre antiguo de Escandinavia. Lutecio (Lu): de Lutetia, antiguo nombre de Pans. Hafnio (Hf): de Hafnia, nombre en latín de Copenhague, Dinamarca. Polonio (Po): de Polonia, país de nacimiento de Marie Curie (codescubridora del elemento junto con su marido Pierre). Francio (Fr): de Francia. Americio (Am): de América. Berkelio (Bk): de Berkeley, unidad educativa de la Universidad de California, USA.. Californio (Cf): de California, USA. Renio (Re): del latín Rhenus, Rin. Nombres que hacen referencia a propiedades: Arsenico (As): arsenikon, oropimente amarillo (auripigmentum). Actino (Ac): del griego aktinos, destello o rayo. Argón (Ar): argos, inactivo. Astato (At): del griego astatos, inestable. Bario (Ba): del griego barys, pesado. Berilio (Be): de berilo, esmeralda de color verde. Bismuto (Bi): del alemán weisse masse, masa blanca. Bromo (Br): del griego bromos, hedor, peste. Cesio (Cs): de caesius, color azul celeste. Cloro (Cl): del griego chloros (amarillo verdoso). Cromo (Cr): del griego chroma, color. Disprosio (Dy): del griego dysprositos, volverse duro. Hidrógeno (H): engendrador de agua. Indio (In): debido al color índigo (anil) que se observa en su espectro. Iridio (Ir): del latin Iris, arco iris. 38 Nomenclatura de sustancias inorgánicas Manganeso (Mg): de magnes, magnético. Nitrógeno (N): engendrador de nitratos (nitrum) Oro (Au): de aurum, aurora resplandeciente. Osmio (Os): del griego osme, olor (debido al fuerte olor del OsO4). Oxígeno (O): formador de ácidos (oxys) Platino (Pt): parecido a la plata3 Praseodimio (Pr): de prasios, verde, y didymos, gemelo. Radio (Ra): del latín radius, rayo. Radón (Rn): radium emanation (radiactiva). Rodio (Rh): del griego rhodon, color rosado. Rubidio (Rb): de rubidius, rojo muy intenso (a la llama). Talio (Tl): del griego tallos, vástago o retoño verde. Volframio (W): del inglés wolfrahm; o tungsteno, de tung sten, del sueco, piedra pesada. Yodo (I): del griego iodes, violeta. Zinc (Zn): del alemán zink, que significa origen oscuro. Zirconio (Zr): del árabe zargun, color dorado. Nombre que hacen referencia a la mitología: Niobio (Nb): Níobe, hija de Tántalo. El nombre de Niobio fue adoptado por la International Union of Pure and Applied Chemicstry en 1950 despues de 100 años de controversia. 3 El platino (Pt) en estado metálico es blanquecino y medianamente similar a la plata (aunque mucho menos maleable que esta), por lo que cuando en 1748 el español don Antonio de Ulloa lo encontró en una expedición por Sudamérica lo llamó "platina", lo que quiere decir más o menos "parecido a la plata". Se describe en un obra: "Relación Histórica del viaje a la América Meridional" (Madrid,1748) como sigue "En el partido de Chocó, habiendo muchas minas de lavadero, como las que se acaban de explicar, se encuentran también algunas, donde por estar disfrazado, y envuelto el oro con otros cuerpos metálicos, jugos y piedras, necesita para su beneficio del auxilio del azogue [mercurio]; y tal vez se hallan minerales, donde la platina (piedra de tanta resistencia, que no es fácil romperla, ni desmenuzarla con la fuerza del golpe sobre el yunque de acero) es causa de que se abandonen; por que ni la calcinación la vence, ni hay arbitrio para extraer el metal, que encierra, sino a expensas de mucho trabajo y costo." 39 Nomenclatura de sustancias inorgánicas Paladio (Pd): Pallas, diosa de la sabiduría. Prometio (Pm): de Prometeo, personaje mitológico que robo el fuego de los cielos. Tantalio (Ta): de Tántalo (mitología griega, padre de Niobe. Torio (Th): de Thor, dios escandinavo de la guerra. Vanadio (V): Vanadis, diosa Escandinava, descubierto inicialmente por Del Rio en 1801. Nombres de científicos: Bohrio (Bh) en honor de Niels Bohr Curio (Cm): en honor de Pierre y Marie Curie. Darmstadtio (Ds) como tributo a la ciudad alemana de Darmstadt donde, en 1994, fue creado este elemento Dufnio (Db), en honor de Instituto Joint para Investigación Nuclear en Dubna, Rusia Einstenio (Es): en honor de Albert Einstein. Fermio (Fm): en honor de Enrico Fermi. Gadolinio (Gd): del mineral gadolinita, del químico finlandés Gadolin Hahnio (Ha) en honor de Otto Hahn Hassio (Hs) (originario del Latín "Hassias" que significa "Hess", El estado alemán.) en Descubierto en el Laboratorio de Investigación de Iónes Pesados GSI en Darmstadt, Alemania en 1984 Kurchatovio (Ku) en honor del científico ruso Igor Vasilevich Kurchatov Lawrencio (Lr): en honor de E. O. Lawrence. Meitneirio (Mt) en honor de Lise Meitner (1878-1968) Mendelevio (Md): En honor al químico ruso Dmitri Ivánovich Mendeléiev precursor de la actual tabla periódica. Nobelio (No): en honor de Alfred Nóbel. Rutherfordio (Rf) en honor de Lord Ernest Rutherford. La IUPAC le asignó este nombre temporal en 1980. Samario (Sm): del mineral samarskita, (en honor del ruso Samarski). Seaborgio (Sg) en honor de Glenn Seaborg 40 Nomenclatura de sustancias inorgánicas Otros: Aluminio (Al): del latín alumen, sin embargo fue Sody (1807) propuso el nombre al metal no descubierto hasta entonces. Antimonio (Sb): de antimonium; Sb de stibium. Azufre (S) del latín sulphurium. Referido en el genesis como brimstone Boro (B): del arabe buraq, y del persa Burah Cadmio (Cd): del latín cadmia, nombre antiguo del carbonato de zinc. Casi todo el cadmio industrial se obtiene como subproducto en el refinado de los minerales de zinc. Calcio (Ca) de calx, caliza. (La caliza está formada por Ca2CO3). Carbono (C): de latín carbo. Cobalto (Co): existen dos explicaciones, una que dice que cobalto proviene de cobalos, mina. Otra versión asegura que cobalto es el nombre de un espíritu maligno de la mitología alemana.. Estaño (Sn): del latín stannum. Fluor (F): de fluere (latin, o frances) que significa flujo. Fósforo (P) de phosphoros, portador de luz (el fósforo emite luz en la oscuridad porque arde al combinarse lentamente con el oxígeno del aire). Helio (He): de la atmósfera del sol (helios, se descubrió por primera vez en el espectro de la corona solar durante un eclipse en 1868, aunque la mayoría de los científicos no lo aceptaron hasta que se aisló en la tierra). Hierro (Fe): de latín ferrum. Kriptón (Kr): del griego kryptos, oculto, secreto. Lantano (La): del griego lanthanein, yacer oculto. Litio (Li): de lithos, roca. Molibdeno (Mo): de molybdos, plomo. (Al parecer, los primeros químicos lo confundieron con mena de plomo). Neodimio (Nd): de neos-dydmos, nuevo gemelo (del lantano). Neón (Ne). nuevo (del griego neos). Niquel (Ni): proviene del término alemán kupfernickel, que quiere decir algo así como cobre del demonio, (aparece en minas de cobre pero no lo es). Como kupfer significa cobre, níquel debe 41 Nomenclatura de sustancias inorgánicas querer decir demonio. Plata (Ag): del latín argentum, mencionado en el genesis Plomo (Pb): del latín plumbum. Se menciona en el exodo. Los alquimistas pensaban que era el metal mas antiguo y lo relacionaban con el planeta saturno Potasio (K) kalium; del inglés pot ashes (cenizas). (Las cenizas de algunas plantas son ricas en potasio). Protoactinio (Pa): de protos (primero) y actinium. Silicio (Si): del latín silex, sílice. Sodio (Na): Del latín sodanum (sosa), Na del latín natrium (nitrato de sodio). Tecnecio (Tc): de technetos, artificial, porque fue uno de los primeros sintetizados. Teluro (Te): de Tellus, tierra. Xenon (Xe): del griego xenon, extraño, raro. Si te interesa la historia del descubrimiento de los elementos químicos te recomiendo el siguiente libro : La búsqueda de los elementos. Isaac Asimov. O bien en el sitio web de Los Alamos National Laboratory's Chemistry División; http://pearl1.lanl.gov/periodic/default.htm 42 Nomenclatura de sustancias inorgánicas APENDICE B; PREFIJOS Y SUFIJOS MAS COMUNES Símbolo Prefijo Sufijo prefijo Significado S Tio- Sulfur- Hipo- El mas bajo P Fosfa- Fosfor- Per- El mas alto N Aza- Nitro- O Oxo- Meta- Mas una molécula de agua Orto- Mas 3 moléculas de agua di- o bi-(bis-) Dos Tri- (tris-) Tres Tetra(tetrakis) cuatro Penta(pentakis-) Cinco hexa(hexakis-) Seis hepta(heptakis-) siete X Halo- (X=F, Cl, Br, I) As Arsin- Sb Estib- O2 Peroxi- Pb Halo Antimon- Plum- 43 Nomenclatura de sustancias inorgánicas APENDICE C; NOMENCLATURA DE LOS PRINCIPALES ACIDOS OXIACIDOS MAS COMUNES H3BO3 ácido bórico (ácido ortobórico) H3AsO4 ácido arsénico H2CO3 ácido carbónico H4SiO4 ácido silícico (ácido ortosilícico) H2SO4 ácido sulfúrico HIO4 ácido peryódico H2SO3 ácido sulfuroso H2CrO4 ácido crómico HNO3 ácido nítrico H2Cr2O7 ácido dicrómico HNO2 ácido nitroso H3PO4 ácido fosfórico (ácido ortofosfórico) HClO4 ácido perclórico H4P2O7 ácido pirofosfórico HClO3 ácido clórico H2PHO3 ácido fosfónico HClO2 ácido cloroso HMnO4 ácido permangánico HClO ácido hipocloroso OXIACIDOS MENOS COMUNES (HBO2)n ácidos metabóricos HBrO4 ácido perbrómico (HPO3)n ácidos metafosfóricos H2SeO4 ácido selénico (H2SiO3)n ácidos metasilísicos HBrO3 ácido brómico H3PO5 ácido peroxomonofosfórico (ácido peroxofosfórico) H2S2O7 ácido disulfúrico (ácido pirosulfúrico) HNO4 ácido peroxonítrico HBrO2 ácido bromoso H4P2O8 ácido peroxo-difosfórico H5IO6 ácido ortoperyódico H2NO2 ácido nitroxílico HBrO ácido hipobromoso H2P2H2O5 ácido difosfónico HIO3 ácido yódico H2SeO3 ácido selenoso H2MnO4 ácido mangánico H3AsO3 ácido arsenoso HIO ácido hipoyodoso H2SO5 ácido peroxomono sulfúrico (ácido peroxosulfúrico) H2S2O3 ácido tiosulfúrico (ácido hiposulfuroso) H2S2O5 ácido disulfuroso (ácido pirosulfuroso) H2S2O8 ácido peroxodisulfúrico (ácido persulfúrico) 44 Nomenclatura de sustancias inorgánicas H2S2O6 ácido ditiónico H2S2O4 ácido ditionoso H2S2O2 ácido tiosulfuroso (ácido pirosulfuroso) H2SO2 ácido sulfoxílico HIDRACIDOS HF Ácido fluorhídrico HBr ácido bromhídrico H2S Ácido sulfhídrico HCN ácido cianhídrico HCl Ácido clorhídrico HI ácido yodhídrico H2Se Ácido selenhídrico HSCN ácido sulfocianhídrico 45 Nomenclatura de sustancias inorgánicas APENDICE D; NOMENCLATURA DE LOS PRINCIPALES IONES CATIONES MONOVALENTES H+1 ión hidrógeno (protón) H3O+1 ión hidronio Li+1 ión litio NH4+1 ión amonio Na+1 ión sodio PH4+1 ión fosfonio K+1 ión potasio AsH4+1 ión arsenio Ag+1 ión plata SO3H+1 ión sulfonio Cu+1 ión cobre (I) (cuproso) Hg+1 ión mercurio (I) (mercuroso) CATIONES DIVALENTES Be+2 ión berilio Cd+2 ión cadmio Mg+2 ión magnesio Sn+2 ión estaño (II) (estanoso) Cu+2 ión cobre (II) (cúprico) Hg+2 ión mercurio (II) (mercúrico) Ca+2 ión calcio Co+2 ión cobalto (II) (cobaltoso) Ni+2 ión niquel (niqueloso) Fe+2 ión fierro (II) (ferroso) Pb+2 ión plomo (II) (plumboso) Ba+2 ión bario Mn+2 ión manganeso (II) (manganoso) Sr+2 ión estroncio Zn+2 ión zinc CATIONES TRIVALENTES Al+3 ión aluminio Bi+3 ión bismuto (III) Sb+3 ión antimonio (III) (antimonioso) Co+3 ión cobalto (III) (cobáltico) Fe+3 ión hierro (III) (férrico) As+3 ión arsénico (III) (arsenoso) Ni+3 ión niquel (III) (niquélico) Cr+3 ión cromo (III) (cromoso) Mn+3 ión manganeso (III) (mangánico) CATIONES POLIVALENTES Sn+4 ión estaño (IV) (estánico) Pb+4 ión plomo (IV) (plúmbico) As+5 ión arsénico (V) (arsénico) Sb+5) ión antimonio (V) (antimónico 46 Nomenclatura de sustancias inorgánicas ANIONES MONOVALENTES H-1 ión hidruro (OH)-1 ión hidróxido F-1 ión fluoruro O3-1 ión ozonido Cl-1 ión cloruro (CN)-1 ión cianuro Br-1 ión bromuro (SCN)-1 ión sulfocianuro (tiocianato) I-1 ión yoduro NO3-1 ión nitrato N3-1 ión azida NO2-1 ión nitrito (ClO4)-1 ión perclorato (IO4)-1 ión peryodato (ClO3)-1 ion clorato (MnO4)-1 ión permanganato (ClO2)-1 ión clorito (BrO3)-1 ión bromato (ClO)-1 ión hipoclorito (NH2)-1 ión amida ANIONES DIVALENTES O2-2 ión peróxido C-2 ión acetiluro S-2 ión sulfuro NH-2 ión imida S2-2 ión disulfuro PHO3-2 ión fosfanato SO4-2 ión sulfato CrO4-2 ión cromato SO3-3 ión sulfito Cr2O7-2 ión cromato S2O3-2 ión tiosulfato CO3-2 ión carbonato ANIONES POLIVALENTES (PO4)-3 ión fosfato N-3 ión nitruro (AsO4)-3 ión arseniato [Fe(CN)6]-4 ión hexaciano ferrato (II) (PO3)-3 ión fosfito (AlO3)-3 ión aluminato (AsO3)-3 ión arsenito (P2O7)-4 ión pirofosfato [Fe(CN)6]-3 ión hexaciano ferrato (III) (PO3) -1 ión metafosfato 47 Nomenclatura de sustancias inorgánicas APENDICE E; NOMENCLATURA DE PRINCIPALES RADICALES INORGÁNICOS -OH hidroxilo -SO sulfonilo (tionilo) -NO nitrosilo -PO fosfonilo -CO carbonilo -SO2 sulfonilo (sulfurilo) -NO2 nitrilo -VO vanadilo -CIO clorosilo -CrO2 cromilo -CIO2 Clorilo -UO2 Uranilo -SeO selenilo -SeO2 Selenonilo APENDICE F; NOMENCLATURA DE ALGUNOS LIGANTES COMUNES EN COMPUESTOS DE COORDINACION ANIONICOS O2-2 peroxo O-2 oxo H-1 hidro OH-1 Hidrozoo F-1 fluoro HS-1 tiolo Cl-1 cloro S-2 tio Br-1 bromo CN-1 ciano I-1 yodo NO2-1 nitro SO2 sulfonil VO Vanadil CO carbonil NO2 nitril NO nitrosil H2O acuo CIO clorosil NH3 ammin NEUTROS 48 Nomenclatura de sustancias inorgánicas IA IIA IIIA IVA VA VIA VIIA He H Li VIIIA B C N O F Ne IIB Al Si P S Cl Ar Be Na Mg IIIB IVB VB VIB VIIB ┌ VIII B┐ IB K Ca Sc Ti Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Tl Pb Bi Po At Rn Y V Cs Ba La Hf Ta Fr Ra Ac Lr Ce W Re Os Rf Db Sg Bh Hs Mt Ds Uuu Uut Uub Uuq Uup Uuh Pt Au Hg Pr Nd Pm Sm Eu Gd Tb Dy Th Pa Esenciales abundantes Ir U Np Esenciales traza Pu Am Cm Bk Posibles esenciales Cf Ho Er Tm Yb Lu Es Fm Md No Lr tóxicos Uuo De interés farmacológico 49