Química General II - Departamento Estrella Campos
Anuncio

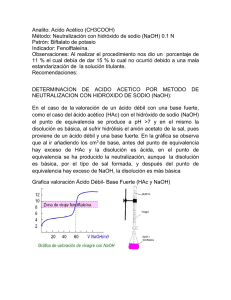
Química General II Curso de laboratorio Práctico 8 Página: 1/7 DEPARTAMENTO “ESTRELLA CAMPOS” PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: “Química, La Ciencia Central”, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica, México, 7a Edición, 1998, págs. 573 - 641. 1- OBJETIVOS 1.1 Ejemplificar el concepto equilibrio químico en solución acuosa mediante el estudio de una reacción ácido base. 1.2 Determinar la constante de disociación de un ácido débil por dos métodos. 2- CONCEPTOS PREVIOS El ácido acético, que en adelante se denotará HAc, es un ácido débil de fórmula CH3COOH. Por lo tanto, en agua se disocia parcialmente dando protones e iones acetato (CH3COO- = Ac-) según se representa mediante la siguiente ecuación química: HAc (ac) → H+ (ac) + Ac- (ac) La constante de equilibrio de la reacción anterior se denomina constante de disociación ácida (Ka) y obedece a la siguiente expresión: [H + ] [Ac- ] K = a [HAc] donde [H+], [Ac-] y [HAc] son, respectivamente, las concentraciones molares en el equilibrio de las especies protón, acetato y ácido acético. En consecuencia, una manera aparentemente sencilla de determinar el valor de Ka, a una cierta temperatura, es medir esas concentraciones de equilibrio. Sin embargo, estrictamente hablando, la expresión de la constante de equilibrio involucra el cociente de actividades y no el de concentraciones. La actividad es una medida de la concentración “real” en solución de una determinada especie. En una solución concentrada, los iones están relativamente próximos, por lo que se establecen atracciones electrostáticas entre ellos (formación de pares iónicos) y sus actividades son menores que sus concentraciones. Química General II Curso de laboratorio Práctico 8 Página: 2/7 La determinación de actividades es bastante compleja e insume mucho tiempo. Afortunadamente, la actividad iguala a la concentración, cuando se agrega a la solución en estudio un electrolito inerte en exceso (respecto a las especies iónicas en estudio). La presencia de dicho electrolito disminuye la probabilidad de que las especies en estudio se acerquen y se asocien. Por ello, es práctica habitual medir las constantes de equilibrio (a una cierta temperatura, por ejemplo a 25°C) en presencia de exceso de un electrolito inerte (por ejemplo en NaCl ≈ 1M). El valor de Ka que se encuentra tabulado para el ácido acético es 1,8 x 10-5 a 25ºC y en NaCl 1M. En este ejercicio práctico, se determinará la constante de disociación ácida del ácido acético, en esas condiciones, por dos métodos. Ambos se basan en la determinación del pH de una solución que contiene concentraciones iguales de HAc y Ac-. Método 1 Se miden los valores de pH de una solución de ácido acético luego de agregar volúmenes medidos de solución de NaOH. Se parte de una solución de HAc cuyo pH se mide y se anota. Éste resulta ser ácido, debido a la reacción: HAc (ac) → H+ (ac) + Ac- (ac) (1) Se comienza a agregar solución de NaOH y luego de cada agregado se mide y anota el pH de la solución resultante. En este proceso el ácido comienza a ser neutralizado por el NaOH: HAc (ac) + NaOH (ac) → NaAc (ac) + H2O (l) (2) o: H+(ac) + OH-(ac) → H2O (l) (3) de acuerdo con la reacción (3), que es prácticamente completa ya que su constante de equilibrio es muy grande (K3 = 1/Kw = 1014, a 25°C). En esta etapa el pH aumenta como consecuencia de que la [H+] disminuye por la reacción (3). Cuando la cantidad de moles de OH- agregados es igual al número de moles de HAc colocados inicialmente las especies presentes en solución son los iones Na+ y Ac-. Se dice que se ha alcanzado el punto equivalente y el pH del mismo estará determinado por la reacción (4) Ac- (ac) + H2O (l) → HAc (ac) + OH- (ac) (4) en la que Ac- actúa como base frente al agua. La constante de equilibrio de la reacción (4), Kb, se relaciona con la constante de disociación del HAc mediante la relación: Kb = Kw/Ka. El pH del punto equivalente estará determinado entonces por la posición de equilibrio de la reacción (4). Química General II Curso de laboratorio Práctico 8 Página: 3/7 Si se continúa agregando solución de NaOH, la solución contendrá Ac-(ac) y OH-(ac) en exceso ( proveniente fundamentalmente de la solución de NaOH). Por consiguiente, el pH de la solución será netamente básico. En la figura se muestra una curva pH vs. volumen de NaOH como la que usted construirá. pH 14 12 pH del punto equivalente 10 8 6 4 2 Veq/2 0 0 1 2 3 V eq 4 5 6 7 8 Volumen de NaOH Observe que: • Cuando se comienza el agregado de NaOH el pH es ácido, debido a la reacción (1). En este tramo de la curva y hasta el punto equivalente, el NaOH es el reactivo limitante. • Luego del punto equivalente el pH es básico, ya que se está en presencia de un exceso de NaOH (se ha agregado más NaOH que la cantidad estequiométrica de ácido colocada inicialmente). • En el punto equivalente se ha agregado exactamente la cantidad de NaOH estequiométrica: el número de moles de NaOH agregados es igual al número de moles de HAc colocados inicialmente. En la figura, Veq es el volumen correspondiente al punto equivalente. También aparece individualizado un volumen que es la mitad del volumen equivalente (Veq/2). A este volumen le corresponde un valor de pH que tiene un significado especial: cuando se haya agregado la mitad de la cantidad de NaOH necesaria para neutralizar el HAc colocado, las concentraciones de HAc y Ac- serán iguales (reacción 2). Ka [H + ] [Ac- ] = [HAc] Como [HAc] = [Ac-], entonces Ka = [H+] o pKa = pH (5) El punto Veq/2 se denomina de semineutralización (porque se ha neutralizado la mitad del ácido colocado) y su determinación permite el cálculo de Ka según (5). Química General II Curso de laboratorio Práctico 8 Página: 4/7 Método 2 Consiste en la medida del pH de una solución en la que las concentraciones de HAc y del ion Ac- son iguales por lo que se cumple la ecuación (5). Para preparar esta solución se parte de dos porciones idénticas de HAc. A una de ellas se le agrega la cantidad equivalente (estequiométrica) de solución de NaOH. De esta manera se obtiene una solución de Ac-. Esta se mezcla con la otra porción de HAc y se mide el pH de la solución resultante. 3- PROCEDIMIENTO EXPERIMENTAL 3.1 Método 1 Colocar 5 mL de la solución de HAc 0,1M en un vaso de 50 mL y agregar 10 mL de solución de NaCl 1,0M. Colocar la barra magnética y comenzar a agitar. Esperar a que la lectura de pH sea estable anotar el pH. Sin quitar el electrodo de la solución, agregar desde una bureta, aproximadamente 0,2 mL de solución de hidróxido de sodio 0,1M. Luego de la adición, anotar el volumen que indica la bureta, y manteniendo siempre el agitador encendido, esperar a que la medida de pH sea estable, anotar el pH. Repetir el procedimiento hasta completar el agregado de 4 ml de solución de NaOH (que también es 1,0 M en NaCl). A partir de este momento comience a agregar porciones de 0,1 mL, anotando el pH resultante luego de cada adición, hasta completar el agregado de 2 mL de NaOH. Finalmente vuelva a adicionar porciones de 0,2mL de NaOH, hasta agregar 4 mL más, siempre midiendo y anotando el pH luego de cada adición. Graficar el pH en función del volumen de soda agregado. Hallar el volumen correspondiente al punto equivalente. Dividir el valor calculado entre dos. El pH correspondiente a dicho volumen se utiliza para calcular Ka 3.2 Método 2 Colocar 10 mL de ácido acético 0,1 M en un erlenmeyer de 250mL. Agregar 90 mL de solución de NaCl 1M. Separar lo más exactamente que pueda, en dos porciones de 50 mL. Colocar una de las porciones en un erlenmeyer de 100 mL y agregarle tres gotas de fenolftaleína. Agregar desde una bureta una solución de NaOH (que también es 1,0 M en NaCl). (que también es 1,0 M en NaCl), gota a gota y con agitación contínua hasta el primer tinte rosado que permanezca más de 30 segundos. Mezclar esta solución con la otra porción de ácido acético. Agitar y medir el pH de la solución resultante. Calcular el valor de Ka. Nota: Las soluciones empleadas serán preparadas con ajuste de fuerza iónica a 1,0M en NaCl. Química General II Curso de laboratorio Práctico 8 Página: 5/7 3.3 Disposición de residuos Solución de NaOH: descartar en recipiente rotulado como “NaOH para descartar”. Para descartar diluir la solución con agua en relación 1:5 y neutralizar hasta pH 6-8 añadiendo lentamente una solución ácida. La solución que resulta se diluye con agua y se vierte por la pileta con exceso de agua. Otras soluciones: diluir con agua y verter por la pileta. Dejar correr agua. Química General II Curso de laboratorio Práctico 8 Página: 6/7 INFORME PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE FECHA: GRUPO: INTEGRANTES: DATOS, CÁLCULOS Y RESULTADOS Determinación de Ka del ácido acético 1)Método 1 Complete la siguiente tabla con sus datos experimentales: VNaOH /mL pH VNaOH /mL 0,00 pH Química General II Curso de laboratorio Práctico 8 Página: 7/7 Grafique la curva de titulación potenciométrica (pH vs. volumen de hidróxido de sodio agregado). Utilizando la curva experimental, determine el volumen de NaOH del punto equivalente. Determine el pH correspondiente a la mitad del volumen en el punto equivalente. Volumen en el punto equivalente = pH en Volumen en el punto equivalente = 2 Ka = 2)Método 2 V NaOH pto final = mL pH solución final = Ka = Indique qué variables afectan la magnitud de Ka. mL