descargar artículo - Revista de Patología Respiratoria
Anuncio
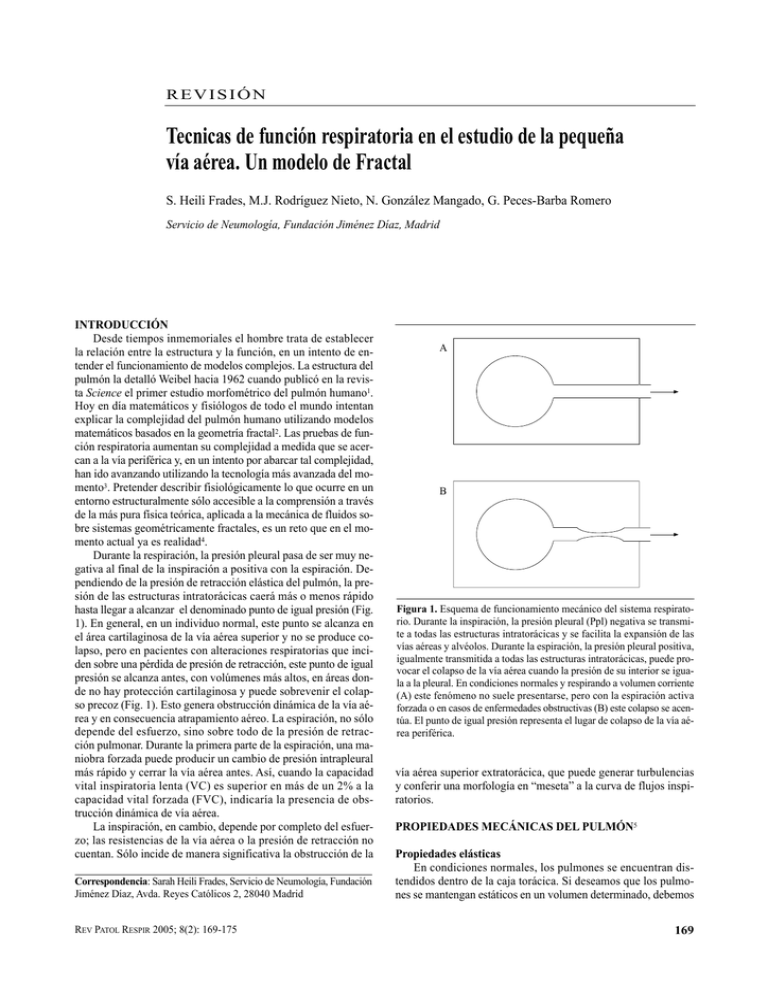
REVISIÓN Tecnicas de función respiratoria en el estudio de la pequeña vía aérea. Un modelo de Fractal S. Heili Frades, M.J. Rodríguez Nieto, N. González Mangado, G. Peces-Barba Romero Servicio de Neumología, Fundación Jiménez Díaz, Madrid INTRODUCCIÓN Desde tiempos inmemoriales el hombre trata de establecer la relación entre la estructura y la función, en un intento de entender el funcionamiento de modelos complejos. La estructura del pulmón la detalló Weibel hacia 1962 cuando publicó en la revista Science el primer estudio morfométrico del pulmón humano1. Hoy en día matemáticos y fisiólogos de todo el mundo intentan explicar la complejidad del pulmón humano utilizando modelos matemáticos basados en la geometría fractal2. Las pruebas de función respiratoria aumentan su complejidad a medida que se acercan a la vía periférica y, en un intento por abarcar tal complejidad, han ido avanzando utilizando la tecnología más avanzada del momento3. Pretender describir fisiológicamente lo que ocurre en un entorno estructuralmente sólo accesible a la comprensión a través de la más pura física teórica, aplicada a la mecánica de fluidos sobre sistemas geométricamente fractales, es un reto que en el momento actual ya es realidad4. Durante la respiración, la presión pleural pasa de ser muy negativa al final de la inspiración a positiva con la espiración. Dependiendo de la presión de retracción elástica del pulmón, la presión de las estructuras intratorácicas caerá más o menos rápido hasta llegar a alcanzar el denominado punto de igual presión (Fig. 1). En general, en un individuo normal, este punto se alcanza en el área cartilaginosa de la vía aérea superior y no se produce colapso, pero en pacientes con alteraciones respiratorias que inciden sobre una pérdida de presión de retracción, este punto de igual presión se alcanza antes, con volúmenes más altos, en áreas donde no hay protección cartilaginosa y puede sobrevenir el colapso precoz (Fig. 1). Esto genera obstrucción dinámica de la vía aérea y en consecuencia atrapamiento aéreo. La espiración, no sólo depende del esfuerzo, sino sobre todo de la presión de retracción pulmonar. Durante la primera parte de la espiración, una maniobra forzada puede producir un cambio de presión intrapleural más rápido y cerrar la vía aérea antes. Así, cuando la capacidad vital inspiratoria lenta (VC) es superior en más de un 2% a la capacidad vital forzada (FVC), indicaría la presencia de obstrucción dinámica de vía aérea. La inspiración, en cambio, depende por completo del esfuerzo; las resistencias de la vía aérea o la presión de retracción no cuentan. Sólo incide de manera significativa la obstrucción de la Correspondencia: Sarah Heili Frades, Servicio de Neumología, Fundación Jiménez Díaz, Avda. Reyes Católicos 2, 28040 Madrid REV PATOL RESPIR 2005; 8(2): 169-175 A B Figura 1. Esquema de funcionamiento mecánico del sistema respiratorio. Durante la inspiración, la presión pleural (Ppl) negativa se transmite a todas las estructuras intratorácicas y se facilita la expansión de las vías aéreas y alvéolos. Durante la espiración, la presión pleural positiva, igualmente transmitida a todas las estructuras intratorácicas, puede provocar el colapso de la vía aérea cuando la presión de su interior se iguala a la pleural. En condiciones normales y respirando a volumen corriente (A) este fenómeno no suele presentarse, pero con la espiración activa forzada o en casos de enfermedades obstructivas (B) este colapso se acentúa. El punto de igual presión representa el lugar de colapso de la vía aérea periférica. vía aérea superior extratorácica, que puede generar turbulencias y conferir una morfología en “meseta” a la curva de flujos inspiratorios. PROPIEDADES MECÁNICAS DEL PULMÓN5 Propiedades elásticas En condiciones normales, los pulmones se encuentran distendidos dentro de la caja torácica. Si deseamos que los pulmones se mantengan estáticos en un volumen determinado, debemos 169 Volumen pulmonar (% TLC) TLC 100 A 75 Espiración B 50 Inspiración 25 FRC RV 10 Presión transpulmonar 20 30 Presión transpulmonar cm H2O Figura 2. Curva de presión-volumen estática del pulmón (A) y representación de la histéresis de la curva de presión-volumen (B). La máxima pendiente (máxima distensibilidad) se obtiene a volúmenes intermedios (próximos a la FRC). La separación de las curvas inspiratoria y espiratoria debida a las propiedades elásticas de las vías aéreas y del parénquima pulmonar representa la histéresis pulmonar. conseguir que la presión transpulmonar se equilibre con las fuerzas de retracción elástica, que se oponen a esta distensión. Las propiedades elásticas del pulmón quedan definidas por la distensibilidad o compliance (CL), es decir, por la relación existente entre los cambios de volumen (∆V) que se pueden generar y los cambios de presión transpulmonar secundarios (∆ PA-Ppl). CL= ∆V ∆ PA-Ppl El incremento del volumen pulmonar da lugar a un incremento no lineal de la presión transpulmonar, de modo que la distensibilidad es menor a volúmenes altos y bajos, y máxima cerca de la FRC. Por esta razón, las curvas de distensibilidad del pulmón (Fig. 2) presentan histéresis y son distintas durante la inspiración y la espiración. En la histéresis pulmonar, intervienen tanto las vías aéreas (la histéresis es proporcional al tono muscular del músculo liso que las envuelve) como el parénquima pulmonar (la histéresis del parénquima depende de la elasticidad del tejido, que a su vez está influenciado por la cantidad y calidad de fibras de elastina y, en menor medida, de colágeno), el surfactante, que actúa como agente tensoactivo disminuyendo la tensión superficial de la interfase liquido aire en los alvéolos y, finalmente, el reclutamiento y des-reclutamiento de los alvéolos durante la inspiración y la espiración. Estas curvas se obtienen bien en condiciones estáticas, punto por punto sin movimientos de flujo, o bien de manera “quasiestática” a flujos lentos y constantes. En ambos casos, estas curvas no son de utilidad para el análisis directo del estado de la vía aérea periférica. Distensibilidad dinámica La distensibilidad dinámica consiste en analizar las relaciones de presión y de volumen mientras se mantiene una respiración de alta frecuencia, próxima a 90 respiraciones por minuto y medidas en los momentos de flujo “0”, en el punto de cambio del ciclo respiratorio desde espiración a inspiración. Bajo las circunstancias de respiración a estas frecuencias elevadas, las relaciones de presión-volumen no siguen la línea de la curva estáti170 ca o “quasiestática” porque en estas condiciones dinámicas, además de las fuerzas de retracción elástica y de tensión superficial, intervienen en mayor medida las resistencias que las vías aéreas oponen al movimiento, tanto del gas como del propio tejido. Este componente de resistencia de las vías aéreas se asume que tiene un valor muy próximo a cero en condiciones estáticas y en el punto de inflexión desde la espiración a la inspiración. Durante la determinación de la distensibilidad dinámica, estas resistencias se hacen patentes por pequeñas que sean, por ello esta prueba es útil en el estudio de las vías aéreas periféricas. Para evitar artefactos técnicos, el volumen corriente debe mantenerse constante, lo que dificulta la realización de esta prueba. Los resultados obtenidos en cada frecuencia respiratoria se emiten como porcentaje respecto de los de la distensibilidad estática. Resistencia pulmonar La resistencia que ofrece un tubo al paso de aire por el mismo se define como la pérdida de presión en relación al flujo existente. R= ∆P ∆F La resistencia pulmonar total es el conjunto formado por las resistencias de las vías aéreas y la resistencia de fricción, al desplazamiento de los tejidos o resistencia tisular. La resistencia tisular pulmonar sólo contribuye en un 10% a las resistencias totales. La resistencia pulmonar total depende de factores como la frecuencia respiratoria, el volumen corriente y el volumen pulmonar. La resistencia tisular aumenta con volúmenes pulmonares altos y frecuencias respiratorias bajas. En cambio, la resistencia de la vía aérea depende de su calibre. En este sentido, una expansión pulmonar disminuye la resistencia ya que, al aumentar la retracción elástica, aumenta la tracción radial ejercida sobre las paredes de las vías aéreas (interdependencia mecánica), aumentando el calibre de éstas. Consecuentemente, cuando disminuye el calibre de la vía aérea, como ocurre durante la broncoconstricción, aumenta la resistencia de la vía aérea. REVISTA DE PATOLOGÍA RESPIRATORIA VOL. 8 Nº 2 - ABRIL-JUNIO 2005 Aire Heliox FEMAX50 VISO TLC VC50 FEMAX50 FEMAX50 VISO VISO RV A Normal B Obstrucción periférica C Obstrucción periférica tras brocondilatador Figura 3. Curvas de flujo-volumen con gases de distinta densidad (aire y heliox). El heliox hace que disminuyan las resistencias proximales, donde predomina el flujo turbulento, y hace aumentar los flujos al 50% de la FVC. En la periferia los flujos son laminares y la mayor viscosidad de este gas hace que sus flujos sean menores que los del aire. Por ello, en condiciones normales (A) el volumen de isoflujo (igualdad de flujos con aire y con heliox se produce en la zona terminal de la prueba. En presencia de obstrucciones periféricas (B) el volumen de isoflujo se adelanta (se produce con volúmenes mayores y el incremento de flujo al 50% disminuye. Tras broncodilatación (C) estas dos variables tienden a recuperarse, indicando una acción de los fármacos a niveles central y periférico. TÉCNICAS DE ESTUDIO DE LA VIA AÉREA PERIFÉRICA TABLA I. Interpretación de los cambios hallados en las curvas de flujovolumen con aire o heliox en respuesta al tratamiento broncodilatador, según el predominio de acción a nivel central o periférico La espirometría: principales patrones respiratorios6,7 Densidad y máximo flujo espiratorio. Gas de baja densidad: He-O26 (heliox) Bajo condiciones de flujo turbulento, el FEFmax (flujo espiratorio máximo) de un individuo es mayor si respira un gas de baja densidad como la mezcla de 80% He y 20% O2 (heliox), que si se respira aire normal (Fig. 3). Esto se debe a que esta mezcla de baja densidad disminuye las resistencias proximales e incrementa el flujo. El hecho de poder obtener 2 curvas de flujo diferentes según se respire aire o heliox planteó la posibilidad de su utilización como método de screening precoz y sensible de enfermedad obstructiva. También sirve para ubicar la obstrucción en el espacio. Esta prueba requiere que el 95% del nitrógeno sea sustituido por heliox, lo que se consigue con 3 inhalaciones a capacidad vital en un sujeto normal, o respirando a volumen corriente durante 5 o 10 minutos en casos de pacientes con una obstrucción severa. Esta técnica utiliza las variables de Femax, ∆-Femax50 y volumen de isoflujo. Con heliox, la máxima amplitud del flujo en una curva flujo-volumen se encuentra en el 50% de la capacidad vital (∆-Femax50), esto es, entre el volumen residual (VR) y la capacidad pulmonar total. En un individuo con función pulmonar normal los flujos son predominantemente turbulentos a este volumen, por lo que el ∆-Femax50 con heliox será máximo8. El volumen de isoflujo9 es el punto de intersección entre las dos curvas de flujo-volumen, la de aire y la de heliox. Las curvas deben de igualarse una vez superado el punto de obstrucción. Ese punto de obstrucción está inevitablemente en relación con la intersección. Si ésta tiene lugar en volúmenes altos la obstrucción será periférica, si lo hace en volúmenes bajos será central. Las curvas se igualan porque el territorio sobre el que actúa la obstrucción tiene un régimen laminar10. La tabla I resume los hallazgos que puede aportar esta técnica en la interpretación del lugar de la obstrucción. Vemax ∆vemax50 Interpretación Aumentado Aumentado Aumentado Aumentado Disminuido No cambia Predomina BD periférica Predomina BD central BD central y periférica Movimiento laminar y turbulento A bajas velocidades, los fluidos fluyen con un movimiento suave llamado laminar, que puede describirse mediante las ecuaciones de Navier-Stokes, deducidas a mediados del siglo XIX. A velocidades altas, el movimiento de los fluidos se complica y se hace turbulento. En los fluidos que fluyen por tubos, la transición del movimiento laminar al turbulento depende del diámetro del tubo y de la velocidad, densidad y viscosidad del fluido. Cuanto mayores son el diámetro, la velocidad y la densidad, y cuanto menor es la viscosidad, la formación de flujo turbulento será más probable. En un sistema de tubos convergentes el flujo depende de la densidad del gas cuando el régimen es turbulento (nº de Reynolds > 2.000) o cuando es alta la pérdida de presión debido a la aceleración convectiva. Cuando el régimen del flujo es laminar éste depende de la viscosidad y es independiente de la densidad. En el pulmón el flujo es laminar en la periferia y turbulento en las vías centrales. De esta manera, en el pulmón normal el flujo es densidad-dependiente a altos volúmenes (75% de VC) localizándose este territorio en vías moderadas a grandes y viscosidad dependiente en el 25% restante, esto es, con volúmenes bajos y, por tanto, en vías pequeñas, hacia la periferia del pulmón. En un individuo normal el punto de igual presión se suele localizar cerca del área cartilaginosa impidiendo el colapso. Si se exagera la espiración es posible que con volúmenes muy bajos se desplace el pun- S. Heili Frades et al. Técnicas de función respiratoria en el estudio de la pequeña vía aérea. Un modelo de Fractal 171 ferencias existentes entre estos 2 gases se deberán únicamente a sus distintas propiedades difusivas. La fase 4 se corresponde con el incremento brusco de la concentración de N2, cerca ya del volumen residual. El volumen comprendido entre el punto donde comienza el incremento y el final de la espiración se llama volumen de cierre. Se debe al cierre de las vías aéreas en las zonas inferiores del pulmón, que son las zonas de menor contenido de N2. Cuando hay lesión en las vías aéreas periféricas, el cierre se anticipa y el volumen de cierre es mayor. Concentración de N2 Este área corresponde al espacio muerto anatómico de Fowler Fase 1 Fase 2 Fase 3 Fase 4 Volumen espirado Figura 4. Nitrograma en la técnica de respiración única. Tras una inspiración de capacidad vital de oxígeno se recoge la concentración de nitrógeno frente al volumen espirado a flujo lento y constante. Se representan las 4 fases clásicas del nitrograma y los procedimientos de medición (véase texto). to hacia el interior del pulmón y se colapse antes la pequeña vía. Sin embargo, en pacientes con patología obstructiva se altera la capacidad de retracción pulmonar y se puede generar una rápida caída de presión ya en zonas muy periféricas del pulmón abocando al colapso de la vía periférica. Cuando esto ocurre, desde este punto (conocido como choked point) y hasta el alvéolo, el flujo pasa a depender sólo de las estructuras periféricas y las dos curvas aireheliox se aproximan y el volumen de isoflujo será mayor y el ∆Femax50 estará levemente aumentado (Fig. 3). Tras administrar broncodilatadores en obstrucciones periféricas se recupera un Viso menor y un ∆Femax50 mayor (Fig. 3). Nitrograma en la técnica de respiración única (SBW)11 Consiste en la inhalación desde RV, de una capacidad vital de O2 al 100% e inmediatamente una espiración durante la que se registra el trazado de la concentración de N2 frente al volumen espirado (Fig. 4)12. De esta manera se obtiene el nitrograma, con sus 4 fases bien definidas. La fase 1 corresponde al gas inspirado (O2) que ocupa la vía aérea principal sin aparición de N2. La fase 2 o fase de transición, con incremento de la concentración de N2 de forma sigmoidal corresponde a la interfase entre el gas inspirado y el gas alveolar. Si no existiesen mecanismos difusivos (sólo hubiese mecanismos convectivos) el paso de la fase 1 a la 3 sería brusco. Esta fase se corresponde con el espacio muerto anatómico de Fowler. La fase 3 o meseta alveolar corresponde a la muestra de gas alveolar. La pendiente de esta fase tiene que ver con la heterogénea distribución del gas en la periferia. Influyen en esta pendiente el intercambio de gases (hasta un 10% de la pendiente se debe a que el mayor consumo de oxígeno respecto de la producción de CO2 deja como balance una mayor concentración del gas inerte, en este caso el nitrógeno). Pero la mayor parte de la pendiente está influenciada por las variaciones de la distribución de la ventilación inter y sobre todo intrarregionales que se producen en la periferia del pulmón donde las vías tienen menos de 2 mm de diámetro. Se puede obtener más información utilizando gases especiales como el He con bajo peso molecular o el SF6 con alto peso meloecular, que permiten estudiar las alteraciones difusivas de la distribución de la ventilación, ya que las di172 Test de lavado utilizando la técnica de respiraciones múltiples (multiple-breath inert gas washout [MBW])13-15 Hasta hace no más de medio siglo esta técnica no se admitía como prueba normalizada de función pulmonar. Ni había adecuados índices, ni se pudieron descartar ciertos factores de confusión inherentes a la técnica. En 1973, Paiva introduce el análisis de las pendientes normalizadas de las fases III y establece las bases de diferenciación del mezclado convectivo (proximal) del difusivo-convectivo (periférico). A partir de aquí, esta técnica se ha venido desarrollando tanto en estudios de fisiología pulmonar, para estudios de los efectos gravitacionales y de distribución de la ventilación en ingravidez, como para el diagnóstico de lesión incipiente de la vía aérea periférica. También se ha llegado a aplicar de forma experimental en el pulmón de algunos tipos de roedores que por su pequeño tamaño no estaban influenciados por la gravedad, consiguiéndose así un gran número de controles16. La figura 5 representa el volumen y la concentración de N2 en relación con el tiempo, en un sujeto al que se le pide que respire de forma regular, a volumen corriente desde la capacidad residual funcional (FRC) e inhalando en cada inspiración O2 puro. Vemos que en cada inspiración de oxígeno puro se produce una mezcla a nivel alveolar y se elimina o “lava” una determinada concentración de nitrógeno cada vez. A medida que el individuo respira se lava cada vez menos nitrógeno pues éste se agota. La curva derivada de estos múltiples lavados en su conjunto se conoce como “curva de lavado de N2”. Mediante el análisis de las pendientes de las fases III de cada respiración pueden estimarse otras variables que indican el estado de afectación de la periferia pulmonar (Fig. 5). Utilización de gases de distinta densidad en el estudio del mezclado intrapulmonar de gases17-20 Los gases de distinta densidad tienen constantes de difusión diferentes. El helio tiene una constante de difusión 6 veces mayor que la del hexafluoruro de azufre (SF6). Así, donde comienza el intercambio de moléculas por diferencias de concentración (difusión molecular) o frente de difusión del gas, será en una zona de la vía aérea más proximal para el gas más liegero. Siguiendo los estudios de Paiva et al., 1976, el frente de difusión del nitrógeno está en la entrada de los acinos, el del He está una generación más proximal y el del SF6 una generación más distal, esto es, dentro del acino. Debido a la diferente posición de los frentes, la pendiente de la fase III para el He será menor, pues este gas comienza a homogeneizarse antes con el gas residente. Como veíamos anteriormente, el papel que el patrón convectivo tiene en la pendiente de la fase III es negligible, por lo que cualquier alteración a este nivel linda con el mecanismo difusivo y, por ende, con trastornos intra-acinares de mezclado. De ahí la importancia de esta técnica en el estudio de la periferia del pulmón. REVISTA DE PATOLOGÍA RESPIRATORIA VOL. 8 Nº 2 - ABRIL-JUNIO 2005 %N2 50 40 S (liter-1) A D 30 Scond 20 10 0 20 30 40 50 60 70 IL OL IL Tiempo S Sacin Volumen L %N2 %N2 N=20 N=1 C B Volumen L Volumen L Figura 5. Test de lavado de nitrógeno en respiraciones múltiples. El sujeto realiza inspiraciones de oxígeno y se va analizando la concetración espirada de nitrógeno a medida que va siendo “lavado” del pulmón. Puede apreciarse cómo desciende la concentración de nitrógeno de un modo exponencial (A). Mediante el análisis de las pendientes normalizadas de las fases III (B y C) puede medirse el perfil de cambio de estas pendientes a lo largo de las sucesivas respiraciones y calcular las variables indicadoras de las alteraciones de la distribución de la ventilación en la periferia pulmonar SACIN y SCOND (D). %HE %SF6 5 %N2 80 70 60 50 40 30 20 10 0 SF6 HE N2 4 3 2 1 0 0 1 2 3 4 5 Volumen espirado Figura 6. Nitrograma extendido con gases de distinta densidad (He y SF6). Tras una inspiración a capacidad vital de la mezcla de gases de 90% de 02, 5% de He y 5% de SF6 se espira hasta volumen residual igual que en el nitrograma simple y se analizan los tres gases inertes (N2, He y SF6). Los gases inertes inspirados muestran una morfología en espejo (pendientes negativas) respecto de la del N2 (gas residente). Aunque sabemos que el SBW (nitrograma en la técnica de respiración única) no es capaz de detectar las alteraciones convectivo-dependientes (CD) ni conectivo-difusivo-dependientes (DCD), el MBW (técnica de respiraciones múltiples) sí es capaz de detectarlas aunque con limitaciones. Estas limitaciones derivan del hecho fundamental de que, si las alteraciones DCD fueran los únicos determinantes de la fase III, la pendiente normalizada del N2 se incrementaría durante las 3 ó 4 primeras respiraciones pero luego alcanzaría un equilibrio y permanecería cons- tante. Lejos de ocurrir esto esta pendiente no logra alcanzar una asíntota. Si sólo tuviésemos en cuenta un mecanismo convectivo, para dos unidades con diferentes volúmenes las diferencias de concentración aumentarían sin cesar hasta que la mejor ventilada se vaciase del todo, es decir, se lavara completamente del gas residente. Utilizando gases de distinta densidad se observa que adquieren diferentes pendientes en las primeras respiraciones, luego a este nivel las heterogeneidades son difusivas. Sin embargo, las pendientes se igualan posteriormente, luego sólo heterogeneidades convectivas pueden explicar el resto de la pendiente de un MBW. La técnica extendida del nitrograma con gases de distinta densidad se realiza igual que la del nitrograma simple pero, en lugar de inspirar únicamente oxígeno puro, se inspira una mezcla de gases que contiene 90% de O2, 5% de He y 5% de SF6, de esta manera, en la espiración se pueden analizar los tres gases (N2, He y SF6 (Fig. 6). Las pendientes de He y SF6 son negativas y la del N2 positiva. Cuando la asimetría es muy periférica se afectan las pendientes de los dos gases pero de forma diferente. Ya que el estrechamiento afecta al mecanismo difusivo de los gases, se afectará en mayor grado el gas menos difusible, es decir el SF6, mientras que el He se homogeneizará más fácilmente con el gas residente. Por lo tanto, el estrechamiento de las vías más periféricas afectará de forma muy significativa a la pendiente de la fase III del SF6. En humanos la referencia existente en cuanto a mezclado intrapulmonar de gases en patología de vías periféricas21 se reduce a los casos de bronquiolitis post-trasplante de pulmón o pulmón-corazón22-24. En un individuo normal las pendientes del He y SF6 no se alteran. En un individuo con una obstrucción periférica, se alteran las 2 pendientes pero lo hacen de forma distinta se- S. Heili Frades et al. Técnicas de función respiratoria en el estudio de la pequeña vía aérea. Un modelo de Fractal 173 gún la localización de la obstrucción. Si la obstrucción se encuentra entre los frentes de difusión del He y del SF6 se afectará en mayor medida la pendiente del He. Así, la diferencia SF6-He se negativiza. Esto sugiere que la alteración se encuentra localizada en la zona del frente de difusión del He, esto es, del bronquíolo membranoso al respiratorio y no en los ductos alveolares. La localización anatómica del proceso nosológico deriva de los estudios de Paiva et al., de 1976 que establecen que el frente de difusión (FD) del nitrógeno N2 está en la entrada de los acinos, el del He está una generación más proximal (desde los bronquíolos membranosos a los respiratorios) y el del SF6 una generación más distal, esto es, en los conductos alveolares. Estas técnicas han permitido establecer el efecto parasimpático sobre la funcionalidad de la vía aérea periférica25. Con el nervio vago intacto, en la espiración este nervio estimula sus receptores. Los receptores son proximales al frente de difusión del helio. El origen último de la obstrucción se desplaza y se produce antes de entrar en el frente de difusión del Helio por lo que su pendiente no se altera más que la del SF6. Las pendientes de SF6 y He se alteran pero su relación deja de ser negativa y se positiviza . Sabemos que hay patología en la vía periférica dada la alteración de todas las pendientes pero esa relación positiva no nos permite ubicar el lugar exacto de la obstrucción. Para alcanzar la relación negativa descrita en post-trasplantados, es necesario anular el efecto del vago, que en este caso es el factor de confusión. EL PULMÓN HUMANO: UN PARADIGMA DE FRACTAL26 Entendemos por geometría fractal a la parte de la matemática que estudia la generación, dimensionalidad y aplicación práctica de los fractales. El análisis fractal aplicado al pulmón humano es un tema de actualidad pero aún no demasiado conocido pero que puede servir para explicar la estructura del pulmón y relacionarla con su función. En realidad el concepto no es nuevo, pero su aplicación a la fisiología respiratoria sí lo es. Es de una complejidad enorme, pero permite aplicar fórmulas de autorrepetición de eventos en tiempo real que permiten predecir y entender a escala alveolar las diferentes heterogeneidades de ventilación y no la heterogeneidad resultante. O sea, no generaliza, fracciona. La geometría euclídea que heredamos de la Grecia clásica proviene de la idealización de las formas de la naturaleza. Conceptos como punto, línea, perpendicularidad o círculo tienen su origen en la observación de formas naturales como planetas, árboles o el horizonte. Aunque esta geometría ha sido utilizada en la descripción, comprensión y modelación, a las cuales no es ajena la anatomía, es muy simple y puede ser vista como una aproximación a las formas naturales que son, esencialmente, complejas e irregulares. Mandelbrot4 introdujo el término “fractal” para ciertos objetos geométricos con la propiedad de la autosimilitud e invarianza bajo contracción y expansión. Posteriormente señaló que “los fractales abren un nuevo campo entre el excesivo orden geométrico euclídeo y el caos geométrico de la rugosidad y la fragmentación”. Uno de los sistemas en que es más evidente el problema geométrico es el sistema respiratorio, pues uno de los fines de éste es distribuir un volumen de aire inspirado (vía aérea) en una superficie de intercambio (superficie alveolar) que a su vez se encuentra en un volumen acotado (el tórax). Mandelbrot4 también fue el primero en proponer que el pulmón de los mamíferos tiene 174 geometría fractal; posteriormente se ha demostrado que la reducción del diámetro de los bronquios, la superficie alveolar y el flujo pulmonar, tienen propiedades fractales26. En referencia al diámetro de la vía aérea, las primeras evidencias señalaron una reducción del calibre de los bronquios siguiendo una curva exponencial que se encontraba asociada a la acomodación de un máximo flujo con mínimo volumen y disipación de energía o mínima producción de entropía. Posteriormente se demostró que el diámetro de los bronquios, más allá de la décima generación, disminuía más lento que lo predicho por una relación de este tipo y que esto podría estar asociado a la transición desde una zona de transporte por convección a una zona de difusión pasiva. Actualmente, ambos tipos de modelos (exponencial y potencial) pueden consideraqrse válidos y obedecen a la geometría fractal unida a la asimetría del patrón de dicotomía bronquial. Las consecuencias de una geometría fractal en el sistema respiratorio son numerosas. Las más evidentes son un aumento de la relación área/volumen que permite optimizar el intercambio de gases y la capacidad de la vía aérea de ocupar espacio mediante ramificación, llegando rápidamente a la superficie alveolar2. La demostración de una geometría fractal a nivel de órganos y organismos no es irrelevante en las ciencias biomédicas pues ha permitido explicar y proponer nuevas causas o consecuencias que relacionan estructura y función. Entre ellas se encuentran la relación entre esta geometría y la salud, su relación con el origen de las leyes alométricas o la dualidad del tiempo intrínseco en el que pueden reconocerse un tiempo euclídeo asociado a la velocidad constante de transporte en estructuras cilíndricas y un tiempo fractal característico de los órganos con estructuras ramificadas autosímiles. La matemática fraccionaria aplicada al estudio funcional de la pequeña vía aérea, donde esta dimensión geométrica es más palpable, aclarará en el futuro sin lugar a dudas el complejo comportamiento biofísico de estas diminutas estructuras. “However, if we do discover a complete theory, it should in time be understandable in broad principle by everyone, not just a few scientists. Then we shall all, philosophers, scientists, and just ordinary people, be able to take part in the discussion of the question of why it is that we and the universe exist”. Stephen Hawking. BIBLIOGRAFÍA 1. Weibel ER, Domingo MG. Architecture of the human lung. Science 1962; 137: 577-85. 2. Petty TL. Robust Design of the Lung*: Fractal Patterns and Capillary Independence. 40Th Annual Aspen Lung Conference: Biology & Pathobiology Of The Lung Circulation. Chest 1998; 114: 16S-17S. 3. Cosio M, Ghezzo H, Hogg JC, Corbin R, Loveland M, Dosman J, et al. The relations between structural changes in small airways and pulmonary function tests. N Engl J Med 1977; 298: 1277-81. 4. Mandelbrot B. The fractal geometry of nature. San Francisco. Freeman Press: 1982. 5. Dubois AB, Botelho J, Corroe JH Jr. A new method for measuring airway resistance in man using a body plethysmograph. J Clin Invest 1956; 35: 327-35. 6. Wilson A. Pulmonary function testings. Indications and interpretations. 1985 by Grune & Stratton. Inc. 7. American Thoracic Society. Standardization of spirometry: 1994 update. Am Rev Respir Dis 1995; 152: 1107-36. 8. Dean RB, Visscher MB. Kinetics of lung ventilation; evaluation of viscous and elastic resistance to lung ventilation with particular refernce to effects of turbulence and therapeutic use of Helium. Am J Physiol 1941; 134: 450-68. REVISTA DE PATOLOGÍA RESPIRATORIA VOL. 8 Nº 2 - ABRIL-JUNIO 2005 9. Mink S, Ziesmann M, Word LDH. Mechanisms of increase maximum expiratory flor during HE-O2 breathing in dogs. J Appl Physiol 1970; 47: 4900-502. 10. Fairsher P, Wilson AF. Volume of isoflow: effect of distribution of ventilation. J Appl Physiol 1977; 43: 807-11. 11. Tobin MJ. Sleep-disordered breathing, control of breathing, respiratory muscles, and pulmonary function testing in AJRCCM. Am J Respir Crit Care Med 2001; 165: 584-97. 12. Fowler WS. Lung function studies. III. Uneven pulmonary ventilation in normal subjects and in patients with pulmonary disease. J Appl Physiol 1949; 2: 283-99. 13. Verbanck S, Schuermans D, Van Muylem A, Melot C, Noppen M, Vincken W, et al. Conductive and acinar lung-zone contributions to ventilation inhomogeneity in COPD. Am J Respir Crit Care Med 157: 1573-7. 14. Verbanck S, González Mangado N, Peces-Barba G, Paiva M. Multiple-breath washout experiments in rat lungs. J Appl Physiol 1991; 71: 847-54. 15. Paiva M, Verbanck S, Van Muylem A. Diffusion-dependent contribution to the slope of the alveolar plateau. Respir Physiol 1988; 72: 257-70. 16. Guy HJB, Prisk GK, Elliott AR, Deutschman R III, Jr, West JB. Inhomogeneity of pulmonary ventilation during sustained microgravity as determined by single breath washouts. J Appl Physiol 1994; 76: 1719-29. 17. Engel LA, Paiva M, Siegler DIM, Fukuchi Y. Dual tracer single breath studies of gas transport in the lung. Respir Physiol 1979; 36: 103-19. 18. Magnussen H, Kluwig M, Scheidt M, Jörres R, Kesseler K. Effect of breath-holding on expired gas concentrations of He and SF6 in healthy subjects and patients with obstructive lung disease. Bull Eur Physiopathol Respir 1982; 18: 255-9. 19. Paiva M, Engel LA. Theoretical studies of gas mixing and ventilation distribution in the lung. Physiol Rev 1987; 67: 750-96. 20. Verbanck S, Paiva M. Model simulations of gas mixing and ventilation distribution in the human lung. J Appl Physiol 1990; 69: 2269-79. 21. Matsuba K, Shirakusa T, Kuwano K, Hayashi S, Shigematsu N. Small airways disease in patients without chronic airflow limitation. Am Rev Respir Dis 1987; 136: 1106-11. 22. Van Muylem A, De Vuyst P, Yernault JP, Paiva M. Inert gas single breath washout and structural alteration of respiratory bronchioles. Am Rev Respir Dis 1992. 23. Estenne M, Van Muylem A, Knoop C, Antoine M, and the Brussels Lung Transplant Group. Detection of obliterative bronchiolitis after lung transplantation by indexes of ventilation distribution. Am J Respir Crit Care Med 2000; 162: 1047-51. 24. Van Muylem A, Antoine M, Yernault JC, Paiva M, Estenne M. Inert gas single-breath washout after heart-lung transplantation. Am J Respir Crit Care Med 152: 947-52. 25. Van Muylem A, Paiva M, Estenne M. Involvement of peripheral airways during methacholine-induced bronchoconstriction after lung transplantation. Am J Respir Crit Care Med 164: 1200-3. 26. Glenny RW, Robertson HT, Yamashiro S, Bassingthwaighte JB. Applications of fractal analysis to physiology. J Appl Physiol 1991; 70: 2351-67. S. Heili Frades et al. Técnicas de función respiratoria en el estudio de la pequeña vía aérea. Un modelo de Fractal 175






