- Ninguna Categoria
Fundamento teórico para laboratorio ácido base File
Anuncio
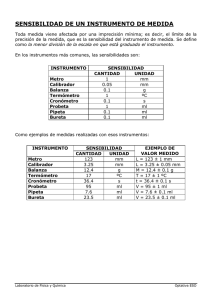
Laboratorio Ácido Base Química I Tecnólogo minero 2 Objetivo Comprender conceptos de equilibrio Ácido – Base y equilibrio de solubilidad con el empleo de piedras calizas. Determinación del pH mediante titulación de disoluciones problema con una disolución patrón secundario de hidróxido de sodio (NaOH) previamente titulada por los docentes, mediante tiras de pH y pHmétro. Introducción La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. Las ideas actuales + sobre tales conceptos químicos consideran los ácidos como dadores de protones (H ) y las bases como aceptores. Los procesos en los que interviene un ácido, interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido – base. Antes de que se conociera el comportamiento a nivel molecular de este tipo de sustancias, se reconocían por sus propiedades características. Esta idea de definir el concepto de ácido y de base indicando cómo ha de comportarse químicamente una sustancia para que pueda considerarse como miembro de una u otra familia de compuestos fue introducida por Boyle en 1663. Posteriormente un conocimiento más preciso de las fórmulas químicas llevó a algunos investigadores, como Justus von Liebig (1803-1873), a definir los ácidos por su composición molecular; sin embargo, la vieja idea de Boyle, aunque transformada con las sucesivas definiciones de ácidos y bases, sigue aún en pie. Producto iónico del agua – pH El agua aunque no es un compuesto iónico, presenta una notable polaridad y por ello se + disocia en iones, aunque en muy pequeña proporción. En agua pura existen iones H30 y OH que proceden únicamente de su disociación iónica, que es el equilibrio ácido-base más sencillo: Resumidamente se expresa como: + - Por la estequiometria de la reacción de disociación, se tiene que [H3O ] = [OH ]. Además, esta reacción pone de manifiesto que el agua puede actuar como una base ganando + protones para convertirse en H3O y, simultáneamente puede actuar como un ácido cediendo protones a otra molécula de agua para convertirse en OH es decir, el agua es una sustancia anfótera. La constante de este equilibrio: 3 + - Kc [H2O] = [H ] [OH ] que es el producto iónico del agua y se representa por Kw. A 25°C Kw -14 + tiene un valor de 10 . Por tanto Kw = [H ] [OH ] entonces en agua pura: + -7 [H ] = [OH ] = 10 M. En disoluciones diluidas el producto iónico del agua Kw es constante, por lo que un + aumento de [H ] supondrá una disminución del [OH ] y viceversa. Así, la presencia de un + ácido en disolución dará lugar a un aumento de la concentración de iones H , mientras que la presencia de una base dará lugar a su disminución, lo que hará aumentar la concentración de iones OH . Siempre que tengamos el agua como disolvente, si la temperatura no varía, el producto iónico debe mantenerse constante. Sorensen introdujo en 1909 el concepto de pH con el objeto de simplificar el manejo de concentraciones de protones. Así, definió pH como menos el logaritmo decimal de la concentración de protones: + pH = - log [H ] Paralelamente definió el concepto de pOH como menos el logaritmo decimal de la concentración de hidroxilos pOH = - log [OH ] Para calificar las disoluciones atendiendo a esta relación se emplean los términos: - Neutra: [H+] = [OH-] = 10-7: pH = pOH = 7 - Ácida: [H+] > [OH-]: pH < 7 - pOH > 7 - Básica: [H+] < [OH-]: pH > 7 - pOH < 7 Si se quiere conocer de forma aproximada el pH de una disolución, se utiliza el indicador universal, que es una mezcla en volúmenes iguales de rojo de metilo, timolftaleina, fenolftaleína, α-nalftolftaleina y azul de bromotimol, que da un color rojo a pH = 4 pasando a violeta a pH = 11. 4 En este esquema se muestra el pH aproximado de algunas disoluciones de sustancias comunes: Piedra Caliza La caliza es una roca sedimentaria compuesta mayoritariamente por carbonato de calcio (CaCO3), generalmente calcita. También puede contener pequeñas cantidades de minerales como arcilla, hematita, siderita, cuarzo, etc., que modifican (a veces sensiblemente) el color y el grado de coherencia de la roca. Es una roca importante como reservorio de petróleo, dada su gran porosidad. Tiene una gran resistencia a la meteorización; esto ha permitido que muchas esculturas y edificios de la antigüedad tallados en caliza hayan llegado hasta la actualidad. Sin embargo, la acción del agua de lluvia y de los ríos (especialmente cuando se encuentra acidulada por el ácido carbónico) provoca su disolución, creando un tipo de meteorización característica denominada kárstica. No obstante es utilizada en la construcción de enrocamientos para obras marítimas y portuarias como rompeolas, espigones, escolleras entre otras estructuras de estabilización y protección. El carbonato de calcio se disuelve con mucha facilidad en aguas que contienen gas carbónico disuelto (CO2), debido a la alta solubilidad del bicarbonato cálcico, como compuesto intermedio. Pero para el caso contrario, en entornos en los que aguas cargadas de CO2 se liberan bruscamente a la atmósfera, se produce generalmente la precipitación del carbonato de calcio en exceso, según la siguiente reacción: Ca 2+ − + 2 (HCO3 ) → CaCO3 + H2O + CO2 Esa liberación de CO2 se produce, fundamentalmente, en dos tipos de entornos: en el litoral cuando llegan a la superficie aguas cargadas de CO2 y, sobre los continentes, cuando las aguas subterráneas alcanzan la superficie. 5 Titulaciones La titulación es un método para determinar la cantidad de una sustancia presente en solución. Una solución de concentración conocida, llamada solución valorada, se agrega con una bureta a la solución que se analiza. En el caso ideal, la adición se detiene cuando se ha agregado la cantidad de reactivo determinada en función de un cambio de coloración en el caso de utilizar un indicador interno, y especificada por la siguiente ecuación de la titulación. NA VA = NB VB A este punto se le llama punto de equivalencia. En términos generales la reacción entre cantidades equivalentes de ácidos y bases se llama neutralización o reacción de neutralización, la característica de una reacción de neutralización es siempre la combinación de hidrogeniones que proceden del ácido, con hidroxilos procedentes de la base para dar moléculas de agua sin disociar, con liberación de energía calorífica como calor de neutralización y formación de una sal. En una expresión como la siguiente expresión: Ácido + Base → Sal + Agua Disoluciones patrón primario: tiene una concentración exactamente conocida de un reactivo patrón primario. Propiedades de los patrones primarios • Composición conocida • Pureza alta • Estable a temperatura ambiente • Debe ser estable a temperaturas altas para poder secarse en una estufa • No debe absorber gases ni reaccionar con el aire • Reaccionar rápidamente y estequiométricamente con el titulante • Masa molecular elevada para minimizar errores en pesada Disoluciones de patrones secundarios: Disoluciones que han sido tituladas mediante un patrón primario. Una vez conocida la concentración se pueden utilizar para realizar otras titulaciones. Indicadores Ácidos o bases débiles que al añadirse a una muestra sobre la que se desea realizar la titulación cambia de color, indicando el fin de la titulación. Se elije el indicador según el pH al cual se produzca el punto de equivalencia. En la tabla se muestran indicadores de pH, sus pH de viraje y los colores correspondientes 6 La fenolftaleína es el indicador de pH más utilizado para titulaciones ácido – base. Material de vidrio, definiciones y usos Antes de ingresar al laboratorio colocarse túnica y lentes de seguridad. Recordar que estos son elementos que van a prevenir accidentes. Para la medida de volúmenes, se cuenta en el laboratorio con diferentes instrumentos denominados genéricamente materiales volumétricos. Los podemos sub-clasificar en elementos contenedores y elementos para transferir. Dentro de los primeros tenemos vasos de Bohemia, matraces y probetas. Dentro de los segundos pipetas y buretas. Para realizar medidas analíticas los instrumentos se clasifican en función de su precisión. La medición de volumen se realiza con matraces aforados, pipetas aforadas y buretas. Que un instrumento sea preciso implica que las medidas de volumen realizadas con dicho instrumento tienen baja dispersión entre ellas. PROBETAS Se utilizan para medir volúmenes cuando la precisión no debe ser muy elevada. Su capacidad varía desde unos pocos mL hasta L. PIPETAS Se utilizan para trasvasar líquidos. Se clasifican en dos tipos, pipetas graduadas y pipetas aforadas. Las primeras carecen de precisión al igual que las probetas y poseen una escala graduada. Mientras que las aforadas se utilizan para transferir un único volumen de líquido, medido con exactitud y precisión. En la de la izquierda se muestran las pipetas graduadas y en la de la derecha las aforadas. Las pipetas aforadas están está formada por un bulbo y un vástago. La parte de la pipeta en la que está el aforo (un aforo es una marca circular grabada con precisión sobre el vidrio (o material que 7 corresponda) del material volumétrico para indicar que ese es el volumen determinado) es lo suficientemente angosta para que cualquier variación en el volumen, produzca una diferencia apreciable en la altura del nivel del líquido dentro de él y es mucho más angosta que el cuerpo de la pipeta donde se encuentra la mayor parte del volumen. Cuando se mide el volumen con una pipeta aforada, no es posible descargar todo el líquido que se introdujo, siempre queda una pequeña cantidad en la punta que nunca debe expulsarse pues la pipeta se calibra teniéndolo en cuenta. Para cargar la pipeta se realiza por succión con una pera de goma como se verá en la siguiente sección. Nunca realizarlo con la boca. BURETA Es un tubo de vidrio graduado, de diámetro interno uniforme, con una llave o sistema similar, que permite dispensar cantidades variables y exactas de líquido y por lo tanto, presenta varias subdivisiones. Después de la carga y antes de su uso se debe tener la precaución de que no queden burbujas en su interior como se verá en la siguiente sección. MATRAZ AFORADO Están provistos de un cuello largo y un aforo que indica su capacidad. Se utiliza para preparar disoluciones de concentración conocida. MATRAZ ERLENMEYER Matraz de paredes inclinadas, su forma disminuye el riesgo de salpicaduras. Su graduación es de volúmenes aproximados. VASO DE BOHEMIA Vaso de vidrio que se utiliza para realizar precipitaciones, contener valoraciones, etc. Puede estar graduado pero su graduación es aproximada. 8 Modo de uso de los materiales de vidrio RECORDAR QUE EL VIDRIO CALIENTE TIENE EL MISMO ASPECTO QUE EL VIDRIO FRIO. Modo de uso de los materiales de vidrio BURETA Antes de llenar la buretas Antes de realizar el llenado de la bureta, enjuáguela con una pequeña cantidad la solución valorante de manera de arrastrar el agua y posibles contaminantes. Llenado de buretas El llenado de la bureta se realiza vertiendo el líquido desde la parte superior de la misma una vez que se ha cerrado la llave o colocado la pinza de Mohr. Algunas buretas tienen un embudo incorporado para facilitar su llenado, pero si es necesario se puede utilizar una pipeta graduada. Uno de los errores más comunes al usar una bureta consiste en no expulsar las burbujas de aire que se forman con frecuencia bajo la llave. Cuando estas burbujas están presentes al inicio de una valoración, pueden escapar mientras se vierte reactivo y provocar un error en la determinación del volumen de líquido vertido de la bureta. Suele ser posible expulsar la burbuja abriendo completamente la llave o la pinza de Mohr durante uno o dos segundos. A veces, una burbuja muy persistente puede eliminarse tapando el pico de la bureta, mientras se golpea o se comprime la goma con cuidado. Enrase La lectura del volumen ha de realizarse de tal modo que los ojos estén en un plano tangente al menisco, como se
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados