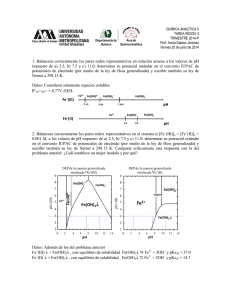
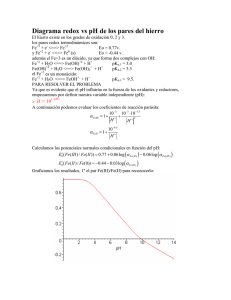
Tarea 4 1. En los siguientes ejemplos las disoluciones se
Anuncio

UNAM-Facultad de Química Prof. Mario Alfredo García Carrillo 1402 Química Analítica I Semestre 2016-I Tarea 4 1. En los siguientes ejemplos las disoluciones se mezclan, la reacción alcanza el equilibrio y se inserta un electrodo de platino en la disolución para hacer una semicelda. Esta semicelda se conecta a un electrodo normal de H2 y se mide el potencial. Calcule el potencial en cada caso: a) 50 mL de Sn2+ 0.10M + 20 mL de Cr2 O72- 0.050M, [H+] = 0.001 M b) 50 mL de Sn2+ 0.050 M + 50 mL de Fe3+ 0.20M Eº Sn4+/ Sn2+ = 0.139 V; Eº Fe3+/ Fe2+ = 0.77 V; Eº Fe2+ / Fe = -0.44 V; Eº Cr2O72-/ Cr3+ = 1.33 V 2. Se dan los siguientes sistemas: Ox1 + e ↔ Red1 E°1 = 1.28V Ox2 + ne ↔ Red2 E°2 = 0.49V La constante de equilibrio de la reacción Ox1 con Red2 es de 1040. Calcular n, el número de electrones de la segunda semirreacción. 3. Considere los siguientes potenciales Redox: a) ClO- + H2O + 2 e- ⇔ Cl- + 2 OH- E° = 0.89 V b) Cr3+ + 3 e- ⇔ Cr(s) E° = -0.76 V c) Cu2+ + 2 e- ⇔ Cu(s) E° = 0.34 V d) Au3+ + 3 e- ⇔ Au(s) E° = 1.50 V e) Ag+ + e- ⇔ Ag(s) E° = 0.80 V Si se coloca Cr(s), Cu(s), Ag(s) o Au(s), en contacto con una solución de hipoclorito de sodio (ClO-), ¿cuáles metales serán oxidados y cuáles no? Justifique en función de los potenciales de cada celda galvánica. ¿Cuál metal es el primero en oxidarse? ¿Cuál metal es el último en oxidarse? Escribe las semireacciones y la reacción global del primer metal en oxidarse y del último metal en oxidarse 4. Se arma una celda como sigue: FeǀFe2+ (0.1M) || Cd2+ (0.001M) | Cd a) dibuje la celda, b) Escriba la reacción de cada electrodo, c) la reacción global de la celda, d) calcule la FEM de la celda, e) la polaridad de los electrodos, e) el sentido del paso de corriente y la dirección de los electrones, f) Calcule la constante de equilibrio de la reacción de celda, g) Tras completarse la reacción, ¿cuál es la concentración de equilibrio de las distintas especies químicas? h) En este punto, ¿qué valor de potencial tiene la celda? Eº Fe2+/ Fe = -0.44V Eº Cd2+/ Cd = -0.403V 5. Calcule la constante de equilibrio para la reacción Fe2+ + B3+ ↔ Fe3+ + B2+ En donde el E° del sistema B3+ / B2+ es 1.07V y E° del sistema Fe3+ / Fe2+ es 0.77V. ¿Espera que la titulación sea factible? Calcule los miligramos de Fe2+ que permanecen sin oxidarse cuando se titulan 5 mmol de Fe2+ con B3+ 0.10M. El volumen que se utilizó de B3+ fue de 100 mL 6. Se tienen los siguientes pares redox: B2+/Ba° = -2.92V, Al3+/Al° = -1.68V, Ga3+/Ga2+ = -0.65V, Ga2+/Ga° = -0.45V, I2/I- = 0.62V, IO3-/I2 = 1.19V, Fe3+/Fe2+ = 0.77V, Ce4+/Ce3+ = 1.7V. ¿Qué especie o especies es un anfolito estable? ¿Qué especie o especies es un anfolito inestable? Para cada especie de anfolito estable escribe las 2 semireacciones, la reacción global y calcula la constante de equilibrio. Para cada especie de anfolito inestable escribe las dos semirreacciones, la reacción global y calcula la E° de dismutación así como la K de dismutación. 7. El potencial estándar de reducción de un par oxidante/Reductor respecto al electrodo de calomel saturado (ECS, EECS = 0.244 vs ENH), es -0.15 V. ¿Cuál es el potencial estándar de reducción de UNAM-Facultad de Química Prof. Mario Alfredo García Carrillo 1402 Química Analítica I Semestre 2016-I dicho par referido al electrodo normal de hidrogeno (ENH)? Desarrolla el planteamiento para justificar la respuesta. 8. Considerando los siguientes valores de potenciales normales: Ti4+/Ti3+ = 0.10V, Ti3+/Ti2+ = 0.37V y Fe3+/Fe2+ = 0.77V. A una disolución que contiene 0.1 mmol de Ti2+ se le agrega una sal de Fe3+ ¿Qué cantidad de milimoles de Fe3+ deberán agregarse para que la disolución alcance un potencial de 0.77V? 9. Se realiza una titulación redox de SnII con CeIV de acuerdo a la siguiente ecuación química no balanceada: SnII (ac) + CeIV (ac) CeIII (ac) + SnIV (ac); E°(CeIV/CeIII) 1.70 V; E°(SnIV/SnII) 0.154 V. ¿Cuál es el potencial redox en el punto de equivalencia? 10. Se tiene en un matraz 250 mL de Hg2+ 0.001 M y se le agregan 0.28 g de Na2S2O3. Escribe y balancea las reacciones que se llevan a cabo. Calcula la constante de equilibrio, asi como las concentraciones al equilibrio. Datos, pesos atómicos: Na: 23; S: 32; O: 16. E°(Hg2+/Hg22+) = 0.92 V, E°(S4O62-/S2O32-) = 0.08 V. 11. Se hacen reaccionar cantidades estequiométricas de un reductor Q2- con Au3+. El potencial de equilibrio medido en la disolución con respecto al ENH es de 0.48V. Si E0 Au(III)/Au(0) = 1.50V, ¿cuál es el potencial normal del par Q0/Q2-? 12. Supongamos que se desea mantener totalmente pura una disolución que contiene I2 y, en particular, libre de iones IO3 , formados generalmente por oxidación atmosférica. ¿Qué especie de los pares que se dan a continuación, agregaría para mantener totalmente pura la disolución de I2? Nota: toma en cuenta los datos de potenciales estándar que se dan a continuación. Eº(IO3-/I2) = 1.19V, Eº(I2/I-) = 0.62V, Eº(Ce4+/Ce3+) = 1.70V, Eº(Zn2+/Zn) = -0.76. 13. Se conocen los siguientes pares redox: M4+ (ac) + 3e- M+ (ac) (E°1) y N4+ (ac) + 2e- N2+ (ac) (E°2); calcule el E° mínimo indispensable para que la reacción descrita por la siguiente ecuación química (no balanceada alcance una cuantitatividad del 99 % si ambos reactivos se mezclan en cantidades estequiométricas. N2+ (ac) + M4+ (ac) N4+ (ac) + M+ (ac) 14. Se conocen los potenciales estándar de reducción de los siguientes pares redox: E° (V) (vs ENH) Par óxido-reductor 1.45 ClO3-/Cl0.802 AuBr4-/AuBr20.520 CuI/Cuo 0.159 CuII/CuI *Ignore cualquier equilibrio de solubilidad, complejación o hidrólisis sobre las especies de interés y tanto la concentración [H+] como de cualquier otro ión espectador o del medio se considerará 1 M. Se tiene una disolución donde están las concentraciones iniciales marcadas en un recuadro: Cu2+ CuI 0.001 M 0.001 M AuBr4- ClO3- 3+ 0.159 CuI 0.01 M 0.520 7 Cu° E° (V) (vs ENH) 0.802 1.45 AuBr2- Cl- UNAM-Facultad de Química Prof. Mario Alfredo García Carrillo 1402 Química Analítica I Semestre 2016-I a) Exprese las ecuaciones de Nernst para cada par redox sobre la escala. b) Calcule la concentración de TODAS las especies químicas una vez que se alcanza el equilibrio. c) Calcule el potencial al equilibrio. Nota: considere desde el inicio un litro de disolución total.