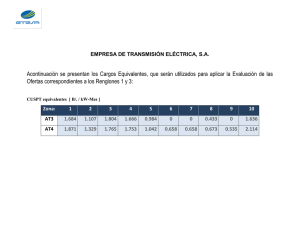
leyes electroquímicas de faraday y la determinación de pesos
Anuncio

1 LEYES ELECTROQUÍMICAS DE FARADAY Y LA DETERMINACIÓN DE PESOS EQUIVALENTES1 ROSEMARY GENE EHL and AARON J. IHDE Universidad de Wisconsin, Madison, Wisconsin Traducción: Luis F. Farrera G. Jöns Jakob Berzelius Tan pronto como la teoría atómica fue anunciada por Dalton, se hizo aparente, para aquellos que aceptaban los átomos como partículas fundamentales de la materia, que la determinación de los pesos atómicos relativos, era una actividad de primordial importancia. El bien intencionado pero desafortunadamente impreciso análisis hecho por Dalton, produjo la primera tabla de pesos atómicos relativos. Hubo otros que hicieron análisis, pero fue Berzelius quien soportó la pesada carga de hacer las determinaciones sistemáticas de los pesos atómicos de los elementos conocidos. Sin embargo, antes de que los pesos atómicos pudieran ser asignados, era esencial que se determinaran, con tanta precisión como fuera posible, los pesos de combinación o equivalentes, y es aquí donde el gran genio de Berzelius queda especialmente ilustrado. El dedicó diez años de su vida a la determinación de hasta 2000 pesos de combinación de los elementos. Con balances relativamente burdos, sustancias químicas impuras y muy poco equipo a su disposición, Berzelius trabajó en esta gigantesca tarea, bajo condiciones en las que, la mayoría de los químicos actuales describirían como insoportables. Aún así, sus resultados fueron excelentes y sus pesos equivalentes no se encuentran tan alejados de los valores modernos. Durante toda su vida, un único, simple y preciso método de determinación de pesos equivalentes llego a estar disponible para Berzelius. En enero de 1834, Michael Fáraday anunció el descubrimiento de las leyes electroquímicas. Subsecuentes investigaciones lo condujeron a la investigación de los equivalentes electroquímicos de algunos elementos y finalmente a la conclusión de que los equivalentes electroquímicos eran idénticos a los equivalentes químicos ordinarios. Aquí había un método no específico de procedimientos puramente químicos de interminables y tediosas precipitaciones, filtraciones y pesadas, usado por Berzelius. Pero había también un método apoyado por lo que probó ser una de las leyes más precisas conocidas por la ciencia. Es extraño que Berzelius no hiciera uso de este enfoque, si no para reemplazar sus métodos químicos, al menos para disponer de una forma de comprobarlos. El no estaba poco familiarizado con las manipulaciones electroquímicas, porque era un experto en el campo, habiendo comenzado su brillante carrera científica con investigaciones sobre los efectos de la pila voltaica, poco después de su desarrollo en 1800. Hasta ahora, solo hay una muy leve evidencia de que Berzelius alguna vez determinara equivalentes químicos por el uso del método delineado por Fáraday, y aún esta evidencia es cuestionable (ver pié de pagina 26). Por otra parte, existe considerable evidencia de que Berzelius eligió despreciar este descubrimiento del más grande científico de Inglaterra. Aunque la “ley de la acción electroquímica definida”, como la llamó él, no fue formalmente publicada por Fáraday hasta enero de 1834, la noción de que los efectos químicos en la electrólisis son dependientes de la cantidad de electricidad pasada, parece habérsele ocurrido a él mucho antes. En su tercera serie de investigaciones publicadas en enero de 1833, Fáraday comentó2: Cuando la descomposición electroquímica tiene lugar, hay grandes razones para creer que la cantidad de materia descompuesta no es proporcional a la intensidad, sino a la cantidad de electricidad pasada. 1 Presentado ante División de la Historia de la química en el 124avo Congreso de la Sociedad Química Americana, Chicago, Septiembre, 1953. JOURNAL OF CHEMICAL EDUCATION 2 Trans. Roy. Soc. London, 123, 39(1833). A Fáraday le tomó gran trabajo distinguir entre cantidad e intensidad de corriente eléctrica. Usó los términos cuidadosa y correctamente y estuvo al parecer consiente al distinguir las características y efectos de cada uno. Este es un tema de no poca importancia, porque fue precisamente la confusión en este punto lo que contribuyó a que Berzelius se equivocara. Las siete series de investigaciones publicadas en enero de 1834, fueron dedicadas al trabajo sobre electroquímica, y representó el reporte final del artículo enviado meses antes. Fáraday encontró la nomenclatura electroquímica prevaleciente innecesariamente confusa y propuso el empleo del término “electrodo” en lugar de “polo”. El sugirió el uso de los términos ánodo, cátodo, electrolito, electrolizar, ion, catión y anión3. Fáraday, primero hizo pruebas de la ley electrolítica definida en agua, bajo una variedad de condiciones 4. Cuando investigaba el efecto de la variación del tamaño de los electrodos, la intensidad de corriente y la concentración de la solución del ácido sulfúrico usada, halló que ninguno de estos tres factores afectó la magnitud de acción química, si la cantidad de electricidad permanecía constante. También encontró que la ley de la acción electroquímica definida, era válida para otras soluciones acuosas, aparte de las del ácido sulfúrico. Por lo tanto, Fáraday estableció sus conclusiones finales5: “…que cuando era sometida a la influencia de la corriente eléctrica, una cantidad de ella (agua) era descompuesta, exactamente en proporción a la cantidad de electricidad que había pasado…” Estos primeros experimentos, fueron todos realizados como pasos preliminares para justificar el uso de un instrumento de medición de corriente, que Fáraday había inventado y llamado “voltaelectrómetro”. El nombre fue cambiado a “voltámetro” en 1838 y después a culombímetro en 1902. El instrumento de Fáraday estaba compuesto de dos tubos de vidrio graduados provistos con electrodos y que contenían agua acidulada. Se recolectaba hidrógeno y oxígeno mezclado o hidrógeno solo, dando la cantidad de gas recolectado una medida de la corriente que había pasado. Fáraday planeó usar este aparato con amplia frecuencia en su trabajo futuro en electroquímica. Al considerar la ley de la acción electroquímica definida, totalmente demostrada para la electrólisis del agua, Fáraday procedió a aplicarla para otras substancias. Electrolizó el protocloruro de estaño (SnCl2) fundido y por medio del volumen de gas en el volta-electrómetro, determinó el peso equivalente. El promedio de cuatro experimentos dio como valor para el equivalente 58.53, comparado con 57.9 que fue registrado para el equivalente químico. Fáraday no podía sino concluir que6: “…los números dejaban poca duda sobre la aplicabilidad de la ley de la acción definida en este y otros casos similares de electro-descomposición…” “No es frecuente que yo haya obtenido una concordancia numérica tan precisa como la que he justamente registrado.” Fáraday electrolizó muchas otras substancias, entre ellas el cloruro de plomo, para el que, de nuevo, obtuvo resultados aproximadamente iguales al equivalente químico. Para establecer ampliamente la validez de la ley electroquímica, Fáraday recurrió al uso de electrodos de diferentes substancias, así también como al uso de arreglos en los que el metal bajo investigación era empleado como electrodo positivo, de manera que habría una transferencia directa del metal de un electrodo al otro. De estos últimos experimentos felizmente Fáraday encontró que el electrodo positivo perdía tanto peso como el electrodo negativo lo ganaba y todo en proporción equivalente al agua descompuesta en el voltámetro 7. Todos estos hechos se combinan, yo pienso, en una gran cantidad de evidencia, que comprueba la veracidad de la importante proposición, que yo en un principio establecí, concretamente, que el poder químico de una corriente de electricidad está en proporción directa a la cantidad absoluta de electricidad que pasa. Ello demuestra, también, que no solo es cierto para una substancia como el agua, sino en general para todas las substancias electrolíticas... Michael Fáraday 3 Ibid., 124, 77–9 (1834). Ibid., pp. 87–91. 5 Ibid., p. 91. 4 MAY, 1954 6 7 Ibid., p. 104. Ibid., p. 110. 3 Que Fáraday consideró los equivalentes electroquímicos y los equivalentes químicos, como idénticos, es puesto en evidencia por los siguientes comentarios en su artículo 8: Después de las primeras investigaciones para establecer la acción química definida de electricidad, no vacilé en aplicar los resultados más estrictos del análisis químico para corregir los números obtenidos como resultados electrolíticos… Los números equivalentes no pretenden ser exactos y son tomados casi enteramente de los resultados químicos de otros científicos en quienes podría depositar más confianza, respecto a estos puntos, que en mí mismo. Oxígeno Cloruro Ioduro Bromuro Fluoruro Cianógeno Ac. Sulfúrico 8 35.5 126 78.3 18.7 26 40 Hidrógeno Potasio Sodio Litio Bario Estroncio Calcio Magnésio Manganeso Zinc Estaño Plomo Fierro Cobre 1 39.2 23.3 10 68.7 43.8 20.5 12.7 27.7 32.5 57.9 103.5 28 31.6 847. Tabla de iones. Aniones A. Selénico 64 A. Nítrico 54 A. Clórico 75.5 A. Fosfórico 35.7 A. Carbónico 22 A. Bórico 24 A. Acético 51 Cadmio Cerio Cobalto Níquel Antimonio Bismuto Mercurio Plata Platino Oro ——— Amonio Potasa Cationes 55.8 46 29.5 29.5 64.6? 71 200 108 98.6? (?) 17 47.2 A. Tartárico A. Cítrico A. Oxálico Azufre (?) Selenio (?) Sulfocianógeno Soda Litio Barita Estroncia Abono Magnesio Alumina Protoxidos Quinina Alkaloide Morfina Alkali vegetal 66 58 36 16 31.3 18 76.7 51.8 28 20.7 (?) 171.6 160 290 En este momento, Faraday insertó una “Tabla de iones” que podría ser, más propiamente considerada, una tabla de equivalentes. Es de interés hacer notar el método por el cual Fáraday arribó a esta tabla. Lo que aparentemente el hizo, fue determinar los equivalentes electroquímicos para un número de substancias por métodos electrolíticos. Estos resultados fueron después usados para dar una idea de la magnitud del valor, y después tomando los equivalentes químicos de otras fuentes (probablemente Berzelius), fueron comparados para corregir este valor. Los valores para el estaño y el plomo, por ejemplo, no son los que Fáraday había hallado por experimento, sino que son los equivalentes químicos a los cuales sus resultados electroquímicos, se habían aproximado estrechamente. La tabla misma da la impresión, más propiamente, de haber sido llenada en forma apresurada, con la idea, como Fáraday indicó, de mostrar el procedimiento, en vez de proporcionar información precisa. Fáraday fue cuidadoso al señalar que9: Un uso muy valioso de los equivalentes electroquímicos será decidir, en caso de duda, cual es el verdadero peso equivalente, proporción definida o número atómico de un cuerpo….no tengo duda de que, asumiendo el hidrógeno como 1, y eliminando la fracción para simplificar la expresión, el número equivalente o peso atómico10 del oxígeno es 8, del cloro 36, del bromo 78.4, del plomo 103.5, del estaño 59, etc., no obstante que alguna muy alta autoridad duplica algunos de estos números. Aún cuando no menciona nombres, la alta autoridad, sin duda, se refiere a Berzelius. Berzelius consideró que el verdadero peso equivalente del hidrógeno era el de un átomo doble, H2, y consideró este equivalente para K, Zn, etc. Por ello, estuvo inclinado a escribir KO, AgO, KCl2, NaSO4, etc., y los pesos atómicos del potasio, sodio, litio y plata fueron duplicados. Fáraday demostró como los equivalentes electroquímicos podían ser usados para decidir cuestiones de este tipo, por lo que la tabla que el ofreció es esencialmente correcta para estimar equivalentes. La posición de Fáraday es clara. El descubrió las leyes de la electroquímica y sugirió métodos para su uso, pero esto fue hasta donde el se interesó, para encarar el problema. El avance de su trabajo sobre equivalentes, lo conduciría hacia el campo de las determinaciones de pesos atómicos y Fáraday, todavía no se había convencido de la existencia de los átomos. Fáraday, el genio experimental, como muchos otros grandes experimentadores, no estaba muy entusiasmado, de ninguna forma, con las teorías o la especulación. Por el contrario, el eligió confiar en los hechos concretos que podía recolectar como resultado de sus investigaciones en su laboratorio. A este respecto, fue como su maestro Davy, de quien él, quizá, adquirió mucho de su aversión por la especulación teórica. En el mismísimo artículo en el que anunció las leyes electroquímicas, mostró su repudio por la teoría atómica, haciendo la siguiente afirmación 11: …pero debo confesar que estoy receloso del término átomo; porque, aunque es muy fácil hablar de átomos, es muy difícil formarse una idea clara de su naturaleza, especialmente cuando están bajo consideración los cuerpos compuestos. La reluctancia a llevar los estudios de los equivalentes, además de los de los que él ya había realizado, fue sin duda un resultado, al menos en parte, de esta aversión a la teoría corpuscular de la materia. Hubo otra gente, en ese tiempo, que apoyaron la validez de las leyes electroquímicas. En una carta a Fáraday, John Frederic Daniell, inventor de la celda 10 8 Ibid., p. 114. 9 Ibid., pp. 115–16. JOURNAL OF CHEMICAL EDUCATION Nótese el mal uso, por Fáraday, del término “peso atómico”. 11 Trans. Roy. Soc. London, 124, 121 (1834). constante Daniell y obviamente gran admirador de Fáraday, había hecho notar12: Un resultado, que sé le agradará; a saber, que entre las casi innumerables pruebas a las que he sometido su gran descubrimiento de la acción química definida de la electricidad, no he hallado ningún resultado que esté en contra de ello… En Italia las leyes de la electroquímica, aparentemente, pasaron por un descubrimiento independiente, poco después de que Fáraday las había publicado. El descubridor fue Carlo Matteucci, un hombre de quien poco se ha escrito en lengua inglesa y quien, al parecer, es casi desconocido por los historiadores de la ciencia, sin embargo, en 1848 recibió la medalla Copley y es considerado el creador de la moderna electrofisiología. iniciado en Forlì sobre la acción de la corriente eléctrica en la combinación química. La corta biografía en la Enciclopedia Italiana” hace esta afirmación: Como resultado, fue capaz de demostrar la ley de la proporcionalidad entre la cantidad de electrolito depositado y la cantidad de electricidad pasada a través del voltámetro, y esto lo hizo independientemente de los bien conocidos experimentos de Fáraday. Además pudo sacar conclusiones de tal importancia que, Fáraday mismo dijo que ellas habían dado al joven científico italiano ―en ese tiempo, en sus tempranos veintes― una fama de europeo. El artículo de Matteucci que contiene el trabajo sobre la ley de la acción electroquímica definida reproduce la fecha de octubre, de 1834, y está publicada en la Annales francesa, en enero de 183515. Matteucci midió la cantidad de corriente usando un culombímetro de plata. Con este instrumento en el circuito, condujo experimentos en los cuales el zinc era disuelto con ácido. A pesar de las condiciones en las que el variaba las concentraciones del ácido, la temperatura y el área superficial del zinc, el siempre obtenía la misma corriente para el mismo peso de metal. A través de otros experimentos, Matteucci llegó a dos conclusiones adicionales16: Haciendo pasar una corriente eléctrica, desarrollada por una cierta acción química, a través de diferentes soluciones metálicas, las cantidades de metales reducidos y separados en estas diferentes soluciones, son variables y cualesquiera que puedan ser sus densidades relativas, siempre están en la misma relación de los equivalentes químicos, de estos mismos metales. Carlo Matteucci Matteucci, químico, psicólogo y físico nació en Forlì en 1811 y murió en Ardenza, cerca de Leghorn, en 1868. Recibió el grado de Doctor en la Universidad de Bologna en 1828, y después continuó sus estudios en París, donde tuvo la oportunidad de conocer a grandes hombres que se habían asociado con Arago. Aunque el estuvo principalmente interesado en la electrofisiología, condujo investigaciones en muchos otros campos de la ciencia13,14. Fue después de su retorno de París en 1831 que continuó, en Florencia, las investigaciones que había Hay finalmente el tercero y último resultado al cual he arribado, y puede bien ser reconocido como la necesaria consecuencia de las otras dos: disponiendo diferentes metales en forma de una pila, de manera que sus cantidades descompuestas estén en la misma relación de sus pesos equivalentes, uno obtiene una a acción electroquímica uniforme. Matteucci parece haber arribado a las mismas conclusiones que Fáraday. La cuestión de si fue o no independiente es interesante. La “Enciclopedia Italiana” dice que lo fue, pero podría esperarse que esta fuente favoreciera la posición de Matteucci. En la Annales de 183917, Matteucci publicó otro articulo en el que comentó su previo descubrimiento. En este comentario reclamó el descubrimiento independiente de las leyes electroquímicas, pero concedió a Fáraday el crédito por el descubrimiento original y por el establecimiento de la ley de la acción electroquímica definida. Esta noción, aparentemente, no prevaleció entre ciertos otros científicos europeos. 12 Ibid., 126,107 (1836). “Enciclopedia Italiana”, Rome, 1934, p. 596. 14 Bianchi, N., “Carlo Matteucci e l’Italia del suo tempo”, Turino, 1874. El retrato fue tomado de este trabajo. 13 MAY, 1954 15 Ann. Chim. Et phys., 58, 75 (1835). Ibid., pp. 78-80. 17 Ibid., 71, 90 (1839). 16 5 En el Philosophical Magazine, Poggendorff ratificó la prioridad de Fáraday en el descubrimiento de la ley de la acción electrolítica definida18. Poggendorff sentía que Fáraday había sido enormemente agraviado. El admitió que debido a que las noticias viajaban lentamente hacia la Italia de Matteucci, podría no haber conocido el descubrimiento de Fáraday. Sin embargo, Poggendorff creía que Gay-Lussac y Arago, editores de la Annales seguramente estaban conscientes del experimento de Fáraday y consecuentemente, no debían haber publicado el artículo de Matteucci en la forma en que apareció. Aun cuando es posible que Matteucci fuera consciente del trabajo de Fáraday, cuando el hacia lo propio, debemos darle crédito por cierta originalidad, en alguna medida. En primer lugar, el usó un culombímetro de plata para medir la cantidad de corriente, un instrumento del cual, Fáraday no hizo mención. Segundo, el había arribado a la ley por experimentos muy diferentes de los de Fáraday. Fáraday había usado corriente de un pila para efectuar el depósito de ciertas substancias que el podía pesar. Matteucci midió la cantidad de corriente que, una cantidad conocida de metal suministraba, conforme sufría la acción química. Estos dos hechos refuerzan la posición de Matteucci del descubrimiento independiente de las leyes electroquímicas. No obstante que la ley de la acción electroquímica definida fue aceptada por muchos científicos como un hecho bien establecido, hubo uno que puso en duda su validez. Este fue Berzelius, que tuvo primero conocimiento del descubrimiento del experimento de Fáraday de la Annalen de Poggendorff19, en la cual las siete series de investigaciones fueron reimpresas en traducción completa. Los comentarios de Berzelius sobre la ley de la acción electroquímica definida hicieron su aparición en el volumen de 1836 20 de su Jahres-Beritcht. Estos comentarios comienzan con un breve resumen de las conclusiones que Fáraday había extraído de sus experimentos. Berzelius registra su primera queja contra la conclusión de que la concentración del ácido sulfúrico no tenía efecto sobre la cantidad de hidrógeno y oxígeno liberados, durante la electrólisis del agua, si la cantidad de corriente permanecía igual: Esto es cierto, sin embargo, a mi me parece que pudo haberse cometido un error de observación. Con el paso de la corriente eléctrica a través del líquido ácido, el 18 Phil. Mag., [3] 7, 421-2 (1835). Ann. Phys. Chem., 33, 301, 433, 481 (1834). 20 Jahres-Bericht, 15, 30-9 (1836) La retraso de dos del material publicado en la Jahres-Bericht, no era inusual, ya que Berzelius estaba fuera del centro principal de la actividad científica en Europa. Las citas de Berzelius que siguen, son todas traducciones de esta referencia. La traducción es de los autores. 19 JOURNAL OF CHEMICAL EDUCATION ácido se reúne en cantidad excesiva en el polo positivo y agua en el polo negativo, y la cantidad debe variar con cantidades diferentes de ácido. Pero si una fija cantidad de electricidad es usada para la división con agua y ácido concentrado, entonces, parece que deben tener lugar variaciones en la cantidad de agua que es descompuesta en sus constituyentes. Aún si la suma de ambas descomposiciones es la misma cada vez, seguramente, ambos tipos pueden variar entre ellos en cantidades relativas. Considerando la reputación de Fáraday como experimentador, la sugerencia de que había cometido un error de observación era un paso audaz. ¡Berzelius, sin embargo, no era alguien que se intimidara! La falacia en el argumento de Berzelius resulta de su incapacidad para ver que la cantidad de electricidad está relacionada sólo a aquellas substancias realmente separadas en los electrodos aunque sea cierto que el ácido se acumula alrededor del ánodo. Las irregularidades que Fáraday encontró, el las atribuyó a efectos de los gases y no a una falla de la ley de la acción electrolítica definida. Berzelius continuó sus comentarios y objeciones: El declara más adelante, que ha encontrado que el mismo número de pares en la pila más débil o fuertemente cargada (que se debe entender por esto, no es indicado por cierto. Sería enteramente equivocado sin embargo, si ello significara “construido con fluidos con fuerzas electromotrices desiguales”), da la misma cantidad de gas hidrógeno y también muestra la misma relación cuando, en una ocasión la pila consistía de 5 pares y en otra consistía de 10 pares, considerando que se habían usado placas del mismo tamaño. Aquí vemos que Berzelius ha confundido desafortunadamente los conceptos de cantidad de corriente e intensidad de corriente. El no puede ver que “débil o fuertemente cargada” y el número de pares en la pila, se refiere a las variaciones en la intensidad de corriente que no afecta necesariamente la cantidad de corriente, de la cual los efectos químicos son dependientes. Berzelius continúa con un comentario sobre las conclusiones de Fáraday sobre la descomposición del agua y el uso del electrómetro como una medida de la corriente. Luego los comentarios sobre los equivalentes químicos: De esta forma Fáraday llega al tercero y principal resultado para sus experiementos, es decir “que aquello que la misma cantidad de electricidad descompone son los equivalentes químicos”. Las pruebas para este principio, no son suficientes para estar seguros. Sin embargo, seguramente parecen demostrar este comportamiento para los casos mencionados. El encuentra que para el caso del ácido clorhídrico y el ácido yodhídrico, disueltos en agua, cada uno dio la misma cantidad de gas hidrógeno en el polo negativo, que la que había obtenido en la cantidad medida, con ácido sulfúrico diluido…. Cuando cloruro de plata y, especialmente de plomo en condición fundida, eran descompuestos entre alambres de platino, de los cuales el negativo fue pesado, se hizo aparente después que, el peso del metal reducido adherido al alambre negativo, correspondía al volumen de gas hidrógeno recolectado en la cantidad medida, de manera tal que, ambos eran equivalentes químicos…. En la evaluación de estos experimentos tal parece como si, el teorema que establece que la misma cantidad de electricidad siempre da la misma cantidad de descomposición, no ha sido probado tan completamente como uno desearía. El hecho es tal vez correcto. Esto no debería evitar que nos inclinemos por el criticismo de la prueba. El escepticismo de Berzelius es muy evidente en este punto, pero el tiene algunas otras objeciones más importantes: En los resultados de estos experimentos, no he hallado nada que fuera suficientemente decisivo para probar que, si el agua y el cloruro de plomo21 fundido son descompuestos uno después del otro, por la misma cantidad de corriente, las cantidades del plomo reducido y el hidrógeno son equivalentes. Pero también aquí, la presencia del ácido sulfúrico22 en el agua causa una incertidumbre, como mencioné antes. Debe causar una variación que es, tal vez, demasiado pequeña para que aparezca, cuando el experimento debe ser realizado a tal escala pequeña. Aún hay otra cuestión que puede preguntarse aquí: ¿es la misma cantidad de electricidad necesaria para separar un átomo de plata y un átomo de oxígeno, uno del otro, como para separar un átomo de potasio de un átomo de oxígeno23, esto es, para neutralizar fuerzas de tan inmensa diferencia en magnitud? ¿Puede la intensidad de corriente ser suficiente, como se ha asumido, para vencer una gran fuerza? ¿No sería concebible la condición de que afinidades de una misma magnitud sean igualmente balanceadas por la misma corriente y afinidades de un grado un poco diferente, con una diferencia tan pequeña en sus magnitudes que, en un experimento a pequeña escala, cayera en errores de observación? Es sabido que el plomo separa al cloro del hidrógeno sólo con dificultad y en ebullición, y que por ello estas afinidades son muy estrechas. Uno puede ver por esto, que estas investigaciones pueden ser tomadas a partir de un punto de vista muy amplio, antes de que los resultados que Fáraday ha inferido de ellas, sean consideradas como válidas. Es evidente que Berzelius está confundiendo los papeles de la intensidad de corriente y la cantidad de 21 De todos los experimentos de Fáraday, parece estar más favorablemente impresionado con los resultados del ácido clorhídrico. 22 Esto es, el ácido usado para hacer que el agua en el voltaelectrómetro, conduzca. 23 Obsérvese las formulas Berzelianas AgO y KO. MAY, 1954 corriente, porque sugiere que tomaría más corriente separar los átomos en un compuesto estable que en uno menos estable. Sucede también, dice Berzelius, que el plomo y el hidrógeno poseen aproximadamente la misma tendencia o afinidad a combinarse para el cloro, ya que es difícil para el plomo reemplazar al hidrógeno en ácido clorhídrico. Por lo tanto, debería tomar casi la misma corriente separar cloro de plomo, como hidrógeno de oxígeno y esto entonces explicaría porque Fáraday obtiene resultados consistentes, con la precaución, por supuesto, de que hay una diferencia en la cantidad de corriente, pero también tan pequeña en este caso, que Fáraday la ha despreciado. Hay al menos un aspecto en el que, el trabajo de Fáraday puede ser genuinamente criticado. Fáraday tuvo la falsa impresión de que solo substancias compuestas de equivalentes simples de cada elemento, podían ser descompuestas por la corriente eléctrica. El fue conducido a esta hipótesis como resultado de probar varias substancias por conductividad y descomposición. Él halló, por ejemplo, que el SnCl2 era descompuesto pero el SnCl4 no lo era. Si se sabía que substancias, que no consistían de equivalentes simples, eran descompuestas, Fáraday pensó que esto era el resultado de alguna acción secundaria en los electrodos y no la descomposición principal causada por la corriente eléctrica. El sulfato de amonio era una de estas substancias. Cuando Fáraday intentó descomponer Sb2O3 y SbCl3, halló que se lograba la descomposición, aunque el supo que esta substancia no consistía de equivalentes simples. El estuvo tan convencido de lo correcto de su teoría del equivalente simple, sin embargo, que propuso la existencia de un óxido y un cloruro de antimonio que contenían la proporción 1:1, que hasta la fecha no son conocidos. Se asumió que estos supuestos compuestos estaban presentes entre los compuestos de antimonio y que eran responsables del poder conductor de los mismos. Por algunos experimentos que el mismo describió como poco cuidadosos, pensó que había descubierto los compuestos reales SbCl y SbO. Sus experimentos fuero apresuradamente hechos y eran, desde un punto de vista analítico, muy incompletos. Berzelius objetó estos nuevos compuestos descritos por Fáraday y repitió sus experimentos más cuidadosamente. Descubrió que Fáraday estaba completamente equivocado en lo que concierne a la existencia de los nuevos compuestos. Fáraday después aceptó su error en relación a los compuestos de antimonio, pero no ofreció retractarse de su teoría de los equivalentes simples o de las leyes de la electroquímica, las cuales creía que eran correctas. Berzelius concluyó sus comentarios con un juicio, en cierto grado violento, sobre la nueva nomenclatura electroquímica de Fáraday: Fáraday cree, por razones que no considero válidas, que sus experimentos nos llevan a un cambio de visión tal, en la teoría de la ciencia, que nuestra nomenclatura 7 científica es inadecuada para la expresión correcta de las ideas, a las cuales sus resultados conducen; por ello ha introducido otras, que no considero, de ningún modo, sean necesarias en algún sentido, o valga la pena seguirlas…. Es obvio para cualquiera que la nueva nomenclatura establecida sobre la idea de una sola electricidad, nunca ha sido más superflua que en el momento en el que la teoría electroquímica24, la cual sin las fuerzas eléctricas opuestas no tendrían sentido, esté en camino de obtener ese fuerte apoyo, que de las relaciones eléctricas cuantitativas Fáraday pidió establecer. Uno debe concluir que Berzelius comentó que no estaba convencido de la corrección de la ley de la acción electroquímica definida. El está inclinado a aceptar los resultados de Fáraday, en la medida en que el trabajo de Fáraday apoye su propia teoría electroquímica. Es bastante obvio, no obstante, que no aprueba toda la nomenclatura introducida por Fáraday. rechazada junto con la hipótesis de Avogadro al rededor de 1811. “Átomo” o “átomo de compuesto” eran con frecuencia usados donde debía significar molécula. Algunos usaban equivalente y peso atómico como sinónimos. Aún el mismo Fáraday había hecho esto. Berzelius había sido uno de los pocos que tenía un concepto claro de la diferencia entre un peso equivalente y un peso atómico. El problema sobre los equivalentes surgió, sin embargo, no tanto de ideas incorrectas, como de la multiplicidad de puntos de vista y la falta de un estándar aceptado en forma general. Los equivalentes electrolíticos pudieron haber sido usados más efectivamente con un estándar, pero la idea no fue llevada a cabo consistentemente. Lothar Meyer, en su “”Outlines of Theoretical Chemistry”25 menciona que hay dos principales dificultades en la determinación de pesos equivalentes (no atómicos), por el uso de las leyes de Fáraday. Uno de estos era el hecho de que, algunos metales, como el cobre, despliegan diferentes valores para sus equivalentes, dependiendo de la naturaleza del compuesto investigado. El problema de cuál equivalente elegir como verdadero, era lo que inquietaba a casi todos los químicos de ese período. Algunos elementos tenían solo dos equivalentes, pero había otros, el manganeso por ejemplo, que tenían seis equivalentes. A menudo se usaba el equivalente más pequeño de ellos, como verdadero. Fáraday había pasado por este problema también. El creía que podía haber solo un equivalente electrolítico para un elemento. La segunda dificultad en el uso de los equivalentes electrolíticos era el hecho de que los compuestos de muchos elementos no podían conducir la electricidad y la determinación de los equivalentes por electrólisis no podían ser llevada a cabo sistemáticamente. Uno podría suponer, después de estudiar la actitud de Berzelius hacia las leyes electroquímicas de Fáraday, que no tenía nada que hacer con ellas, más que tomar en cuenta la determinación de los equivalentes. Hay una ligera evidencia de que el usó los equivalentes electrolíticos. Esto aparece en la forma de una oración en el libro de Meyer 26: Una balanza de Berzelius Hay que decir algo en lo concerniente al significado de las frases “peso equivalente” y “peso atómico”. Entre los químicos de este período, la definición de estos términos era una materia de preferencia personal y nadie estaba de acuerdo en el significado de “equivalente”, “átomo” o “peso atómico”. La palabra molécula era literalmente desconocida, habiendo sido 24 Esto se refiere a la propia teoría electroquímica o dualística de Berzelius que explicaba la combinación química y la electro-descomposición, sobre la base de dos fuerzas opuestamente cargadas. JOURNAL OF CHEMICAL EDUCATION Después del descubrimiento de la ley del isomorfismo, Berzelius consideró los pesos equivalentes cristalográficos como idénticos con los pesos atómicos, excepto en los casos del K, Na, Li, Ag a los cuales determinó los pesos atómicos por el uso de sus equivalentes electrolíticos. 25 Meyer, L., “Outlines of Theoretical Chemistry”, Longmans, Green and Co., London, 1892, pp. 16-17 (1est German edition, 1890). 26 Ibid., p. 20. Esta evidencia nunca ha sido comprobada en ninguna otra forma. Una fuente muy confiable, “Determinaciones de pesos atómicos” 27 de Becker, es un compendio de las investigaciones de pesos atómicos publicadas entre los años 1814-80. Este trabajo no hacen mención de ninguna determinación de peso atómico en la que el haya hecho uso de equivalentes electrolíticos. Esta fuente menciona, como un hecho sin importancia, solo dos casos, en los que el procedimiento electrolítico fue usado, estos ocurrieron después de 1873. El punto más importante que surge en este tiempo, es el hecho de que las leyes electroquímicas de Fáraday fueron casi completamente rechazadas entre 1834 y 1880. Algunos las reconocieron como un gran descubrimiento pero la casi inmediata oposición por parte de Berzelius le dio un golpe certero a su completa aceptación. Berzelius, el “legislador de leyes de la química”, y una innegable autoridad en temas de química, había de dar su fallo, antes que pudiera decirse que un tema tan importante como este, era aceptado. Este fallo fue, incuestionablemente equivocado y puede decirse que era el factor simple más importante en el rechazo de las leyes de Fáraday. Berzelius, aparentemente, mantuvo esta oposición hasta el final de su vida28. En la quinta edición de su “Lehr buch der chemie”29 el menciona las leyes y parece más convencido de su incorrección 30: íntimamente conectada con esta falsa hipótesis. La confusión sobre el significado de “equivalente” y la existencia de varios equivalentes para un elemento, así también como el hecho de que no todas las substancia podían ser electrolizadas para dar sus equivalentes químicos, fue también importante. Con todos estos factores operando hacia la derrota de las leyes electroquímicas de Fáraday, no es sorprendente que tan tardíamente como 1900, Louis Kahlenberg32 y T. W. Richards y sus asociados33, condujeran estudios para determinar si las leyes de Fáraday eran o no universalmente aplicables y válidas, bajo condiciones tan simples como, por ejemplo, soluciones no acuosas y diferentes temperaturas. Es en absoluto demasiado pronto, en realidad solo conjetural, aceptar la admisión de estos resultados para una ley natural general, válida….ahí no se encuentra una comparación entre la cantidad de lo que es separado en diferentes substancias y la cantidad de corriente. Por lo que se refiere a la teoría de Fáraday de los equivalentes simples y la acción secundaria relacionada, Berzelius las clasificó como “…conclusiones que solo requiere una mínima aplicación de lógica para ser rechazadas”31. Además de las objeciones de Berzelius, hubo algunos otros factores que influyeron para el rechazo de las leyes electroquímicas. La propia desconfianza de Fáraday de la teoría atómica y su renuencia a dirigir su trabajo sobre los equivalentes, más allá de su “Tabla de iones” fueron, indudablemente factores que contribuyeron. Sus falsas interpretaciones de ciertas partes de su trabajo, especialmente en la teoría de los equivalentes simples, dañaron ciertamente su posición, ya que la ley de la acción química definida estaba 27 Becker, G. F., “The constants of Nature. IV: Atomic Weight Determinations”, Smithsonian Misc. Coll. 358 (1880). 28 Berzelius murió en 1848. 29 Berzelius, J., “Lehrbuch der Chemie”, 5th ed., Arnoldische Buchhandlung, Leipzig, 1856, pp. 99-101. (La pasta del libro muestra la fecha 1842). 30 Op. Cit.,pp.100-1. 31 Ibid. MAY, 1954 32 33 J. Phys. Chem., 349 (1900). Proc. Am. Arts Sci., 38 409-13 (1902).