Comparación HPLC - CG - Departamento de Química Orgánica
Anuncio
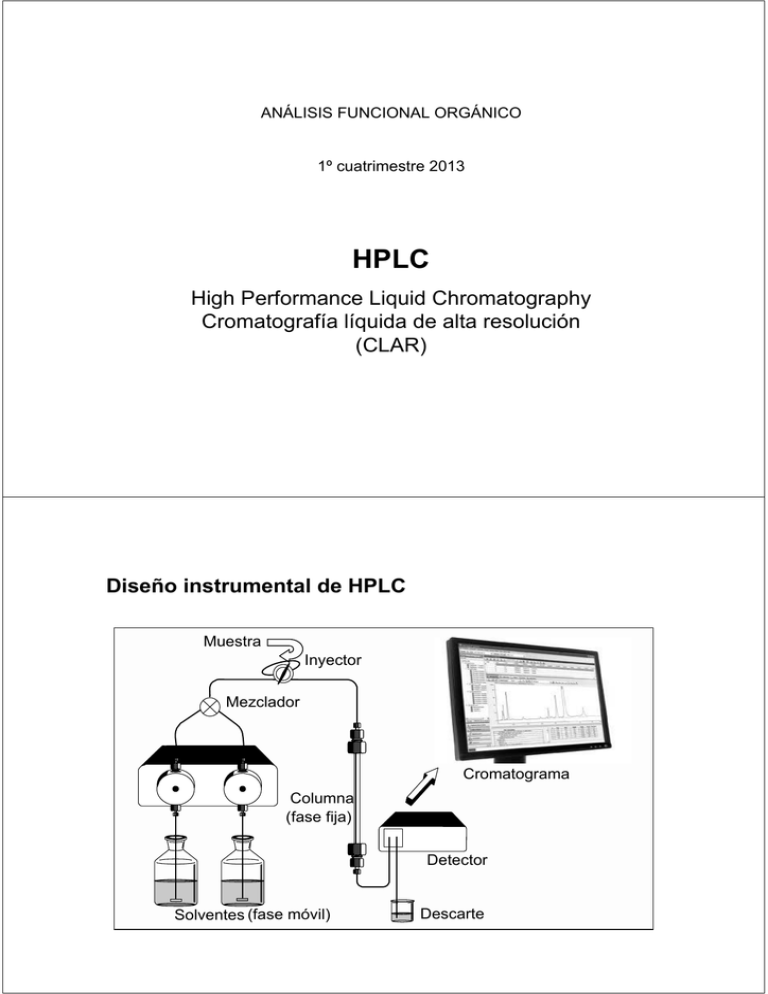
ANÁLISIS FUNCIONAL ORGÁNICO 1º cuatrimestre 2013 HPLC High Performance Liquid Chromatography Cromatografía líquida de alta resolución (CLAR) Diseño instrumental de HPLC Muestra Inyector Mezclador Bombas Cromatograma Columna (fase fija) Detector Solventes (fase móvil) Descarte Comparación HPLC - CG Propiedad HPLC CG Volatilidad de la muestra No es requisito Muestra soluble en fase móvil Es un requisito Polaridad de analitos Iónicos, polares, no polares Polares, no polares Estabilidad térmica Análisis a T amb o menor (Tmáx 60 ºC) Es un requisito (inyector, columna) Peso molecular No hay límite teórico superior (solubilidad) Típicamente hasta 500-600 (volatilidad) Comparación HPLC – CG (cont.) Propiedad HPLC CG Preparación de la muestra Filtrar Sv inyección = fase móvil (idealmente) Sv inyección volátil, eluye antes que los analitos (idealmente) Escala Analítica, preparativa Analítica Separación Fase móvil, fase estacionaria Gas carrier Fase estacionaria (temperatura) Detectores Más común UV-vis Muchos no destructivos HPLC-MS Más común FID GC-MS Conceptos teóricos básicos tR,B Eficiencia (Nº platos teóricos) tR,A N = 16 (tR/wt)2 = 5,54 (tR/w1/2)2 tR,C Parámetros de columna t0 Fase móvil (viscosidad) W1/2 Wt Velocidad de flujo de solvente Analitos Conceptos teóricos básicos Factor de retención (factor de capacidad) k = (tR-t0)/ t0 tR,B Tiempo en fase estacionaria vs tiempo en fase móvil tR,A tR,C t0 W1/2 Wt Conceptos teóricos básicos Selectividad o factor de separación α= k2/ k1 = (tR,B-t0)/ (tR,A-t0) tR,B α≥1 tR,A Composición de fase móvil Composición de fase estacionaria Temperatura tR,C t0 W1/2 Wt Conceptos teóricos básicos tR,B tR,A tR,C t0 W1/2 Wt Resolución Conceptos teóricos básicos Selectividad tiene el mayor impacto sobre resolución (fase estacionaria, fase móvil) Rs = 0,6 ⇒ valle entre picos Rs = 1⇒ permite cuantificar Rs = 1,6-1,7⇒ cuantificación confiable Conceptos teóricos básicos Cambio de presión Viscosidad Velocidad de flujo Longitud de columna Radio de la columna Diámetro de partícula Conceptos teóricos básicos Altura de plato (H) Ecuación de van Deemter Hmín uopt Velocidad lineal (u) A menor altura de plato, hay mayor número de platos y es mayor la resolución cromatográfica Conceptos teóricos básicos Retención con gradiente de solvente Tiempo de gradiente Velocidad de flujo Volumen muerto de columna Cambio de fracción en volumen del solvente B Desarrollo de un método para HPLC -Modos de HPLC -Elección de dimensiones de la columna y tamaño de partícula -Elección de fase estacionaria -Aplicación a fase reversa -Selección de fase estacionaria -Selección de fase móvil -pH -Optimización de condiciones -Desarrollo de condiciones para otros modos cromatográficos Variables: fase estacionaria y fase móvil Elección del modo cromatográfico -Fase reversa (RP, reverse phase) -Fase normal -HILIC (Hydrophilic Interaction Liquid Chromatography), [ANC (aqueous normal phase)] -Intercambio iónico (IEC) -Exclusión por tamaño (SEC) sistema acuoso Permeación por geles (GPC) sistema no acuoso Selección determinada por -tipo de analito y su solubilidad -peso molecular del analito -matriz de la muestra -disponibilidad de fase estacionaria y columna Fase reversa es aplicable a analitos iónicos, polares y no polares. Selección adecuada de condiciones. Varios modos posibles para un mismo tipo de analito Elección de dimensiones de la columna y tamaño de partícula Columna HPLC Dimensiones de columna Fase estacionaria Tipo de superficie Tamaño de poro Propiedades químicas Selectividad, factor de retención Tamaño de partícula Largo Propiedades físicas Eficiencia, velocidad de análisis Diámetro interno Algunas especificaciones de columnas para cromatografía líquida Tamaño de partícula -Tradicional 5 μm, tendencia actual 3 μm -UHPLC (Ultra high pressure liquid chromatography) Para mayor velocidad de análisis y/o mayor resolución → 1,8-2 μm, en combinación con columnas cortas (50 mm o menos). Partículas más pequeñas: mejoran resolución, eficiencia y tiempo de análisis; aumenta la presión de trabajo (600-1200 bar) Clasificación según tiempo de análisis: fast ≤ 10 min ultra fast ≤ 1min -Se desarrolaron recientemente partículas superficialmente porosas (SPP), tienen un core sólido (1,7 μm) recubierto con una capa porosa de sílica (0,5 μm de espesor). Separación superficial ⇒ disminuye difusión Ventaja: resolución similar a partículas de 1,8 μm a menor presión de trabajo (<400 bar) ⇒ se puede aumentar la velocidad de flujo, menor tiempo de análisis Algunas especificaciones de columnas para cromatografía líquida (cont) Dimensiones de columna -Tradicional para desarrollo analítico: 4,6 x 150 mm; 5 μm 4,6 x 100 mm; 5 μm 4,6 x 250 mm; 5 μm Tendencia actual: 4,6 x 100 mm; 3 μm (partícula común) 4,6 x 100 mm; 2,7 μm (partícula porosa) -Columnas de menor diámetro interno para mejorar sensibilidad o cuando la muestra es limitada Nano → muestra < 1 pg; velocidad de solvente: nl/min Capilar → muestra pg-ng; velocidad de solvente: 4 μl/min Microbore → muestra ng-μg; velocidad de solvente: 40 μl/min Dimensiones de columna Diámetros de columna según su aplicación -Análisis de alta capacidad de muestras (high throughput) → Longitud ↓, partícula < 2 μm - Muestra compleja con varios componentes → Longitud ↑, partícula pequeña (P ↑) -LC-MS → diámetro ↓ (≤ 2,1 mm), velocidad de flujo ↓ -Cromatografía preparativa → diámetro ↑ (10-50 mm), partículas grandes (5-10 μm), velocidad de flujo ↑ Fase estacionaria – Modo fase reversa Principio: Partición de analitos entre fase estacionaria no polar y fase móvil polar. Interacciones no polares y no específicas de los analitos con la fase estacionaria hidrofóbica. Fases estacionarias ligadas: grupos hidrofóbicos unidos a los grupos silanoles (SiOH) de la sílica. -C18 -C8 -C3 -fenilo Fase móvil -agua, con control de pH opcional (buffer, ácido o base) -solvente orgánico miscible con agua Separación de moléculas no polares, polares, ionizables y iónicas Se mejora la retención de compuestos ionizables por agregado de un modificador a la fase móvil. Regla general: los analitos de mayor tamaño (proteínas, PM > 2000) se analizan en columnas de fase reversa de cadena corta (C3, CN) con poro grande (300 Å); los analitos más pequeños (PM < 2000) se separan en columnas de cadena más larga (C8, C18) con poro menor (80-120 Å). Fase estacionaria – Modo fase reversa Diferentes estrategias para distribuir las cadenas hidrofóbicas sobre los SiOH OH OH No recubierta Recubierta Protegida estéricamente (end capped) No recubierta Fase estacionaria – Modo fase reversa Recubierta, mayor estabilidad al pH (hasta pH 11) Fase móvil – Modo fase reversa H2O + modificador orgánico: acetonitrilo, metanol (THF, i-propanol) Cambio en fase móvil → Variación en selectividad y retención de muestras. La solubilidad de la muestra puede condicionar la selección de la fase móvil. Es importante controlar el pH y la fuerza iónica de la fase móvil cuando los analitos son compuestos ionizables o iónicos. Se recomienda trabajar a pH 2-4. pH de trabajo: ± 1 unidad de pH con respecto a pKa o pKb de los solutos analizados (90% de predominio de especies no ionizadas). Ajustar el pH sobre el componente acuoso. Fase móvil – Modo fase reversa Siempre considerar a la fase móvil como una potencial fuente de problemas para la columna. Consultar tablas de propiedades de solventes y miscibilidades. Usar solventes frescos (cambio de composición o contaminación). Asegurar la desgasificación de los solventes: -Desplazamiento con un gas menos soluble (He) -Vacío -Sonicación -Calentamiento Fase móvil – Modo fase reversa En lo posible preparar la muestra un solvente de la misma composición que la fase móvil para evitar distorsiones por solventes con gran poder de elución. pH de la fase móvil – Modo fase reversa Supresión iónica: regulación del pH de la fase móvil para evitar la ionización de los analitos y mejorar su retención en la fase fija. Un buffer es efectivo para regular el pH a ± 1 unidad con respecto a su pK. Ejemplo: buffer acético/acetato tiene pKa 4,8, regula a pH 3,8-5,8. pH de la fase móvil – Modo fase reversa pH de la fase móvil – Modo fase reversa - Par iónico: alternativa a supresión iónica. Fase unida Reactivo de par iónico SO3 Na+ SO3 + H R N R R Separación de bases con alquilsulfonatos Ácido Trifluoroacético (TFA) Ácido Heptafluorobutírico (HFTBA) Ácido Hexanosulfónico - Compuestos básicos: muchas veces no es necesario trabajar a pH alto, que puede dañar la columna. - Ionización potencial de los SiOH a pH ~7 ⇒ SiO- ⇒ aumenta la retención de cationes (aminas protonadas), interacción secundaria, ensanchamiento del pico cromatográfico. Se evita a pH bajo. Otra opción: columnas end-capped, recubiertas. pH de la fase móvil – Modo fase reversa Es posible usar una fase móvil sin buffer, simplemente una fase acuosa ácida Detector UV: La fase móvil y en particular el buffer deben ser transparentes a la λ de medición ⇒ solvente y buffer con cutoff < 220 nm ⇒ sales de ácido fosfórico + acetonitrilo. Desventaja: no se debe exceder 70% de solvente orgánico debido a la baja solubilidad de las sales de fosfato. pH de la fase móvil – Modo fase reversa Detector espectrómetro de masa: Se deben excluir materiales no volátiles de la fase móvil para no dañar la fuente de ionización ⇒ se evitan sales de fosfato y contraiones no volátiles; se evitan TEA y TFA que presentan supresión iónica en la fuente de ionización. Se usan sales de amonio de buffer formiato y acetato, que no sirven para detector UV. Idealmente, ambas fases móviles (A = acuosa, B = orgánica) deberían tener el mismo contenido de buffer, de modo que cuando se use un gradiente de solvente sólo varíe la proporción de fase orgánica. Optimización de condiciones – Modo fase reversa 1) Isocrática Para un método de control de calidad, se reducen variables. 2) Gradiente Para una muestra compleja con un rango amplio de tR de los analitos. Optimización de condiciones – Modo fase reversa 1) Isocrática Se varía %B de modo que 1 ≤ k ≤ 10. Se comienza con %B alto para asegurar elución de todos los analitos, se va reduciendo 10-20% (¡cuidado con el uso de buffer!) -Buena resolución -Análisis rápido Optimización de condiciones – Modo fase reversa Luego de optimizar la retención, si no se logró resolución adecuada, se varía la selectividad (α): Temperatura pH Tipo de buffer (acetato, formiato, fosfato) Modificador orgánico (acetonitrilo, metanol, mezclas) Velocidad de flujo de solvente Optimización de condiciones – Modo fase reversa 2) Gradiente Se comienza con un amplio rango de %B en poco tiempo, luego se ajusta la retención k* Análisis antidoping en orina humana – SPE - LC- ESI - TOF Detección de 124 analitos, incluyendo estimulantes, β-bloqueantes, narcóticos, agonistas β-adrenérgicos, antiestrogénicos, diuréticos y cannabinoides. Columna C18 2 x 100 mm; 3 μm. Fase móvil: A: 5 mM NH4Ac en HCOOH 0,1%; B: acetonitrilo. Gradiente: 10% a 40% B en 10 min; a 75% B en 13,5 min; a 80% en 16 min; 5 min a 80% B. Equilibrio post-run 6 min. Flujo de solvente: 0,3 ml/min metilfenidato (m/z 234,1489) Muestra de orina adquirida luego de administrar metilfenidato: a) Cromatograma TIC; b) Cromatograma reconstituido por superposición de iones específicos correspondientes a metilfenidato (m/z 234,1489), su metabolito ácido ritalínico (m/z 220,1332) y dibenzepina (m/z 296,1757) como estándar interno Ac. ritalínico (m/z 220,1332) Rango m/z: 50-800 Resolución promedio: 10000 para m/z 300 ESI, modo +, [M+H]+ Identificación en base a tiempo de retención, masa exacta y pattern isotópico. metilfenidato (m/z 234,1489) Ac. ritalínico (m/z 220,1332) Anal. Clin. Acta 2007, 585, 94-102. Elección del modo cromatográfico -Fase reversa (RP, reverse phase) -Fase normal -HILIC (Hydrophilic Interaction Liquid Chromatography), [ANC (aqueous normal phase)] -Intercambio iónico (IEC) -Exclusión por tamaño (SEC) sistema acuoso Permeación por geles (GPC) sistema no acuoso Fase estacionaria: sílica, otras fases polares como amino (RNH2), diol (RCHOHCH2OH) o ciano (RCN), en orden decreciente de polaridad. Fase móvil no polar inmiscible con agua: hidrocarburos, CH2Cl2, EtOAc. Los compuestos más polares son más retenidos. Razones para usar fase normal: -mayor retención de compuestos polares -elución de compuestos hidrofóbicos muy retenidos en RP -separación de isómeros -solvente de inyección inmiscible con agua -separaciones preparativas -recuperación de muestra en solvente no polar HILIC (Hydrophilic Interaction Liquid Chromatography) Fase estacionaria: polar. Fase móvil no polar miscible con agua, con un pequeño porcentaje de agua (≥ 2,5% en volumen). Los compuestos hidrofílicos, polares o cargados son más retenidos que los compuestos hidrofóbicos. El agregado de agua a la fase móvil reduce la retención ⇒ picos agudos para analitos polares (≠ fase normal). Útil para compuestos muy polares poco retenidos en RP ⇒ modo complementario a RP Fácilmente adaptable a equipos acoplados a espectrómetro de masa. Cuando se usa fase móvil con alta proporción de solvente orgánico aumenta la sensibilidad de MS debido a que se reduce la supresión iónica de la fuente (con respecto a buffer acuosos). Optimización de los siguientes parámetros: Fase estacionaria: sílica, amino (RNH2), modo mixto (alquil-diol, alquil-carboxilo, C18-amida, aromáticociano, alquil-hidroxilo, etc) zwitteriónico (tetraalquilamonio-sulfónico) Concentración de solvente orgánico Tipo de buffer y concentración (si se usa) pH Temperatura HILIC (Hydrophilic Interaction Liquid Chromatography) Paroxetina m/z 330 → 192 Gradiente: 5% B a 90% B en 10 min RP C18 Ranitidina m/z 315 → 176 A: HCOOHNH4 8mM en H2O B: HCOOHNH4 8mM en 95% acetonitrilo Paroxetina m/z 330 → 192 Ranitidina m/z 315 → 176 HILIC LC-MS/MS Gradiente: 100% B a 50% B en 10 min Selección de los iones Paroxetina m/z = 330 192,0 [M+1]+ 330,2 Ranitidina 175,9 m/z = 315 [M+1]+ 315,1 Varias consideraciones importantes Preparación de muestras Muestras libre de interferencias, compatible con el método de separación y detección seleccionados. Filtrar la muestra: a medida que disminuye el tamaño de partícula, disminuye también el fritado de la columna. Bloqueo de capilares, fritados, ingreso a la columna, detector. Filtrar la fase móvil. Daños en válvulas, sellos, pistones, agujas y jeringas, tubería capilar. HPLC estándar: filtro 0,45 μm UHPLC: filtro 0,22 μm Lavar la columna, lavar el buffer, dejar con fase móvil: agua/solvente orgánico. Usar fases móviles miscibles con el solvente de inyección de la muestra. Usar la columna hasta un 10% por debajo del límite máximo de presión (¡ver manual!), regular las velocidades de flujo de solvente. Seguir la dirección de flujo marcada en la columna. Evitar ajustar excesivamente las roscas (fittings) de las columnas al colocarlas o sacarlas del equipo. Bibliografía -The LC Handbook. Guide to LC columns and method development. Agilent. 2011. Publication number 5990-7595EN. www.chem.agilent.com\Library\primers\public\LC-Handbook-Complete-2.pdf -Agilent ZORBAX column guide selection. -The basics of HILIC. www.sepscience.com -Trends in universal detection in high performance liquid chromatography. Joshi, P. B.; Bhoir, S. I.; Bhagwat, A. M. www.sepscience.com