DETERMINACIÓN ESPECTROFOTOMÉTRICA DE KMnO4, CuSO4
Anuncio
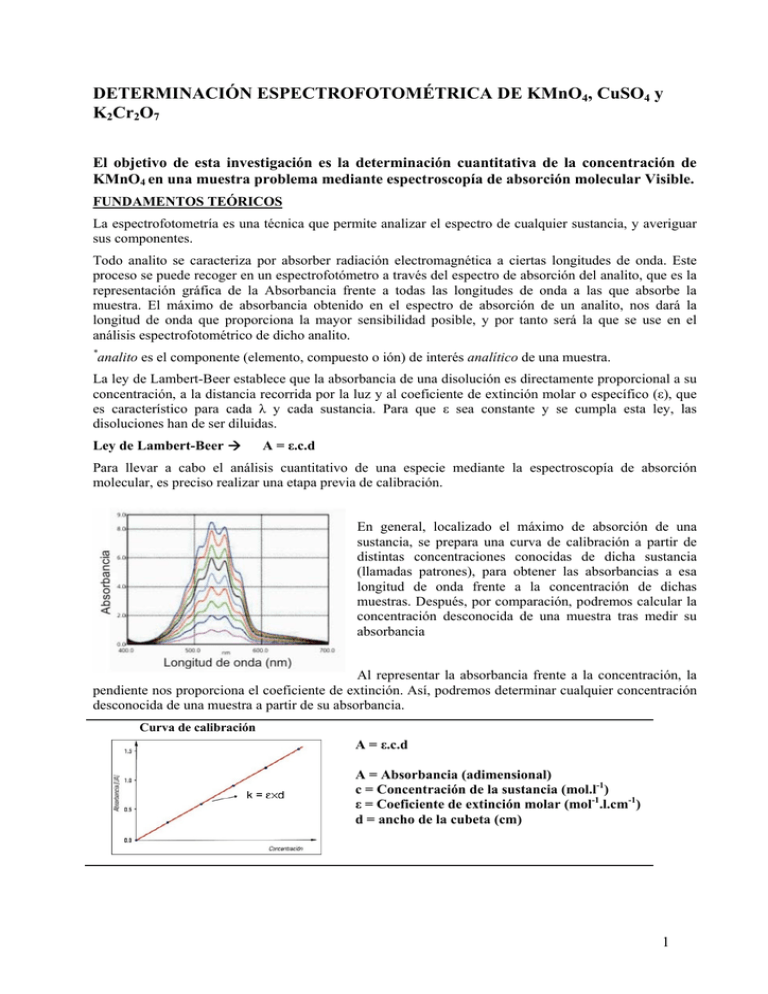
DETERMINACIÓN ESPECTROFOTOMÉTRICA DE KMnO4, CuSO4 y K2Cr2O7 El objetivo de esta investigación es la determinación cuantitativa de la concentración de KMnO4 en una muestra problema mediante espectroscopía de absorción molecular Visible. FUNDAMENTOS TEÓRICOS La espectrofotometría es una técnica que permite analizar el espectro de cualquier sustancia, y averiguar sus componentes. Todo analito se caracteriza por absorber radiación electromagnética a ciertas longitudes de onda. Este proceso se puede recoger en un espectrofotómetro a través del espectro de absorción del analito, que es la representación gráfica de la Absorbancia frente a todas las longitudes de onda a las que absorbe la muestra. El máximo de absorbancia obtenido en el espectro de absorción de un analito, nos dará la longitud de onda que proporciona la mayor sensibilidad posible, y por tanto será la que se use en el análisis espectrofotométrico de dicho analito. * analito es el componente (elemento, compuesto o ión) de interés analítico de una muestra. La ley de Lambert-Beer establece que la absorbancia de una disolución es directamente proporcional a su concentración, a la distancia recorrida por la luz y al coeficiente de extinción molar o específico (ε), que es característico para cada λ y cada sustancia. Para que ε sea constante y se cumpla esta ley, las disoluciones han de ser diluidas. Ley de Lambert-Beer Æ A = ε.c.d Para llevar a cabo el análisis cuantitativo de una especie mediante la espectroscopía de absorción molecular, es preciso realizar una etapa previa de calibración. En general, localizado el máximo de absorción de una sustancia, se prepara una curva de calibración a partir de distintas concentraciones conocidas de dicha sustancia (llamadas patrones), para obtener las absorbancias a esa longitud de onda frente a la concentración de dichas muestras. Después, por comparación, podremos calcular la concentración desconocida de una muestra tras medir su absorbancia Al representar la absorbancia frente a la concentración, la pendiente nos proporciona el coeficiente de extinción. Así, podremos determinar cualquier concentración desconocida de una muestra a partir de su absorbancia. Curva de calibración A = ε.c.d A = Absorbancia (adimensional) c = Concentración de la sustancia (mol.l-1) ε = Coeficiente de extinción molar (mol-1.l.cm-1) d = ancho de la cubeta (cm) 1 Todas las disoluciones que presentan color, absorben radiación electromagnética perteneciente al espectro visible, el cual puede dividirse en varias zonas según se muestra en la tabla siguiente: Longitud de Onda λ (nm) 380-435 435-480 480-490 490-500 500-560 560-580 580-595 595-650 650-780 Color Violeta Azul Azul-verdoso Verde-azulado Verde Verde-amarillo Rojo Anaranjado Rojo Color Complementario Verde amarillo Amarillo Anaranjado Rojo Púrpura Violeta Azul Azul-verdoso Verde-azulado En dicha tabla, la columna del "color" indica la porción del espectro que es absorbida, mientras que la correspondiente al "color complementario" indica la porción de radiación electromagnética que no absorbe la muestra y que por tanto es transmitida a través de ella y puede ser captada por el ojo humano (color de la disolución). Así, por ejemplo, una disolución de color amarillo absorbe la radiación de color azul, y por tanto cabe esperar que presente un máximo de absorbancia en la zona de longitud de onda en la banda de 435-480 nm. 2 OBJETIVOS 1. 2. 3. 4. Determinación de la longitud de onda de máxima absorbancia de una disolución de CuSO4 , KMnO4 o K2Cr2O7 Relación entre la absorbancia y la concentración de una disolución de CuSO4, KMnO4 ó K2Cr2O7 Determinación del coeficiente de extinción a la longitud de onda de máxima absorbancia para una disolución de CuSO4 , KMnO4 o K2Cr2O7 Determinación de la concentración de una disolución de CuSO4 , KMnO4 ó K2Cr2O7 MATERIAL Y REACTIVOS. MATERIAL. 1 matraz aforado de 100 mL, matraces aforados de 25 ml. vasos de precipitado de 100 mL. pipetas graduadas. 2 cubetas para espectrofotómetro REACTIVOS. Realmente nos interesa disoluciones mucho más diluidas, pero como las cantidades necesarias de reactivos son tan pequeñas, preparamos estas disoluciones para poder diluirlas después • • • • 100 ml disolución KMnO4 0,1M 100 ml disolución CuSO4 0,05M 100 ml disolución K2Cr2O7 0,05 M Muestras problema PROCEDIMIENTO EXPERIMENTAL. Preparación de las disoluciones patrón A. Preparamos una disolución 0,01 M a partir de las anteriores. V’ = 50 ml N = M.V = M’.V’ Æ 0,1 M x 5 ml = 0,01 x V’ B. Con una pipeta graduada, tomar 1 mL de la disolución 0,01M de KMnO4 y verterlo en un vaso de precipitado de 100 mL. Añadir poco a poco con la pipeta ml de agua destilada, y agitando cuidadosamente, hasta que la disolución resultante presente un color un poco más intenso al de la muestra problema. Así, podremos conocer la concentración aproximada de la muestra. Recogemos el espectro también para comparar. C. Ej.: Supongamos que hemos añadido en un matraz aforado 2 ml de la disolución y 23 ml de agua hasta que la tonalidad de la disolución es algo más fuerte que la de la muestra. La concentración de la disolución resultante sería: n = M.V = M’.V’ Æ 0,01 M x 2 ml = M’ x 25 ml Æ M’ = 8 x 10-4 M A continuación, preparamos una disolución patrón a partir de la disolución 8 x 10-4M. Por ej: 8 x 10-4 M x 5 ml = 1,6 x 10-4 M x V1 Æ V1 = 25 ml 3 Después a partir de la segunda disolución, preparamos una tercera y así sucesivamente. 1,6 x 10-4 M x 5 ml = 3,2 x 10-5 M x V2 Æ V2 = 25 ml 3,2 x 10-5 M x 5 ml = 6,4 x 10-6 M x V3 Æ V3 = 25 ml 6,4 x 10-6 M x 5 ml = 1,28 x 10-6 M x V4Æ V4 = 25 ml 1,28 x 10-6 M x 5 ml = 2,56 x 10-7 M x V5 Æ V5 = 25 ml Otra forma es a partir de la disolución algo más intensa, formar disoluciones patrón a partir de la misma: M = 8 x 10-4 mol.l-1 V = 0,050 l n=MxV Disolución 8 x 10-4 M 5 ml 4 ml 3 ml 2 ml 1 ml nº mol = M x V 4 x 10-6 3,2 x 10-6 2,4 x 10-6 1,6 x 10-6 8 x 10-7 V total disolución 5 ml + 20 ml agua 4 ml + 21 ml agua 3 ml + 22 ml agua 2 ml + 23 ml agua 1 ml + 24 ml agua Molaridad (mol.l-1) 1,6 x 10-4 1,28 x 10-4 9,6 x 10-5 6,4 x 10-5 3,2 x 10-5 Obtención del espectro de absorbancia. Debido al color púrpura de la disolución de KMnO4 o el color azul de la disolución de CuSO4 podemos predecir la zona del espectro en la que se obtendrá la máxima absorbancia. Los espectros de las disoluciones patrón se obtendrán así: Preparar el blanco: para ello, tomar una de las cubetas y, tras llenarla con agua destilada que es el blanco para este caso particular, (ya que el disolvente es el agua), situarla en el portacubetas. A continuación, llenar otra cubeta con la 1ª disolución patrón de KMnO4 o CuSO4 y situarla en el portacubetas. Siempre las cubetas se llenarán con la disolución o el blanco ocupando las ¾ partes de la cubeta. Introducir la cubeta con el blanco en el espectrofotómetro y calibrarlo. Esperar unos segundos hasta que la absorbancia se estabilice. Extraer la cubeta y a continuación introducimos la cubeta con la 1ª disolución patrón. Recoger el espectro correspondiente. A continuación, volvemos a calibrar el espectrofotómetro y lavamos bien con agua destilada la última cubeta e introducimos en ella la segunda disolución patrón. Recogemos el espectro y así sucesivamente. Finalmente recogemos el espectro de la muestra problema. Recordar que antes de la medición de cada patrón debe hacerse el blanco. Observaciones: La medición de la absorbancia de los patrones debe realizarse en orden creciente de concentraciones y utilizando una misma cubeta. Para ello, después de cada medida: - Desechar la disolución patrón ya medida - Limpiar la cubeta con agua destilada varias veces - Limpiar la cubeta con la nueva disolución patrón una vez - Llenar la cubeta con la nueva disolución patrón y medir 4 Obtención de la curva de calibrado Con las absorbancias anotadas para cada una de las disoluciones patrón, representar gráficamente, en EXCEL, la curva de calibrado en la forma: A vs. C y calcular la ecuación de la recta obtenida. Medición de la muestra problema A. Siguiendo el procedimiento conocido, medir la absorbancia de la muestra problema. B. Calcular la concentración de dicha muestra mediante dos métodos: - Gráficamente, mediante interpolación del valor de absorbancia obtenido - Matemáticamente, mediante la utilización de la ecuación de la recta de calibrado DESCRIPCIÓN DE LAS VARIABLES Establecer las variables independientes, dependientes y controladas en los objetivos 2, 3 y 4. Descripción de las variables para determinación de las absorbancias Variables independientes Variables dependientes Variables controladas Descripción de las variables para determinación del coeficiente de extinción Variables independientes Variables dependientes Variables controladas Descripción de las variables para determinación de la concentración de la muestra desconocida Variables independientes Variables dependientes Variables controladas RESULTADOS EXPERIMENTALES - Longitud de onda seleccionada: ____ nm - Ecuación de la recta de calibrado: _________________________ - Cálculo de la concentración de MnO4- en la muestra problema: Gráficamente Æ c = __________ Matemáticamente Æ c = ____________ 5



