Química ALCANOS - ENERGÍA DE DISOCIACIÓN DE ENLACES
Anuncio
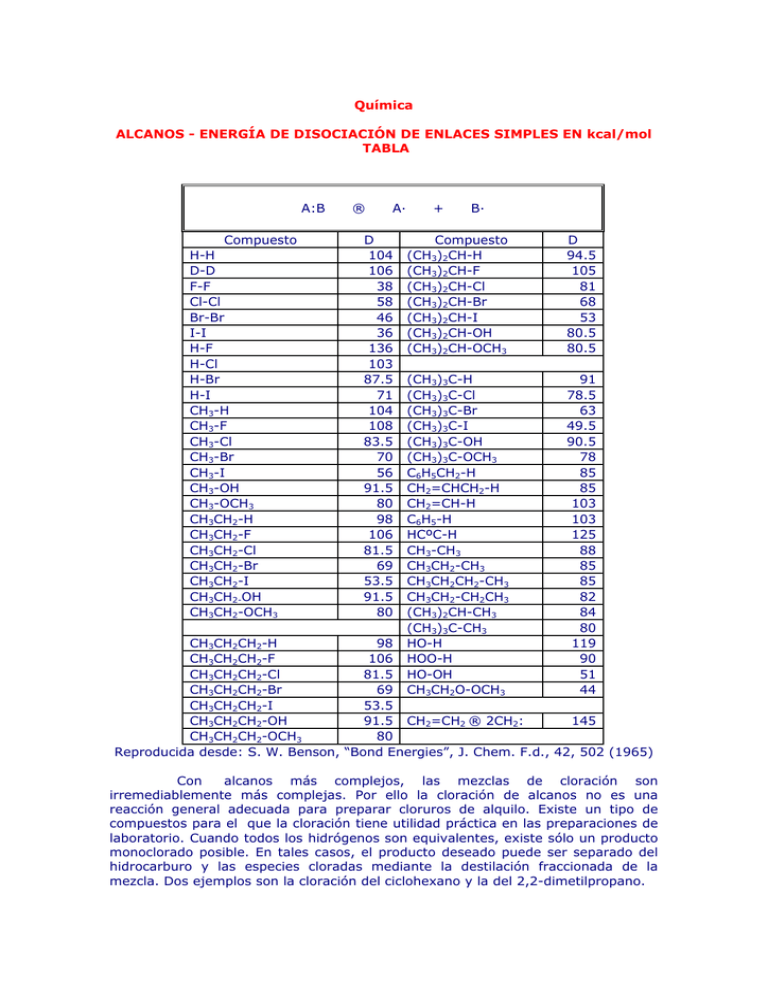
Química ALCANOS - ENERGÍA DE DISOCIACIÓN DE ENLACES SIMPLES EN kcal/mol TABLA A:B Compuesto H-H D-D F-F Cl-Cl Br-Br I-I H-F H-Cl H-Br H-I CH3-H CH3-F CH3-Cl CH3-Br CH3-I CH3-OH CH3-OCH3 CH3CH2-H CH3CH2-F CH3CH2-Cl CH3CH2-Br CH3CH2-I CH3CH2-OH CH3CH2-OCH3 ® A· D 104 106 38 58 46 36 136 103 87.5 71 104 108 83.5 70 56 91.5 80 98 106 81.5 69 53.5 91.5 80 + B· Compuesto (CH3)2CH-H (CH3)2CH-F (CH3)2CH-Cl (CH3)2CH-Br (CH3)2CH-I (CH3)2CH-OH (CH3)2CH-OCH3 D 94.5 105 81 68 53 80.5 80.5 (CH3)3C-H (CH3)3C-Cl (CH3)3C-Br (CH3)3C-I (CH3)3C-OH (CH3)3C-OCH3 C6H5CH2-H CH2=CHCH2-H CH2=CH-H C6H5-H HCºC-H CH3-CH3 CH3CH2-CH3 CH3CH2CH2-CH3 CH3CH2-CH2CH3 (CH3)2CH-CH3 (CH3)3C-CH3 HO-H HOO-H HO-OH CH3CH2O-OCH3 91 78.5 63 49.5 90.5 78 85 85 103 103 125 88 85 85 82 84 80 119 90 51 44 CH3CH2CH2-H 98 CH3CH2CH2-F 106 CH3CH2CH2-Cl 81.5 CH3CH2CH2-Br 69 CH3CH2CH2-I 53.5 CH3CH2CH2-OH 91.5 CH2=CH2 ® 2CH2: 145 CH3CH2CH2-OCH3 80 Reproducida desde: S. W. Benson, “Bond Energies”, J. Chem. F.d., 42, 502 (1965) Con alcanos más complejos, las mezclas de cloración son irremediablemente más complejas. Por ello la cloración de alcanos no es una reacción general adecuada para preparar cloruros de alquilo. Existe un tipo de compuestos para el que la cloración tiene utilidad práctica en las preparaciones de laboratorio. Cuando todos los hidrógenos son equivalentes, existe sólo un producto monoclorado posible. En tales casos, el producto deseado puede ser separado del hidrocarburo y las especies cloradas mediante la destilación fraccionada de la mezcla. Dos ejemplos son la cloración del ciclohexano y la del 2,2-dimetilpropano. El mecanismo de cloración puede ser aplicado también a los otros halógenos, pero las reacciones muestran importantes diferencias. En la Tabla 8.2 se recogen las entalpías totales de la halogenación del metano con diferentes halógenos. TABLA 8.2 CH3X + HX CH4 + X2 = X (halógeno) DHº = kcal/mol F - 102.8 Cl - 24.7 Br - 7.3 I + 12.7 La reacción con el flúor es tan fuertemente exotérmica que resulta difícil llevar a cabo una fluoración controlada. La yodación está en el extremo opuesto. La reacción del metano con el yodo es endotérmica. La bromación del metano es menos exotérmica que la cloración. De los dos pasos de propagación de la cadena, solamente uno es relativamente exotérmico: Por consiguiente, la bromación es mucho más lenta que la cloración. Desde el punto de vista mecanístico el bromo es mucho más selectivo que el cloro en sus reacciones con otros alcanos. Por ejemplo, la bromación del propano a 330 ºC en fase de vapor arroja un 92 por 100 de bromuro de isopropilo y solamente un 8 por 100 del bromuro de n-propilo. Los pasos de abstracción de hidrógenos para la formación de los dos isómeros son: La selectividad del bromo en comparación con la del cloro se hace más evidente cuando el alcano tiene hidrógenos terciarios. Por ejemplo, cuando el 2,2,3-trimetilbutano se somete a bromación, se obtiene más de un 96 por 100 del bromuro de terciario, a pesar de que el alcano tiene solamente un hidrógeno terciario frente a quince hidrógenos primarios. (96 por 100) Así pues, la bromación es un procedimiento un poco más útil que la cloración para propósitos preparativos. Sin embargo, cuando existe solamente un hidrógeno terciario y muchos secundarios en una molécula, se seguirán produciendo mezclas muy complejas. http://www.loseskakeados.com




