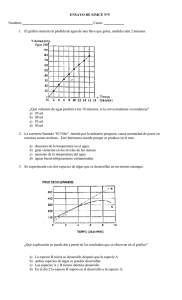
universidad veracruzana facultad de ciencias químicas zona xalapa
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS ZONA XALAPA ELABORACIÓN DE DIAGRAMAS ECOLÓGICOS PARA UN MANUAL DE PRÁCTICAS DE LABORATORIO DE QUÍMICA. TRABAJO TEÓRICO-PRÁCTICO Que para acreditar la Experiencia Educativa: Experiencia Recepcional P r e s e n t a: YANET DURÁN DURÁN. Asesores: M.C. SAMUEL GARCÍA DÍAZ (UV) DRA. IRMA CRUZ GAVILÁN GARCÍA (UNAM) 1 ÍNDICE GENERAL INTRODUCCIÓN ...................................................................................................................3 Planteamiento del problema ..........................................................................................5 Justificación ......................................................................................................................6 Objetivo general ...............................................................................................................8 Objetivos particulares .....................................................................................................8 CAPÍTULO I ...........................................................................................................................9 ANTECEDENTES ..................................................................................................................9 1.1 Evolución de la enseñanza de la química y su enfoque al medio ambiente. 9 1.2 Enfoque de la química hacia el cuidado del ambiente. .................................... 10 1.2.1 La Química Verde. ............................................................................................ 10 1.2.2 Microescala ........................................................................................................ 13 1.3 Diagramas ecológicos ............................................................................................ 13 1.4 Tratamiento de residuos en el laboratorio .......................................................... 15 1.4.1 Tratamientos químicos .................................................................................... 16 1.4.2 Tratamientos físicos ......................................................................................... 17 1.4.3 Tratamientos térmicos ..................................................................................... 18 1.5 Separación de residuos en contenedores ...................................................... 18 1.6 Identificación y etiquetado de los residuos ........................................................ 19 1.7 Marco legal para la identificación y clasificación de residuos peligrosos. . 20 CAPÍTULO II ........................................................................................................................ 25 EXPERIENCIA EDUCATIVA QUÍMICA ............................................................................ 25 2.1 Selección de las prácticas de laboratorio ........................................................... 25 2.2 Identificación, clasificación y cuantificación de los residuos generados en los experimentos de laboratorio de química. ........................................................... 30 2.3 Elaboración de los diagramas ecológicos. ......................................................... 31 2.4 Integración del manual de prácticas. ................................................................... 33 CAPÍTULO III ....................................................................................................................... 34 3. RESULTADOS ................................................................................................................ 34 CAPÍTULO IV ....................................................................................................................... 52 4. CONCLUSIONES ............................................................................................................ 52 Apéndice A .......................................................................................................................... 52 5. BIBLIOGRAFÍA ............................................................................................................. 114 2 Índice de figuras Figura 1. Métodos de tratamiento de residuos.........................................................15 Figura 2. Diagrama ecológico....................................................................................32 Figura 3. Diagrama ecológico No.1...........................................................................35 Figura 4. Diagrama ecológico No.2……………….....................................................36 Figura 5. Diagrama ecológico No.3.................................................………………....37 Figura 6. Diagrama ecológico No.4.................................................……………..…..38 Figura 7. Diagrama ecológico No.5.................................................………………....40 Figura 8. Diagrama ecológico No.6.................................................………………....41 Figura 9. Diagrama ecológico No.7.................................................………………....42 Figura 10. Diagrama ecológico No.8.................................................………………..43 Figura 11. Diagrama ecológico No.9.................................................………………..45 Figura 12. Diagrama ecológico No.10.................................................………………46 Figura 13. Diagrama ecológico No.11..................................................………………48 Figura 14. Diagrama ecológico No.13..................................................………………51 Figura 15. Materiales de laboratorio..................................................………………..54 Figura 16. Montaje para destilación sencilla..................................................……...62 Figura 17. Ley de la conservación de la materia.................………………………….73 Figura 18. Recopilación de gases.................…………………………………………...81 Figura 19. Circuito cerrado.................................................…………………………...95 Figura 20. Efecto Tyndall..................…………………………………………………....106 Índice de tablas Tabla 1. Residuos de la práctica operaciones preliminares.................……………35 Tabla 2. Residuos de la práctica cristalización y recristalización...............………37 Tabla 3. Residuos de la práctica elemento, mezcla, compuesto........................…39 Tabla 4. Residuos de la práctica conservación de la materia......................………40 Tabla 5. Residuos de la práctica relación masa-masa..................................………41 Tabla 6. Residuos de la práctica rendimiento porcentual.........................…………42 Tabla 7. Residuos de la práctica nomenclatura inorgánica.............................……44 Tabla 8. Residuos de la práctica estequiometria.....................................................45 Tabla 9. Residuos de la práctica eliminación de impurezas...................................47 Tabla 10. Residuos de la práctica de solubilidad.....................................................49 Tabla 11. Residuos de la práctica efecto de la concentración y temperatura.......51 Tabla 12. Ley de la conservación de la materia........................................................75 Tabla 13. Características del agua..................................................…………………..92 Tabla 14. Solubilidades..................................................………………………………..98 Tabla 15. Valores de titulación.................................................……………………...103 Tabla 16. Valores de concentración........................................................................113 3 INTRODUCCIÓN Actualmente, en la Facultad de Ciencias Químicas, Xalapa; se carece de procedimientos para el tratamiento del total de los residuos generados por los experimentos en los laboratorios de química, en consecuencia las cantidades obtenidas requieren de una disposición final que involucra altos costos. Debido a la falta de una metodología de identificación, clasificación y tratamiento general para los residuos específicos después de una práctica obliga a que en algunas ocasiones éstos se acumulen almacenando numerosos frascos. El uso de las sustancias químicas en los laboratorios de química educacional tiene objetivos didácticos insustituibles (Ibáñez, 2012), lo que hace inminente la obtención de productos químicos de reacción durante las realizaciones de las prácticas en los laboratorios. En lo que respecta a los laboratorios de la Facultad de Ciencias Químicas (FCQ), Xalapa, de la Universidad Veracruzana, la generación de los residuos químicos usualmente se almacena de manera temporal, dado que la mayoría de estas sustancias no son vertidas al drenaje. Por lo anterior, es necesario la implementación de un procedimiento que permita el manejo y minimización de residuos químicos. Los residuos producidos en el laboratorio representan un riesgo debido a las manipulaciones que se generan y a los productos obtenidos de ellos, por lo que es fundamental cumplir con las normas establecidas relacionadas con la seguridad y gestión de residuos, entre ellas la Ley General para la Prevención y Gestión Integral de los Residuos (LGPGIR), la Ley General del Equilibrio Ecológico y la Protección al Ambiente (LGEEPA) y la Norma Oficial Mexicana NOM-052-SEMARNAT-2005. Una herramienta utilizada para facilitar la identificación y naturaleza de los residuos generados en cada experimento, es un “diagrama ecológico”, el cual muestra en forma esquemática el desarrollo de cada experimento. En la que se incorpora la composición química esperada en cada etapa, así como una explicación resumida del tratamiento recomendado para los residuos (Gavilán, 2001). Esta metodología ha sido desarrollada en los laboratorios de la Universidad Nacional Autónoma de México, con buenos resultados, por lo que para el presente trabajo se propone tomar como base el manual de prácticas 4 de química en uso para la implementación de diagramas ecológicos en cada experimento, con la finalidad de formar una conciencia ecológica y crear hábitos para el correcto manejo de los residuos, que además de evitar que éstos se viertan en el drenaje sin previo tratamiento, algunas sustancias puedan ser útiles en prácticas posteriores, ya que al ser recuperadas pueden utilizarse. El presente trabajo se basa en una determinación cualitativa y cuantitativa de los residuos generados a partir de las prácticas en el laboratorio de química y una propuesta de tratamiento para los mismos. Planteamiento del problema Actualmente, en la Facultad de Ciencias Químicas, Xalapa se carece de procedimientos para el tratamiento del total de los residuos generados por los experimentos en los laboratorios de química, en consecuencia las cantidades obtenidas requieren de una disposición final que involucra altos costos. Debido a la falta de una metodología de identificación, clasificación y tratamiento general para los residuos específicos después de una práctica obliga a que en algunas ocasiones éstos se acumulen almacenando numerosos frascos. En determinado momento esta actividad puede ser considerada un riesgo, toda vez que algunos de estos residuos se guardan como desconocidos, creando el problema de inseguridad al no saber su compatibilidad para almacenarse adecuadamente. Cabe destacar que actualmente en los laboratorios básicos de la Facultad de Ciencias Químicas Xalapa, los residuos generados se vierten en frascos y contenedores donde se separan según sean residuos ácidos, básicos, de metales, solventes. 5 Justificación La realización del presente trabajo tiene como finalidad la implementación de diagramas ecológicos, en un manual de prácticas de laboratorio de química, como una herramienta de tratamiento para garantizar un mejor manejo de los residuos químicos. A través de la aplicación de estas técnicas se obtendrán beneficios técnicos, legales, económicos, ambientales y educativos. En cuanto a los aspectos técnicos, al establecer un sistema o un método de tratamiento se favorece a una identificación de residuos generados, lo cual permitirá una mejor disposición final de los residuos que no pudieron ser recuperados o tratados en el laboratorio. A su vez existe un uso eficiente de los insumos químicos, así como en su caso la reutilización de productos obtenidos de los experimentos para su implementación en técnicas posteriores. Actualmente, una empresa externa a la Universidad Veracruzana realiza una recolección periódica de los residuos generados, lo cual implica un costo de acuerdo a las cantidades de los mismos. La aplicación de los diagramas ecológicos permite además, una reducción en los volúmenes de residuos químicos generados y en algunos casos reduce la demanda de insumos para el desarrollo de las prácticas. La implementación de las actividades antes mencionadas permitirá obtener beneficios con el ahorro de los recursos. En términos legales, la FCQ, Xalapa; en calidad de generador es el responsable directo del manejo, tratamiento y disposición adecuada de sus residuos peligrosos. Todos los residuos peligrosos deben manejarse de acuerdo con la LGEEPA, LGPGIR además de las NOM en materia de protección ambiental que están publicadas en el Diario Oficial de la Federación. Con la aplicación de esta herramienta (diagramas ecológicos), existe una reducción del impacto al ambiente por las actividades realizadas en el laboratorio, al evitar que los residuos sean vertidos a las tarjas sin consideración y proporcionar un tratamiento previo a los residuos para minimizar su peligrosidad. El propósito de la elaboración y propuesta de diagramas ecológicos en un manual de prácticas es promover que el alumno identifique los residuos generados habitualmente en los laboratorios, tomando en cuenta que el laboratorio es un lugar ideal para complementar el aprendizaje de la Química y establecer la relación entre la teoría y la práctica. Además es posible crear 6 conciencia y desarrollo de habilidades en los estudiantes respecto al uso racional de recursos, así como un criterio sobre contaminación y conservación del ambiente. Es por ello que surge la necesidad de implementar los diagramas ecológicos tiene el propósito de dar una guía de manejo adecuado a los residuos generados; para lograr la reducción y tratamiento de los residuos, así como facilitar su clasificación y disposición aplicable según la normativa. 7 Objetivo general Elaboración de diagramas ecológicos para su integración en un manual de prácticas de química dirigido a estudiantes de los tres programas educativos de la Facultad de Ciencias Químicas, Xalapa, que incluya los diagramas ecológicos de cada experimento. Objetivos particulares -Identificar y clasificar los residuos generados en los experimentos seleccionados de acuerdo al plan de estudios de la experiencia educativa, de química. -Diseñar e implementar los diagramas ecológicos que incluyan una propuesta de tratamiento de acuerdo a la naturaleza del residuo. -Integrar al manual de laboratorio de química los diagramas ecológicos. 8 CAPÍTULO I ANTECEDENTES 1.1 Evolución de la enseñanza de la química y su enfoque al medio ambiente. El desarrollo académico de los futuros profesionistas debe basarse en estrategias novedosas y eficaces en el proceso enseñanza-aprendizaje, que garanticen el desarrollo de las competencias requeridas en el campo laboral (Ramírez, García y Cordero, 2013). Los cambios recientes en la sociedad, en la ciencia y en la química han contribuido a un redefinición de cómo debe ser la educación en química. Estos cambios demandan de la comunidad química un desarrollo continuo y la producción masiva de productos químicos que mejoren el estándar de vida humano, así como un manejo responsable, reducción tratamiento y eliminación de los desechos químicos. En consecuencia, es esencial que los estudiantes de cualquiera de las ciencias químicas, en general, adquieran un conocimiento básico de tecnologías que contribuya positivamente a los cambios, entre ellos encontramos a la Química Verde, que propone reemplazar los procesos químicos que afectan al ambiente por alternativas no contaminantes o lo menos dañinas posibles. (Carrillo, 2002) Por su parte, también se encuentra la química a microescala, que busca minimizar los costos, tiempos y residuos de la experimentación necesaria para la enseñanza de la química, además de generar el mínimo de desechos y fin de reducir la “huella ecológica”, rediseñando las metodologías propuestas para romper el paradigma creado y volver a minimizar los reactivos utilizados y ya no generar desechos, considerando que la mejor manera de recuperarlos es no generándolos. (Rincón y Pérez, 2003) Ambas opciones son consideradas en el presente trabajo como parte de la mejora en las prácticas de laboratorio de química. La enseñanza de la química tuvo su evolución para la enseñanza/aprendizaje desde 1994. (Giordan y Gois, 2009) Para que una analogía sea bien recibida por los estudiantes, se requiere generar interés y motivación en ellos pues son 9 cruciales para el aprendizaje. (Harrison, 2006) Esto, en gran parte se logra con la experimentación adecuada en el laboratorio, el cual es un lugar idóneo para promover y fortalecer la relación teoría-práctica fomentando el interés de los estudiantes. Además el laboratorio se puede aprovechar para fomentar conciencia en el uso de recursos, con el uso de técnicas de experimentación que propicien la utilización racional de los recursos, así como crear un criterio bien formado sobre contaminación y conservación del ambiente, sin detrimento de la calidad de enseñanza. (Carrillo, 2002) 1.2 Enfoque de la química hacia el cuidado del ambiente. La química verde y la microescala son pedagogías complementarias ya que con ellas se demuestran aspectos de la química que promueven tanto en la educación como en la investigación, una conducta de prevención y reducción de la contaminación, así como la protección al medio ambiente; implementándolas desde el laboratorio académico, con esto se promueve un desarrollo sostenible y cuidado del ambiente. (Montagut P. et al., 2006) El desarrollo sostenible es aquel que satisface las necesidades del presente sin comprometer la capacidad de las generaciones futuras para satisfacer sus propias necesidades para lograr este desarrollo existen como alternativas la química verde y las técnicas de microescala. (Ávila, Gavilán y Cano, 2011) 1.2.1 La Química Verde. Según Manahan (2006) la química verde puede definirse como “la práctica de la ciencia química de una manera que sea sostenible, segura y no contaminante y que consume menos cantidades de materiales y energía, mientras que la producción de material de desecho es poca o nada, es por ello que la práctica de la química verde comienza con el reconocimiento de que la producción , el procesamiento, así como el uso y la eventual eliminación de los productos químicos pueden causar daños cuando se realizan de forma incorrecta. Por ello, en el cumplimiento de sus objetivos, la química verde y la ingeniería química pueden modificar los productos químicos totalmente desde un rediseño en sus procesos con el objetivo de minimizar desechos y el uso o generación de materiales, especialmente los peligrosos”. 10 Hoy en día existen propuestas que incorporan los principios de la química verde para mejorar la seguridad, reducir la energía, usar sustancias auxiliares y tener una plataforma de discusión sobre la toxicidad, manipulación de los desechos y los efectos que tienen a la salud humana y el ambiente. (Osorio y Salvo, 2008) Cabe destacar que la Química Verde es considerada como la química sostenible, dado a los cuidados que aporta sobre aspectos, tales como: • Económicos: A un alto nivel de sofisticación, la química verde cuesta normalmente menos en términos estrictamente económicos (por no hablar de los costos ambientales) que la química como se practica normalmente. • Materiales: Por el uso eficiente de materiales, el reciclaje máximo y mínimo uso de materias primas. • Residuos: Al minimizarlos en la medida de lo posible, o incluso eliminar totalmente su producción. (Manahan, 2006) Es por ello que en algunas instituciones académicas se están incorporando técnicas de Química Verde en sus laboratorios, entre ellas, se encuentra la UNAM, por ejemplo, que en materia de química orgánica presenta un libro de teoría y experimentos de con un enfoque de química verde, en 2011 y otro con un enfoque ecológico, de 2001. Por ello, se ha empezado una creación de consciencia respecto al manejo adecuado de sustancias químicas peligrosas, tanto por los profesionales como por las industrias (algunas implementaron la estrategia de “eco-eficiencia”, es decir, se mide la relación entre las salidas y entradas de un proceso productivo, enfatizando la importancia de producir o hacer más con menos, esto incluye temas ambientales, sociales, éticos y económicos en su forma de operarproducir de manera sostenible).Uno de los retos ha sido el reducir cada vez más el consumo de materiales y energía en los procesos, minimizar la emisión de sustancias químicas peligrosas al ambiente, maximizar el uso de recursos renovables y extender la durabilidad y el reciclaje de los productos. (Clark, 1999) 11 El crecimiento de la Química Verde en el transcurso de las últimas décadas ha aumentado a un ritmo acelerado, y sus avances continuarán hasta que sus 12 principios sean incorporados como parte de la química cotidiana. Todo lo cual constituye una plataforma necesaria para alcanzar el desarrollo sostenible. (Pájaro y Olivero, 2011) Estos 12 principios de la Química Verde se enuncian de la siguiente manera: “1. Prevenir la generación de residuos: Diseño de síntesis química para prevenir los residuos, es mejor prevenirla generación que tratarlos después de que se forman. 2. Eficiencia atómica: Métodos de síntesis diseñados para aprovechar al máximo la incorporación de todos los materiales utilizaos en los procesos. 3. Reducir los residuos, diseñar procesos que minimicen la generación de residuos siempre que sea posible. 4. Diseñar sustancias seguras, las sustancias químicas deben ser diseñadas para garantizar la eficacia de una función específica, pero deben ser de baja toxicidad. 5. Diagramas seguros, uso de disolventes de baja toxicidad. 6. Energía eficiente, optimización del uso de fuentes de energía. 7. Materias primas renovables, siempre que sea técnica y económicamente factible. 8. Reducción de pasos intermedios, evitar innecesaria derivatización (bloqueo de grupo, protección/desprotección) siempre que sea posible. 9. Uso de catalizadores, es preferible el uso estequiométrico de sustancias químicas. 10. Productos de fácil degradación, diseñar materiales que no persistan en el ambiente. 11. Monitoreo continuo para prevención, usar metodologías analíticas que permitan el monitoreo continuo de los procesos. 12. Procesos seguros, seleccionar métodos seguros el potencial de ocurrencia de accidentes”. (Ávila et al., 2011) Los principios de la química verde fueron propuestos originalmente por Paul Anastas y John Warner en su libro Green Chemistry, theory and practice en 1998, y constituyen el pilar de la química verde. Este enfoque de la química debe ser aplicado desde los trabajos realizados en los laboratorios de 12 enseñanza para crear en los estudiantes valores y actitudes para la conservación del ambiente. 1.2.2 Microescala La microescala consiste en técnicas donde se busca la reducción de la cantidad de reactivos químicos utilizados a su mínima expresión, suficiente para que los experimentos puedan ser efectivamente realizados, con un impacto mínimo en el ambiente, a través de la generación de cantidades mínimas de residuos. (Esta definición es la aprobada por la International Union of Pure and Applied Chemistry, donde se reconoce a la microescala como química en escala pequeña; las cantidades de reactivos empleadas son menores de 1 gramo o 2 mililitros, preferentemente de 25 a 150 miligramos para sólidos y de 100 a 1000 microlitros para líquidos.) Esto se observa en algunas de las prácticas presentes en el manual de laboratorio de química. Durante los últimos años, la química a microescala ha cobrado importancia como una rama de la química que considera experiencias caracterizadas por tener un bajo riesgo de peligrosidad en la manipulación del material de laboratorio, reducir el gasto de agua y disolventes, bajo costo en implementación, menor espacio de almacenamiento del material de laboratorio y fácil trabajo en el aula. Las consideraciones anteriores favorecen también la innovación didáctica por parte de los profesores y el desarrollo de la creatividad por parte de los estudiantes al participar en la construcción de su propio instrumental y experimentar por si mismos el trabajo de laboratorio. (González y Urzúa, 2012) Entre sus ventajas pedagógicas se destacan la oportunidad para el aprendizaje colaborativo y su flexibilidad, ya que no es más difícil de aprender o de aplicar que las técnicas convencionales e incluso algunas son más sencillas y los aparatos más fáciles de armar. En general, la habilidad y el cuidado en el manejo de sustancias químicas. (Aponte, Aguilar y Austin, 2013) 1.3 Diagramas ecológicos Un diagrama ecológico es un complemento didáctico en el cual está incorporada la información referente a la identificación, clasificación y 13 tratamiento de los residuos generados en las diferentes etapas de los experimentos de un laboratorio de enseñanza. Su manejo ayuda al estudiante a analizar la actividad experimental y sirve para proponer el tratamiento adecuado de los residuos que genere a través de la misma. Debido al enfoque de la química verde principalmente, hoy en día se ha propuesto la elaboración de diagramas ecológicos, los cuales tienen el propósito de trabajar de manera ordenada los residuos de las prácticas y proponer su tratamiento. Se ha propuesto integrar a manuales de práctica con diagramas ecológicos donde se identifiquen la generación de los residuos peligrosos y cómo pueden minimizarse. (Gutiérrez, 2013) La elaboración de un diagrama ecológico es en forma de red conceptual, a través de toda la práctica, de cada uno de los reactivos y finalmente establecer con claridad los productos y subproductos que van a formar parte de los residuos peligrosos, para poder identificarlos y posteriormente facilitar su manejo y tratamiento. Un ejemplo de aplicación de los diagramas ecológicos se ha dado en la Escuela Nacional Preparatoria donde se realiza su uso, permitiendo a los alumnos y a los profesores identificar claramente cuáles son los residuos que deben ser tratados o almacenados, o bien, que es posible eliminar en el drenaje, sin riesgo de contaminación severa. Al tenerlos en forma de diagrama se hace posible la visualización y se evitan confusiones por parte de los alumnos, quienes de esa manera ven con claridad qué deben hacer con los desechos. (Martínez, Martínez y Treviño, 2008) Esto permite formar una conciencia ecológica en los alumnos y crearles hábitos sobre el correcto manejo de los residuos, pues además de evitar que éstos se derramen en el drenaje, aprenden a reciclar ciertas sustancias, esto resulta benéfico para el laboratorio de química, ya que además de que no se contamina, que es lo más importante, se reduce el consumo de algunos reactivos, y poco a poco las personas que trabajan en los laboratorios se preocuparán por nuestro planeta. (Catalá, y Chamizo, 1993) 14 1.4 Tratamiento de residuos en el laboratorio Es muy difícil establecer un sistema o un método de tratamiento general para los residuos específicos de un laboratorio, ya que depende del volumen generado, del tipo de laboratorio en que se esté trabajando y de la variedad de residuos que se generan; además, los residuos casi nunca están constituidos por un solo producto, sino que, generalmente son mezclas complejas. En algunas ocasiones en los laboratorios se almacenan residuos debido a diferentes causas (no saber cómo tratarlos, reactivos caducados, reactivos que han perdido su etiqueta) estos pueden ser conocidos o desconocidos (en cuanto a su composición química), los primeros se tratan de acuerdo a la secuencia que se describe en la literatura y a los segundos se le debe efectuar un análisis para saber su composición y luego proceder al diseño del tratamiento. (Ávila, J., García, C., Gavilán, I., León, F., Méndez, J., Pérez, G., Rodríguez, A., Salazar, G., Sánchez, A., Santos, E. y Soto, R., 2009) Cabe mencionar que el tratamiento de residuos generados en los laboratorios, debe ser llevado a cabo por personal capacitado, siendo esta la manera más efectiva para proteger a los seres vivos y no contaminar el ambiente. (González y Urzúa, 2012) De este modo se acentúa la responsabilidad que cada uno de los que están en contacto con sustancias químicas tiene desde el primer momento hasta el final del trabajo. En la figura 1 se muestran algunos de los métodos de tratamiento de residuos que suelen ser de los más comunes. Químicos Métodos de tratamiento Físicos Biológicos Térmicos Neutralización Precipitación Oxidación Reducción Filtración Cristralización Destilación Adsorción Aeróbicos Anaeróbicos Enzimáticos Incineración Figura 1. Métodos de tratamiento de residuos. (Fuente: elaboración propia) 15 Se debe recordar que cada residuo es diferente y el diseño de su tratamiento depende de muchos factores, tales como si en el residuo están presentes una o más sustancias, si está en solución acuosa o no, en qué concentración se encuentra cada componente, si es un residuo con varias fases; y con base en estos aspectos se diseña un tratamiento en el cual se combinan tanto los métodos químicos, como los físicos o térmicos, para llegar a la destrucción final de este o a su confinamiento. Cada investigador, profesor o estudiante antes de empezar a trabajar en el laboratorio, necesita planear cómo va a manejar los residuos que generará que son residuos de su responsabilidad. (Ávila et al., 2009) La planeación de las actividades debe incluir consideraciones tales como; los tipos y cantidades de residuos que se pueden generar, la forma en que se llevará a cabo el tratamiento y la verificación de la eficiencia del mismo, llegando hasta la disposición de éstos. En algunos casos se puede rediseñar, de ser posible, el experimento o emplear materiales alternativos que permitan alcanzar los mismos fines sin la generación de residuos peligrosos, o por lo menos la disminución máxima de peligrosidad y/o cantidad producida. Es por ello que se propone la implementación de estos recursos en la realización de cada una de las prácticas en el laboratorio de química. 1.4.1 Tratamientos químicos Una reacción química es un proceso en el cual una o varias sustancias (reactivos) cambian para formar una o más sustancias químicas nuevas (productos).Una ecuación química simboliza qué ocurre durante la correspondiente reacción. Por su parte la estequiometría es el estudio cuantitativo de reactivos y productos en una reacción química. (Coronas, J., 2013) Las reacciones de neutralización tienen como objetivo variar el pH de la disolución, cuya acidez o basicidad pueda resultar perjudicial; hasta llegar a un valor que sea aceptable, usualmente es entre 6 y 9. 16 Algunos líquidos de carácter ácido que contienen metales, a través de la neutralización pueden precipitarse pues se forman sus hidróxidos insolubles y se separan por sedimentación-filtración generalmente. (García, Cabildo, Claramunt, Cornago, Escolástico, Esteban, López, Pérez, Pérez y Sanz, 2010) Las reacciones de precipitación se utilizan a menudo para quitar elementos disueltos, haciéndolos sedimentar en forma sólida de diversas maneras, buscando siempre la reducción de su producto de solubilidad, una de las formas más comunes es alcalinizar la disolución, llevando el pH a valores entre 9 y 12, por ejemplo. Es posible agrupar los tratamientos químicos atendiendo al tipo de reacción que se lleva a cabo en cada caso; ya sean de oxidación, precipitación o neutralización. Una reacción de oxidación es el aporte de electrones acompañados de oxígeno en la mayoría de los casos, cedido por una sustancia oxidante a otra que se oxida. Las reacciones de reducción son un proceso opuesto a la oxidación pues la sustancia reducida cede electrones al compuesto reductor. Las reacciones de oxidación-reducción se utilizan principalmente para destruir contaminantes orgánicos o inorgánicos en solución acuosa. 1.4.2 Tratamientos físicos Entre los tratamientos físicos encontramos a la filtración y la cristalización. La primera consiste en la separación de una mezcla de sólidos y fluidos, que incluye el paso de la mayor parte del fluido a través de un medio poroso, el cual retiene la mayor parte de las partículas sólidas contenidas en la mezcla. Esta operación unitaria (acción necesaria de transporte, adecuación y/o transformación de las materias implicadas en un proceso químico) requiere de un medio filtrante que puede ser una pantalla, tela, papel o un lecho de sólidos. El líquido que pasa a través del medio filtrante se conoce como filtrado. (Perry y Green, 2001) 17 La cristalización es un proceso importante debido a la gran pureza y la forma atractiva de un producto químico sólido que puede obtenerse. Además este proceso requiere mucha menos energía que otros métodos de purificación usados comúnmente, puede usarse a bajas temperaturas y en cantidades que van desde los gramos hasta las toneladas. 1.4.3 Tratamientos térmicos La incineración es una de las técnicas más comunes para el tratamiento de residuos peligrosos, debido a que reduce el volumen y además se puede obtener energía del proceso. Se define como una oxidación controlada a alta temperatura, de esta combustión se desprende gas, partículas, humos, cenizas entre otros que deben ser controlados adecuadamente y según la legislación para evitar resulten contaminantes. En cuanto a los tratamientos biológicos al no ser utilizados para el presente trabajo, se omite su explicación. 1.5 Separación de residuos en contenedores Existen ciertas reglas que deben seguirse para el manejo de contenedores con residuos o productos peligrosos, independientemente del lugar donde se almacenan. Los contenedores pueden ser recipientes de vidrio, polietileno de alta densidad, acero inoxidable, metal con recubrimiento, entre otros, en los que se recolectan residuos. En primer lugar, el material del que están hechos los contenedores debe ser compatible con su contenido. Los contenedores siempre deben estar bien cerrados para evitar derrames o emisión de vapores. Cada persona que participe en el trasvase y empacado de los productos o residuos peligrosos a un contenedor debe conocer y usar el equipo de protección adecuado como: bata, goggles, mascarilla para respirar, guantes, botas o cualquier otro equipo necesario, así como las características mínimas de seguridad del local donde se llevan a cabo estas acciones. (Santos y Gavilán, 1997) 18 Como recomendación, nunca se deben mezclar residuos químicos desconocidos, esto puede generar una reacción peligrosa. Un gran número de personas pueden resultar gravemente heridas en un accidente causado por la falta de identificación de los residuos. (Ávila et al., 2009) 1.6 Identificación y etiquetado de los residuos Todos los residuos deben estar correctamente etiquetados, la etiqueta debe indicar el nombre y ubicación del generador, así como las precauciones e indicaciones correspondientes para el anejo adecuado del residuo. Una adecuada etiquetación y descripción de la composición cualitativa y cuantitativa (en forma aproximada) de los residuos peligrosos, es una obligación para un sistema de tratamiento. Los residuos bien etiquetados deben proporcionar información adecuada de su composición. El saber que en un contenedor se tiene los productos finales de una reacción, no es suficiente. Si el residuo es identificado como un compuesto específico o mezcla conocida (número de productos, su naturaleza y cantidad), dan una idea de su peligrosidad, clase química, grupos funcionales y con esto puede establecerse su compatibilidad, o medidas de emergencia en caso de un derrame accidental. Hoy en día se utilizan diferentes colores en las etiquetas de los recipientes y/o empaques de reactivos que se emplean tanto en la industria como en el laboratorio, con base en la asignación de un color para cada una de las siguientes propiedades predominantes: Riesgo a la salud; etiqueta azul Riesgo de incendio; etiqueta roja Riesgo de reactividad; etiqueta amarilla Riesgos especiales; etiqueta blanca Este sistema de codificación corresponde al establecido por la Asociación Nacional de Protección contra Incendios 704 (NFPA por sus siglas en inglés), para la clasificación de las sustancias químicas. (Santos y Gavilán, 1997) 19 Por lo anterior, algunas de las particularidades tomadas para la caracterización de los residuos de laboratorio de química en la Facultad de Ciencias Químicas, inician cuando el generador conoce de antemano si el residuo tiene alguna de las características CRETIB o de las especificadas en la normatividad. La vigilancia del cumplimiento de la NOM-052-SEMARNAT-2005 corresponde a la Secretaría de Medio Ambiente y Recursos Naturales, por conducto de la Procuraduría Federal de Protección al Ambiente, cuyo personal realizará los trabajos de inspección y vigilancia que sean necesarios. Las violaciones a la misma se sancionan en los términos de la Ley General del Equilibrio Ecológico y la Protección al Ambiente, la Ley General para la Prevención y Gestión Integral de los Residuos, sus Reglamentos y demás ordenamientos jurídicos aplicables. Los productos y residuos químicos que sean clasificados como peligrosos se deben tratar utilizando alguno o varios de los siguientes procesos: neutralización, combustión, evaporación, precipitación, reciclado y confinamiento. (Tejión y García, 1996) 1.7 Marco legal para la identificación y clasificación de residuos peligrosos. En las últimas dos décadas algunos gobiernos (nuestro país, de la Unión europea y Estados unidos) han comenzado a crear normatividades para los temas relacionados a cuestiones ambientales, con el surgimiento de legislaciones como la Pollution Prevention Act de los Estados Unidos de América en 1990, que tiene la intención de prevenir la generación de contaminantes, a través de distintas herramientas, entre ellas; la química verde. Por su parte la Enviromental Protection Agency (EPA) trabaja con el programa ambiental México-Estados Unidos; donde se otorga reconocimiento y apoyo a proyectos que apliquen este enfoque de la química. (US EPA, 2014) Respecto a otras legislaciones se encuentra la Agencia Europea del Medio Ambiente (AEMA) y su Red Europea de Información y de Observación sobre el 20 Medio Ambiente (Eionet). La información proporcionada por la AEMA guarda relación con: la calidad del aire y del agua, el estado del suelo, de la fauna y flora; el uso del suelo y de los recursos naturales, la gestión de los residuos; las emisiones sonoras; las sustancias químicas; la protección del litoral y de la marina. La red Eionet incluye los principales elementos que componen las redes nacionales de información, los centros de control nacionales y los cinco centros temáticos europeos (CTE). Las actividades de los centros abarcan los ámbitos del agua, el aire y el cambio climático, la protección de la naturaleza y la biodiversidad, los flujos de residuos y de materiales, y el medio ambiente terrestre. (Europa, 2014) En México, es alrededor de los años cuarenta cuando surgen las primeras políticas ambientales; posteriormente para enfrentar los problemas ambientales desde un enfoque sanitario nace la Subsecretaria para el mejoramiento del ambiente, es hasta 1988 cuando se promulga la Ley General del Equilibrio Ecológico y la Protección al Ambiente (LEEGEPA), misma que actualmente es la base de la política ambiental del país. Para 1989 se crea la Comisión Nacional del Agua (CNA), a su vez en 1992 surgen el Instituto Nacional de Ecología (INE) y la Procuraduría Federal de Protección al Ambiente (PROFEPA). En el año 2000, se cambió la Ley de la Administración Pública Federal dando origen a la Secretaria de Medio Ambiente y Recursos Naturales (SEMARNAT) con la intención de implementar una política nacional de protección ambiental que responda ante el cuidado y protección de los recursos naturales y que atienda las causas de la contaminación y de la pérdida de ecosistemas y de biodiversidad. (SEMARNAT, 2014) La clasificación y manejo de los residuos peligrosos publicada en el DOF el 13 de diciembre de 1996, está controlada por la Ley General de Equilibrio Ecológico y Protección al Ambiente (LGEEPA). Esta ley define en el Art. 3°, Fracc. XXVII, como residuo peligroso “a todo aquel residuo en cualquier estado físico, que por sus características corrosivas, reactivas, explosivas, tóxicas, inflamables o biológicas infecciosas, representen un peligro para el equilibrio 21 ecológico o el ambiente. Así mismo, establece que el responsable directo del manejo, tratamiento y disposición adecuada de un residuo peligroso es el generador”. La LGEEPA establece que la regulación de las actividades relacionadas con materiales o residuos peligrosos es un asunto de alcance federal. Con base a su naturaleza y toxicidad, los desechos se clasifican para: reciclaje, reúso ó tratamiento. De acuerdo con la legislación ambiental, los residuos peligrosos son “todas aquellas sustancias en cualquier estado físico que representan un peligro para el equilibrio ecológico o el medio ambiente, por sus características corrosivas, tóxicas, venenosas, reactivas, explosivas, inflamables, biológico infecciosas o irritantes”. Conforme la misma normatividad vigente, se entiende por manejo de residuos peligrosos el “conjunto de operaciones que incluyen el almacenamiento, recolección, transporte, reutilización, tratamiento, reciclaje, incineración y disposición final de los residuos peligrosos”. En nuestro país, dichas actividades requieren de la aprobación, autorización y supervisión del Instituto Nacional de Ecología. Para determinar si son peligrosos los residuos químicos que se generan en las actividades experimentales de un laboratorio de enseñanza, se debe tomar en cuenta la norma oficial mexicana NOM-052-SEMARNAT-2005, en la cual se precisan las características y los límites que hacen peligroso a un residuo, con base en su impacto negativo hacia el medio ambiente. Así, un residuo se considera peligroso, si presenta algunas de las características establecidas en el código CRETIB (Corrosivo, Reactivo, Explosivo, Tóxico, Inflamable, Biológico infeccioso) de la misma norma, en la cual se precisan los valores límites de dichas características para considerar peligroso a un residuo químico a través de los listados, figuras y anexos que ahí se mencionan y cuando algunos de los residuos no sean considerados bajo el criterio de esta norma se apoya de otras disposiciones y especificaciones establecidas en la NOM-004-SEMARNAT2002, NOM-133-SEMARNAT-2000, NOM-138-SEMARNAT/SS-2003, NOM141-SEMARNAT-2003, NOM-053-SEMARNAT-1993, NOM-087-SEMARNATSSA1-2002, así como la NOM-002-SCT/2003. 22 La Norma Oficial Mexicana NOM-052-SEMARNAT-2005 establece que un residuo se considera corrosivo si: Es un líquido acuoso que presenta un pH menor o igual a 2.0 o mayor o igual a 12.5, de conformidad con el procedimiento que se establece en la Norma Mexicana correspondiente. Es un sólido que al mezclarse con agua destilada presenta un pH menor o igual a 2.0 o mayor o igual a 12.5, según el procedimiento que se establece en la Norma Mexicana correspondiente. Es un líquido no acuoso capaz de corroer el acero al carbón, tipo SAE 1020, a una velocidad de 6.35 milímetros o más por año a una temperatura de 328 K (55°C), según el procedimiento que se establece en la Norma Mexicana correspondiente. Se considera reactivo si: Es un líquido o sólido que después de estar en contacto con el aire se inflama en un tiempo menor a cinco minutos sin que exista una fuente externa de ignición, según el procedimiento que se establece en la Norma Mexicana correspondiente. Cuando se pone en contacto con agua reacciona espontáneamente y genera gases inflamables en una cantidad mayor de 1 litro por kilogramo del residuo por hora, según el procedimiento que se establece en la Norma Mexicana correspondiente. Es un residuo que en contacto con el aire y sin una fuente de energía suplementaria genera calor, según el procedimiento que se establece en la Norma Mexicana correspondiente. Tiene en su composición cianuros o sulfuros liberables, que al exponerse a condiciones ácidas genera gases en cantidades mayores a 250 miligramos de ácido cianhídrico por kilogramo de residuo o 500 miligramos de ácido sulfhídrico por kilogramo de residuo. Se considera explosivo si: Es capaz de producir una reacción o descomposición detonante o explosiva solo o en presencia de una fuente de energía, o si es 23 calentado bajo confinamiento. Esta característica se determina mediante análisis de laboratorio sino a partir del conocimiento del origen o composición del residuo. Se considera tóxico ambiental si: El extracto PECT, obtenido mediante el procedimiento establecido en la NOM-053-SEMARNAT-1993, contiene cualquiera de los constituyentes tóxicos listados en la Tabla 2 de la NOM-052-SEMARNAT-2005 en una concentración mayor a los límites ahí señalados. Se considera inflamable si: Es un líquido o una mezcla de líquidos, que contienen sólidos en disolución o suspensión con un punto de inflamación inferior a 60.5°C, medido en copa cerrada, de conformidad con el procedimiento que se establece en la Norma Mexicana correspondiente, quedando excluidas las disoluciones acuosas que contengan un porcentaje de alcohol, en volumen, menor a 24%. No es líquido y es capaz de provocar fuego por fricción, absorción de humedad o cambios químicos espontáneos a 25°C, según el procedimiento que se establece en la Norma Mexicana correspondiente. Es un gas que, a 20°C y una presión de 101.3 kPa, arde cuando se encuentra en una mezcla del 13% o menos por volumen de aire, o tiene un rango de inflamabilidad con aire de cuando menos 12% sin importar el límite inferior de inflamabilidad. Es un gas oxidante que puede causar o contribuir más que el aire, a la combustión de otro material. Al no haber residuos biológico-infecciosos es innecesaria la definición en este trabajo. Para facilitar el manejo, almacenamiento, tratamiento y disposición final de los residuos, es fundamental que se encuentren identificados con una etiqueta que da a conocer el tipo de residuo y evitar riesgos por su compatibilidad con otros. 24 CAPÍTULO II EXPERIENCIA EDUCATIVA QUÍMICA 2.1 Selección de las prácticas de laboratorio Para la elección de los experimentos se realizó una revisión del programa de estudios de la experiencia educativa de química básica el cual se presenta dividido en 6 unidades que abordan los temas a tratar durante el curso de la misma en la Facultad de Ciencias Químicas. El objetivo de dicha experiencia educativa es proporcionar al estudiante los principios básicos de química, para ello en el programa de estudios se incluyen conceptos de materia, energía y cambios, clasificación de la materia y estados de agregación, mediciones y unidades de medida, relaciones estequiométricas, periodicidad química, tipos de enlaces, dispersiones, conceptos básicos de termodinámica química y de equilibrio químico, electroquímica y cinética, química de los metales y contaminación. Se pretende que a través de un trabajo tanto individual como por equipo, aunado a un ambiente de responsabilidad y compromiso; el alumno aprenda las teorías actuales y conceptos unificantes del contenido y adquiera la destreza para la resolución de muchos problemas químicos típicos respetando el medio ambiente. Este programa de estudios resalta que el estudiante adquiere conocimientos sobre los fundamentos, leyes y teorías de la química (eje teórico), de manera práctica y por escrito expresa los resultados del trabajo realizado (eje heurístico) e identifica los valores que le permiten interactuar en beneficio de sí mismo y de la sociedad (eje axiológico). A continuación se presentan cada uno de ellos. Saberes Teóricos Unidad 1 Fundamentos Química. Materia de Heurísticos energía y cambios. Clasificación Conceptos básicos de química general. de la Diferenciar y materia: sustancias y relacionar mezcla/elementos conceptos básicos en y los 25 compuestos. Química. Estados de agregación de la materia. Aplicar las unidades de medida a estados Mediciones y unidades de agregación de la materia. de medida. Reconocimiento del material de laboratorio. Unidad 2 Átomos y moléculas. Describir Estequiometría, Fórmulas químicas. conceptos básicos de símbolos químicos, Iones y compuestos las fórmulas y iónicos. cuantitativas entre las Una introducción a la sustancias nomenclatura de los participan compuestos. reacciones químicas. ecuaciones. los relaciones que en las Pesos atómicos. El mol. Aplicar las fórmulas Pesos fórmula, pesos para la resolución de moleculares y moles. problemas químicos. Ecuaciones químicas. Cálculos basados en Determinación ecuaciones químicas. relaciones de peso. Porcentaje de de rendimiento a partir de reacciones químicas. Unidad 3 Estructura de los Conceptos Estructura atómica. átomos. de la estructura de la Partículas materia. subatómicas. Describir la variación Estructuras de electrónicas de los los elementos según átomos. su Tabla periódica y tabla periódica. básicos propiedades de posición en la 26 propiedades Explicar periódicas de los comportamiento elementos. físico y químico de Abundancia de los los metales. metales. Explicar Procesos importancia metalúrgicos. metales Tendencias desarrollo periódicas de las civilización. propiedades Identificar metálicas. principales fuentes de Metales más el la de en los el de la las contaminación. importantes Analizar los daños Contaminación del que aire. contaminación Contaminación del Analizar agua propiedades físicas y Contaminación del químicas de algunos suelo. metales. causa la las Oxígeno, obtención y propiedades. Hidrógeno, obtención y propiedades. Explicar el fenómeno de la Lluvia ácida Unidad 4 Conceptos básicos. Explicar Periodicidad química Enlace iónico. diferentes y enlace iónico. Enlace covalente. enlace químico. Enlace metálico Diferenciar Interacciones entre moléculas los tipos de las propiedades de los compuestos en base a sus enlaces. Unidad 5 Cambios de calor y • Conceptos 27 Termodinámica. termoquímica. básicos de la La primera ley de la termodinámica química. • termodinámica Explicar los cambios de energía que acompañan procesos a los físicos y químicos. • Caracterización de disoluciones, coloides y suspensiones • Titulación ácido- base Unidad 6 Conceptos básicos. Equilibrio químico. La constante de equilibrio. Factores que afectan los equilibrios. La ley de la velocidad de reacción. Relación entre concentración la de reactivos y el tiempo. Mecanismos de reacción. Catálisis La Reacciones Redox. Celdas electroquímicas. Potenciales estándar de electrodo. Ecuación de Nernst autoionización del agua. 28 Tomando como base los temas a tratar durante el curso de la materia, se realizó una revisión de manuales para laboratorio de química general ya existentes como los de la Universidad Autónoma de Aguascalientes, Universidad Iberoamericana y Universidad Nacional Autónoma de México; para considerar las prácticas que pudieran ser complementarias para esta experiencia educativa, Con esto, se determinó la siguiente lista de prácticas a implementar durante el curso de la materia. La lista de prácticas que integran el manual, con su respectivo manual se presenta a continuación: Unidad 1. Fundamentos de Química. Operaciones preliminares; disolución, decantación, filtración y evaporación Destilación. Métodos de separación y purificación de compuestos químicos. Cristalización y recristalización. Unidad 2. Estequiometría, símbolos químicos, fórmulas y ecuaciones. Elemento, compuesto, mezcla. Ley de la conservación de la materia. Relación masa-masa Rendimiento porcentual de una reacción. Nomenclatura química inorgánica Estequiometría Unidad 3. Estructura atómica. Eliminación de impurezas en aguas residuales Unidad 4. Periodicidad química y enlace iónico. Solubilidad, polaridad y su relación con el enlace químico. Unidad 5. Termodinámica. Suspensiones, coloides y disoluciones Unidad 6. Equilibrio químico. Principio de Le Chatelier Efecto de la temperatura sobre la velocidad de reacción 29 Como prácticas complementarias para esta experiencia educativa de química se consideran: Unidad 1. Fundamentos de Química. Equipo de laboratorio y medidas de seguridad. Unidad 4. Periodicidad química y enlace iónico. Conductividad eléctrica de los electrolitos Unidad 5. Termodinámica. Titulación de un producto casero 2.2 Identificación, clasificación y cuantificación de los residuos generados en los experimentos de laboratorio de química. La parte experimental de cada una de las técnicas propuestas en el manual de laboratorio de química se realizó llevando a cabo los análisis cualitativos y cuantitativos respectivos a cada uno de los productos y subproductos obtenidos, de la siguiente manera: Se realizó una estimación de los componentes esperados de cada reacción realizada, en base a la literatura especializada incluyendo el cálculo del rendimiento teórico y real de los experimentos. Se determinó el pH a todas las soluciones para proceder a la determinación de su tratamiento, y en el caso de los sólidos se buscó la forma de recuperarlos, pues algunos podrían ser reutilizados o de lo contrario ser depositados en su recipiente correspondiente. Se utilizaron pruebas de solubilidad para comprobar la presencia o no, de algunos compuestos y en algunos casos fue necesaria la determinación de iones. Se clasificó cada uno de los residuos siguiendo las condiciones señaladas en la Norma Oficial Mexicana NOM-052-SEMARNAT-2005, donde se definen los criterios que hacen que sean considerados peligrosos por sus características CRETIB. A continuación se define cada una de ellas: Corrosividad Involucra a aquellas sustancias que en estado sólido, líquido o gaseoso pueden causar destrucción o alteraciones irreversibles en el tejido vivo o en el sitio de contacto. 30 Reactividad Es la capacidad que tienen las sustancias químicas de producir reacciones de gran potencial energético a veces de forma instantánea. Explosividad Son aquellas sustancias que en estado sólido, líquido o gaseoso que por un incremento de temperatura o presión sobre un porcentaje de masa, reaccionan repentinamente generando altas temperaturas y presiones sobre el medio circundante. Toxicidad Es la capacidad de una sustancia para producir daños importantes en los tejidos por ello se debe llevar bata de laboratorio, guantes y gafas de seguridad, además de trabajar con la campana de seguridad bien ventilada. Involucra a sustancias que en estado sólido, líquido o gaseoso, pueden causar trastornos estructurales o funcionales, que provoquen daños a la salud o la muerte, si son absorbidas aún en cantidades relativamente pequeñas. Inflamabilidad Es la medida de la facilidad que presenta un gas, líquido o sólido para encenderse y de la rapidez con que, una vez encendido. 2.3 Elaboración de los diagramas ecológicos. Considerando las indicaciones principales que aparecen en cada una de las técnicas a realizar, se procede a representarlas esquemáticamente en un diagrama ecológico. Según Ávila, García, Gavilán, León, Méndez, Pérez, Rodríguez, Salazar, Sánchez, Santos y Soto, (2009) al final de cada práctica incluye la propuesta de los diagramas ecológicos. Como se muestra en la Figura 2, la representación gráfica se inicia con un rectángulo donde se escriben los reactivos y posteriormente, con otros rectángulos se indica la presencia de productos obtenidos por cada experimentación, las flechas sirven como conectores que indican la secuencia de las actividades a realizar durante la técnica y los rombos incluyen la decisión tomada para llevar a cabo el 31 tratamiento, representado por la letra D, acompañada por el número que identifica cada residuo específico derivado de las acciones anteriores. Figura 2. Diagrama ecológico (Fuente: Elaboración propia) Para establecer los tratamientos de residuos se utilizaron principalmente las operaciones unitarias: Con los productos de reacción obtenidos de los diferentes experimentos fue necesario la aplicación de operaciones unitarias que ayudaran a la separación de los componentes de los residuos para un mejor tratamiento; por ejemplo: sedimentar, filtrar y decantar para el caso de la formación de precipitados o cualquier mezcla heterogénea, en otros casos, fue necesario la evaporación para separar el agua de algunas sales derivadas de neutralizaciones. En los casos en que los residuos quedaban sin reuso ni recuperación fueron depositados en su recipiente asignado siguiendo la Norma Oficial Mexicana NOM-052-SEMARNAT-2005. 32 2.4 Integración del manual de prácticas. En esta elaboración de los diagramas ecológicos para el manual de prácticas de laboratorio de química básica, se vió que cada una de las técnicas incluyera: -Nombre de la práctica -Objetivos; que definen el propósito esperado al realizar cada una de las prácticas. -Fundamento; que explica brevemente los términos teóricos del tema de la práctica. -Reacciones; en los casos que se presentan y las cuales esquematizan los procedimientos. -Materiales; necesarios para llevar a cabo la técnica. -Reactivos; que serán utilizados en el proceso de la práctica. -Técnica; son las indicaciones y pasos a seguir para de desarrollo de la práctica. -Diagrama ecológico; la herramienta que esquematiza la información de la práctica para la identificación, clasificación y tratamiento de los residuos generados en cada etapa de la experimentación en el laboratorio. -Cuestionario previo; para introducir al alumno al panorama que será realizado en la práctica. -Resultados; en este apartado el alumno anotará sus observaciones, imágenes y datos obtenidos durante la realización de cada técnica. -Bibliografía; para referenciar la información tomada como fuente. -Hoja de informe; que será entregada al profesor, así como el cuestionario previo, los resultados y la bibliografía, todo esto como reporte de la práctica de laboratorio, de este modo se complementa el aprendizaje de lo teórico y lo práctico. (Véase Apéndice A) 33 CAPÍTULO III 3. RESULTADOS Los siguientes diagramas ecológicos representan en forma esquematizada de cada una de las prácticas, a su vez incluye; las características de residuo, su clasificación y el tratamiento. En la tabla final (presente en algunos casos) aparecen las cantidades de residuo obtenidas en una práctica y considerando que será aplicado para 6 equipos de laboratorio, se muestra la cantidad esperada para 6 repeticiones del experimento. 34 Operaciones preliminares: disolución, decantación, filtración y evaporación. 5 g .de arena 5 g. de sal + 20 ml de agua destilada 1. Disolver mediante agitación. 2. Decantar la solución, realizar los lavados de la arena que sean necesarios. D1 A 5 gotas del lavado se añaden 2 gotas de HNO3 1N y 1 gota de AgNO3 0.1N. Arena 5 gr.de sal + 20 ml de agua destilada Evaporar la solución filtrada en una cápsula de porcelana previamente pesada. Calentar lentamente la solución decantada manteniendo una temperatura cercana a los 45˚C. 3. Filtrar y recoger en un vaso de precipitado Figura 3. Diagrama ecológico No.1 (Fuente: elaboración propia) Características del residuo: 1. Sólido (5.2 gramos de NaCl) D1: al ser inocuo y en cantidades pequeñas puede desecharse a la basura. Residuo Cantidad para 6 Operaciones preliminares (g) repeticiones (g) sal 5,2 31,2 Tabla 1. Residuos obtenidos en la práctica operaciones preliminares. (Fuente: elaboración propia) 35 Destilación Montar un equipo de destilación y colocar 5 ml de vino en el matraz. 1. Iniciar calentamiento. 2. Anotar temperatura a que condensa la gota. el Destilar hasta obtener 1 ml. D11 la la 1ª D21 Residuo de destilación D11: El producto obtenido puede reutilizarse (Residuo inflamable) D21: El residuo de la destilación se desecha al drenaje con abundante agua. Figura 4. Diagrama ecológico No.2 (Fuente: elaboración propia) En este caso no se presenta tabla final de residuos pues es inocuo y reutilizable. 36 Métodos de separación y purificación de compuestos químicos. Cristalización y recristalización. En 25 ml de agua destilada disolver una tableta de aspirina 1. Añadir HCl hasta pH de 1. 2. Calentar a ebullición Disolución completa aspirina. de 3. Enfriar (Agua helada) Formación de cristales en la solución Filtración al vacío Solución Ác. Acetilsalicílico puro D1 Secado a 80° C por 5 minutos Figura 5. Diagrama ecológico No.3 (Fuente: elaboración propia) Características del residuo: 1. Solución transparente, pH= 5, (obtención de cristales: 0.3951g) (Residuo corrosivo y tóxico) 2. Cristales de ácido acetilsalicílico, blancos transparentes. D1: Desechar la solución al drenaje con previa neutralización Cantidad para Métodos de separación y purificación de compuestos Residuo 6 repeticiones químicos. Cristalización y recristalización. (g) (g) Obtención de cristales de ácido acetilsalicílico 0,3951 2,3706 Tabla 2. Residuos de la práctica cristalización y recristalización (Fuente: elaboración propia) 37 Elemento, mezcla, compuesto. Colocar en un tubo HgO en polvo Hg Calentar mechero introducir astilla en D1 el e una Remover de las paredes el sólido obtenido O2 SÓLIDO En un mortero mezclar polvo de S y Fe - FeS - Fe -S a) Colocar un poco de la mezcla en un papel y acercar un imán b) Realizar pruebas de magnetismo D2 D3 -SO2/SO3 GAS Figura 6. Diagrama ecológico No.4 (Fuente: elaboración propia) Características del residuo: 1. Carbonizado en las paredes del tubo y mercurio, gris brillante; rendimiento de 63% (Residuo Tóxico) 2. Sustancia sólida de color negro en las paredes y el fondo del tubo. (Residuo reactivo, Inflamable) 3. Sustancia sólida de color amarillo, rendimiento del 17% (Residuo Salud:2, Inflamabilidad:1) D1: Con un agitador raspar las paredes del tubo para recuperar el mercurio para su posterior reúso. D2: separar con un imán el Fe y reutilizar, disponer el FeS como residuo sólido. D3: Lavar con abundante agua y desechar. 38 Cantidad para 6 Elemento, mezcla, compuesto Residuo (g) repeticiones (g) Hg 0,0588 0,3528 FeS 0,1225 0,735 S recuperado 0,017 0,102 Tabla 3. Residuos de la práctica elemento, mezcla, compuesto (Fuente: elaboración propia) 39 Ley de la conservación de la materia 16.5 ml de HCl al 3% 1 g de NaHCO3 Ley de la conservación de la materia D1 16.5 ml de agua destilada Alka-setzer D2 16.5 ml de agua destilada 16.5 ml de HCl al 3% Alka-setzer D3 Figura 7. Diagrama ecológico No.5 (Fuente: elaboración propia) Características del residuo: 1. Líquido transparente, pH= 1. (Residuo corrosivo) 2. Líquido transparente. (Residuo inocuo) 3. Solución heterogénea con formación de precipitado blanco y pH= 4. (Residuo de ácido clorhídrico: reactivo) D1, D2 y D3: Verificar el pH, dependiendo del resultado neutralizar y desechar al drenaje. Cantidad para 6 Ley de la conservación de la materia. Residuo (ml) repeticiones (ml) Agua destilada y HCl (ml) 66 396 Tabla 4. Residuos de la práctica conservación de la materia (Fuente: elaboración propia) 40 Relación masa-masa 10ml de destilada 500mg NaOH agua de Pesar después de agregar cada uno de los reactivos 2 gotas fenolftaleína de Añadir HCl gota a gota Evaporar D1 D1: El residuo es NaCl, desechar directamente al drenaje. Figura 8. Diagrama ecológico No.6 (Fuente: elaboración propia) Relación masa-masa Residuo (g) Cantidad para 6 repeticiones (g) NaCl 0,35 2,1 Tabla 5. Residuos de la práctica relación masa-masa (Fuente: elaboración propia) 41 Cálculo del rendimiento porcentual de una reacción química 0.1g Zn metálico 1. Monte aparato generador gases. 0.5g CuSO4 5H2O 40ml de agua destilada 0.3g de Zn granular Reacciones: un de Adicione 0.5ml de HCl al tubo, utilizando la jeringa. Esperar a que la reacción sea completa y medir el volumen de H+ D1 Combinación de Zn y Cu 1. Agitar 2. Dejar sedimentar el cobre. 3. Decantar y lavar el cobre obtenido. 4. Dejar secar y pesar. Solución de lavado D3 Figura 9. Diagrama ecológico No.7 (Fuente: elaboración propia) Características del residuo: 1. El zinc cambia a un color más oscuro mientras se lleva a cabo la reacción. 2. Se obtiene un residuo sólido de coloración negra, combinación de Cu y Zn. D1 y D3: La solución desechar neutra al drenaje. D2: Guardar el sólido para su posterior reúso. Residuo Cantidad para 6 Cálculo del rendimiento porcentual de una reacción. (g) repeticiones (g) Cu y Zn 0.2861 1.7166 Tabla 6. Residuos de la práctica rendimiento porcentual (Fuente: elaboración propia) 42 D2 Nomenclatura química inorgánica Obtención de un óxido metálico y un hidróxido Obtención de un óxido metálico Cinta de Mg 2) Colocar las cenizas en un vaso de precipitados con 5 ml de agua destilada Obtención de un hidróxido 3) Colocar una tira de papel pH D1 Obtención de un óxido no metálico y un ácido Agua destilada 20 gotas de naranja de metilo. 4) Colocar en la cucharilla de combustión 500mg de azufre en polvo y calentar. Aparición de vapores (óxido no metálico) 5) Introducir inmediatamente la cucharilla en el matraz. Formación de un ácido D2 Figura 10. Diagrama ecológico No.8 (Fuente: elaboración propia) Características del residuo: 1. Mezcla heterogénea con precipitado negro de magnesio (Residuo Inflamabilidad:1, Reactivo:2) 2. Solución homogénea de coloración naranja-amarilla (Residuo tóxico y corrosivo) D1: Realizar una filtración para separar el Mg y pesarlo. Obtención de una sal D2: Neutralizar la solución anterior con NaOH 1N. Determinar la presencia de iones de S Calentar hasta que el agua se evapore y obtener la sal. 43 Nomenclatura química inorgánica Residuo (g) Cantidad para 6 repeticiones (g) Mg 0.0155 0.093 Sulfato de sodio 0.0451 0.2706 Tabla 7. Residuos de la práctica nomenclatura inorgánica (Fuente: elaboración propia) 44 Estequiometria D1 Pesar el tubo de ensayo. MnO2 KClO3 1) Calentar la mezcla e introducir al tubo el palillo de madera con un punto de ignición. 2) Esperar a que la reacción termine Dejar enfriar y pesar. Figura 11. Diagrama ecológico No.9 (Fuente: elaboración propia) Estequiometria Residuo (g) Cantidad para 6 repeticiones (g) KCl 0.2018 1.2108 Tabla 8. Residuos de la práctica estequiometria (Fuente: elaboración propia) 45 Eliminación de impurezas en aguas residuales 50 ml de agua residual (Agua-jabónaceite vegetal-tierra) 1. Colocar la muestra del agua en un embudo con un trozo de manguera de hule cerrada con unas pinzas de Mohr. 2. Dejarla reposar para separar fases. Fase (superior) aceitosa D1 Filtración: Colocar en el vaso de unicel capas de arena y grava prehumedecidas. Verter en el vaso, con cuidado la muestra decantada. Fase decantada Filtrado D3 Agua destilada. D4 Carbón activado Filtrado 3. Someter a destilación con el equipo necesario. Adsorción: Verter la mezcla de agua filtrada en el matraz, que tiene una cucharadita de carbón activado y agitar vigorosamente. Colocar el papel filtro doblado en un embudo y pasar la mezcla anterior. Figura 12. Diagrama ecológico No.10 (Fuente: elaboración propia) Características del residuo: 1. Mezcla heterogénea de agua y aceite 2. Grava y arena 3. Pasta de carbón activado D1: Al ser agua y aceite vegetal inmiscibles se separan. 46 Grava y arena D2 D2: El filtro de arena se enjuaga y puede ser reutilizada. D3: El carbón activado se lava con una solución de NaHCO 3 al 10% y se confina para incinerar, la solución se desecha al drenaje D4: el agua tiene un pH de 5 por lo que se neutraliza añadiendo 0.5ml de NaOH 1N para poder verter a la tarja. Eliminación de impurezas en aguas residuales Residuo Cantidad para 6 repeticiones Destilado (ml) 20 120 Carbón activado (g) 3.4493 20.6958 Tabla 9. Residuos de la práctica eliminación de impurezas (Fuente: elaboración propia) 47 Solubilidad, polaridad y su relación con el enlace químico. Disolvente I2(s) S(s) Kl(s) CuSO45H2O(s) (0.5ml) Soluto (0.1g) CCl4 D3 1 CS2 D3 D3 D3 D3 D3 D3 3 D3 D3 D3 D3 D3 D3 Éter Agua 1ml tetracloruro 2 de carbono 1ml agua destilada 1ml de éter 2 D1 Formación trifásica Tubo 1 Yodo + tetracloruro de carbono Tubo 2 Sulfato de cobre + Agua Tubo 3 Yodo + éter D2 Figura 13. Diagrama ecológico No.11 (Fuente: elaboración propia) En este caso para la esquematización del diagrama ecológico se realizó una tabla pues la cantidad de reactivos involucrados es mejor apreciada de tal modo. D1 y D2: Con una pipeta Pasteur separar cada una de las fases. Colocar los residuos que contengan disolventes orgánicos en un recipiente previamente etiquetado para su posterior tratamiento. 48 D3: Realizar una filtración para separar los solutos de cada disolvente. Los residuos de sales orgánicas en agua, desecharlos directamente en la tarja, arrastrando con abundante agua. Solubilidad, polaridad y su relación con el enlace químico. Residuo (g) Cantidad para 6 repeticiones (g) CS2+CuSO4 0,039 0,234 CS2+I 0,0513 0,3078 CS2+S 0,0661 0,3966 CS2+KI 0,0848 0,5088 éter+I 0,0343 0,2058 éter+S 0,0739 0,4434 éter+KI 0,0856 0,5136 éter+CuSO4 0,0789 0,4734 agua+I 0,0243 0,1458 agua+S 0,0638 0,3828 CCl4+S 0,0872 0,5232 CCl4+CuSO4 0,1017 0,6102 Tabla 10. Residuos de la práctica de solubilidad (Fuente: elaboración propia) 49 Principio de Le Chatelier Gotas de FeCl3 y AgNO3 KSCN FeCl3 Distribuir en 3 tubos con 0.5ml en cada uno. 5ml de NaOH Gotas FeCl3 Gotas AgNO3 D1 de D2 D3 de Trocitos de alambre de Cu 1ml de HNO3 concentrado Formación de NO2 D4 Figura 14. Diagrama ecológico No.12 (Fuente: elaboración propia) Características del residuo: 1. Precipitados (Residuo tóxico agudo) 2. Formación de un “gel” en tono azulado D1, D2, D3 confinar al recipiente adecuado. D4: succionar 5 ml de NaOH 1M en la jeringa que contiene el NO 2 para eliminarlo. 50 Efecto de la concentración y temperatura sobre la velocidad de reacción. 50 ml de Na2S2O3 0.3M Cruz entintada en una hoja blanca. Añadir 6ml de HCl y cronometrar. Agitar hasta que la marca desaparezca. Repetir el experimento bajo las condiciones de temperatura y concentraciones indicadas. 5ml de Na2S2O3 0.3M 45ml de agua Añadir 6ml de HCl y cronometrar. destilada Agitar hasta que la marca D1 Repetir el experimento bajo las condiciones indicadas. D1 desaparezca. Tomar las temperaturas. Figura 14. Diagrama ecológico No.13 (Fuente: elaboración propia) Características del residuo: 1. Solución turbia de tonalidad amarilla, en algunos de los vasos se aprecia una precipitación blanca. D1: Colectar todas las muestras en un solo vaso de precipitados, filtrar y desechar a la basura. La solución restante se neutraliza y puede verterse al drenaje. Efecto de la concentración y Residuo (ml) temperatura sobre la velocidad de Cantidad para 6 Recuperado repeticiones (ml) reacción Tiosulfato de sodio 210 1260 Agua destilada 540 3240 HCl 90 540 TOTAL 840 ml 5040 ml S= 1,8362 g S= 11,0172 g Tabla 11. Residuos de la práctica efecto de la concentración y temperatura (Fuente: elaboración propia) 51 CAPÍTULO IV 4. CONCLUSIONES A partir de la propuesta e implementación de los diagramas ecológicos en las prácticas de laboratorio se demuestra que los residuos producidos en los laboratorios de química, pueden tratarse previamente antes de su disposición final; con la intención de minimizarlos (incluso desde el origen) y evitar que se almacenen o viertan al drenaje sin consideración alguna. Con un análisis de las legislaciones vigentes para residuos peligrosos en nuestro país, se determinó la clasificación de los residuos de acuerdo a sus características de corrosividad, reactividad, explosividad, toxicidad, e inflamabilidad, principalmente. Se neutralizaron los ácidos y soluciones básicas, al momento de su generación para minimizar y dar un previo tratamiento a los residuos, aquellos que no lo tienen, se depositan en el recipiente correspondiente, ubicado en el laboratorio. Al influir en la concientización de los estudiantes para que su comportamiento genere nuevas formas de relación con el ambiente y su cuidado, desde el laboratorio y las aulas, contribuye a que la formación de los profesionales sea con base en una conducta de respeto y preservación del ambiente. 52 Apéndice A A continuación se presenta el manual de prácticas de laboratorio. PRÁCTICA 1 Equipo de laboratorio y medidas de seguridad OBJETIVOS El alumno revisará las reglas básicas de seguridad e higiene que se deben aplicar en un Laboratorio de Química. Identificará el uso y las precauciones que hay que considerar al manipular el material y equipo que se empleará durante el curso. Identificará algunas de las sustancias química, sus usos y precauciones. FUNDAMENTO El laboratorio de química es uno de los ambientes más seguros en una facilidad académica o industrial, por ello es necesario ser cuidadoso en la manipulación, almacenamiento y disposición de los químicos. Es importante utilizar el equipo de seguridad de laboratorio; bata de algodón, lentes de protección, guantes, zapatos cerrados, así como detectar los extintores y las campanas de extracción, salidas de emergencia, duchas de seguridad. Evita probar, oler o tocar alguna solución química ya que las respuestas de sensibilidad a los productos químicos no se pueden anticipar. Procura conocer la correcta manipulación de productos químicos, ubicación, avisos de seguridad, MSDS, normas NFPA. En cuanto al material de laboratorio, debe ser tratado con cuidado, especialmente al ser de vidrio, no lo utilices si está dañado o en malas condiciones, y el conocimiento del funcionamiento de los equipos es indispensable antes de utilizarlos. REACTIVOS - Bicarbonato de sodio. - Bromuro de potasio. - Fenolftaleína. - Ácido clorhídrico. 53 - Sulfato de cobre. MATERIALES Figura 15. Materiales de laboratorio (Fuente: Manual de química general, UNAM) 1. Pinzas para bureta. 6. Papel indicador. 2. Anillo metálico. 7. Pinza para tubo de ensayo. 3. Soporte con varilla metálica. 8. Escobillones. 4. Tela de alambre con asbesto. 9. Manguera de hule. 5. Papel filtro. 10. Pinza de Mohr. 54 11. Mechero de Bunsen 23. Pipeta de Pasteur 12. Tapones de hule. 24. Termómetro. 13. Embudo de Büchner. 25. Varilla de vidrio. 14. Mortero con pistilo. 26. Matraz de fondo plano. 15. Cápsula de porcelana. 27. Matraz de Erlenmeyer. 16. Vidrio de reloj. 28. Matraz de filtración. 17. Gotero. 29. Vaso de precipitados. 18. Tubos de ensayo. 30. Probetas. 19. Embudo de vidrio. 31. Frasco con tapón. 20. Bureta. 32. Piseta. 21. Pipeta graduada. 33. Matraz volumétrico. 22. Pipeta volumétrica. 34. Aparato de Fisher-Johns TÉCNICA El profesor dará lectura ante el grupo del reglamento interno de higiene y seguridad para el Laboratorio de Química y se discutirán con los alumnos los puntos más importantes del mismo. Previamente se investigará al respecto El profesor mostrará a los alumnos cada uno de los materiales y equipos más comunes, existentes en el laboratorio, e indicará el procedimiento correcto para su uso. El profesor expondrá a los alumnos algunos de los reactivos que se tienen en el laboratorio, indicará cuáles son sus características y los cuidados que deben tenerse durante su manipulación, así como la información que debe contener cada etiqueta. Con base en lo aprendido en la clase, se indicará qué material podría emplearse para: - Medir volúmenes - Determinar densidades - Realizar reacciones químicas 55 Se hará una inspección del laboratorio y considerará si las instalaciones son las adecuadas para trabajar con seguridad. CUESTIONARIO PREVIO EQUIPO DE LABORATORIO Y MEDIDAS DE SEGURIDAD 1. Cita algunos de los accidentes que pueden presentarse en el laboratorio de química y mencione cómo evitarlos. 2. Investiga las propiedades de las sustancias químicas siguientes: ácido sulfúrico, ácido clorhídrico, ácido acético, hidróxido de sodio, hexano, etanol y acetona. 3. Cita al menos cinco sustancias químicas de uso común en la vida diaria. 4. Investigue cuántas clases de fuego existen y qué tipo de extintores se emplean en cada caso. 5. ¿Cuál es la información mínima que debe contener la etiqueta de un reactivo químico? 6. Dibuja los pictogramas alusivos a las características siguientes que puede tener un reactivo químico: a) Explosivo b) Oxidante o comburente c) Inflamable d) Tóxico e) Irritante f) Corrosivo g) Peligroso para el medio ambiente. BIBLIOGRAFÍA HOJA DE INFORME 1. Menciona las principales medidas de seguridad al trabajar en un laboratorio de química. 2. ¿Cómo se encuentran distribuidos los materiales en el laboratorio? 3. ¿Cuáles son los auxiliares que están presentes en caso de algún accidente? 56 4. ¿Por qué es recomendable preparar cada experimento? 5. ¿Qué crees necesario para obtener un conocimiento profundo de la química a través del tiempo en el laboratorio? 6. ¿Qué precauciones se toman con el material de vidrio y cristalería? 7. Menciona ejemplos de algunos tipos de instrumentos (metálicos, volumétricos, no volumétricos) 8. Da algunas recomendaciones para un buen trabajo en el laboratorio. 57 PRÁCTICA 2 Operaciones preliminares: disolución, decantación, filtración y evaporación OBJETIVOS El alumno se familiarizará con las sustancias y desarrollará habilidades sobre las operaciones preliminares de química. FUNDAMENTO La química tiene como objeto de estudio a las sustancias y las mezclas; las sustancias puras se caracterizan porque tienen composición fija, no pueden separarse por métodos físicos en otras más simples y durante un cambio de estado de temperatura, fusión o ebullición, presión se mantiene constante. Una mezcla es la unión física de 2 o más sustancias puras, por lo tanto, tienen composición variable y sus componentes pueden separarse. Estas mezclas, pueden clasificarse en heterogéneas u homogéneas, según las fases con que cuenten. Los métodos de separación de mezclas son necesarios para encontrar sustancias puras, se pueden elegir de acuerdo a las propiedades físicas del componente de formas simples o complejas, entre ellos están: -Evaporación: separa una mezcla líquida, siempre y cuando uno de los componentes no sea volátil. -Decantación: separa componentes líquido y sólido con base en su diferencia de estado de agregación y densidad. Se vierte el líquido hasta que el sedimento del sólido queda prácticamente en el fondo del recipiente. -Filtración: separa los componentes, uno sólido y otro líquido con base en su diferencia de estado de agregación. Se vierte la mezcla en un papel filtro que sólo puede ser atravesado por el líquido. Además de los métodos mencionados existen otros como; centrifugación, destilación, cristalización y cromatografía. REACCIONES NaCl(s) + H2O(ac) HCl(ac) + NaOH(ac) AgNO3(ac) + HCl (ac) AgCl(s) + HNO3(ac) 58 MATERIALES -Anillo metálico -4 vasos de precipitados de 250ml -Soporte universal -6 tubos de ensaye -Papel filtro -3 pipetas graduadas -Agitador -Balanza granataria REACTIVOS -Mechero de bunsen. -Arena. -Tripié -Sal común. -Tela de alambre de asbesto -Agua destilada -Embudo de vidrio -Ácido nítrico (HNO3) 1N. -Cápsula de porcelana -Nitrato de plata (AgNO3) 0.1N TÉCNICA Preparación de la mezcla y disolución. Pesa en un vaso de precipitado de 250 ml, 5 gr de arena común (en balanza granataria) y por separado se pesan 5 gr. de sal común en otro vaso de precipitado, añadiendo luego 20 ml de agua destilada. Disuelve la sal mediante agitación. Una vez disuelta, agrégala al vaso que contiene la arena. Añade un poco de agua al vaso pequeño, agita y agrégala nuevamente al vaso que contiene la mezcla. Decantación. Remueve la mezcla ayudándose con el agitador, observa la naturaleza y condiciones de la mezcla y procede a decantar la solución, vertiéndola con cuidado en otro vaso de precipitado de 250ml. Una vez realizada la separación añada pequeñas porciones de agua destilada a la arena contenida en el vaso y remueva continuamente los contenidos. Decante de nuevo, recogiendo la solución en el vaso correspondiente. Realiza otra vez la operación de lavado utilizando otra porción de agua y remover. Pon en un tubo de ensayo unas cuantas gotas del agua de lavado, añadir 2 gotas de ácido nítrico 1N y una gota de solución de nitrato de plata 0.1N. Si aparece un precipitado blanco realiza los lavados necesarios y decanta los restos de la solución juntándolos con la solución inicial. La operación de lavado termina cuando la prueba con solución de nitrato de plata, muestre resultado negativo. Observe la naturaleza de la solución obtenida. Filtración. 59 Calienta lentamente la solución decantada anteriormente (que contiene impurezas) a una temperatura cercana a los 45˚C, procurando agitarla a intervalos regulares. Coloca un papel filtro en un embudo y, sujetándolo con un dedo, se moja con un chorro de agua destilada. El ángulo del cono debe ser de 60˚C, ajustándose bien a las paredes del embudo cónico. Coloca el embudo con el filtro preparado en un anillo metálico sujeto al soporte. Agita la solución decantada en el vaso de precipitado utilizando un agitador y vierte con cuidado el contenido en el embudo, de igual forma recoger el filtrado en un vaso de precipitado. Con una pipeta que contenga agua destilada, lava cuidadosamente el vaso del precipitado que contenga la solución anterior. Una vez terminada la filtración, lava varias veces el residuo que se encuentra en el papel filtro con auxilio de una piseta. Evaporación Calienta la solución filtrada recogida en el vaso de precipitado y continua el calentamiento a ebullición hasta que el volumen de la solución se haya reducido hasta 30-40ml. Pesa una cápsula de porcelana y añade la solución caliente. Continuar con la evaporación mediante calentamiento suave para evitar la ebullición de la solución. Detén el calentamiento hasta que se evapore toda el agua. Deja enfriar la cápsula y su contenido. Pesa y anota el dato en la hoja de informe. Calcula el rendimiento de la sal recuperada. CUESTIONARIO PREVIO 1. ¿Qué características deben tener los componentes de una mezcla para que se puedan separar por filtración, decantación, evaporación? 2. ¿En qué orden aplicarías cada uno de los métodos de separación de mezclas? 3. Describe brevemente cada concepto; a) Disolución b) Decantación c) Filtración d) Evaporación RESULTADOS 60 BIBLIOGRAFÍA HOJA DE INFORME 1. Cálculo de la sal recuperada. a. Peso de la cápsula vacía m1: b. Peso de la cápsula + contenido (salino) m2: c. Peso de la sal: d. Rendimiento: 2. Explica los siguientes términos a. Mezcla: b. Disolución: c. Decantación: d. Filtración: e. Evaporación: 3. Explica por qué en esta práctica se optó primero por utilizar la decantación y después la filtración, y no en caso inverso. 4. ¿Por qué se prefiere realizar la filtración en caliente? 5. ¿Qué reuso se le puede dar a la sal obtenida en los residuos? 61 PRÁCTICA 3 Destilación OBJETIVOS El alumno utilizará el método de destilación para separar sustancias de una mezcla líquida. Comparar las características del estado líquido y gaseoso. FUNDAMENTO La destilación consiste en separar las sustancias que se encuentran en una mezcla líquida. El soluto puede ser sólido, líquido o gas, y el solvente es un líquido. Consiste en evaporar una sustancia y luego condensarla; la primera sustancia que se separa de la mezcla en forma de gas, es aquella que tiene el punto de ebullición más bajo, luego se recupera condensándola para obtenerla en forma líquida. El líquido a destilar se denomina destilando, el líquido que queda después de ser destilado es un residuo y el líquido que se recoge es el destilado. Existen distintos tipos de destilación, que se aplican dependiendo de las características de las sustancias que se requieren separar de la mezcla; entre ellos están, destilación simple, fraccionada (cuando hay varias sustancias volátiles). Como regla general, para que una mezcla pueda separarse por destilación simple, debe tener una diferencia entre sus puntos de ebullición que sea mínimo de 10ºC entre los componentes. Figura 16. Montaje para destilación sencilla (Fuente: Elaboración propia) 62 MATERIALES - 1 columna refrigerante - 1 matraz balón de fondo plano - - 1 conexión de tipo "y" esmerilada mangueras látex -1 - 1 probeta de 10 ml adaptador para termómetro 1 equipo de (tapón de hule horadado) - 1 pipeta de 5 ml - 2 soportes universales - 1 perilla de hule - 2 pinzas de 3 dedos - 1 parrilla eléctrica - 1 tina de baño María REACTIVOS - 1 termómetro - 5 ml de vino recirculación y TÉCNICA Coloca en el matraz balón 5 ml de vino tinto Arma el aparato que se indica en la figura 16 Llena de agua fría el refrigerante Calienta suavemente el matraz balón Cuando empiece a ebullición suave, observe atentamente el líquido que empieza a condensarse, en el refrigerante y anote la temperatura. Descarta las primeras 5 gotas de destilado Siga destilando hasta obtener aproximadamente 1 ml de destilado Apaga la parrilla y desatornille cuidadosamente el tapón que sostiene al termómetro Anota sus observaciones. CUESTIONARIO PREVIO 1. ¿Qué bebidas alcohólicas se fabrican mediante destilación? 2. ¿Cuál es la característica previa que se debe conocer para poder realizar una separación por destilación? 3. Describe brevemente el proceso de la destilación 4. ¿De qué depende el grado de separación producido por una destilación? 5. ¿Cuáles son los principales cuatro métodos de destilación? 6. ¿Cómo seleccionar el método más adecuado? 7. Menciona algunos ejemplos en la industria donde se utiliza la destilación. RESULTADOS BIBLIOGRAFÍA 63 HOJA DE INFORME 1. Menciona 10 métodos de separación de mezclas: 2. ¿En qué consiste el método (proceso) de destilación? 3. ¿Qué olor y color tenía el destilado? 4. ¿Qué color y olor tenía la solución que quedó en el matraz? 5. La destilación ¿es un cambio físico o químico? 6. Anota 3 ejemplos de mezclas que separarías por destilación: 7. ¿Por qué se dice que el proceso de destilación simple es un proceso de baja eficiencia? 8. ¿Qué contienen los residuos de la destilación? 64 PRÁCTICA 4 Métodos de separación y purificación de compuestos químicos. Cristalización y recristalización. OBJETIVOS El alumno aplicará los métodos de cristalización y recristalización de compuestos químicos en la separación y purificación de ácido acetilsalicílico de una tableta de aspirina. Determinará la eficacia y eficiencia del proceso para la separación y purificación del ácido acetilsalicílico. FUNDAMENTO Uno de los métodos empleados para separar compuestos químicos sólidos de una disolución es la cristalización. Esta técnica se fundamenta en las diferencias de solubilidad de los compuestos sólidos en un disolvente líquido. La cristalización se utiliza en gran escala en diversos procesos industriales. Un ejemplo es la cristalización de la sacarosa (azúcar de mesa) a partir del jugo de caña o la cristalización del cloruro de sodio (sal común) a partir del agua de mar. Mediante este proceso se separa de la mezcla el compuesto químico sólido de interés. Para obtener una mayor purificación del compuesto químico cristalizado se emplea el proceso de recristalización, aquí, la sustancia sólida cristalizada se disuelve por completo en el mínimo volumen de disolvente caliente; como esta disolución caliente contiene más soluto que el que puede haber en la disolución saturada, se denomina disolución sobresaturada; posteriormente se deja enfriar lentamente, así, la solubilidad disminuye, provocando que la concentración exceda el límite de solubilidad y que el soluto se separe de la disolución formando cristales. La solubilidad se define como la cantidad máxima de soluto que puede disolverse en determinado volumen de disolvente a una temperatura específica. Durante la recristalización se forma un retículo cristalino que deja fuera a moléculas de tamaño o formas diferentes; de este modo, las impurezas permanecen en la disolución y el compuesto químico recristalizado es puro. 65 Cabe mencionar que una tableta de aspirina tiene como ingrediente activo el ácido acetilsalicílico cuyas propiedades son analgésicas, sin embargo, los medicamentos también contienen otro tipo de ingredientes que no contienen propiedades terapéuticas y que se incluyen en la fórmula del producto para darle determinadas características (sabor, consistencia, entre otros) es por ello que la fórmula del medicamento, sin especificar cada uno de ellos, hace referencia a estos ingredientes con los términos de excipiente. Para este caso se considera que el contenido de la tableta de Aspirina es de 500mg de compuesto activo y un excipiente. MATERIALES -1 probeta graduada de 25 ml -1 espátula -1 probeta graduada de 10 ml -1 charolita de aluminio -4 vasos de precipitados de 50 ml -1 pinzas para crisol -1 agitador de vidrio -1 aparato de Fisher-Johns -1 parrilla de calentamiento -2 cubreobjetos para determinar el -1 piseta punto de fusión -1 embudo de vidrio -1 baño de hielo -1 anillo de hierro para el embudo -Papel filtro de vidrio -Papel pH -1 vidrio de reloj -Piedras de ebullición -1 baño María -Balanza -1 embudo Büchner (de 5 cm de REACTIVOS diámetro) -2 Tabletas de 500 mg de Aspirina -1 matraz kitasato de 125 ml efervescente -1 manguera gruesa para vacío -Ácido clorhídrico concentrado -1 pinza de 3 dedos -Agua destilada TÉCNICA Mide con la probeta 25 ml de agua destilada en un vaso de precipitados. Lee la información proporcionada en la caja del medicamento y anota los resultados y la fórmula de la tableta de Aspirina. Pesa la tableta y disuélvela en el vaso de precipitados, agitando la mezcla. Acidifica la disolución añadiendo, gota a gota HCl concentrado, hasta un pH de 1. Evita el contacto con la piel. Agita la mezcla, agita la mezcla constantemente para no excederte de ácido. Con esto se cristaliza el ácido acetilsalicílico. 66 Agrega 3 piedras de ebullición y calienta la mezcla suavemente en la parrilla eléctrica (con precaución) hasta que se disuelvan completamente los cristales de ácido acetilsalicílico. Evita el calentamiento excesivo y procura que la pared del vaso se encuentre limpia en todo momento, de no ser así, añade agua destilada caliente. Cuando no haya impurezas insolubles, retira el vaso y tápalo con un vidrio de reloj y déjalo enfriar a temperatura ambiente, sin moverlo. La disolución al enfriarse recristaliza el ácido acetilsalicílico, para que termine este proceso se deja en un baño con hielo por unos minutos. Corta y pesa un círculo de papel filtro del diámetro necesario para cubrir todos los orificios del embudo de Büchner, sin que se doble en la pared; humedécelo con agua destilada para mejor adherencia, luego adapta el matraz Kitasato al embudo para comenzar con el filtrado al vacío de los cristales. Utiliza una manguera gruesa para conectar el matraz y hacer vacío, abrir lentamente la llave del mismo y verter la mezcla, para transferir todos los cristales se puede usar una espátula, con la intención de recuperar todos los cristales. Luego cerrar la llave de vacío y lavar los cristales añadiendo 10 ml de agua destilada fría, abrir de nuevo la llave de vacío y dejarla así unos minutos. Para secar los cristales se transfiere el papel filtro a una charolita de aluminio para secarlos por 5 minutos en la estufa a 80º, luego hay que dejar enfriar y pesar el papel. Con el aparato de Fisher-Johns se determina el punto de fusión del ácido acetilsalicílico recristalizado, comparándolo con el reportado en la literatura se observa la eficacia del proceso. Calcula el porcentaje recuperado (rendimiento). CUESTIONARIO PREVIO 1. ¿Cómo piensas que se purifica la sal común o el azúcar? 2. ¿Crees que exista alguna diferencia entre la cristalización y recristalización? 3. ¿Cuáles son las etapas del método de recristalización? 4. ¿Cómo se presenta la concentración de la disolución para poder recristalizarla? 67 5. Al realizar la disolución; ¿Cómo debe ser el compuesto sólido que se va a recristalizar? 6. ¿En qué consiste la filtración por gravedad? 7. ¿Cómo se realiza el filtrado al vacío? 8. ¿Cuáles son las opciones para facilitar el secado de los cristales? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. Fórmula de la tableta de Aspirina®: 2. Peso de la tableta de la Aspirina®: 3. Peso del papel filtro: 4. Peso de la cápsula: 5. Peso del papel filtro, la cápsula y los cristales de ácido acetilsalicílico: 6. Peso del ácido acetilsalicílico recristalizado: 7. Aspecto de los cristales 8. Punto de fusión del ácido acetilsalicílico: 9. Cálculo del porcentaje recuperado del ácido acetilsalicílico: 10. La tableta de Aspirina ¿es una mezcla o un compuesto puro? ¿Por qué? 11. ¿Cómo fue la eficacia y eficiencia del método empleado para la separación y purificación del ácido acetilsalicílico de la tableta de Aspirina®? 12. ¿Qué características deben tener los componentes de una mezcla para que a través de un proceso de cristalización sea posible separarlos? 13. ¿Por qué deben neutralizarse los residuos antes de verterlos al drenaje? 68 PRÁCTICA 5 Elemento, compuesto, mezcla OBJETIVO El alumno diferenciará lo que es un compuesto, una mezcla y un elemento, estudiando algunas de sus propiedades. FUNDAMENTO Lavoisier definió un elemento como una sustancia que no puede descomponerse por medio de alguna reacción química en sustancias más sencillas. Un compuesto es una sustancia conformada por dos o más elementos combinados químicamente en proporciones de masa definidas. Una mezcla es un material que puede separarse por medios físicos en dos o más sustancias. A diferencia de un compuesto, una mezcla tiene composición variable. Pueden clasificarse en heterogénea; que consiste en partes físicamente distintas y cada una con propiedades diferentes y mezclas homogéneas (también conocidas como disolución) cuando es uniforme en sus propiedades en todas las muestras dadas. REACCIONES 2HgO 2Hg + O2 Fe (s) + S FeS S (s) + O2 SO2 (g) + O2 SO3 -2 astillas de madera (tomadas de MATERIALES un abatelenguas dividido a la mitad) -Lentes de seguridad -1 agitador de vidrio -1 soporte con anillo y rejilla de -1 pinzas de 3 dedos asbesto -1 imán -1 mechero de Bunsen -1 pinzas de crisol REACTIVOS: -1 mortero con pistilo -100 mg de óxido de mercurio II -1 vidrio de reloj -100 mg de azufre en polvo -2 tubos de ensaye -100 mg de hierro en polvo 69 TÉCNICA Elemento y compuesto Coloca 100 mg de óxido de mercurio (HgO) en un tubo de ensaye y con ayuda de las pinzas acércalo a la flama del mechero. (Se debe tener cuidado que la boca del tubo no apunte directamente a tus compañeros ya que al calentar a la flama directa la boca del tubo puede proyectar el contenido) Al momento de observar el comienzo de la reacción, introduce al tubo una astilla de madera con punto de ignición. Explica lo que sucede. Calienta hasta que la reacción se lleve a cabo por completo. Espera a que el tubo se enfríe y luego raspa las paredes del mismo con el agitador. Mezcla y compuesto: Mezcla homogéneamente 100 mg de azufre en polvo y 100 mg de hierro en polvo en un mortero. Describe las características. Luego separa un poco de la mezcla en una charolita de papel y acerca un imán. Escribe tus observaciones. Regresa lo más que se posible de la mezcla al tubo de ensaye y con las pinzas para tubo de ensaye calienta sobre la flama del mechero. Describe todo lo observado en los cambios de la reacción, compara con las características iniciales y registra. Mantén el calentamiento hasta que se inicie la incandescencia de la mezcla y deje de observarse desprendimiento de humo. Coloca la mezcla obtenida en un mortero y pulveriza, aproxima un imán y observa. CUESTIONARIO PREVIO 1. ¿Qué es un elemento? 2. ¿Cuántos son los elementos existentes? ¿Cuántos existen en la Tierra? ¿Cuántos han sido creados por los científicos? 3. ¿Cómo se clasifica la materia? 4. ¿Qué es un compuesto? 5. ¿Qué es una mezcla? 6. ¿Cuáles son las diferencias que hay entre mezcla y sustancia? RESULTADOS BIBLIOGRAFÍA 70 HOJA DE INFORME 1. ¿Qué pasó al introducir la astilla al tubo de ensaye? 2. ¿Cuáles son las características de la mezcla resultante al calentar el HgO (II)? 3. Describe las características de los reactivos y la mezcla obtenida. 4. ¿Qué ocurrió cuando se acerca el imán a la mezcla de azufre e hierro? Y ¿cómo cambia la apariencia antes y después del calentamiento? 5. Describe las características del líquido formado en las paredes del tubo de ensaye al calentar HgO (II), identifica y escribe qué es. 6. El punto de ignición se incrementa al introducir la astilla en el tubo, esto ocurre por la presencia de un elemento obtenido por la descomposición de HgO (II) Anota el nombre. 7. ¿Qué ocurre al calentar el HgO (II)? Investiga y completa la reacción química y los elementos obtenidos. 8. ¿Por qué se presenta el comportamiento en la mezcla de hierro y azufre al acercar el imán? 9. Investiga y escribe la reacción química así como el nombre del compuesto formado al calentar la mezcla de hierro y azufre. 71 PRÁCTICA 6 Ley de la conservación de la materia OBJETIVO El alumno comprobará en forma experimental la ley de la conservación de la materia. FUNDAMENTO A finales del siglo XVII y durante la mayor parte del siglo XVIII, la combustión y las reacciones asociadas con ella se explicaban en términos de la teoría del flogisto. Dicha teoría fue totalmente rechazada por el químico francés Joseph Antoine Laurent Lavoisier (1743-1794). Los trabajos de Lavoisier se caracterizan por su modalidad sistemáticamente cuantitativa: hizo un uso constante de la balanza. El método cuantitativo supone, necesariamente, la validez de la ley de la indestructibilidad de la materia. Lavoisier enunció esta ley en forma específica de la forma siguiente: “…porque nada se crea en los procesos, sean estos naturales o artificiales, y puede tomarse como un axioma que en todo proceso existe igual cantidad de materia antes y después del mismo, permaneciendo constantes la cantidad y la naturaleza de los principios que intervienen, siendo todo lo que sucede, sólo cambios y modificaciones. Toda la técnica de las experiencias de química se dunda en este principio: debemos tener siempre un balance o igualdad exacta entre los principios que constituyen el cuerpo en examen y los que forman los productos del análisis mismo”. REACCIONES HCl(l) + NaHCO3(s) NaCl(s) + CO2(g) + H2O(l) HCl(l) + NaHCO3(s) + H2O(l) 2CO2(g) + NaCl(s) + NaOH(l) + 2H2O(l) 72 MATERIALES Etiquetas 1 balanza semianalítica Parrilla eléctrica 3 matraces de Erlenmeyer de 250 REACTIVOS (ml) Bicarbonato de sodio (NaHCO3) 3 globos grandes Ácido clorhídrico al 3.7% 1 probeta de vidrio de 100 (ml) Agua destilada 1 vaso de precipitados de 30 (ml) Tabletas de Alka- Seltzer 1 vaso de precipitaos de 250 (ml) Grenetina o polvo comercial para 1 mortero con pistilo gelatina. 1 espátula con mando de madera TÉCNICA Coloca en el matraz de Erlenmeyer (etiquetado como matraz 1) 20 ml de HCl al 3.7% empleando la probeta. En un vaso de precipitados pese 1g de NaHCO 3 y posteriormente, con mucho cuidado, vierta el bicarbonato en el interior del globo, cuidando que no quede en el vaso o se derrame. Ajusta el globo a la boca del matraz teniendo mucho cuidado de que no caiga dentro del matraz NaHCO3. Coloca el sistema en la balanza y pésalo (como se muestra en la siguiente figura) El valor obtenido será m1: Figura 17. Ley de la conservación de la materia (Fuente: Manual de química general, UNAM) 73 Sin retirar el sistema de la balanza, permita que caiga el NaHCO 3 en el matraz. Una vez terminada la reacción (cuando ya no se observe desprendimiento de gases), pesa nuevamente el sistema. El valor obtenido será m2. Para verificar que se cumple la ley de la conservación de la masa, compara los valores de m1 y m2. Coloca en el matraz de Erlenmeyer (matraz 2) 20 ml de agua destilada empleando la probeta. En el mortero coloca la tableta de Alka-Seltzer y tritúrala con ayuda del pistilo; posteriormente, con mucho cuidado vierta el Alka-Seltzer en el interior del globo, cuidando que no quede en el mortero o se derrame. Ajusta el globo a la boca del matraz teniendo cuidado de que no caiga Alka-Seltzer dentro del matraz. Coloca el sistema en la balanza y péselo. El valor obtenido será m1. Sin retirar el sistema de la balanza, permita que caiga el Alka-Seltzer en el matraz. Una vez terminada la reacción (cuando ya no se observe el desprendimiento de gases), pese nuevamente el sistema. El valor obtenido será m2. Para verificar que se cumple la ley de la conservación de la masa, compare los valores de m1 y m2. Coloque en el matraz de Erlenmeyer (matraz 3) 20 ml de agua destilada y 20 ml de HCl a 3.7% empleando la probeta. Repita los pasos de triturar y colocar la tableta en el globo, ajustarlo a la boca del matraz y pesarlo (m1) Deje que caiga el contenido y posteriormente pese. Con los datos obtenidos complete la siguiente tabla: Conten Globo Masa Masa ¿Cumple la ido 1 2 Ley la de Reacciones conservación de la materia? Matraz 20 1 ml 1g de de HCl NaHCO3 al 3.7% 74 Matraz 20 2 de H2O Alka-Seltzer Matraz 20 3 ml 1 tableta de ml 1 tableta de de H2O Alka-Seltzer y 20 ml de HCl al 3.7% Tabla 12. Ley de la conservación de la materia (Fuente: elaboración propia) En una balanza semianalítica pesa un vaso de precipitados de 250 ml y adiciónale 150g de agua potable embotellada. El valor obtenido será m1. En un vaso de precipitados de 100 ml, pesa cuidadosamente 13g de grenetina (o gelatina comercial de sabor); tal que 13g = m2. Calienta los 150g de agua con ayuda de una parrilla hasta aproximadamente 70°C. (No permita que hierva el agua, ya que eso causaría pérdida de la materia) Una vez que se tenga el agua caliente, adiciona los 13g de grenetina y agita manualmente con ayuda de una franela hasta que ya no se observen grumos. No se emplea un agitador ya que causaría pérdida de la materia. Cuando ya no se tengan grumos, retire la mezcla del calentamiento y deja enfriar hasta que se pueda tocar el exterior del vaso sin ayuda de la franela. Entonces coloque el vaso en un baño con agua helada hasta que se forme el gel completamente. Seque el exterior del vaso y pese. El valor obtenido será m 3. Verifique el cumplimiento de la ley de la conservación de la materia; es decir, compruebe que m1 + m2 = m3 CUESTIONARIO PREVIO 1. Enuncia las leyes ponderales. 2. Define estequiometria. 3. ¿Qué experimentos permitieron a Lavoisier enunciar la ley de la conservación de la materia? 75 4. ¿Cómo calcularías la fuerza de flotación que un fluido ejerce sobre un cuerpo sumergido en él? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. Describe las observaciones de cada uno de los globos. 2. Enuncia la ley de la conservación de la materia. 3. ¿A qué crees que se deben los ligeros cambios en las masas de cada uno de los experimentos? 4. ¿Por qué la ley de la conservación de la materia constituye un principio base para el balanceo de las ecuaciones químicas? 5. Describe las reacciones que llevó a cabo para desechar los residuos al drenaje 76 PRÁCTICA 7 Relación masa-masa OBJETIVO El alumno obtendrá experimentalmente la masa de los reactivos y del producto de una reacción química. FUNDAMENTO La relación masa-masa se presenta cuando está proporcionada la masa de alguna de las sustancias y hay que calcular la masa de otra que participa en la reacción química, independientemente de que sea reactivo o producto. Usualmente los cálculos ayudan a conocer, entre otras cosas, la cantidad de productos que se pueden obtener a partir de una reacción, aunque es común que cuando se realiza una reacción química se empleé en exceso alguno de los reactivos por lo que el producto obtenido depende del reactivo que no se encuentre en exceso, es decir el reactivo limitante. El reactivo que se consume por completo en una reacción se denomina reactivo limitante, mientras que el utilizado en mayor proporción se conoce como reactivo en exceso. El primero, es el que determina la cantidad de producto de la reacción química puesto que al consumirse totalmente ya no se forma más producto y por ello la reacción termina. Para una reacción química se proporcionan las cantidades de 2 o más reactivos y luego es necesario determinar cuál es el reactivo limitante, algunas recomendaciones son: -Obtener la cantidad de producto en moles o gramos que se forma a partir de cada reactivo. -El reactivo limitante es aquél que da la menor cantidad de producto, los demás se encuentran en exceso. -Para conocer la cantidad de reactivo en exceso se requiere conocer cuanta cantidad reacciona con el reactivo limitante. La diferencia que resulta con la cantidad de reactivo inicial es la sustancia que está sin reaccionar. 77 MATERIALES Tela de alambre con asbesto 1 vaso de precipitados 1 mechero de bunsen 1 pipeta de Pasteur con su bulbo REACTIVOS Balanza analítica 500 mg de hidróxido de sodio 1 agitador de vidrio 10 ml de agua destilada 1 probeta de 10 ml 5 ml de ácido clorhídrico al 50 % 1 soporte con anillo de hierro Fenolftaleína al 1% TÉCNICA: Pesa el vaso de precipitados vacío y registra el dato, al cual llamaremos m1. Mida 10 ml de agua destilada; viértela en un vaso y pésalo nuevamente, registra el dato al que llamaremos m2. Por diferencia de pesos se obtiene la masa del agua. Pesa 500 mg de hidróxido de sodio (NaOH) y disuélvelos en el agua del vaso de precipitados; agrega dos gotas de fenolftaleína a la solución y agítala. Observa el color que adquiere la solución con la fenolftaleína y regístralo. Pesa el vaso de precipitados y registra el dato al cual llamaremos m 3 Con la pipeta Pasteur toma ácido clorhídrico y déjalo caer gota a gota en solución de hidróxido de sodio, agitando constantemente, hasta que desaparezca por completo el color que adquirió con la fenolftaleína. Pesa el vaso de precipitados con la mezcla obtenida en la reacción química anterior y registra el dato al que llamaremos m4. Determina, por diferencia de masas, la del ácido clorhídrico utilizado en la reacción. Sujeta el anillo metálico al soporte universal, acomoda la tela de alambre con asbesto y coloca el vaso sobre la tela de alambre. Enciende el mechero y calienta el vaso de precipitados con la mezcla hasta que el líquido se evapore por completo (con precaución). Observa el residuo que se formó en el fondo del vaso de precipitados, registra el color, olor y estado de agregación. Espera a que se enfríe el vaso de precipitados; pésalo nuevamente y registra el dato al cual llamaremos m5 Por diferencia obtenga la masa del residuo. CUESTIONARIO PREVIO 1. ¿En qué se basan los cálculos de las cantidades de productos o reactivos en las reacciones químicas? 78 2. ¿Qué describe una ecuación química? 3. ¿Qué es una relación masa-masa? 4. ¿Qué datos son necesarios para la resolución de problemas con una relación masa-masa? 5. ¿Qué es un mol? 6. ¿Qué es un coeficiente estequiométrico? 7. Enuncia la ley de la conservación de la materia. RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. ¿Cuál es la masa del agua (m2 - m1)? 2. ¿Por qué ocurre el cambio de coloración? 3. ¿Qué pasa al agregar el ácido clorhídrico? 4. ¿Cuál es la masa del ácido agregado (m4 – m3 )? 5. ¿Cuáles son las características del residuo formado después de la evaporación? 6. ¿Cuál es la masa del residuo (m5 – m4 )? 7. Defina el reactivo limitante y en exceso de esta práctica. 79 PRÀCTICA 8 Cálculo del rendimiento porcentual de una reacción química OBJETIVOS El alumno identificará las relaciones estequiometrias que existen entre reactivos y productos en una reacción química. Diferenciará los conceptos de reactivo limitante y reactivo en exceso, en una reacción química. Calculará las cantidades de reactivos que reaccionaron para producir una determinada cantidad de producto. Determinará el rendimiento porcentual de una reacción química. FUNDAMENTO En una gran cantidad de procesos químicos industriales es muy importante conocer la cantidad real de productos obtenidos, así como la cantidad teórica que se podría obtener a partir de cierta cantidad de reactivos. La estequiometria es una parte de la química que se encarga del estudio de este y otros aspectos. Cuando se efectúa una reacción, los reactivos comúnmente no están presentes en las cantidades estequiometrias, esto es, en las proporciones indicadas en la ecuación química balanceada. El reactivo que se encuentra en menor cantidad estequiometria se llama reactivo limitante y es el que limita la cantidad máxima de producto que se puede obtener ya que, cuando se acaba este reactivo, no se puede formar más producto. Los otros reactivos, presentes en cantidades mayores que aquellas requeridas para reaccionar con la cantidad del reactivo limitante presente, se llaman reactivos en exceso. El rendimiento porcentual describe la proporción del rendimiento real con respecto al rendimiento teórico y se define como: REACCIONES CuSO4 Zn(s) + + Zn ———> ZnSO4 + Cu 2 HCl (ac) ———> H 2(g) + ZnCl2 (ac) MATERIALES 2 probetas de I00 [ml]. 1 balanza semianalítica. 1 tubo de ensayo con tapón de hule. 80 2 soportes universales. 1 agitador magnético. 1 anillo metálico. 1 piseta. 1 pinza de tres dedos. 1 espátula con mango de madera. 1 jeringa de plástico de 5 [ml] con REACTIVOS aguja. Zinc metálico (Zn). 1 manguera de hule. Disolución comercial al 37.6 [%] en 1 recipiente de plástico. masa de ácido clorhídrico (HCl) y 1 tubo de vidrio de 5 [mm] de densidad de I.I9 [glcm3]. diámetro interno. Sulfato de cobre pentahidratado 2 vasos de precipitados de I00 [ml]. (CuSO4 * 5H2O). 1vaso de precipitados de 30 [ml]. Agua destilada. 1 parrilla con agitación. TÉCNICA Coloca en el tubo de ensayo 0.1 g de zinc metálico y adapta el tapón que tiene insertada la manguera de hule. Introduce la manguera de hule en una probeta llena con agua e invertida en un recipiente que también contiene agua (observe la figura). Evita que el interior de la probeta quede con aire. Figura 18. Recopilación de gases (Fuente: Manual de química general, UNAM) Adiciona 0.5 ml de la disolución comercial de ácido clorhídrico al tubo de ensayo, utilizando para tal fin una jeringa, con la cual perforará la manguera para adicionar el ácido. Se recomienda trabajar con mucha precaución ya que el hidrógeno es explosivo. 81 Mide y anota el volumen de hidrógeno gaseoso recolectado en la probeta. Calcula el volumen del hidrógeno gaseoso con base en la ley de los gases ideales y determine: a) El reactivo limitante. b) El rendimiento teórico. c) El rendimiento experimental o real. d) El rendimiento porcentual. En un vaso de precipitados de 100 ml, previamente pesado (peso del vaso = m1) coloca 0.5 g de CuSO4*5H2O, adiciona 40 ml de agua destilada, coloca el agitador magnético y pon en agitación. Evita que se salpiquen las paredes del vaso. Agrega, a la solución anterior, 0.3 g de zinc granular o en lentejas y continua con la agitación por espacio de 15 minutos, al cabo de los cuales ya habrá reaccionado todo el zinc. Retira el agitador magnético y anota sus observaciones. Espera a que sedimente todo el cobre y decanta el líquido, evitando en la medida de lo posible la pérdida de cobre. Para lavar el cobre obtenido, adiciona agua destilada, agita y espera a que sedimente el cobre para decantar el líquido. Repite esta operación dos veces. El cobre ya lavado que quedó en el vaso de precipitados, se seca por evaporación en la parrilla. NOTA: la evaporación debe ser con un calentamiento para evitar la ebullición del líquido. Una vez que se tiene el cobre completamente seco, se deja enfriar y se pesa junto con el vaso (m2). La cantidad de cobre producido se determina por diferencia de masas (mcu = m2 - m1) Determina, para la reacción entre el sulfato de cobre y el zinc: a) El reactivo limitante. b) El rendimiento teórico. c) El rendimiento experimental o real. d) El rendimiento porcentual. CUESTIONARIO PREVIO 82 Balancea las ecuaciones químicas siguientes y demuestra que se cumple la ley de la conservación de la masa. Ca (OH)2 + H3PO4 = Ca3 (PO4)2 + H2O Cr2O3 + Cl2 + C = CrCl3 + CO Establece las relaciones estequiométricas en gramos, en moles y en entidades fundamentales para las reacciones anteriores. ¿Cómo se determina cuál es el reactivo limitante en una reacción química? Da un ejemplo. ¿Cuál es la toxicidad del Cu y del Zn? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME ¿Cuáles serían algunas de las condiciones que se ajustan para aumentar el rendimiento de un producto deseado en la reacción? Explica cómo se determinan las siguientes condiciones en cada parte del experimento; El reactivo limitante. El rendimiento teórico. El rendimiento experimental o real. El rendimiento porcentual 83 PRÁCTICA 9 Nomenclatura química inorgánica OBJETIVO El alumno experimentará la síntesis de óxidos metálicos, hidróxidos, óxidos no metálicos y ácidos. Dará el nombre y la fórmula química de dichos compuestos químicos inorgánicos. Comprobará la obtención de hidróxidos y ácidos mediante la ayuda de indicadores ácido-base y obtendrá una sal a partir de un hidróxido y un ácido. FUNDAMENTO Los óxidos son compuestos que resultan de la unión del oxígeno con cualquier otro elemento, ya sea metálico o no metálico. El oxígeno actúa con número de oxidación 2 -, y los elementos combinados con el oxígeno utilizan números de oxidación positivos. Los óxidos metálicos tienen carácter básico, los óxidos de no metales reciben el nombre de óxidos ácidos. Los hidróxidos son compuestos ternarios formados por la combinación de metales con el ión hidróxido OH-, que actúa con número de oxidación 1 - . Se formulan y nombran siguiendo las normas básicas y empleando la palabra genérica hidróxido. REACCIONES Mg + O2 MgO MgO + H2O Mg (OH)2 SO2 + H2O H2SO3 NaOH + HCl H2O + NaCl 84 MATERIAL: REACTIVOS: Lentes de seguridad 1 cinta de magnesio 1 vaso de precipitados de 250 ml 100 mililitros de agua destilada 1 vaso de precipitados de 100 ml Fenolftaleína al 1% 1 pinza para crisol Papel pH 1 mechero de Bunsen Anaranjado de metilo 1 vidrio de reloj 1 g de Azufre en polvo 1 agitador de vidrio Gas doméstico y cerillos 1 cucharilla de combustión 5 ml de solución de NaOH 0.1 M 1 tapón de hule 10 ml de solución de ácido clorhídrico 1 matraz Erlenmeyer de 250ml 0.1 N. TÉCNICA: Para la obtención de un óxido metálico y un hidróxido: Identifica las zonas de la flama del mechero al encenderlo. Toma la cinta de magnesio con la pinza para crisol y pónla en la flama del mechero, cuidando que el polvo obtenido se deposite en el vidrio de reloj. En un vaso de precipitados coloca 5 ml de agua destilada y agrega el polvo obtenido, agita hasta que se disuelva por completo. Coloca una tira de papel pH y registre las observaciones. Agrega las gotas de la solución de fenolftaleína al vaso y registre. Para la obtención de un óxido no metálico y un ácido: En un matraz Erlenmeyer mide 50 ml de agua destilada y añade 20 gotas de solución indicador de naranja de metilo. Pon en la cucharilla de combustión 1 g de azufre en polvo, calienta en la flama de mechero hasta la aparición de vapores, sin inhalarlos. Inmediatamente introduce la cucharilla de combustión en el matraz con la solución original; sin sumergirla, el gas producido se disolverá para lo cual es necesario agitar circularmente. 85 Para la obtención de una sal: Agrega unas gotas de NaOH 1N hasta que cambie el color de la solución y el pH sea neutro (7) con esto se obtiene una sal. (Introduce en el matraz una tira de papel pH) Vierte el contenido del matraz en una cápsula de porcelana y calienta suavemente hasta que el agua se evapore y obtenga el residuo. Agrega las gotas de la solución de fenolftaleína al vaso y registra lo observado. CUESTIONARIO PREVIO 1. Define cada uno de los siguientes términos: a) Óxidos metálicos b) Hidróxidos c) Óxidos no metálicos d) Ácidos e) Bases f) Sales 2. ¿Cómo se otorga el nombre a los compuestos químicos inorgánicos? 3. ¿Qué es una fórmula química? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. Escribe el nombre de las reacciones efectuadas en la técnica. 2. ¿Qué ocurre cuando a un metal reacciona con oxígeno? 3. ¿Qué pasa cuando a un óxido metálico se le hace reaccionar con agua? 4. ¿Qué indica el cambio de coloración con la fenolftaleína? 5. Anota el nombre de la sustancia que quedó como residuo al final de la evaporación. 86 PRÁCTICA 10 Estequiometría OBJETIVO El alumno detectará las relaciones cuantitativas implícitas en una reacción química, estableciendo las relaciones masa-masa y calculando el volumen de uno de los productos obtenidos. FUNDAMENTO Estequiometría viene de vocablos griegos y significa la forma de medir y/o calcular la cantidad de materia en su forma de elemento o compuesto, que interviene en algún proceso químico de transformación, por lo que es la parte de la química encargad del estudio de las relaciones cuantitativas entre las sustancias que intervienen en una reacción química; se basa principalmente en el conocimiento de las fórmulas de los compuestos que intervienen, del balance de ecuaciones y las relaciones de masa que pueden presentarse. MATERIALES Balanza granataria 1 palillo de madera 1 tubo de ensaye REACTIVOS 1 mechero de Bunsen 1 g de Dióxido de Manganeso 1 pinza para tubo de ensaye 1g de clorato de potasio. TÉCNICA Pesa el tubo de ensayo limpio y seco, registre el dato. Coloca el clorato de potasio y el dióxido de manganeso en el tubo de ensayo, mezcla las sustancias y pesa de nueva cuenta el tubo con las sustancias, registrael dato. Toma el tubo con las pinzas y calienta la mezcla contenida en el tubo, introduce al tubo el palillo de madera con un punto de ignición, observa y registra lo que ocurre. Cuando la reacción termine, espera a que el tubo de enfríe, pesa el tubo y registra el dato. 87 CUESTIONARIO PREVIO 1. ¿Qué es la estequiometria? 2. ¿Qué es una reacción química? 3. ¿Cuáles son las relaciones cuantitativas que se pueden presentar en una reacción? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. ¿Cuál es el peso del tubo antes y después de colocar las sustancias? 2. ¿Qué ocurre al introducir un palillo en punto de ignición? 3. ¿Cuál es el peso después de que la reacción es completa? 88 PRÀCTICA 11 Eliminación de impurezas en aguas residuales OBJETIVO El alumno manejará algunos métodos físicos de separación de mezclas, tales como: decantación, filtración, adsorción y destilación. Someterá una muestra de agua residual a decantación, filtración por arenagrava, tratamiento con carbón activado y finalmente destilación. FUNDAMENTO Las aguas residuales son aquellas que contienen materiales indeseables, entre ellos restos de basura, agua de lavado usada, desperdicios de mataderos y de plantas de empacado de alimentos, así como disolventes orgánicos y productos químicos de desecho provenientes de viviendas, comercios e industrias. Es importante que estas aguas reciban un tratamiento primario para remover los desperdicios insolubles, la grasa y otros materiales, posteriormente un tratamiento secundario que consiste en la aireación de las aguas negras para fomentar el crecimiento de microorganismos que se alimentan de compuestos orgánicos que se encuentran en las aguas negras. Las sustancias que quedan en el agua después del tratamiento secundario pueden eliminarse mediante un proceso adicional que se conoce como tratamiento terciario. El propósito de éste es eliminar los contaminantes orgánicos, los nutrientes como iones fosfato y nitrato cualquier exceso de sales minerales. El objetivo principal del tratamiento terciario es que el agua de desecho sea tan pura como sea posible antes de devolverla al medio ambiente. El 30% de las aguas negras (residuales o de desecho) reciben sólo el tratamiento primario; el tratamiento secundario alrededor del 60%. Pocas veces se aplica el tratamiento terciario a las aguas residuales por ser muy costoso. El agua tratada puede usarse para el riego de hortalizas, pero no para consumo humano. MATERIALES 1 pinzas de Mohr 2 vasos de unicel 1 soporte 1 probeta de 50 ml 1 embudo 1 tozo de manguera de hule 2 vasos de precipitados de 250 ml 89 2 papeles filtro Pinzas de tres dedos 1 equipo de destilación o bien; un Anillo de hierro matraz Erlenmeyer, un tapón, un REACTIVOS condensador y un tubo de ensayo. Carbón activado Arena 100 ml de agua residual (preparada Grava por el profesor) Papel pH TÉCNICA Se emplearán cuatro técnicas para purificar el agua: 1) decantación, separación de agua y aceite. 2) filtración con arena-grava. 3) adsorción/filtración con carbón. 4) destilación -Mide el pH de la muestra de "agua de la llave", el pH del agua a la que se ha agregado una gota de ácido y el pH del agua a la que se ha agregado una gota de una base. -Coloca en una probeta graduada aproximadamente 50 ml de "agua residual", proporcionada por el profesor. Mide con exactitud su volumen y anótalo (con unidades) en la tabla de datos. -Examina las propiedades de la muestra: color, olor, transparencia, presencia de sólidos o zonas aceitosas. Compara las propiedades del agua potable y del agua destilada. Anota tus observaciones en la sección "antes del tratamiento" de la tabla de datos. Para la separación del agua y aceite: 1. Coloca un embudo sostenido con un anillo de hierro y un soporte. Inserta la punta del embudo en un trozo de manguera de hule. 2. Cierra el tubo de hule mediante unas pinzas de Mohr. Agita la muestra de agua sucia. Enseguida, vierte la muestra en el embudo y déjala reposar unos minutos hasta que sobrenade la fase aceitosa. (Unos golpes ligeros pueden ayudar a que las gotas de aceite flote libremente) 3. Abre con cuidado la manguera para vaciar la capa inferior en un vaso de precipitados de 250 ml. Cuando haya terminado de salir, cierra la manguera rápidamente. 4. Vierte la capa restante en otro vaso de precipitados (Fase aceitosa.) 90 5. Desecha la capa superior aceitosa. Observa las propiedades de la capa restante. Mide el pH y el volumen. Anota tus observaciones y datos. Guarda la muestra de agua para el procedimiento que sigue. 7. Lava el embudo con agua y jabón. Para la filtración con arena: 1. Con un clip desdoblado, haz pequeñas perforaciones en el fondo de un vaso de unicel. 2. Coloca en el vaso capas de arena y grava prehumedecidas (La grava del fondo impedirá que la arena se salga por las perforaciones. La grava de la parte superior evitará que la arena se agite al verter la muestra) 3. Vierte en el vaso, con cuidado, la muestra por filtrar. Recibe el filtrado (agua filtrada) en un vaso de precipitados. 4. Lava y recicla la arena y la grava ya usadas. 5. Observa las propiedades del agua filtrada y mide su volumen. Anota los resultados. Guarda la muestra para el procedimiento que sigue. Para la adsorción/filtración con carbón activado: 1. Dobla un papel filtro de papel en forma de cono. 2. Coloca el papel filtro doblado en un embudo. Humedece con agua "de la llave" ligeramente el papel para que se adhiera al cono del embudo. 3. Coloca el embudo sostenido por un anillo de hierro. Baja la pinza de 3 dedos manera que el tallo del embudo penetre unos 2 o 3 cm en un vaso de precipitados de 250 ml. 4. Coloca una cucharadita de carbón en un matraz Erlenmeyer de 125 o 250ml. 5. Vierte la mezcla de agua en el matraz. Agita vigorosamente. Enseguida agregar, poco a poco, el líquido a través del papel filtro. Conserva el nivel del líquido abajo del borde superior del papel filtro para que el líquido no fluya entre el papel y el embudo. 6. Si el filtrado se ve oscuro debido a pequeñas partículas de carbón, volver a filtrar el líquido. 91 7. Cuando la apariencia y el olor de la muestra de agua purificada sean satisfactorios, pasarla a una probeta graduada. Observa y anota sus propiedades. Mide el pH y anota el volumen final de la muestra. Para la destilación: 1. Construye un equipo de destilación. 2. Coloca dentro del matraz balón la muestra de agua. 3. Calienta suavemente, hasta que la mayor parte de la muestra de agua haya destilado. 5. Desecha la primera fracción del líquido destilado. No permitas que la muestra de agua en el matraz llegue a sequedad. 6. Construye una gráfica de temperatura contra el tiempo e identifica el punto de ebullición. Mide el pH y volumen de la muestra de "agua purificada" y anótalos en la tabla de datos. Mide también el pH de una muestra de agua destilada de la que se encuentra en el laboratorio. TABLA DE DATOS Agua residual Color Antes Transparenci Presencia Presencia a de sólidos de aceite Volumen pH del tratamiento Después de la separación de agua y aceite Después de la adsorción/ filtración con carbón Después de la destilación Tabla 13. Características del agua (Fuente: elaboración propia) 92 CUESTIONARIO PREVIO 1. ¿Cuáles son algunos de los tratamientos físicos que se utilizan para la separación de mezclas? 2. Describe cada uno de estos métodos. a) Decantación b) Filtración c) Adsorción/filtración con carbón activado d) Destilación 3. ¿Qué propiedad deben tener las sustancias para que puedan ser separadas por decantación? 4. Investiga cómo se obtiene el carbón activado. 5. ¿Por qué se desecha la primera fracción del líquido destilado? 6. ¿Por qué debe quedar líquido en el matraz al término de la destilación? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. ¿Qué porcentaje de la muestra original de agua sucia recuperó como agua "pura"? Porcentaje de agua purificada= (Vol. de agua purificada/ vol. de agua sucia) * 100 2. ¿Qué volumen de líquido se perdió durante la purificación? 3. ¿Qué porcentaje de la muestra original de agua sucia se perdió en la purificación? 4. Compara los resultados y datos de la purificación del agua con los de otros equipos de trabajo en el laboratorio, ¿cómo se podría evaluar el éxito de los distintos equipos? 5. Analiza la gráfica temperatura contra tiempo y localizar en ella el punto de ebullición. 6. La destilación no se utiliza en las plantas industriales de tratamientos ¿por qué? 7. ¿Existen diferencias entre el pH del agua destilada y el agua de la llave? Justifique su respuesta. 93 8. ¿Observaste alguna variación en el pH de la muestra después de cada tratamiento? ¿Por qué? 9. ¿Hubo variación en la conductividad eléctrica de la muestra a lo largo del proceso? Justifique su respuesta. 10. ¿A qué se llama agua potable? 11. ¿El agua purificada por Ud.es potable? Justifique su respuesta. 12. ¿Para qué se puede emplear el agua que acaba de purificar? 94 PRÀCTICA 12 Conductividad eléctrica de los electrolitos OBJETIVOS El alumno determinará la conductividad eléctrica de algunos electrolitos por el método celda de cobre-zinc FUNDAMENTO La conductividad es una propiedad que mide la facilidad con que los portadores de carga migran bajo la acción de un campo eléctrico. Para el caso de un conductor iónico, son los cationes y aniones de la solución los que intervienen en el transporte de la corriente y por lo tanto, el valor de la conductividad dependerá del número de iones presentes. Material Reactivos Barra de Cobre Alcohol (etanol) Barra de Zinc Ac. Clorhídrico 1 M Caimanes Acetona Batería Solución de amoniaco 1M 2 focos LED Azúcar Placa de porcelana Cloruro de Sodio TÉCNICA En la placa de porcelana se colocan tres soluciones de Cloruro de sodio, sacarosa y acetona respectivamente, esto se hace considerando que una solución electrolítica funciona como conductor de electrones. Se conectan dos caimanes en la batería; uno de ellos se queda libre y el otro es conectado a uno de los brazos del LED, el otro brazo está conectado al otro caimán. Simultáneamente se introduce en las soluciones uno de los extremos con el caimán libre, todo esto es con la intención de realizar un circuito cerrado: Figura 19. Circuito cerrado (Fuente: elaboración propia) 95 Se elaboró el mismo sistema para el circuito cerrado pero en los extremos se colocaron los electrodos de Zinc y Cobre (en lugar de la batería) y utilizando las soluciones restantes. CUESTIONARIO PREVIO 1. ¿Qué es un electrolito? 2. ¿Qué es un no electrolito? 3. ¿Qué es la conductividad eléctrica? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. ¿Cuáles de las sustancias utilizadas son electrolitos? 2. ¿Qué pasó con el LED al estar con cada una de ellas? Describe las observaciones correspondientes. 96 PRÁCTICA 13 Solubilidad, polaridad y su relación con el enlace químico. OBJETIVOS El alumno observará la disolución de algunas sustancias en una serie de disolventes con diferente polaridad. Explicará mediante pruebas de solubilidad con diferentes solutos y disolventes, el porqué de “lo similar disuelve a lo similar” FUNDAMENTO Desde el punto de vista químico, si se conoce el enlace de una sustancia, es posible predecir las características que debe tener su disolvente. El agua como sustancia esencial para la vida, debe muchas de sus propiedades como disolvente a su carácter polar, íntimamente relacionado con las características de sus componentes y su distribución espacial. Por consiguiente, el enlace químico y la posibilidad de disolver un sólido están relacionados. A continuación se efectuarán una serie de experimentos con el fin de explicar la relación entre enlace químico soluto y disolvente. MATERIALES 18 microconos Yoduro de potasio 0.1g 1 espátula Sulfato de cobre pentahidratado 1 gradilla 0.1g 6 pipetas Pasteur Disolventes: tetracloruro de carbono 1 piseta Disulfuro de carbono REACTIVOS Éter Solutos: cristales de yodo 0.1g Agua destilada. Azufre 0.1g TÉCNICA Coloca en 4 microconos una pequeña cantidad de cada uno de los solutos a utilizar (consultar la cantidad utilizada) Etiqueta del 1 al 4 cada serie de microconos. Son 4 series, cada una de las cuales corresponde a un disolvente (ver la tabla) 97 Agrega 0.5ml de cada uno de los disolventes a cada una de las 4 series. Anota todas las observaciones en la tabla. Agrega más disolvente cuando lo juzgue necesario (no más de 2 ml por tubo) Disolvente/ I2(s) S(s) Kl(s) CuSO45H2O(s) soluto Observaciones Observaciones Observaciones Observaciones CCl4 CS2 Éter Agua Tabla 14. Solubilidades (Fuente: elaboración propia) En un tubo de ensayo coloca 1 ml de CCl 4, ponlo en la gradilla. Agrega lentamente y gota a gota 1ml de éter en la misma forma. Anota tus observaciones. Sobre el mismo tubo, agrega 1 ml de éter en la misma forma. Anota las observaciones. ¿Cuántas fases se observan? ¿A qué se debe? En el tubo de ensayo que contiene yodo disuelto en tetracloruro de carbono (tabla 1) agrega lentamente con un gotero la disolución de sulfato de cobre en agua. ¿Qué se observa? Después, con otro gotero, añadir lentamente en el mismo tubo de ensayo la disolución de yodo en éter. NO AGITAR. Anota las observaciones. CUESTIONARIO PREVIO 1. ¿Qué es un disolvente? 2. ¿Qué es un soluto? 3. Define polaridad y ejemplos de sustancias que la presenten. 4. ¿Qué es un enlace químico? 5. ¿Qué es solubilidad? 6. ¿Todos los solutos se disuelven en todos los disolventes? De no ser así, ¿cuáles solutos se disuelven en cuáles disolventes? Justifica tu respuesta. 98 7. Explica; ¿por qué el amoníaco (NH3) es una molécula polar, si todos sus átomos terminales son iguales? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. ¿Cuáles son las características de cada uno de los reactivos utilizados en la técnica? 2. ¿Cuáles son compuestos polares? 3. ¿Cuáles se disolvieron? Explica el porqué. 99 PRÁCTICA 14 Titulación de un producto casero OBJETIVO El alumno aplicará el método de titulación en un análisis químico FUNDAMENTO La titulación es un método para determinar la cantidad de una sustancia presente en solución. Una solución de concentración conocida, llamada solución valorada, se agrega con una bureta a la solución que se analiza. La adición se detiene cuando se ha agregado la cantidad de reactivo determinada en función de un cambio de coloración en el caso de utilizar un indicador interno, a esto se le llama punto de equivalencia. MATERIALES REACTIVOS 1 matraz aforado de 50ml Vinagre casero (de caña, manzana o 1 pipeta graduada de 10 ml de vino) 1 bureta de 50 ml Hidróxido de sodio 0.1M (solución 1 pinza para bureta patrón normalizada) 1 pipeta Indicador fenolftaleína (1% p/v en 3 matraces Erlenmeyer de 125 ml etanol-agua al 50 1 vidrio de reloj TÉCNICA Toma 5 ml de vinagre y agregar 45ml de agua destilada. Coloca la muestra en un matraz Erlenmeyer de 125ml. Repite esta operación dos veces más (segundo y tercer matraz Erlenmeyer) Llena la bureta con la solución patrón de hidróxido de sodio, 0.1M enjuagándola previamente con un poco de la solución patrón que se desecha. Ajustar el nivel a cero y controla que no se encuentren burbujas de aire en el cuerpo de la bureta o en la llave. Antes de iniciar la titulación agrega dos gotas de fenolftaleína a la solución por titular y registra el color de la solución. 100 Procede a titular con la solución de hidróxido de sodio 0.1M. Controla que la punta de la bureta no esté situada arriba de 3 o 4 cm de la superficie de la solución por titular, de manera que la caída de reactivo titulante no provoque salpicaduras. Durante la titulación agita manual y suavemente el matraz Erlenmeyer después de cada adición. Registra los cambios de color del indicador y el volumen “gastado” de solución patrón en el momento en que se observa un cambio y hasta que el nuevo color deja de variar. NOTA: el “punto final” de la titulación se logra cuando una gota de NaOH produce el cambio para que permanezca el color. Repite el procedimiento con las otras dos muestras. Determina el contenido de ácido acético del vinagre. CUESTIONARIO PREVIO 1. ¿Cuáles son las propiedades de los ácidos y las bases? 2. Define las características de: a) Ácidos fuertes b) Ácidos débiles c) Bases fuertes d) Bases débiles 3. ¿Qué es una titulación? RESULTADO BIBLIOGRAFÍA HOJA DE INFORME No. de muestra Lectura bureta de 1 2 3 la (punto final/ml) Concentración NaOH (reactivo 101 titulante) Concentración (g/l) de ácido acético % (p/vol.) ácido acético Tabla 15. Valores de titulación (Fuente: elaboración propia) 1. Molaridad promedio ácido acético_______ 2. % (peso/volumen) promedio ácido acético_______ 3. Realiza los cálculos para determinar la molaridad del ácido acético y porcentaje de acidez del vinagre. 4. ¿Cuál es la razón por la que generalmente se recomienda guardar la disolución de hidróxido de sodio en envase de plástico? 102 PRÁCTICA 15 Suspensiones, coloides y disoluciones OBJETIVOS El alumno diferenciará algunas de las propiedades de los diferentes tipos de dispersiones, disoluciones y coloides. Clasificará algunas mezclas como suspensiones, coloides o disoluciones Apreciará el efecto Tyndall. FUNDAMENTO Las mezclas o dispersiones se pueden clasificar, según el tamaño de las partículas de la fase dispersa, en: disoluciones, coloides y suspensiones. En una disolución verdadera hay partículas de líquido, sólido o gas (fase dispersa) disueltas en otro líquido, sólido o gas (fase dispersante), pero las partículas no se alcanzan a distinguir a simple vista porque son muy pequeñas. En una suspensión las partículas se logran apreciar a simple vista o con un microscopio, y las partículas son tan grandes que, si se dejan reposar, sedimentan. Las partículas de un coloide se encuentran entre los tamaños de estas dos primeras. No se logran distinguir a simple vista, pero tienen propiedades que nos permiten diferenciarlas de las soluciones. Los coloides tienen una propiedad óptica exclusiva, que se conoce como el efecto Tyndall: debido al tamaño de las partículas, éstas funcionan como espejitos que reflejan la luz, lo que nos permite ver la trayectoria de un rayo de luz que pasa a través del recipiente en el que se encuentra el coloide, en tanto que las soluciones son completamente transparentes (no se observa el rayo de luz en el recipiente), y las suspensiones, debido al gran tamaño de las partículas, suelen ser opacas. El efecto Tyndall se puede apreciar cuando entra un rayo de sol por la ventana en un cuarto que está oscuro, pues se pueden ver partículas de polvo suspendidas en el aire, que forman un sistema coloidal. 103 MATERIALES: 1 gradilla 1 caja pequeña de cartón (como las REACTIVOS: de cereal de porción individual) Agua (H2O) destilada 1 linterna de mano con foco y pilas Alcohol etílico que den una buena intensidad de luz Azúcar de mesa 6 Leche tubos de ensayo de aproximadamente 8 mL Detergente en polvo 1 probeta de 10 mL Arena (fina) 1 gotero TÉCNICA Etiqueta los tubos de ensayo en la parte superior, del 1 al 6, y llénalos de la siguiente forma: TUBO CONTENIDO 1 6 mL de agua 2 6 mL de agua + 0.3 g de azúcar 3 6 mL de agua + 5 gotas de leche 4 6 mL de agua + 0.3 g de arena 5 6 mL de agua + 0.3 g de detergente en polvo 6 6 mL de agua + 5 gotas de alcohol Agita suavemente cada uno de los tubos durante un minuto y después déjalos reposar unos minutos. Clasifica los tubos que sedimentan como suspensiones. Los que no sedimentan, somételos a la siguiente prueba. Recorta en la caja de cartón los siguientes orificios de la siguiente figura: 104 Figura 20. Efecto Tyndall (Fuente: elaboración propia) Introduce por los orificios de la parte superior de la caja: el tubo 1, que contiene agua, y el tubo 2, que contiene una disolución. Ilumina los tubos con la linterna de mano, a través del orificio indicado para ello. Por la ventana del costado, mirando en forma perpendicular al rayo de luz, observa la diferencia entre ambos. a. Compara el tubo 3, que contiene un coloide, con el 2 y con el 1. Observa la diferencia entre ellos y describe en qué consiste el efecto Tyndall. b. Introduce de uno en uno todos los demás tubos para que puedas clasificar a las dispersiones como coloides o como disoluciones verdaderas. CUESTIONARIO PREVIO 1. Define los siguientes conceptos: a) Suspensiones b) Coloides c) Soluciones 2. ¿Qué pruebas necesitarías hacer para clasificar una mezcla como coloide, suspensión, o solución? 105 RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. En las pruebas realizadas; 2. ¿Cuáles mezclas resultaron ser soluciones? 3. ¿Cuáles coloides? 4. ¿Cuáles suspensiones? 5. ¿Cómo realizas la clasificación? 6. Escribe un ejemplo de cada tipo de dispersión e indica qué características de ésta te permite clasificarla como tal. 106 PRÁCTICA 16 Principio de Le Chatelier OBJETIVO El alumno observará la reversibilidad de algunas reacciones, verificará el principio de Le Chatelier y comprobará que la posición de equilibrio se puede alterar modificando diferentes factores como la concentración y la temperatura. FUNDAMENTO El Principio de Le Chatelier, se refiere a que un estado de equilibrio químico es mantenido en tanto no se alteren las condiciones del sistema. Cuando se modifica algún parámetro, (presión, temperatura o la concentración de algunas de las especies) el equilibrio se traslada en cierta dirección (hacia los reactivos o hacia los productos) hasta alcanzar un nuevo estado de equilibrio. Se enuncia así: “Cuando una reacción en equilibrio sufre una alteración de condiciones, las proporciones de los reactivos y de los productos se ajustan de manera de minimizar el efecto de la alteración.” Para un sistema en equilibrio químico, la variación de concentración de uno de los componentes constituye una fuerza. Los cambios de presión pueden ejercer considerable efecto sobre la posición de equilibrio, o casi ningún efecto en absoluto. Por ejemplo, un aumento en la presión de un sistema en que ocurre el siguiente equilibrio la reacción se trasladará para el lado con menor número de moles de gas. Por otra parte, si la presión disminuye, la reacción se trasladará para el lado con mayor número de moles de gas. Si en el sistema donde sucede una reacción se eleva la temperatura, la reacción se trasladará hacia el lado que absorba calor (reacción endotérmica). Por otro lado, si la temperatura disminuye, la reacción se trasladará para el lado que desprenda calor (reacción exotérmica). MATERIALES 2 pipetas de plástico 3 tubos de ensayo 1 gradilla 2 vasos de precipitados de 10ml 2 vasos de precipitados de 400 y 1 probeta de 10 ml 600ml 107 Jeringa (la más grande) Nitrato de plata REACTIVOS Hidróxido de sodio Tiocianato de potasio Alambre de cobre Cloruro férrico Hielo REACCIONES FeCl3 + 6 KSCN ↔ K3 [Fe (SCN)6] + 3KCl Cu(s) + 4 HNO3 (aq) → Cu (NO3)2(aq) + 2 NO2 (g) + 2H2O (I) 2 NO2 ↔ N2O4 + CALOR TÉCNICA Para el desplazamiento del equilibrio al modificar la concentración de reactivos en una reacción en solución: Mide en una probeta 4 ml de solución de tiocianato de potasio (KSCN) y viértelos en un vaso de precipitados de 10 ml. Agrega 4 gotas de solución de cloruro férrico (FeCl 3). El color rojo observado se debe a la presencia del complejo K 3 [Fe (SCN)6], llamado tiocianato de potasio o hexatiocianoferrato (III) de potasio. Al aumentar la concentración del Fe3+ (FeCl3) o del SCN- (KSCN), el equilibrio se desplaza hacia la derecha, lo cual se nota en el aumento en la intensidad del color rojo debida a la formación de mas K3 [Fe (SCN)6] . si se elimina Fe3+ o SCN- de la solución, el equilibrio se desplazara hacia el lado izquierdo de la ecuación, por lo que la solución tendrá un color más claro debido a la desaparición del K 3 [Fe (SCN)6]. Cuando se agrega a la solución nitrato de plata (AgNO 3), el ión plata Ag+ forma un precipitado blanco de AgSCN que retira al SCN- de la reacción en equilibrio, lo que desplaza el equilibrio hacia la izquierda y disminuye la intensidad del color rojo. Etiqueten tres tubos de ensayo marcándolos como 1, 2,3. Vierta en cada uno 0.5 ml del contenido del vaso de precipitados. Toma el tubo 1 como control para comparar los cambios de color en el medio de reacción. En el tubo 2 agrega unas gotas de FeCl 3. Anota las observaciones. Agrega al tubo 3 unas gotas de solución de AgNO3. Anota las observaciones. 108 Al tubo 3 agrega ahora unas gotas de FeCl3 y unas gotas de AgNO3. Anota las observaciones. Para el desplazamiento del equilibrio de una reacción en fase gaseosa al variar la temperatura: Mide 5 ml de solución de hidróxido de sodio 1 M y viértelos en un vaso de precipitados de 10 ml, previamente etiquetado como NaOH. Prepara una jeringa para la obtención de gases. Coloca varios trocitos de alambre de cobre de unos 0.5 cm de longitud, en la tapa plástica para reactivos sólidos, luego introduzca la tapa en el cuerpo de la jeringa. Trabaja en la campana de extración o en un lugar bien ventilado y utiliza guantes para proteger tus manos del contacto con el ácido nítrico. Toma con la jeringa 1 ml de ácido nítrico concentrado, tapa la jeringa y agítala. Notaras la formación de un gas de color café; es el dióxido de nitrógeno (NO2). Gira la jeringa de manera que la punta quede hacia arriba. Si el volumen del gas llega a 15 ml, destapa la jeringa para evitar que la presión del gas bote el émbolo. Gira la jeringa 180º y desecha el exceso de reactivo líquido en el vaso de precipitados que contiene la solución NaOH 1M. Tapa la jeringa para evitar que el gas escape. Repite la operación para tener dos jeringas llenas con NO 2. El gas formado, NO2, de color café, está en equilibrio con su dímero N 2O4, que es incoloro. La reacción es exotérmica, por lo que en este caso el calor puede considerarse como un producto; de este modo, al retirar calor del sistema se notara que el color del gas se desvanece por la formación del dímero incoloro (N 2O4), ya que el equilibrio se desplaza hacia la derecha para compensar la pérdida de calor. Por otra parte, al proporcionar calor al sistema, se agrega un “producto”, con lo que el equilibrio se desplaza hacia la izquierda y se percibe un aumento en el color café del gas dentro de la jeringa. Utilizando dos vasos de precipitados de 400 ml, prepara un baño de hielo/agua y otro de agua hirviendo. 109 Conserva una de las jeringas como testigo para comparar el color original del gas, e introduce la otra en el baño de hielo. Sostén firmemente el émbolo de la jeringa en la posición que tiene a temperatura ambiente para evitar variaciones en el volumen que ocupa el gas. Anota tus observaciones. Introduce la jeringa en el baño de agua hirviendo y sostén firmemente el émbolo de la jeringa para evitar variaciones en el volumen que ocupa el gas. Anota tus observaciones. CUESTIONARIO PREVIO 1. ¿Cuál es el principio de Le Chatelier? 2. ¿Cómo se presenta la reversibilidad de reacciones? 3. ¿Qué es un equilibrio químico? 4. ¿Cómo influyen la concentración y temperatura en una reacción? 5. ¿Cuándo se establece el equilibrio en una reacción reversible? RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME Desplazamiento del equilibrio al modificar la concentración de reactivos en una reacción en solución: 1. Describa que observa al mezclar: a) cloruro férrico con tiocianato de potasio b) nitrato de plata añadido a la mezcla anterior c) cloruro férrico a la mezcla formada Desplazamiento del equilibrio de una reacción en fase gaseosa al variar la temperatura 2. ¿A qué se deben los cambios que se observan? 3. ¿Qué se observa cuando la jeringa que contiene dióxido de nitrógeno se introduce en el baño de hielo/agua y en el baño de agua hirviendo? Explica por qué. 4. Escribe las ecuaciones para la constante de equilibrio K para las reacciones que se llevaron a cabo en la experimentación. 110 PRÁCTICA 17 Efecto de la concentración y temperatura sobre la velocidad de reacción. OBJETIVO El estudiante determinará el efecto ejercido por la concentración y temperatura sobre la velocidad de reacción química. Al finalizar la experimentación reportará las gráficas correspondientes en cada caso. FUNDAMENTO La temperatura es una magnitud referida a las nociones comunes de caliente, tibio o frío que puede ser medida con un termómetro. En física, se define como una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como «energía cinética», que es la energía asociada a los movimientos de las partículas del sistema, sea en un sentido transnacional, rotacional, o en forma de vibraciones. A medida de que sea mayor la energía cinética de un sistema, se observa que éste se encuentra más «caliente»; es decir, que su temperatura es mayor. En química, la concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada está. TÉCNICA: Para el efecto de la concentración sobre la velocidad de reacción. Mide 50 ml de tiosulfato de sodio 0.3M y transvásalos a un matraz Erlenmeyer. Coloca el matraz sobre el papel blanco con una cruz entintada fuertemente. Mide 6 ml de HCl 2M y añádelos a la solución contenida en el Erlenmeyer, simultáneamente acciona el cronómetro. Agita con movimiento circular y deja reposar. Al desaparecer la marca observada a través de la disolución, detén el cronómetro y anota el tiempo y concentración empleados. 111 Repite el experimento, variando la concentración del tiosulfato de sodio de la siguiente manera: Na2S2O3 0.3M agua destilada Temperatura HCl 50ml 0ml 40ml 10ml 80° 6ml 30ml 20ml 70° 6ml 20ml 30ml 60° 6ml 15ml 35ml 50° 6ml 10ml 40ml 40° 6ml 5ml 45ml 30° 6ml 6ml Tabla 16. Valores de concentración (Fuente: elaboración propia) En todos los casos se emplea la misma cantidad de ácido clorhídrico. Con los tiempos obtenidos, calcula el valor de 1/T Para el efecto de la temperatura sobre la velocidad de reacción. Mide 5ml de tiosulfato de sodio 0.3M y pásalos a un matraz Erlenmeyer de 250ml.; diluye con 45ml de agua destilada y coloca el matraz sobre la hoja marcada. Añade 6ml de HCl 2M y pon en marcha el cronómetro, introduce el termómetro. Detén el cronómetro en el momento que desaparezca la marca y toma la temperatura de la mezcla. Repite el procedimiento anterior empleando las mismas cantidades de tiosulfato de sodio, agua destilada y ácido clorhídrico, sólo que antes de hacer la adición del ácido caliente suavemente hasta 30°C (la segunda muestra), 40°C la tercera, 50°C la cuarta, 60°C, 70°C, 80°C, y 90°C respectivamente cada muestra. El termómetro deberá ser sostenido en la mano evitando que toque el fondo del matraz. Ya que el trabajo es en equipo, para las lecturas de los tiempos y temperaturas, se recomienda que otra persona se encargue de estas operaciones. El tiempo debe considerarse desde el momento que se ha vaciado la pipeta. CUESTIONARIO PREVIO 1. ¿Qué es la velocidad de reacción química? 112 2. ¿Cuáles son los factores que intervienen en ella? 3. Define los conceptos de: a) Temperatura b) Concentración RESULTADOS BIBLIOGRAFÍA HOJA DE INFORME 1. Elaboración de gráficas 2. Con los datos obtenidos, construya las siguientes gráficas: 3. Concentración en función del tiempo. 4. Concentración del tiosulfato en función de 1/T 5. Grafique el tiempo de precipitación contra 1/T (temperatura) 113 5. BIBLIOGRAFÍA Alonso, J. H. (2004). Manual de prácticas de laboratorio de química. Aguascalientes. Aponte, A., Aguilar, R. y Austin de Sánchez, I. (2013). Trabajos prácticos en microescala como estrategia didáctica en cursos de química. Revista Electrónica "Actualidades Investigativas en Educación" , 1-19. Ávila, J. G., Gavilán, I. C. y Cano, S. (2011) Teoría y experimentos de Química Orgánica con un enfoque de Química Verde. México. Ávila, J., García, C., Gavilán, I., León, F., Méndez, J., Pérez, G., Rodríguez, A., Salazar, G., Sánchez, A., Santos, E., Soto, R., (2009). Química Orgánica; Experimentos con un enfoque ecológico. México: Dirección General de publicaciones y fomento editorial. Beran, J. (2009). Laboratory manual for principles of general chemistry. Texas: Wiley. Bernal, J., Beyhart, A., Correa, A., Gutiérrez, M., Serna, A. y Valdéz M. (2008) Manual de prácticas de química I y II. Universidad Autónoma de Aguascalientes. Departamento de Química. Brown, T. L., LeMay, H. E. y Bursten, B. E. (1991) “Química. La Ciencia Central”, Prentice & Hall; México. Carrillo, M. (1996) Microescala. Química General. Manual de Laboratorio. México, Pearson Educación. UNAM Catalá, R. y Chamizo, J. (1993). Enseñar seguridad es enseñar Química. Educación Química . 114 Cervantes, B. V. y Loredo, J. (2012) Manual de prácticas de química general en microescala. Cd.de México, Ed. Trillas. Universidad Iberoamericana Chang, R. (2007) Chemistry, 9ª. Ed., McGraw-Hill, Nueva York,. Clark, J. (1999). Green chemistry: challenges and opportunities. Journal of Green Chemistry , págs. 1-8. Dickson, T.R (1986) Química. Un enfoque ecológico, 1a. ed., México, Editorial Limusa,. Domínguez, M. Á. (2008). Química, la ciencia básica. Madrid: Thomson. García, M. Á., Cabildo, M. P., Claramunt, R. M., Cornago, M. P., Escolástico, C., Esteban, S., López, C., Pérez, J., Pérez, M. y Sanz, D., (2010) Reciclado y tratamiento de residuos. Madrid: UNED. Giraldo, R. D. (2009). Manual de técnicas de laboratorio químico. Colombia: Editorial Universidad de Antioquia. Gómez, A. R. (2002). Manual de laboratorio de química. Chihuahua. González, A. y Urzúa, C. (2012). Experimentos químicos de bajo costo: un aporte desde la microescala. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias , 401-409. Gutiérrez, F. L. (3 de marzo de 2013). Universidad Autónoma de Baja California Sur. Recuperado el 15 de octubre de 2013, de http://www.uabcs.mx/sdifusion/noticia_p/2259 Joaquín, C. C. (2013). Química básica para ingenieros. Zaragoza: UNE. Little, A.D. (1993). Report to the corporation of M.I.T. Silver Anniversary, Volume- A.I.C.H.E. 115 Martínez, J., Martínez, C. y Treviño, A. (2008). El cuidado de nuestro planeta: disminuyendo la generación de residuos peligrosos. Mixco AC de la academia a la sociedad , 8-12. Márquez Eduardo (2010) Química II. Cengage Learning. Editores Latinoamericanos. Merck, The Merck Index and Encyclopedia of Chemicals, Drugs and Biologicals, 14ª. Ed. Merck Research Laboratories, Whitehouse Station, Nueva York, 2006. Osorio, R. y Salvo, A. D. (2008,). Química verde: Un nuevo enfoque para las actividades experimentales de química. Multiciencias , 11-17. Pájaro, N. y Olivero, J. (2011). Química verde: un nuevo reto. Ciencia e Ingeniería Neogranadina , 169-182. Perry, R. H. y Green, D. W. (2001). Manual del ingeniero químico. Madrid: Mc Graw Hill. Picado, A. B. y Milton, Á. (2008). Química 1, Introducción al estudio de la materia. Costa Rica: EUNED. Ramírez, M. Y., García, A. G., y Cordero, M. Á. (2004). La química verde en México. Gaceta Ecológica , 35-44. Ramírez, J. H. (2006) Manual de prácticas de química I y II. Universidad Autónoma de Aguascalientes. Departamento de Química. Russell, J. B. y Larena, A (1990) “Química”, Mc Graw-Hill; México,. Santos, E. y Gavilán, I. C. (1997). Manual de procedimientos de seguridad. México. 116 Singh, M. M., Pike, R. M., Szafran, Z. ( 1995) “Microscale and Selected Macroscale Experiments for General and Advanced General Chemistry: An Innovative Approach”; First Edition, Edited by John Wiley &Sons, Inc., 1995. Tejión, J. M. y García, J. A. (1996). Química, teoría y problemas. Tebar. Valiente, A. (2011). La Química, la Ingeniería Química y su relación con otras disciplinas. Acta Universitaria , 11-18. 117