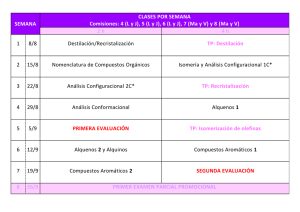
NOMENCLATURA DE LOS ALCANOS
Anuncio

UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 1 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUÍMICA INDUSTRIAL ENLACES QUÍMICOS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón COMPETENCIAS Conoce y maneja los conceptos propios del tema enlace químico Identifica las aplicaciones del enlace químico Reconoce y comprende cada tipo de enlace Resuelve los ejercicios propuestos CONCEPTUALIZACIÓN ENLACES QUÍMICOS Un enlace iónico es la fuerza electrostática que mantiene unidos a los iones en un compuesto iónico. Un átomo puede dar electrones a otro átomo de modo que ambos obtienen un octeto de electrones en su nivel de energía más externo. Si se considera la reacción entre el litio y el flúor para formar el fluoruro de litio. La configuración electrónica del litio es 1s2 2s1 y la del flúor es 1s22s22p5. Cuando dos átomos entran en contacto, el electrón de valencia 2s1 del litio se transfiere al átomo de flúor. Usando los símbolos de Lewis, la reacción se puede representar como: ◦ Li ◦◦ + ◦◦ F ◦ ◦◦ Li + ◦◦ ◦◦ F ◦◦ ◦◦ EJERCICIOS Utilizando los símbolos de Lewis y sobre la base de la configuración electrónica describa la formación de los siguientes compuestos: óxido de calcio CaO; óxido de aluminio Al2O3; fluoruro de sodio NaF; cloruro de calcio CaCl2 El enlace covalente es aquel en el que dos electrones son compartidos por dos átomos. En este tipo de enlaces cada electrón del par compartido es atraído por los núcleos de ambos átomos. ◦◦ ◦◦ F ◦◦ ◦◦ ◦ + ◦◦ F ◦ F F ◦◦ 1 Enlaces covalentes dobles son aquellos en los cuales dos pares de electrones son compartidos entre dos átomos. Represente el enlace para el C2H4 Los enlaces covalentes triples son aquellos en los cuales tres pares de electrones se comparten entre dos átomos Represente los enlaces para: N2 y C2H2 Escriba las estructuras de Lewis para cada uno de los siguientes compuestos: CO2; CH3I; COCl2; AsCl3; H2S; H2O Determine si los enlaces en los siguientes compuestos son iónicos o covalentes con base en la electronegatividad: H2S; KCl; MgO; H2, H2O; MgS; Cl2 Elabore los enlaces y diga si hay enlaces sencillos, dobles o triples: C2H6, C 3 H4, C4H2 CONSULTA: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Regla del octeto Electronegatividad y su relación con los diferentes tipos de enlaces químicos Enlaces covalentes coordinados y ejemplos Teoría del enlace valencia Hibridación de orbitales atómicos Teoría de la hibridación del carbono Que es un enlace covalente polar y covalente no polar elabore el enlace para H2SO4 y H3PO4 orbitales sp3 , el metano y el etano orbitales sp2 y la estructura del etileno o eteno orbitales sp y la estructura del acetileno o etino BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 2 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 2 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: QUÍMICA INDUSTRIAL NOMENCLATURA DE LOS ALCANOS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón AUTOR: COMPETENCIAS Nombra correctamente alcanos con base en lo dispuesto por la IUPAC Elabora correctamente las fórmulas de los compuestos químicos con base en la teoría. CONCEPTUALIZACIÓN NOMENCLATURA DE LOS ALCANOS Prefijo ------------- Sustancia principal ----------- Sufijo ¿Donde están los sustituyentes? ¿Cuántos carbonos tiene?¿A qué familia pertenece? Paso 1. Determinar cuál es el hidrocarburo principal. Encuentre la cadena continua más larga de átomos de carbono presente en la molécula y use el nombre de esa cadena para la sustancia principal. Puede ser que la cadena más larga no sea evidente, por la manera en que esta escrita; quizá haya que “girar o doblar esquinas”. Ejemplo: CH2CH3 CH3 CH2 CH2 CHCH3 ______________________________ 3 Si hay dos cadenas distintas con igual longitud, elija como sustancia principal la que tenga mayor cantidad de puntos de ramificación. CH3 CH3 CHCHCH2 CH2 CH3 CH3 CH3 CH - CHCH2 CH2 CH3 CH2CH3 Nombre como un hexano con Dos sustituyentes CH2CH3 Y NO como un hexano con un sustituyente __________________________ Paso 2. Numerar los átomos de la cadena principal Numere cada átomo de carbono en la cadena de la sustancia principal a partir del extremo más cercano al punto de ramificación. 1 CH3 7CH3 2 CH2 6CH2 CH3 - CH - CH - CH2 - CH3 3 4 CH2 - CH2 - CH3 5 6 7 Y no CH3 - CH - CH - CH2 - CH3 5 4 CH2 - CH2 - CH3 3 2 1 _______________________ La primera ramificación esta en el C3, cuando el sistema de numeración es el correcto, y no en el C4. Si hay ramificaciones a distancias iguales de ambos extremos de la cadena de la sustancia principal, la numeración comienza en el extremo más cercano al segundo punto de ramificación: Paso 3. Identificar y numerar a los sustituyentes Asigne un número a cada sustituyente, de acuerdo con su punto de unión a la cadena principal: Si hay dos sustituyentes en el mismo carbono, se les asigna el mismo número. De haber tantos números en el nombre como sustituyente haya en la molécula. Paso 4. Escribir el nombre en una sola palabra. Use guiones para separar los distintos prefijos y comas para separar los números. Si hay dos o más sustituyentes distintos, cítelos en orden alfabético. Si hay dos o más sustituyentes idénticos, use uno de los prefijos multiplicadores di, tri, tetra, penta etc. 4 Escriba la formula estructural para: 1. 2. 3. 4. 5. 6. 7. 8. 9. 3-etil-2,2-dimetilpentano 3,5-dimetil-octano 2,2,4trimetilhexano 1-bromo-3-nitrobutano 4-etil-2,2,8-trimetil-6-propildecano 3-etil-1metilciclohexano 1-metilciclopropano 3-etil-2-metil-pentano 2,3,4- trimetilheptano BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 5 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 3 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: QUÍMICA INDUSTRIAL PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS Y CICLOALCANOS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón AUTOR: COMPETENCIAS Desarrolla la capacidad para relacionar las estructuras químicas y su reactividad. Reconoce la importancia de los alcanos en algunos procesos industriales CONCEPTUALIZACIÓN PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS Y CICLOALCANOS Características de los alcanos: Se les conoce como parafinas, palabra derivada del latín parum affinis, que quiere decir poca afinidad. Los alcanos son hidrocarburos de cadena abierta. Presentan solamente enlaces covalentes simples, por lo tanto son, hidrocarburos saturados. Presentan cadenas en las que los carbonos presentan hibridación sp3. Estos compuestos presentan enlaces carbono-carbono o carbono-hidrógeno son todos totalmente apolares; los enlaces carbono-hidrógeno son ligeramente polares debido a las electronegatividades de los dos elementos, pero dada la distribución tetraédrica de los enlaces, esta ligera polaridad se cancela, de modo que las moléculas de los alcanos son apolares o no polares. Su Formula general es CnH2n+2 en la cual n corresponde al número de carbonos. Ejercicio: Elabore con 6 lápices un tetraedro. Propiedades físicas Los cuatro primeros son gaseosos, del pentano al heptadecano (17 carbonos) son líquidos y del heptadecano en adelante son sólidos. Son poco solubles en agua y pueden disolverse en éter y etanol. 6 Complete la tabla: Nombre Fórmula estructural Punto de Punto de fusión ebullición Densidad (g/mL) Estado físico Metano Etano propano ciclopropano pentano ciclopentano Propiedades químicas Dado que sus moléculas están constituidas por enlaces tipo sigma, son poco reactivos. Son químicamente inertes a la mayor parte de los reactivos de laboratorio. Sin embargo, los alcanos reaccionan con el oxígeno, los halógenos y algunas otras sustancias bajo condiciones apropiadas. 1. Oxidación o combustión de alcanos Los alcanos y cicloalcanos se combinan con el oxígeno del aire a altas temperaturas, como en los motores de combustión interna que convierten la energía calórica procedente de la combustión de la gasolina, acpm o petróleo en energía mecánica o también en hornos cuando el alcano se usa como combustible. Se forma dióxido de carbono y agua como productos y se libera una gran cantidad de calor. ∆ CH4 + 2O 2 C 3H8 + 5O 2 ∆ CO2 + H2O + 890 kj/mol (213 Kcal./mol) 3CO2 + 4H2O + 526 kcal/mol C 4H10 + O 2 C 5H12 + O 2 7 C 7H16 + O 2 C 9H20 + O 2 2. Halogenación Los alcanos reaccionan con los halógenos, sustituyendo sus hidrógenos para formar los derivados halogenados correspondientes. Las reacciones se realizan en presencia de luz o a altas temperaturas y es usual en cloro y bromo, el fluor reacciona violentamente y el yodo no reacciona. Esta reacción es de sustitución y se efectúa por un mecanismo de radical libre. El mecanismo de una reacción es la descripción detallada, paso a paso de una reacción química. La siguiente reacción se lleva a cabo en tres pasos: iniciación, propagación y terminación. La reacción general es: Luz o calor R-H + X2 R -X + H-X CH3Cl + HCl Luz o calor CH4 + Cl 2 a. iniciación. En esta reacción se producen los primeros radicales libres por acción de la luz: luz o calor X2 X● Molécula de halógeno + X● radicales libres b. Propagación. Los radicales libres de halógeno formados atacan a las moléculas de alcano para formar un radical libre orgánico R (estable) y un haloácido: R - H + X● Alcano halógeno (atómico) R● + HX radical libre haloácido En una segunda etapa de esta fase, el radical orgánico ataca al halógeno para dar el producto de la reacción y otro radical iniciador X ●, determinando que la reacción de propagación sea en cadena: R● Radical libre + + X2 halógeno Molecular R -X + derivado halogenado X● halógeno atómico 8 c. Terminación. Son un conjunto de reacciones entre los radicales libres y las especies activas (átomos) en donde se aparean sus electrones libres. Una vez se neutralizan los radicales libres se termina la reacción correspondiente: X● + ●X Átomos de halógenos R ● + X Radical libre átomos de halógeno R ● + R Radicales libres X2 molécula de halógeno R - X derivado halogenado R – R alcano (subproducto) Complete: CH3CH3 + Cl 2 CH3CH3 + Br2 3. Nitración Con ácido nítrico, los alcanos sufren una nitración, se obtienen combustibles, solventes e intermedios químicos, para la síntesis de otras moléculas orgánicas. En la nitración se presenta una ruptura de enlaces C –C, de manera que resultan varios productos. HNO3 + CH3CH2CH3 HONO+2 CH3CH2CH2NO2 + CH3CHCH3 1-nitropropano CH3CH2NO2 Nitroetano + CH3NO2 + NO2 + H2O nitrometano Obtención de alcanos y cicloalcanos Consulte como pueden obtenerse alcanos por ejemplo a través de la síntesis de Grignard, la síntesis de Wurtz y la síntesis a partir de la hulla Aplicaciones de los alcanos y sus derivados Consulte acerca de las aplicaciones de los alcanos, cicloalcanos a nivel industrial y domestico. Complete los mapas conceptuales 9 LOS ALCANOS Son H de Cadena que puede ser Con formula general unidos por con fórmula general Enlaces LOS ALCANOS Se obtienen por H R Ejemplo S ejemplo ejemplo 10 BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://www.alonsoformula.com/organica/alcanos.htm http://genesis.uag.mx/edmedia/material/quimicaII/Alcanos.cfm 11 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUÍMICA INDUSTRIAL LOS ALQUENOS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón COMPETENCIAS Nombra correctamente alquenos con base en lo dispuesto por la normatividad de la IUPAC Elabora correctamente las fórmulas de los alquenos con base en la teoría. Desarrolla la capacidad para relacionar las estructuras químicas y su reactividad. Reconoce la importancia de los alquenos en algunos procesos industriales CONCEPTUALIZACIÓN LOS ALQUENOS Los alquenos son hidrocarburos que tienen uno o varios dobles enlaces carbono-carbono, Son comúnmente llamados olefinas(del latín, oleum: aceite y ficare: hacer). Abundan en la naturaleza, por ejemplo, el etileno es una hormona vegetal que induce a la maduración de los frutos o el β-caroteno, compuesto que contiene 11 dobles enlaces y es el pigmento que da el color anaranjado a las zanahorias y una valiosa fuente de vitamina A. ESTRUCTURA DEL DOBLE ENLACE En el enlace doble de los alquenos existe un enlace sigma б entre dos orbitales híbridos sp2 y un enlace PI (π) por la superposición con los orbitales 1s de los hidrógenos y dan origen a cuatro enlaces sigma. Los alquenos de cadena abierta y un solo doble enlace tienen la formula general: CnH2n Complete la tabla con los nombres y las fórmulas de algunos alquenos Nombre Fórmula Eteno o etileno 12 propeno 2-buteno 1-penteno 3-hexeno NOMENCLATURA DE ALQUENOS De acuerdo a los lineamientos establecidos por la IUPAC, los alquenos se nombran usando una serie de reglas parecidas a las de los alcanos, con la terminación eno en vez de ano, para identificarlos. PASO 1. Dé el nombre del hidrocarburo principal. Determine la cadena más larga de carbonos que contenga el doble enlace y dé el nombre correspondiente al compuesto usando la terminación eno. PASO 2. Numere los átomos de carbono en la cadena Comience en el extremo más cercano al doble enlace, o si el doble enlace es equidistante de los dos extremos, empiece en el extremo más cercano al primer punto de ramificación. Con esta regla se asegura que los carbonos con doble enlace reciban los números menores. PASO 3. Escriba el nombre completo. Numere los sustituyentes de acuerdo con sus posiciones en la cadena y menciónelos en orden alfabético. Indique la posición del doble enlace, asignando el número del primer carbono de alqueno y poniendo ese número antes del nombre del hidrocarburo principal. Si hay más de un doble enlace, indique la posición de cada uno y use las terminaciones dieno, trieno, etc. Que correspondan. CH3 CH2 CH2 CH = CHCH3 6 5 4 3 2 1 2-hexeno CH3 CH3 CH CH = CHCH2CH3 1 2 3 4 5 6 2-metil-3-hexeno Los nombres de los cicloalquenos se asignan en forma parecida, pero como no hay extremo de una cadena, se numeran de tal forma que el doble enlace este entre C1 y C2 y el primer sustituyente tenga el número más bajo posible. No es necesario indicar la posición del doble enlace en el nombre, porque siempre está entre el C1 y C2. 13 1-metil-ciclohexeno 1,4-ciclohexadieno Ejercicios de práctica: a. b. c. d. e. f. g. h. i. j. k. l. m. n. 2-metil-1,5-hexadieno 3-etil-2-2-dimetil-3-hepteno 2,3,3-trimetil-1,4,6-octatrieno 1,3-pentadieno 2-metil.1,3-butadieno 3,4-diisopropil-2,5-dimetil-3-hexeno 4-terbutil-2-metilpenteno 3-bromociclopenteno 1,3-ciclopentadieno 3-metil-ciclopenteno 2-bromo-4-metil-1,5-heptadieno 3-clorociclopenteno 1,5-dimetil ciclopenteno 2,3-dimetilciclobuteno PROPIEDADES FÍSICAS DE LOS ALQUENOS A 20 O C, el eteno, propeno y buteno son gases. Los alquenos de 5 a 18 átomos de carbono son líquidos y aquellos con más de 18 átomos de carbono son sólidos. Son compuestos no polares, insolubles en agua pero muy solubles en solventes orgánicos. Son menos densos que el agua. Nombre Fórmula estructural Punto de Punto de fusión ebullición Densidad (g/mL) Eteno Propeno 1-buteno 1-penteno 1-hexeno 1-octeno 14 ciclohexeno PROPIEDADES QUÍMICAS DE LOS ALQUENOS 1. HIDROGENACIÓN CATALÍTICA En los alquenos se presentan reacciones de adición generalmente, ya que en ellas un reactivo se adiciona se une al alqueno mediante la ruptura de uno de los enlaces del doble enlace. Este proceso se utiliza industrialmente en la conversión de aceites insaturados en grasas sólidas. En presencia de platino, paladio, níquel o hierro finamente divididos, la adición transcurre lentamente H H C =C R* + R* H2 R** - H H C - C H H R** Ni CH2 = CH - CH2CH3 CH3 - CH2 - CH2 CH3 Hidrogenación del 1-buteno n-butano Pt 1. R – CH = CH2 + H2 Pt 2. CH2 = CH – CH3 + H2 2. HALOGENACIÓN El bromo y el cloro se adicionan con facilidad a los alquenos para formar 1,2 dihaloalcanos. Por ejemplo se sintetizan unos 6 millones de toneladas al año del 1,2-dicloroeteno (dicloruro de etilo) en la industria añadiendo Cl2 al etileno. Este producto se utiliza como solvente y como materia prima para la fabricación del policloruro de vinilo (PVC). H H C = C H H Etileno Cl + Cl2 Cl H- C -C - H H H 1,2-dicloroetano 15 El fluor es demasiado reactivo y difícil de controlar para la mayor parte de las aplicaciones del laboratorio, y el yodo no reacciona con la mayoría de los alquenos. 3. HIDRATACIÓN Al adicionar a los alquenos agua con un catalizador ácido diluido se produce alcohol. Esta reacción cumple el mecanismo de acuerdo con la regla de Marconicoff. H H C = C R H + H – OH H R - C - C - R* R* H Alqueno OH alcohol 4. OZONOLISIS Es la reacción entre los alquenos y el ozono y la posterior hidrólisis. La molécula del alqueno se rompe en dos partes por el enlace doble originando aldehídos y cetonas. (Consulte las reacciones) 5. OXIDACIÓN Los alquenos se oxidan fácilmente con solución de KMnO4 (permanganato de potasio), diluido en frío y conduce a la formación de dioles y glicoles. (esta reacción se conoce como prueba de Bayer). El color violeta o púrpura se decolora debido a la formación del diol y aparece la formación de un precipitado marrón de MnO2. Esta prueba se utiliza para diferenciarlos de los alcanos. 3CH3 CH = CH2 + KMnO4 + 4H2O 3CH3 - CH – CH2 + OH OH 1,2-propanodiol 2MnO2 + 2 KOH 6. POLIMERIZACIÓN Los alquenos poseen la propiedad de polimerizarse una gran variedad de productos como cauchos, pinturas, plásticos, barnices, fibras etc. (Consulte las reacciones involucradas). Consultar: 1. como se producen los polímeros industrialmente, que es un monómero y una macromolécula. 2. Como se obtienen y para que se utilizan el polietileno, el cloruro de polivinilo y el poli estireno. 3. Formas de obtención de alquenos 4. usos de los alquenos 5. Elabore un mapa conceptual que involucre todo lo trabajado para los alquenos. 16 BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo14.htm 17 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 5 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: Química industrial LOS ALQUINOS CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón COMPETENCIAS Nombra correctamente alquinos con base en la normatividad dispuesta por la IUPAC Elabora correctamente las fórmulas de los alquinos con base en la teoría. Desarrolla la capacidad para relacionar las estructuras químicas y su reactividad. Reconoce la importancia de los alquinos en algunos procesos industriales CONCEPTUALIZACIÓN LOS ALQUINOS Los alquinos son hidrocarburos que presentan uno o varios triples enlaces carbono – carbono. Su formula general es C n H 2n -2 El alquino más simple es el acetileno H – C Ξ C – H, que se usa en la industria como materia prima para preparar el acetaldehído, ácido acético, cloruro de vinilo y otras sustancias a gran escala. Actualmente se sigue usando el acetileno o etino en la preparación de polímeros acrílicos y se obtiene en escala industrial descomponiendo el metano a alta temperatura (pirolisis). La interacción de dos átomos de carbono con hibridación sp da lugar a un triple enlace carbonocarbono. Nomenclatura La nomenclatura usada para indicar sus nombres sigue las mismas reglas utilizadas para alquenos. De acuerdo con la IUPAC, se cambia el sufijo ano de los alcanos por ino 1. Se determina la cadena continua más larga que contenga el triple o los triples enlaces. 2. Se nombra la cadena, cambiando el sufijo ano por ino. 3. Se numera la cadena empezando por el extremo donde se halle más cerca el triple enlace, de modo que éste recibe el número mas bajo posible. 4. Se indica la posición del triple enlace escribiendo el número del primer carbono al cual está unido el triple enlace, antes del nombre de la raíz. 5. Se completa el nombre, nombrando e indicando al comienzo la posición de los grupos sustituyentes. 18 6. A los compuestos con más de un triple enlace se les llama diinos, triinos, etc. A los que contienen dobles y triples enlaces eninos. La numeración de una cadena de enino comienza en el extremo más cercano al primer enlace múltiple, sea doble o triple. Cuando hay opción de numerar, los dobles enlaces reciben números menores que los triples enlaces. HC Ξ CCH2 CH2 CH2 CH = CH2 7 65 4 3 2 1-hepten-6-ino 1 CH3 HC Ξ CCH2 CH CH2 CH2CH = CHCH3 1 23 4 5 6 7 4-metil-7-nonen-1-ino 8 9 Ejercicios de práctica 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 6—metil-3-octino 3,3-dimetil-4-octino 2,2,5,5-tetrametil-3-hexino 3,5-heptadien-ino 3-etil-5-metil-1,6,8-decatriíno 3 –cloro-4,4-dimetil-1-nonen-6-ino 1,3- butadiíno 4-cloro-3-etil-hexino 4-metil-2-pentino 3-etil-5-nitro-1,8-decadiino 3,3-dimetil-5-octino 1,3,5-ciclohexatrieno 2,2,-dinitro-5,5-dimetil-3-heptino PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALQUINOS Nombre Fórmula estructural Punto de Punto de fusión ebullición Densidad (g/mL) 19 Consulte: 1. Propiedades químicas de los alquinos 2. obtención de alquinos 3. usos de los alquinos. 4. Elabore un mapa conceptual de los alquinos. BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo15.htm http://es.geocities.com/qo_14_alquinos/ 20 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 6 Química Industrial EL BENCENO NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 Sonia Torres Garzón COMPETENCIAS Nombra correctamente compuestos aromáticos con base en la normatividad dispuesta por la IUPAC. Elabora correctamente las fórmulas de los compuestos aromáticos. Desarrolla la capacidad para relacionar las estructuras químicas y su reactividad. Reconoce la importancia del benceno en algunos procesos industriales CONCEPTUALIZACIÓN EL BENCENO El benceno es un hidrocarburo poliinsaturado de fórmula C6H6, con forma de anillo (se le llama anillo bencénico, o aromático, ya que posee un olor particularmente llamativo para cierto tipo de individuos) y puede considerarse una forma poliinsaturada del ciclohexano. En el benceno cada átomo de carbono ocupa el vértice de un hexágono, ocupa dos valencias con los dos átomos de carbonos adyacentes, una tercera valencia con un átomo de hidrógeno y la cuarta 'oculta' dirigiéndola hacia el centro del anillo hexagonal. Los átomos de carbono comparten sus electrones libres de manera similar a de los enlaces covalentes corrientes, de modo que la estructura molecular adquiere una gran estabilidad. El benceno es un líquido incoloro de aroma dulce. Se evapora al aire rápidamente y es poco soluble en agua. Es sumamente inflamable y se forma tanto de procesos naturales como de actividades humanas. Algunas industrias usan benceno para manufacturar otros productos químicos usados en la fabricación de plásticos, resinas, nylon y fibras sintéticas. También se usa benceno para hacer ciertos tipos de gomas, lubricantes, tinturas, detergentes, medicamentos y pesticidas. Los volcanes e incendios forestales constituyen fuentes naturales de benceno. El benceno es también un constituyente natural del petróleo crudo, gasolina y humo de cigarrillo. 21 Resonancia del Benceno La representación de los tres dobles enlaces en resonancia se debe a Friedrich Kekulé, quien además fue el descubridor de la estructura anular de dicho compuesto y el primero que lo representó de esa manera. Se representa normalmente como un hexágono con un círculo dentro para recordar que los tres dobles enlaces del benceno están deslocalizados y estabilizados por resonancia. Es decir, no "funcionan" como un doble enlace normal sino que al estar uno si uno no dan a la molécula unas características especiales. Esto es así porque cada carbono que en el benceno presenta hibridación sp2 tiene un orbital pz perpendicular al plano de enlace con el que forma un orbital molecular paralelo a la molécula por encima y por debajo de ella, en el que los seis electrones correspondientes a los dos dobles enlaces se encuentran deslocalizados. La resonancia del benceno es lo que le confiere su increíble estabilidad y su reaccionabilidad tan especial, haciéndolo una de las moléculas más importantes en la síntesis orgánica. Toxicidad Respirar, inhalar ,aspirar ,inspirar o ingerir niveles de benceno muy altos puede causar la muerte, mientras que niveles altos pueden causar somnolencia, mareo, alucinaciones, aceleración del latido del corazón o taquicardia, dolores de cabeza ,migrañas , temblores, tiritar ,confusión y pérdida del conocimiento. Comer o tomar altos niveles de benceno puede causar vómitos o acidez ,irritación del estómago ulceras estomacales, mareo, somnolencia o convulsiones; y la muerte. El efecto principal de la exposición de larga duración al benceno es en la sangre. El benceno produce efectos nocivos en la médula de los huesos y puede causar una disminución en el número de glóbulos rojos, lo que conduce a anemia. El benceno también puede producir hemorragias y daño al sistema inmunitario, aumentando así las posibilidades de contraer infecciones. 22 El Departamento de Salud y Servicios Humanos (DHHS) ha determinado que el benceno es un reconocido carcinógeno en seres humanos y otros mamíferos lactantes. La exposición de larga duración a altos niveles de benceno en el aire puede producir leucemia, un cáncer a los tejidos que fabrican las células de la sangre como también un cáncer de colón. Propiedades físicas. La serie aromática se caracteriza por una gran estabilidad debido a las múltiples formas resonantes que presenta. Muestra muy baja reactividad a las reacciones de adición. El benceno es una molécula plana con un alto grado de saturación lo cual favorece las reacciones de sustitución. Es un líquido menos denso que el agua y poco soluble en ella. Es muy soluble en otros hidrocarburos. Consulte: 1. Acerca de las reacciones químicas del benceno. 2. acerca de los compuestos heterocíclicos aromáticos como la piridina, el pirrol, el furano, el tiofeno, el benzopireno entre otros consulte su estructura y usos. 3. la incidencia de los hidrocarburos aromáticos en los seres humanos como es el caso del uso del cigarrillo, el cáncer y la toxicidad del benceno 23 Nombre los siguientes compuestos: ___________________________ ___________________________ ___________________________ ___________________________ ___________________________ 24 ___________________________ ___________________________ ___________________________ ___________________________ ___________________________ 25 ___________________________ ___________________________ ___________________________ ___________________________ ___________________________ 26 Tomado de: http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l12/nomen.html BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://es.wikipedia.org/wiki/Benceno http://www.monografias.com/trabajos7/bence/bence.shtml 27 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 7 QUIMICA INDUSTRIAL FUNCIONES ORGANICAS aldehídos y cetonas NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente aldehídos y cetonas con base en la teoría Elabora las formulas de aldehídos y cetonas Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de aldehídos y cetonas. Reconoce la importancia de los aldehídos y las cetonas en algunos procesos industriales CONCEPTUALIZACIÓN Función Alcanos Grupo -C-C- Alquenos -C=C- Alquinos -C≡C- Hidrocarburos aromáticos Derivados halogenados R-X Ejemplo CH3-CH3 propano CH2=CH2 propeno CH≡CH propino Terminación -ano Ejemplo -eno -ino benceno CH3CH2CH2 Cl haluro ...ilo de 1- cloropropano (cloruro propilo) Alcoholes R-OH de CH3CH2-OH etanol ....ol 28 Fenoles φ-OH nombre no sistemático acabados en ol fenol Éteres R-O-R CH3-O-CH3 dimetileter éter Aldehídos R-CHO CH3CH2CHO propanal -al Cetonas R-CO-R CH3COCH3 propanona -ona Ácidos carboxílicos R-COOH CH3CH2COO H -oico ácido propanoico Ésteres R-COOR CH3COOCH3 etanoato metilo Anhídridos -ato de ....ilo de R-CO-O-CO-R (CH3CO)2O anh......oico anhídrido etanoico Haluros ácido de R-COX Aminas R-NR2 Nitrilos cianuros o R-C≡N Amidas CH3COCl cloruro etanoilo R-CO-NR2 de CH3CH2NH2 etanoamina haluro ...oílo de -amina CH3CH2CN -nitrilo propanonitrilo ó cianuro de etilo CH3CONH2 etanoamida -amida ALDEHIDOS Y CETONAS Aldehídos y cetonas se caracterizan por tener el grupo carbonilo 29 La fórmula general de los aldehídos es La fórmula general de las cetonas es Los aldehídos y cetonas se encuentran entre los compuestos de más importancia tanto en la naturaleza como en la industria química. En la naturaleza, muchas de las sustancias necesarias para los sistemas vivos son aldehídos y cetonas. En la industria química se sintetizan grandes cantidades de tales compuestos, que se usan como solventes o como materias primas para una multitud de otros productos. Muchos aldehídos poseen olores, razón por la cual se usan en perfumería y otros con sabores agradables se usan como agentes saborizantes. Propiedades de Aldehídos y Cetonas El doble enlace carbono-oxígeno de los grupos carbonilos es similar en muchos aspectos al doble enlace carbono-carbono de los alquenos. El átomo de carbono carbonílico tiene hibridación sp2 y tres enlaces sigma. El cuarto electrón de valencia permanece en un orbital p del carbono, y por superposición con un orbital p del oxígeno forma con él un enlace pi. El átomo de oxígeno tiene otros dos pares de electrones no compartidos, que ocupan los dos orbitales restantes. Como los alquenos, los compuestos carbonílicos son planares respecto al doble enlace, y tienen ángulos de enlace de 120º aproximadamente. Como podría esperarse, el doble enlace carbonooxígeno es más corto (1.22 Aº contra 1.43 Aº) y más fuerte (175 kJ/mol contra 92 kJ/mol) que un enlace sencillo carbono-oxígeno. Los dobles enlaces carbono-oxígeno se encuentran polarizados debido a la elevada electronegatividad del oxígeno respecto a la del carbono. Nomenclatura Aldehídos El sistema de nomenclatura corriente consiste en emplear el nombre del alcano correspondiente terminado en -al. También puede el nombre del grupo alquilo mas la palabra aldehído. CH3CH etanal o acetaldehído CH3CH2CH ║ ║ O O propanal o propanaldehido Cetonas Para nombrar los cetonas tenemos dos alternativas: 30 1. El nombre del hidrocarburo del que procede terminado en -ona . 2. Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona. Ejercicios: Escriba la formula química para los siguientes aldehídos y cetonas: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. propionaldehido o propanal Pentanal acetaldehído hexanal butanal o butiraldehido 4- octanona propanona o acetona 3-octanona etil metil cetona etanodial 4- metil-2- pentanona dietilcetona benzaldehido ciclohexanona 2-metilciclohexanona 2-metilciclopropanona 4-hexen-2-ona 2,4-hexanodiona 2-etil-4-metilpentanal un compuesto que contenga una cadena de siete carbonos, un sustituyente metil, un etil y la función aldehido. Nombrelo. De el nombre para cada uno de los siguientes compuestos: 1. CH3 - (CH2)4 – C - H ║ O 3. CH3CH2 - C - H ║ O 2. CH3 CH2 - C - CH2 CH3 ║ O 4. CH3 CH2 - C - CH3 ║ O Propiedades físicas Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular.No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad. 31 Reacciones La reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción. Consultar: 1. Como esta constituido el reactivo de Tollens y para que se utiliza en el laboratorio 2. Que son los reactivos de Fehling y Benedict y que permiten diferenciar a nivel de laboratorio 3. Cuál es la composición del reactivo de Schiff, que se identifica con el en el laboratorio y como se muestra la prueba positiva. 4. Las propiedades químicas de aldehídos y cetonas 5. Qué aplicaciones se dan a los aldehídos y las cetonas. Elaboración o preparación de Aldehídos y Cetonas. Uno de los mejores métodos para la síntesis de aldehídos es la oxidación de alcoholes primarios y ruptura oxidativa de alquenos. Para la síntesis de cetonas los métodos son análogos a los de aldehídos los resumimos en forma de tabla: SÍNTESIS DE ALDEHÍDOS Y CETONAS EJEMPLOS 1.- Formación de aldehídos (a).- Oxidación de alcoholes primarios (b).- Ozonólisis de alquenos (c).- Reducción parcial de ésteres 2.- Formación de cetonas (a).- Oxidación de alcoholes secundarios 32 (b).- Ozonólisis de alquenos (c).- Acilación de Friedel-Crafts (d).- Hidratación de alquinos (e).- Reacción de diorganocupratos con cloruros de ácidos BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://www.telecable.es/personales/albatros1/quimica/grupofun/aldeceto/aldeceto.htm http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo17.htm http://www.ust.cl/html/cree/asignaturas/material_profesor/material_qorganica/clase8.pdf http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo04.htm http://rt000uvd.eresmas.net/funcorg.htm 33 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 8 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUIMICA INDUSTRIAL ALCOHOLES Y FENOLES 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente alcoholes y fenoles con base en la teoría. Elabora las formulas de alcoholes y fenoles. Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de alcoholes. Reconoce la importancia de los alcoholes y los fenoles en algunos procesos industriales CONCEPTUALIZACIÓN ALCOHOLES y FENOLES Los alcoholes son el grupo de compuestos químicos con grupos hidrófilo unidos a átomos de carbono saturados con hibridación sp3, en tanto que los fenoles son compuestos que tienen grupos hidroxilo unidos a anillos aromáticos. Ambos se pueden considerar como derivados orgánicos del agua en que un grupo orgánico ha sido sustituido a uno de los hidrógenos: H-O-H o Ar-O-H. Los alcoholes se encuentran ampliamente distribuidos en la naturaleza y tienen muchas aplicaciones industriales y farmacéuticas. 34 Alcoholes primarios, secundarios y terciarios De acuerdo al tipo de carbono al cual está unido el grupo hidrófilo en la cadena, los alcoholes se clasifican en primarios, secundarios y terciarios. Un alcohol es primario si el grupo –OH esta unido a un carbono primario como en el etanol o también un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario: Es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario: y finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario: La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc. 35 Fórmula Nombre Clasificación 1-propanol monol 1,2-propanodiol (propilen glicol) diol 1,2,3-propanotriol (glicerina) triol Nomenclatura de alcoholes: 9 9 9 En la nomenclatura del sistema IUPAC los alcoholes simples se designan como derivados del alcano progenitor y se utiliza el sufijo OL Seleccione la cadena de carbonos más larga que contenga el grupo hidroxilo y derive el nombre del alcohol reemplazando la terminacion o del alcano correspondiente con ol. Numere los sustituyentes de acuerdo con su posición en la cadena y escriba el nombre, mencionando los sustituyentes en orden alfabético. Nomenclatura de fenoles: La palabra fenol se utiliza como nombre de una sustancia específica (hidroxibenceno) o para nombrar los compuestos aromáticos hidroxisustituidos. Ejercicios: escriba las formulas estructurales de los siguientes compuestos: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 2-metil-2-pentanol 1,4-ciclohexanodiol 3-fenil-2-butanol 2-propen-1-ol (alcohol alilico) 2-metil-2-propanol (alcoholterbutilico) 1,2-etanodiol (etilenglicol) 1,2,3- propanotriol (glicerol) 2-etil-2-buten.1.ol 2,6-dimetilfenol 3-ciclohexen-1-ol 1,4- pentanodiol 2-metil-1-propanol 3-buten-2-ol 2-cloro-3-buten-2-ol 1,3-butanodiol ciclopentanol ciclohexanol 36 Consultar acerca de las reacciones químicas de los alcoholes. BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://www.ust.cl/html/cree/asignaturas/material_profesor/material_qorganica/clase7a.pdf 37 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 9 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUIMICA INDUSTRIAL ÁCIDOS CARBOXILICOS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente ácidos carboxílicos. Elabora las formulas de ácidos carboxílicos. Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de los ácidos carboxílicos. Reconoce la importancia de los ácidos carboxílicos en algunos procesos industriales CONCEPTUALIZACIÓN| Ácidos carboxílicos Son compuestos que se caracterizan por tener el grupo "carboxilo" -COOH en el extremo de la cadena. Nomenclatura Se nombran anteponiendo la palabra "ácido" al nombre del hidrocarburo del que proceden y con la terminación "-oico". ácido etanoico Son numerosos los ácidos dicarboxílicos, que se nombran con la terminación "-dioico" 38 ácido propanodioico Cuando los grupos carboxílicos se encuentran en las cadenas laterales, se nombran utilizando el prefijo "carboxi-" y con un número localizador de esa función. Aunque en el caso de que haya muchos grupos ácidos también se puede nombrar el compuesto posponiendo la palabra "tricarboxílico", "tetracarboxílico", etc., al hidrocarburo del que proceden. ácido 2-carboxipentanodioico ou ácido 1,1,3-propanotricarboxílico Ejemplos: ESTRUCTURAS NOMBRES ácido. metanoico ácido. fórmico ácido. etanoico ácido. acético ácido. propenoico ácido. benceno-carboxílico ácido. benzoico ácido. propanodioico ácido. malónico 1,1,3-propano-tricarboxílico EJERCICIOS Elabore las formulas estructurales para: • • • • • • • • • Ácido 2-cloro-propanoico Ácido 3-aminobutanoico Ácido m. hidroxibenzoico Ácido propanodioico Ácido 4-cloro-2metil-pentanoico Ácido 2-pentenoico Ácido etanodioico Ácido 2,2-dimetil-propanoico Ácido-4-metil-pentanoico 39 • • • • • Ácido 2-hidroxi-2-metil-propanoico Ácido 1,2 dicarboxilico Ácido 2-fenil-etanoico Ácido m.metil-benzoico Ácido p.nitrobenzoico PREPARACIÓN DE LOS ÁCIDOS CARBOXÍLICOS: Entre los métodos de síntesis de ácidos carboxílicos los más frecuentes son oxidación, hidrólisis de nitrilos y reacción de reactivos de Grignard con CO2. A continuación se muestran en forma de esquema con un respectivo ejemplo. Formación de Ácidos Carboxílicos Método sintético Ejemplo a) Hidrólisis de otros derivados de ácidos carboxílicos Donde X = -Cl, -OR’, -OCOR’, -NHR’. b) Oxidación de alquilbencenos c) Ruptura oxidativa de alquenos y alquinos d) Oxidación de alcoholes primarios o aldehídos 40 e) Hidrólisis de nitrilos f) Transposición del ácido bencílico g) Síntesis malónica h) Reacción de Kolbe i) Carboxilación de reactivos organometálicos j) Oxidación de cetonas 41 http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo19.htm Consultar acerca de: Preparación de los ácidos y los usos industriales de los mismos. BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://www.monografias.com/trabajos5/acicar/acicar.shtml http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo19.htm http://www.quimicaorganica.net/quimica-organica/acidos-carboxilicos/acidos-carboxilicos.htm 42 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 10 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUIMICA INDUSTRIAL Los esteres 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente esteres. Elabora las formulas de esteres Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de los esteres. Reconoce la importancia de los esteres en algunos procesos industriales CONCEPTUALIZACIÓN| Ésteres Los esteres son compuestos de formula general Se forman al sustituir el H de un ácido orgánico por una cadena hidrocarbonada, R' 43 Nomenclatura Para asignar un nombre a un éster, primero se suprime la palabra ácido y sustituya el sufijo -ico del nombre del ácido por ato, a continuación se escribe la preposición "de" seguida del nombre del grupo alquilo o arilo del correspondiente alcohol. Ejemplo: Propiedades físicas A diferencia de los ácidos, los ésteres no pueden donar enlaces de hidrógeno puesto que no tienen un átomo de hidrógeno unido a un átomo de oxígeno. Por lo tanto, los puntos de ebullición de los ésteres son inferiores en comparación con los puntos de ebullición de los ácidos carboxílicos con masas moleculares semejantes. Sin embargo, los ésteres pueden aceptar enlaces de hidrógeno de otros líquidos con enlaces de hidrógeno; por lo tanto, los ésteres de baja masa molecular son solubles en agua y los de mayor masa molecular son insolubles en agua. A diferencia de los ácidos carboxílicos de los cuales se derivan, los ésteres poseen olores agradables. En realidad, los aromas específicos de muchas flores y frutos se deben a la presencia de ésteres. Estos se emplean en la fabricación de perfumes y como agentes saborizantes en las industrias de la confitería y bebidas no alcohólicas. Para obtener un sabor artificial de frambuesa, se emplea una mezcla de nueve ésteres. Los vapores de los ésteres son inocuos, a menos que se inhalen grandes concentraciones. El uso más importante de los ésteres es como disolventes industriales. La mayor parte de los ésteres son líquidos, incoloros, insolubles y más ligeros que el agua. Estructura CH3COOCH2(CH2)3CH3 CH3CH2COOH CH3(CH2)4COOCH2CH2CH3 HCOOCH2CH( CH3)2 Nombre IUPAC Nombre común Sabor o fragancia Etanoato de pentilo metanoato de etilo acetato de amilo platano formiato de etilo Ron butirato de amilo formiato de albaricoque Frambuesas metanoato de 44 isobulo isobutilo CH3COOCH2(CH2)6CH3 etanoato de octilo acetato de n-octilo Naranjas CH3(CH2)2COOCH2CH3 butanoato de etilo butirato de etilo Piña butanoato de pentilo butirato de pentilo Duraznos CH3(CH2)2COOCH2(CH2)3CH3 Propiedades químicas Los ésteres se pueden hidrolizar a su ácido y su alcohol precursores. Recordemos que en la reacción de hidrólisis, una molécula de agua se rompe y se adiciona a otra molécula. Para aumentar la velocidad de las reacciones de hidrólisis de los ésteres se agregan ácidos o bases inorgánicas y se calienta la mezcla. La hidrólisis de un éster ocurre de la siguiente forma: Si los ésteres se hidrolizan en una solución alcalina, la reacción de hidrólisis se denomina saponificación. El término saponificación significa fabricación de jabón. Los jabones, o sea las sales solubles de los ácidos grasos, se preparan calentando las grasas de plantas o animales en una solución básica de alcohol y agua. Ejercicios Nombre las siguientes esteres 1. CH3 - COO – CH3 2. 3. Elabore las estructuras para los siguientes compuestos: 45 1. propianoato de metilo metilpropanato 2. propionato de etilo o etilpropanato 3. acetato de propilo o propiletano 4. acetato de etilo 5. etanoato de etilo o acetato de etilo 6. butiletanoato 7. butirato de etilo BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://medicina.usac.edu.gt/Quimica/acarb/Esteres.htm http://zootvirtual.iespana.es/esteres2.htm 46 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 11 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUIMICA INDUSTRIAL LAS AMINAS 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente aminas. Elabora las formulas de aminas Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de aminas. Reconoce la importancia de los aminas en algunos procesos industriales CONCEPTUALIZACIÓN Las aminas Las aminas se consideran como derivados del amoniaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente. Amoniaco Amina primaria Amina secundaria Amina terciaria Nomenclatura Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos, los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y terciarias. 47 Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina. Algunas veces se indica el prefijo amino indicando la posición, más el nombre del hidrocarburo. Se nombran adicionando al nombre del radical hidrocarbonado el sufijo "-amina". Ejemplos: ESTRUCTURA NOMBRE CH3-NH2 Metilamina o aminometano CH3-NH-CH3 Dimetilamina ó metilaminometano CH3-CH2-NH-CH2-CH2-CH3 Etil-propil-amina ó etil-amino-propano CH3 | N-CH3 | CH3 CH3 | N-CH2-CH2-CH3 | CH2-CH3 Trimetilamina ó dimetilaminometano Metil-etil-propilamina ó metil-etilaminopropano tomado de "http://es.wikipedia.org/wiki/Amina" En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos "di-" o "tri-", aunque, frecuentemente, y para evitar confusiones, se escoge el radical mayor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno. N-etil-N-metil-propilamina Cuando las aminas primarias no forman parte de la cadena principal se nombran como substituyentes de la cadena carbonada con su correspondiente número localizador y el prefijo "amino-". ácido 2-aminopropanoico 48 Los N que no formen parte de la cadena principal se nombran como amino-, aminometil-, metilamino-, etc. 3-amino-4-aminometil-6-metilamino-1,6-hexanodiamina Ejemplos ESTRUCTURA NOMBRE metilamina Trimetilamina N- metiletilamina N-etil-N-metilpropilamina Fenilamina (anilina) Ácido 2-aminopropanoico EJERCICIOS Elabore las formulas estructurales para: • etilamina • 1-metilbutilamina • P.fluoranilina • 5-bromo-2-etilanilina • 1,2-propanodiamina • 1,6 hexanodiamina • 2-aminoetanol 49 • P.aminobenzaldehido Asigne el nombre a cada una de las siguientes aminas • C6H5CH2NH2 • C6H5 CHNH2 CH3 • H2C ═ CHCH2NH2 Elabore la formulas y clasifique como aminas primarias, secundarias o terciarias • N-metiletilamina • 4-cloro-N-etil-3-nitroanilina • N,N-dimetilcicloheptilamina CH3 • (CH3)CH NCH2CH3 Consultar: Acerca de las aminas como productos naturales, que son, cual es su uso y sus formulas: cocaina, morfina, quinina, nicotina, serotonina, putresina, epinefrina entre otras. BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://es.wikipedia.org/wiki/Amina http://www.telecable.es/personales/albatros1/quimica/grupofun/amina/amina.htm http://www.alonsoformula.com/organica/aminas.htm 50 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE 12 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: AUTOR: QUIMICA INDUSTRIAL Amidas 2 horas CAREY FRANCIS A. Química orgánica. Sexta edición. Mc Graw Hill. México.2006 MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004 SONIA TORRES GARZON COMPETENCIAS Nombra correctamente amidas. Elabora las formulas de amidas Desarrolla la capacidad para relacionar las estructuras químicas y la reactividad de amidas. Reconoce la importancia de los amidas en algunos procesos industriales CONCEPTUALIZACIÓN| Las Amidas Son compuestos derivados de los ácidos carboxílicos por substitución del grupo -OH por un grupo dando lugar a amidas sencillas, amidas N-substituidas o N, N-disubstituidas. Nomenclatura Se nombran como el ácido del que provienen, pero con la terminación "-amida". 51 etanamida o acetamida Si se trata de amidas substituidas hay que especificar los radicales unidos al nitrógeno anteponiendo la letra N. N-metil-etanamida Se utiliza el sufijo -carboxamida para el grupo -CO-NH2 cuando el ácido de referencia se nombra usando el sufijo -carboxílico. 1,2,4-butanotricarboxamida Cuando la función amida no es la principal, el grupo -CO-NH2 se nombra por el prefijo carbamoil-, y un grupo como -CO-NH-CH3 por el prefijo metilcarbamoil-. El grupo -NH-CO-CH3 se nombra como acetamido-, y el grupo -NH-CO-CH2-CH2-CH3 como propanocarboxamido-. ácido 4-carbamoilhexanoico ácido 4-etanocarboxamidohexanoico 52 EJEMPLOS Estructura Nombre etanamida o acetamida benzamida N-metilacetamida N-metiletanamida diacetamida N-metildiacetamida N-metilbenzamida Una amida es un grupo funcional del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno: Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino). Propiedades ¾ ¾ ¾ ¾ ¾ ¾ Salvo la formamida, que es líquida, todas las amidas primarias son sólidas. Casi todas las amidas son incoloras e inodoras. Los miembros inferiores de la serie son solubles en agua y en alcohol; la solubilidad en agua disminuye conforme aumenta la masa molar. Las amidas poseen puntos de fusión y ebullición altos. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. 53 EJERCICIOS Escriba la estructura de los siguientes compuestos. 1.- metanamida (formamida) 2.- Benzamida 3.- N-etilbutanamida 4.- N-isopropil-N-terbutilpentanamida 5.- 2-etil-3-metilhexanamida BIBLIOGRAFIA SCHAUM. Química orgánica. Tercera edición. McGrawHill. 2001. Colombia. EGE SEYHAN. Química orgánica. Editorial reverte. Tomo I y II. España. 2000 FIESER LOUIS Y FIESER MARY. Química orgánica fundamental. Editorial Reverte. España. 1981. HOLUM JOHN. Principios de fisicoquímica, química orgánica y bioquímica. Editorial Limusa. México.1971. MAYER L. TEGEDER. Métodos de la industria química. Editorial Reverte. MCMURRY JOHN. Química orgánica. Editorial Thomson. Sexta edición. México.2004. MORRISON R. BOYD R.Química orgánica. 5 edición. Addison Wesley longman. México. 1990 WEINIONMGER STEPHEN. STERMITZ FRANK. Química orgánica. Editorial reverte. España. 1988 http://www.alonsoformula.com/organica/amidas.htm http://medicina.usac.edu.gt/quimica/aminas/Amidas.htm http://docentes.uacj.mx/polivas/quimica/clases/Quimica%20organica/amidas/formula_amid as.htm 54