Oxidación de un alcohol
Anuncio

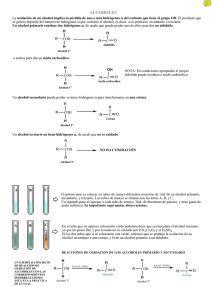
INTRODUCCIÓN TEÓRICA. La oxidación de un alcohol implica la pérdida de uno o más hidrógenos (hidrógenos ) del carbono que tiene el grupo −OH. El tipo de producto que se genera depende del número de estos hidrógenos que contiene el alcohol, es decir, si es primario, secundario o terciario. Un alcohol primario contiene dos hidrógenos , de modo que puede perder uno de ellos para dar un aldehído. HH øø R−−C−−OH ! R−−C = O ø Un aldehido H Un alcohol primario o ambos para formar un ácido carboxilico. H OH øø R−−C−−OH ! R−−C = O ø Un ácido carboxílico H Un alcohol primario Por lo general es difícil obtener el aldehído, porque la mayor parte de los agentes oxidantes que pueden oxidar al alcohol primario, también oxidan al aldehído. El ácido crómico oxida a un alcohol primario y llega hasta el ácido carboxílico. Por esto para oxidar alcoholes primarios a aldehídos se utiliza agentes oxidantes menos fuerte que ácido crómico como lo son: el reactivo de Jones que es una solución diluida de ácido crómico en acetona y el reactivo de Collins que es un complejo de trióxido de cromo con dos moléculas de piridina que es mucho más efectivo que el primero. Un alcohol secundario puede perder su único hidrógeno para transformarse en una cetona RR øø R−−C−−OH ! R−−C = O 1 ø Una cetona H Un alcohol secundario Siendo el ácido crómico (H2CrO4) el procedimento más eficiente, pues genera altos rendimientos. El ácido crómico se prepara disolviendo dicromato de sodio (Na2Cr2O7) en una mezcla de ácido sulfúrico y agua. Na2Cr2O7 + 2H2SO4 [H2Cr2O7] 2H2CrO4 + 2NaHSO4 El mecanismo de la oxidación del alcohol implica probablemente la formación de éster cromato. La eliminación de este éster produce la cetona. En la eliminación, el carbono del carbinol retiene su átomo de oxígeno pero pierde su hidrógeno y gana el segundo enlace al oxígeno. El cromo (+4) que se forma arriba es totalmete inestable ,por lo que icurre una reacción de desproporciónentre el cromo (+4) y el cromo (+6) para producir cromo (+5), un nuevo agente oxidante escrito como HcrO3. Los dos moles de croo (+5) así formado pueden oxidar dos moles de alcohol produciendoce entonces el cromo (+3) totalmente estable y escrito como H3CrO3. Que en presencia de ácido sulfúrico la especie es convertida en Cr2SO4. H2CrO3 + H2CrO4 2HcrO3 + H2O 2HcrO3 + 2R CHOH C O +2H3CrO3 R 2H3CrO3 + 3H2SO4 Cr2(SO4)3 + 6 H2O pudiendo escribir entonces la ecuación general como: 3R C HR + 2H2CrO4 + 3H2SO4 3RCR + Cr(SO4)3 + 8H2O OH Un alcohol terciario no tiene hidrógenos , y cualquier oxidación se debe llevar a cabo por ruptura de los enlaces carbono−carbino, necesitandoce para esto condiciones drásticas y además producen mezclas de compuestos ;de modo que no es oxidado. R ø R−−C−−OH ! no hay oxidación ø R Un alcohol terciario Para identificar una cetona o aldehído y el alcohol de donde puede provenir (previo a la oxidación) dichos 2 compuestos, existe una reacción de adición nucleofílica (característica común en aldehídos y cetonas) con un derivado de amoníaco como lo es la 2,4 dinitrofenilhidracina (reactivo de Brady) para formar un sólido insoluble, amarillo o rojo que es una dinitrofenilhidrazona. Compuestos que han sido ya caracterizados con el punto de fusión para permitir identificar entonces el aldehído o cetona que reaccionó. PROCEDIMIENTO EXPERIMENTAL. • Monte el equipo como de la figura 1. • En un balón de 50 ml coloque la muestra entregada en el laboratorio y 5 perlas de ebullición. • En el embudo coloque el agente oxidante ( dicromato de sodio en ácido sulfúrico) • Caliente el alcohol suavemente con un mechero hasta que este caliente al tacto y luego quite el mechero. • Añada la solución de dicromato de sodio con ácido sulfúrico gota a gota en el alcohol y debe calentar suavemente la mezcla de vez en cuando con el mechero, para asegurar que exista una destilación más o menos continua. Cuando la adición de la mezcla oxidante haya finalizado, caliente la mezcla suavemente con un mechero para completar la destilación del producto carbonílico. Preparación de 2,4 Dinitrofenilhidrazona: • Disuelva 1 ml del aldehido o cetona en 5 ml de etanol. • Añadaló a 5 ml de la solución de 2,4 dinitrofenilhidracina (Reactivo de Brady). • Se formaran cristales. Deje la mezcla reposar durante 15 minutos en un baño de hielo. • Recoja los cristales en un embudo pequeño por filtración a vacío. • Séquelos al aire. • Determine el punto de fusión de los cristales. • Busque los puntos de fusión de los derivados de los aldehidos o cetonas. • Identifique su aldehido o cetona y el alcohol usado en al oxidación. TOXICIDAD. Compuesto Toxicidad Nocivo si es inhalado, ingerido o absorbido por la piel. Causa irritación. El vapor es irritante de los ojos, membranas mucosas y vías respiratorias. La exposición puede causar nauseas, vómitos, excitación mental o depresión, soñolencia, incoordinación y atontamiento Nocivo si es ingerido, inhalado o absorvido por la piel. Puede causar irritación en los ojos y piel. La absorción dentro de la piel promueve la formación de methemoglobin la cual a altas concentraciones causa cianosis. Puede ser fatal si es inhalado, tomado o absorbido continuamente por la piel. Causa quemaduras. Es material extremadamente destructivo en los tejidos de las membranas mucosas y las vías respiratorias, ojos y piel. Es potencialmente cancerígeno. Puede causar ulceraciones y perforaciones del septum nasal. Puede ser fatal si es inhalado, tomado o absorbido continuamente por la piel. Causa quemaduras. Es material extremadamente destructivo en los tejidos de las membranas mucosas y las vías respiratorias, ojos y piel. Causa irritación de la piel. Etanol 2,4 dinitrofenilhidracina Dicromato de Sodio Acido Sulfúrico PROPIEDADES FÍSICAS. Compuesto Peso molecular Pto. Ebulli. Densidad Solubilidad 3 Etanol CH3CH2OH Na2CrO4 H2SO4 46.07 78.3 ºC 0.7894420 Misc aq, alc, et,cl 161.97 98.08 .......... 280 ºC d 2.723 1.8318 20 84 20 Muy miscible Lig s aq ; alc; s ácido. 2,4 dinitrofenilhidracina 198.14 Sólido inflamable .......... OBSERVACIONES EXPERIMENTALES. • Muestra Nº 43 es incolora • El agente oxidante es de color anaranjado fuerte • Al agregar al alcohol el agente oxidante la mezcla se torna verde claro y luego se hace más intenso el color verde. • Cuando se agregan gotas del oxidante al alcohol la mezcla ebulle sin que sea calentada por el mechero por un instante pequeño de tiempo. • A pesar que la mezcla ebulle sin tener que ser calentada continuamente es necesario el calentamiento suave con el mechero para logra la destilación. • El destilado presentó una coloración anaranjada muy tenue. • Al agregar el reactivo de Brady al destilado fue muy poca la cristalización y el matraz tubo que ser enfriado por un largo periodo de tiempo (20 min) en hielo para ver un poco más de cristales. • Los cristales formados por la hidracina t el aldehído o cetona son de color anaranjado fuerte. • El punto de fusión de los cristales de hidrazona al ser medido para dos muestras fueron: 109 ºC y 110 ºC. 4