Fundamentos de Espectroscopía
Anuncio

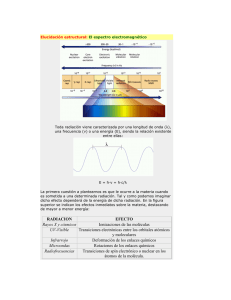
Fundamentos de Espectroscopía Prof. Jesús Hernández Trujillo Fac. Química, UNAM Se utiliza el potencial de Morse para describir la interacción entre los átomos en una molécula diatómica. Las gráficas que representan a la energía potencial como función de la posición son útiles para describir el movimiento de una partícula o de un sistema de partículas. En particular, en el caso de un sistema de dos partículas, la energía potencial es una función de la distancia entre ellas. El potencial de Morse, V (r), es utilizado frecuentemente para estudiar la interacción entre dos átomos A y B que conduce a la formación de la molécula AB: A + B → AB . Este potencial tiene la forma: V (r) = D(1 − e−β(r−ro ) )2 , (1) donde D, β y ro son constantes positivas que dependen del sistema bajo estudio. Por ejemplo, para la molécula H2 los valores de estas constantes son: 7.61 × 10−19 J, 0.0193 pm−1 y 74.1 pm, respectivamente. Además, r es la distancia entre los núcleos de los átomos A y B. 1. Realice las siguientes etapas para trazar la gráfica del potencial de Morse con respecto a r. a) Obtenga el límite de V (r) cuando r tiende a 0. lı́m V (r) = V (0) = D(1 − e−β(0−ro ) )2 = D(1 − eβro )2 > 0 r→0 La función es continua en r = 0. Además, note que V (0) es finito. Esto significa que, en principio, los átomos pueden encontrarse uno sobre el otro. Esta situación se conoce como el límite del átomo unido. b) Obtenga el límite de V (r) cuando r tiende a ∞. lı́m V (r) = D(1 − e−∞ )2 = D(1 − 0) = D r→∞ Es decir, la recta V = D es una asíntota de la función v(r). c) Encuentre los puntos críticos de V (r) y determine si son máximos, mínimos o puntos de inflexión. 1 Se trata de localizar los valores de r donde la primera o segunda derivadas del potencial, V (r), valen cero, y el valor del potencial en esos puntos. Cuando en un punto la primera derivada de la función vale cero y la segunda derivada es diferente de cero, se trata un extremo, es decir, de un máximo o un mínimo de la función; cuando la segunda derivada vale cero, se trata de un punto de inflexión.1 Primero, localicemos los máximos y mínimos. A la posición de estos puntos, cuyo número desconocemos, la denotaremos como rm . Para ésto, hay que evaluar la primera derivada de la función: dV = 2D(1 − e−β(r−ro ) )(βe−β(r−ro ) ) . dr (2) Después de igualarla a cero para r = rm , se obtiene 2D(1 − e−β(rm −ro ) )(βe−β(rm −ro ) ) = 0 . Es conveniente reacomodar los factores en la expresión anterior: h i 2Dβe−β(rm −ro ) (1 − e−β(rm −ro ) ) = 0 . Al dividirla entre 2Dβe−β(rm −ro ) se obtiene: 1 − e−β(rm −ro ) = 0 . Esta división es posible debido a que el factor 2Dβe−β(rm −ro ) siempre es diferente de cero. Al pasar el término exponencial al segundo miembro de la igualdad y después de obtener el logaritmo natural en ambos lados, se llega a: ln 1 = ln e−β(rm −ro ) 0 = −β(rm − ro ) y por lo tanto, rm = ro , (3) ya que β 6= 0. Sólo hay un punto crítico correspondiente a la primera derivada. Aún falta determinar si se trata de un máximo o un mínimo. Para ésto, hay que obtener la segunda derivada del potencial, V (r). Cuando se trata del 1 También es posible que tanto la primera como la segunda derivadas de una función valgan cero en un punto; en este caso, no se trata de un extremo, sólo de un punto de inflexión. 2 mínimo de una función, su segunda derivada es positiva; en el caso de un máximo, ésta es negativa. d dV d2 V = d r2 dr dr i d h 2D(1 − e−β(r−ro ) )(βe−β(r−ro ) ) dr i d h = 2Dβ (1 − e−β(r−ro ) )(e−β(r−ro ) ) dr i d h −β(r−ro ) = 2Dβ e − e−2β(r−ro ) dr = El resultado es: d2 V = 2Dβ 2 (−1 + 2e−β(r−ro ) )e−β(r−ro ) d r2 (4) Al sustituir r = rm = ro en (4) se obtiene: d2 V d r2 = 2Dβ 2 (−1 + 2e−β(ro −ro ) )e−β(ro −ro ) = 2Dβ 2 (−1 + 2e0 )e0 . (5) r=rm =ro Y como e0 = 1, la segunda derivada del potencial en ese punto se reduce a d2 V d r2 = 2Dβ 2 > 0 . r=rm =ro Debido a que esta segunda derivada es mayor que cero (pues las constantes D y β son positivas), ro es un mínimo. El valor del potencial en este punto se obtiene al sustituir r = ro en (1): V (ro ) = D(1 − e−β(ro −ro ) )2 = D(1 − e0 ) = D(1 − 1) = 0 . Aún falta localizar la posición de los puntos de inflexión, es decir, los valores de r donde la segunda derivada de la función vale cero. A la posición de estos puntos la denotamos como ri . Al evaluar (4) en r = ri , obtenemos: 2Dβ 2 (−1 + 2e−β(ri −ro ) )e−β(ri −ro ) = 0 . Después de reacomodar los factores en la igualdad anterior, se obtiene: h i 2Dβ 2 e−β(ri −ro ) (−1 + 2e−β(ri −ro ) = 0. Dado que el factor 2Dβ 2 e−β(ri −ro ) es siempre diferente de cero, dividimos ambos lados de la igualdad anterior entre éste: 3 −1 + 2e−β(ri −ro ) = 0 . Después de pasar el primer término al segundo miembro de la igualdad y de aplicar el logaritmo natural en ambos lados de ésta, se llega a: ln 2e−β(ri −ro ) = ln 1 ln 2 − β(ri − ro ) = 0 A partir de la igualdad anterior se obtiene 1 ln 2 . β ri = ro + (6) Note que ri > ro ya que tanto 1/β como ln 2 son positivos y, por lo tanto, su producto también lo es. Aún falta determinar el valor de V (ri ). Al sustituir r = ri en la ecuación (1): V (ri ) = D(1 − e−β(ri −ro ) )2 −β(ro + β1 ln 2−ro ) 2 = D(1 − e ) D = D(1 − e− ln 2 )2 = . 4 En resumen, el potencial de Morse tiene un mínimo en r = ro , es decir, cuando la distancia entre los átomos A y B vale ro . La función tiene también un punto de inflexión en r = ro + β1 ln 2, que corresponde a una separación internuclear mayor que ro . Además, V (r) → D cuando r → ∞, lo cual significa que, cuando la distancia entre los átomos A y B se hace muy grande, la energía potencial tiende al valor D. Finalmente, cuando la distancia entre los núcleos de los átomos se hace muy pequeña, el potencial tiende al valor D(1 − eβro ) > 0. d) Trace la gráfica del potencial para la molécula de Hidrógeno. Para trazar la gráfica de la función, ecuación (1), se utilizarán las constantes que corresponden a la molécula de hidrógeno: D = 7.61 × 10−19 J, β = 0.0193 pm−1 y ro = 74.1 pm. De acuerdo con (3) y (6), el mínimo se encuentra en rm = 74.1 pm y el punto de inflexión en ri = 110.0 pm. Note que en ri cambia la curvatura de la función. 4 Potencial de Morse de la molécula H2 30 V(x) (10−19 J) 25 20 15 10 D 5 · 0 0 50 100 150 200 250 300 350 400 450 r (pm) ro ri 2. Determine los rangos de distancia donde las fuerzas entre los átomos son atractivas y aquellas donde son repulsivas. La fuerza ejercida entre los átomos se obtiene a partir del potencial: F (r) = − dV . dr (7) En el caso del potencial de Morse, la fuerza se obtiene sustituyendo la ecuación (2) en (7): F (r) = −2D(1 − e−β(r−ro ) )(βe−β(r−ro ) ) . la cual puede reescribirse como: h i F (r) = 2Dβe−β(r−ro ) (e−β(r−ro ) − 1) . (8) El factor 2Dβe−β(r−ro ) en la expresión anterior siempre es positivo debido a que D, β y la función exponencial siempre lo son. Por lo tanto, el signo de la fuerza estará dado por el signo del factor (e−β(r−ro ) − 1). Note que cuando r = ro , este factor vale cero y, por lo tanto, en este valor de r la fuerza vale cero. A ro la llamamos distancia de enlace de equilibrio. 5 En la siguiente figura se representa la fuerza que actúa entre los átomos y su relación con el potencial. Potencial de Morse y fuerza en la molécula H2 F(x) (10−19 N) V(x) (10−19 J) 30 25 Potencial 20 15 10 5 300 25 20 15 10 5 0 −5 −10 Fuerza F=0 F>0 F<0 Máxima atracción 0 50 100 ro 150 200 250 300 350 400 450 r (pm) ri De la ecuación (8), F (r) > 0 cuando r < ro . En este caso, la distancia entre los átomos es menor a la distancia de equilibrio y éstos tienden a alejarse uno del otro. Esto corresponde a una fuerza repulsiva. De manera análoga, F (r) < 0 cuando r > ro y la distancia entre los átomos tiende a disminuir debido a una fuerza atractiva entre ellos. Geométricamente, la derivada del potencial es la pendiente de la recta tangente a la gráfica de V (r) en un punto dado. Además, por la ecuación (7), para cada valor de r, la fuerza tiene signo contrario al de la pendiente de esa recta. Por ejemplo, cuando r < ro la pendiente de la recta tangente a la curva es negativa y, por lo tanto, la fuerza entre los átomos es positiva (repulsiva). Esta situaciones pueden apreciarse en la figura anterior. 3. Encuentre las posiciones de los puntos de retorno cuando se satisfacen las siguientes condiciones para la energía mecánica del sistema: (a) 0 < E1 < D, (b) E2 tiende a 0 y (c) E3 > D. Explique la dinámica del sistema en cada caso. La energía mecánica del sistema de dos partículas está dada por E= 1 2 µv + V (r) . 2 (9) mA mB mA + mB (10) En esta expresión, µ= 6 es la masa reducida del sistema de dos partículas de masas mA y mB , v es la razón de cambio de la posición relativa entre los átomos y, en este caso, V (r) es el potencial de Morse, definido en (1). Un punto de retorno es aquel donde la velocidad vale cero. Por lo tanto, en un punto de retorno rr la energía cinética, Ec = (1/2)µv 2 , vale cero y, de acuerdo con (9), V (rr ) = E. En la siguiente figura se presentan tres casos de punto de retorno con energía mecánica con valores E1 , E2 y E3 . Potencial de Morse de la molécula H2 20 V(x) (10−19 J) 15 R 10 E3 · 5 P E1 E2 0 · 0 Q · · 50 100 150 200 250 300 350 400 450 ro r (pm) a) 0 < E1 < D En el punto de retorno P, la fuerza entre los átomos es positiva y éstos se repelen. Cuando alcanzan la distancia de equilibrio, ro , la fuerza cambia de signo y se hace atractiva. Sin embargo, debido a la inercia, los átomos continuan alejándose uno del otro. Debido a esa fuerza atractiva, los átomos se frenan hasta alcanzar el punto de retorno Q y la distancia entre los átomos comienza a disminuir. Al pasar nuevamente el punto ro , la fuerza cambia de signo y se hace repulsiva; después, los átomos alcanzan el punto de retorno P y empieza un nuevo ciclo. A partir de este análisis se concluye que la molécula oscila alrededor de la posición de equilibrio. b) E2 tiende a 0 Cuando la energía mecánica es menor que el valor E1 los puntos de retorno están más cercanos entre sí. En el límite cuando la energía mecánica vale cero, E2 = 0, la fuerza que actúa sobre el átomo B también vale cero, F(ro ) 7 = 0. Dado que el sistema está en equilibrio, entonces no hay oscilación; la separación internuclear permanece constante. NOTA: Uno de los resultados del tratamiento cuántico de este probléma es que la molécula no puede tener nunca el valor de energía mecánica E2 = 0; la energía de una molécula diatómica es siempre diferente de cero. Sin embargo, el resultado del inciso (a) permanece válido; ésto es, una molécula siempre oscilará alrededor de la longitud de enlace de equilibrio. c) E3 > D En este caso sólo hay un punto de retorno, R; por lo tanto, el átomo B eventualmente se alejará del átomo A hasta una distancia infinita; es decir, la molécula se disociará. NOTA: Siempre que la energía mecánica sea menor que D pero se acerque ese valor, habrá dos puntos de retorno y, por lo tanto, la molécula oscilará. Cuando cuando E sea mayor que D y se acerca ese valor, sólo habrá un punto de retorno y entonces la molécula se disociará. Este argumento permite interpretar al parámetro D como la energía de disociación de la molécula. El siguiente inciso es consistente con esta interpretación. 4. Calcule el trabajo necesario para separar a los átomos desde la distancia de equilibrio hasta una distancia infinita, es decir, el trabajo que es necesario realizar para disociar la molécula. En el caso del potencial de Morse, el trabajo necesario para separar a los átomos desde una distancia r1 hasta r2 es W = r2 Z F (r) dr (11) r1 En este caso, la fuerza F entre los átomos puede considerarse como la fuerza restitutiva de un resorte que modela al enlace químico. Dado que F (r) es conservativa, es decir, que F (r) se expresa como menos la derivada de un potencial, es posible sustituir (7) en (11): W =− Z r2 r1 d V (r) dr . dr Además, la diferencial de V (r) se define como dV (r) = Por lo tanto, el trabajo es 8 d V (r) dr . dr W =− Z r2 r1 dV (r) = −V (r)|rr21 . Es decir, (12) W = V (r1 ) − V (r2 ) En el caso del trabajo realizado para disociar la molécula, se utiliza r1 = ro , r2 = ∞, y se sustituye (1) en (12): W = V (ro ) − V (∞) = D(1 − e−β(ro −ro ) )2 − D(1 − e−∞ )2 = D(1 − e0 )2 − D(1 − 0)2 = −D Esta es la cantidad de trabajo realizado por la fuerza restitutiva del resorte. Para disociar a la molécula, un agente externo debe realizar un trabajo igual a −W = D. De esta manera, se observa que la magnitud del trabajo coincide con la interpretación de D como la energía de disociación mencionada anteriormente. 5. Realice el desarrollo del potencial de Morse en series de Taylor alrededor de la longitud de enlace de equilibrio, r = ro . Además, obtén la constante de fuerza del enlace y la frecuencia vibracional de la molécula H2 . La serie de Taylor del potencial de Morse alrededor de la longitud de enlace equilibrio está dada por la suma infinita: dV 1 d2 V (r − r ) + V (r) = V (ro ) + o dr r=ro 2 dr 2 (r − ro )2 + . . . (13) r=ro En (13), sólo se han presentado los términos que incluyen hasta la segunda derivada. Cuando se desprecian los términos que involucran las derivadas de orden mayor que dos, se dice que se ha realizado el desarrollo de la función a orden dos. Esta aproximación será valida sólo para valores de r cercanos a ro . Además, debido a que r = ro es la longitud de enlace de equilibrio, entonces, de acuerdo a (7), F (r0 ) = − dV /dr|r=ro = 0. Es decir, la primera derivada en (13) vale cero. Por lo tanto, a orden dos, (13) se reduce a: 1 d2 V V (r) = V (ro ) + 2 dr 2 9 (r − ro )2 . r=ro La segunda derivada en la expresión anterior está evaluada en el punto r = ro y, por lo tanto, es una constante: d2 V k= dr 2 (14) r=ro Al sustituir k en la expresión de V (r), se obtiene: k V (r) = V (ro ) + (r − ro )2 . 2 Además, como V (ro ) = 0, el resultado final es: V (r) = k (r − ro )2 . 2 (15) Esta expresión indica cuando r ≈ ro el potencial de Morse se puede aproximar mediante una parábola. 14 V(x) (10−19 J) 12 2 → ½ kx 10 8 6 4 → Potencial de Morse 2 0 0 50 100 150 200 250 r (pm) 300 350 400 Note además que al sustituir (15) en (7) se obtiene: i d k k d h k 2 F (r) = − (r − ro ) = − (r − ro )2 = − [2(r − ro )] dr 2 2 dr 2 Es decir, 10 F (r) = −k(r − ro ) . Esto significa que a deformaciones del enlace pequeñas en relación a la distancia de enlace de equilibrio, es decir cuando (r − ro ) ≈ 0, la fuerza entre los átomos obedece la ley de Hooke. Por lo tanto, k puede interpretarse como la constante de rigidez del enlace. En el caso del potencial de Morse, es posible obtener la constante k al sustitur la segunda derivada de V (r) evaluada en r = ro , (5), en la expresión (14): k = 2Dβ 2 (16) En el caso de la molécula H2 , como D = 7.61 × 10−19 J y β = 0.0193 pm−1 = 1,93 × 1010 m−1 . Por lo tanto, k = 2(7.61 × 10−19 J)(1.93 × 1010 m−1 )2 = 566.93J m−2 = 566.93N/m . Además, la frecuencia de oscilación del enlace es 1 ν= 2π s k . µ En el caso del H2 , de acuerdo con (10), µ= m2H mH mH mH 1.66 × 10−27 kg = = = = 8.30 × 10−28 kg . mH + mH 2mH 2 2 Por lo tanto, la frecuencia vibracional del H2 es 1 ν= 2π s 566.93N/m = 1.32 × 1014 s−1 . 8.30 × 10−28 kg Es decir, la molécula efectúa 1.32 × 1014 vibraciones por segundo. 11 (17)