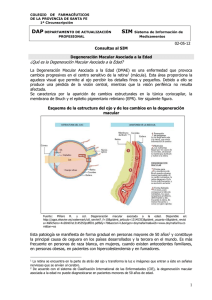
UNA NUEVA MIRADA EN OFTALMOLOGÍA MONOGRAFÍA DE
Anuncio

MONOGRAFÍA DE PRODUCTO UNA NUEVA MIRADA EN OFTALMOLOGÍA CONTENIDOS I. resumen ejecutivo 04 II. fundamentos 08 A) Información general sobre la enfermedad DMAE húmeda 09 IV. Estudios en curso 73 A) Estudios en curso B) Edema macular diabético C) Oclusión de la vena central de la retina A) El peso de la enfermedad (ceguera, otras secuelas, impacto sobre la calidad de vida) B) Epidemiología (prevalencia e incidencia mundial/regional, factores de riesgo) D) Oclusión de las ramas venosas de la retina C) Patogénesis E) NVC secundaria a mIopía B) Información general sobre el tratamiento VEGF 17 V. PROSPECTO A) Tratamientos dirigidos a Terapia anti-VEGF 83 PROSPECTO B) Otros tratamientos 83 C) Estudios de regímenes de administración para terapia anti-VEGF (SAILOR, HORIZON, EXCITE) D) Estudios comparativos entre ranibizumab y bevacizumab patrocinados por agencias gubernamentales VI. REFERENCIAS III. EYLIA® 39 93 REFERENCIAS 94 A) Estructura de la proteína de fusión B) Mecanismo de acción C) farmacocinética D) inmunogenicidad E) Estudios clínicos eY/2 eY/3 i. resumen ejecutivo I. RESUMEN EJECUTIVO L a degeneración macular asociada a la edad (DMAE), neovascular o húmeda, es una de las causas principales de pérdida de visión en individuos de 50 o más años de edad en los países desarrollados1-2. La DMAE húmeda reduce sustancialmente la calidad de vida relacionada y no relacionada con la visión y causa discapacidad significativa3. Es de destacar que la pérdida de visión asociada con DMAE húmeda aumenta significativamente el riesgo de accidentes, los cuales, a su vez, pueden ocasionar internaciones y otras complicaciones3. Figura 1.1. Grilla de Amsler. El factor de crecimiento del endotelio vascular (VEGF), es el agente patogénico primario de la DMAE húmeda, induciendo el desarrollo de nuevos vasos sanguíneos desde las capas internas del ojo, lo que se conoce como neovascularización coroidea (NVC). Estos vasos sanguíneos nuevos son inmaduros y pierden lípidos, líquido y sangre, lo que causa edema, inflamación y alteraciones de la arquitectura retiniana, que eventualmente produce visión borrosa, distorsión de la imagen (metamorfopsia) y pérdida de visión5-6. El estándar actual de tratamiento de DMAE húmeda es terapia anti-VEGF administrada por medio de inyección intravítrea. Ranibizumab, un fragmento de anticuerpo monoclonal 7-8dirigido contra el VEGF está indicado para el tratamiento de la DMAE húmeda y patologías retinianas. Bevacizumab (un anticuerpo monoclonal recombinante humanizado anti-VEGF) está aprobado para varias indicaciones oncológicas9-10. Bevacizumab administrado en inyección intravítrea se usa ampliamente en la población con DMAE húmeda, pero no tiene autorización para su comercialización en esta indicación. Tanto ranibizumab como bevacizumab han mostrado no solamente prevenir la pérdida de visión sino también mejorar la agudeza visual en pacientes con DMAE húmeda. a En el estudio CATT, más del 90% de los pacientes tratados con ranibizumab o bevacizumab mensual no experimentan pérdida de visión y la ganancia media en agudeza visual es de aproximadamente 8 letras después de 1 año de tratamiento11. Ensayos randomizados controlados mostraron que ranibizumab y bevacizumab mensuales son equivalentes o casi equivalentes en términos de impacto sobre la agudeza visual a 1 año11. Sin embargo, bevacizumab podría asociarse con una incidencia mayor de eventos adversos serios sistémicos11. UNA NUEVA MIRADA EN OFTALMOLOGÍA eY/4 eY/5 i. resumen ejecutivo i. resumen ejecutivo En los regímenes PRN (a demanda), los pacientes son tratados mensualmente durante 3 meses y luego tratados nuevamente según sea necesario, en base a criterio médico de acuerdo a presencia de líquido en la retina, y/ó aumento del edema, disminución de la agudeza visual entre otros. Aunque puede disminuir el número de inyecciones, este enfoque reactivo para el tratamiento de la DMAE húmeda requiere de monitoreo mensual para determinar la necesidad de inyección y otras visitas para la inyección cuando sea necesario. Los ensayos que comparan los regímenes mensuales con los PRN de ranibizumab y bevacizumab han demostrado que la administración mensual de ranibizumab en el primer año produce ganancias visuales óptimas y que el cambio a regímenes PRN de ranibizumab y bevacizumab pueden producir pérdida de las ganancias de agudeza visual, salvo que se lleve a cabo un monitoreo regular y frecuente11-13. Por lo tanto, a pesar de la disponibilidad de tratamientos efectivos para este trastorno altamente discapacitante, todavía existe la necesidad de una terapia anti-VEGF que proporcione ganancias óptimas en agudeza visual, con un perfil de efectos secundarios oculares y sistémicos bajos y un régimen de administración alcanzable bajo condiciones del mundo real. EYLIA®(aflibercept solución inyectable) es una proteína de fusión soluble que actúa como receptor señuelo para todas las isoformas de VEGF-A y PIGF con mayor afinidad que los receptores VEGF naturales. A diferencia de bevacizumab, que forma complejos inmunes multiméricos que son rápidamente eliminados de la circulación y pueden depositarse en los tejidos, EYLIA® forma un complejo inerte, muy estable, 1:1 con la molécula VEGF sostenida entre los dos extremos de la proteína EYLIA®16. Este aumento en la afinidad de unión sugiere que EYLIA® puede tener una duración más prolongada y una mayor potencia en el ojo, permitiendo una administración menos frecuente y reduciendo la carga que representan las inyecciones y el monitoreo mensual. EYLIA® se administra mediante inyección intravítrea bimensualmente. En 2 estudios clínicos grandes, randomizados, de no inferioridad, EYLIA® administrado bimensualmente demostró ser clínicamente equivalente a ranibizumab administrado mensualmente. EYLIA® administrado cada 2 meses también produjo mejoras en las mediciones anatómicas (reducción del espesor central de la retina) equivalentes a aquellas de ranibizumab administrado mensualmente,17 a la vez que reduce el peso del tratamiento en términos de número de inyecciones, monitoreo y visitas al consultorio. b a Ensayos de comparación de tratamientos para DMAE b Estudios clínicos no han demostrado efectos clínicos relacionados a uniones más potentes RESUMEN EL FACTOR DE CRECIMIENTO DE ENDOTELIO VASCULAR (VEGF), ES EL CAUSANTE DE LA NEOVASCULARIZACIÓN COROIDEA QUE PRODUCE VISION BORROSA, DISTORSION Y PERDIDA DE LA VISIÓN Y ALTERACIÓN DE LA ARQUITECTURA RETINIANA. EL TRATAMIENTO STANDARD EN TERAPIA ANTI-VEGF POR INYECCIÓN INTRAVITREA SON LOS ANTICUERPOS MONOCLONALES. (ATC) BEVACIZUMAB, ATC MONOCLONAL NO AUTORIZADO PARA LA DMAE HUMEDA PREVIENE LA PERDIDA DE LA VISION Y LA MEJORA PERO SE ASOCIA CON UNA INCIDENCIA MAYOR DE EFECTOS ADVERSOS SERIOS. OTRO ATC MONOCLONAL ES EL RANIBIZUMAB QUE JUNTO AL BEVACIZUMAB DAN UNA GANACIA VISUAL DE 8 LETRAS EN UN AÑO DE TRATAMIENTO. EL ENFOQUE REACTIVO O PNR CON MONITOREO MENSUAL O LAS APLICACIONES MENSUALES NO LOGRAN SATISFACER LA NECESIDAD DE UN TRATAMENTO OPTIMO QUE PROPORCIONE CALIDAD VISUAL CON MENOS EFECTOS COLATERALES Y CON MEJOR REGIMEN DE ADMINISTRACIÓN. EYLIA® -AFLIBERCEPT- ES UNA PROTEINA DE FUSIÓN SOLUBLE, SE UNE AL VEGF CON MAYOR AFINIDAD QUE RANIBIZUMAB Y BEVACIZUMAB BRINDANDO MEJOR Y MAYOR DURACION DE LA RESPUESTA, ADMINISTRACION MENOS FRECUENTE Y MENOR FRECUENCIA DE MONITOREO. EYLIA® SE ADMINISTRA MEDIANTE INYECCION INTRAVITREA CADA 2 MESES EQUIVALENTE A LA ADMINISTRACIÓN MENSUAL DE RANIBIZUMAB. MEJORA LAS MEDICIONES ANATÓMICAS Y BRINDA GANACIAS VISUALES OPTIMAS. LA DEGENERACION MACULAR -DMAE- PRODUCE PERDIDA DE LA VISION EN MAYORES DE 50 AÑOS, REDUCE LA CALIDAD DE VIDA Y CAUSA DISCAPACIDAD SIGNIFICATIVA. eY/6 eY/7 Información general sobre la enfermedad DMAE húmeda INformación general sobre el tratamiento VEGF El impacto de la degeneración macular húmeda relacionada con la edad (DMAE) y su tratamiento. La DMAE es la causa principal de la pérdida irreversible de la visión en individuos ≥50 años de edad en países desarrollados y la tercera causa a nivel mundial1-2. La DMAE avanzada o tardía puede ser no neovascular (seca) o neovascular (húmeda). La DMAE húmeda avanzada se caracteriza por neovascularización coroidea (NVC), el desarrollo de vasos sanguíneos nuevos desde las capas más profundas de la retina. Esta filtración puede causar edema, inflamación y alteraciones en la arquitectura retiniana lo que eventualmente produce visión borrosa y distorsión de la visión. Si no se trata, el área de neovascularización se expande rápidamente y se desarrolla una cicatriz fibrosa en la mácula. Desgraciadamente, este proceso es irreversible. El problema económico asociado con la pérdida de visión relacionada con DMAE húmeda es sustancial. Además de los costos médicos asociados con la visión (por ejemplo, ayudas para ver, visitas al oftalmólogo) existen costos no relacionados con la visión asociados con las resultantes caídas y fracturas, discapacidad, internaciones, provisión formal de cuidado y cuidado en hogares de ancianos20. UNA NUEVA MIRADA EN OFTALMOLOGÍA eY/8 eY/9 II. fundamentos ii. FUNDAMENTOS Información general sobre DMAE húmeda II. fundamentos II. fundamentos Los pacientes con DMAE húmeda también pueden tener una pérdida de visión súbita e importante dentro de días o semanas de desarrollar DMAE húmeda como resultado de una hemorragia subretiniana o acumulación de líquido secundario a NVC. necesaria una inyección adicional. Generalmente, no puede administrarse la inyección el mismo día que se toma la decisión porque debe obtenerse el consentimiento adicional del paciente, lo cual requiere que los pacientes vuelvan al consultorio por segunda vez. Estos monitoreos y visitas adicionales pueden significar una carga extra en el tratamiento para los pacientes y para la utilización de los recursos y costos sanitarios. Más aún, dado que la población con DMAE es mayor y con deterioro en la visión las visitas múltiples al consultorio pueden resultar físicamente fatigantes. Aunque la mayoría de las personas con DMAE avanzada no se vuelven completamente ciegas, la pérdida de visión a menudo reduce marcadamente la calidad de vida (QOL) en pacientes con esta enfermedad, aunque solamente esté afectado un ojo. Un meta-análisis reciente, mostró que dentro de los 3 años del inicio de la neovascularización, cerca del 75% de los pacientes sin tratar tendrán un nivel de visión de 20/200 o peor, lo que es consistente con la definición de deterioro visual severo, según la Organización Mundial de la Salud18. Aunque la DMAE húmeda representa solamente el 10 al 15% de los casos de DMAE, es responsable del 80% de la pérdida de visión severa o ceguera legal asociada con DMAE5. La mayoría de los pacientes con DMAE húmeda sin tratar experimentan una progresión a pérdida severa de la visión en el ojo afectado dentro de los 2 años del diagnóstico19. Durante los últimos 20 años el tratamiento de la DMAE húmeda ha avanzado dramáticamente con el descubrimiento de agentes dirigidos contra el factor de crecimiento del endotelio vascular (VEGF). Estos agentes han permitido a los pacientes con este trastorno potencialmente causante de ceguera no sólo prevenir la pérdida de visión, sino también a ganar agudeza visual. Sin embargo, el peso del tratamiento asociado con la inyección intravítrea (IVT) de agentes anti-VEGF actualmente disponibles es sustancial. Los pacientes deben someterse con una frecuencia mensual a un procedimiento de pasos múltiples que incluye la inserción de un blefaróstato para mantener el ojo abierto y la inserción de una aguja dentro del humor vítreo. En algunos países, se recomienda una visita de seguimiento después de cada inyección ya sea al consultorio de un especialista en retina o de un oftalmólogo general. Aun cuando las inyecciones se administren con menos frecuencia, se requiere monitoreo mensual para determinar si es eY/10 RESUMEN LA DMAE HÚMEDA O NEOVASCULAR ES LA CAUSA PRINCIPAL DE PÉRDIDA IRREVERSIBLE DE LA VISIÓN DESPUES DE LOS 50 AÑOS. SE CARACTERIZA POR EL DESARROLLO DE VASOS QUE PRODUCEN VISIÓN BORROSA Y DISTORSIÓN DE LA MISMA. Sin tratamiento puede desarrollarse UNA CICATRIZ FIBROSA IRREVERSIBLE. LA DMAE CAUSA PROBLEMAS ECONÓMICOS ASOCIADOS NO SOLO A LA GRAVE PÉRDIDA DE VISIÓN SINO A TODAS LAS CONSECUENCIAS eY/11 II. fundamentos fundamentos II. fundamentos fundamentos RELACIONADAS CON LA MISMA DISCAPACIDAD: FRACTURAS, INTERNACIONES y deterioro de la CALIDAD DE VIDA. LA DMAE HUMEDA COMPRENDE EL 15% DE los casos de DMAE PERO REPRESENTA EL 80% DE LA CEGUERA ASOCIADA A ESTA ENFERMEDAD. SI BIEN EL TRATAMIENTO DE LA DMAE HA PROGRESADO considerablemente EN LOS ULTIMOS 20 AÑOS, AÚN QUEDA POR RESOLVERSE LA DETERMINACIÓN DE LA TERAPIA ÓPTIMA, YA QUE LAS DROGAS DISPONIBLES REQUIEREN, O BIEN DE UNA INYECCIÓN MENSUAL, O MONITOREO FRECUENTE PARA DECIDIR LA TERAPÉUTICA. con el desarrollo de DMAE húmeda. Los fumadores tienen el doble de probabilidad de desarrollar DMAE húmeda comparado con los no fumadores. Aunque el mecanismo mediante el cual el fumar aumenta el riesgo de DMAE húmeda no es claro, la hipótesis es que fumar provoca un daño oxidativo repetido a los tejidos como la retina externa y disminuye los niveles de circulación de antioxidantes22. Tabla 1.1. Prevalencia de DMAE tardía en países y poblaciones seleccionadas24-33. PAÍS POBLACIÓN, EDAD PREVALENCIA Estados Unidos24 Blanca, ≥ 40 a 1,64% Australia25 Blanca, ≥ 50 a 2,06% Países Bajos26 Blanca, ≥ 55 a 1,65% 27 Blanca, ≥ 60 a 1,9% 28 Blanca, ≥ 50 a 2,5% Noruega29 Blanca, ≥ 50 a 2,8% India30 General, ≥ 60 a 1,2% China31 Francia Grecia Epidemiología de la DMAE General, ≥ 40 a 0,2% 32 General, ≥ 65 a 1,9% 33 General, ≥ 50 a 0,89% Taiwán Japón C on el aumento en la edad promedio de la población, se estima que para el año 2020, se encontrarán afectadas 80 millones de personas en el mundo21. Aunque la DMAE húmeda representa solamente el 10 al 15% de los casos de DMAE, ésta es responsable del 80% de la pérdida severa de visión o ceguera legal asociada con DMAE5. Se han identificado varios factores de riesgo para DMAE, algunos de ellos tienen una asociación más fuerte (por ejemplo, edad avanzada, predisposición genética, antecedentes de cirugía de cataratas y antecedentes o actual tabaquismo) que otros (por ejemplo, mayor índice de masa corporal [IMC], raza, antecedentes de enfermedad cardiovascular, etnia, diabetes, color del iris)22. RESUMEN CON EL AUMENTO DEL A EXPECTATIVA DE VIDA SE PREVE UN INCREMENTO SUSTANCIAL DE ESTA PATOLOGÍA, YA QUE LA EDAD, ADEMÁS DE FACTORES GENÉTICOS, CIRUGÍA DE CATARATAS Y TABAQUISMO, ES CONSIDERADA UNO DE LOS FACTORES DE RIESGO MÁS IMPORTANTES DE ESTA ENFERMEDAD. El aumento de la edad es un factor de riesgo establecido para DMAE. Los individuos de entre 6080 años de edad tienen aproximadamente un riesgo 3 veces mayor de desarrollar DMAE comparado con aquellos <60 años22. Los factores genéticos juegan un papel clave en la patogénesis de DMAE. Varias anomalías genéticas se han ligado a la susceptibilidad para padecer DMAE. La más importante de estas afecta al gen CFH, que codifica el factor H del complemento, un regulador de la vía alterna del complemento. Antecedentes de más de 10 paquetes-año de cigarrillos se han asociado independientemente eY/12 eY/13 II. fundamentos II. fundamentos PATOGÉNESIS Importancia de los factores de crecimiento en la patogénesis de la DMAE húmeda C on la edad, comienzan a formarse depósitos focales de residuos no celulares, conocidos como drusas, entre el epitelio pigmentario de la retina (EPR) y la membrana de Bruch, detrás de la retina. Estas pueden dañar el EPR y la respuesta inflamatoria crónica puede producir grandes áreas de atrofia retinal, expresión de proteínas VEGF o ambas5. FOTORRECEPTORES M iembros de la familia de VEGF y sus receptores juegan un papel esencial en el desarrollo y mantenimiento de la vasculatura sanguínea y linfática. Hasta la fecha, se han identificado en humanos 5 VEGF diferentes: VEGF-A, -B, -C, -D y PIGF14. En la patología ocular, se conoce que el VEGF-A y el PIGF se encuentran involucrados en forma predominante en la inducción de neovascularización ocular6. El VEGF-B puede también tener un papel, pero puede cumplir una función antiapoptósica más que angiogénica36. * VEGF-A VEGF-A proteína que promueve la vasculogénesis y la angiogénesis37, asociada con el crecimiento patológico de nuevos vasos sanguíneos frágiles en el ojo junto con permeabilidad vascular anormal y subsiguientes cambios edematosos en los tejidos comprometidos6. En la DMAE húmeda, se forman vasos sanguíneos anormales debajo y dentro de la mácula, un proceso conocido como neovascularización coroidea (NVC). Si no se trata la filtración y el edema o sangrado resultante de esos vasos anormales, se produce la degeneración neuronal y la pérdida permanente de la visión central. EPR MEMBRANA DE BRUCH COROIDES En los últimos años, se ha establecido el papel fundamental de los factores de crecimiento, en particular el VEGF en la patogénesis de la DMAE húmeda. El VEGF-A (también conocido como VEGF) y el factor de crecimiento placentario (PIGF) son miembros de la familia VEGF de factores angiogénicos que pueden actuar como potentes factores mitógenos, quimiotácticos y en la permeabilidad vascular para las células endoteliales. El VEGF actúa a través de dos receptores tirosin-quinasas (RTK), VEGFR-1 y VEGFR-2, presentes en la superficie de las células endoteliales34. Una variedad de enfermedades oculares está relacionada con la neovascularización patológica, filtración vascular y/o puede producir engrosamiento y edema de la retina, que contribuye a la pérdida de visión35. eY/14 El VEGF-A se considera el factor angiogénico prototípico que, con un efecto angiogénico potente de estructura cristalina, muestra dos monómeros que se encuentran organizados de forma anti paralela para formar un dímero38. Se han identificado varias isoformas del VEGF-A con diferentes actividades biológicas. La VEGF165 es la que se expresa más abundantemente en los humanos14. * PIGF El factor angiogénico PIGF, también miembro de la superfamilia de los VEGF, se cree que juega un papel importante en la angiogénesis patológica39-40. Hasta la fecha se han descripto 3 isoformas de PIGF: PIGF-1, -2 y -341. Se han propuesto diferentes mecanismos para una posible interacción entre PIGF y VEGF-A, incluyendo la activación de VEGFR-1, mediante la formación de heterodímeros con PIGF y VEGF-A o el desplazamiento del VEGF-A por el PIGF del VEGFR-1, dejando, por lo tanto, al VEGF-A disponible para unirse al VEGFR-240. Alternativamente, se ha sugerido que el PIGF podría estimular directamente la angiogénesis mediante la transmisión de señales intercelulares a través del VEGFR-1 ligado a la membrana. eY/15 Además, por medio de la activación del VEGFR-1, se piensa que el PIGF-1 regula la función de barrera hemato- retiniana externa mediante un efecto directo sobre la unión oclusiva de la célula RPE41. El PIGF puede jugar un papel en el reclutamiento de células inflamatorias hacia adentro de la retina afectada, produciendo la liberación del VEGF y otros mediadores inflamatorios, continuando en consecuencia el ciclo de angiogénesis e inflamación6. Dado que el VEGF es un inductor de vital importancia para la NVC en DMAE húmeda, las terapias anti-VEGF se han convertido en la piedra angular del manejo de esta patología. Las terapias antiVEGF actualmente en uso incluyen: ranibizumab y bevacizumab (off-label). Todos estos agentes se administran por medio de inyección intravítrea. RESUMEN * VEGF-B El papel preciso del VEGF-B en el desarrollo de NVC no se comprende totalmente y es tema de investigación continua. No existe evidencia definitiva del papel de VEGF-B como factor angiogénico. Una revisión concluyó que el VEGF-B puede ser el único miembro de la familia VEGF con características potencialmente potentes de supervivencia y efectos antiapoptósicos, pero carece de actividad angiogénica general36. * Receptores del VEGF Los receptores del VEGF (VEGFR) son miembros de la superfamilia RTK y pertenecen a la misma subclase de los receptores para los factores de crecimiento derivados de plaquetas (PDGF) y los factores de crecimiento de fibroblastos (FGF). El VEGFR-1 y el VEGFR-2 son los VEGFR mejor caracterizados. El receptor VEGFR-1, también conocido FLT-1, puede servir como señuelo inerte que une al VEGF, regulando por lo tanto la disponibilidad de VEGF para unirse al VEGFR-240. El VEGFR-2, también conocido como FLK-1, se encuentra predominantemente en la superficie de las células endoteliales vasculares6. Está implicado en todos los aspectos de la biología celular endotelial vascular normal y patológica y tiene un papel clave en la mediación de la supervivencia, migración y proliferación de las células endoteliales6-38. La actividad de los VEGFR de membrana se encuentra regulada por la disponibilidad de ligandos. La expresión de VEGF-A y VEGFR-1 es estimulada por las condiciones hipóxicas. El VEGFR-2 también parece estar estimulado por condiciones hipóxicas38. La activación aguda del VEGFR-1, pero no del VEGFR-2, en respuesta a la hipoxia (o insulina) trastorna la barrera hemato- retiniana externa41. Esta barrera externa es mantenida por las células del epitelio pigmentario de la retina (EPR); por lo tanto, el balance de líquido dentro de la retina depende de una capa de células de EPR saludable y funcionales41. La ruptura de la barrera retiniana externa contribuye a la acumulación de líquido debajo y entre las capas de la retina. eY/16 LA EXCESIVA ACTIVACIÓN DE ESTOS RECEPTORES MEDIANTE EL VEGF-A PUEDE PRODUCIR NEOVASCULARIZACIÓN PATOLÓGICA Y PERMEABILIDAD VASCULAR EXCESIVA. LOS FACTORES DE CRECIMIENTO COMO LOS VEGF SON FACTORES ANGIOGÉNICOS RESPONSABLES DE LA NEOVASCULARIZACIÓN PATOLÓGICA RESPONSABLES DE LA PÉRDIDA DE LA VISIÓN. VEGF-A Y SUS ISOFORMAS PROMUEVEN LA VASCULOGENESIS Y LA NEOANGIOGÉNESIS -AUMENTO DE LA PERMEABILIDAD AUMENTO DEL EDEMA- PÉRDIDA DE LA VISIÓN. EL FACTOR ANGIOGÉNICO PIGF Y SUS ISOFORMAS JUEGAN UN PAPEL IMPORTANTE EN LA ANGIOGÉNESIS PATOLÓGICA DE MANERA DIRECTA E INDIRECTA VIA MEDIADORES DE LA INFLAMACIÓN. LOS VEGFR PERTENECEN A LA MISMA SUBCLASE DE RECEPTORES QUE LOS FACTORES DE CRECIMIENTO DERIVADOS DE PLAQUETAS (PDGF) Y LOS FACTORES DE CRECIMIENTO DE FIBROBLASTOS (FGF) TIENEN UN PAPEL CLAVE EN LA MEDIACIÓN DE LA SUPERVIVENCIA, MIGRACIÓN Y PROLIFERACIÓN DE LAS CÉLULAS ENDOTELIALES Y SU EXPRESIÓN ES ESTIMULADA POR LA HIPOXIA. LAS TERAPIAS ANTI-VEGF SON LA PIEDRA ANGULAR DEL MANEJO DE DMAE: RANIBIZUMAB Y BEVACIZUMAB POR MEDIO DE INYECCIÓN IVT. eY/17 II. fundamentos II. fundamentos Información general sobre el tratamiento VEGF II. fundamentos II. fundamentos TERAPIA ANTI-VEGF La eficacia de ranibizumab administrado mensualmente en el tratamiento de DMAE húmeda fue establecida en 2 grandes ensayos randomizados, el Ensayo MARINA (Ensayo Clásico/Oculto en Grado Mínimo del Anticuerpo Anti-VEGF en el Tratamiento DMAE) y el ensayo ANCHOR (Anticuerpo Anti-VEGF para el Tratamiento de Neovascularización Coroidea Predominantemente Clásica en DMAE)51-52. * Pegaptaniba Pegaptanib, el primer agente anti-VEGF aprobado para el tratamiento de DMAE húmeda en adultos, es un aptámero que se desarrolló para unirse selectivamente e inhibir el VEGF16545. El pegaptanib ha mostrado prevenir la pérdida de visión moderada a severa en pacientes con DMAE húmeda pero no se ha demostrado que aumente la agudeza visual45. En 2 ensayos prospectivos, randomizados, doble ciego, controlados, de fase III, la dosis de 0,3 mg de pegaptanib administrada cada 6 semanas durante 48 semanas redujo el riesgo de pérdida de visión moderada y severa – 70% de los pacientes perdió <15 letras por ETDRS (Estudio de Tratamiento Temprano de Retinopatía Diabética) comparado con 55% en el grupo de control (P<0,001)45. Además, el 33% de los pacientes que recibieron 0,3 mg de pegaptanib mantuvieron o ganaron actividad visual contra el 23% de quienes recibieron inyecciones simuladas (P=0,003)45. a. No se llegó a utilizar en nuestro país. * Bevacizumab Bevacizumab es un anticuerpo monoclonal recombinante humanizado anti-VEGF completo con 2 sitios de unión al VEGF-A46. Está indicado en combinación con otros agentes quimioterapéuticos para el tratamiento de varios cánceres, entre ellos cáncer metastásico de colon, cáncer de pulmón de células no pequeñas, carcinoma de células renales, glioblastoma, cáncer de mama metastásico (en ciertos mercados) y cáncer de ovario (en ciertos mercados)9-10. No está indicado para el tratamiento de DMAE húmeda, pero los oftalmólogos comenzaron a usar bevacizumab intravitreo (“off label”) mientras esperaban la aprobación de ranibizumab 11. Muchos estudios de poca cantidad de pacientes fuera de la indicación han documentado la eficacia y seguridad de bevacizumab en pacientes con DMAE húmeda47, pero sólo en forma reciente se encuentran a disposición datos de ensayos cabeza a cabeza con ranibizumab11-48-49. Estos ensayos se discutirán más adelante en este documento. * Ranibizumab Ranibizumab es un fragmento de anticuerpo derivado del mismo anticuerpo original que bevacizumab pero no incluye el segmento Fc(ver fig. 1.6). Ranibizumab se diseñó para tener una vida media sistémica más corta, una mayor afinidad de unión con las isoformas VEGF una mejor penetración retiniana y una menor predisposición a inducir reacciones inflamatorias comparado con bevacizumab46. Está indicado para el tratamiento de DMAE húmeda y en algunos mercados, para alteraciones retiniales asociado con edema macular diabético u oclusión de la vena retiniana. Ranibizumab también se está estudiando en el tratamiento de NVC secundario a miopía patológica50. eY/18 En el ensayo MARINA, 716 pacientes con DMAE asociada con NVC clásica en grado mínimo o enfermedad oculta con NVC no clásica fueron randomizados con una razón 1:1:1 a tratamiento mensual con ranibizumab 0,3 mg o 0,5 mg o una inyección placebo durante 2 años. En el año 2, el 90% de los pacientes que estaban recibiendo la dosis de 0,5 mg de ranibizumab perdieron <15 letras ETDRS comparados con el 52,9% en el grupo con inyección simulada. Más importante es que en el año 2, el 33,3% de los pacientes que estaban recibiendo ranibizumab 0,5mg (contra 3,8% en el grupo simulado) ganaron ≥15 letras ETDRS. En el grupo ranibizumab 0,5 mg, se obtuvo una ganancia de 6,6 letras contra una pérdida de 14,9 letras en el grupo de inyección simulada51. El ensayo ANCHOR fue un ensayo de 1 año, comparando ranibizumab 0,3 mg o 0,5 mg con terapia fotodinámica con verteporfina en pacientes con lesiones predominantemente clásicas. Los pacientes fueron randomizados para recibir ranibizumab más terapia simulada de verteporfina o inyección IVT simulada de ranibizumab más terapia verteporfina activa. Las inyecciones simuladas y activas se dieron mensualmente y los tratamientos con verteporfina simulado y activo se dieron en el día 0 y después a demanda en los meses 3, 6, 9 y 12. El ensayo ANCHOR, ranibizumab 0,5 mg dio como resultado una dramática mejora en agudeza visual, 96,4% perdieron <15 letras comparado con basal (contra 64,3% en el grupo verteporfina), 40,3% de los pacientes (contra 5,6% en el grupo verteporfina) ganaron ≥15 letras desde la basal hasta el año 1 y el cambio medio en agudeza visual ETDRS fue una ganancia de 11,3 letras (contra una pérdida de 9,5 letras en el grupo verteporfina)52. En ambos ensayos, las tasas de eventos adversos severos (EAS) oculares o sistémicos fueron bajas51-52. RESUMEN PEGAPTANIB, PRIMER AGENTE ANTI-VEGF APROBADO PARA EL TRATAMIENTO DE DMAE HÚMEDA EN ADULTOS, INHIBE EL VEGF (no utilizado en nuestro paÍs). BEVACIZUMAB ANTICUERPO MONOCLONAL ANTI-VEGF ESTA INDICADO EN COMBINACIÓN CON OTROS AGENTES QUIMIOTERÁPICOS PARA EL TRATAMIENTO DE VARIOS TIPOS DE CÁNCER. eY/19 II. fundamentos II. fundamentos Otros tratamientos * El tratamiento con láser y la PDT han sido reemplazados ampliamente por la terapia anti-VEGF en el tratamiento de DMAE húmeda. Los tratamientos más antiguos para la DMAE húmeda incluyen tratamiento con láser y terapia fotodinámica (PDT). Con PDT, el tejido retiniano es tratado con fotosensibilizadores tales como verteporfina y luego expuesto a luz de baja intensidad. Esto produce la destrucción selectiva de la NVC mientras se preserva la retina que la cubre. Contrariamente al tratamiento térmico con láser, la PDT no causa una disminución inmediata en la agudeza visual53. La PDT también reduce el riesgo de pérdida de la visión54. * Regímenes alternativos de administración para terapia anti-VEGF. Figura 1.6. Estructura de bevacizumab y ranibizumab.46 BEVACIZUMAB NO ESTÁ INDICADO PARA EL TRATAMIENTO DE DMAE HÚMEDA. LOS OFTALMÓLOGOS COMENZARON A USAR BEVACIZUMAB A LA ESPERA DE LA APROBACIÓN DE RANIBIZUMAB. RANIBIZUMAB TIENE UNA VIDA MEDIA SISTÉMICA MÁS CORTA, UNA MAYOR AFINIDAD DE UNIÓN CON LAS ISOFORMAS VEGF, UNA MEJOR PENETRACIÓN RETINIANA Y UNA MENOR PRedisposiciÓn A INDUCIR REACCIONES INFLAMATORIAS COMPARADO CON BEVACIZUMAB. RANIBIZUMAB, TAMBIÉN SE ESTA ESTUDIANDO EN EL TRATAMIENTO DE NVC SECUNDARIO A MIOPÍA PATOLÓGICA. OFRECE GANANCIAS EN AGUDEZA VISUAL CON ADMINISTRACIÓN MENSUAL . eY/20 Los ensayos MARINA y ANCHOR demostraron que la administración mensual de ranibizumab por medio de inyección IVT produjo una importante mejora en la visión en pacientes con DMAE húmeda51-52. Sin embargo, dado que las inyecciones IVT mensuales representan una carga significativa para los pacientes, se han realizado varios ensayos para determinar si regímenes de administración alternativos, darían los mismos resultados. Estos ensayos apoyan la eficacia creciente del tratamiento mensual y la importancia del inicio temprano del tratamiento con terapia anti-VEGF para prevenir la pérdida de la visión. En general, los regímenes de administración con intervalos mayores de un mes con ranibizumab y bevacizumab no brindan los resultados óptimos comparados con los regímenes mensuales, a no ser que los pacientes sean monitoreados de manera frecuente y cuidadosamente. Además, con la terapia mensual, las ganancias visuales óptimas se obtienen en el primer año y estas ganancias pueden perderse con un cambio a una terapia de menor frecuencia. El estudio PIER (Estudio Fase III b, multicéntrico, randomizado, doble ciego, controlado para valorar eficacia y seguridad de ranibizumab versus simulada en pacientes con neovascularización coroidea subfoveal con o sin NVC clásica secundaria a degeneración macular asociada con la edad) fue un ensayo de 2 años, controlado por inyección placebo, diseñado para evaluar la eficacia de ranibizumab 0,5 mg o 0,3 mg administrado mensualmente durante 3 meses y luego trimestralmente en pacientes con DMAE húmeda55. Después del entrecruzamiento y el traspaso subsiguiente, la agudeza visual entre los pacientes del grupo con inyección placebo disminuyó con el transcurso del tiempo (3,5 letras 10 meses después del entrecruzamiento), lo que respalda la importancia del inicio temprano de la terapia anti-VEGF para prevenir la pérdida de la visión56 (ver fig. 1.2). eY/21 II. fundamentos II. fundamentos Figura 1.2. Estudio PIER, resultados del año 1: Cambio medio en agudeza visual55. En el ensayo multicéntrico, abierto, de fase 3 SUSTAIN (Estudio de Ranibizumab en Pacientes con Neovascularización Coroidea Subfoveal Secundaria a Degeneración Macular Asociada con la Edad), los pacientes se trataron con 3 inyecciones mensuales de ranibizumab 0,3 mg o 0,5 mg y a partir de ese momento se monitorearon mensualmente durante un total de 1 año. Si la agudeza visual había disminuido en más de 5 letras o si el espesor de la retina central (ERC) había aumentado en >100µm, los pacientes se trataron nuevamente. El estudio EXCITE (Eficacia y Seguridad de Ranibizumab en Pacientes con Neovascularización Coroidea Subfoveal [NVC] Secundaria a Degeneración Macular Asociada con la Edad [DMAE]) comparó regímenes trimestrales y mensuales de ranibizumab en pacientes con NVC subfoveal secundaria a DMAE12. Los pacientes se randomizaron para recibir 0,3 mg mensuales, 0,5 mg trimestrales o 0,3 mg trimestrales (después de 3 inyecciones mensuales iniciales) (ver fig. 1.3). eY/22 Figura 1.3. Resultados del año 1 del estudio EXCITE: Cambio medio en agudeza visual12. El ensayo SAILOR (Evaluación de Seguridad de Lucentis Intravítreo para Degeneración Macular Asociada con la Edad) de Fase IIIb, a 12 meses, exploró 2 regímenes de administración diferentes de ranibizumab, uno con una dosis de carga y visitas de seguimiento programadas y otro sin dosis de carga y seguimiento menos frecuente13. En el primer cohorte, los pacientes se trataron inicialmente con 3 inyecciones mensuales de ranibizumab (0,3 o 0,5 mg), evaluadas en los meses 3, 6, 9 y 12 y volvieron a tratarse en base a los resultados de una tomografía de coherencia óptica (OCT) preespecíficada o criterios de agudeza visual. El segundo cohorte se trató con una dosis única de ranibizumab (0,5 mg) y volvió a tratarse a criterio del médico, con evaluaciones programadas en los meses 6 y 12. En el primer grupo, la agudeza visual aumentó durante los primeros 3 meses pero disminuyó desde el mes 3 hasta el 12 entre los pacientes sin tratamiento previo y los tratados previamente (ver fig. 1.4). En el segundo grupo, 50% discontinuó el estudio antes del mes 12, dificultando la interpretación de los resultados13. Los resultados resaltaron la importancia de una terapia anti-VEGF regular, mensual en el primer año para lograr y mantener ganancias visuales óptimas. eY/23 II. fundamentos II. fundamentos Tabla 1.2. Cambios en agudeza visual en ensayos clínicos de ranibizumab en regímenes de dosis variables. Figura 1.4. Resultados del año 1 del estudio SAILOR: Cambio medio en agudeza visual13. Ensayo clínico Regímenes de administración estudiados Cambios en agudeza visual (Letras ganadas o perdidas) PIER (n = 184)55-56 Regillo 2008; Abraham 2011 0,3 mg o 0,5 mg mensuales durante 3 meses, seguido de administración trimestral (t3 meses.) 0,3 mg a año 1.: -1,655 0,5 mg a 1 año.: -0,2 0,3 mg a 2 años.: -2,256 0,5 mg a 2 años.: -2,3 SAILOR (n=2378)13 Boyer et al 2009 SUSTAIN(N = 513) Holz et al 2011 57 EXCITE (n = 293)12 Schmidt-Ehrfurth et al 2011 HARBOR (n = 1097)58 Suner/ARVO 2012 eY/24 0,3 mg o 0,5 mg mensuales durante 3 meses, seguido de administración PRN durante hasta 1 año Sin tratamiento previo13: 0,3 mg a 3 meses.: +5,8 0,5 mg a 3 meses.: +7,0 0,3 mg a 1 año.: +0,5 0,5 mg a 1 año: 2,3 Previamente tratados13 0,3 mg a 3 meses.: +4,6 0,5 mg a 3 meses.: +5,8 0,3 mg a 1 año.: +1,7 0,5 mg a 1 año.: +2,3 0,3 mg mensuales durante 3 meses, seguido de administración PRN durante 9 meses; promedio 2,3 inyecciones entre los meses 3-12 A 3 meses.: +5,857 A 1 año.: +3,6 0,3 mg mensuales durante 1 año 0,3 mg mensuales durante 3 meses seguido de administración trimestral durante 9 meses 0,5 mg mensuales durante 3 meses seguido de administración trimestral durante 9 meses 0,3 mg mensuales12 a 1 año.: +8,3 0,3 mg trimestrales a 1 año.: +4,9 0,5 mg trimestrales a 1 año.: +3,8 0,5 mg o 2,0 mg mensuales durante 3 meses seguido de administración mensual o PRN durante 9 meses 0,5 mg mensuales a 1 año.: +10,158 2,0 mg mensuales a 1 año.: +9,2 0,5 mg PRN a 1 año.: +8,2 2,0 mg PRN a 1 año.: +8,6 eY/25 II. fundamentos II. fundamentos El ensayo HARBOR (Estudio de Ranibizumab administrado mensualmente o a demanda en pacientes con Degeneración Macular Asociada a la Edad Neovascular Subfoveal) comparó la eficacia y seguridad de regímenes mensuales y PRN de 2,0 mg con 0,5 mg de ranibizumab IVT58 . A los12 meses, la dosis de 2,0 mg de ranibizumab no fue superior a la dosis de 0,5 mg con relación al cambio medio en la mejor agudeza visual corregida (MAVC). El estudio HORIZON (Estudio de Extensión para Evaluar la Seguridad y Tolerancia de Ranibizumab en Pacientes con Neovascularización Coroidea Secundaria a DMAE o Edema Macular secundario a OVCR) evaluó los resultados a largo plazo en 853 pacientes que habían participado en uno de los 3 ensayos controlados, randomizados, de ranibizumab IVT mensual (MARINA, ANCHOR o FOCUS). [RhubFab V2 tratamiento ocular combinado con Visudyne®]59 En el estudio HORIZON, estos pacientes recibieron 0,5 mg de ranibizumab a intervalos mensuales o mayores como fuera necesario. La mayoría, pero no todos estos pacientes había sido tratado con ranibizumab en ensayos anteriores. A los 2 años, los pacientes que no habían recibido terapia inicial anti-VEGF tuvieron resultados peores que aquellos que habían sido tratados con ranibizumab, lo que sugiere que una demora en la iniciación de tratamiento anti-VEGF se asocia a resultados visuales peores. Además, la administración menos frecuente en años subsiguientes se asoció con disminución visual. 59 Varias ensayos han explorado regímenes del tipo “tratar y extender” de ranibizumab y bevacizumab, donde las inyecciones mensuales se administran hasta que el ojo no posee líquido retinal y los intervalos entre visitas y tratamientos se aumentan hasta 10 semanas siempre que no se encuentre presente líquido en la OCT. Si la retina tiene líquido, se acorta el intervalo entre tratamientos. Un análisis retrospectivo que compara regímenes “tratar y extender” con regímenes PRN mostró que las ganancias de visión eran mayores en el grupo “tratar y extender” teniendo en cuenta que este grupo recibió un número mayor de inyecciones y un número similar de visitas de seguimiento60. El protocolo “tratamiento guiado por objetivos” implica tratar con terapia anti-VEGF mensual hasta que se alcance una agudeza visual máxima, esto es, el puntaje de agudeza visual del paciente se mantiene estable durante 3 meses consecutivos durante el tratamiento. A partir de este punto, los pacientes se monitorean mensualmente para controlar la agudeza visual y se vuelven a tratar si el monitoreo indica una pérdida en agudeza visual7. Comparación de ranibizumab con bevacizumab y de regímenes mensuales con regímenes PRN E n 2011 y 2012, se publicaron resultados de dos programas de ensayos importantes que compararon directamente ranibizumab con bevacizumab. Estos y otras investigaciones se iniciaron para determinar si los resultados de eficacia obtenidos con ranibizumab mensual podían alcanzarse con el menos costoso bevacizumab o con intervalos entre inyecciones superiores a un mes. * CATT: Resultados a 1 año El programa CATT, asignó de forma aleatoria a 1208 pacientes con DMAE húmeda a bevacizumab 1,25 mg o ranibizumab 0,5 mg administrado mensualmente o PRN11. El objetivo primario fue el cambio medio en la agudeza visual desde la basal hasta 1 año. Los objetivos de eficacia secundaria incluyeron la proporción de pacientes con un cambio ≥15 letras en agudeza visual, cambios en líquido retiniano (espesor foveal) y cambio en el tamaño de la lesión. El límite de no inferioridad para la diferencia entre grupos en relación al cambio medio de agudeza visual al primer año de estudio fue de 5 letras11. La agudeza visual mejoró en todos los 4 grupos. En el año 1, se encontró que bevacizumab no era inferior a ranibizumab ya sea que la medicación se administra mensualmente o PRN. Las ganancias visuales medias fueron 8,0 y 8,5 letras en los grupos bevacizumab mensual y ranibizumab mensual, respectivamente, y 5,9 y 6,8 letras en los grupos PRN bevacizumab y ranibizumab, respectivamente.11 La Figura 1.5 muestra las diferencias entre pares de grupos de estudio con respecto al cambio medio desde la basal en el puntaje de agudeza visual. Las líneas verticales dentro de cada barra indican los valores de las medias y las barras grises indican los intervalos de confianza del 99,2%. Las líneas punteadas denotan los límites de no inferioridad de -5 y +5 letras. Los intervalos de confianza que están entre las líneas punteadas indican equivalencia de los 2 grupos de estudio11. Se encontró que ranibizumab administrado mensualmente fue equivalente a ranibizumab administrado a demanda. Se encontró que ranibizumab administrado a demanda fue equivalente a bevacizumab administrado mensualmente. La comparación entre los regímenes mensuales y PRN de bevacizumab no fue concluyente, al igual que la comparación entre bevacizumab PRN y ranibizumab mensual, por lo tanto, no pudo establecerse la no inferioridad. El aumento medio mayor en agudeza visual se obtuvo con ranibizumab mensual (8,5 letras) y el menor con bevacizumab a demanda (5,9 letras)11. Con respecto a las mediciones anatómicas, todos los regímenes redujeron el espesor de la retina, pero la disminución media en el espesor de la retina fue significativamente mayor en el grupo eY/26 eY/27 II. fundamentos II. fundamentos Figura 1.5. Resultados del año 1 de CATT: Comparaciones entre ranibizumab y bevacizumab por medicación y por régimen11 ranibizumab mensual comparado con el grupo bevacizumab PRN (P=0,03). Después de la primera inyección, 27,5% de los pacientes que recibieron ranibizumab tuvieron ausencia de líquido retinal, comparado con 17,3% de aquellos que recibieron bevacizumab (P<0,001). Las inyecciones mensuales no produjeron cambios en la media del área de lesión, mientras que las inyecciones PRN produjeron un aumento pequeño del área de lesión11. La incidencia de muerte, infarto de miocardio y ACV fue similar en los grupos ranibizumab y bevacizumab. Las proporciones de pacientes con EA serios sistémicos (en su mayoría internaciones) fue significativamente mayor en los grupos bevacizumab comparado con los grupos ranibizumab. (24,1% vs 19,0% : P=0,04)11 Figura 1.6. Resultados del año 2 de CATT: cambio medio en agudeza visual 48 Aunque las tasas de mortalidad y las tasas de eventos aterotrombóticos fueron similares para ambas medicaciones, la incidencia de eventos adversos serios (EAS) sistémicos fue significativamente mayor con bevacizumab (39,9% vs. 31,7%)48. Los resultados del CATT confirmaron que los regímenes mensuales produjeron mejores resultados que el tratamiento PRN, teniendo en cuenta los cambios en agudeza visual y las mediciones anatómicas. * IVAN * CATT: Resultados de 2 años En el segundo año, el ensayo se diseñó para determinar los efectos a largo plazo de los regímenes de administración originales y para describir el impacto del cambio del tratamiento mensual al tratamiento PRN. Después de 1 año de tratamiento, los pacientes asignados originalmente a tratamiento mensual con cualquiera de las medicaciones fueron randomizados nuevamente a tratamiento mensual o PRN sin cambiar la medicación asignada48. Los resultados de 2 años mostraron que el tratamiento PRN, ya fuera instituido después de la primera dosis o después de 1 año de tratamiento mensual, produjo menos ganancia en agudeza visual (ver fig. 1.6) 48. La ganancia media en agudeza visual fue estadísticamente significativamente mayor para el tratamiento mensual que para el tratamiento PRN con cualquiera de las medicaciones, aunque la diferencia fue pequeña. La proporción de pacientes con retina libre de líquido a los 2 años fue significativamente mayor con ranibizumab mensual que con bevacizumab a demanda48. eY/28 El estudio IVAN es un ensayo factorial de no inferioridad, multicéntrico, randomizado, que se encuentra todavía en curso, diseñado, también, para comparar ranibizumab con bevacizumab así como regímenes de administración mensuales con PRN. En el ensayo IVAN, los pacientes fueron primero randomizados a bevacizumab o ranibizumab (3 inyecciones mensuales) y luego a tratamiento continuo (mensual) o tratamiento discontinuo (esto es, nuevo tratamiento con 3 dosis mensuales si se cumplieron los criterios clínicos y de OCT previamente especificados para enfermedad activa) con el mismo agente49. Es importante notar que el tratamiento discontinuo, tal como se define en el ensayo IVAN, no fue el mismo que el tratamiento PRN descripto en el protocolo del CATT. (ver fig. 1.7) El criterio de valoración de eficacia primaria fue la mejor agudeza visual corregida (MAVC) a distancia a los 2 años y el objetivo de seguridad primario fue la incidencia de eventos tromboembólicos arteriales (ETA) o falla cardíaca a los 2 años. El límite de no inferioridad fue de 3,5 letras. eY/29 II. fundamentos II. fundamentos OCT EN DMAE HÚMEDA ( *) (* Figura 1.7. Comparaciones del estudio IVAN de ranibizumab y bevacizumab por medicación y por régimen49 En base al análisis del primer año de este ensayo a 2 años, los autores concluyeron que el tratamiento discontinuo (dosis de carga inicial seguida de tratamiento periódico de 3 meses en la presencia de enfermedad activa) fue equivalente al tratamiento mensual. 49 * ( ) eY/30 Cortesía del Dr. Martínez Cartier eY/31 II. fundamentos II. fundamentos Fondo de ojo normal Fondo de ojo con patología eY/32 eY/33 II. fundamentos II. fundamentos RESUMEN LA DISMINUCIÓN DEL ESPESOR CENTRAL DE LA RETINA FUE SIGNIFICATIVAMENTE MAYOR EN EL GRUPO RANIBIZUMAB MENSUAL COMPARADO CON EL GRUPO BEVACIZUMAB PRN (P=0,03). CATT 1 AÑO: LA AGUDEZA VISUAL MEJORÓ EN LOS 4 GRUPOS. BEVACIZUMAB NO FUE INFERIOR A RANIBIZUMAB ADMINISTRADO MENSUALMENTE (8-8.5 LETRAS) Y EN LOS GRUPOS PRN BEVACIZUMAB GANARON 5,9 Y RANIBIZUMAB 6,8 LETRAS LOS EFECTOS ADVERSOS SERIOS SISTÉMICOS FUERON SIGNIFICATIVAMENTE MAYORES EN LOS GRUPOS BEVACIZUMAB COMPARADO CON LOS GRUPOS RANIBIZUMAB. CATT 1 AÑO ADMINISTRADO MENSUALMENTE FUE EQUIVALENTE A RANIBIZUMAB ADMINISTRADO A DEMANDA. EL AUMENTO MEDIO MAYOR EN AGUDEZA VISUAL SE OBTUVO CON RANIBIZUMAB MENSUAL (8,5 LETRAS) Y EL MENOR CON BEVACIZUMAB PRN (5,9 LETRAS). CATT 2 AÑOS LA GANANCIA MEDIA EN AGUDEZA VISUAL FUE SIGNIFICATIVAMENTE MAYOR EN TÉRMINOS ESTADÍSTICOS PARA EL TRATAMIENTO MENSUAL QUE PARA EL TRATAMIENTO PRN CON CUALQUIERA DE LAS MEDICACIONES, AUNQUE LA DIFERENCIA FUE PEQUEÑA. A LOS 2 AÑOS, LOS PACIENTES TRATADOS MENSUALMENTE CON CUALQUIER REGIMEN TUVIERON: * MENOR GANANCIA DE LA AGUDEZA VISUAL. * MENOR DISMINUCIÓN DEL ESPESOR RETINAL. * MAYOR RIESGO DE FILTRACIÓN. * MENOR REDUCCIÓN DEL ÁREA DE LA LESIÓN. eY/34 eY/35 II. fundamentos II. fundamentos Tabla 1.3. Enseñanzas clave de ensayos clínicos controlados de ranibizumab y bevacizumab. Estudio Conclusiones ANCHOR52 Se mantienen ganancias en agudeza visual con la administración mensual de ranibizumab. MARINA51 Se mantienen ganancias en agudeza visual con la administración mensual de ranibizumab. PIER55-56 Las ganancias en agudeza visual logradas con la administración inicial mensual de ranibizumab parecen disminuir con la administración trimestral fija. EXCITE12 Las ganancias en agudeza visual logradas con la administración inicial mensual parecen disminuir con administración trimestral. SAILOR13 Las ganancias en agudeza visual parecen disminuir con la administración menos frecuente. Es importante la dosis de carga inicial mensual de ranibizumab. Se requiere monitoreo regular para mantener las ganancias visuales logradas con las dosis mensuales iniciales. SUSTAIN57 Las ganancias en agudeza visual parecen disminuir con la administración menos frecuente. HARBOR58 La administración PRN no es equivalente a la administración mensual; los beneficios de ranibizumab no parecen estar relacionados con la dosis. HORIZON59 El tratamiento temprano con terapia anti-VEGF está asociado con mejores resultados visuales que el tratamiento tardío. CATT1,48 La administración PRN no es clínicamente equivalente a la administración mensual, a menos que se efectúe un monitoreo mensual estricto. Las ganancias visuales logradas después de 1 año de ranibizumab o bevacizumab no se mantienen con una administración menos frecuente. Bevacizumab puede estar asociado a una tasa mayor de eventos adversos sistémicos comparado con ranibizumab. IVAN 49 * Otros estudios Se están efectuando o se han completado varios otros estudios comparando ranibizumab con bevacizumab (ver Tabla 1.4). Estos estudios ayudarán a informar el debate con relación a la eficacia comparada de ranibizumab con bevacizumab. El tratamiento discontinuo con ranibizumab o bevacizumab (dosis de carga inicial seguida de tratamiento periódico de 3 meses en la presencia de enfermedad activa) parece ser equivalente al tratamiento mensual con cualquiera de los agentes. eY/36 eY/37 II. fundamentos Tabla 1.4. Estudios en curso que comparan ranibizumab y bevacizumab. Estudio Estudio Lucentis comparado con Avastin (LUCAS)61 Grupo de Evaluación Francés Avastin Versus Lucentis (GEFAL)62 Estudio Manta: Avastin Versus Lucentis en Degeneración Macular Relacionada con la Edad (MANTA)63 Prevención de Pérdida de la Visión en Pacientes con Degeneración Macular Relacionada con la Edad (DMAE) Mediante Inyección Intravitrea de Bevacizumab y Ranibizumab (VIBERA)64 Lugar Noruega Francia Austria Alemania Estado Recluta -miento estimado Regímenes en comparación 420 Bevacizumab 1,25 mg o ranibizumab 0,5 mg mensual según sea necesario hasta ausencia de líquido con intervalos entre dosis variando de 4 a 12 semanas a lo largo del tiempo (régimen tratar y extender) Reclutando Reclutando -- -- eY/38 500 3 inyecciones mensuales de bevacizumab 1,25 mg o ranibizumab 0,5 mg con inyecciones adicionales como sea necesario durante 1 año (hasta un total de 12 durante el estudio) 320 3 inyecciones mensuales de bevacizumab o ranibizumab, seguidas de inyecciones mensuales durante tanto tiempo como se requiera 366 3 inyecciones mensuales de bevacizumab 1,25 mg o ranibizumab 0,5 mg e inyecciones adicionales como sea necesario durante 2 años iii. EYLIA® Estructura de la proteína de fusión Mecanismo de acción farmacocinética inmunogenicidad Estudios clínicos eY/39 III. EYLIA III. EYLIA III. EYLIA® Estructura de la proteína de fusión E YLIA (aflibercept solución inyectable) es una proteína de fusión recombinante formada por porciones de los dominios extracelulares de VEGFR-1 y VEGFR-2 humanos, fusionados con la Fc de la Ig G1 humana formulada como solución isosmótica para administración IVT (ver fig. 4.1). Aflibercept es una glicoproteína dimérica con un peso molecular de la parte proteica de 97 kilodaltons (kDa) y un adicional del 15% de la masa molecular total correspondiente a la parte de glicosilación, lo que resulta en un peso molecular total de 115 kDa. Aflibercept se produce en células recombinantes ováricas de hámster chino (CHO) 70. ® Estos complejos inmunes pueden producir efectos indeseables en el organismo. Por ejemplo, complejos VEGF-anticuerpo pueden depositarse en tejidos tales como el riñón, contribuyendo potencialmente a daño renal. Los complejos inmunes pueden también inducir agregación plaquetaria 16. El VEGF se presenta en general en forma dimérica, con los sitios de unión del receptor ubicados en cada polo del dímero 38. La estructura molecular de EYLIA® se diseñó para una unión oclusiva en ambos extremos simulando 2 manos atrapando una pelota. El resultado es una afinidad exponencialmente mayor para VEGF-A comparado con otras moléculas terapéuticas anti-VEGF lo cual, impide confiablemente que el ligando interactúe con los receptores de su superficie celular. Además EYLIA® tiene la propiedad única de poder unirse al VEGF-B como así también al PIGF. Se presume que EYLIA® tiene una vida media intravítrea mayor comparado con ranibizumab72. Esta propiedad, sumada a su mayor afinidad de unión al VEGF comparado con ranibizumab, permite potencialmente una terapia efectiva con intervalos de administración mayores e inyecciones menos frecuentes. Debe notarse, sin embargo, que los estudios clínicos no han mostrado un efecto clínico relacionado con una unión más fuerte. RESUMEN EYLIA® PROTEINA RECOMBINANTE CON UNA VIDA MEDIA intravítrea MAYOR COMPARADO AL RANIBIZUMAB, PERMITE UNA TERAPIA EFECTIVA CON INTERVALOS DE ADMINISTRACIÓN MAYORES E INYECCIONES MENOS FRECUENTES. Figura 4.1. Estructura de EYLIA® (VEGF Trap-Eye). A diferencia de otros tratamientos anti-VEGF usados en DMAE húmeda, el aflibercept totalmente humano se une a múltiples miembros de la familia VEGF. EYLIA® tiene una afinidad muy alta para todas las isoformas de VEGF-A como así también con el PIGF 14. EYLIA® forma un complejo estable e inerte 1:1 con el VEGF. EYLIA® también se une al PIGF con una alta afinidad y es capaz de formar complejos PIGF-EYLIA® circulantes estables in vivo. Estos complejos son estables en la circulación y no son liberados rápidamente. En contraste, los anticuerpos monoclonales (tal como bevacizumab) forman comúnmente complejos multiméricos inmunes que son rápidamente liberados de la circulación y se depositan en los tejidos. eY/40 eY/41 III. EYLIA III. EYLIA Mecanismo de acción * Actividad biológica de EYLIA® en comparación con ranibizumab y bevacizumab E l VEGF-A y el PIGF son miembros de la familia VEGF de factores angiogénicos que pueden actuar como potentes factores mitógenos, quimiotácticos y en la permeabilidad vascular para las células endoteliales. La excesiva activación de estos receptores vía VEGF-A y PIGF puede producir neovascularización patológica, permeabilidad excesiva, infiltración e inflamación vascular69. Aflibercept actúa como receptor señuelo que une el VEGF-A y el PIGF con mayor afinidad que sus receptores naturales y por lo tanto inhibe la unión y activación de estos receptores VEGF aún cuando estén presentes en bajas concentraciones. (ver fig. 4.2) RESUMEN EYLIA® se une con mayor afinidad y más rápido que ranibizumab y bevacizumab. RESUMEN EYLIA 1,15 MG ES EQUIVALENTE A O,5 MG DE RANIBIZUMAB. EYLIA 2 MG TIENE UNA ACTIVIDAD BIOLóGICA A LOS 83 DíAS EQUIVALENTE A RANIBIZUMAB A LOS 30 DíAS. LA EXCESIVA ACTIVACIÓN DE LOS RECEPTORES VEGF-A y PIGF PUEDEN PRODUCIR NEOVASCULARIZACIÓN PATOLOGICA, PERMEABILIDAD EXCESIVA, INFILTRACIÓN E INFLAMACIÓN VASCULAR. AFLIBERCEPT ACTUA COMO RECEPTOR SEÑUELO QUE UNE eL VEGF-A Y EL PIGF CON MAYOR AFINIDAD QUE SUS RECEPTORES NATURALES. 4.2. Modelo de la actividad biológica IVT prolongada72. Días Días eY/42 eY/43 III. EYLIA III. EYLIA Farmacocinética Inmunogenicidad 17 C * Absorción / distribución Aflibercept no se acumula en plasma administrado intravítreo cada 4 semanas por lo que los efectos farmacodinámicos sistémicos son improbables. * Eliminación Como EYLIA® es un producto terapéutico basado en proteínas, no se han efectuado estudios de metabolismo. El aflibercept libre se une al VEGF para formar un complejo inerte estable. Como con otras grandes proteínas, se espera que tanto aflibercept libre como unido se eliminen por catabolismo proteolítico. omo con todas las proteínas terapéuticas, existe un potencial de inmunorreactividad a aflibercept intravítreo en los estudios VIEW. Para determinar esta posibilidad, se analizaron muestras de suero con ensayos de anticuerpos anti-fármaco para evaluar el número de pacientes que desarrollaban anticuerpos a aflibercept, como así también el número que desarrollaban anticuerpos neutralizantes a aflibercept. En el VIEW 1 y VIEW 2, la incidencia previa al tratamiento de inmunorreactividad a aflibercept intravítreo fue del 1% al 3% a través de los grupos de tratamiento. Después de la administración de aflibercept intravítreo durante 52 semanas, se detectaron anticuerpos a aflibercept intravítreo en el mismo rango de 1% a 3% en todos los grupos de tratamiento, incluido el grupo ranibizumab. Más aún, en estos estudios, solamente una muestra de un paciente demostró alguna actividad neutralizante. No existieron diferencias en eficacia o seguridad entre pacientes con o sin resultados de reactividad anti-fármaco. Estudios clínicos en DMAE húmeda E l programa de ensayos clínicos para EYLIA® en la población con DMAE húmeda consiste en un estudio fase 2 (CLEAR-IT 2) y dos estudios fase 3, randomizados, con control activo (VIEW 1 y VIEW 2) que compararon EYLIA® con ranibizumab. * Pacientes con deterioro renal No se efectuaron estudios especiales con EYLIA® en pacientes con deterioro renal. Los análisis de farmacocinética de pacientes con DMAE húmeda en el estudio VIEW 2, de los cuales 40% padecían deterioro renal (24% leve, 15% moderado y 1% severo) no revelaron diferencias con respecto a las concentraciones en plasma de la medicación activa después de la administración IV cada 4 u 8 semanas. RESUMEN EN EL ESTUDIO VIEW 2, 40% DE LOS PACIENTES PADECIAN DETERIORO RENAL Y NO SE REVELARON DIFERENCIAS CON RESPECTO A LAS CONCENTRACIONES EN PLASMA DE LA MEDICACIÓN ACTIVA DESPUES DE LA ADMINISTRACIÓN CADA 4 / 8 SEMANAS. Un total de 159 pacientes con DMAE húmeda fueron asignados aleatoriamente a 1 de 5 grupos de tratamiento EYLIA® durante los primeros 12 meses, la fase de dosis fija del estudio: * 0,5 mg cada 4 semanas * 2 mg cada 4 semanas * 0,5 mg cada 12 semanas * 2 mg cada 12 semanas * 4 mg cada 12 semanas Desde la semana 16 a 52, los pacientes se evaluaron mensualmente y se trataron nuevamente a demanda con su dosis asignada (0,5, 2 o 4 mg)70-74. Un total de 117 pacientes reclutados originalmente en el CLEAR-IT 2 fueron seguidos en un estudio de extensión a rótulo abierto y recibieron 2 mg de EYLIA® a demanda durante 12 meses adicionales. Los pacientes fueron monitoreados cada 8 semanas75. RESUMEN EL PROGRAMA DE ENSAYOS CLÍNICOS PARA EYLIA EN LA POBLACIÓN CON DMAE HUMEDA CONSISTE EN UN ESTUDIO FASE II Y DOS ESTUDIOS FASE III. eY/44 III. EYLIA III. EYLIA Resultados CLEAR –IT 2 RESUMEN E Mejor agudeza visual corregida media desde basal MAVC n el año 1, después de lograr una mejora significativa en MAVC durante la fase de dosis fija de 12 semanas para todos los grupos combinados, la administración PRN durante 40 semanas mantuvo las mejoras en MAVC hasta las 52 semanas (ganancia de 5,3 letras; P<0,0001). En todos los grupos de tratamiento combinados, la disminución significativa desde la basal en el espesor retiniano central/lesión (CR/LT) observada en la semana 12 (-119 µm) se mantuvo hasta la semana 52 (-130 µm; P<0,0001). La mayor mejora en MAVC ocurrió en las 4 dosis de carga mensuales de 2 mg seguidas de administración PRN, con un aumento medio de 8,3 letras en la semana 12 y 9,0 letras en la semana 52 (P<0,0001 vs la basal [Figura 5.1]). Aquellos que recibieron 4 dosis de carga mensuales de 0,5 mg seguidas de administración PRN lograron mejoras medias de 5,4 letras desde basal hasta la semana 52 (P=0,085). Los pacientes que recibieron tratamiento una vez cada 12 semanas también lograron ganancias en MAVC, pero en general no tan importantes como aquellas logradas en los grupos de tratamiento mensual74. Dosis fija PRN - Dosis de carga EN EL AÑO 1 LA ADMINISTRACIóN PRN DURANTE 40 SEMANAS MANTUVO LAS MEJORAS EN MAVC HASTA LAS 52 SEMANAS, con una GANANCIA DE 5,3 LETRAS. LA DISMINUCIóN EN EL ESPESOR RETINIANO CENTRAL/LESIóN OBSERVADA EN LA SEMANA 12 SE MANTUVO HASTA LA SEMANA 52. LA MAYOR MEJORIA EN MAVC APARECIO CON LAS 3 DOSIS DE CARGA MENSUAL DE 2 MG SEGUIDA DE ADMINISTRACION DE PRN, CON UN incremento en 8,3 LETRAS EN LA SEMANA 12. LA MEJORA DE LA VISION A DOSIS FIJA SE MANTUVO DURANTE EL PERIODO DE ADMINISTRACIÓN A DEMANDA (PRN) HASTA LA SEMANA 52. EN LA SEMANA 12 SE OBSERVO LA GANANCIA MAYOR EN EL GRUPO QUE RECIBIó 2 MG CADA 4 SEMANAS, LA CUAL SE MANTUVO HASTA LA SEMANA 52. RECIBIERON UN PROMEDIO DE SOLO 4,6 INYECCIONES ADICIONALES DE EYLIA®, MIENTRAS QUE EL 9% NO REQUIRIÓ INYECCIONES ADICIONALES. EYLIA® FUE BIEN TOLERADO. Semanas PARA RECORDAR Todos los grupos Figura 5.1. Cambio medio en MAVC en grupos de tratamiento individual74. A las 12 semanas, se observó la ganancia mayor en el grupo que recibió 2 mg cada 4 semanas; esta ganancia en MAVC se mantuvo hasta la semana 52 (9,0 letras; *P≤0,0001; +P=0,085; ‡P=0,0412; §P=0,0154 y P=0,344 para los grupos individuales comparado con la basal). Se usó el método de la última observación llevada hacia delante para imputar los datos perdidos. Durante los 21 meses de la etapa de administración PRN del ensayo fase 2 y del estudio de extensión, los pacientes recibieron un promedio de sólo 4,6 inyecciones adicionales de EYLIA®, mientras que el 9% no requirió inyecciones adicionales. eY/46 eY/47 III. EYLIA III. EYLIA ESTUDIOS VIEW 1 Y VIEW 2 * Objetivos Los ensayos fase III VIEW 1 y VIEW 2 se diseñaron para evaluar la eficacia y seguridad de EYLIA® (administrado mensualmente y cada 2 meses) en comparación con ranibizumab mensual17. * Diseño del estudio VIEW 1 y VIEW 2 fueron 2 estudios randomizados, multicéntricos, doble ciego, con control activo efectuados en pacientes con DMAE húmeda. En cada estudio, los pacientes fueron asignados aleatoriamente en razón 1:1:1:1 a 1 de 4 regímenes de administración17: * EYLIA® administrado a 2 mg cada 8 semanas a continuación de 3 dosis mensuales iniciales (EYLIA® 2q8) * EYLIA® administrado a 2 mg cada 4 semanas (EYLIA® 2q4) * EYLIA® administrado a 0,5 mg cada 4 semanas (EYLIA® 0,5q4) * Ranibizumab administrado a 0,5 mg cada 4 semanas (ranibizumab 0,5q4) Después de 52 semanas (en la fase exploratoria de los estudios), los pacientes continuaron recibiendo la dosis a la cual habían sido inicialmente randomizados, pero en un esquema de administración modificado guiado por la evaluación de los resultados visuales y anatómicos con un intervalo máximo de administración definido por protocolo de 12 semanas (ver Figura 5.2)17. Los pacientes fueron evaluados cada 4 semanas, recibiendo una inyección con un intervalo máximo de 12 semanas69. Los criterios para el nuevo tratamiento incluían66: * Aumento del espesor central de la retina (ERC) ≥100 µm comparado con el valor previo más bajo medido por OCT o * Una pérdida ≥5 letras en la cartilla ETDRS respecto al mejor puntaje previo en conjunto con líquido recurrente indicado por un OCT o Líquido nuevo o persistente indicado por OCT o * * Nuevo inicio de neovascularización clásica o * Filtración nueva o persistente en una angiografía con fluoresceína o * Nueva hemorragia macular o * Intervalo de 12 semanas desde la inyección previa. eY/48 Figura 5.2. Diseño de los estudios VIEW 1 y VIEW 2.17 RESUMEN LOS ENSAYOS FASE III VIEW 1 Y VIEW 2 SE DISEÑARON PARA EVALUAR LA EFICACIA Y SEGURIDAD DE EYLIA COMPARADO CON RANIBIZUMAB MENSUAL. eY/49 III. EYLIA III. EYLIA Fundamentos para la administración en el programa VIEW ESTOS ESTUDIOS FUERON EFECTUADOS EN PACIENTES CON DMAE HUMEDA, CON UN REGIMEN DE ADMINISTRACIÓN DE EYLIA DE 3 dosis de 2 mg durante los 3 primeros meses, SEGUIDO DE UNA DOSIS DE 2 MG CADA 8 SEMANAS. DESPUÉS DE 52 SEMANAS LOS PACIENTES CONTINUARON RECIBIENDO LA MISMA DE DOSIS CON LA CUAL HABÍAN SIDO INICIALMENTE RANDOMIZADOS, CON UN INTERVALO MÁXIMO DE ADMINISTRACIÓN DE 12 SEMANAS. LOS PACIENTES SE TRATARON NUEVAMENTE CADA 4 SEMANAS Y CON UNA FRECUENCIA NO MENOR A 3 MESES, TENIENDO EN CUENTA LOS SIGUIENTES CRITERIOS: AUMENTO DEL ERC, PÉRDIDA DEL MEJOR PUNTAJE PREVIO DE LAS LETRAS, LÍQUIDO NUEVO O PERSISTENTE INDICADO POR OCT, INICIO DE NEOVASCULARIZACIÓN, FILTRACIÓN NUEVA O PERSISTENTE, NUEVA HEMORRAGIA MACULAR. El estudio CLEAR-IT 2 demostró mejoría en la MAVC a las 12 semanas desde la basal después de las 4 dosis de carga mensuales iniciales de 0,5 mg y 2 mg de EYLIA® se mantuvo en la semana 52 con la administración PRN únicamente en el grupo 2 mg, pero no en el grupo 0,5 mg. Los pacientes que recibieron 4 dosis de carga mensuales de 2 mg seguidas de administración PRN lograron un aumento medio de 8,3 letras en la semana 12 y 9 letras en la semana 52 (P<0,0001 vs basal) comparado con 5,4 letras desde basal hasta la semana 52 (P=0,085) en los pacientes que recibieron 4 dosis de carga mensuales de 0,5 mg seguido de administración PRN74. El estudio CLEAR-IT 2 también demostró mejoría en la MAVC en pacientes tratados una vez cada 12 semanas con EYLIA®, sin las dosis de carga mensuales, en general no fueron tan importantes como aquellas logradas en los grupos 0,5q4 y 2q4 con dosis de carga mensuales. Más aún, la dosis 4q12 no proporcionó beneficio adicional de eficacia comparado con 2q12. Por lo tanto, en el programa VIEW, se probó EYLIA® 2q8 después de 3 dosis de carga mensuales iniciales a fin de proveer una respuesta fuerte a lo largo de las 52 semanas74. RESUMEN LA MEJORA EN MAVC OBSERVADA A LAS 12 SEMANAS DESPUÉS DE LAS 4 DOSIS DE CARGA MENSUALES INICIALES DE 0,5 MG Y 2 MG DE EYLIA, SE MANTUVO EN LA SEMANA 52 CON LA ADMINISTRACIÓN PRN SOLO EN EL GRUPO DE 2 MG, PERO NO EN EL GRUPO DE 0,5 MG. LOS PACIENTES CON 4 DOSIS DE CARGA MENSUALES DE 2 MG SEGUIDA DE ADMINISTRACIÓN PRN LOGRARON AUMENTO MEDIO DE 8,3 LETRAS EN LA SEMANA 12 Y 9 LETRAS EN LA SEMANA 52. * Población de pacientes En el programa VIEW se randomizaron 2.457 pacientes en total (1.217 en VIEW 1 y 1.240 en VIEW 2) que cumplieron los criterios de inclusión. Estos incluyeron pacientes ≥50 años con (1) lesiones NVC subfoveales activas (cualquier subtipo) secundarias a DMAE; también se permitieron pacientes con lesiones yuxtafoveales con filtración que afectaba la fóvea; (2) NVC que abarcaba por lo menos el 50% del tamaño total de la lesión y (3) MAVC entre 73 y 25 letras de la cartilla ETDRS (20/40 a 20/320 en la equivalencia Snellen). Se excluyeron los pacientes con tratamiento previo de DMAE (inclusive tratamiento con un agente en investigación o terapia anti-VEGF) en el ojo del estudio. El estudio VIEW 1 fue efectuado en los EE.UU. y Canadá por Regeneron Pharmaceuticals, Inc. El estudio VIEW 2 lo llevó a cabo Bayer HealthCare en Europa, Asia Pacífico, Japón y América Latina70. La edad de los pacientes varió entre los 49 y los 99 años, con una media de 76 años69. eY/50 eY/51 III. EYLIA III. EYLIA * Criterios de valoración del estudio Los estudios VIEW 1 y VIEW 2 se diseñaron para determinar si EYLIA® en cualquiera de los 3 regímenes de dosis era no inferior a ranibizumab 0,5 mg dado una vez cada 4 semanas con respecto al mantenimiento de la visión a las 52 semanas (definido como perder menos de 15 letras comparado con la basal). En ambos estudios, el criterio de valoración primario de eficacia fue la proporción de pacientes en el conjunto por protocolo que mantuvo la visión, definido como la pérdida de menos de 15 letras de agudeza visual en la semana 52 comparado con la basal17. Si todos los 3 grupos EYLIA® mostraban ser no inferiores a ranibizumab en el criterio de valoración primario, se efectuarían comparaciones adicionales con ranibizumab con respecto a los criterios de valoración secundarios, usando una secuencia jerárquica de pruebas en la cual cada criterio de jerarquía secundario se probaría respecto a la superioridad de EYLIA® sobre ranibizumab17-70. Variables de eficacia secundarias especificadas previamente compararon cada dosis de EYLIA® (2q4, 0,5q4 y 2q8) con ranibizumab 0,5q4 en la basal y en la semana 52 en busca de17: * Cambio medio en MAVC * Proporción de pacientes que ganaron ≥15 letras de visión * Calidad de vida evaluada por cambio en puntaje total NEI VFQ-25 * Cambio medio en el área NVC * Análisis estadístico El criterio de valoración primario se evaluó mediante una secuencia jerárquica especificada previamente de comparaciones en orden 2q4, 0,5q4 y luego 2q8. El IC del 95,1% (VIEW 1) y el IC del 95% (VIEW 2) se estimaron para la diferencia entre ranibizumab y cada grupo EYLIA® en la proporción de pacientes que mantuvieron la visión. Si el estudio alcanzaba los criterios de no inferioridad para el mantenimiento de la visión en la semana 52, se usarían los criterios de valoración secundarios parta determinar si EYLIA® era superior a ranibizumab17-70. Se eligió un margen de no inferioridad del 10% para preservar aproximadamente dos tercios del efecto ranibizumab para la prevención de pérdida moderada de la visión (pérdida <15 letras) demostrada en estudios ranibizumab fundamentales, usando el enfoque de 2 IC. En cada paso de la secuencia de comparaciones, EYLIA® se consideró no inferior a ranibizumab si el IC de la diferencia estaba totalmente por debajo del 10%17. Mientras que se usó el IC del 10% para evaluar no inferioridad, se usó un IC del 5% para evaluar la equivalencia clínica entre EYLIA® y ranibizumab. El plan de análisis especificado previamente incluyó un análisis integrado planeado prospectivamente que combinaba los 2 estudios VIEW; en este análisis integrado, se aplicó un margen de no inferioridad del 7%17. Resultados RESUMEN LOS ESTUDIOS VIEW 1 Y VIEW 2 SE DISEÑARON PARA DETERMINAR SI EYLIA, EN CUALQUIERA DE LOS 3 REGIMENES, ERA NO INFERIOR A RANIBIZUMAB 0,5 MG ADMINISTRADO UNA VEZ CADA 4 SEMANAS CON RESPECTO AL MATENIMIENTO DE LA VISION A LAS 52 SEMANAS. * Criterio de valoración primario: Proporción de pacientes que mantuvo la visión En el estudio VIEW 1, en la semana 52, 95,1% de los pacientes en el grupo de tratamiento EYLIA® 2q8, 95,1% de los pacientes en el grupo de tratamiento EYLIA® 2q4 y 95,9% de los pacientes en el grupo de tratamiento EYLIA® 0,5q4 mantuvieron la visión, comparado al 94,4% de los pacientes en el grupo ranibizumab 0,5q417. *Criterio de valoración adicional analizado Se efectuaron análisis de subgrupos para criterios de valoración secundarios como parte de los análisis integrados de los datos conjuntos de los estudios VIEW 1 y VIEW 2 por edad, sexo, raza, etnia, función renal, antecedentes de deterioro hepático, agudeza visual basal, tamaño y tipo de la lesión basal. Los análisis de subgrupos fueron dependientes de la disponibilidad de un tamaño de muestra adecuado para la comparación significativa de los criterios de valoración primario y secundario. Los resultados de los análisis de subgrupos no están informados en esta monografía. eY/52 En el estudio VIEW 2, en la semana 52, 95,6% de los pacientes en el grupo de tratamiento EYLIA® 2q8, 95,6% de los pacientes en el grupo de tratamiento EYLIA® 2q4 y 96,3% de los pacientes en el grupo de tratamiento EYLIA® 0,5q4 mantuvieron la visión, comparado al 94,4% de los pacientes en el grupo ranibizumab 0,5q417. En ambos estudios, todos los grupos de tratamiento EYLIA® mostraron ser no inferiores y clínicamente equivalentes al grupo ranibizumab 0,5q4 (Figura 5.3)17. eY/53 III. EYLIA III. EYLIA El análisis integrado del criterio de valoración primario para mantenimiento de la visión en la semana 52 de los estudios VIEW 1 y VIEW 2 muestra que todos los grupos EYLIA® , inclusive el EYLIA® 2q8, alcanzaron no inferioridad estadística comparados con ranibizumab mensual, con los intervalos de confianza de la diferencia entre ranibizumab y cada grupo EYLIA® dentro del margen especificado previamente del 10% y los estimados puntuales de las diferencias en las medias favoreciendo a los grupos EYLIA® en todos los casos (ver Figura 5.4). Todos los grupos EYLIA® también alcanzaron el margen especificado previamente de no inferioridad del 7% en los análisis integrados predeterminados, como así también el margen del 5% especificado previamente para equivalencia clínica comparada con ranibizumab en los estudios VIEW individuales17. 1 Figura 5.3. Proporción de pacientes que mantuvieron la visión (datos combinados de ambos estudios) 76 RESUMEN EN LOS ESTUDIOS VIEW 1 Y VIEW 2, TODOS LOS GRUPOS DE TRATAMIENTO EYLIA® MOSTRARON SER NO INFERIORES Y CLÍNICAMENTE EQUIVALENTES AL GRUPO RANIBIZUMAB 0,5Q4. Figura 5.4. Criterio de valoración primario: Diferencia en proporciones de pacientes que mantuvieron la visión (pérdida <15 letras ETDRS) en la Semana 52 en los 2 estudios (por conjunto de protocolo)17-70. Nota: el eje x está invertido de forma tal que los valores negativos aparecen a la derecha. El IC del 10% dentro del margen izquierdo indica que todos los grupos EYLIA® fueron no inferiores a ranibizumab. El IC del 5% dentro del margen izquierdo indica equivalencia clínica con ranibizumab. eY/54 eY/55 III. EYLIA III. EYLIA Criterios de valoración secundarios RESUMEN * Cambio en MAVC Los datos integrados de los estudios VIEW 1 y VIEW 2 sobre cambio medio en MAVC muestran que todos los grupos tratados con EYLIA® y ranibizumab tuvieron cambios similares en la MAVC media17-70-76. En base a la secuencia jerárquica de pruebas, solamente el grupo EYLIA® 2q4 fue estadísticamente superior a ranibizumab y sólo en el VIEW 1, con una ganancia media de 10,9 contra 8,1 letras. Las pequeñas diferencias numéricas entre grupos de tratamiento en un estudio en cualquier punto de tiempo dado no se reprodujeron en el otro estudio, lo que sugiere que estos reflejaban una variabilidad aleatoria en los resultados. Esta interpretación fue respaldada mediante un análisis integrado especificado previamente que combinó los 2 estudios, mostrando puntajes muy similares de agudeza visual a lo largo de la totalidad del estudio de 52 semanas para todos los grupos de tratamiento. Todos los grupos se comportaron de manera similar en este análisis integrado, con aumentos rápidos de la agudeza visual media después de la primera inyección, seguido de ganancias incrementales que fueron durables y se mantuvieron hasta la semana 52 (Figura 5.5)17. LOS DATOS INTEGRADOS EN LOS ESTUDIOS SOBRE CAMBIO MEDIO EN MAVC MUESTRAN QUE TODOS LOS GRUPOS TRATADOS CON EYLIA Y RANIBIZUMAB TUVIERON CAMBIOS SIMILARES EN LA MAVC MEDIA CON UNA GANANCIA MEDIA DE 10,9 CONTRA 8,1 LETRAS. EN EL ESTUDIO VIEW 1, SOLAMENTE EL GRUPO DE EYLIA FUE ESTADISTICAMENTE SUPERIOR A RANIBIZUMAB. TODOS LOS GRUPOS SE COMPORTARON DE MANERA SIMILAR EN ESTE ANALISIS INTEGRADO. * Pacientes que ganaron ≥15 letras de visión Los datos integrados de los estudios VIEW 1 y VIEW 2 sobre la proporción de pacientes que ganaron ≥15 letras desde la basal a la semana 52 fue similar en todos los grupos de tratamiento (Figura 5.6)78 Figura 5.5. Cambio medio en agudeza visual comparado con la basal 17-76 eY/56 eY/57 III. EYLIA III. EYLIA Tabla 5.2. Cambio en el área NVC activa (mm2, media ± SD)17. a Después de 3 inyecciones mensuales iniciales. VIEW 1 Ranibizumab VIEW 2 EYLIA® Ranibizumab EYLIA® 0,5q4 2q4 0,5q4 2q8a 0,5q4 2q4 0,5q4 2q8a -4,2 ± 5,6 -4,6 ± 5,5 -3,5 ± 5,3 -3,4 ± 6,0 -4,2 ± 5,9 -6,0 ± 6,1 -4,2 ± 6,1 -5,2 ± 5,9 * Espesor central de la retina (ERC) y líquido retiniano Las mediciones anatómicas evaluadas en los estudios VIEW 1 y VIEW 2 incluyeron el ERC y líquido persistente evaluado por OCT. En ambos estudios, todos los regímenes de EYLIA® resultaron en reducciones similares en el ERC comparado con ranibizumab mensual, como se evaluó mediante OCT. La gran y rápida reducción hasta casi un ERC normal fue evidente para la semana 4 y se mantuvo hasta la semana 52. En el estudio VIEW 2, existieron fluctuaciones menores en el ERC en el grupo EYLIA® 2q8; sin embargo, estas fluctuaciones desaparecieron con el tiempo sin asociación negativa aparente con los resultados de agudeza visual17 (ver fig 5.7) Figura 5.6. Proporción de pacientes que ganaron ≥15 letras a las 52 semanas. * Calidad de vida relacionada con la visión La calidad de vida relacionada con la visión, evaluada por el cambio en el puntaje total del Nei vfq-25, mejoró para todos los grupos de tratamiento en ambos estudios17. Tabla 5.1. Cambio en el puntaje NEI VFQ-25 (media ± SD). Después de 3 inyecciones mensuales iniciales. µm a VIEW 1 Ranibizumab VIEW 2 EYLIA® Ranibizumab 0,5q4 2q4 0,5q4 2q8a 0,5q4 4,9 ±14,0 6,7 ±13,5 4,5 ±11,9 5,1 ±14,7 2q4 EYLIA® 0,5q4 6,3 ±14,8 4,5 ± 15,0 5,1 ±13,7 2q8a 4,9 ±14,7 * Cambio medio en el área NVC En ambos estudios VIEW 1 y VIEW 2, existió una disminución similar del cambio en el área NVC activa en todos los grupos de tratamiento. 17 eY/58 Figura 5.7. Cambio medio en el ERC (µm)17-76 eY/59 III. EYLIA III. EYLIA RESUMEN RESUMEN LA MEDICIONES ANATÓMICAS EVALUADAS EN LOS ESTUDIOS VIEW 1 Y VIEW 2 INCLUYERON EL ERC Y LÍQUIDO PERSISTENTE EVALUADO POR OCT. EN AMBOS ESTUDIOS, TODOS LOS REGIMENES DE EYLIA RESULTARON EN REDUCCIONES SIMILARES EN EL ERC COMPARADO CON RANIBIZUMAB MENSUAL. LA GRAN Y RÁPIDA REDUCCIÓN DE HASTA CASI UN ERC NORMAL FUE EVIDENTE PARA LA SEMANA 4 Y SE MANTUVO HASTA LA SEMANA 52. EN EL ESTUDIO VIEW 2 EXISTIERON FLUCTUACIONES MENORES EN EL ERC EN EL GRUPO EYLIA, DESAPARECIENDO EN EL TIEMPO SIN ASOCIACIÓN NEGATIVA CON LOS RESULTADOS DE AV. EN LA FASE EXPLORATORIA DE VIEW 1 Y 2 LOS PACIENTES CONTINUARON RECIBIENDO LA DOSIS A LA CUAL HABIAN SIDO inicialmente RANDOMIZADOS PERO CON UNA ADMINISTRACIÓN DIFERENTE EVALUADA POR LOS RESULTADOS VISUALES Y ANATÓMICOS CON UN INTERVALO MÁXIMO DE ADMINISTRACIÓN DE 12 SEMANAS. EN GENERAL, LOS RESULTADOS DEL AÑO 1 FUERON MAYORMENTE MANTENIDOS HASTA LA SEMANA 96. * Proporción de pacientes que mantuvo la visión En todos los grupos de tratamiento, la proporción de pacientes que mantuvo la visión (pérdida <15 letras ETDRS) fue levemente inferior en la semana 96 (~92% entre grupos de tratamiento) que en la semana 52 (~95%) (Figura 5.8)66. Resultados de la fase exploratoria (semana 52 a semana 96) E n la fase exploratoria de VIEW 1 y VIEW 2, los pacientes continuaron recibiendo la potencia de dosis a la cual habían sido inicialmente randomizados, pero con una administración diferente guiada por la evaluación de los resultados visuales y anatómicos con un intervalo máximo de administración de 12 semanas definido por protocolo. De los pacientes que completaron el año 1 del estudio, 81% a 86% completaron hasta 96 semanas. En general, los resultados del año 1 fueron mayormente mantenidos hasta la semana 9669. Figura 5.8. Proporción de pacientes que mantuvo la visión (pérdida <15 letras ETDRS vs basal).66 a eY/60 Después de 3 inyecciones mensuales iniciales. eY/61 III. EYLIA III. EYLIA * Cambio en la agudeza visual * Pacientes que ganaron ≥15 letras de visión En todos los grupos de tratamiento se observaron pequeñas reducciones de la agudeza visual (-0,8 a -1,7 letras) desde la semana 52 hasta la 96. (Figura 5.9)68. En la semana 96, aproximadamente 30% de los pacientes en cada grupo ganaron ≥15 letras de visión, con la proporción mayor en el grupo EYLIA® 2q8 (33%) (Figura 5.10). La proporción de pacientes que ganaron ≥15 letras de visión disminuyó desde la semana 52 hasta la semana 96 en todos los grupos excepto el grupo EYLIA® 2q8 (n=607), en el cual aumentó de 30,97% a 33,44%66-76. (Ver Figura 5.10) Figura 5.9. Cambio medio en agudeza visual desde basal hasta la semana 96 (datos combinados de los estudios VIEW 1 y VIEW 2)66. Figura 5.10. Proporción de pacientes que ganaron visión a la semana 9666. RESUMEN EN LA SEMANA 96 APROXIMADAMENTE EL 30 % DE LOS PACIENTES EN CADA GRUPO GANARON 15 LETRAS DE VISIÓN, ESTO DISMINUYO DESDE LA SEMANA 52 HASTA LA SEMANA 96 EN TODOS LOS GRUPOS EXCEPTO en EL GRUPO DE EYLIA®. eY/62 eY/63 III. EYLIA III. EYLIA * ERC y líquido retiniano En todos los grupos de tratamiento desde la semana 52 hasta la semana 96, se observó un leve aumento del ERC (Figura 5.11). La mayor reducción en ERC se observó a la semana 96 en los grupos de tratamiento EYLIA® 2q866. Figura 5.12. Proporción de pacientes con retinas libres de líquido, como se evaluó en la OCT66. Tabla 5.4. Resultados de eficacia a la semana 52 (análisis primario) y semana 96 (análisis exploratorio) de los estudios VIEW 1 y VIEW 2 (datos combinados)69. Después del inicio del tratamiento con 3 dosis mensuales. Conjunto de análisis completo, última observación para todos los análisis, excepto la proporción de pacientes que mantuvieron la agudeza visual en la semana 52, esto es por conjunto de protocolo. c La diferencia es el valor del grupo EYLIA® menos el valor del grupo ranibizumab. Un valor positivo favorece a EYLIA®. d IC calculado por aproximación normal e Un IC que figura por encima -10% indica una no-inferioridad de EYLIA® comparado con ranibizumab. a b Figura 5.11. Cambio medio en ERC hasta la semana 9666. eY/64 eY/65 III. EYLIA III. EYLIA RESUMEN Resultado de eficacia Número medio de inyecciones Proporción de pacientes que mantuvieron agudeza visual (<15 letras de pérdida MAVC; por conjunto de protocolo) Diferenciac (IC 95%)d Cambio medio en MAVC desde basal medido por el puntaje de letras ETDRS Cambio en la diferencia de los mínimos cuadrados medios (letras ETDRS)c (IC 95%)d Proporción de pacientes que ganaron al menos 15 letras de visión desde basal Diferenciac (IC 95%)d EYLIA® 2 mg q8a (n=607) 52 Semanas 96 Semanas Ranibizumab 0,5 mg q4 (n=595) 52 Semanas 96 Semanas 7,6 11,2 12,3 16,5 95,33%b 92,42% 94,42%b 91,60% 0,9% (-1,7, 3,5)e 0,8% (-2,3, 3,8)e 8,40 7,62 8,74 7,89 -0,32 (-1,87, 1,23) -0,25 (-1,98, 1,49) 30,97% 33,44% 32,44% 31,60% -1,5% (-6,8, 3.8) 1,8% (-3,5, 7,1) eY/66 * Número de inyecciones De acuerdo al protocolo del estudio, los pacientes en el grupo EYLIA® 2q8 recibieron 1 inyección durante los 3 primeros meses, seguido de 1 inyección cada 2 meses, durante el primer año de estudio. En la fase exploratoria del estudio, el protocolo indicó inyecciones cada 12 semanas (PRN con límite tope), sin considerar si se presentaban los criterios de re-tratamiento, por lo tanto, en esta fase del estudio, los pacientes recibieron un mínimo de 3 inyecciones. De ser necesario, los pacientes podían recibir inyecciones adicionales. Aproximadamente la mitad de los pacientes en la fase exploratoria recibieron solamente las inyecciones trimestrales obligatorias por protocolo67. El análisis del número de inyecciones recibidas durante el periodo del estudio de 96 semanas mostró que pacientes tratados originalmente con EYLIA® cada 2 meses (después de 3 dosis iniciales mensuales) lograron resultados de eficacia comparables con el grupo de tratamiento con ranibizumab mensual, pero con 5 inyecciones menos (11,2 vs 16,5 inyecciones, respectivamente)66. Entre los pacientes que se trataron originalmente con EYLIA® cada 2 meses y que recibieron solamente las inyecciones trimestrales obligatorias por protocolo (3 inyecciones) durante la fase exploratoria de los ensayos, se mantuvieron las ganancias en agudeza visual y reducciones del ERC logradas en el primer año67. Durante la fase exploratoria de VIEW 1 y VIEW 2, el grupo EYLIA® 2q8 recibió 4,2 inyecciones, mientras que el grupo ranibizumab recibió 4,7 inyecciones. Las diferencias en administraciones entre grupos disminuyeron ampliamente respecto a las inyecciones cada 12 semanas obligatorias por protocolo (sin considerar la presencia/ausencia de los criterios de nuevo tratamiento.Es de notar que el cuartil de pacientes que requirieron la terapia más intensa (en términos de frecuencia de inyecciones) recibió 1,4 inyecciones menos con EYLIA® administrada cada 2 meses comparado con ranibizumab administrado mensualmente (6,6 inyecciones en el grupo EYLIA® 2q8 vs. 8,0 inyecciones con ranibizumab mensual). En la fase exploratoria, hubo casi una duplicación en el porcentaje de pacientes que requirieron inyecciones frecuentes (≥6) en el grupo ranibizumab (26,5% de los pacientes en el grupo ranibizumab comparado con el 15% en el grupo EYLIA® 2q8) 66. Los datos de la semana 96 confirman la viabilidad de la administración extendida con EYLIA®. eY/67 III. EYLIA III. EYLIA * Análisis de seguridad RESUMEN Pacientes del grupo EYLIA® 2q8 recibieron 1 inyección durante los 3 primeros meses, seguido de 1 inyección cada 2 meses, durante el primer año de estudio. EL ANáLISIS DE INYECCIONES RECIBIDAS DURANTE EL ESTUDIO DE 96 SEMANAS MOSTRó QUE PACIENTES TRATADOS ORIGINALMENTE CON EYLIA® RECIBIERON 5 INYECCIONES MENOS, COMPARADO CON RANIBIZUMAB, MANTENIENDO LAS GANANCIAS EN AGUDEZA VISUAL Y REDUCCIONES DEL ERC LOGRADAS EN EL PRIMER AÑO. En general, EYLIA® fue bien tolerado y tuvo un perfil de eventos adversos emergentes de tratamiento (EAET) oculares, incluyendo eventos adversos severos (EAS) oculares similar a ranibizumab mensual17. Casi todos los pacientes (89% a 93% en cada grupo de tratamiento) experimentaron por lo menos 1 EAET durante el primer año del estudio y no se observó respuesta a la dosis para EYLIA®. En general, la incidencia de EAET, EAET oculares en el ojo del estudio y EAET no oculares fue similar entre grupos de tratamiento. La incidencia de EAET que condujo a los pacientes a discontinuar la medicación del estudio, los EAS y las muertes, resultaron bajos en todos los grupos de tratamiento. Las reacciones adversas más frecuentes (en al menos el 5% de los pacientes tratados con EYLIA®) fueron hemorragia conjuntival (26,7%), dolor ocular (10,3%), desprendimiento de vítreo (8,4%), cataratas (7,9%), moscas volantes (7,6%), aumento de la presión intraocular (PIO) (7,2%). Los EAS emergentes del tratamiento relacionados con la inyección ocular fueron poco frecuentes e incluyeron trastornos oculares, endoftalmitis, complicaciones del procedimiento y aumento de la presión intraocular17. RESUMEN EYLIA® FUE BIEN TOLERADO CON UN PERFIL DE EA SIMILAR A RANIBIZUMAB MENSUAL. CASI TODOS LOS PACIENTES EXPERIMENTAN, POR LO MENOS 1 EA DURANTE EL PRIMER AÑO DEL ESTUDIO, SIENDO EN TODOS LOS GRUPOS SIMILAR. LA INCIDENCIA DE EA QUE CONDUJO A LOS PACIENTES A DISCONTINUAR LA MEDICACIóN DEL ESTUDIO, RESULTARON DE BAJA INCIDENCIA EN TODOS LOS GRUPOS DEL TRATAMIENTO. LAS REACCIONES ADVERSAS MAS COMUNES FUERON: HEMORRAGIA CONJUNTIVAL, REDUCCIóN DE LA AGUDEZA VISUAL Y DOLOR OCULAR. eY/68 eY/69 III. EYLIA III. EYLIA Eventos aterotrombóticos (ATE) CONCLUSIONES VIEW 1 Y VIEW 2 L * LA MEJORÍA EN LA AGUDEZA VISUAL Y MEDICIONES ANATOMICAS LOGRADAS DURANTE EL AÑO 1 SE MANTUVIERON HASTA LA SEMANA 96 CON ADMINISTRACION TRIMESTRAL MODIFICADA. Los ATE, definidos de acuerdo con los criterios de la Antiplatelet Trialists’ Collaboration (APTC) incluyen infarto de miocardio no fatal, accidente cerebrovascular no fatal o muerte vascular (inclusive muertes por causa desconocida). La incidencia en los estudios de la DMAE húmeda VIEW 1 y VIEW 2 durante el estudio de 96 semanas de duración fue 3,3% (60 de 1.824) en el grupo combinado de pacientes tratados con EYLIA® comparado con 3,2% (19 de 595) en pacientes tratados con ranibizumab. * CON TODAS LAS DROGAS UTILIZADAS, LA ADMINISTRACIÓN PROACTIVA PROVEE UN MEJOR CONTROL QUE EL TRATAMIENTO REACTIVO. 67 os ATE son EA potencialmente relacionados con la inhibición sistémica del VEGF. Existe un riesgo teórico de ATE a continuación del uso IV de inhibidores del VEGF. * EL 90% DE LOS PACIENTES TRATADOS CON EYLIA® 2 MG CADA 2 MESES RECIBIO 6 DOSIS O MENOS Y EL 72% RECIBIO 4 DOSIS O MENOS. * EYLIA® ADMINISTRADO MENSUALMENTE O CADA 2 MESES (DESPUES DE 3 DOSIS MENSUALES INICIALES) PRODUJO RESULTADOS DE EFICACIA Y SEGURIDAD EQUIVALENTES A RANIBIZUMAB MENSUAL Y CON MEJORÍA SIMILAR EN LA VISIÓN Y EN LAS MEDIDAS ANATOMICAS. * EYLIA® TIENE UN PERFIL DE SEGURIDAD SISTEMICO Y OCULAR SIMILAR AL DE RANIBIZUMAB * EN LA SEMANA 96 LOS BENEFICIOS LOGRADOS CON LA ADMINISTRACION CADA 2 MESES EN EL PRIMER AÑO SE MANTIENEN AUN CON ADMINISTRACIÓN TRIMESTRAL MODIFICADA. * LA MEJORÍA EN LA AGUDEZA VISUAL Y MEDIDAS ANATOMICAS PUEDEN LOGRARSE CON MENOS INYECCIONES MENSUALES- SIN MONITOREO MENSUALESTO ES UN AVANCE IMPORTANTE TANTO PARA LOS PACIENTES COMO PARA LOS ESPECIALISTAS. * SE REDUCE EL RIESGO DE LAS INYECCIONES IVT Y LAS VISITAS MENSUALES AL CONSULTORIO MEJORANDO LA CALIDAD DE VIDA. eY/70 eY/71 III. EYLIA iv. Estudios en curso Edema macular diabético Oclusión de la vena central de la retina Oclusión de las ramas venosas de la retina NVC secundaria a miopía UNA NUEVA MIRADA EN OFTALMOLOGÍA eY/72 eY/73 IV. ESTUDIOS EN CURSO IV. ESTUDIOS EN CURSO IV. ESTUDIOS EN CURSO * Proporción de pacientes que ganan un cambio umbral desde basal en agudeza visual * Cambio en los puntajes del cuestionario de calidad de vida desde basal * Introducción El éxito de las terapias anti-VEGF en la DMAE húmeda ha determinado a la investigación de edema macular diabético, oclusión de la vena central de la retina, y NVC relacionada a miopía entre otras. Varios estudios demostraron la eficacia de agentes anti-VEGF, en particular bevacizumab y ranibizumab. Actualmente, EYLIA® está en estudios clínicos Fase III. * EYLIA® en el tratamiento de edema macular diabético (EMD) Un estudio Fase I de EYLIA® en 5 pacientes con EMD mostró una reducción del espesor foveal 4 semanas después de una dosis única, lo que se mantuvo en 4 pacientes 6 semanas después de la inyección, con una mejora media de MAVC de 9 letras ETDRS en el mes 1 y 3 letras a las 6 semanas. El estudio DAVINCI fue un ensayo clínico Fase II, multicéntrico, randomizado, doble ciego que comparó los resultados entre EYLIA® y tratamiento con láser en 221 pacientes diabéticos con edema macular clínicamente significativo que comprometía el centro de la mácula. Los pacientes se asignaron en forma aleatoria e igual a 1 de 5 grupos de tratamiento: * EYLIA® 0,5 mg cada 4 semanas (0,5q4) * EYLIA® 2,0 mg cada 4 semanas (2q4) * EYLIA® 2,0 mg cada 8 semanas a continuación de 3 inyecciones mensuales iniciales (2q8) * EYLIA® 2,0 mg a demanda (PRN) a continuación de 3 inyecciones mensuales iniciales (2prn) * Fotocoagulación láser macular El VIVID-DME, iniciado en mayo de 2011 y dirigido por Bayer HealthCare, es un estudio multicéntrico, randomizado, de 3 grupos, doble ciego, que se está realizando en Europa, Japón, Taiwán y Australia. Pacientes adultos con EMD secundario a diabetes mellitus que compromete el centro de la fóvea con ERC ≥300 µm en el subcampo central en la OCT fueron randomizados 1:1:1 a 3 grupos de tratamiento. * 2 mg de EYLIA® cada 4 semanas * 2 mg de EYLIA® cada 8 semanas después de una fase de carga de inyecciones mensuales * Fotocoagulación láser macular Todos los pacientes se seguirán durante 3 años. La medición del resultado primario es cambio en MAVC (puntaje de letra ETDRS) desde la basal a la semana 52. Las mediciones de resultado secundario desde basal hasta la semana 52 incluyen: * Cambio en el ERC desde la basal eY/74 La fecha estimada de terminación del resultado primario para el estudio VIVID-DME es mayo de 2013 y la fecha estimada de terminación del estudio es marzo de 2015. VISTA-DME, iniciado en mayo de 2011 y dirigido por Regeneron Pharmaceuticals, Inc. se está efectuando en los Estados Unidos. Los grupos del estudio y las mediciones de los resultados primario y secundario son los mismos que en el VIVID-DME. Sin embargo, la medición del resultado primario de cambio en MAVC (puntaje de letra ETDRS) desde basal se tomará en la semana 100. La fecha estimada de terminación de la medición del resultado primario para el estudio VISTADME es diciembre de 2013 y la fecha estimada de terminación del estudio es noviembre de 2014. RESUMEN EL EMD ES LA CAUSA PRINCIPAL DE CEGUERA EN JOVENES EN PAISES DESARROLLADOS. AFECTA AL 12% DE LOS PACIENTES CON DIABETES TIPO 1 Y A LA CUARTA PARTE DE LOS PACIENTES CON DIABETES TIPO 2. EN EL ESTUDIO DAVINCI LA MEJORÍA EN LA MAVC FUE SIGNIFICATIVAMENTE MAYOR EN TODOS LOS GRUPOS EYLIA® COMPARADO CON EL GRUPO DE TRATAMIENTO CON LASER. LAS GANANCIAS ALCANZADAS EN LA SEMANA 24 CON EYLIA® SE MANTUVIERON EN LA SEMANA 52. LAS REDUCCIONES EN ERC FUERON SIGNIFICATIVAMENTE MAYORES EN TODOS LOS GRUPOS EYLIA® CONTRA EL TRATAMIENTO LASER (P<0,0001). ACTUALMENTE, DOS ENSAYOS CLíNICOS FASE 3 ESTAN INVESTIGANDO A EYLIA® PARA EL TRATAMIENTO DE EMD: VIVID-DME Y VISTA-DME. EL OBJETIVO DE ESTOS ESTUDIOS ES EVALUAR LA EFICACIA DE EYLIA® IVT COMPARADO CON TRATAMIENTO LASER EN LA MEJORA DE LA AGUDEZA VISUAL. eY/75 IV. ESTUDIOS EN CURSO IV. ESTUDIOS EN CURSO EYLIA en el tratamiento de oclusión de la vena cetral de la retina (OVCR) ® Aunque se encuentran disponibles pautas intermedias para el manejo de OVCR, el estándar de cuidado para este grupo de pacientes continuará evolucionando. Los agentes anti-VEGF jugarán un papel predominante como agentes nuevos en esta clase terapéutica a medida que se encuentren disponibles. Tabla 6.1. Comparación de resultados de ensayos clínicos recientes sobre el tratamiento de OVCR Estudios clínicos con EYLIA® en OVCR: COPERNICUS y GALILEO El ensayo COPERNICUS, dirigido por Regeneron Pharmaceuticals, Inc., se efectuó en los Estados Unidos, Canadá, Colombia, India e Israel; y el ensayo GALILEO, dirigido por Bayer HealthCare se efectuó en Europa, Japón, Corea del Sur, Singapur y Australia. En el ensayo COPERNICUS, de los 189 pacientes randomizados, 188 recibieron tratamiento y 187 se incluyeron en el conjunto de análisis completo. En el ensayo GALILEO, de los 177 pacientes randomizados, 172 recibieron tratamiento y 171 se incluyeron en el conjunto de análisis completo. En ambos ensayos, los pacientes se randomizaron 3:2 para recibir EYLIA® 2 mg IVT o inyección simulada cada 4 semanas durante 24 semanas. Desde la semana 24 a la semana 52, los pacientes en ambos grupos de COPERNICUS se trataron con EYLIA® si cumplían con los criterios de nuevo tratamiento especificados previamente o con inyección simulada se no se indicaba un nuevo tratamiento. En GALILEO, después de las 24 semanas iniciales, los pacientes en el grupo EYLIA® del estudio recibieron tratamiento PRN, mientras que aquellos en el grupo de inyección simulada continuaron con tratamiento PRN simulado hasta el final de las 52 semanas, en cuyo punto se tornaron elegibles para recibir EYLIA® PRN, de acuerdo a los criterios de nuevo tratamiento especificados previamente, hasta el final del estudio en la semana 76. * Mediciones de resultados de COPERNICUS y GALILEO Criterio de valoración primario * La proporción de pacientes que ganaron al menos 15 letras en MAVC en la semana 24 comparado con la basal. Criterios de valoración secundarios * Cambio del puntaje MAVC desde basal a la semana 24 * Cambio en el ERC desde la basal, evaluado por OCT, en la semana 24 * Proporción de pacientes que progresaron a la neovascularización del segmento anterior, neovascularización del disco óptico (NVD) o neovascularización de la retina en otro sitio (NVE) * Cambio desde la basal en el puntaje total del NEI VQF-25, actividades de distancia, actividades de cerca y subescalas de dependencia de la visión en la semana 24. * Resultados de los estudios Estudio COPERNICUS Los resultados de seis meses mostraron que 56,1% de los pacientes que recibieron EYLIA® 2mg mensual ganaron al menos 15 letras de visión desde la basal, el criterio de valoración primario del estudio, comparado con 12,3% de pacientes que recibieron inyecciones simuladas (P<0,0001). Los pacientes que recibieron EYLIA® 2mg mensual ganaron, en promedio, 17,3 letras de visión, un criterio de valoración secundario, comparado con una pérdida media de 4,0 letras con inyecciones eY/76 eY/77 IV. ESTUDIOS EN CURSO IV. ESTUDIOS EN CURSO simuladas (P<0,001). La proporción de pacientes que ganaron visión en la semana 24 se muestra en la Figura 6.1 y el cambio en el espesor de la retina se muestra en la Figura 6.2. En general, EYLIA® fue buen tolerado y los EA más comunes fueron aquellos generalmente asociados con inyecciones IVT o la enfermedad subyacente. Los EA serios oculares en el grupo EYLIA® fueron poco comunes (3,5%) y fueron más frecuentes en el grupo control (13,5%) (Tabla 6.2). La incidencia de EAS no oculares resultó, en general, bien balanceada entre los 2 grupos de tratamiento. No existieron muertes entre los 114 pacientes tratados con EYLIA® habiendo 2 en los 73 (2,7%) pacientes tratados con inyecciones simuladas. No existieron ATE APTC (Antiplatelet Trialists’ Collaboration) entre pacientes tratados con EYLIA® habiendo 2 en aquellos tratados con inyecciones simuladas. Tabla 6.2. Porcentaje de pacientes con EAS oculares en el ojo en estudio (ensayo COPERNICUS). Figura 6.1. Proporción de pacientes que ganaron visión en la semana 24 comparado con la basal (Ensayo COPERNICUS). Número de pacientes con al menos 1 EA Hemorragia vítrea Glaucoma neovascular Neovascularización del iris Hemorragia retiniana Agudeza visual reducida Oclusión de la arteria retiniana Desgarro de la retina Oclusión de la vena retiniana Endoftalmitis Abrasión corneal Placebo (n=74) EYLIA® 2q4 (n=114) 10 (13,5%) 4 (3,5%) 4 (5,4%) 2 (2,7%) 2 (2,7%) 2 (2,7%) 1 (1,4%) 0 1 (1,4%) 1 (1,4%) 0 0 0 0 0 0 1 (0,9%) 1 (0,9%) 0 0 1 (0,9%) 1 (0,9%) * Estudio GALILEO µm A 6 meses el 60,2% de los pacientes que recibieron EYLIA® 2 mg mensual ganaron por lo menos 15 letras de visión desde la basal –criterio de valoración primario- y en criterio de valoración secundario, ganaron 18 letras de visión comparado con una ganancia media de 3,3 letras con inyecciones simuladas (P<0,0001). Tabla 6.3. Porcentaje de pacientes con EAS oculares en el ojo del estudio (Estudio GALILEO). Figura 6.2. Cambio medio en el espesor de la retina central (conjunto de análisis completo, ensayo COPERNICUS) eY/78 Número de pacientes con al menos 1 EA Hemorragia vítrea Glaucoma Placebo (n=68) EYLIA® 2q4 (n=104) 6 (8,8%) 3 (2,9%) 1 (1,5%) 2 (2,9%) 0 0 eY/79 IV. ESTUDIOS EN CURSO IV. ESTUDIOS EN CURSO Neovascularización del iris Agudeza visual reducida Isquemia macular Edema macular Desprendimiento vítreo 0 1 (1,5%) 0 2 (2,9%) 0 1 (1,0%) 0 1 (1,0%) 0 1 (1,0%) RESUMEN OVCR ES UN TRASTORNO VASCULAR COMUN DE LA RETINA Y CAUSA FRECUENTE DE PéRDIDA DE LA VISION, EN PACIENTES MAYORES DE 50 AÑOS. MAS DE 100.000 PERSONAS EN USA Y MAS DE 66.000 PERSONAS EN EUROPA PADECEN OVCR. RECIENTEMENTE, HAN DEMOSTRADO EFECTIVIDAD ENSAYOS CLíNICOS CON 3 NUEVOS TRATAMIENTOS FARMACOLóGICOS PARA OVCR. LUCENTIS® (RANIBIZUMAB) (CRUISE), TRIAMCINOLONA ACETONIDO (FUERA DE LA INDICACIÓN) (SCORE) Y OZURDEX® (SISTEMA DE ADMINISTRACIóN DE FARMACOS en base a DEXAMETASONA) (GENEVA). LOS PACIENTES QUE RECIBIERON EYLIA® 2 MG MENSUAL GANARON EN PROMEDIO 17,3 LETRAS DE VISIóN. LA INCIDENCIA DE EA SERIOS NO OCULARES RESULTO BIEN BALANCEADA ENTRE LOS 2 GRUPOS DE TRATAMIENTO. EN SEMANA 52, 60,2% DE LOS PACIENTES EN EL GRUPO EYLIA® GANARON POR LO MENOS 15 LETRAS ETDRS DESDE la BASAL, CONTRA 32,4% DE LOS PACIENTES EN EL GRUPO SIMULADO (P=0,0004). LA DISMINUCIóN MEDIA EN EL ERC TAMBIEN RESULTO SIGNIFICATIVAMENTE MAYOR EN EL GRUPO EYLIA® COMPARADO CON LOS PACIENTES QUE RECIBIERON INYECCIONES SIMULADAS. eY/80 EYLIA® en el tratamiento de edema macular secundario a ORVR EYLIA® se está evaluando en un estudio fase 3 de 52 semanas, doble ciego, randomizado, de grupo paralelo, para evaluar su eficacia y seguridad comparado con el tratamiento con láser en pacientes con edema macular secundario a ORVR. El estudio está dirigido por Regeneron Pharmaceuticals. El criterio de valoración primario es la proporción de pacientes que ganó por lo menos 15 letras en MAVC. Las mediciones de resultados secundarios incluyen: * Cambio en el puntaje MAVC en la semana 24 desde la basal * Cambio en ERC, evaluado mediante OCT, en la semana 24 desde la basal * Cambio en el puntaje total del NEI VFQ-25 en la semana 24 desde la basal El ensayo espera incorporar 180 adultos con edema macular con compromiso del centro foveal secundario a MAVC diagnosticado dentro de los 12 meses anteriores a la visita de selección y con un puntaje ETDRS MAVC de 73 a 24 en el ojo del estudio en selección y en el día 1. El estudio comenzó en abril de 2012 y se espera completarlo en septiembre de 2014. La fecha estimada de terminación primaria es septiembre de 2013. EYLIA® en NVC secundaria a miopía Actualmente, Bayer HealthCare está dirigiendo MYRROR, estudio fase 3, randomizado, doble ciego para investigar eficacia y seguridad de EYLIA® en pacientes con NVC secundaria a miopía patológica. El criterio de valoración primario del ensayo MYRROR es el cambio medio en MAVC. Los criterios de valoración secundarios de MYRROR incluyen: Porcentaje de pacientes que ganaron o perdieron un número de letras: cambios del espesor retiniano; cambios en el tamaño total de la lesión; filtración de los vasos. El criterio de valoración primario del ensayo MYRROR es el cambio medio en MAVC. Los criterios de valoración secundarios de MYRROR incluyen: * Porcentaje de pacientes que ganaron o perdieron un número de letras definido * Cambios del espesor retiniano desde basal, medidos mediante OCT * Cambios en el tamaño total de la lesión NVCm * Filtración de los vasos, observada mediante angiografía Los criterios de valoración se evaluarán en las semanas 24 y 48. Los resultados se esperan para el 2013. eY/81 IV. ESTUDIOS EN CURSO El criterio de valoración primario del ensayo MYRROR es el cambio medio en MAVC. Los criterios de valoración secundarios de MYRROR incluyen: V. PROSPECTO * Porcentaje de pacientes que ganaron o perdieron un número de letras definido * Cambios del espesor retiniano desde la basal, medidos mediante OCT * Cambios en el tamaño total de la lesión NVCm * Filtración de los vasos, observada mediante angiografía Los criterios de valoración se evaluarán en las semanas 24 y 48. Los resultados se esperan para el 2013. UNA NUEVA MIRADA EN OFTALMOLOGÍA eY/82 eY/83 EYLIA® Aflibercept 40 mg/mL Solución para inyección intravítrea * COMPOSICIÓN Un mL de solución para inyección contiene 40 mg de aflibercept. Excipientes: fosfato monobásico de sodio monohidrato 0,8 mg; fosfato dibásico de sodio heptahidrato 1,126 mg; cloruro de sodio 2,338 mg; sacarosa 50 mg; polisorbato 20 0,3 mg; agua para inyectables, c.s. Cada vial proporciona una cantidad utilizable para dar una dosis única de 50 μL que contienen 2 mg de aflibercept. * FORMA FARMACÉUTICA Solución para inyección intravítrea. Solución transparente, incolora a amarilla pálido, isoosmótica, de pH 6,2. estériles y un blefaróstato estéril (o equivalente). Inmediatamente después de la inyección intravítrea, en los pacientes se debe monitorear una posible elevación de la presión intraocular. El monitoreo adecuado puede consistir en un control de la perfusión de la cabeza del nervio óptico o tonometría. En caso necesario, debe haber disponible un equipo estéril para paracentesis. Después de la inyección intravítrea se debe instruir a los pacientes para que informen, inmediatamente, sobre cualquier síntoma sugestivo de endoftalmitis (p. ej., dolor ocular, enrojecimiento ocular, fotofobia, visión borrosa). Cada vial debe utilizarse únicamente para el tratamiento de un único ojo. Después de la inyección, cualquier producto no utilizado debe desecharse. * PROPIEDADES FARMACOLÓGICAS Mecanismo de acción Aflibercept actúa como receptor señuelo soluble que se une al VEGF-A y PlGF con mayor afinidad que sus receptores naturales y, en consecuencia, puede inhibir la unión y activación de estos receptores análogos del VEGF. * INDICACIÓN TERAPÉUTICA Propiedades farmacocinéticas EYLIA® está indicado para el tratamiento de: R La degeneración macular asociada a la edad (DMAE) neovascular (húmeda) en pacientes adultos. Absorción / Distribución Aflibercept es absorbido lentamente desde el ojo en la circulación sistémica después de la administración intravítrea y se observa predominantemente en la circulación sistémica como un complejo estable, inactivo con VEGF; sin embargo, sólo “aflibercept libre” puede unirse al VEGF endógeno. En un subestudio farmacocinético con muestreo frecuente, las concentraciones plasmáticas máximas de aflibercept libre (Cmáx sistémica) fueron bajas, con una media de aproximadamente 0,02 μg/mL (rango 0 a 0,054) en 1 a 3 días después de una inyección intravítrea de 2 mg, y no eran detectables dos semanas después de la administración en casi todos los pacientes. Aflibercept no se acumula en el plasma cuando se administra de forma intravítrea cada 4 semanas. La concentración plasmática máxima media de aflibercept libre son aproximadamente 50 a 500 veces inferiores a la concentración de aflibercept requerida para inhibir la actividad biológica del VEGF sistémico un 50% en modelos animales, en donde se observaron cambios en la presión arterial luego de que niveles circulares de aflibercept libre alcanzaron aproximadamente 10 μg/mL y regresaron al valor basal cuando los niveles cayeron aproximadamente 1 μg/mL. Se estima que después de la administración intravítrea de 2 mg a pacientes, la concentración media plasmática máxima de aflibercept libre es más de 100 veces menor que la concentración de aflibercept requerida para la unión semimáxima a VEGF sistémico. Por tanto, son improbables los efectos farmacodinámicos sistémicos. Posología y forma de administración EYLIA® es para inyección intravítrea. Sólo debe ser administrado por un médico calificado con experiencia en la administración de inyecciones intravítreas. Pauta posológica Degeneración macular asociada a la edad (AMD húmeda) neovascular (húmeda) El volumen de inyección de EYLIA® es de 50 μL (equivalentes a 2 mg de aflibercept). El tratamiento con EYLIA® se inicia con una inyección mensual durante tres meses consecutivos, seguida por una inyección cada 2 meses. No hay requerimiento alguno de monitoreo entre las inyecciones. A largo plazo (luego de los primeros 12 meses de tratamiento), se recomienda que los pacientes continúen con el tratamiento con EYLIA® cada 2 meses. Información adicional sobre poblaciones especiales Pacientes con insuficiencia hepática y/o renal. No se han realizado estudios específicos en pacientes con insuficiencia hepática y/o renal con EYLIA®. Los datos disponibles no indican la necesidad de ajustar la dosis de EYLIA® en estos pacientes (ver sección “Propiedades farmacocinéticas”). Pacientes de edad avanzada. No es necesaria ninguna consideración especial. Población pediátrica No se ha establecido la seguridad y eficacia de EYLIA® en niños y adolescentes. No existe una recomendación de uso específica para EYLIA® en la DMAE exudativa en la población pediátrica. Eliminación El aflibercept libre se une a VEGF para formar un complejo estable e inerte. Como con otras proteínas grandes, es de esperar que tanto el aflibercept libre como el no libre se eliminen por catabolismo proteolítico. * DATOS PRECLÍNICOS SOBRE SEGURIDAD * FORMA DE ADMINISTRACIÓN Las inyecciones intravítreas deben realizarse conforme a los estándares médicos y las directrices aplicables por un médico calificado con experiencia en la administración de inyecciones intravítreas. En general, tienen que garantizarse anestesia adecuada y asepsia, incluyendo microbicidas tópicos de amplio espectro (p. ej., povidona iodada). Se recomienda desinfección quirúrgica de las manos, guantes estériles, campos eY/84 Efectos en los estudios clínicos sobre la toxicidad a dosis repetidas sólo se observaron a exposiciones sistémicas consideradas muy superiores a la exposición máxima humana después de la administración intravítrea de la dosis clínica propuesta, lo que indica la poca relevancia en el uso clínico. No se han realizado estudios sobre el potencial mutagénico o carcinogénico de aflibercept.Se demostró un efecto de aflibercept en el desarrollo intrauterino en estudios de desarrollo embriofetal en conejas gestantes con administración intravenosa (3 a 60 mg/kg) así como con administración subcutánea (0,1 a 1 mg/kg). El eY/85 V. PROSPECTO V. PROSPECTO V. Prospecto * CONTRAINDICACIONES R Infección ocular o periocular. R Inflamación intraocular activa severa. R Hipersensibilidad conocida a aflibercept o a alguno de sus excipientes. * ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO Endoftalmitis Las inyecciones intravítreas, incluyendo las de EYLIA®, se han asociado a endoftalmitis (ver sección “EVENTOS ADVERSOS”). Siempre que se administre EYLIA® se debe emple ar técnica de inyección aséptica adecuada. Se debe instruir a los pacientes para que informen inmediatamente cualquier síntoma sugestivo de endoftalmitis y deben tratarse adecuadamente. Aumento de la presión intraocular Se han observado aumentos de la presión intraocular en los 60 minutos siguientes a una inyección intravítrea, incluida EYLIA® (ver sección “EVENTOS ADVERSOS”). Se ha de tener precaución especial en los pacientes con glaucoma mal controlado. Por lo tanto, en todos los casos se deberá realizar un seguimiento y tratamiento adecuado tanto de la presión intraocular como de la perfusión de la cabeza del nervio óptico. Otros Al igual que ocurre con otros tratamientos dirigidos contra el VEGF intravítreos para la DMAE, son pertinentes las siguientes afirmaciones:R No se ha estudiado sistemáticamente la seguridad y eficacia del tratamiento de EYLIA® ( aplicado en los dos ojos a la vez R Entre los factores de riesgo asociados con el desarrollo de un desgarro del epitelio pigmentario de la retina tras la terapia con anti-VEGF para la DMAE exudativa, se incluye el desprendimiento amplio y/o importante del epitelio pigmentario de la retina. Cuando se inicie el tratamiento con EYLIA® ( se debe tener la precaución en pacientes con estos factores de riesgo de desarrollar desgarros del epitelio pigmentario de la retina. R El tratamiento se debe aplazar en pacientes con desprendimiento de retina regmatógeno o con agujeros maculares en estadio 3 o 4.R En caso de rotura retiniana, se debe aplazar la dosis y el tratamiento no se debe reanudar hasta que se haya reparado la rotura.R La dosis se debe aplazar y el tratamiento no se debe reanudar antes del siguiente tratamiento programado en caso de: Una disminución en la agudeza visual mejor corregida (AVMC) de >= 30 letras comparado con la última evaluación de la agudeza visual. Una hemorragia subretiniana que afecte al centro de la fóvea o, si el tamaño es de >=50% del área total de la lesión. La dosis se debe aplazar en los 28 días previos o posteriores a una cirugía intraocular planificada o realizada. *INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN No se han realizado estudios formales de interacción de medicamentos con EYLIA®. *EMBARAZO Y LACTANCIA beneficio potencial supere el posible riesgo para el feto. Lactancia Se desconoce si aflibercept es excretado en la leche materna. No puede excluirse un riesgo para el lactante. EYLIA® no se recomienda durante la lactancia. Debe tomarse la decisión sobre si interrumpir la lactancia o abstenerse del tratamiento con EYLIA®. Mujeres en edad fértil Las mujeres en edad fértil deberán utilizar un método anticonceptivo eficaz durante el tratamiento. Fertilidad Los resultados de los estudios en animales con elevada exposición sistémica indican que el aflibercept puede alterar la fertilidad masculina y femenina. No se prevé que se produzcan estos efectos tras una administración ocular con una exposición sistémica muy baja. * EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR O UTILIZAR MÁQUINAS Los pacientes pueden experimentar trastornos visuales temporales después de una inyección intravítrea con EYLIA® y los exámenes oculares asociados. No deben conducir ni utilizar máquinas hasta que se haya recuperado suficientemente la función visual. *EVENTOS ADVERSOS Población AMD Húmeda Un total de 1.824 pacientes constituyeron la población de seguridad en los dos ensayos clínicos de fase III con hasta 96 semanas de exposición a EYLIA®, de los cuales 1.223 pacientes fueron tratados con la dosis de 2 mg. Se han presentado eventos adversos serios relacionados con el procedimiento de inyección en menos de 1 inyección intravítrea de cada 1.000 con EYLIA® e incluyeron endoftalmitis, catarata traumática y aumento transitorio de la presión intraocular (ver sección “ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO”). Los eventos adversos más frecuentes (en al menos el 5% de los pacientes tratados con EYLIA®) fueron hemorragia conjuntival, dolor ocular, desprendimiento vítreo, catarata, moscas volantes y aumento de la presión intraocular. Estas reacciones adversas se presentaron con una incidencia similar en el grupo de tratamiento con ranibizumab. Lista tabulada de reacciones adversas Datos de seguridad integrados de la población AMD húmeda Los datos de seguridad descritos a continuación incluyen todas las reacciones adversas (serias y no serias) de los estudios de fase III de AMD húmeda con una posibilidad razonable de causalidad con el procedimiento de inyección o con el medicamento durante las 96 semanas de duración del estudio. Las reacciones adversas se listan con un sistema de clasificación de órganos y frecuencia usando el siguiente criterio: Muy frecuentes (≥1/10 pacientes); frecuentes (≥1/100 a <1/10 pacientes); poco frecuentes (≥1/1.000 a <1/100 pacientes muy poco frecuentes (1/10.000 a < 1/1.000 pacientes). Embarazo No se dispone de datos sobre el uso de aflibercept en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva después de la administración sistémica (ver sección “DATOS PRE CLÍNICOS SOBRE SEGURIDAD”). EYLIA® no está recomendado durante el embarazo, a menos que el eY/86 eY/87 V. PROSPECTO V. PROSPECTO NOAEL materno fue a la dosis de 3 mg/kg ó 1 mg/kg, respectivamente. No se identificó un NOAEL de desarrollo. A la dosis de 0,1 mg/kg, las exposiciones sistémicas basadas en la Cmáx y el AUC acumulada de aflibercept libre eran aproximadamente 17 y 10 veces mayores, respectivamente, cuando se compararon con los valores correspondientes observados en humanos después de una dosis intravítrea de 2 mg. V. PROSPECTO V. PROSPECTO Clase de órgano o sistema Trastornos del sistema inmunológico Trastornos oculares Muy frecuentes Frecuentes Poco frecuentes Muy poco frecuentes Hipersensibilidad Hemorragia conjuntival, Dolor ocular Desprendimiento Endoftalmitis*, de la retina, Desgarro Desgarro del retiniano, epitelio Cataratas pigmentario corticales, retiniano, Opacidades Desprendimiento lenticulares, del epitelio Defecto del pigmentario epitelio corneal, retiniano, Erosión de la Cataratas, córnea, Cataratas Vitritis, nucleares, Uveítis, Cataratas Iritis, subcapsulares, Iridociclitis, Abrasión corneal, Turbidez del Aumento de la humor acuoso de presión la cámara intraocular, anterior Visión borrosa, Moscas volantes, Edema corneal, Desprendimiento vítreo, Dolor en el lugar de la inyección, Sensación de cuerpo extraño en los ojos, Aumento del lagrimeo, Edema palpebral, Hemorragia en el lugar de la inyección, Hiperemia conjuntival, Hiperemia ocular eY/88 Hipopión * Endoftalmitis de cultivo positivo y cultivo negativo. Además, 157 pacientes de AMD húmeda fueron tratados durante 44 meses en una extensión a largo plazo de los ensayos clínicos de fase I y fase II. Elperfil de seguridad fue consistente con el observado en los ensayos clínicos de fase III de AMD Húmeda. Eventos tromboembólicos arteriales Eventos tromboembólicos arteriales (ETA) son eventos adversos potencialmente relacionados con la inhibición sistémica del VEGF. Hay un riesgo teórico de ETA después del uso intravítreo de inhibidores del VEGF. Inmunogenicidad Como con todas las proteínas terapéuticas, hay un potencial de inmunogenicidad con EYLIA®. *SOBREDOSIS En general, fueron bien toleradas dosis de hasta 4 mg a intervalos mensuales en los ensayos clínicos y de 8 mg en casos aislados de sobredosis. La sobredosis con aumento del volumen de inyección puede incrementar la presión intraocular. Por tanto, en caso de sobredosis se debe monitorear la presión intraocular y, si se considera necesario por el médico responsable, debe iniciarse tratamiento adecuado. Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano o comunicarse con los centros de toxicología: En Uruguay : CIAT ( 2) 1722. *DATOS FARMACÉUTICOS Incompatibilidades EYLIA® no debe mezclarse con otros medicamentos *INSTRUCCIONES DE USO/MANIPULACIÓN El vial es de un solo uso. Antes de la administración, inspeccione visualmente la solución inyectable. No use el vial si son visibles partículas, turbidez o descoloración. Antes de utilizar, el vial no abierto de EYLIA® pueden conservarse a temperatura ambiente (25 °C) durante 24 horas. Después de abrir el vial, continuar bajo condiciones asépticas. Para la inyección intravítrea se debe usar una aguja hipodérmica de 30 G x 0,5 pulgadas. eY/89 2 Acoplar la aguja con filtro de 18 G y 5 micras suministrada en el estuche a una jeringa Luer-lock estéril de 1 mL. V. PROSPECTO 7 Usando técnica aséptica, enrosque firmemente una aguja hipodérmica de 30 G x 0,5 pulgadas a la punta de la jeringa Luer-lock. 8 Cuando esté listo para administrar EYLIA®, quitar la protección de plástico de la aguja. 9 Sujete la jeringa con la aguja hacia arriba, compruebe que no hay burbujas en la jeringa. Si hay burbujas, golpee suavemente a jeringa on los dedos hasta que las burbujas se desplacen a la parte superior. l 1m 0.8 0.9 Quitar la tapa de plástico y desinfectar la parte exterior del tapón de goma del vial. 0.1 0.2 0.3 0.4 0.5 0.6 0.7 1 0.9 l 1m 0.7 0.8 0.1 0.2 0.3 0.4 0.5 0.6 0.3 0.4 0.1 0.2 Usando técnica aséptica, extraiga todo el contenido del vial de EYLIA® en la jeringa, manteniendo el vial en una posición vertical, ligeramente inclinado para facilitar la extracción completa. Para impedir la introducción de aire, asegúrese que el bisel de la aguja con filtro está sumergido en el líquido. Continúe inclinando el viadurante la extracción manteniendo el bisel de la aguja con filtro sumergida en el líquido. 5 Asegurarse que el vástago del émbolo se ha retirado suficientemente cuando vacíe el vial para vaciar completamente la aguja con filtro. 6 Quitar la aguja con filtro y desecharla adecuadamente. Nota: la aguja con filtro no debe utilizarse para la inyección intravítrea. eY/90 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1ml 0.5 0.6 4 Introducir la aguja con filtro en el centro del tapón del vial hasta que la aguja esté completamente insertada en el vial y la punta toque el extremo inferior o fondo del vial. 0.7 0.8 3 0.9 1m l V. PROSPECTO INSTRUCCIONES DE USO/MANIPULACIÓN 10 Eliminar todas las burbujas y expulsar el exceso de medicamento empujando despacio el émbolo, de modo que el extremo del émbolo se alinea con la línea que marca 0,05 mL en la jeringa. Dosing Line for 0.05 ml 0.1 0.2 0 2 Flat plunger edge 0.1 0.2 0.3 0.4 0.5 0.6 deberá ser Los frascos son de uso único. Cualquier producto no utilizado o material de desperdicio desechado de acuerdo con los requerimientos locales. 0.7 0.8 0.9 1ml 0.1 0.2 0.3 0.4 0.5 0.6 11 Solution after expelling air bubbles and excess drug eY/91 V. PROSPECTO VI. rEFERENCIAS * PRESENTACIÓN Viales: Cada estuche incluye un vial de vidrio de tipo I que contiene un volumen de llenado de 278 µL de solución para inyección con un tapón elastómero de goma y una aguja con filtro de 18 G. No todas las presentaciones se comercializan en todos los países. * PRECAUCIONES ESPECIALES DE CONSERVACIÓN Conservar en refrigeración (de 2 °C a 8 °C). No congelar. Conservar el vial en el caja exterior para protegerlo de la luz. Fabricante Vial: Fabricado por: Regeneron Pharmaceuticals, Inc., Nueva York, EE.UU. Envasado por: Vetter Pharma-Fertigung GmbH & Co. KG, Langenargen, Alemania. Acondicionado por: Bayer Pharma AG, Berlín, Alemania. Bajo licencia de: Bayer Pharma AG, Alemania. Titular: Bayer Pharma AG, Alemania. En Uruguay: Representado, importado y distribuido por: Bayer S.A. R.L. N° 4 – Paysandú 1283. Dir.Téc.: Q.F. Alinne Galbarini. Reg. M.S.P. No. 43775 Venta bajo receta profesional. Servicio de atención personalizada: 0800-2104. eY/92 eY/93 VI. REFERENCIAS VI. REFERENCIAS 1. Resnikoff S, Pascolini D, Etya’ale D, et al. Global data on visual impairment in the year 2002. Bull World Health Organ. 2004;82(11):844-851. 2. Congdon N, O’Colmain B, Klaver CC, et al; Eye Diseases Prevalence Research Group. Causes and prevalence of visual impairment among adults in the United States. Arch Ophthalmol. 2004;122 (4):477-485. 3. Soubrane G, Cruess A, Lotery A, et al. Burden and health care resource utilization in neovascular age-related macular degeneration: findings of a multicountry study. Arch . 2007;125(9):12491254. 4. Jager RD, Mieler WF, Miller JW. Age-related macular degeneration. N Engl J Med. 2008;358(24):2606-2617. 5. Brown D, Heier JS, Ciulla T, et al. CLEAR-IT 2 Investigators. Primary endpoint results of a phase II study of vascular endothelial growth factor trap-eye in wet age-related macular degeneration. Ophthalmology. 2011;118(6):1089-1097. 6. Lucentis [summary of product characteristics]. Frimley, Surrey, UK: Novartis Pharmaceuticals UK Ltd; 2012. 7. Lucentis [package insert]. San Francisco, CA: Genentech USA, Inc; 2010. 8. Avastin [summary of product characteristics]. Grenzach- Whylen, Germany; Roche Pharma AG; November 2011. 14. Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis. 2012;15(2):171-185. 15. Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis. 2012;15(2):171-185. 16. Rudge JS, Holash J, Hylton D, et al. VEGF Trap complex formation measures production rates of VEGF, providing a biomarker for predicting efficacious angiogenic blockade. Proc Natl Acad Sci U S A. 2007;104(47):18363-18370. 17. Heier JS, Brown DM, Chong V, et al; VIEW 1 and VIEW 2 Study Groups. Intravitreal aflibercept (VEGF Trap-Eye) in wet age-related macular degeneration. Ophthalmology. 2012. [Published online ahead of print October 16, 2012] doi:10.1016/j.optha.2012.09.006. 18. Wong TY, Chakravarthy U, Klein R, et al. The natural history and prognosis of neovascular agerelated macular degeneration: a systematic review of the literature and meta-analysis. Ophthalmology. 2008;115(1):116-126. 19. Bressler SB, Bressler NM, Fine SL, et al. Natural course of choroidal neovascular membranes within the foveal avascular zone in senile macular degeneration. Am J Ophthalmol. 1982;93(2):157163. 20. Schmier JK, Jones ML, Halpern MT. The burden of age- related macular degeneration. Pharmacoeconomics. 2006;24(4):319-334. 9. Avastin [package insert]. San Francisco, CA: Genentech; 2012. 10. Martin DF, Maguire MG, Ying GS, et al; CATT Research Group. Ranibizumab and bevacizumab for neovascular age-related macular degeneration. N Engl J Med. 2011;364(20):1897-1908. 11. Schmidt-Erfurth U, Eldem B, Guymer R, et al; EXCITE Study Group. Efficacy and safety of monthly versus quarterly ranibizumab treatment in neovascular age-related macular degeneration: the EXCITE study. Ophthalmology. 2011;118(5):831-839. 12. Boyer DS, Heier JS, Brown DM, Francom SF, IanchulevT, Rubio RG. A phase IIIb study to evaluate the safetyof ranibizumab in subjects with neovascular age-related macular degeneration. Ophthalmology. 2009;116(9):1731-1739. 28. 13. Boyer DS, Heier JS, Brown DM, Francom SF, Ianchulev T, Rubio RG. A phase IIIb study to evaluate the safety of ranibizumab in subjects with neovascular age-related macular degeneration. Ophthalmology. 2009;116(9):1731-1739. 21. Katta S, Kaur I, Chakrabarti S. The molecular genetic basis of age-related macular degeneration: an overview. J Genet. 2009;88(4):425-449. 22. Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration: a systematic review and meta-analysis. BMC Ophthalmol. 2010;10:31. 23. Klein R, Klein BE, Linton KL. Prevalence of age-related maculopathy. The Beaver Dam Eye Study. Ophthalmology. 1992;99(6):933-943. 24. Mitchell P, Smith W, Attebo K, Wang JJ. Prevalence of age-related maculopathy in Australia. The Blue Mountains Eye Study. Ophthalmology. 1995;102(10):1450-1460. 25. Vingerling JR, Dielemans I, Hofman A, et al. The prevalence of age-related maculopathy in the Rotterdam Study. Ophthalmology. 1995;102(2):205-210. 26. Delcourt C, Diaz JL, Ponton-Sanchez A, Papoz L; the POLA Study Group. Smoking and age- eY/94 eY/95 VI. REFERENCIAS VI. REFERENCIAS related macular degeneration. Arch Ophthalmol. 1998;116(8):1031-1035. 27. Topouzis F, Coleman AL, Harris A, et al. Prevalence of age- related macular degeneration in Greece: the Thessaloniki Eye Study. Am J Ophthalmol. 2006;142(6):1076-1079. 28. Björnsson OM, Syrdalen P, Bird AC, Peto T, Kinge B. The prevalence of age-related maculopathy (ARM) in an urban Norwegian population: the Oslo Macular study. Acta Ophthalmol Scand. 2006;84(5):636-641. 29. Krishnan T et al. Prevalence of early and late Age-Related Macular Degeneration in India: The INDEYE Study. Invest Ophthalmol Vis Sci. 2010; 51: 701-707. 30. Li Y, Xu L, Wang YX, et al. Prevalence of age-related maculopathy in the adult population in China: the Beijing eye study. Am J Ophthalmol. 2008;146(2):329. 31. Chen SJ, Cheng CY, Peng KL, et al. Prevalence and associated risk factors of age-related macular degeneration in an elderly Chinese population in Taiwan: the Shihpai Eye Study. Invest Ophthalmol Vis Sci. 2008;49(7):3126- 3133. 32. Oshima Y, Ishibashi T, Murata T, et al. Prevalence of age related maculopathy in a representative Japanese population: the Hisayama study. Br J Ophthalmol. 2001;85(10):1153-1157. 33. Ferrara N, Gerber H-P, LeCouter. The biology of VEGF and its receptors. Nature Medicine. 2003;9(6):669-676. 34. Nork TM, Dubielzig RR, Christian BJ, et al. Prevention of experimental choroidal neovascularization and resolution of active lesions by VEGF Trap in nonhuman primates. Arch Ophthalmol. 2011;129(8):1042-1052. 35. Li X, Lee C, Tang Z, et al. VEGF-B: a survival, or an angiogenic factor? Cell Adh Migr. 2009;3(4):322-327. 36. Hoeben A, Landuyt B, Highley MS, Wildiers H, Van Oosterom AT, De Bruijn EA. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 2004;56(4):549-580. 37. Olsson AK, Dimberg A, Kreuger J, Claesson-Welsh L. VEGF receptor signaling—in control of vascular function. Nat Rev Mol Cell Biol. 2006;7(5):359-371. conditions. Nat Med. 2001;7(5):575-583. 40. Miyamoto N, de Kozak Y, Jeanny JC, et al. Placental growth factor-1 and epithelial haematoretinal barrier breakdown: potential implication in the pathogenesis of diabetic retinopathy. Diabetologia. 2007;50(2):461-470. 41. Gragoudas ES, Adamis AP, Cunningham ET Jr, Feinsod M, Guyer DR; VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med. 2004;351(27):2805-2816. 42. Kovach JL, Schwartz SG, Flynn HW Jr, Scott IU. Anti- VEGF treatment strategies for wet AMD. J Ophthalmol. 2012;2012:786870. 43. El-Mollayess GM, Noureddine BN, Bashshur ZF. Bevacizumab and neovascular age related macular degeneration: pathogenesis and treatment. Semin Ophthalmol. 2011;26(3):69-76. 44. Martin DF, Maguire MG, Fine SL, et al; Comparisonof Age-related Macular Degeneration TreatmentsTrials (CATT) Research Group. Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Ophthalmology. 2012;119(7):1388-1398. 45. Chakravarthy U, Harding SP, Rogers CA, et al; The IVAN Study Investigators. Ranibizumab versus bevacizumab to treat neovascular age-related macular degeneration: one-year findings from the IVAN randomized trial. Ophthalmology. 2012;119(7):1399-1411. 46. Efficacy and safety of ranibizumab in patients with visual impairment due to choroidal neovascularization secondary to pathologic myopia. ClinicalTrials.gov Web site. http://www.clinicaltrials.gov/ct2/show/ NCT01217944?term=NCT01217944&rank=1. Updated December 15, 2011. Accessed September 25, 2012. 47. Rosenfeld PJ, Brown DM, Heier JS, et al; MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1419-1431. 48. Brown DM, Kaiser PK, Michels M, et al; ANCHOR Study Group. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):14321444. 38. Rakic JM, Lambert V, Devy L, et al. Placental growth factor, a member of the VEGF family, contributes to the development of choroidal neovascularization. Invest Ophthalmol Vis Sci. 2003;44(7):3186-3193. 49. Kulkarni AD, Kuppermann BD. Wet age-related macular degeneration. Adv Drug Deliv Rev. 2005;57(14):1994-2009. 39. Carmeliet P, Moons L, Luttun A, et al. Synergism between vascular endothelial growth factor and placental growth factor contributes to angiogenesis and plasma extravasation in pathological 50. Bressler NM; Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age- eY/96 eY/97 VI. REFERENCIAS VI. REFERENCIAS related macular degeneration with verteporfin: two-year results of 2 randomized clinical trials- tap report 2. Arch Ophthalmol. 2001;119(2):198-207. 51. Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER Study year 1. Am J Ophthalmol. 2008;145(2):239-248. 52. Abraham P, Yue H, Wilson L. Randomized, double- masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER study year 2. Am J Ophthalmol. 2010;150(3):315-324. 53. Holz FG, Amoaku W, Donate J,et al; SUSTAIN Study Group. Safety and efficacy of a flexible dosing regimen of ranibizumab in neovascular age-related macular degeneration: the SUSTAIN study. Ophthalmology. 2011;118(4):663-671. 54. Suner IJ, Yau L, Lai P. HARBOR study: one-year results of efficacy and safety of 2.0 mg versus 0.5 mg ranibizumab in patients with subfoveal choroidal neovascularization secondary to age-related macular degeneration. Poster presented at: ARVO 2012; May 8, 2012; Fort Lauderdale, FL. 55. Singer MA, Awh CC, Sadda S, et al. HORIZON: an open-label Extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology. 2012;119(6):1175-1183. 56. Oubraham H, Cohen SY, Samimi S, et al. Inject and extend dosing versus dosing as needed: a comparative retrospective study of ranibizumab in exudative age-related macular degeneration. Retina. 2011;31(1):26-30. Ophthalmology (ARVO) Annual Meeting; May 6-9, 2012; Fort Lauderdale, FL. 62. Data on file. Efficacy analysis of subgroup of subjects who were treated with quarterly injections during year 2 of VIEW studies. Biometrical report Bay 86-5321. Bayer HealthCare; 2012. 63. Data on file. 96 week efficacy analysis of patients treated quarterly. Tarrytown, NY: Bayer Healthcare, Inc.; 2012. 64. EYLEA® (aflibercept solution for injection) summary of product characteristics. Berlin, Germany: Bayer Pharma AG; 2012. 65. Ophthalmologic Drugs Advisory Committee: VEGF Trap-Eye briefing document. Tarrytown, NY: Regeneron Pharmaceuticals Inc.; June 17, 2011. 66. Stewart MW, Rosenfeld PJ. Predicted biological activity of intravitreal VEGF trap. Br J Ophthalmol. 2008; 92(5):667-668. 67. Heier JS, Boyer D, Nguyen QD, et al; CLEAR-IT 2 Investigators. The 1-year results of CLEARIT 2, a phase 2 study of vascular endothelial growth factor trap-eye dosed as-needed after 12week fixed dosing. Ophthalmology. 2011;118(6):1098-1106. 68. Boyer DS. VEGF Trap-Eye in wet AMD: update on phase 2 studies. Paper/Poster presented at: 2009 American Academy of Ophthalmology Meeting; October 25, 2009; San Francisco, CA. 69. Korobelnik JK; VIEW 1 and VIEW 2 Study Group. Vascular endothelial growth factor (VEGF) Trap-Eye investigation of the efficacy and safety in wet age-related macular degeneration (AMD). Presented at: 11th Euretina Congress; May 26-29, 2011; London, United Kingdom. 57. LUCAS (lucentis compared to avastin study). ClinicalTrials. gov Web site. http://www.clinicaltrials.gov/ct2/show/ NCT01127360. Updated June 30, 2011. Accessed July 2, 2012. 58. French Evaluation Group Avastin Versus Lucentis (GEFAL). ClinicalTrials.gov Web site. http:// www.clinicaltrials.gov/ ct2/show/NCT01170767. Published July 26, 2010. Updated July 21, 2011. Accessed July 2, 2012. 59. Manta Study: avastin versus lucentis in age related macular degeneration (MANTA) ClinicalTrials.gov Web site. http://www.clinicaltrials.gov/ct2/show/NCT00710229. Updated June 8, 2010. Accessed July 2, 2012. 60. Prevention of vision loss in patients with age-related macular degeneration (AMD) by intravitreal injection of bevacizumab and ranibizumab (VIBERA). http://www.clinicaltrials.gov/ct2/show/ NCT00559715. ClinicalTrials.gov Web site. Updated March 25, 2009. Accessed July 2, 2012. 61. Heier JS. Investigation of efficacy and safety of intravitreal aflibercept injection in wet agerelated macular degeneration (AMD). Data presented at: Association for Research in Vision and eY/98 eY/99 UNA NUEVA MIRADA EN OFTALMOLOGÍA EN RESUMEN: Mecanismo de acción único: Trap. angiogénicos. 83 días de actividad biológica estimada. Formulado especialmente para inyección intravítrea. 80% de pacientes con ganancia de visión. menos controles, menos molestias, menos gastos menos riesgo de complicaciones. L.UY.SM.10.2013.0056 Eylia permite ampliar el intervalo entre inyecciones sin necesidad de monitoreo intermedio.