Examen BQOI Junio 1999
Anuncio

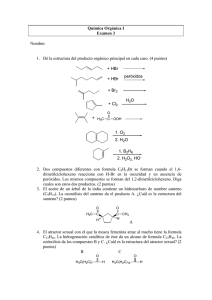
Química Orgánica Examen Junio 1999 1. Nombre las fracciones del petróleo Obtenidas de la destilación del petróleo tenemos: Gases(metano a butano) hasta 20º Nafta ligera(gasolina ligera) 20-150º Nafta pesada (gasolina) 150-200º Keroseno 175-275º Gasóleo 250-350º Residuo >350º 2. A) Enumere los tipos de polímeros 1-4C 5-8C 8-11C 10-16C 15-22C 20-...C 1-5% 10-20% 10-25% 8-15% 15-30% 30-50% Plásticos (termoblandos): cadenas ramificadas con interacciones débiles Fibras: existe un eje sobre el que se hila la molécula Elastómeros o cauchos: pueden deformarse reversiblemente cuando se les aplica una fuerza Resinas: o plásticos termoduros: polímeros muy duros y resistentes que adoptan la forma antes de sufrir el fraguado B) Indique dos características a nivel molecular de las fibras Existe un eje sobre el que se hila la molécula. Son cadenas lineales con interacciones fuertes. Una vez se ha hilado se queda siempre así: Se puede romper pero no deformar. Las interacciones so dipolo-dipolo o puentes de H. 3. Dibuje la estructura del monómero de fibras A) acrílicas El polímero (p.ej. el orlón) se obtiene por vía radicalaria (es un caso de polimerización vinílica). CH 2 CH CH 2 C N CH CH 2 C N CH CH 2 C N A partir del acrilonitrilo se obtiene el poliacrilonitrilo. B) Nylon 6 Es la amida cíclica(caprolactama) O N H Nylon 6 4. A) Nombre dos procesos a partir del carbón e indique los objetivos Coque (residuo) HULLA CARBÓN CaO 2000º C Ca 2 CH=CH acetileno BTX, mezclas disolventes, etilbenceno CARBÓN Gas de Agua o de Síntesis C+H2O CO+H 2 ∆ H=30 Kcal/mol/ Que se acopla con la combustión parcial del C que es exotérmica C+1/2O2 CO ∆ H=-28 Kcal/mol/ El gas de agua se utiliza para obtener metanol (para combustible), derivados, y también metano B) ¿Qúe es la fracción BTX y en qué proceso se obtiene? La fracción BTX son los anillos aromáticos (Benceno, Tolueno y Xileno) obtenidos de la destilación seca del alquitrán de hulla (como se ve en el apdo.a) Con una temperatura de 150ºC y una posterior destilación fraccionada obtenemos BTX, mezclas de disolventes y etilbenceno. 5. A)¿Qué es el gas de síntesis y para qué se utiliza? El gas de síntesis se obtiene de las naftas el gasóleo, el metano y en la gasificación del carbón (ver ej.4) mediante una combustión incompleta y reacción con H2O. También es llamado gas de agua y es CO + H2 El gas de agua se utiliza para la síntesis del metanol, de NH3 para fertilizantes, para obtener alcoholes por medio de la hidroformilación y para obtener H2 para hidrógenos industriales. B)Indique la estructura de algún freón y la relación de este tipo de compuestos con la capa de ozono Los freones, también llamados clorofluorocarbonados. Estos compuestos se emplean como refrigerantes, solventes, y propulsores en los aerosoles. Siendo los más típicos el triclorofluorometano CFCl3 (denominado Freón – 11) y el diclorodifluorometano CF2Cl2 (Freón – 12). Los freones son tan buenos refrigerantes debido a que poseen una gran capacidad calorífica, lo que les permite pasar casi a temperatura ligeramente inferior a la ambiente de estado líquido a gas absorbiendo el calor del medio. Nomenclatura: Cl F C Cl F - nº carbonos –1 - nº hidrógenos +1 - nº de fluor = CF2Cl2 Freon - 12 Se creía que eran inertes, pero se ha demostrado que lo que realmente pasaba con los freones, era que se volatilizaban y se incorporaban a la atmósfera, donde se difundían sin sufrir alteraciones, llegando hasta la capa de ozono en la estratosfera, y lo que hace este freón que ha llegado hasta la estratosfera es iniciar reacciones en cadena de radicales libres, con la luz ultra violeta proveniente del sol sin filtrar por la atmósfera, que rompen el equilibrio natural del ozono. (1) Inicio de la cadena CF2Cl2 + hν (2) Propagación Cl· + O3 (3) de la cadena ClO· + O CF2Cl· + Cl· ClO· + O2 O2 + Cl· En la etapa inicial la luz ultra violeta provoca la ruptura homolítica de un enlace C-Cl del Freón. Siendo el átomo de cloro que se forma es verdadero causante del problema ya que es capaz de producir una cadena de reacciones que destruyen miles de moléculas de ozono rápidamente. 6. A)Dibuje la estructura del caucho natural. B)Indique la diferéncia en la estructura del caucho natural y la del poliisopreno obtenido por vía radicalaria. El caucho natural es el polímero todo cis 1,4 del isopreno. Varias plantas producen un poliisopreno todo trans 1,4 llamado gutapercha o balata. Este producto es cristalino, menos elástico y menos resistente que el caucho. Gutapercha 7. Indique cuatro reacciones de formación de enlace C-C y ponga un ejemplo de cada una de ellas HC CH NaNH2 O H3C C AlCl 3 Cl HC CO C ClCH3 CH 3 HC C CH 3 A partir de alquinos Acilación de Fiedel-Crafts O CH3-MgI CH 3 H3C C O MgI H3C C H+ CH 3 CH 3 O H3C H C H H H H3C C CH 3 Grignard CH 3 O CH 3 CH CH C C C OH H O Condensación aldólica H 8. A) Qué compuesto, la propanamina ó la N,N-dimetilmetanamina tiene un P.eb. 3º y cuál 50º? Justifique porqué teniendo el mismo PM tienen ptos de ebullición tan diferentes Es mayor el P.eb. de la propanamina(50º) pues forma enlaces de Van der Waals (es un Hidrocarburo lineal) y no el otro que no lo es y las fuerzas moeculares no son numerosas (si las hay). NH 2-CH 2-CH 2-CH 3 Propanamina CH3 N,N-dimetilmetanamina N CH3 CH3 B) Sintetizar 1-fenil-2-pentanol a partir de bromobenceno, tolueno y compuestos de uno o más carbonos. 9. A)Explique a qué es debida la acidez de los hidrógenos α a un grupo carbonilo de una cetona La razón de esta acidez de los hidrógenos α es, que cuando un compuesto carbonílico pierde un protón α, el anión resultante es estabilizado por resonancia. B) Ponga un ejemplo de condensación aldólica. O O CH 3 C OH- (conc) CH 3 CH 3 C CH C CH 3 CH 3 9. 10. A) ¿Cómo se generó acetileno en el laboratorio? Se hizo una mezcla con 0,5 gramos de C2Ca y 5ml. de agua destilada, lo que generó acetileno, quedando la reacción de la siguiente manera. C2Ca H2O destilada HC CH acetileno B)¿Qué ocurría cuando se burbujeaba acetileno a través de una disolución de bromo en agua? Cuando se burbujeaba bromo en agua ocurría la siguiente reacción, formándose cisdibromoeteno, y con un exceso de bromo el dibromoetano. HC Br Br 2 CH Br C H C H con exceso de Bromo CHBr 2 CHBr 2 11. A) ¿Cómo se estableció en prácticas la diferencia de acidez entre el ácido oleico, el fenol y el butanol? Mezclando cada uno de ellos con Na2CO3 (aq), NaOH (aq) y con Na(s) y viendo el resultado de las posibles reacciones. Na2CO3 (aq) NaOH (aq) butanol NO REACCIONA NO REACCIONA fenol NO REACCIONA FENIL+Na+ Na (s) BUTÓXIDO SÓDICO FENÓXIDO SÓDICO Ac.oleic SAPONIFICACIÓN SAPONIFICACIÓN SAPONIFICACIÓN o Vemos que el butanol es el menos reactivo (es menos ácido) El fenol si reacciona con el NaOH (aq) y con Na(s) (es más ácido) Y el Ac.oleico es el más ácido de los tres creando jabón gracias a la saponificación. B) Nombre los diferentes polímeros que realizó en prácticas (Indique los monómeros). En prácticas preparamos dos resinas; La Fenol- formol cuyos precursores eran la resorcina y el fenol, y que nos daba como producto una resina como la baquelita. OH H OH O C H H+ Resina fenol-formol resorcina (fenol modificado) Y por otro lado, la resina Urea-formol, cuyos precursores eran la urea y el formol, formando así mismo una resina. H2N O C NH 2 H Urea O C H H+ Resina Urea-formol Una poliamida, el nylon. Creabamos una fibra, en este caso el nylon a partir de dicloro de adipolilo proviniente del Ac. dióico pero clorado y de hexametilendiamina O C Cl (CH 2)4 O C Cl dicloruro de adipolilo H2N (CH 2)6 NH 2 hexametilendiamina Fibra Finalmente formábamos un caucho. Procediendo con un prepolímero como es el alcohol polivinílico y borato para unir cadenas. Caucho NaB(OH)4 CH2=CHOH Alcohol vinílico Borato 12. Mecanismo de polimerización y estructura de la resina urea formaldehído. El monómero es: O C H O O + H2N H C NH 2 + CH 2OH C H H N C N H O H CH 2OH dimetilol-urea Que se polimeriza formando cadenas como la que sigue: H C N CH 2OH 13. 14. 15. 16. 17. 18. 19. 20. CH 2 N O C H CH 2 N O CH 2 N C N N CH 2 CH 2 N O ?? ?? ?? Sintetiza 1,2-difenil-2-propanol a partir de benceno, tolueno y compuestos de uno o más carbonos. ?? ?? ?? A) Ordene por reactividad creciente frente a la adición de bromuro de hidrógeno los siguientes alquenos justificando la respuesta: 1-buteno, 1-metil-ciclopenteno y 2etenilnaftaleno. B) a partir de tolueno obtener el ácido 4-bromo-2-cloro-benzoico