PRÁCTICA 3: Valoración potenciométrica
Anuncio

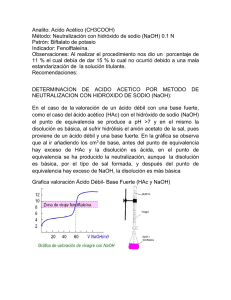
Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 1 PRÁCTICA 3: Valoración potenciométrica: Determinación de la constante de acidez del ácido acético. OBJETIVOS Esta Sesión consta de tres partes. PARTE A: Valoración de una disolución de NaOH empleando un patrón primario. PARTE B: Obtención de las curvas de valoración de un ácido fuerte y de un ácido débil. PARTE C: Determinación potenciométrica de la constante de acidez del ácido acético. El objetivo de la práctica es doble: por una parte, introducir al alumno en el campo cuantitativo donde, a diferencia del cualitativo, la medición exacta de todas las variables es de capital importancia; y por otra parte, ilustrar la utilización del método potenciométrico en dos de sus aplicaciones más importantes: (1) valoración potenciométrica ácido-base, obtención de la curva de valoración y (2) utilización de los datos potenciométricos obtenidos en una valoración para la determinación de una constante de acidez. INTRODUCCIÓN La valoración ácido-base consiste en la determinación de la concentración de un ácido o una base, mediante la adición del volumen necesario de una base o ácido de concentración conocida, respectivamente, para alcanzar el punto de equivalencia, es decir, cuando todo el ácido o base presentes en la disolución han sido neutralizados. La sustancia cuya concentración se conoce se denomina valorante, y la sustancia de la cual queremos conocer su concentración valorado. Dado que a menudo tanto las disoluciones empleadas como los productos de la reacción no presentan color en el visible, es necesario el empleo de un indicador ácido-base que nos indique en qué punto la neutralización del ácido o base problema se ha completado. Estos indicadores son especies ácido-base cuyas formas básica y ácida tienen colores diferentes. El pH al que vira el indicador y que será el que nos dé el punto final de la valoración no tiene por que coincidir con el pH en el punto de equivalencia. En la valoración clásica de un ácido fuerte con una base fuerte, el punto de equivalencia de la valoración es el punto en el que el pH de la disolución es exactamente 7. Sin embargo, si se emplea fenolftaleina como indicador, el punto final de la valoración tiene lugar cuando se alcanza un pH de 10 unidades. La variación del pH con la adición del valorante se puede seguir midiendo el pH en cada punto con la ayuda de un pHmetro (potenciometro). Este tipo de valoraciones se conocen como potenciometrías. La determinación potenciométrica requiere la utilización de un electrodo de vidrio acoplado a un pHmetro. El electrodo de vidrio contiene una membrana permeable, que permite el paso de los iones entre dos disoluciones, de manera que cuando se sumerge en una disolución (Figura 1) se establece una diferencia de potencial entre la parte interna de la membrana (en contacto con la disolución interna del mismo y de pH constante) y la parte externa de la membrana en contacto con la disolución problema. Esta diferencia de potencial, respecto a un electrodo de referencia, es proporcional a la diferencia en concentración de H+ en ambas disoluciones. El pHmetro mide esta diferencia de potencial y la transforma en una escala de pH. Así, el método potenciométrico nos permite seguir cuantitativamente la concentración de H+ en el transcurso de una reacción ácido-base. El método potenciométrico es más general, y así, la utilización de electrodos selectivos de otros iones (ej. iones metálicos) proporciona medidas cuantitativas de la concentración de éstos de forma análoga a la descrita anteriormente. Lab. Química II (Grado Química) Curso 2011-2012 201 Práctica 3- Pág. 2 Figura 1. Esquema del electrodo de vidrio empleado en la práctica. EXPERIMENTAL Material Reactivos Dos vasos de precipitados de 100 mL Disolución de ácido clorhídrico de plástico (NaOH) y 3 de 100 mL de aprox. 0.1 M para ser valorada. Disolución de NaOH aprox. 0.1 M vidrio (HAc, HCl y “para Valor.pot.) Erlenmeyer de 100 mL para ser valorada. Pipeta de 10 mL y propipeta Disolución de ácido acético aprox. Bureta de 10 mL 0.1 M para ser valorada. Disoluciones tampón de pH 4 y 7 Papel milimetrado y calculadora para calibrar el pH-metro Probeta 50 mL Ftalato ácido de potasio Pesasustancias (C H C HO K). 6 4 2 4 2 Espátulas por balanza Fenolftaleina NaCl (s) Equipos pHmetro con electrodo de vidrio Agitador magnético y barrita imantada para agitar Balanza En las Figuras 2 y 3 se indican los montajes que deben realizarse. Antes de realizar cualquier medida de pH el pHmetro debe calibrarse con tampones de pH 4 y 7. Para este calibrado se consultará la hoja de instrucciones que hay junto al pHmetro. 1. Valoración de la disolución de NaOH La cantidad calculada en la cuestión preliminar nº 2 nos servirá como referencia para saber cuánto tenemos que pesar, pero si se pesa un poco más o un poco menos NO importa. Lo importante para hacer los cálculos es anotar lo que cada alumno pesa. Se pesa (en balanza de al menos 3 cifras decimales) ftalato ácido de potasio, anotando la cantidad pesada y se disuelve dentro del matraz erlenmeyer con unos 10 mL de agua desionizadada. Se adicionan nan 2 gotas de fenolftaleína y se procede a la valoración de la disolución NaOH preparada anteriormente, colocándola en la bureta de 10 mL. La fenolftaleína es uno de los indicadores ácido-base base más utilizado: es incolora en disoluciones con pH menor de 8, [H3O+] > 10-8 M y de color rosa intenso (fucsia) a pH mayor de 10, [H3O+] < 10-10 M. En la valoración, el punto final (experimental), se pone de manifiesto por el cambio de coloración a rosa débil, que persiste por lo menos 15 segundos al agitar la disolución. El procedimiento práctico detallado, que en los aspectos generales de limpieza, material empleado y montaje experimental es común a las distintas valoraciones a realizar en la práctica, es el siguiente: Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 3 Figura 2. Esquema del montaje para realizar una valoración. 1. Lavar la bureta. Se llena la bureta con agua desionizada (inclinando ligeramente para facilitar el llenado). Comprobar que no gotea y que al abrir la llave el líquido fluye adecuadamente. Antes de continuar, es conveniente entrenarse en el manejo de la llave para coger habilidad y ser capaces de verter gota a gota. Se vacía la bureta comprobando que se eliminan las posibles burbujas de aire. Para evitar que vuelva a entrar aire se cierra la llave dejando un pequeño volumen de agua por encima de la llave. 2. Lavar la bureta 3 veces con pequeñas porciones de la disolución a valorar (hidróxido de sodio). En cada paso se cerrará la llave antes de vaciarla del todo para impedir que vuelva a entrar aire. 3. Llenar la bureta con hidróxido sódico. Enrasar a cero. 4. Pesar la cantidad de ftalato ácido de potasio (patrón primario) calculada previamente para consumir aproximadamente 6-7 ml de la disolución de NaOH. 5. Disolver esta cantidad en unos 10 mL (aprox.) de agua destilada. No importa el volumen de agua utilizado, ¿por qué? 6. Añadir 1 ó 2 gotas de fenolftaleína. 7. Añadir NaOH desde la bureta sobre el ácido (en el erlenmeyer) y cuando se esté próximo al punto final de la valoración (cercano al indicado en la cuestión previa 2), añadir el valorante lentamente, gota a gota. Seguir hasta cambio de color (que debe persistir unos segundos). Anotar el volumen gastado. 8. Repetir la valoración tres veces, comprobando que la concentración media obtenida de NaOH presenta un error relativo menor del 5%. Incluir los valores experimentales de la masa de ftalato ácido de potasio y los volúmenes de NaOH en la Tabla 1. Seguir las indicaciones de la sección “Resultados, trat. de datos y discusión” apartado 1, para determinar la concentración de la disolución de sosa. 2. Valoración potenciométrica del ácido clorhídrico. Determinación de Kw y la curva de valoración ácido fuerte-base fuerte. Calibrado del pH-metro. Antes de realizar cualquier medida con el pH-metro es necesario calibrarlo. El pH-metro debe calibrarse con tampones de pH 4 y 7. Para este calibrado se seguirán las indicaciones la hoja de Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 4 instrucciones que hay junto al equipo. En caso de duda, consultar al profesor. Curva de valoración ácido fuerte-base fuerte. Tomar unos 25 mL de "HCl 0.1M aprox." en un vaso limpio y seco marcado como “HCl”. Enjuagar la pipeta de 10mL con 2-3 mL de la disolución de HCl. Desechar en el bote de residuos. Pipetear 5 mL (por diferencia del 0 al 5) de la disolución de HCl y trasvasar al vaso marcado como “Para valor.pot.” limpio. (El HCl sobrante de la pipeta se puede devolver al vaso marcado como “HCl”). Se añaden 45 mL de agua desionizada. Se coloca el electrodo dentro de la disolución y se agita sobre el agitador magnético con la barrita imantada dentro del vaso (Fig.3). El electrodo no ha de tocar la pared del vaso y el imán no ha de golpear el electrodo al girar. Se añaden 2 gotas de fenolftaleína. En la bureta de 10 mL tendremos la disolución de "NaOH valorada". Se enrasa a cero. Desde ésta se deja caer la disolución de NaOH sobre el vaso, con intervalos de 0.2 mL, agitando continuamente y se mide el pH después de cada vertido. En las proximidades del punto final, cuando en una adición el valor del pH varía considerablemente (en 2-3 unidades) respecto de las anteriores, las adiciones deberán ser 0.05 en 0.05 mL (gota a gota). Continuar la valoración hasta haber añadido un total de 10 mL de la sosa. Repetir la valoración ácido fuerte-base fuerte dos veces más, completando la Tabla 2. Seguir las indicaciones de la sección “Resultados, trat. de datos y discusión”, aptdos. 2 y 3 para determinar la concentración de la disolución de HCl y el valor de Kw. Figura 3. Montaje de la valoración potenciométrica. 3. Valoración potenciométrica del ácido acético. Curva de valoración ácido débil-base fuerte. Determinación de su Ka. Repetir el mismo procedimiento que en el apartado 2, pero en lugar de “HCl 0.1M aprox” se utiliza “Ácido acético problema”. En este caso, a la disolución a valorar añadiremos además 2.9 g de cloruro sódico para mantener constante la fuerza iónica. Repetir la valoración ácido débil-base fuerte dos veces más, completando la Tabla 5. Seguir las indicaciones de la sección “Resultados, trat. de datos y discusión” aptdos. 4 y 5, para determinar la concentración del ácido acético y el valor de su Ka. Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 5 RESULTADOS, TRATAMIENTO DE DATOS Y DISCUSIÓN 1. Determinación de la concentración de NaOH. Las disoluciones de concentración exactamente conocidas se denominan disoluciones estándar y existen estándares primarios y secundarios. La disolución de NaOH preparada mediante pesada del sólido no es estándar primario porque, incluso en estado sólido, el NaOH absorbe CO2 y H2O del aire, por lo que su peso no se conoce exactamente. En cambio el ftalato ácido de potasio constituye un estándar primario porque cumple los requisitos de: 1. 2. 3. 4. 5. No absorber ni reaccionar con los componentes atmosféricos. Reaccionar con las bases de modo invariable. Tener un alto porcentaje de pureza. Ser soluble en agua. No ser tóxico. La reacción que tiene lugar es la siguiente: NaOH (aq) + C6H4C2HO4K → C6H4C2O4KNa + H2O Así pues, conociendo exactamente el peso de ftalato ácido de potasio (también nombrado como KHP) y el volumen de la disolución de NaOH gastado para alcanzar el punto de equivalencia (moles de ácido = moles de base en ácidos y bases monopróticos), puede deducirse la concentración exacta de dicha disolución haciendo uso de la relación general: VA . CA = VB . CB (1) de la que se pueden derivar las siguientes expresiones: moles de ftalato = nº de moles de NaOH m ftalato/ Mrftalato = VNaOH x MNaOH siendo el Mr ftalato =204.23 La concentración de la disolución de NaOH (MNaOH) es ahora estándar para cualquier valoración ácido-base posterior, como la del ácido acético. Tabla 1. Valoración de la disolución de NaOH. Mftalato (g) 1 2 3 VNaOH (mL) [NaOH] (M) [NaOH] media (M) 2. Determinación de la concentración de ácido clorhídrico. Con los datos de la Tabla 2, representa gráficamente el pH medido frente al volumen de hidróxido sódico añadido VB. La representación obtenida constituye la denominada curva de valoración. Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 6 Tabla 2. Valoración ácido fuerte-base fuerte. Valoración nº 1 VNaOH pH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH Valoración nº 2 pH VNaOH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH Valoración nº 3 VNaOH pH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH El punto de inflexión de dicha curva corresponde al punto de equivalencia, en el cual el número de moles de ácido es igual al número de moles de base, o lo que es lo mismo (ecuación (1)): Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 7 VHCl . MHCl = VNaOH . MNaOH donde VHCl es 5 mL, MHCl la concentración del ácido que queremos determinar, VNaOH es el volumen de la base correspondiente al punto de equivalencia y MNaOH la concentración determinada en el apartado anterior. Para determinar dicho punto de equivalencia, se puede seguir el siguiente procedimiento gráfico indicado en la Figura 4: Figura 4.- Determinación del punto de equivalencia. 1) Traza una recta (1) que pase por la porción ascendente de la curva de valoración. 2) Prolonga una recta (2) desde la parte final de la curva para cortar la línea (1) y determinar el punto A. 3) Traza por A una recta paralela al eje de pH (3) y otra paralela al eje de volumen (4). 4) De forma similar, determina el punto B (1) y (5), y traza las dos paralelas (6) y (7). Se determina así un rectángulo de vértices ABCD 5) Traza la diagonal CD. Su intersección con la línea (1) da el punto de equivalencia. O bien se utiliza un programa de cálculo o representación (tipo excel, kaleida…) para estimar el punto de inflexión de la curva, trazando la derivada de la misma (Figura 5): ∆pH pH -------------- ∆V VB VB Figura 5.- Curva de valoración y derivada de la curva de valoración. Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 8 A partir de los valores del punto de equivalencia para las tres valoraciones realizadas (Tabla 3), calcular el valor medio de concentración para la disolución de HCl: Tabla 3.- Concentración de la disolución de HCl. [HCl] Valoración nº1 [HCl] Valoración nº2 [HCl]Valoración nº3 [HCl] promedio 3. Determinación del valor de Kw. La determinación de Kw se realiza a partir de los datos experimentales de la valoración potenciométrica ácido fuerte-base fuerte (Tabla 2). El producto iónico del agua (o constante de autoprotólisis), KW se define según la ecuación (2), de la cual podemos deducir la (3). KW = [OH-].[H3O+] log[OH-] = logKW + pH (2) (3) A partir de los puntos (pH, VB) tomados inmediatamente después del salto de la curva de valoración HCl-NaOH, podemos calcular teóricamente el valor de [OH-] según la ecuación (4), mientras que los de pH serán los obtenidos potenciométricamente para los correspondientes VB (la definición de los símbolos se da más abajo). [OH-] = (VB.C0B – VA.C0A)/VT (4) Una representación de los valores de log[OH-] frente a los de pH (completar la Tabla 4) nos proporcionará una recta de pendiente unidad y de ordenada en el origen logKW. Representar y ajustar las rectas para cada una de las tres valoraciones y tomar el valor medio de Kw para el apartado siguiente. Tabla 4. Determinación de KW. VB [OH-] log[OH-] pH 4. Determinación de la concentración de ácido acético. Con los datos de la Tabla 5, representa gráficamente el pH medido frente al volumen de hidróxido sódico añadido VB. La representación obtenida constituye la denominada curva de valoración. Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. Tabla 5. Valoración ácido débil-base fuerte. Valoración nº 1 VNaOH pH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH Valoración nº 2 pH VNaOH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH Valoración nº 3 VNaOH pH (mL) VNaOH (mL) pH VNaOH (mL) pH VNaOH (mL) pH 9 Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 10 Proceder de forma análoga a la indicada en el apartado 2. y completar la Tabla 6. Tabla 6.- Concentración de la disolución de ácido acético (HAc). [HAc] Valoración nº1 [HAc] Valoración nº2 [HAc]Valoración nº3 [HAc] promedio 5. Determinación de la constante de acidez del ácido acético. La disociación del ácido acético en agua corresponde al equilibrio HAc + H2O ↔ Ac- + H3O+ que tiene una constante de equilibrio Ka (constante de acidez) (5) Ka = [Ac-].[H3O+] / [HAc] Queda claro que para determinar el valor de Ka necesitamos conocer [Ac-], [HAc] y [H3O+] en el equilibrio. Si bien [H3O+] puede determinarse potenciométricamente, no disponemos de "aparatos" análogos capaces de medir [Ac-] y [HAc]. Para poder deducirlas tendremos que utilizar nuestros conocimientos sobre el equilibrio químico y desarrollar ecuaciones matemáticas que lo permitan. Muy comunes y útiles son los llamados balances de masas y de cargas (ecuaciones (6) y (7) respectivamente). CHAc = [Ac-] + [HAc] (6) [Na+] + [H 3O+] = [OH-] + [Ac-] (7) A partir de (6) y (7) fácilmente podemos deducir las ecuaciones (8) y (9) que nos proporcionan los valores de [Ac-] y [HAc] respectivamente. [Ac-] = VB.C0B/VT + [H3O+] – KW/[H3O+] (8) [HAc] = VHAc.C 0HAc/VT - [Ac-] (9) donde se ha tenido en cuenta que [OH-] = KW/[H3O+], CHAc = VHac.C0HAc/VT y [Na+] es la concentración del ión sodio debido solamente a la adición de NaOH (es decir [Na+] = VB.C0B/VT). El significado de los demás parámetros se indica a continuación: VT = Volumen total de la disolución en cada punto ( VT = VB+V0 ). V0 = Volumen inicial de la disolución (100 mL). VB = Volumen de NaOH añadido. VHAc = Volumen de HAc añadido. C0B =Concentración de NaOH utilizada. C0HAc = Concentración de HAc utilizado. KW = Constante de autoprotólisis del agua (en las condiciones de la práctica, pKw=13.85). NOTA.- Se ha introducido la variable VT para tener en cuenta la dilución de los reactivos por la adición de NaOH. Así pues, para cualquier punto (VB, pH) de la curva de valoración podemos calcular las correspondientes concentraciones de Ac- y HAc existentes en el equilibrio y determinar Ka mediante la ecuación (5). Sin embargo, cuando se dispone de una curva completa de valoración se puede trabajar de la forma que se describe a continuación, donde se minimizan los errores y se verifica la bondad de la experiencia realizada. De la expresión (5) se deduce fácilmente la (10), pH = pKa + log [Ac-]/[HAc] (10) Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 11 Si representamos el pH (en ordenadas) en función de log [Ac-]/[HAc], obtendremos una línea recta de pendiente la unidad y cuya ordenada en el origen es pKa. Para ello tomaremos los puntos más representativos del equilibrio, es decir los comprendidos en el intervalo a-b (Figura 6), o sea, los comprendidos entre un 10 y un 90% de la valoración aproximadamente. * NOTA.-Para pH inferiores a 6, el último término de la ecuación (8), KW/[H3O+] puede eliminarse. Además, aunque en los primeros puntos de la valoración el segundo término, [H3O+], puede tener cierta influencia, para pH superiores a 4 ó 5 puede eliminarse también. Figura 6. Curva de valoración del ácido acético con sosa. Tabla 7. Determinación de Ka. VB pH (exp.) [Ac-] [HAc] ecuación (8) ecuación (9) log [Ac-]/[HAc] Lab. Química II (Grado Química) Curso 2011-2012 Práctica 3- Pág. 12 CUESTIONES Cuestiones previas Lee atentamente cada uno de los apartados de esta práctica y a continuación intenta responder a las siguientes cuestiones antes de realizar las experiencias propuestas 1. A partir de los datos que figuran en la etiqueta o en la ficha de seguridad, indica los posibles riesgos que puede implicar la manipulación del hidróxido sódico y las precauciones que se deben de tomar en su manipulación. 2. Calcular la cantidad de ftalato ácido de potasio (Mr ftalato =204.23) que se necesita en la neutralización de 5 mL de NaOH 0.1M. 3. Discute y razona los balances de masas y cargas (ecuaciones (6) y (7)) y deduce las ecuaciones (8) y (9). 4. Discute y comprueba numéricamente las indicaciones de la NOTA del último apartado. 5. Calcula los mililitros de una disolución de NaOH 0.1 M que se requieren para "neutralizar" 100 mL de una disolución (a) 0.01 M en HCl, (b) 0.01 M en HAc y (c) 0.01 M en ácido oxálico. 6. Calcula el pH resultante cuando a 100 mL de una disolución 0.01 M en HCl se le añaden los siguientes volúmenes de una disolución de NaOH 0.1 M: a) 9 mL, b) 10 mL, c) 11 mL. 7. Haz lo mismo que en la cuestión 6 pero, reemplazando la disolución de HCl por una de HAc de la misma concentración (Ka=1.8 10-5). Calcula [HAc] y [Ac-] en cada punto Cuestiones posteriores al trabajo experimental 1. Comentar la forma de las curvas de valoración (HCl y HAc) y calcular el pH del punto final en cada una de ellas. 2. Deducir las concentraciones de Ac- y HAc para las cuales pH = pKa. Utiliza la curva de valoración para determinar el valor correspondiente de VB. Discutir el valor encontrado. 3. ¿Por qué es mucho más importante obtener medidas de pH estables en la valoración de HAc que en la de ácido fuerte-base fuerte? 4. ¿Se puede utilizar el indicador fenolftaleína para determinar el punto de equivalencia en la valoración ácido acético-sosa? BIBLIOGRAFÍA 1. P.W.Atkins. Principios de Química. 2005. 3ª Edición. Capítulos 10 y 11. Ed. Panamericana. 2. Daniel C.Harris. Análisis Químico Cuantitativo. 2009. 6ª edición. Tema 12. Ed. Reverté. 3. Tabla de indicadores ácido-base (ver Anexo en web). 4. Tabla de constantes de ionización (ver Anexo en web). VIDEOS: Universitat de València. Lab. Química General: Valoración ácido-base: http://mmedia.uv.es/buildhtml?lang=es_ES&user=tcliment&name=valoracion_biologos.mp4&path=/LABORATORIO/&id=2686 Calibrado pHmetro: http://mmedia.uv.es/buildhtml?lang=es_ES&user=tcliment&name=calibrado_phmetro.mp4&path=/LABORATORIO/&id=6580