Síntesis de Nitro
Anuncio

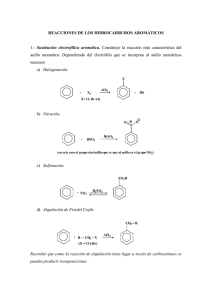
NITROCOMPUESTOS Nomenclatura de los Nitro Compuestos Estos compuestos se nombran considerando al grupo -NO2 como un sustituyente nitro Nitro Compuestos alifáticos nitrometano Nitro Compuestos aromáticos nitrobenceno Estructura El átomo de nitrógeno es trigonal plano con ángulos de enlace de 120°. Hay dos formas resonantes que implican que los dos átomos de oxígeno son equivalentes Efectos electrónicos Los grupos nitro son grupos electroatractores, tanto por efecto inductivo, ‐I, como por efecto resonante, ‐ R. Esto significa que tanto el enlace C‐N y el sistema π están fuertemente polarizados EFECTO -R El grupo ‐NO2 en el nitrobenceno hace sentir su efecto por resonancia –R en las posiciones orto y para a través de los enlaces π. También opera el efecto –I, pero este es menos obvio EFECTO -I Debido al efecto inductivo -I en el enlace σ, los valores de pKa de los compuestos conteniendo al grupo nitro se ven afectados: Propiedades físicas Al comparar a los nitrocompuestos con otros compuestos aromáticos que tengan el mismo peso molecular, se observa e.g. un incremento en el punto de ebullición fuera de proporción: Propiedades físicas O N O o p.f. 5.7 C O O N N O O N o p.f. 118 C o p.e. 319 C (774 mm Hg) O N O O N O O o p.e. 210 C O O N O o o p.e. 303 C (770 mm Hg) o p.e. 299 C (777 mm Hg) p.f. 89.8 C p.f. 174 C o Los nitrocompuestos son insolubles en agua, a menos que contengan dentro de su estructura un grupo que interacciones con ella: Síntesis de Nitro-Compuestos Los nitro compuestos alifáticos se sintetizan por: Nitración en fase gaseosa de alcanos Reacción SN2 de nitrito sobre halogenuros de alquilo Nitración electrofílica de aniones enolato Oxidación de aminas con perácidos Síntesis de Nitro-Compuestos Nitración en fase gaseosa de alcanos Este es un proceso industrial que ocurre a través de radicales libres y que involucra al radical NO2 Síntesis de Nitro-Compuestos Nitración en fase gaseosa de alcanos Síntesis de Nitro-Compuestos o CH3CH2CH2CH2CH3 + HNO3 420 C CH3 CH2 CH2 CH2 CH2 NO2 + CH3 CH CH2 CH2 CH3 + NO2 18.2 % 18.9 % H CH3 CH2 C CH2 CH3 NO2 20.2 % o CH3CH2CH2CH3 + HNO3 420 C H3C NO2 + CH3 CH2 NO2 + CH3 CH2 CH2 NO2 + 10 % 13 % CH3 CH2 CH2 CH2 NO2 24 % 8% CH3 CH CH2 CH3 NO2 45 % Síntesis de Nitro-Compuestos Reacción SN2 de nitrito sobre halogenuros de alquilo Cuando se hace reaccionar al nitrito de sodio (el cual actúa como un nucleófilo ambivalente, a través del O o del N como nucleófilos) se obtienen dos productos: un nitro compuesto o bien un éster nitrito Síntesis de Nitro-Compuestos Reacción SN2 de nitrito sobre halogenuros de alquilo + NaNO2 I EtOH + H2O O 58 % N O N O O 30 % Síntesis de Nitro-Compuestos El uso de nitrito de plata produce únicamente el nitro compuesto El AgNO2 es insoluble en éter, por lo que se evitan reacciones laterales Síntesis de Nitro-Compuestos Reacción SN2 de nitrito sobre halogenuros de alquilo Et2O Cl + AgNO2 o NO HAY REACCIÓN 0 a 25 C Et2O Br + AgNO2 o 0 a 25 C 80 % N O Et2O I + AgNO2 o 0 a 25 C 82 % N O O O Síntesis de Nitro-Compuestos Reacción SN2 de nitrito sobre halogenuros de alquilo Br + NaNO2 DMF N O 60 % BrH+ NaNO2 + NaNO2 I DMF O + O N O 20 % 61 % N O 60 % N O DMSO O + O N O 20 % O Síntesis de Nitro-Compuestos Reacción SN2 de nitrito sobre halogenuros de alquilo Síntesis de Nitro-Compuestos Nitración electrofílica de aniones enolato El uso de los aniones enolato de compuestos con metilenos activos, forman un producto muy estable debido a la formación de un quelato con el contraion O CH3O CH2 H Na O CH3O H + O CH2 Na CH2 H3C O N O O Na O CH H O N O O + CH3O Na O N CH3O H C O + H QUELATO MUY ESTABLE Síntesis de Nitro-Compuestos Nitración electrofílica de aniones enolato CH3 CH2 O N CH3 CH2O O O K O N K O 75 % CH3 CH2 O N O OEt CH3 CH2O O O N O K H 80 % K O O + CH3CH2 O O CH2CH3 Síntesis de Nitro-Compuestos Oxidación de aminas con perácidos Los nitro compuestos se pueden obtener por medio de la oxidación de aminas con perácidos Síntesis de Nitro-Compuestos Oxidación de aminas con perácidos O H N H CF3 H O O NO2 (3 EQUIVALENTES) O N O NO2 Síntesis de Nitro-Compuestos Oxidación de oximas con perácidos Síntesis de Nitro-Compuestos Nitro compuestos aromáticos Estos son sintetizados por medio de la reacción de sustitución electrofílica aromática (SEA) con iones NO2+ como electrófilos MEZCLAS NITRANTES HNO3 (FUMANTE) + H2SO4 (FUMANTE) (95 A 100 %) (10 % DE SO3) MEZCLA USADA PARA LLEVAR A CABO LA NITRACIÓN SOBRE ANILLOS DISUSTITUÍDOS O TRISUSTITUÍDOS MEZCLAS NITRANTES HNO3 (FUMANTE) + H2SO4 (FUMANTE) (95 A 100 %) (10 % DE SO3) MEZCLAS NITRANTES HNO3 (FUMANTE) + H2SO4 (FUMANTE) (95 A 100 %) CH3 O CH3 NO2 HNO3 (f) NO2 (10 % DE SO3) H2SO4 (f) o 40 C 3h O2N NO2 KMnO4 C OH O2N NO2 H H2SO4 O2N NO2 H2O NO2 98 % NO2 NO2 70 % MEZCLAS NITRANTES HNO3 (CONCENTRADO) + H2SO4 (CONCENTRADO) (65 A 70 %) (98 %) d = 1.4 A 1.42 g/mL d = 1.84 g/mL Cl Cl Cl HNO3 (c) H2SO4 (c) NO2 + o 40 C NO2 HNO3 (c) H2SO4 (c) o 90 C Cl NO2 NO2 MEZCLAS NITRANTES HNO3 (CONCENTRADO) + H2SO4 (CONCENTRADO) (65 A 70 %) (98 %) d = 1.4 A 1.42 g/mL d = 1.84 g/mL MEZCLAS NITRANTES HNO3 (CONCENTRADO) + H2SO4 (CONCENTRADO) (65 A 70 %) (98 %) d = 1.84 g/mL d = 1.4 A 1.42 g/mL H H C H 61 % 39 % H H C CH3 47 % 53 % H H3C C CH3 31 % 69 % CH3 H3C C CH3 18 % 82 % MEZCLAS NITRANTES KNO3 + H2SO4 (CONCENTRADO) (98 %) d = 1.84 g/mL MEZCLAS NITRANTES KNO3 + H2SO4 (CONCENTRADO) (98 %) d = 1.84 g/mL 3 2 4 2 MEZCLAS NITRANTES HNO3 (FUMANTE) + Ac2O (95 A 100 %) MEZCLAS NITRANTES HNO3 (FUMANTE) + Ac2O (95 A 100 %) MEZCLAS NITRANTES HNO3 (CONCENTRADO) + AcOH (65 A 70 %) Condiciones más suaves d = 1.4 A 1.42 g/mL MEZCLAS NITRANTES HNO3 (CONCENTRADO) + AcOH (65 A 70 %) d = 1.4 A 1.42 g/mL El grupo controla la regioquímica MEZCLAS NITRANTES PROBLEMAS PROBLEMAS REACIONES DE NITROCOMPUESTOS ÁCIDO-BASE Formación de Aniones Las bases conjugadas, se forman con facilidad cuando se tratan con una base fuerte. Dichos aniones se encuentran estabilizados por resonancia (aniones nitronato): H H Base + N O O Base H + N O O ANION NITRONATO N O O REACIONES DE NITROCOMPUESTOS Los protones en el nitrometano, MeNO2, tienen un pKa de 10.2, por lo que una base apropiada para llevar a cabo la reacción ácido-base podría ser el KOH. Como el ion nitronato esta deslocalizado, es una base blanda que reacciona con ácidos blandos REACIONES DE NITROCOMPUESTOS Reacción de Henry Esta es una reacción análoga a la reacción Aldólica Henry, L. Compt. Rend., 1895, 120, 1265. MECANISMO REACCIÓN DE HENRY ELIMINACIÓN E1BC O H O H N O O O N H O O H O N H H O N O O MECANISMO REACCIÓN DE HENRY Si el aldehído es alifático, se necesita utilizar anhídrido acético para llevar a cabo la eliminación O OH O R H + N O O R O N H O O O N H R O N O REACCIÓN DE HENRY EJEMPLO RECIENTE (+)-N-metilefedrina DIPEA = (iso-Pr)2EtN A New Copper Acetate-Bis(oxazoline)-Catalyzed, Enantioselective Henry Reaction D. A. Evans, D. Seidel, M. Rueping, H. W. Lam, J. T. Shaw, C. W. Downey, J. Am. Chem. Soc., 2003, 125, 12692-12693. Cloruro de cetiltrimetilamonio (CTACl) Nitroaldol Reaction in Aqueous Media: An Important Improvement of the Henry Reaction R. Ballini, G. Bosica, J. Org. Chem., 1997, 62, 425-427. SmI2 = yoduro de Samario A Convenient Samarium-Promoted Synthesis of Aliphatic (E)-Nitroalkenes under Mild Conditions J. M. Concellón, P. L. Bernad, H. Rodríguez-Solla, C. Concellón, J. Org. Chem., 2007, 72, 5421-5423. Ephedrine (EPH) is a sympathomimetic amine commonly used as a stimulant, appetite suppressant, concentration aid, decongestant, and to treat hypotension associated with anaesthesia. Ephedrine is similar in structure to the synthetic derivatives amphetamine and methamphetamine. Chemically, it is an alkaloid derived from various plants in the genus Ephedra (family Ephedraceae). It is most usually marketed in the hydrochloride and sulfate forms. NUCLEÓFILOS AMBIDIENTES Los aniones nitronato por si mismos pueden actuar como nucleófilos ambidientes que pueden actuar tanto por el C (nucleófilo suave) o por el O (nucleófilo fuerte). Estos centros reaccionarán con electrofilos (suaves o duros, respectivamente). REACCIÓN DE MICHAEL Adición de Michael La adición de Michael es una adición conjugada al doble enlace de un centro ácido suave de un éster, siendo el grupo carbonilo el centro ácido duro Arthur Michael, nació en Buffalo, New York Ionic Liquid as Catalyst and Reaction Medium. The Dramatic Influence of a Task-Specific Ionic Liquid, [bmIm]OH, in Michael Addition of Active Methylene Compounds to Conjugated Ketones, Carboxylic Esters, and Nitriles B. C. Ranu, S. Banerjee, Org. Lett., 2005, 7, 30493052. REACCIÓN DE NEF John Ulric Nef (Johann Ulrich Nef) nacio en suiza y sus padres emigraron a norteamerica. Descubrío la reacción de Nef John Ulric Nef 1862-1915 REACCIÓN DE NEF REACCIÓN DE MICHAEL REACCIÓN DE NEF O O OCH3 NO2 CH3 N CH3 CH3 OCH3 NO2 85 % 1) NaOH, H2O o 2) H2SO4, H2O, 5 C HO O OCH3 O 65 % REACCIÓN DE NEF Este comportamiento, ambivalente se puede ver en la reacción Nef REACCIÓN DE NEF Cu-Catalyzed Enantioselective Conjugate Addition of Alkylzincs to Cyclic Nitroalkenes: Catalytic Asymmetric Synthesis of Cyclic α-Substituted Ketones C. A. Luchaco-Cullis, A. H. Hoveyda, J. Am. Chem. Soc., 2002, 124, 8192-8193. REACCIÓN DE NEF Cu-Catalyzed Enantioselective Conjugate Addition of Alkylzincs to Cyclic Nitroalkenes: Catalytic Asymmetric Synthesis of Cyclic α-Substituted Ketones C. A. Luchaco-Cullis, A. H. Hoveyda, J. Am. Chem. Soc., 2002, 124, 8192-8193. REACCIÓN DE NEF Simple Conversion of Nitro Group Into Carbonyl Group Synthetic Communications, 1998, 28(16), 3057-3064. Paolo Ceccherelli,† Massimo Curini, Maria Carla Marcotullio, * Francesco Epifano and Ornelio Rosati NO2 KSO5H O CH3OH Na2HPO4 NaOH (1N) 25 o C, 1h O O 75 % Sustrato Producto Rendimiento (%) Nitrociclohexano (15) Ciclohexanona (9) 81 5-Nitro-2-hexanona (26) 2,5-hexanodiona (12a) 75 Etilencetal de la 5-Nitro-2hexanona (37) Mono-etilidencetal de la 2,5hexanodiona (137) 87 5-Nitro-2-hexanol (48) Materia prima 5-acetoxi-2-nitrohexano (5) 5-acetoxi-2-hexanona (14) 93 5-Nitro-2-hexanol TBDMS éter (6) 5-hidroxi-2-hexanona TBDMS éter (15) 88 3-(1-Nitroetil)-ciclohexanol (79) 3-Acetilciclohexanol (16) 85 1-Nitrohexano (85) Ácido hexanoíco (17a) 98 4-Nitro-2-butanol (910) Ácido 3-Hidroxibutírico (1812) 70 Fenilnitrometano (1011) Ácido benzoíco (19a) 91 a Los productos de la reacción se caracterizaron por comparación con una muestra auténtica (espectros de IR, RMN-1H y por datos de GC-MS). b Rendimiento del producto aislado. REACCIÓN DE NEF REACCIÓN CON OXONO EFECTO α DEL HETEROÁTOMO ORBITAL LUMO DE LA MOLÉCULA ACEPTORA ORBITAL HOMO DE MÁS ALTA ENERGÍA H O O o o REACCIÓN DE NEF MECANISMO DE LA OXIDACIÓN DE UN ALDEHÍDO CON OXONO O O O O S O H O O H H K O H O H H H O H O O O S O O H O O O S O O K K O H REACCIÓN REDOX O + OH O H O O K O H H Unprecedented, selective Nef reaction of secondary nitroalkanes promoted by DBU under basic homogeneous conditions R. Ballini, G. Bosica, D. Fiorini, M. Petrini, Tetrahedron Lett., 2002, 43, 5233-5235 REACCIÓN DE NEF A New Method for the Conversion of Nitro Groups into Carbonyls JOHN E. McMURRY AND JACK MELTON, J . Org. Chem., 1973, Vol. 38, [66], 4367-4373. REACCIÓN DE NEF REACCIÓN CON TICl3, RUPTURA EDUCTIVA El método reductivo permite obtener oximas, las cuales pueden hidrolizadas a los compuestos carbonílicos correspondientes. El titanio (III) permite reducir el enlace N-O, ya que el titanio muestra una fuerte afinidad hacia el oxígeno, lo cual facilita la hidrólisis completa para que ocurra la conversión REACCIÓN REDOX. FORMACIÓN DE LA OXIMA H H H N O O O H N O O Cl Ti Cl Cl H O (III) Cl N Ti O Cl TiCl3 + Cl H N O O (III) H N O + O TiCl3 H O H H N O (IV) + HO TiCl3 H Ti Cl H Cl (III) Ti Cl Cl TiCl3 O (III) Cl N Ti + TiCl4 O Cl REACCIÓN DE HIDRÓLISIS DE LA OXIMA H H O H H N + H O H O H N O H H O H + H O H + H N O H H N O H H O H H O H H H O H H N O H O-ALQUILACIÓN DE UN ANIÓN NITRONATO CON EL REACTIVO DE MEERWEIN Hans Meerwein alrededor de sus estudiantes, debajo de los doctores Graeb, Bieker, Müller, Haffner, Gies, von Rinteln y otros. La fotografía proviene de la herencia del famoso químico. Hans Meerwein (Mayo 20, 1879, Hamburgo, Alemania – Octubre 24, 1965, Marburgo, Alemania) Et2O·BF3 + 2 Et2O + 3 C2H3(O)CH2Cl → 3 Et3O+BF4- + B[(OCH(CH2Cl)CH2OEt]3 La O-alquilación es posible con un agente alquilante duro como el reactivo de Meerwein que actúa como una fuente de Me+ CH3 H3C O R CH3 O C N O H BF4 ó H3C O O R O C N O CH3 H S F O La naturaleza ambidiente del grupo nitro hace que éste sea un reactivo muy versátil REDUCCIÓN Panorama General En principio la reducción de un grupo nitro debe de seguir los siguientes paso: La reducción de los grupos nitroso en general es más fácil de llevar a cabo, pero la ventaja de la reducción de los grupos nitro es que esta se puede llevar a cabo de diferentes maneras REDUCCIÓN REACCIÓN METAL / H+ Se pueden usar metales como Fe, Zn, Sn, los cuales en presencia de medio H+ permiten reducir el grupo –NO2 por una secuencia de dos reacciones: transferencia de un solo electrón (Single Electron Transfer, (SET))/protonación O N O Zn, HCl NH2 (80 %) NITRO O N O Zn NH4Cl NITRO O N O NITRO N OH H (70 %) BH3 THF N OH H (80 %) El mecanismo para la reacción Zn/H+ es: R N O NITROSO H Cl Zn R N O H Cl o R N O H (I) Zn Cl R N O H Zn Cl (II) H Cl R N O H H HIDROXILAMINA (II) + Zn Cl Cl o REDUCCIÓN MEDIO BÁSICO REDUCCIÓN MEDIO BÁSICO REDUCCIÓN MEDIO BÁSICO REDUCCIÓN MEDIO BÁSICO O N O Zn NaOH EtOH CALOR N N AZOBENCENO (84 A 86 %) REDUCCIÓN MEDIO BÁSICO MECANISMO: transferencia de un solo electrón (Single Electron Transfer, (SET) REDUCCIÓN MEDIO BÁSICO REDUCCIÓN MEDIO BÁSICO OH R N O + R N H NaOH H2O O R N N R AZOXI Zn, HCl CALOR R NH2 2e NaOH H2O 2e R N N R AZO Zn, HCl CALOR R NH2 NaOH H2O R N N R H H HIDRAZO Zn, HCl CALOR R NH2 HIDROGENACIÓN CATALÍTICA H2/Pd soportado en carbono Las reacciones de H2/Pd (o bien Pt) se puede utilizar para llevar a cabo una reacción en la que se transfiere heterogeneamente un H:- a la superficie del metal y de éste al grupo nitro Palladium-catalyzed reduction of aromatic nitro groups to amines can be accomplished in high yield, with wide functional group tolerance and short reaction times at r.t. using aqueous potassium fluoride and polymethylhydrosiloxane (PMHS) for aromatic nitro groups. Aliphatic nitro compounds are reduced to the corresponding hydroxylamines using triethylsilane instead of PMHS/KF. R. J. Rahaim, R. E. Maleczka (Jr.), Org. Lett., 2005, 7, 5087-5090. A microwave-assisted, palladium-catalyzed catalytic transfer hydrogenation of different homo- or heteronuclear organic compounds using formate salts as a hydrogen source was performed in ([bmim][PF6]. Essentially pure products could be isolated in moderate to excellent yields by simple liquid-liquid extraction. REACTIVOS CON AZUFRE (S) El bisulfuro de sodio (NaSH) o el polisulfuro de sodio (Na2Sx) o el sulfuro de amonio ((NH4)2S2) se pueden utilizar para reducir regioselectivamente un grupo nitro de otros presentes en la misma molécula y es posible que dicha reacción también proceda a través de reacciones SET: REACTIVOS CON AZUFRE (S) NH2 NO2 1) S8, NaOH NO2 NaOH 55 oC 2) HCl 3) NaOH NO2 (80 %) N. N. Zinin (1812-1880). Zinin. N. Ann. Chem. Pharm. 1842. 44. 283-287; 1844, 52, 361-362: 1853, 85,328-329. [H] O R N O R N O O N R N O + S O O N S S S S S + AMINA S S S S S S N O H H O O O N H O H O H S S S S O O N H R N H [H] H ALQUILHIDROXILAMINA NITROSO NITRO OH [H] S + S S S S S S S NITROSOBENCENO H O S S S S S S S + H O H S O H S O H H O S S S S S S S S O S S S S S S S O R N O NITRO [H] R N O NITROSO [H] OH R N H ALQUILHIDROXILAMINA [H] H R N H AMINA O R N O NITRO [H] R N O NITROSO [H] OH R N H ALQUILHIDROXILAMINA [H] H R N H AMINA O R N O [H] OH [H] R N O R N H ALQUILHIDROXILAMINA NITROSO NITRO O O S S S S O S O S S H O S S H O N H H R N H [H] H O S + O H + S AMINA S S S S S N H N-FENILHIDROXILAMINA O H N H N H H O H O H + O S + H O S S S S S S S ANILINA O H O O S S H O S S O S S S S O S O S S S H O S S H O S S HIDRUROS METÁLICOS Los reactivos como el LiAIH4 (pero no el NaBH4) pueden reducir al grupo nitro por la transferencia de un hidruro, H:-. El producto dependerá de la naturaleza del agente reductor, pero el punto final será una amina 4 LiH + AlCl3 → LiAlH4 + 3 LiCl Otra manera de obtener LAH Na + Al + 2 H2 → NaAlH4 Reacción de metatesis: NaAlH4 + LiCl → LiAlH4 + NaCl Problema: descomposición del LAH en presencia de agua LiAlH4 + 4 H2O LiOH + Al(OH)3 + 4 H2 Sin embargo: excelente agente reductor cetona aldehído éster epóxido ó luego Ácido carboxílico luego Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds1 Robert F. Nystrom, and Weldon G. Brown J. Am. Chem. Soc., 1948, 70 (11), 3738-3740 • DOI: 10.1021/ja01191a057 NITROCOMPUESTOS AROMÁTICOS NITROCOMPUESTOS ALIFÁTICOS 2 3 4 2 2 2 2 Trace Amine-Associated Receptor Agonists: Synthesis and Evaluation of Thyronamines and Related Analogues Matthew E. Hart, Katherine L. Suchland, Motonori Miyakawa, James R. Bunzow, David K. Grandy, and Thomas S. Scanlan J. Med. Chem. 2006, 49, 1101-1112 (a) (a) CH3NO2, NH4OAc, reflujo (b) (b) (i) LiAlH4, THF, reflujo; (ii) Boc2O, NaHCO3, THF/H2O. REACCIÓN DE SNA (MEISENHEIMER) REACCIÓN DE SNA (MEISENHEIMER) Jakob Meisenheimer (14 junio de 1876 – 2 diciembre de 1934). Químico alemán REACCIÓN DE SNA (MEISENHEIMER) INFLUENCIA DEL TIPO DE NUCLEÓFILO REACCIÓN DE SNA (MEISENHEIMER) X X O N Nu NO2 Nu + NO2 O X: INFLUENCIA DEL NUCLEÓFUGO N Nu NO2 O + X NO2 O Nu = H3C O I Cl 1.00 5.20 Br F Ph O O2N 3.40 3,100.00 0.88 2,590.00 Nu = H3C S REACCIÓN DE SNA (MEISENHEIMER) INFLUENCIA DEL GRUPO ELECTROATRACTOR REACCIÓN DE SNA VICARIA MIECZYSLAW MAKOSZA Y JERZY WINIARSKI EN 1987 Vicarious nucleophilic substitution of hydrogen. Mieczysław Mąkosza and Jerzy Winiarski; Acc. Chem. Res.; 1987; 20(8) pp 282 - 289 Synthesis of heterocyclic compounds via vicarious nucleophilic substitution of hydrogen Mieczysław Mąkosza; Pure & Appl. Chem., Vol. 69, No. 3, pp. 559-564, 1997 REACCIÓN DE SNA VICARIA REACCIÓN DE SNA VICARIA MECANISMO DE REACCIÓN NO2 + O S Ph NO2 nBu4N OH + nBu4N Ph Cl Cl Ph Cl nBu4N O S Ph Cl Cl Ph Ph O N NO2 O S OH Ph Ph Ph S O O O S Ph H Cl Ph O N O O H O S Ph HCl O N O para-Formylation of nitroarenes via vicarious nucleophilic substitution of hydrogen with tris(benzotriazol-1-yl)methane A. R. Katritzky, L. Xie, Tetrahedron Lett., 1996, 37, 347-350. Reaction of nitroarenes with tris(benzotriazol-1-yl)methyl anion followed by treatment with zinc bromide and hydrochloric acid yielded the corresponding pnitroarylaldehydes in good to excellent yields. 1,1,1-Trimethylhydrazinium Iodide: A Novel, Highly Reactive Reagent for Aromatic Amination via Vicarious Nucleophilic Substitution of Hydrogen P. F. Pagoria, A. R. Mitchell, R. D. Schmidt, J. Org. Chem., 1996, 61, 2934-2935. TMHI, that is easily prepared from 1,1-dimethylhydrazine, is a novel aminating reagent for vicarious nucleophilic substitution. It can be used to obtain isomers not produced by reaction with other nucleophilic aminating reagents. Mecanismo de reacción propuesto: Hydroxylation of Nitroarenes with Alkyl Hydroperoxide Anions via Vicarious Nucleophilic Substitution of Hydrogen M. Makosza, K. Sienkiewicz, J. Org. Chem., 1998, 63, 4199-4208. Nitroarenes react with anions of tert-butyl and cumyl hydroperoxides in the presence of strong bases to form substituted o- and p-nitrophenols. The reaction usually proceeds in high yields and is of practical value as a method of synthesis and manufacturing of nitrophenols. Mecanismo de reacción propuesto: ESPECTROSCOPÍA I.R. El alargamiento del enlace N=O se observa en señales a 1500‐1600 cm‐1, las cuales si se comparan con las del enlace C=O en 1650‐1800 cm‐1, se observa que el primer grupo esta muy desprotegido (polarizado) RMN – 1H Para un protón CH, adyacente a el grupo –NO2, se observa un desplazamiento químico δ = 4.3, debido al efecto electroatractor U.V . El grupo nitro da lugar a un desplazamiento pronunciado de la λ en la que se presenta la εmax hacia longitudes de onda más largas cuando está conjugado a sistemas insaturados π, el cual es un efecto batocrómico. Esta es la causa por la que los nitro compuestos con frecuencia son de color amarillo