O 2 + O
Anuncio

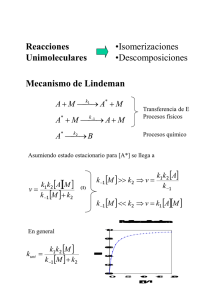
Tema 6 Cinética de las reacciones químicas Tema 6.-Cinética de las reacciones químicas • 6.1.-Cinética formal: repaso de definiciones básicas • 6.2.-Reacciones complejas: reversibles, consecutivas y paralelas • 6.-3.-Reacciones en cadena lineal y ramificada. Introducción a la fotoquímica • 6.4.-Variación de la constante de velocidad con la temperatura. Relación del factor de frecuencias con la TCG. • 6.5.-Métodos instrumentales de medida de las velocidades de reacción • 6.6.-Introducción a la Cinética Molecular • 6.7.-Catálisis homogénea y heterogénea 6.1.-Cinética formal: repaso de definiciones básicas • Ecuaciones diferenciales de velocidad. • Ordenes de reacción parcial y total. • Constante de velocidad de una reacción química. Tiempo de vida medio • Ecuaciones integradas de velocidad • Mecanismos de reacción. Una reacción no simple: formación de HBr Ejemplos de reacciones químicas y órdenes experimentales de reacción • Reacción • Orden • • • • • • • • • • • • • • Hidrólisis de la sacarosa Dimerización de la 2-proflavina Hb·3 O2 + O2 Hb·4 O2 H2 + I2 2 HI H2 + Br2 2 HBr CH3CHO CH4 +CO CH3CH2OH enzimas hepáticas CH3CHO 1 2 2 (global) 2 Compleja 3/2 • 0 Mecanismos de reacción. Una reacción no simple: formación de HBr • H2 + Br2 2 HBr • La ley experimental es: (1) Mecanismos de reacción. Una reacción no simple: formación de HBr Mecanismos de reacción. Una reacción no simple: formación de HBr Centramos nuestra atención en los radicales formados: La parte entre llaves es 0 según la ecuación anterior con lo que: Y, por tanto: O bien: Mecanismos de reacción. Una reacción no simple: formación de HBr Recombinando ambas ecuaciones se obtiene que: que coincide con la ecuación empírica de velocidad sin mas que hacer las identificaciones: 6.2.-Reacciones complejas: reversibles, consecutivas y paralelas 6.2.1.-Reacciones reversibles de primer orden en ambos sentidos de la reacción. 6.2.1.-Reacciones reversibles de primer orden en ambos sentidos de la reacción. 6.2.2.-Reacciones paralelas: control cinético del rendimiento de una reacción 6.2.3.-Reacciones consecutivas. Período de inducción e hipótesis del estado estacionario. 6.2.3.-Reacciones consecutivas. Período de inducción e hipótesis del estado estacionario. 6.2.3.-Reacciones consecutivas. Período de inducción e hipótesis del estado estacionario. 6.2.3.-Reacciones consecutivas. Período de inducción e hipótesis del estado estacionario. Una combinación de reacciones reversibles y consecutivas • Reacción de descomposición del ozono en la alta atmósfera • O3 O2 + O • O2+ O O3 • O3+ O 2 O2 6.-3.-Reacciones en cadena lineal y ramificada. Introducción a la fotoquímica • 6.3.1.-Reacciones en cadena lineal • Ejemplos: • Reacción de formación del HBr • Reacciones de polimerización por radicales libres 6.3.2.-Reacciones en cadena ramificada • Imposibilidad de aplicar la hipótesis del estado estacionario • Teoría de Semionov • Explosiones térmicas y explosiones isotermas 6.3.3.-Introducción a la fotoquímica • Definición del campo de la Fotoquímica y de la Radioquímica • Rendimiento cuántico de una reacción. Leyes básicas de la fotoquímica • Ejemplos de algunas reacciones fotoquímicas • Posibles caminos reactivos y no reactivos de una molécula excitada. Algunos rendimientos cuánticos representativos • • • • • • NH3 N2 +H2 =0.2 2HCl =105 H2+ Cl2 H2O+ CO2 =10-1 (CH2O)x +O2 Rhodopsina retinal+opsina =1 (en los ojos de los mamíferos) • Hemoglobina·CO • Hemoglobina·O2 Hemoglobina + CO Hemoglobina + O2 =1 =10-2 6.4.-Variación de la constante de velocidad con la temperatura. Relación del factor de frecuencias con la TCG. • Ley de Arrhenius: Energía de activación y factor de frecuencia. • La ley de Arrhenius y la TCG. • Ley de Arrhenius y fenómenos de transporte: reacciones controladas por difusión. 6.5.-Métodos instrumentales de medida de las velocidades de reacción • Fundamento de los métodos de relajación • Métodos espectroscópicos: Espectroscopía de absorción y de emisión. Fundamento de los métodos de fluorescencia. • Espectroscopias de resonancia • Espectroscopía de femtosegundo 6.6.-Introducción a la Cinética Molecular • Descripción cuántica de una reacción simple: H + H2 H2 + H • Naturaleza del estado de transición. Tratamiento termodinámico del estado de transición. • Concepto de sección eficaz • Métodos experimentales en Cinética Molecular 6.7.-Catálisis homogénea y heterogénea • Fundamento del fenómeno de la catálisis • Catálisis y energía libre • Catálisis homogénea. Reacciones lineales de energías libres • Catálisis heterogénea. Pasos en una catálisis heterogénea. Centros activos en una superficie ¿Qué debo saber ahora? • • • • • • • • • • Escribir la ecuación de velocidad diferencial en una reacción, conocido el mecanismo de reacción Conocer la expresión integrada de velocidad en los casos mas sencillos Conocer los principales tipos de reacciones complejas. Entender la hipótesis del estado estacionario Entender los principales mecanismos de reacción mediante radicales libres. Conocer el alcance de la fotoquímica y el concepto de rendimiento cuántico de una reacción. Conocer los principales métodos experimentales para estudiar reacciones rápidas Entender la base molecular de la ley de Arrhenius Comprender los resultados esenciales en la teoría del estado de transición Distinguir entre los diferentes tipos de catálisis y comprender su base termodinámica