Clase_cinética 3
Anuncio
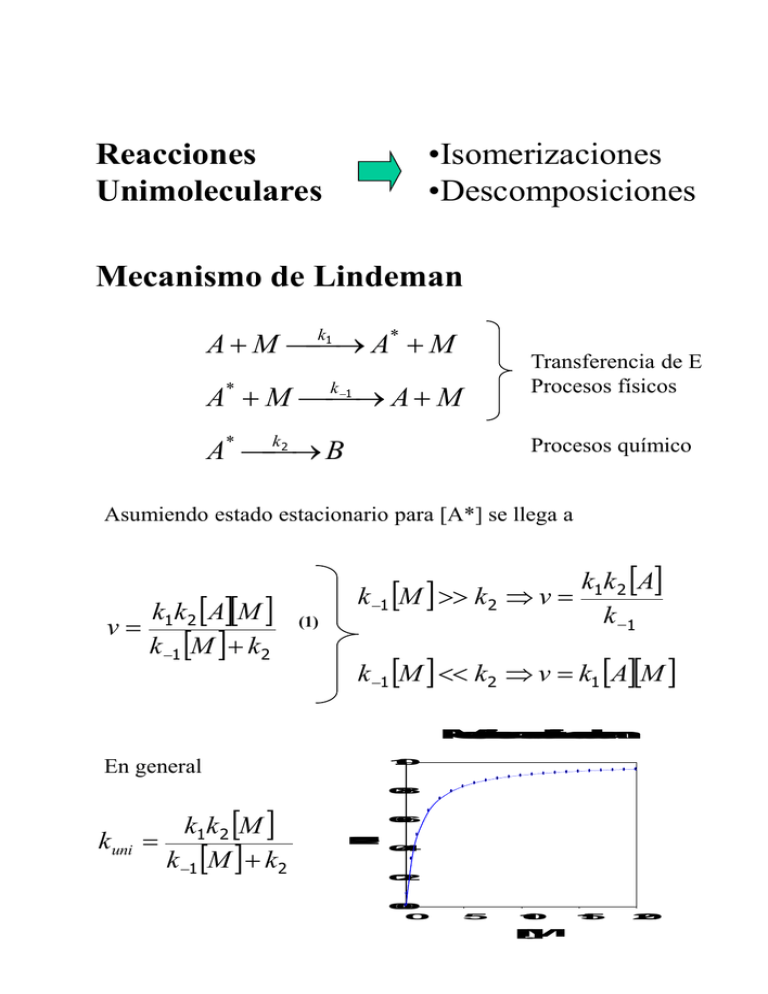
•Isomerizaciones •Descomposiciones Reacciones Unimoleculares Mecanismo de Lindeman k1 A M A* M k 1 A* M A M k2 A* B Transferencia de E Procesos físicos Procesos químico Asumiendo estado estacionario para [A*] se llega a v k1 k2 AM k 1 M k2 k 1 M k2 v (1) k1 k2 A k 1 k 1 M k2 v k1 AM M e c a n i s m o d e L i n d e m a n En general 1 . 0 0 . 8 0 . 6 kuni kuni k k M 1 2 k 1 M k2 0 . 4 0 . 2 0 . 0 0 5 1 0 [ M ] 1 5 2 0 Mecanismo de Michaelis-Menten E S ES E P (2) Asumiendo estado estacionario para [ES] se llega a v d [ P] k1 k2 E S dt k 1 k2 (3) ...pero se busca una expresión en función de [E]0=[E]+[ES] v k cat E 0 1 K M S (4) k cat k2 Nro. de intercambi o KM k 1 k2 Cte. de Michaelis k1 M e c a n i s m o d e M i c h a e l i s M e n t e n L v k cat E 0 vmax k E L v cat 0 S S 0 KM vS K M vmax 2 v m a x 0 . 4 0 . 3 0 , 5 v m a x d[P]/t S 0 . 5 0 . 2 0 . 1 0 . 0 K M 0 1 0 2 0 [ S ] 3 0 Linearización de la ec de M-M k v v cat S E 0 K M K M E 0 (5) v S E 0 k cat KM m 1 KM v k cat E 0 Inhibición E S ES E P E I EI (7) (6) k cat E 0 v KS I 1 1 S K I Inhibición no competitiva Activación Competitiva Reacciones en cadena •Combustiones •Explosiones •Polimerizaciones Ej: Br2 + H2 2HBr Br2 M 2 Br M iniciación /terminaci ón Br H 2 HBr H propagación H Br HBr Br H y Br son portadores de cadena d HBr v2 v 2 v3 dt Asumiendo estado estacionario para [ H ] y [ Br ] d H v2 v 2 v3 0 dt d Br 2v1 2v1 v2 v2 v3 0 dt Cadena ramificada. Ej: 2H2+O2 2H2O H O2 OH O ramificaci ón O H 2 OH H


