El hıgado graso y el sındrome metabo´ lico
Anuncio

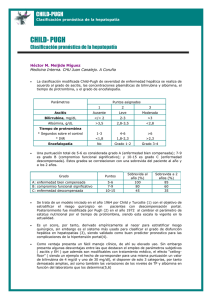
Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Med Clin (Barc). 2013;141(6):252–253 www.elsevier.es/medicinaclinica Editorial El hı́gado graso y el sı́ndrome metabólico Fatty liver and metabolic syndrome Jordi Tor * y Roberto Muga Servicio de Medicina Interna, Hospital Universitari Germans Trias i Pujol, Universitat Autònoma de Barcelona, Badalona, Barcelona, España El hı́gado graso no alcohólico (HGNA) se define como el acúmulo de vesı́culas de grasa en más del 5% de los hepatocitos en individuos que reconocen un consumo de alcohol inferior a los 20 g/dı́a para la mujer, y a 30 g/dı́a para el hombre, y sin otras causas evidentes de enfermedad hepática crónica1,2. El espectro de la enfermedad incluye varios trastornos relacionados, desde la esteatosis hepática simple y a menudo autolimitada hasta la esteatohepatitis no alcohólica (EHNA), una entidad patológica que entraña mayor gravedad y se asocia a un incremento del riesgo de desarrollar distintos grados de inflamación, fibrosis hepática y hepatocarcinoma3.En general, y a pesar de los datos acumulados en los últimos años, aunque se acepta ampliamente la carga epidemiológica de la enfermedad, aún se discute sobre su gravedad, probablemente debido a que ha sido considerada históricamente y de forma errónea como una entidad benigna. En biopsias hepáticas realizadas como cribado a donantes potenciales de hı́gado aparentemente sanos, se ha encontrado una prevalencia de HGNA del 51%4, o un 20% de los casos con un grado de esteatosis superior al 30%5. Además, en el 66% de los pacientes con HGNA se encuentran lesiones mı́nimas de fibrosis en el momento del diagnóstico histológico1, mientras que los puentes de fibrosis se observan en 25-33% de los pacientes con EHNA, incluyendo cirrosis en el 10-15%6. Desde el punto de vista histológico, el HGNA y la EHNA son indistinguibles de la hepatopatı́a asociada al consumo de alcohol, incluyendo la infiltración de células inflamatorias de predominio centrolobulillar, la balonización de los hepatocitos con presencia de hialina de Mallory en su interior y de acúmulo de gránulos de glucógeno, con áreas de necrosis y presencia de fibrosis más o menos extensa en el caso de enfermedad avanzada7. Desde un punto de vista patogénico, puede definirse como una enfermedad metabólica adquirida que resulta del depósito de triglicéridos dentro de los hepatocitos, la lesión precursora necesaria para la aparición de inflamación y luego fibrosis. En esta evolución, se han implicado mecanismos como la insulinorresistencia e hiperinsulinemia, la formación de radicales libres del oxı́geno a partir de la peroxidación de la grasa, y la liberación de Véase contenido relacionado en DOI: http://dx.doi.org/10.1016/j.medcli.2012.11.034 * Autor para correspondencia. Correo electrónico: [email protected] (J. Tor). determinadas citocinas proinflamatorias8–10. Fisiopatológicamente, el espectro del HGNA y la EHNA mantienen una vı́a final común que comparte múltiples causas de estrés metabólico hepático, incluida la obesidad, factores metabólicos, nutricionales, raciales y genéticos, el consumo de alcohol o de ciertos fármacos, infecciones crónicas por el virus de la hepatitis C o el VIH, el estı́mulo de endotoxinas bacterianas producidas en el intestino, o el efecto regulador sobre el metabolismo del huésped que ejerce la flora microbiana o microbiota intestinal8,11,12. La inflamación es un elemento común en la patogenia de la mayorı́a de las enfermedades hepáticas crónicas, que conduce a la fibrosis y la cirrosis. Dicho proceso se caracteriza por la activación de células inmunes innatas y la producción de citocinas proinflamatorias IL-1a, IL-1b y TNF-a, relacionado todo ello con la activación de determinados complejos intracelulares multiproteicos, denominados inflamasomas por algunos autores10, y la aparición de distintos grados de esteatosis, inflamación y fibrosis. Estos factores son capaces de ocasionar un mismo efecto sindrómico en forma de esteatosis hepática y/o esteatohepatitis13,14, de manera que un enfoque más general de la esteatosis hepática como un trastorno multicausal puede optimizar las estrategias de prevención y ayudar a tratar a los pacientes con mayor eficacia en el plano individual15. No es sencillo conocer la prevalencia de estas alteraciones en la población general. Una buena aproximación la constituyen estudios realizados en el ámbito de la medicina primaria, como es el caso del trabajo de Caballerı́a et al.16 que presentan en este número de la revista, y que aporta información complementaria a la de las series de origen hospitalario o de dispositivos muy especializados. Ejemplos de ello también se han descrito en otros entornos de atención primaria17 y en grupos de población aparentemente sanos18–20. La prevalencia de HGNA en la población general en los paı́ses occidentales evaluada por medio de ecografı́a se calcula entre el 25 y el 30%, y la prevalencia máxima de hasta un 76% o más se ha observado en individuos obesos, demostrándose, además, que la esteatosis está más fuertemente asociada con la obesidad que con el hecho de beber en deması́a, lo que sugiere un papel más importante del exceso de peso que del consumo de alcohol en la inducción de la acumulación de grasa en el hı́gado19,20. En un estudio reciente17 realizado con la intención de averiguar las causas de la elevación no explicada de las pruebas de 0025-7753/$ – see front matter ß 2013 Elsevier España, S.L. Todos los derechos reservados. http://dx.doi.org/10.1016/j.medcli.2013.02.013 Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. J. Tor, R. Muga / Med Clin (Barc). 2013;141(6):252–253 funcionalismo hepático, se llegó a un diagnóstico en el 55% de los casos, y la EHNA fue la causa más frecuente de las conocidas (26%), antes que el uso excesivo del alcohol (25%) y a mucha distancia de todas las causas clásicas de enfermedad hepática (infección por virus de la hepatitis B o C, hemocromatosis, cirrosis biliar primaria, déficit de alfa-1-antitripsina), que representan menos del 1% de los casos cada una. Por lo tanto, el HGNA es hoy en dı́a el principal actor en hepatologı́a. También se ha demostrado que la EHNA es la causa más frecuente de fibrosis y cirrosis en pacientes con elevación de transaminasas de origen no aclarado21. Otro aspecto a destacar es la frecuencia de la asociación del hı́gado graso con la epidemia de obesidad y sedentarismo que caracteriza la era actual. En el presente número Caballerı́a et al., en su estudio de casos y controles16, confirman la presencia de una clara asociación independiente entre el HGNA evaluado por medio de ecografı́a y las manifestaciones fenotı́picas más frecuentes de los HGNA/EHNA primarios: el sobrepeso, la obesidad, el sı́ndrome metabólico (SM), la resistencia a la insulina y unos valores elevados de la alaninoaminotransferasa y la gammaglutamiltranspeptidasa. Cuando en el análisis multivariado incluyeron los diferentes componentes que conforman el SM, la hiperglucemia y el aumento de los triglicéridos se comportaron como las variables independientes del SM asociadas a la presencia de HGNA. Es conocido, y en ello insisten de forma acertada Caballerı́a et al. en su trabajo16, que el HGNA clásico comparte los mismos criterios que el SM (obesidad, hiperglucemia, dislipidemia e hipertensión arterial) y en la actualidad el HGNA se considera el componente hepático del SM22. Por ello, en ambas situaciones existen múltiples factores de riesgo cardiovascular23, y de hecho la enfermedad hepática es solo la tercera causa de muerte entre individuos con HGNA, después de las enfermedades cardiovasculares y las neoplasias24. En definitiva, el HGNA es la causa más frecuente de la elevación de enzimas hepáticas y, en el espectro de la misma, la EHNA indica la progresión hacia la cirrosis hepática y el carcinoma hepatocelular. Asociado a la obesidad y al SM, la prevalencia y el impacto sanitario del complejo HGNA/EHNA continúa aumentando, proyectándose como la causa más frecuente de hepatopatı́a avanzada en las próximas décadas y una relevante causa de muerte cardiovascular y hepática. Bibliografı́a 1. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: A proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94:2467–74. 2. Ratziu V, Bellantani S, Cortez-Pinto H, Day C, Marchesini G. A position statement on NAFLD/NASH based on the EASL 2009 special conference. J Hepatol. 2010;53: 372–84. 253 3. Ong JP, Younossi ZM. Epidemiology and natural history of NAFLD and NASH. Clin Liver Dis. 2007;11:1–16. 4. Lee JY, Kim KM, Lee SG, Yu E, Lim YS, Lee HC, et al. Prevalence and risk factors of non-alcoholic fatty liver disease in potential living liver donors in Korea: A review of 589 consecutive liver biopsies in a single center. J Hepatol. 2007;47: 239–44. 5. Marcos A, Fisher RA, Ham JM, Olzinski AT, Shiffman ML, Sanyal AJ, et al. Selection and outcome of living donors for adult to adult right lobe transplantation. Transplantation. 2000;69:2410–5. 6. Argo CK, Caldwell SH. Epidemiology and natural history of non-alcoholic steatohepatitis. Clin Liver Dis. 2009;13:511–31. 7. Brunt EM. Histopathology of non-alcoholic fatty liver disease. Clin Liver Dis. 2009;13:533–44. 8. Matherly SC, Puri P. Mechanism of simple hepatic steatosis: Not so simple after all. Clin Liver Dis. 2012;16:505–24. 9. Bohinc BN, Diehl AM. Mechanisms of disease progression in NASH: New paradigms. Clin Liver Dis. 2012;16:549–65. 10. Szabo G, Csak T. Inflammasomes in liver diseases. J Hepatol. 2012;57: 642–54. 11. Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718–23. 12. Greiner T, Bäckhed F. Effects of the gut microbiota on obesity and glucose homeostasis. Trends Endocrinol Metab. 2011;22:117–23. 13. Vernon G, Baranova A, Younossi ZM. Systematic review: The epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011;34:274–85. 14. Szabo G, Zakhari S. Mechanisms of alcohol-mediated hepatotoxicity in humanimmunodeficiency-virus-infected patients. Word J Gastroenterol. 2011;17: 2500–6. 15. Völzke H. Multicausality in fatty liver disease: Is there a rationale to distinguish between alcoholic and non-alcoholic origin? World J Gastroenterol. 2012;18: 3492–501. 16. Caballerı́a L, Arteaga I, Pera G, Rodrı́guez L, Alumà A, Auladell MA, et al. Factores de riesgo asociados a la presencia de hı́gado graso no alcohólico: un estudio de casos y controles. Med Clin (Barc). 2013;141:233–9. 17. Armstrong MJ, Houlihan DD, Bentham L, Shaw JC, Cramb R, Olliff S, et al. Presence and severity of non-alcoholic fatty liver disease in a large prospective primary care cohort. J Hepatol. 2012;56:234–40. 18. Hamaguchi M, Kojima T, Takeda N, Nakagawa T, Taniguchi H, Fujii K, et al. The metabolic syndrome as a predictor of nonalcoholic fatty liver disease. Ann Intern Med. 2005;143:722–8. 19. Bedogni G, Miglioli L, Masutti F, Tiribelli C, Marchesini G, Bellentani S. Prevalence of and risk factors for nonalcoholic fatty liver disease: The Dionysos nutrition and liver study. Hepatology. 2005;42:44–52. 20. Pares A, Tresserras R, Núñez I, Cerralbo M, Plana P, Pujol FJ, et al. Prevalencia y factores asociados a la presencia de hı́gado graso en varones adultos aparentemente sanos. Med Clin (Barc). 2000;114:561–5. 21. De Lédinghen V, Ratziu V, Causse X, Le Bail B, Capron D, Renou C, et al.; Association Française pour l’Etude du Foie Groupe Epidémiologie et Evaluation; Association Nationale des Gastroentérologues des Hôpitaux généraux de France. Diagnostic and predictive factors of significant liver fibrosis and minimal lesions in patients with persistent unexplained elevated transaminases. A prospective multicenter study. J Hepatol. 2006;45:592–9. 22. Fabbrini E, Sullivan S, Klein S. Obesity and nonalcoholic fatty liver disease: Biochemical, metabolic, and clinical implication. Hepatology. 2010;51: 679–89. 23. Targher G, Day CP, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010;363:1341–50. 24. Ong JP, Pitts A, Younossi ZM. Increased overall mortality and liver-related mortality in non-alcoholic fatty liver disease. J Hepatol. 2008;49:608–12.