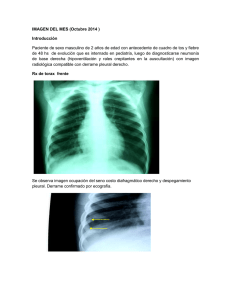
traumatologia torácica y determinación de presión intrapleural en
Anuncio

TRAUMATOLOGIA TORÁCICA Y DETERMINACIÓN DE PRESIÓN INTRAPLEURAL EN CANINOS RESIDENTES EN LA CIUDAD DE BOGOTÁCOLOMBIA ANDREA VIVIANA SOLANO ALVARADO MARÍA ALEXANDRA ARCHILA BELTRÁN UNIVERSIDAD DE LA SALLE FACULTAD DE MEDICINA VETERINARIA BOGOTÁ, D.C. 2006 TRAUMATOLOGIA TORÁCICA Y DETERMINACIÓN DE PRESIÓN INTRAPLEURAL EN CANINOS RESIDENTES EN LA CIUDAD DE BOGOTÁCOLOMBIA ANDREA VIVIANA SOLANO ALVARADO Cód. 14991110 MARÍA ALEXANDRA ARCHILA BELTRÁN Cód 14992014 Trabajo de grado para optar al título de Médico Veterinario Director DR. ÉDGAR GUTIÉRREZ VÉLEZ M.V. MSC. UNIVERSIDAD DE LA SALLE FACULTAD DE MEDICINA VETERINARIA BOGOTÁ, D.C. 2006 DIRECTIVOS RECTOR VICERRECTOR ACADÉMICO VICERRECTOR DE PROMOCIÓN Y Hno. Fabio Gallego Arias Hno. Carlos Gabriel Gomez Restrepo Hno. Edgar Figueroa Abrajím DESARROLLO HUMANO VICERRECTOR ADMINISTRATIVO Dr. Mauricio Fernández Fernández DECANO DE LA FACULTAD Dr. Pedro Pablo Martínez Méndez SECRETARIO ACADEMICO Dra. María Teresa Uribe Mallarino DIRECTOR DE LA CLÍNICA VETERINARIA Dr. Humberto Vásquez Romero ACEPTACIÓN DIRECTOR _______________________________ Dr. Edgar Gutierrez Velez JURADO _______________________________ Dra. Marta Elena Sanchez Klinge JURADO _______________________________ Dr. Mauricio Ortega Tamayo SECRETARIA ACADEMICA _______________________________ Dra. María Teresa Uribe Mallarino DEDICATORIA Este trabajo lo dedico a mis padres Ciro Alberto Solano y Amalia Alvarado, que con su ejemplo y dedicación me impulsaron a salir adelante y a esforzarme en todos los proyectos presentes y futuros. Andrea Viviana Solano A. Este trabajo está dedicado a mis padres, Aristóbulo Archila y Georgina Beltrán, motivadores constantes en el desarrollo de mi aprendizaje y a quienes debo mis logros personales y profesionales, A Cesar Iván Vargas quien me apoyo y estuvo a mi lado en todo el desarrollo de la carrera. Maria Alexandra Archila B. AGRADECIMIENTOS Las autoras expresan sus agradecimientos a: La Universidad de la Salle por permitirnos utilizar sus instalaciones y recursos para el desarrollo de la práctica. Dr. Edgar Gutiérrez Vélez, Medico Veterinario y Director de la investigación, por sus valiosas orientaciones. Dr. Humberto Vásquez Romero, Medico Veterinario y director de la clínica de pequeños animales de la Universidad de la Salle Dr. Germán Rodríguez, Medico Veterinario y docente de la facultad de Medicina Veterinaria, por su constante motivación en la elavoración este trabajo. COMPROMISO El presente trabajo de investigación no contiene ideas que de una u otra forma, sean contrarias a la Iglesia Católica, en cuanto a su doctrina, dogma y moral. Las Ideas aquí expuestas por los graduados no son responsabilidad ni de director del proyecto de investigación, ni de los jurados o la Universidad de la Salle. TABLA DE CONTENIDO Pág. INTRODUCCION………………………………………………………………………… 20 1. OBJETIVOS………………………………………………………………………….. 22 1.1 OBJETIVO GENERAL……………………………………………………………… 22 1.2 OBJETIVOS ESPECÍFICOS………………………………………………………. 22 2. MARCO TEÓRICO………………………………………………………………….. 23 2.1 TRAUMATISMO TORÁCICO……………………………………………………… 23 2.1.1 Anatomía de la Cavidad Torácica………………………………………………. 23 2.1.1.1 Tórax…………………………………………………………………………….. 24 2.1.1.2 Costillas y esternón…………………………………………………………..... 24 2.1.1.3 Músculos torácicos…………………………………………………………….. 25 2.1.1.4 Órganos respiratorios intratorácicos…………………………………………. 25 2.1.1.4.1 Tráquea……………………………………………………………………….. 25 2.1.1.4.2 Pleura y Fascia endotoráxica………………………………………………. 26 2.1.1.4.3 Árbol bronquial……………………………………………………………….. 26 2.1.1.4.4 Pulmones……………………………………………………………………… 27 2.1.1.5 Órganos cardiovasculares intratorácicos…………………………………..... 27 2.1.1.5.1 Pericardio……………………………………………………………………… 27 2.1.1.5.2. Corazón………………………………………………………………………. 28 2.1.1.5.3 Vasos en conexión con el corazón ………………………………………. 29 2.1.2 Examen clínico orientado al trauma de tórax………………………………….. 30 2.1.2.1 Historia clínica………………………………………………………………….. 30 2.1.2.2 Examen físico (TORAX) ………………………………………………………. 31 2.1.2.2.1 Inspección del tórax………………………………………………………..... 32 2.1.2.2.2 Palpación del tórax…………………………………………………………… 33 2.1.2.2.3 Percusión del tórax…………………………………………………………... 35 2.1.2.2.4 Auscultación del tórax……………………………………………………….. 38 2.1.3 Principales afecciones torácicas……………………………………………….. 45 2.1.3.1 Contusión torácica……………………………………………………………… 45 2.1.3.2 Contusiones pulmonares……………………………………………………… 45 2.1.3.3 Lesión miocárdica secundario a trauma torácico directo ………………..... 52 2.1.3.4 Neumotórax…………………………………………………………………….. 54 2.1.3.5 Hemotórax………………………………………………………………………. 57 2.1.3.6 Piotórax………………………………………………………………………….. 59 2.1.3.7 Quilotórax……………………………………………………………………….. 61 2.1.3.8 Efusión pleural………………………………………………………………….. 67 2.1.3.9 Fracturas de costillas y del tórax flotante……………………………………. 68 2.1.3.10 Hernia diafragmática………………………………………………………..... 70 2.1.3.11 Hernia diafragmática peritoneopericardica………………………………… 73 2.1.3.12 Frenoplejia…………………………………………………………………….. 73 2.1.3.13 Hemomediastino……………………………………………………………… 74 2.1.3.14 Edema mediastínico………………………………………………………….. 74 2.1.3.15 Mediastinitis…………………………………………………………………… 74 2.1.3.16 Neumomediastino…………………………………………………………….. 75 2.1.3.17 Ruptura aórtica………………………………………………………………... 75 2.1.3.18 Trauma toráxico romo……………………………………………………….. 75 2.1.3.19 Traumas Internos pulmonares ocasionados por inhalación o aspiración de materiales nocivos…………………………………………… 76 2.1.3.20 Traumatismo perforante……………………………………………………… 79 2.1.4 Signos y diagnostico en trauma torácico…………………………………..... 79 2.1.4.1 Signos que prevalecen en traumatismos torácicos……………………… 79 2.1.4.2 Diagnostico en traumatología torácica…………………………………….. 83 2.1.4.2.1 Radiografías del tórax………………………………………………………. 84 2.1.4.2.2 Ultrasonografía………………………………………………………………. 86 2.1.4.2.3 Toracocentesis………………………………………………………………. 88 2.1.4.2.4 Muestras sanguíneas……………………………………………………….. 93 2.1.4.2.5 Electrocardiografía (ECG)………………………………………………….. 112 2.1.4.2.6 Ecocardiografía……………………………………………………………… 113 2.1.4.2.7 Toracoscopia………………………………………………………………… 113 2.1.4.2.8 Biopsia a cielo abierto………………………………………………………. 114 2.1.4.2.9. Biopsias pleurales…………………………………………………………… 115 2.1.5 Tratamiento……………………………………………………………………..... 116 2.1.5.1 Método ABC……………………………………………………………………. 118 2.1.5.1.1 Vía aérea……………………………………………………………………… 118 2.1.5.1.2 Circulación…………………………………………………………………..... 121 2.1.5.1.3 Respiración (espontánea o asistida) y oxigenoterapia…………………... 123 2.1.5.2 Inspección secundaria post resucitación y estabilización………………… 132 2.1.5.3 Tratamiento quirúrgico………………………………………………………… 133 2.1.5.3.1 Tipos de abordajes…………………………………………………………… 133 2.1.5.3.2 Instrumental especial………………………………………………………… 134 2.1.5.3.3 Técnica………………………………………………………………………… 135 2.1.5.3.4 Cuidados post- quirúrgicos………………………………………………..... 136 2.1.5.3.5 Complicaciones………………………………………………………………. 136 2.1.5.4 Farmacoterapia utilizada en eventos de emergencia respiratoria………… 137 2.1.5.4.1 Manejo de emergencia para el distress respiratorio……………………… 137 2.1.5.4.2 Obstrucción de las vías respiratorias………………………………………. 137 2.1.5.4.3 Trauma………………………………………………………………………… 138 2.1.5.4.4 Neumonía…………………………………………………………………….. 139 2.1.5.4.5 Lesión pulmonar aguda y síndrome de distress respiratorio Agudo…… 140 2.1.5.4.6 Tromboembolismo pulmonar……………………………………………….. 140 2.1.5.4.7 Edema pulmonar…………………………………………………………….. 142 2.2 PRESIÓN INTRAPLEURAL (PIP)………………………………………………… 144 2.2.1 Anatomia pleural y fascia endotorácica………………………………………… 144 2.2.2 Presión y volumen en el ciclo respiratorio…………………………………….. 150 2.2.2.1 Presión pulmonar……………………………………………………………..... 150 2.2.2.2 Presión intrapleural…………………………………………………………….. 150 2.2.3 Historia…………………………………………………………………………….. 153 2.2.4 Medición de la presión intrapleural……………………………………………... 156 3. MATERIALES Y MÉTODOS ……………………………………………………… 158 3.1 LOCALIZACIÓN…………………………………………………………………….. 158 3.2 POBLACIÓN Y MUESTRA………………………………………………………… 158 3.3 VARIABLES……………………………………………………………………….... 158 3.4 ANÁLISIS ESTADÍSTICO……………………………………………………….... 159 3.5 MATERIALES Y EQUIPOS……………………………………………………….. 159 3.6 METODOS Y PROCEDIMIENTOS……………………………………………….. 162 4. RESULTADO Y DISCUSIÓN……………………………………………………….. 165 5. CONCLUSIONES Y RECOMENDACIONES……………………………………… 171 BIBLIOGRAFIA………………………………………………………………………….. 173 LISTA DE TABLAS Pág. Tabla 1 Quilotórax y pseudoquilo………………………………………………….. 61 Tabla 2 Características del exudado y trasudado……………………………….. 90 Tabla 3 Pasos a tener en cuenta en la inspección primaria……………………. 116 Tabla 4 Clasificación tratamientos para trauma………………………………….. 117 Tabla 5 Métodos de suplementación de oxígeno………………………………… 124 Tabla 6 Modificaciones de la gasometría sanguínea, pH equilibrio ácido base y saturación de oxígeno en paciente normo e hiperventilados…………………. 125 Tabla 7 Ventilación artificial………………………………………………………… 126 Tabla 8 Agentes farmaceuticos usados para el manejo médico de enfermedad de las vías respiratorias altas………………………………………………….. 138 Tabla 9 Antibióticos usados en el tratamiento de neumonía……………………. 140 Tabla 10 Anticoagulantes…………………………………………………………… 141 Tabla 11 Agentes farmacéuticos usados en el manejo del edema pulmonar.. 143 Tabla 12 Datos registrados en caninos de práctica……………………………… 165 Tabla 13 Conversión de registros de Presión Intrapleural de mmHg y mbar a cmH20………………………………………………………………………………… 166 Tabla 14 Datos calculados para análisis estadístico……………………………. 167 Tabla 15 Análisis de varianza de un factor…………………………………......... 168 Tabla 16 Análisis de varianza……………………………………………………… 168 LISTA DE FIGURAS Pág Figura 1 Cámaras del corazón……………………………………………………… 28 Figura 2 Auscultación cardiaca…………………………………………………….. 43 Figura 3 Contusión pulmonar………………………………………………………. 46 Figura 4 Neumotórax de tensión…………………………………………………… 56 Figura 5 Hermotórax………………………………………………………………… 57 Figura 6 Quilotoráx ………………………………………………………………….. 62 Figura 7 Radiografía de perro con quilotoráx……………………………………. 63 Figura 8 Citología de quilotórax……………………………………………………. 65 Figura 9 Vendaje de soporte……………………………………………………….. 69 Figura 10 Jeringa para toraconcentesis…………………………………………… 91 Figura 11 Ubicación del sitio para punción en toracocentesis………………….. 92 Figura 12 I- STAT……………………………………………………………………. 94 Figura 13 Laringoscopio de Miller para sondeo endotraqueal…………………. 120 Figura 14 Colocación de sonda endotraqueal……………………………………. 120 Figura 15 Cateterización venosa (vena cefálica)………………………………… 122 Figura 16 Cateterización venosa (vena cefálica)………………………………… 123 Figura 17 Cateterización venosa (vena cefálica)………………………………… 123 Figura 18 AMBU……………………………………………………………………… 128 Figura 19 Ventilador Penlon………………………………………………………… 129 Figura 20 Separadores estáticos del tipo Balfour, Finochietton y Gelpi………. 135 Figura 21 Dinámica de los fluidos pleurales……………………………………… 149 Figura 22 Cambios de presión durante el ciclo respiratorio…………………….. 151 Figura 23 Cateter calibre 14 GA…………………………………………………… 160 Figura 24 Anestesia gas sampling line (datex ohmeda)………………………… 160 Figura 25 Simulador de presión marca simcube…………………………………. 161 Figura 26 Manómetro de presión con estructuras modificadas “controle presión mayonne”………………………………………………………………........ 161 Figura 27 Punción con cateter calibre 14…………………..…………………….. 163 Figura 28 Medición de la presión intrapleural (PIP) con simulador de presión marca SIMCUBE……………………………………………………………. 164 Figura 29 Medición de la presión intrapleural (PIP) con manómetro de presión “controle presión mayonne”……………………………………………... 164 GLOSARIO ALCALOSIS METABOLICA: desplazamiento del estado ácido-básico hacia la alcalinidad debido a una pérdida descompensada de ácidos, ingestión o retención excesiva de bases, o depleción de potasio. Puede aparecer por vómitos o por el tratamiento con diuréticos. ALCALOSIS RESPIRATORIA: disminución en la tensión de dióxido de carbono del líquido extracelular debida a una eliminación excesiva de este gas a nivel pulmonar (HIPERVENTILACIÓN). Las situaciones generalmente asociadas con la alcalosis respiratoria son: la hipoxia, dolor, fiebre, temperatura ambiental alta, intoxicación, edema pulmonar, embolia pulmonar y enfermedad del sistema nerviosos central. ANIÓN GAP: también conocido como intervalo aniónico; es la diferencia entre la concentración real y medida de aniones en el suero. El contenido catiónico es superior al contenido aniónico, una incongruencia química, ya que están medidos todos los cationes, pero no todos los aniones. ATELECTASIA: colapso o ausencia de aire en los pulmones; puede ser aguda o crónica, y puede afectar a todo o parte del pulmón. BRADICARDIA: disminución del latido cardiaco; en perros y en gatos si son menos de 60 latidos / minuto BRAQUICEFALO: animal que tiene cabeza corta y ancha ej: Boxer, British bulldog, Pekines, Pug BRONQUIECTASIA: dilatación crónica de los pulmones y bronquiolos con una infección secundaria, normalmente comprometiendo las partes subordinadas del pulmón. Puede darse por una malformación congénita de los alvéolos con el resultado de una dilatación de los bronquios terminales. Suele ser una enfermedad adquirida secundaria a una obstrucción parcial de los bronquios con una infección necrotizante. Entre las enfermedades primarias que llevan a bronquiectasia están las bronquitis crónicas, neoplasias y aspiración de un cuerpo extraño. CAPNOGRAFÍA: es el registro gráfico de las concentraciones de CO2 en los gases espirados en un ciclo respiratorio, dando origen a una curva, denominada capnograma. CAPNOMETRÍA: es la medición del CO2 en la vía aérea de un paciente durante un ciclo respiratorio. Su lectura se obtiene de un dígito a través de un aparato, el capnógrafo, y es la representación “numérica” de la PCO2 inhalada y exhalada por un individuo CONCENTRACIÓN DE DIÓXIDO DE CARBONO EN EL ALVEOLO (PACO2): viene determinado por el grado en el que el CO2 se añade al alvéolo y la velocidad o el grado en el que este es eliminado. DIAFRAGMA: tabique músculo-membranoso que separa las cavidades torácica y abdominal. Lateralmente se inserta en las costillas caudales; centralmente al esternón; dorsalmente a la espina. El esófago, la aorta y la vena cava y los nervios pasan a través del diafragma. Relajado el diafragma es convexo pero se aplana y se mueve caudalmente cuando se contrae durante la inhalación, aumentándose así la cavidad pectoral y permitiendo la expansión de los pulmones. DIFUSIÓN: fenómeno por el cual el oxígeno y el dióxido de carbono pasan a través de la membrana alvéolo- capilar. DISNEA: respiración laboriosa. Constituye un signo de numerosos trastornos y es principalmente un signo de ventilación inadecuada o de cantidades insuficientes de oxígeno en la sangre circulante. DOLICOCEFALICO: animal de cabeza estrecha y larga característico de algunas razas de perros ej: collie, Borzoi, galgo. EDEMA PULMONAR AGUDO: se define como la acumulación anormal y de rápido desarrollo de líquido en los componentes extravasculares del pulmón, lo que incluye tanto en intersticio pulmonar (fase intersticial del edema) como los espacios alveolares (edema alveolar). HEMATOSIS: la hematosis es el intercambio gaseoso que se efectúa en la superficie de los alvéolos pulmonares, entre el oxigeno del aire inspirado y el anhídrido carbónico de la sangre venosa, a su paso por dicha superficie alveolar; la hematosis tiene como resultado la transformación de la sangre venosa en sangre arterial HEMOPTISIS: se define como la presencia de sangre en el esputo (secreciones que salen cuando se tose). Se presenta por sangrado en los bronquios y los pulmones. No es usual, indica un problema serio. Es difícil observarla en caninos y felinoa porque ellos tragan el esputo. HIPERCAPNIA: exceso de dióxido de carbono en la sangre, caracterizado por una elevada pCO2. se determina por análisis de gases y produce acidosis respiratoria. HIPERPNEA o HIPERVENTILACIÓN: se caracteriza porque la respiración tiene la amplitud y la frecuencia aumentadas HIPOCAPNIA: deficiencia de dióxido de carbono en la sangre. MEDIASTINO: masa de tejidos y órganos que separa los 2 pulmones, entre el esternón por delante y la columna vertebral por detrás. Contiene el corazón y sus grandes vasos, la tráquea el esófago, timo, ganglios linfáticos y otros tejidos y estructuras. NEUMOTACÓGRAFO: (volumen/tiempo). instrumento diseñado para medir flujos aéreos PLEURA: membrana serosa que tapiza los pulmones (pleura pulmonar) y reviste las paredes de la cavidad torácica (pleura parietal); las dos capaz encierran un espacio virtual, la cavidad pleural. POLIPNEA: es una respiración rápida y superficial. PRESIÓN PARCIAL DE CO2 FINAL EXPIRADA (ETCO2): es la cantidad de CO2 que abandona el alvéolo al finalizar la expiración, siendo este el resultado de la mezcla total de gas que viene simultáneamente de millones de alvéolos. PRESIÓN PLEURAL: es la presión que se genera por la cantidad pequeña de líquido que se encuentra en el espacio pleural que es el que se encuentra entre las 2 pleuras (visceral y parietal). Siempre es negativa y se produce por la interacción mecánica del pulmón y la cavidad torácica durante el ciclo respiratorio. PULSIOXIMETRÍA: la oximetría de pulso o pulsioximetría es la medición. No invasiva, del oxígeno transportado por la hemoglobina en el interior de los vasos sanguíneos PULSIOXÍMETRO: aparato que determina la saturación de oxígeno midiendo espectrofotométricamente el “grado” de azules de la sangre arterial y expresa esto en términos de saturación. Dado que la absorción de luz de los tejidos y de la sangre venosa son constantes, cualquier cambio en la absorción de la luz entre un tiempo dado y uno posterior se deben exclusivamente a la sangre arterial. Esta relación vincula directamente con la saturación de oxihemoglobina. RESPIRACIÓN: el termino "respiración" significa intercambio gaseoso entre un organismo y el medio ambiente. Este intercambio consiste en la absorción y la fijación de oxigeno y la eliminación de anhídrido carbónico. RESUCITACIÓN CARDIOPULMONAR (RCP): técnica de emergencia que se usa en el paro cardiaco para restablecer la función cardiopulmonar, hasta que este disponible otro método más avanzado de soporte vital. Los pasos básicos son: vía aérea, respiración y circulación. Se debe establecer y mantener una vía aérea evidente; se alivia cualquier obstrucción y se coloca un tubo endotraqueal o de traqueotomia. Se proporciona una ventilación adecuada con oxígeno mediante presión positiva intermitente y, si hace falta, se comienza la compresión o masaje cardiaco. SURFACTANTE: en fisiología pulmonar, mezcla de fosfolípidos (principalmente dipamilmitoilfosfatidilcolina) secretado por las células tipo II o células grandes alveolares de los alvéolos y las vías aéreas respiratorias , que reduce la tensión superficial de los líquidos pulmonares, y así contribuye a las propiedades elásticas del tejido pulmonar. TAQUIPNEA: respiraciones muy rápidas. La frecuencia es rápida y superficial, como en el ataque cardiaco, porque el mecanismo iniciador es la hipertermia y no la hipercapnia. TENSIÓN SUPERFICIAL: tensión o resistencia que actúa para preservar la integridad de una superficie. TORACOCENTESIS: es un procedimiento realizado para drenar el líquido que se encuentra entre el recubrimiento externo de los pulmones ( pleura) y la pared torácica. Normalmente se encuentra muy poco fluido en este espacio. TORAX: parte del cuerpo situada entre el cuello y el abdomen; pecho. Esta separado del abdomen por el diafragma. Las paredes del tórax están formadas por pares de costillas unidas a los lados del espinazo y curvado hacia el esternón. Los pares de costillas craneales están unidos al esternón, las siguientes se conectan a un cartílago que también se une al esternón y por fin las últimas no están unidas (costillas flotantes). Los órganos principales de la cavidad torácica son el corazón, con sus principales vasos sanguíneos y los pulmones con los bronquios. La traquea penetra en el tórax para unirse a los pulmones, y el esófago lo atraviesa para conectarse con el estómago por debajo del diafragma. VENTILACIÓN: proceso por el cual los gases entran y salen de los pulmones. VENTILACIÓN ARTIFICIAL: soporte respiratorio por medios manuales o mecánicos cuando la respiración normal es ineficaz o se ha detenido. VENTILACIÓN ASISTIDA: utilización de dispositivos mecánicos o de otro tipo para ayudar a mantener la respiración, suministrando generalmente aire u oxígeno a presión positiva. VENTILACIÓN ASISTIDA INTERMITENTE: sistema en el que se combina la respiración asistida con la espontánea. VENTILACIÓN CONTROLADA: utilización de un respirador de presión positiva intermitente o de otro respirador que tenga un dispositivo cíclico automático que sustituya a la respiración espontánea VENTILACIÓN ESPONTÁNEA: respiración normal, sin ayuda, en la cual el paciente crea el gradiente de presión mediante los movimientos de la pared del tórax y de los músculos que desplazan el aire hacia dentro y hacia fuera de los pulmones. VENTILACIÓN MECÁNICA: utilización de dispositivos especiales para ayudar al paciente a respirar. RESUMEN Día a día, el personal medico veterinario debe enfrentarse a circunstancias que requieren de conocimiento y rápida respuesta para determinar el curso a seguir en pacientes que oscilan entre la vida y la muerte; muchos de estos casos se deben a episodios traumáticos que son causas comunes de muerte en caninos, debido a alteraciones sistémicas que se pueden originar como es el shock, distress respiratorio y alteraciones en el metabolismo ácido base; además se pueden ver gravemente afectadas estructuras extratorácicas e intratorácicas (esófago, diafragma, pleuras, corazón, grandes vasos, pulmones,etc.) las cuales generan una descompensación en el organismo, creando así una alerta y emergencia veterinaria. Debido a la importancia del tema en el desempeño laboral de nuestra profesión se recopilaron escritos y se actualizaron con nuevas técnicas empleadas para la solución de problemas, creando así un documento base para consulta de la comunidad estudiantil y todo profesional interesada en este campo. A nivel práctico se determinó la presión intrapleural en caninos residentes en Bogotá, en donde dicha medición se realizo por medio de una punción directa en el tórax y la utilización de un manómetro y de un simulador de presión que arrojaron valores específicos. Como resultado, se estandarizo la técnica de presión intrapleural por punción directa con manómetro marca controle presión Mayonne (modificado) y el Simulador de presión marca simcube y se concluyo que no hay diferencia significativa entre los valores con los dos métodos empleados. El valor promedio obtenido con el manómetro controle presión Mayonne (modificado) = 4.7 cmH2O y con el Simulador de presión marca simcube = 5.0 cmH2O, la variación entre estos es mínima, la cual se puede deber a la sensibilidad que presenta cada uno de estos equipos. La falta de estudios de presión intrapleural en nuestro país publicados, no permite realizar comparativos a nuestra práctica, razón por la que fueron comparados con datos bibliográficos de otros países, de los que se observo que lo valores obtenidos se encuentran dentro de los parámetros ya establecidos. Los valores de presión intrapleural sirven como ayuda diagnóstica en la valoración de un paciente en el cual se piense que esta afectado el volumen minuto (VM) por una posible alteración de las presiones del tórax. Palabras claves: presión intrapleural, manómetro, simulador, punción ABSTRACT Day to day, the veterinary personnel must face circumstances that they require of knowledge and fast answer to determine the course to follow in patients who oscillate between the life and the death; many of these cases must to traumatic episodes that are causes common of death in canine, due to generals alterations that can be originated as it is the shock, distress respiratory and alterations in the metabolism acid- base; in addition they are possible to be seen seriously affected inside and outside structures of the thorax (esophagus, diaphragm, pleuras, heart, great glasses, lungs,etc.) which generate a descompensation in the organism, creating therefore an alert and veterinary emergency. Due to the importance of the subject in the work performance of our profession writings were compiled and they were updated with new techniques used for the solution of problems, creating therefore a document it bases for consultation of the student community and all professional interested in this field. At practical level the intrapleural pressure was determined in canine which live in the Sabana de Bogotá, this measure was made through direct puncture thorax and using a Moyonne pressure manometer (modified) and using a Simcube pressure electronic simulator that give specific values. As a result, the intrapleural pressure tecnic was standard by direct pucture whit Moyonne controle pressure (modified) manometer and the Simcube pressure simulator. Both used methods had nonesignificant values differences. The average values whit the Moyonne pressure gauge = 4.7 cmH2O and with the Simcube pressure simulator = 5.0 cmH2O. the variation is minimum because the sensibility as each equipment. There are not studies about intrapleural pressure in this country which didn´t permit to be compared, so it was compared with bibliographies of other contries. It was determined that the gotten valves are inside the set parameters. The intrapleural pressure valves help the diagnostic of a patient examination who has the minute size affected by alterations in thorax pressure. Keywords: intrapleural pressure, manometer , electronic simulator, puncture. INTRODUCCIÓN El traumatismo torácico es una de las causas más comunes de muerte en caninos, debido a las diferentes consecuencias que causa como shock, distress respiratorio y alteraciones en el metabolismo ácido base. Toda lesión de la caja torácica puede ocasionar trastornos a nivel de las estructuras intratorácicas: esófago, diafragma, corazón, grandes vasos y pulmones. El conocimiento de la forma en que reacciona el organismo ante un evento traumático, y las diversas consecuencias que trae consigo, permiten al clínico poder tener un punto de referencia con el cual puede tomar decisiones importantes que tendrán como objetivo el suministrarle al paciente el tratamiento adecuado que le salvará la vida. Los tratamientos empleados dependen no solo de las alteraciones que se observarían en el animal, sino también de realizar un buen examen clínico y análisis que permitan valorar la severidad del caso y el pronóstico que se le puede dar al mismo. Afecciones como hemotórax, neumotórax, distress respiratorio, contusión pulmonar, quilotórax, hernia diafragmática, contusión cardiaca, entre otros, causan una descompensación en el organismo que lleva consigo alteraciones a nivel funcional que principalmente se deben a los cambios que se producen en la relación ventilación/perfusión que impide una correcta expansión de los pulmones o contracción cardiaca. La mayoría de las lesiones alteran el valor de la presión intrapleural, volviendo la presión más negativa o más positiva, dependiendo del caso. La presión intrapleural es la presión que ejerce la cavidad torácica entre las 2 pleuras (parietal y visceral) durante el ciclo respiratorio, la cual es negativa atmosférica. 20 con respecto a la presión Con este trabajo se quieren establecer los beneficios que tiene el empleo de un método de medición de la presión intrapleural (PIP) a nivel clínico como ayuda diagnostica a la hora de presentarse un caso de trauma torácico donde puede estar implicado un daño que cause alteraciones a nivel de las presiones presentes en la cavidad torácica principalmente la presión entre las pleuras que pongan en riesgo la vida del paciente, beneficios reflejados en la presentación de un método diagnostico más rápido, confiable y poco empleado a la hora de diagnosticar posibles daños a nivel torácico por traumas. 21 1. OBJETIVOS 1.1 OBJETIVO GENERAL Realizar un documento escrito en trauma torácico en caninos; con conceptos, esquemas, gráficos y propuestas terapéuticas, actualizadas para la remisión de traumas torácicos y como evento práctico determinar el valor de la presión intrapleural en pacientes sanos a una altura de 2600 msnm. 1.2 OBJETIVOS ESPECÍFICOS Revisar conceptos sobre técnicas empleadas para el tratamiento de trauma de tórax. Elaborar un escrito que permita al lector tener una información completa y actualizada del tema “traumatología torácica” Determinar la presión intrapleural directa por medio de punción a nivel del tórax en caninos clínicamente sanos a una altura de 2600 msnm 22 2. MARCO TEÓRICO 2.1 TRAUMATISMO TORÁCICO El traumatismo toráxico es una de las causas más comunes de muerte en caninos, debido a las diferentes consecuencias que causa, como shock, distress respiratorio y alteraciones en el metabolismo ácido base. Toda lesión de la caja torácica puede ocasionar trastornos a nivel de las estructuras intratorácicas: esófago, diafragma, corazón, grandes vasos, pulmones. La presencia de daños externos es poco evidente, y esto causa que muchas veces haya confusión a la hora de diagnosticar al animal; aunque la piel esté intacta, el diafragma, la pared torácica, el corazón o los pulmones pueden estar gravemente dañados. Es necesario evaluar consumo cuidado al paciente, con mucha rapidez y en su totalidad, para así poder establecer el tratamiento más efecto y rápido que se le debe realizar. Los animales con traumatismo toráxico pueden sufrir lesiones abdominales concurrentes. La corrección quirúrgica de las lesiones asociadas a traumatismo toráxico puede requerir tratamiento de urgencia; sin embargo, en la práctica veterinaria es preferible evitar la cirugía de urgencia en los animales que han sufrido traumatismo toráxico, a menos de que sea absolutamente necesaria. Debe iniciarse de inmediato el tratamiento del choque hipovolémico u otros trastornos que pongan en peligro la vida del paciente, incluso antes de efectuar la valoración completa del animal. 1 2.1.1 Anatomía de la Cavidad Torácica. La caja torácica esta formada por piel, grasa, músculo, la columna vertebral en su porción torácica, costillas, esternón, músculos intercostales, pleura parietal y los vasos y nervios asociados a todas estas 1 ARCHIBALD, James.Traumatologia Canina. Zaragoza:Acribia, 1977. p 41 23 estructuras, además del diafragma que la cierra en su porción posterior, separando la cavidad torácica de la abdominal.2 La cavidad toráxico es la segunda del cuerpo en tamaño, su forma puede compararse a la de un cono truncado, muy comprimido lateralmente en su parte craneal y con la base escotada muy oblicua; La parte dorsal esta formada por las vértebras torácicas y el músculo largo del cuello porción torácica; Las paredes laterales están constituidas por las costillas y los músculos intercostales; La pared ventral esta formada por el esternón, los cartílagos de las costillas asternales y el músculo transverso del tórax; La pared caudal formada por el diafragma que la separa de la cavidad abdominal; La abertura craneal es de forma oval y ancha en el perro, esta limitada dorsalmente por la primera vértebra torácica y por el músculo largo del cuello, lateralmente por el primer par de costillas y centralmente por el preesternón3. 2.1.1.1 Tórax. El tórax óseo tiene forma de tonel, se limita dorsalmente por las vértebras torácicas, centralmente por el esternón y las paredes laterales por las costillas y los cartílagos costales. La abertura craneal esta limitada dorsalmente por la primera vértebra torácica, lateralmente por el primer par de costillas y cartílagos costales y centralmente por el manubrio de esternón. La abertura caudal esta limitada por la última vértebra toráxico, el ultimo par de costillas, el arco costal y la parte craneal del cartílago xifoides. 2.1.1.2 Costillas y esternón. Son estructuras óseas que forman las paredes del tórax, y presentan para su estudio un cuerpo o diáfisis, dos extremidades o epífisis y dos bordes. Los caninos poseen 13 pares de costillas, de los cuales 9 son verdaderas o esternales y 4 falsas o asternales. Las cabezas de las dos o tres últimas se articulan a una vértebra y la última costilla, por lo general, es flotante. Los cartílagos costales continúan la extremidad ventral de las costillas, son largos y se curvan ventral y cranealmente, los 8 primeros se articulan con el esternón (cartílagos esternales), mientras que los restantes (cartílagos asternales)4. Los 8 primeros cartílagos costales forman articulaciones sinoviales; Estas articulaciones junto con la 2 MARTINEZ H. Manuel. Radiología veterinaria: pequeños animales. Madrid:Interamericana, 1992. p. 187 TOBOS, Juan A. Generalidades de anatomía. Bogotá D.C.:Universidad Nacional de Colombia, 1999. p. 66 4 Ibid., p. 17 3 24 forma curvilínea de las costillas permiten el movimiento de expansión de la cavidad torácica al moverse en dirección cráneo dorsal5. El Esternón es una estructura esquelética impar, larga y segmentada situada en la línea media ventral, se encuentra comprimida lateralmente y formada por 8 esternebras. Las esternebras se unen solo en casos excepciónales y en los animales muy viejos. Se divide en tres segmentos: el manubrio o pre-esternón (Articula con el primer par de cartílagos), el cuerpo del esternón o mesoesternón (articula con los cartílagos costales), y la apófisis xifoides o metaesternón, se prolonga hacia atrás con el cartílago xifoides6. 2.1.1.3 Músculos torácicos. De acuerdo a la función de los músculos del tórax, estos se pueden dividir en inspiratorios y espiratorios. Entre los inspiratorios tenemos al escaleno, serrato dorsal craneal y al diafragma. Entre los espiratorios tenemos al oblicuo abdominal externo e interno, el transverso abdominal el ileocostal y recto abdominal. Entre los inspiratorios tenemos al escaleno, serrato dorsal craneal y al diafragma. Entre los espiratorios tenemos al oblicuo abdominal externo e interno, el transverso abdominal el ileocostal y recto abdominal7. El diafragma participa de la respiración y provee, aproximadamente, el 50% de la fuerza mecánica respiratoria en la inspiración. El diafragma, junto con otros músculos estriados que también participan en la respiración, son los únicos músculos esqueléticos cuya función ininterrumpida es necesaria para mantener la vida. 2.1.1.4 Órganos respiratorios intratorácicos 2.1.1.4.1 Tráquea. La tráquea es un conducto flexible, cartilaginoso y membranoso que forma la parte proximal del árbol traqueobronquial. Se extiende desde la salida 5 TORRES, Guzmán Patricio. Principios de cirugía torácica. En. http://www.mevepa.cl/modules.php?name=News&file=article&sid=323 6 GETTY, Robert. Sisson y Grossman. Anatomía de los animales domésticos. Mexico:Salvat editores S.A., 1993. p. 1581 7 TORRES, Guzman Patricio. Principios de cirugía torácica. En. http://www.mevepa.cl/modules.php?name=News&file=article&sid=323 25 de la laringe, a nivel de la vértebra C II, hasta el nivel del cuarto o quinto espacios intercostales, donde se bifurca en los bronquios derecho e izquierdo, inmediatamente dorsal a la base del corazón, este lugar de bifurcación se conoce con el nombre de carina. La parte de tráquea que asienta en el cuello se designa como parte cervical y la que está en la cavidad torácica es la parte torácica8. 2.1.1.4.2 Pleura y Fascia endotoráxica. Las pleuras son membranas serosas que tapizan la cavidad torácica y forman dos sacos cerrados de los cuales el izquierdo es más pequeño ya que el corazón esta desplazado hacia ese lado. Estos dos sacos pleurales recubren las paredes, como pleura parietal, se juntan en la línea media como pleura mediastínica y de esta se refleja sobre el parénquima pulmonar los pulmones para continuarse en la pleura visceral. La fascia endotoráxica es un tejido conjuntivo que recubre la superficie interna de las paredes de la cavidad torácica. Se pueden distinguir las porciones parietal, mediastínica y pulmonar de la pleura9. ( ver más información en el capítulo de presión intrapleural – anatomía Pleura y Fascia endotorácica) 2.1.1.4.3 Árbol bronquial. La tráquea se bifurca en bronquios principales derecho e izquierdo a nivel del quinto espacio intercostal. La bifurcación traqueal está situada ligeramente a la derecha de la línea media, inmediatamente dorsal a la base del corazón10. Los bronquios principales se subdividen adquiriendo una estructura anatómica de ramas de árbol, dando origen a bronquiolos terminales que en la parte distal del árbol bronquial conducen a los bronquiolos respiratorios.11. Los bronquiolos normalmente son menores a un milímetro y no tienen cartílago, ni glándulas en sus paredes, presentan cilios que ayudan a evitar que se acumulen secreciones bronquiales. Los bronquiolos dan origen a los conductos alveolares que a su vez desembocan en los sacos alveolares donde se realiza el intercambio gaseoso. 8 GETTY, Op. cit., p. 1719 TOBOS, Op. cit., p. 66 10 GETTY, Op. cit., p. 1724 11 Ibid., p. 1727. 9 26 Los alvéolos están formados por dos tipos de células, los neumocitos tipo 1 y neumocitos tipo 2, las cuales secretan el surfactante sustancia que reduce la tensión superficial dentro del alvéolo12. 2.1.1.4.4 Pulmones. Los pulmones son pares, derecho e izquierdo, órganos respiratorios que ocupan la mayor parte del espacio de la cavidad torácica. Cada pulmón está cubierto por la pleura pulmonar e invaginado en el saco pleural ipsolateral, en el cual se mueve libremente, y al que está unido solamente por su raíz y por el ligamento pulmonar. Los pulmones están subdivididos por fisuras interlobulares profundas en lóbulos. El pulmón derecho tiene cuatro lóbulos denominados apical (craneal), medio (cardiaco), diafragmático (caudal) y accesorio (intermedio); es mayor que el pulmón izquierdo que solamente tiene dos lóbulos, apical (craneal) y diafragmático (caudal). El hilio del pulmón es una zona de pulmón que no está cubierta por pleura y que contiene los bronquios, vasos linfáticos y sanguíneos y nervios que entran o salen del pulmón. Las estructuras contenidas por el hilio son las siguientes: arteria bronquial y sus ramas, plexo pulmonar, venas bronquiales y vasos linfáticos. 13. Las arterias que nutren a los pulmones se originan del tronco pulmonar que sale directamente del ventrículo derecho. Las venas drenan directo de cada lóbulo a la aurícula izquierda del corazón14. 2.1.1.5 Órganos cardiovasculares intratorácicos 2.1.1.5.1 Pericardio Es un saco fibroseroso que rodea al corazón y a los grandes vasos que están en conexión con dicho órgano. Tiene la misma forma cónica del corazón, como si fuese el molde adaptable del mismo pero lo suficientemente amplio que facilita los movimientos del corazón dentro de el. Externamente esta cubierto por 12 TORRES, Guzman Patricio. Principios de cirugía torácica. En. http://www.mevepa.cl/modules.php?name=News&file=article&sid=323 13 GETTY, Op. cit., p. 1721 14 TORRES, Guzman Patricio. Principios de cirugía torácica. En. http://www.mevepa.cl/modules.php?name=News&file=article&sid=323 27 la pleura mediastínica, entre ambas caras libres de la serosa existe un espacio estrecho (espacio pericardiaco) lleno de una pequeña y variable cantidad de liquido (liquido pericardiaco). Las funciones del pericardio en general son: Presentar una superficie lubricada al corazón para facilitar sus movimientos; Evitar una súper dilatación del corazón y garantiza su situación topográfica15 2.1.1.5.2. Corazón. Órgano muscular hueco situado en la región esternal que actúa como una bomba controlando el flujo de sangre16. Tiene 3 paredes: interna (endocardio), miocardio o músculo cardiaco, externa (epicardio). Esta dividido por el tabique interventricular en lado derecho o venoso y un lado izquierdo o arterial; cada lado se divide por medio de las válvulas auriculo-ventriculares (A-V) en una aurícula y un ventrículo. Las 2 aurículas (derecha e izquierda) son las cámaras receptoras o bombas cebadoras y los 2 ventrículos son las bombas de potencia. El corazón generalmente se extiende de la 3ª a la 6ª costilla, sin embargo se observan diferencias por razas y constitución17. Las válvulas del corazón son cuatro: Válvula tricúspide, Válvula pulmonar, Válvula mitral y Válvula aórtica. 18 Figura 1. Cámaras del corazón Fuente. http://www.tmc.edu/thi/anato_sp.html 15 TOBOS, Op. cit., p. 68 STUDDERT P. Virginia D.C. BLOOD. Diccionario de veterinaria. Mexico: Mac Graw Hill, 1994. p 239 17 GETTY, Op. cit., p. 1748 18 TEXAS HEART INSTITUTE at St. Luke´s Episcopal Hospital. The Heart of Discovery, Anatomia del Corazón 2004. En: http://www.tmc.edu/thi/valve_sp.html 16 28 2.1.1.5.3 Vasos en conexión con el corazón Tronco pulmonar. El tronco pulmonar surge del cono arterioso del ventrículo derecho. Pasa caudal y dorsalmente entre las aurículas derecha e izquierda y se relaciona, medialmente, con la aorta ascendente. Ambos vasos tienen un revestimiento tubular común, de pericardio seroso. El tronco pulmonar se divide en arterias pulmonares derecha e izquierda. Inmediatamente después toma contacto con la aorta mediante una conexión fibrosa, el ligamento arterioso remanente del conducto arterioso del feto. El conducto arterioso permanece funcional en los cachorros de menos de 4 días y, normalmente, el cierre no se realiza hasta los siete u ocho días de edad. Aorta ascendente. La aorta ascendente tiene su origen en el ventrículo izquierdo y muestra una expansión, el bulbo aórtico, debido a la presencia de los senos aórticos caudales de cada válvula semilunar. Los senos aórticos derecho e izquierdo dan origen a las arterias coronarias correspondientes que pueden surgir por un tronco común19. Tronco braquiocefálico. El tronco braquiocefálico se extiende cranealmente y a la derecha del arco aórtico, ventral a la traquea. De forma variable se divide en dos arterias carótidas comunes y arteria subclavia derecha. Su terminación, normalmente, asienta medial al primer espacio intercostal derecho o primera costilla. La arteria traqueo esofágica por lo general surge como una rama secundaria de la braquiocefálica y la arteria timopericardial surge inconstantemente de la cara craneal de la braquiocefálica, cerca de la reflexión pericardiaca. Irriga fundamentalmente el timo y el pericardio. Cuando no esta presente este vaso, el timo es irrigado por la arteria toráxico interna izquierda20. Las arterias carótidas comunes, derecha e izquierda, surgen de la braquiocefálica. Ocasionalmente puede presentarse un tronco bicarotídeo corto opuesto al primer espacio intercostal o II costilla. Ambas carótidas acompañan al tronco vago-simpático en una extensión variable a la vena 19 20 GETTY, Op. cit., p. 1750 Ibid., p. 1754 29 yugular interna, dentro de la lámina carotidea. El curso de ramificación de ambas carótidas comunes es casi idéntico en el cuello. Termina en la arteria carótida externa e interna cerca del nivel del hueso basihioides. Las ramas de las carótidas comunes son las siguientes: ramas musculares, arterias tiroideas caudales, arteria tiroidea craneal. La arteria carótida común se continúa con la arteria carótida externa, por detrás del punto de origen de la carótida interna. La carótida externa proporciona las siguientes ramas: arteria occipital, arteria laringea craneal, arteria faríngea ascendente, arteria lingual, arteria facial, arteria auricular caudal, arteria parótida, arteria temporal superficial, arteria maxilar. La arteria carótida interna es la rama terminal más pequeña de la carótida común21 2.1.2 Examen clínico orientado al trauma de tórax Para evaluar pacientes con trauma de tórax se debe realizar un examen minucioso y ordenado de los diferentes órganos y estructuras que conforman la cavidad torácica. Es importante notar que los hallazgos físicos que participan en la mayoría de las enfermedades pulmonares también participan en la mayoría de las enfermedades cardiacas importantes (regurgitación mitral, cardiomiopatia dilatada, parásitos del corazón)22 2.1.2.1 Historia clínica. La historia clínica como en cualquier especie, es de gran importancia. Al realizarse se debe registrar: Datos del propietario: Nombre, Identificación, teléfono, dirección. Datos del paciente: Nombre, especie, raza, edad, sexo, peso, tamaño. Anamnesis. Es esencial hacerla lo más completa posible, porque es una guía muy valiosa para el diagnóstico. 21 Ibid., p. 1755 HAMLIN L, Robert. Physical examination of the pulmonary system: Respiratory medicine and surgery. En: Veterinary Clinic of North America: Small Animal practice. Ohio. Vol. 30 No. 6 (Noviembre. 2000); p. 1177 22 30 o Historia médica. Vacunaciones, traumas previos y otras enfermedades. o Habitad: Tipo de habitación y alimentación o Motivo de la consulta. Interrogar al propietario sobre los sucesos ocurridos, Identificar episodios traumáticos recientes o pasados, signos estáticos o que evolucionan, signos previos similares, tratamientos y resultados. Nota: Es importante tomar la historia clínica mientras se hace la evaluación inicial de los signos vitales, de manera que puedan descubrirse y tratarse de inmediato las lesiones que ponen en peligro la vida del paciente (p. ej, neumotórax a tensión) 2.1.2.2 Examen físico (TORAX). Inspección primaria: - Visualización a distancia Acercamiento desde adelante Examen de boca, nariz Palpación cara, nariz, cráneo y cuello Auscultación laringe y tráquea Inspección-palpación, auscultación, percusión tórax Palpación pulsos en los miembros Rápida observación y palpación de columna, abdomen y miembros Después de la determinación inicial de los signos vitales del animal (p. ej., frecuencia cardiaca y respiratoria, color de las membranas mucosas (reflejan el estado de la circulación sanguínea de un paciente, puede ser una guía para determinar la oxigenación de los tejidos y la perfusión periférica), y tiempo de llenado capilar, temperatura, pulso arterial, estado de conciencia) se hace un examen minucioso y ordenado de los diferentes órganos y estructuras que conforman la cavidad torácica, para este es de vital importancia examinar el sistema respiratorio y sistema 31 cardiovascular ya que la mayoría de las estructuras se encuentran alojadas en el interior de esta cavidad. Al examinar el tórax se hace un examen comparativo de los dos hemitórax, derecho e izquierdo, cada hemitórax se divide en tres porciones o tercios: superior, medio e inferior, porque la mayoría de las afecciones pulmonares se establecen en estas zonas. Los ruidos como el frémitus pleural, se percibe mejor en el tercio inferior. El tórax se examina por inspección, palpación (temperatura, presión, dolor, ruidos palpables), percusión (digito-digital, para definir los órganos o delimitarlos, y comparada para saber el estado físico, natural del pulmón), auscultación (ruidos normales y anormales) y punción o toracocentesis, rayos X y escanografía. 2.1.2.2.1. Inspección del tórax: - Conformación del tórax: el tórax se puede observar (muy dilatado, en forma bilateral, con ensanchamiento de los espacios intercostales (en el enfisema pulmonar alveolar crónico). Ensanchamiento de un solo hemitórax (en casos de neumotórax, grandes colecciones de liquido como en la pleuritis unilateral, deformaciones ventrales como edemas subtorácicos (hipo-proteinemia)). - El tipo respiratorio predominante es el costo-abdominal. La respiración costal siempre es patológica. Se da por inmovilidad del diafragma, de origen nervioso (parálisis del nervio frénico, dolor abdominal como en la peritonitis, hepatitis y esplenitis) y mecánico, por procesos abdominales que ocupan espacio (dilatación gástrica, torsión del estómago, ascitis copiosas, tumores abdominales y dilatación vesical). La respiración abdominal puede ser de origen nervioso (parálisis de nervios costales “mielitis extensiva”, procesos dolorosos del tórax como pleuritis incipiente, miositis intercostal traumática, fractura de costillas y pericarditis traumática, fractura de vértebras cervicales.) y mecánico (efusiones pleurales, dificultad para la salida del aire de los pulmones por disminución en su elasticidad, entonces el abdomen debe reforzar la espiración). 32 - El ritmo normal se define por una inspiración siempre más corta que la espiración, con una pequeña pausa posterior (relación inspiración: expiración es 1: 1.6). Esta pausa es patológica y se denomina apnea, cuando es mayor de 15-30 segundos. Existen patrones de modificaciones patológicas del ritmo: Respiración sincopada: movimientos respiratorios profundos que se hacen cada vez más superficiales. Se presenta en animales agónicos. Respiración de Cheyne-Stockes: es una respiración que inicia superficial y rápida, se hace cada vez más profunda, luego vuelve a ser superficial y posteriormente se da el periodo de apnea. Se presenta en la uremia del perro. Respiración de Kussmaul: Movimientos respiratorios muy profundos, pero uniformes. Se presenta en acidosis graves23. Respiración de Biot o meningítica: respiración aparentemente normal, el animal deja de respirar y luego empieza a respirar nuevamente en forma normal, para suspenderla de nuevo, casi siempre es mortal, en animales muy jóvenes o muy viejos24. - La frecuencia respiratoria normal es 10-30 resp/min en caninos. Fisiológicamente la frecuencia puede aumentar en animales en estado de preñez avanzada, animales jóvenes y animales con sobrepeso25. 2.1.2.2.2. Palpación del tórax. La palpación permite determinar: - Temperatura del tórax. Puede estar aumentada por congestión cutánea y pleuritis inicial. 23 TAMAYO Arango Lynda. Examen del aparato respiratorio en caninos y felinos. En. http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 24 GARCIA G., Argemiro. Sistema Respiratorio y Sistema Circulatorio. Bogtá D.C.:Fondo Nacional Universitario, 1995., p 104 25 Ibid., p. 105 33 - Sensibilidad (Ej. Dolor por aplicación de drogas cáusticas o pomadas tópicas para descongestionar el pulmón y bronquios, en animales con osteomalacia, primera fase de pleuritis, fractura de costillas y miositis intercostal) - Frémitus, los principales son: Frémitus o roce pleural. Por resecamiento y rugosidades, el deslizamiento es difícil, doloroso y sonoro; se percibe mejor durante la inspiración y por el lado izquierdo. Fremitus bronquial o estertor. Ruidos que se producen en los bronquios cuando hay estertores bronquiales muy sonoros que se alcanzan a palpar.26 El corazón del canino está situado: sus 3/5 partes al lado izquierdo y 2/5 partes al lado derecho y se sitúa de la tercera a la séptima costilla. Al realizar la palpación de la región precordial, debe percibirse la localización, la fuerza del choque precordial, el ritmo e inclusive, se puede tomar la frecuencia cardiaca; además se puede determinar la presencia de arritmias. Se palpa la pared torácica en busca de: - costillas fracturadas segmentos inestables (flotantes) hematomas (por lo general adyacentes a las costillas fracturadas) enfisema subcutáneo (crepitación) localización anormal del latido de la punta del corazón (desplazado por herniación de vísceras abdominales). También se palpa la cavidad abdominal para buscar lesiones intra-abdominales concurrentes. La ausencia de vísceras sugiere su desplazamiento hacia la cavidad torácica27. 26 27 Ibid., p. 110 Ibid., p. 109 34 2.1.2.2.3. Percusión del tórax. Detecta cambios en la resonancia, lo cual permite hacer las inferencias con respecto al contenido del tórax. Siempre se deben comparar ambos hemitórax. Los límites pulmonares en el canino: El límite posterior del pulmón en caninos, empieza a nivel del raquis en el 12º espacio intercostal; se continua con el 11º espacio intercostal a nivel de la tuberosidad coxal; en el 8º espacio intercostal a nivel del encuentro y termina en el 5º espacio intercostal; para continuarse con el limite inferior, dos dedos por encima del borde inferior del tórax, para terminar en el 4º espacio intercostal sigue adelante paralelo al humero y luego hacia arriba, paralelo a la escápula, donde termina el límite anterior, para continuar con el límite superior, paralelo al raquis. Se puede percutir hasta el primer espacio intercostal llevando el miembro anterior hacia la cabeza28. La técnica de percusión es la siguiente: la percusión del tórax debe hacerse con el animal en pie, por que el paciente en decúbito, no manifiesta todas las alteraciones existentes. Si el animal esta en decúbito lateral o costal, las afecciones pulmonares o pleurales unilaterales, pueden complicar la respiración; hay disnea y el animal se puede asfixiar. Al percutir con el animal en decúbito, los líquidos que se encuentran en el tórax, se diseminan y no se encuentran a la percusión. La percusión debe hacerse en forma ordenada: Percusión horizontal. Empezando en el cuarto o quinto espacio intercostal, dando 2 ó 3 golpes en cada sitio percutido, y continuando en forma horizontal, sexto, séptimo y octavo, etc, espacios intercostales. Percusión vertical. Se empieza en la parte posterior de la escápula, siguiendo siempre los espacios intercostales en forma vertical; la percusión debe ser bilateral y comparada en los dos hemotórax Percusión superficial o liminal: generalmente para delimitar órganos 28 Ibid., p. 113 35 Percusión más profunda. Esta se hace con mayor fuerza en el percutor29. Los límites pulmonares pueden variar en: - Casos de enfisema pulmonar, sobre todo si es crónico alveolar, los pulmones se encuentran muy grandes, los espacios intercostales están ensanchados y los límites pulmonares son diferentes (los posteriores se amplían hacia atrás, sobre todo en el lado izquierdo y porciones antero-inferiores, donde es más notorio, la macicez cardiaca es más pequeña, disminuye porque la escotadura cardiaca se ha estrechado por el aumento de tamaño del pulmón); los alvéolos se agrandan, pierden su capacidad de contraerse y permanecen llenos de aire. - En el enfisema intersticial, cuando el alveolar llega a su extremo, los alvéolos se rompen y se ven como conductos llenos de aire; esto se debe a grandes esfuerzos. - Cuando el corazón adquiere gran tamaño, como en la hipertrofia y posterior dilatación cardiaca, la macicez cardiaca está aumentada y el límite pulmonar está rechazado. - Los límites pulmonares anteriores pueden estar rechazados hacia atrás, por la presencia de un tumor o absceso situado en la parte anterior del tórax (trastornos circulatorios y respiratorios); Los límites pulmonares posteriores, son rechazados hacia adelante, cuando órganos vecinos se agrandan y los rechazan como en el caso de: (Hernias diafragmáticas, con paso de vísceras abdominales al tórax y dilatación del estómago). Los ruidos que se pueden encontrar a la percusión del tórax, a nivel del pulmón son: Timpánico, Submate, Mate o macizo-Hipersonoro, Claro o pulmonar. Claro o pulmonar: Es el ruido normal del pulmón a la percusión, porque el aire está a una presión permanente e igual en todo el pulmón. 29 Ibid. p. 111 36 Hipersonoro: Es un ruido alto, fuerte y prolongado; es llamado también hueco. Se encuentra en animales con paredes torácicas muy delgadas por enflaquecimiento intenso o en animales flacos por enfermedades crónicas. Submate: Es un ruido bajo, corto, en el cual las paredes del tórax no vibran o lo hacen débil y difícilmente. Mate o macizo: Cuando en el pulmón se han formado focos o zonas de atelectasia o de hepatización, durante el desarrollo de una neumonía. Cuando hay focos de hepatización microscópicos. en casos de bronconeumonias, no se percibe macicez a la percusión. Se produce ruido mate cuando hay líquidos acumulados en el tórax; estos líquidos pueden ser de cuatro tipos: Tipo 1. Exudados inflamatorios: En casos de pleuritis, que generalmente es unilateral. Pueden ser: serosos, sero-fibrinosos, fibrinosos. Tipo 2. Líquidos de trasudación: Son claros, transparentes y no coagulan. Se forman en casos de hidrotórax que casi siempre es bilateral y resulta de un trastorno e insuficiencia cardiaca, con éxtasis de la circulación de retorno; o como secuela de una hipoproteinemia. Tipo 3. Líquido entre exudado y trasudado: Como en el caso de la estrangulación de hernias diafragmáticas. Tipo 4. Sangre o hemotórax. Cuando hay gran hemorragia interna, generalmente por ruptura de una vena. Macicez horizontal (altura del contenido percusión dígito-digital vertical). En pequeños animales cuando el animal se cambia de posición, la macicez sigue siendo horizontal, esto es debido a la coagulación de la fibrina. Cuando el animal se coloca en posición de decúbito lateral, puede desaparecer la macicez porque los líquidos se difunden en la cavidad si se trata de un hidrotórax por un trasudado. 37 Timpánico: Es un sonido muy alto, que vibra y recuerda el ruido del tambor. Se presenta en ocasiones como: Enfisema subcutáneo. Cuando las vísceras abdominales huecas se llenan de gran cantidad de gases y rechazan el diafragma y los pulmones se desplazan hacia delante. Cuando una extensa zona del pulmón esta rodeada de tejido solidificado o de exudado. En neumotórax el cual puede ser abierto (bronconeumonía), cerrado (pleuritis purulenta), a medida que se acumulan gases o aire, el pulmón va siendo rechazado hacia la parte anterior y queda finalmente una gran cavidad; en la inspección se encuentra deformación del tórax, respiración asimétrica y polipnea. Grandes bronquiectasias: los bronquios pierden su capacidad de distensión, contracción y permanecen abiertos. Cuando hay abscesos pulmonares. Cavernas pulmonares: cavidades formadas por destrucción de tejido o parénquima. 30 2.1.2.2.4 Auscultación del tórax. Se ausculta cuidadosamente toda la cavidad torácica para determinar si hay tejido pulmonar funcional. La ausencia de sonidos respiratorios sugiere desplazamiento de los pulmones por aire, liquido (p. ej., sangre) o vísceras abdominales. A nivel de tórax, los sonidos que se escuchan, se produce principalmente por la diferencia de presiones del aire que penetra y el aire que 30 Ibid., p. 116 38 todavía esta en los alveólos, a partir de remolinos que se forman al pasar el aire de los bronquios a los alvéolos31. La auscultación revela ruidos propios, naturales de la función respiratoria y sus movimientos. Siempre indirecta o mediata, por medio del fonendoscopio; debe realizarse en un lugar sin ruidos, se debe auscultar toda la superficie de los límites pulmonares y toda la superficie de percusión. 32 Auscultación con estetoscopio: Permite el reconocimiento y la caracterización de sonidos respiratorios. El animal no puede estar jadeando, para lo cual se le sostiene el hocico o se le coloca un bozal.33 En el animal sano hay dos ruidos normales: - Soplo laringotraqueal o soplo glotico: Se escucha desde la laringe y a lo largo de la tráquea, a nivel de los dos bronquios principales (5to espacio intercostal, porción medial), escuchándose mejor en la porción cervical ventral, sobre la traquea, producido por el estrechamiento de la glotis y la vibración de las cuerdas vocales;. Se escucha tanto en espiración como en inspiración, es de intensidad fuerte, se oye mejor en la espiración. Es notorio en caninos y debe intensificarse con ejercicio.34 - Murmullo vesicular o murmullo respiratorio: Se escucha en la traquea porque es cuando esta se cierra que se escucha el sonido.35 Siempre es un ruido inspiratorio y se oye fácilmente por detrás de la espalda, en el tercio medio. Se produce mayor sonoridad en la inspiración por la diferencia de presión entre el aire que entra y el que esta contenido en el pulmón, en cada alvéolo; el aire al entrar abre o agranda el alvéolo y esto produce el ruido. 31 TAMAYO, Arango Lynda. Examen del aparato respiratorio en caninos http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 32 GARCIA, Op. cit., p. 117 33 TAMAYO, Arango Lynda. Examen del aparato respiratorio en caninos http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 34 GARCIA, Op. cit., p. 117 35 HAMLIN, Op cit., p. 1179 39 y felinos. En. y felinos. En. El murmullo vesicular es muy débil: En casos de estenosis, cuando el aire entra débilmente, sin fuerza. Siempre que el pulmón pierde elasticidad, como en el enfisema pulmonar (polipnea, disnea espiratoria, fatiga), el murmullo vesicular no se oye. Cuando en las paredes torácicas hay engrosamientos patológicos, como edemas y enfisemas, que alejan el pulmón del oído. El murmullo no se escucha en animales muy gordos, obesos o de paredes musculosas (gruesas). El murmullo vesicular se acentúa en los casos de congestión pulmonar, tanto activa como pasiva - Congestión activa: mayor aflujo de sangre arterial. -En enfriamientos intensos, prolongados. -En la primera fase de la neumonía aguda. - Congestión pasiva: sangre venosa, éxtasis o mala circulación de retorno. -En insuficiencia cardiaca, dilatación cardiaca, miocarditis. -Cuando el animal está en decúbito lateral permanente (postración prolongada, congestión, neumonía). Los ruidos anormales que se pueden oír a la auscultación son: - Respiración pueril. - Respiración bronquial o tubaria - soplo tubárico. - Estertores, tanto en tráquea como en bronquios. - Ruidos de roce, roce pleurítico o pleural (frémitus pleural a la palpación). - Ruidos de sucución. - Ruidos propagados (ladrido, tos, aullidos). 40 - Ruidos de perturbación: intestino, crepitación de pelos, ruidos masticatorios, defecación, micción, etc - Estridor Respiración pueril. En animales jóvenes, el murmullo vesicular se oye fácilmente, es más sonoro que en animales adultos y se llama respiración pueril. Cuando en un animal adulto se oye respiración pueril, se debe a una gran congestión pulmonar.36 Estertores o crepitaciones. Las crepitaciones son más ruidosas durante la inspiración pero son también escuchadas durante la espiración; son sonidos adventicios, los cuales no son causados por el flujo de aire a través de las vías respiratorias pero probablemente ocurren como resultado de las vías respiratorias cerradas, que de repente se abren.37 Estertores secos o musicales. Cuando hay exudados, coagulados que están adheridos a la pared del bronquiolo y suenan al paso del aire. Desde el punto de vista acústico se dividen en: o Agudos o sibilantes. Silbidos secos y se producen en pequeños bronquios o cuando hay demasiado engrosamiento de la mucosa, en bronquitis, bronconeumonía y traqueobronquitis.38 Se produce por el paso de aire por vías aéreas estrechas. 39 o Bajos o sonoros. Recuerdan el ronquido humano y se presentan en grandes bronquios, o cuando el engrosamiento es poco. Estertores húmedos. Cuando hay desplazamiento de exudados, los estertores también se desplazan, se cambian de lugar, lo hacen por la tos. Los exudados pueden ser líquidos o semilíquidos, y los estertores se oyen como burbujas y según su tamaño y número, se dividen en: 36 GARCIA, Op. cit., p. 119 HAMLIN, Op. cit., p.1181 38 GARCIA, Op. cit., p. 120 39 TAMAYO, Arango Lynda. Examen del aparato respiratorio en caninos http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 37 41 y felinos. En. o Crepitantes, De burbuja muy pequeña, igual y numerosa; se producen en pequeños bronquios (sal al fuego o crepitación de pelos entre los dedos). o Subcrepitantes. o mucosos, burbujas más grandes, desiguales y menos numerosas. o De gorgoteo o chapoteo.;(Cavernas), burbujas muy grandes y escasas. Se oyen a nivel de cavernas y bronquiectasias. Roce pleurítico o pleural. A la palpación corresponde al frémitus pleural o pleurítico. El roce pleural es un ruido normal de frote entre las pleuras parietal y visceral. Si las pleuras parietal y/o visceral sufren una inflamación de cualquier naturaleza (traumática, enfriamiento, metástasis), se resecan, y aparece la primera fase de la pleuritis, llamada pleuritis seca, en la cual hay gran congestión y descamación de la pleura; a la palpación hay frémitus pleural, y a la auscultación hay ruido de roce pleural, que dura poco tiempo, de 1 a 3 días, para pasar a la segunda fase o pleuritis exudativa: el frémitus y el roce pleural desaparecen paulatinamente y por zonas, hasta que a los 2-3 días ya no se escuchan porque la enfermedad ha evolucionado. El frémitus y el roce pleural se presentan en la inspiración especialmente, son ruidos inspiratorios, porque es el momento en que el pulmón está en estrecho contacto con la pared torácica y por lo tanto es más audible en el tercio medio del tórax. Ruido de sucución. Es un ruido que semeja al producido al agitar una botella medio llena de líquidos; se ponen en movimiento líquidos y gases, se presenta en la pleuritis con pio-neumotórax y en el hidro-neumotórax. Ruidos de propagación. Son ruidos de las vías aéreas anteriores, como: ladridos, tos, que se perciben normalmente en el tórax, pero en forma débil. Ruidos perturbadores. Producidos por movimientos de los músculos cutáneos o por crepitación de los pelos al ponerse en contacto entre sí. Para saber si son o no ruidos de origen respiratorio, se tapa la nariz, para impedir los movimientos 42 respiratorios y que continúen los no respiratorios. Los peristaltismos del intestino se oyen fuertes y claros, cuando hay diarrea o hipermotilidad.40 Estridor. Es un sonido producido cuando el aire se mueve rápidamente a través de una abertura estrecha. Se produce durante la inspiración. Es causada por lesiones que estrechan la abertura laríngea y la luz traqueal. 41 También se ausculta el corazón: Un cambio en la localización o tono de los sonidos cardiacos, sugiere desplazamiento del corazón por aire, líquido o vísceras. A menudo ocurren arritmias ventriculares como consecuencia de miocarditis traumática o isquemia del miocardio. Sin embargo, es más frecuente que la aparición se observe 24 a 48 horas después del episodio traumático. Figura 2. Auscultación cardiaca Fuente: http://education.vetmed.vt.edu/Curriculum/VM8354/clintechgct/Techniques/Thorax4.htm Los sonidos normales del corazón en el perro son 2 el S1 y el S2, los sonidos S3 y S4 son considerados anormales en perros y gatos y están asociados con las enfermedades cardíacas. Los desordenes sistémicos pueden producir los sonidos S3 y S4. S1 es el cierre de las válvulas mitral y tricúspide (comenzando la sístole), el tipo más común de murmullo que se escucha en perros es el sistólico. S2 resulta del cierre de las válvulas pulmonar y aórtica (fin de sístole).42 40 GARCIA, Op. cit., p. 121 TAMAYO, Arango Lynda. Examen del aparato respiratorio en caninos http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 41 43 y felinos. En. En ocasiones no se puede distinguir con facilidad cuál es el primero y cuál el segundo tono, entonces se puede recurrir a las tres reglas siguientes: Primera regla. Los tonos cardíacos se oyen con mayor facilidad, cuanto más cerca de sus focos se ausculte: Primer tono: hacia el vértice del corazón, 4 y 5 espacio intercostal, focos de las válvulas mitral y tricúspide. -Segundo tono: hacia la base del corazón; 3ro y 4to espacio intercostal, válvulas sigmoideas aórtica y pulmonar. Segunda regla. En ocasiones, el corazón marcha con tonos que acústicamente son iguales. El primer tono es aquel que va más rápidamente seguido de otro. Tercera regla. el primer tono sistólico, coincide con el choque precordial, con el pulso arterial y es más grave y prolongado. Los tonos cardíacos pueden modificarse en individuos sanos, cuando se trata de animales nerviosos (perros: muerden, orinan o defecan por miedo). Los animales deben encontrarse se calmados en el momento del examen clínico. El primer tono puede estar reforzado, más fuerte, en todos aquellos casos en que el corazón trabaja con más fuerza. Esto puede ocurrir en: - Todos los casos de anemia crónica, grave o de hipovolemia. - Las endocarditis crónicas donde hay una alteración de la hemodinámica, la sangre pasa forzada de una cavidad a otra o se devuelve; el corazón trata de compensar la deficiencia y marcha hacia la hipertrofia compensadora y se escucha más fuerte el primer tono. - Todos los casos de fiebre; a mayor temperatura hay mayor estimulo para el corazón. 42 GREGORY C., Troy. Clinical techniques: Thorax and http://education.vetmed.vt.edu/Curriculum/VM8354/clintech_gct/Techniques/Thorax4.htm 44 Forelimb. En: - Hipertrofia cardiaca. El segundo tono o diastólico, está reforzado, siempre que se presente hipertensión pulmonar, enfermedad de las alturas, enfisema pulmonar y otras. Puede estar reforzado por uno o por ambos factores, aórtico o pulmonar. Los tonos cardíacos son débiles, apagados, cuando el corazón se contrae débilmente por: Miocarditis avanzadas, dilatación, degeneración del miocardio y debilidad cardiaca: asfixia, disnea, congestión, fatiga. Siempre que haya líquidos dentro del tórax, los tonos cardíacos se oyen apagados o no se oyen; Cuando en la pared torácica hay edemas inflamatorios, traumáticos, los tonos cardíacos se oyen apagados. 2.1.3 PRINCIPALES AFECCIONES TORÁCICAS 2.1.3.1 Contusión toráxica. Las contusiones se deben más que todo a resultados de accidentes automovilísticos, pero también existen otras causas (como una patada propinada por una persona o algún animal de granja (caballo, vaca), por un golpe con algún objeto pesado, o por caer de una altura). La gravedad del daño depende de la masa y de la velocidad del objeto que produce el golpe, y del área afectada por este mismo. La contusión torácica puede causar neumotórax, hemotórax, contusiones pulmonares, fractura de costillas y cualquier combinación de éstas. 43 2.1.3.2 Contusiones pulmonares La contusión pulmonar (CP) es la lesión anatomofisiológica resultante de la compresión/descompresión de la pared torácica. Es más común luego del trauma romo, cuya etiología principal son los accidentes con automotores 43 BIRCHARD, Stephen J. Manual clinico de pequenas espécies. México: Mac Graw Hill Interamericana, 1996., p 703 45 (además de riñas, abusos humanos, caídas y aplastamientos. La CP puede ser sutil y pasada por alto en presencia de otras lesiones más llamativas, tiene el potencial de evolucionar hacia una insuficiencia respiratoria. El resultado final de la CP suele depender del reconocimiento temprano de las lesiones asociadas; ya que con frecuencia puede estar acompañada por neumotórax, hemotórax, fracturas de costillas, hernia diafragmática, contusión miocárdica y taponamiento miocárdico. La CP puede ser leve y con escasas anormalidades clínicas o radiográficas o extensas y asociadas con afectación respiratoria e hipoxemia significativas. Las lesiones tienden a empeorar dentro de las 24 a 36 horas después del accidente. Debido a la naturaleza insidiosa de la CP, se suele prestar más atención a otros problemas y por ello su terapia es retrasada. Figura 3. Contusión pulmonar* *Los 3 componentes de una contusión pulmonar incluyen edema, hemorragia y atelectasia. Fuente: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/pulmcont.htm Fisiopatología:La extensión de la CP directa resultante del trauma romo se relaciona con la magnitud, duración, velocidad de la fuerza aplicada y área interesada por esta. Las fuerzas indirectas contribuyentes , incluyen la aceleración, desaceleración, compresión, torsión y deslizamiento. Las fuerzas que operan sobre el pulmón 46 causan disrupción estructural con ruptura de los alvéolos y vasos sanguíneos adyacentes. Se produce hemorragia intraalveolar e intersticial. El parénquima adyacente también es dañado a nivel celular, con el derrame progresivo de los constituyentes plasmáticos dentro del intesticio y espacios aéreos. Se libera ácido araquidónico, precursor de prostaglandinas, ácidos grasos hidroxi y leucotrienos, con incremento de la permeabilidad capilar, contracción de las vías aéreas y vasoconstricción. La lipoxigenasa atrae granulocitos, los que poseen enzimas lisosomales que producen oxirradicales, mediadores de la lesión parenquimatosa. En consecuencia, la lesión de la CP inicialmente está causada por la hemorragia, seguida por la infiltración de líquido edemático, células nucleadas y mediadores inflamatorios. Los efectos son la disminución de la distensibilidad y el incremento de la distancia de difusión gaseosa. La respuesta temprana de lecho vascular dañado es la vasoconstricción de intensidad variable, que en gran medida es una respuesta a la hipoxemia local, ya sea mediante efectos directos sobre el músculo liso vascular o liberación de sustancias mediadoras ( por ej, leucotrienos). La hipoperfusión local también puede ser el resultado de la disrupción mecánica ( congestión , agregación plaquetaria o microtrombosis fibrinosa). El efecto global es reducir la perfusión del pulmón sin ventilar, con lo cual se limita la desproporción ventilación/ perfusión e impide el incremento de los cortocircuitos en los estadios tempranos de la lesión. Los espacios aéreos adyacentes a la región traumatizada tiene perfusión normal por unidad de volumen, pero son menos distensibles (debido al edema y disrupción de la capa de surfactante) y por ello están hipoventilados, como secuela, en esta parte del pulmón aumenta la desproporción ventilación/perfusión e incrementa la mezcla venosa. La hipoxemia resultante responde al aumento de la concentración del O2 inspirado. A mediada que empeora el edema ( por los efectos de los mediadores inflamatorios) y progresivamente se afectan más porciones del pulmón, la desproporción incrementa mucho más. La hipoventilación puede exacerbar la hipoxemia. El esfuerzo respiratorio puede estar reducido por el dolor. La broncoconstricción y obstrucción de las vías aéreas por la hemorragia pueden reducir la ventilación efectiva, y las lesiones torácicas concurrentes pueden contribuir a la depresión de la distensibilidad. Si la PaO2 ( presión parcial de oxígeno en 47 sangre arterial) cae por debajo de 60 mmHg, se producen hipoxia y acidosis titulares, arritmias cardiacas, depresión mental y perdida final de la conciencia. 44 La mayoría de los pacientes con CP tiene taquipnea con la resultante disminución de la PaCO2; empero, en la CP grave puede haber retención del CO2. La hipercapnia marcada con una PaCO2 >puede fomentar edema cerebral. El deterioro cardíaco sería el resultado de la contusión miocárdica e hipovolemia y puede ser corregida con la fluidoterapia apropiada. La resolución de la CP en general ocurre dentro de los 3ª 7 días; no obstante, la disfunción pulmonar puede persistir durante varias semanas, lo cual explica la discrepancia entre las radiografías normales y el retardo de la recuperación clínica en algunos casos. Diagnóstico: Se basa en los antecedentes, signos físicos e imagenología. El análisis de gases arteriales es de extrema utilidad y sensibilidad para supervisar la intensidad de la insuficiencia respiratoria. Cuando sucede el accidente, los pacientes están choqueados y en estado de deterioro; por ende, la reanimación debe ser iniciada antes del alcanzar el diagnóstico definitivo. Es importante recordar que los signos de la CP pueden no ser evidentes en la valoración inicial y por ello se requieren de chequeos periódicos para asegurar que no sea paso por alto algún signo. La sintomatología depende del grado lesional , pueden ser, taquipnea, disnea, ortopnea y respiración a boca abierta. La hemoptisis o la presencia de sangre o un líquido sanguinolento en la orofaringe y tráquea indican una CP pronunciada.45 La hemorragia y el edema recientes generan ruidos pulmonares húmedos, mientras que los lóbulos consolidados causan ausencia o potenciación de sonidos. Las costillas se palpan en su extensión por la existencia de fracturas. La piel del tórax se examina mediante inspección y palpación en busca de heridas penetrantes o de enfisema subcutáneo que pueden estar disimulados por el manto. El examen es de especial importancia en las heridas por mordedura donde la extensión del trauma externo puede ser mucho menor que la lesión más profunda, además se debe tener en cuenta la contaminación ( cultivo bacteriano y antibioticograma)46. 44 HACKNER, Susan. Contusiones pulmonares. En:Selecciones veterinarias. Pennsylvania. Vol. 8 Nº. 4 (Octubre. 2000); p. 364 45 Ibid .,p. 365 46 ETTINGER, Stephen J. Tratado de Medicina Interna Veterinaria: enfermedades del perro y el gato. Buenos Aires: Intermedica, 1997. p. 1204 48 La radiología es uno de los medios más importantes y prácticos para diagnosticar CP y lesiones asociadas. Se observan áreas difusas o en manchas de patrones alveolar e intersticial que no siguen el patrón anatómico. No obstante, la CP puede no evidenciarse en la radiología dentro de las 4-6 horas de la lesión. Las placas tomadas en tal período pueden confirmar otros problemas ( por ej., hemo o neumotórax, fractura de costilla, ruptura diafragmática).47 Estos cambios pueden retratarse hasta las 24 horas luego del trauma .48 La magnitud de la hipoxemia se determina midiendo la PaO2 ( normal: 80 – 100 mmHg); la cianosis no se detecta hasta valores <50 mmHg. Los pacientes con PaO2 <60 mmHg requieren oxigenoterapia y ventilación mecánica. La PaCO2 ( normal: 35-45 en perros) es un reflejo de la eficacia ventilatoria y suele estar reducida en la CP debido a la hiperventilación. El dolor o un segmento de aleteo puede reducir tal respuesta. La PaCO2> 50 mmHg justifica el uso de ventilación mecánica. El gradiente A-a ( gradiente de O2 alveolar- arterial) se calcula como ( 150 – PaCO2/ 0.8) – PaO2 ; si es > 15 existe desproporción ventilación/ perfusión. Tratamiento: La CP en general no se maneja como una entidad aislada sino que el tratamiento exitoso depende de respetar los principios básicos en el manejo del trauma y atención temprana adecuada del pulmón dañado. Siempre se deben detectar y corregir (en forma precoz) las emergencias que amenazan la vida. Tener en cuenta que puede haber lesión torácica significativa sin daño apreciable en la pared torácica. Por lo tanto, la detección depende de la anticipación y exclusión más que de la manifestación lesional directa. Las prioridades inmediatas son iguales para todos los casos: establecer una vía aérea permeable y asegurar la ventilación y circulación adecuadas. Durante y después de la reanimación, los signos vitales y respuesta al tratamiento deben ser seguidos de cerca. En los pacientes riesgosos es fundamental la valoración objetiva continuada ( ECG, vigilancia hemodinámica, oximetria de pulso y gases en sangre). La radiología se debe considerar solo cuando se estabiliza la condición del enfermo, porque la información aportada rara vez justifica el potencial riesgo. - Ventilación: En los pacientes con insuficiencia ventilatoria pos trauma se deben de considerar 7 posibilidades: obstrucción respiratoria, neumotórax abierto o a tensión, 47 48 HACKNER, Op. cit., p. 365 ETTINGER, Op. cit., p. 1204 49 aleteo torácico, hemotórax masivo, CP grave y hernia diafragmática. Para la valoración rápida escuchar la respiración; examinar la orofaringe; observar frecuencia, patrón y grado de movimientos torácicos; y hacer semiología torácica básica ( inspección, percusión y auscultación). La orofaringe debe ser despojada de sangre y secreciones. La CP grave puede generar grandes cantidades de saliva espumosa sanguinolenta, lo cual demanda la inmediata intubación endotraqueal y aspiración de las vías aéreas; la aspiración se puede hacer introduciendo un catéter dentro del bronquio principal y luego en el otro, con succión intermitente, la instilación de cantidades reducidas de solución salina estéril colabora rompiendo los coágulos y moco. El paciente inconsciente debe ser intubado de inmediato y ventilado en forma mecánica. La traqueostomia de urgencia se reserva para las condiciones de obstrucción mecánica ( edema facial o laríngeo intenso) en las cuales no es posible la intubación endotraqueal. En el neumotórax abierto, la herida debe ser cubierta con apósito o guante ( convirtiéndolo en cerrado) hasta que sea posible el cierre definitivo. La toracocentesis rápida elimina el potencial letal de un neumotórax a tensión e identifica la presencia de hemotórax . la intubación y la ventilación mecánica son requeridas cuando estos procedimientos no aseguran una ventilación adecuada. - Perfusión: valorar el estado circulatorio ( frecuencia y calidad del pulso, color de mucosas, tiempo de llenado capilar) y buscar indicios de hemorragia externa ( si la misma es profusa debe ser controlada). La ecocardiografía permite reconocer el taponamiento cardíaco ( por hemopericardio) y guía la pericardiocentesis. En general se considera que la fluidoterapia debe restaurar el volumen minuto y perfusión tisular óptimos, destacando que el pulmón lesionado es más sensible a la sobrecarga que el normal. El volumen requerido depende de las necesidades individuales y se basa en los indicadores fisiológicos habituales. Como guía, los animales en choque pueden recibir soluciones de cristaloides a razón de 90100ml/kg/ hora, siendo fundamental la valoración continua de la respuesta a la carga hídrica.49 La hidroterapia enérgica puede causar acumulación de líquidos en el pulmón. La administración agresiva de los cristaloides puede resultar en edema pulmonar complicado con la contusión pulmonar.50 49 HACKNER, Op. cit., p. 366 Colorado State University, College of Veterinary and Biomedical Science. Pulmonary contusions. En. http://www.cvmbs.colostate.edu/clinsci/wing/trauma/pulmcont.htm 50 50 Las soluciones salinas hipertónicas no incrementan el agua pulmonar extravascular ni afectan la función pulmonar o mecánica respiratoria; por lo tanto; son un complemento de utilidad para restaurar la función circulatoria sin efectos pulmonares nocivos. Una combinación de CINa al 7.5 % con Dextran-70 al 6% demostró ser superior a la solución salina sola. Esta combinación se administra a razón de 35ml/kg IV durante 5 minutos y se emplea en conjunción con las medidas de reanimación convencionales.51 Es poco probable que la administración de líquidos IV aumente la acumulación de líquido dentro de las contusiones pulmonares, a menos que la concentración de proteínas plasmáticas sea <3.0g/100ml o la concentración de albúmina plasmática sea <1.5g/100ml.52 - Manejo pulmonar: Después de estabilizar las emergencias riesgosas para la vida inmediatas, se puede emprender la terapia de la CP, la cual es de sostén y orientada al mantenimiento de una oxigenación adecuada. La agresividad del tratamiento depende de la magnitud lesional. Cuando la CP es leve y sin afección respiratoria, el reposo en jaula es suficiente. El paciente disneico e hipoxémico necesita oxigenoterapia, ya sea en jaula especial o con sonda nasofaríngea. En los animales echados es importante el cambio posicional frecuente. La corticoterapia es motivo de controversia.53 La administración de corticoesteroides ( 2 a 4 mg/kg de fosfato de dexametasona o 30 mg/kg de succinato sódico de metilprednisolona) puede ser sutil para limitar el tamaño de las contusiones pulmonares si se aplica lo más pronto posible después del traumatismo, los corticoesteroides contribuyen a la inmunosupresión de los pacientes, por lo cual predisponen al animal a presentar neumonía bacteriana, por eso se deben de administrar antibióticos a los pacientes con CP para reducir que esto se presente. Se recomiendan los diuréticos para extraer el exceso de agua y limitar el tamaño de las contusiones; sin embargo, los diuréticos pueden reducir el líquido corporal total en un momento en el que la expansión de volumen sea crítica para resucitar al animal. 51 HACKNER, Op. cit., p. 366 BIRCHARD, Op. cit., p. 708 53 HACKNER, Op. cit., p. 366 52 51 Los broncodilatadores ( por ej., aminofilina 6 a 10 mg/kg cada 8horas, PO o IV) pueden mejorar la ventilación, ya que mantiene las vías aéreas abiertas. 54 2.1.3.3 Lesión miocardíca secundaria a trauma torácico directo El trauma torácico es común que se presente en perros golpeados por automóviles. Normalmente, el mecanismo exacto de la lesión miocárdica que sigue del trauma es desconocido y la mayoría tiene un origen multifactorial.55 La naturaleza elástica de la caja torácica hace que su contenido pueda llegar a sufrir lesiones compresivas, por concusión ( golpe) y por penetración. El mecanismo más común que causa una lesión miocárdica es una lesión compresiva lateral del tórax. La lesión miocárdica puede ser sospechada en perros que se ven envueltos en accidentes con vehículos y que tiene las siguientes lesiones asociadas: (1) fractura de extremidades, la columna o la pelvis; (2) evidencia externa de trauma torácico; (3) evidencia radiográfica de trauma del pecho, tales como la contusión pulmonar, neumotórax, hemotórax, ruptura diafragmática y fractuas de costillas o escápula ; y (4) lesión neurológica. La electrocardiografía (ECG) debe de ser realizada en los perros con cualquiera de estas lesiones durante el examen inicial y se debe de repetir intermitentemente ( cada 12 a 24 horas),es importante notar que las anormalidades en el ECG pueden no aparecer antes de las 48 horas después del trauma torácico directo. Dentro de las primeras 48 horas después de causada la lesión, el examen ecocardiográfico debe ser considerado en perros severamente traumatizados con una pobre respuesta al esfuerzo por resucitarlo y a la evidencia de lesiones torácicas, aún sino presentan ninguna alteración en el ECG. En los perros , la ecocardiografía transtorácica puede identificar y localizar anormalidades funcionales y estructurales del miocardio lesionado por un trauma torácico directo. 54 BIRCHARD, Op cit., p. 708 REISS, Adam. Myocardial Injury Secondary to Blunt Thoracic Trauma in Dogs: Incidence y Pathophysiology. Compendium. Colorado. Vol. 24 No. 12. (December. 2002); p. 935 55 52 Se ha dicho que la distorsión de la cavidad torácica resulta en un aumento de las presiones intracardiacas y intratorácica, causando una tensión dentro del miocardio lo suficientemente poderosa para producirse una contusión. La severidad de la lesión causada por el trauma se ve afectada por la magnitud y la velocidad del impacto así como de la cantidad de tejido suave que absorbe la fuerza. Adicionalmente hay factores que pueden influir en la severidad de la lesión , como la posición del animal en el momento de la fuerza traumática y si el animal esta consciente del inminente evento y si es capaz de iniciar una respuesta de protección. 56 El trauma miocárdico causa alteraciones del sodio y el calcio que pasa a través de la membrana celular, esto puede causar aritmogenesis, la cual puede ser realzada por la acidosis, hipoxia y el incremento de las catecolaminas que se presenta recurrentemente en pacientes con trauma, estas alteraciones modifican el transporte a través de la membrana y la permeabilidad de los cationes ( potasio, sodio, calcio). Las lesiones miocárdicas comúnmente se manifiestan como arritmias, entre las primeras 48 horas que siguen al evento traumático. Estas arritmias se presentan por una alteración en el transporte de los cationes que resulta en una disminución del potencial de membrana de los miocitos lesionados, volviéndose susceptibles a despolarizaciones aberrantes. Las arritmias que más se presentan en caninos con lesión miocárdica incluyen contracciones ventriculares prematuras, taquicardia ventricular y la disminución o aumento inespecífico del segmento ST.57 La terapia antiarrítmica es recomendada cuando los pacientes están en riesgo esto quiere decir que ya han sido estabilizados apropiadamente ( terapia de fluidos adecuada, electrolitos, oxígeno, y control del dolor) aún siguen presentando arritmia severa, como el complejo ventricular prematuro, y la taquicardia ventricular.58 La administración de corticosteroides, puede ser benéfica en el caso de contusiones del miocardio; sin embargo, la eficacia de cualquier forma de tratamiento es incierta. 56 Ibid., p. 938 Ibid., p. 939 58 Ibid., p. 948 57 53 Por medio del ECO continuo se evalúa si hay arritmias ventriculares, las cuales pueden desarrollarse a consecuencia de miocarditis traumática. El tratamiento inicial consiste en administrar lidocaína IV (2 mg/kg en bolos hasta un máximo de 8 mg/kg/hora). Si la terapéutica con lidocaína es eficaz pero se requiere una infusión constante, se administra a una velocidad de 50 a 80 mg/kg/min. Se ajusta la velocidad hasta lograr el efecto deseado.También puede administrarse procainamida (8 a 20 mg/kg, PO o IM, cada 4 a 6 horas). 59 2.1.3.4 Neumotórax: neumotórax es la presencia de aire dentro de la cavidad pleural, su efecto es el de dificultar el intercambio gaseoso pulmonar, incluso llegando a un colapso pulmonar. Existen varios tipos de neumotórax causa: y se clasifican de acuerdo a su etiología o Neumotórax Espontáneo: es la presencia de aire sin una causa clara (no traumática): neoplasia pulmonar, neumonía bacteriana/absceso, parásitos del corazón, bronquitis crónica o asma.60 Neumotórax Traumático: resulta de una lesión traumática en el tórax, que puede ser penetrante, por herida con arma blanca o arma de fuego, o contundente, como en el caso de un impacto a causa de un accidente automovilístico. Se puede clasificarse como abierto o cerrado, según exista comunicación con el medio externo o no en: - Neumotórax Abierto: El trauma penetrante del tórax por lo regular ocasiona neumotórax abierto, la situación se complica dependiendo del tamaño del orificio de comunicación tóraco – atmosférico. El perro, tiene una pleura mediastinica muy delgada y fenestrada, de manera que una herida penetrante unilateral genera un neumotórax bilateral, lo que determina 59 BIRCHARD, Op. cit., p. 708 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 60 54 Pneumothorax. 2003. En. colapso parcial o total de ambos pulmones. Cuando el diámetro del orificio es igual o superior al diámetro de la traquea el colapso pulmonar es severo y el animal tiene serias dificultades para movilizar aire y en general habrá un paro cardio-respiratorio en algunos minutos (5 a 10) después del accidente. Orificios de menor tamaño son compatibles con la vida, pero necesitaran atención veterinaria urgente. Síntomas: Dolor toráxico, dificultad para respirar, fatiga, taquicardia y cianosis Diagnóstico: El cuadro clínico es dramático, con respiración angustiosa, y dificultosa a una alta frecuencia, frecuentemente con cianosis, etc. A la auscultación los sonidos cardíacos pueden ser difíciles de escuchar; los sonidos pulmonares disminuidos y la percusión del tórax será hiper-resonante. La radiología se utiliza para confirmar el diagnóstico, y conocer la extensión del daño. Tratamiento: Habrá compromiso clínico importante cuando el grado de colapso es mayor al 50%, puesto que los pequeños neumotórax pueden resolverse por sí mismos. El tratamiento implica la rápida descompresión mediante un toracocentesis. El alivio mostrado por el paciente al retirar un poco de aire es impresionante, y esto permite ganar tiempo como para colocar posteriormente un tubo de drenaje toráxico que durara varios días, se repetirá esta maniobra con una frecuencia decreciente (cada 2 a 4 hrs el primer día) según la evolución del paciente, logrando que el pulmón se reexpanda, por lo cual se requiere de hospitalización para el manejo de dicha sonda. - Neumotórax Cerrado Simple : El trauma romo puede crear un neumotórax cerrado como resultado de fracturas de costillas que laceran el pulmón, aunque la mayoría de los casos de neumotórax postraumático, la etiología es la ruptura alveolar o de las vías aéreas en los casos más graves. Esta ruptura es la razón por la que se va perdiendo aire hacia la cavidad plural. La laceración de un pulmón, bronquio o tráquea puede producir neumotórax a tensión, que es la acumulación progresiva de aire en el espacio pleural, lo 55 cual provoca presión intrapleural positiva.61 La presión intrapleural eventualmente aumenta a tal punto que interfiere con el retorno venoso, resultando en un emposamiento de sangre en los vasos dando como resultado un colapso cardiovascular y por consiguiente shock.62 Los animales con neumotórax a tensión requieren drenaje toráxico inmediato por medio de un tubo de toracostomía para evitar colapso pulmonar, la disminución del retorno venoso sistémico al corazón y muerte rápida. Esto restablece la presión intrapleural negativa y permite la reexpansión pulmonar. El drenaje toráxico intermitente tal vez no sea adecuado y con frecuencia se necesita drenaje de aspiración continua. En este caso, se conecta el tubo toráxico a una unidad de aspiración, como la Pleurevac (Deknatel, Inc.). Si no se estabiliza el estado del paciente, se debe de considerar realizar una toracotomia explorativa63 Figura 4. Neumotórax de tensión Fuente: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/tension.htm 61 BIRCHARD, Op. cit., p. 707 Colorado State University, College of Veterinary and Biomedical Science. Tensión pneumothorax. En. http://www.cvmbs.colostate.edu/clinsci/wing/trauma/tension.htm 63 BIRCHARD, Op. cit., p. 707 62 56 A nivel radiográfico los signos de neumotórax de tensión son: - Hipertransparencia, hemitórax excesivamente expandido - Cambios en el mediastino del lado opuesto - Corazón muy elevado del esternón, los lóbulos pulmonares están retraídos de la pared del tórax. La principal indicación en el tratamiento de este tipo de neumotorax es la de aliviar la presión intrapleural aumentada. Esto se realiza por medio de la toracocentesis.64 Todos los cuadros de neumotórax se benefician con la administración de oxigeno 2.1.3.5 Hemotórax. El hemotórax (acumulación de sangre en el espacio pleural) ocurre secundario a cualquier causa traumática que provoque laceración de vasos, corazón, pulmón o pared toráxica (Otras enfermedades diferentes al traumatismo pueden causar hemotórax),65 estas pueden ser coagulopatias (deficiencias de factores tales como el antagonista de la vitamina K); neoplasia (sarcoma metastásico, hemangiosarcoma) y torsión de los lóbulos pulmonares. Figura 5. Hemotórax Fuente: www.vet.ohio-state.edu/.../ hemorrhage/hem5.html 64 Colorado State University, Collage of Veterinary Medicine and Biomedical. Tension pneumothorax. En: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/tension.htm 65 BIRCHARD, Op. cit, . p. .708 57 Características: Es rojo, es una efusión opaca, PCV y el conteo de células empaquetadas es menor de 25% de la sangre periférica; la evaluación citológica (la mayoría son glóbulos rojo, algunos macrófagos y neutrófilos maduros)66 El hemotórax causa dos problemas principales: choque hipovolémico y restricción de la ventilación. Una hemorragia masiva debida a una lesión cardiaca o de uno de los grandes vasos, por lo general causa muerte rápida al paciente.67 Test diagnóstico: Estudio de la coagulación (PT, PTT) Radiografía toráxica (evidencia de fractura de costillas, torsión de los lóbulos, neoplasia metastásica) Radiografía abdominal/ ultrasonografía (mirar los tumores primarios), toracotomía exploratoria cuando las coagulopatias han sido descartadas.68 Tratamiento: El tratamiento del hemotórax inducido por trauma, implica apoyo enérgico y rápido, que consiste en la aplicación IV de líquidos o transfusión sanguínea y drenaje pleural. Se junta sangre en forma aséptica por medio de un tubo toráxico y se administra al paciente a través de un equipo para transfusión. Se evalúan estrechamente los signos vitales, el Ht y la CPP del paciente. El tratamiento quirúrgico del hemotórax puede fracasar debido a que el origen de las hemorragias rara vez se identifica. 69 66 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 67 BIRCHARD, Op. cit., p. 708 68 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 69 BIRCHARD, Op cit., p. 708 58 Pneumothorax. 2003. En. Pneumothorax. 2003. En. 2.1.3.6 Piotórax. El piotórax (empiema, pleuresía purulenta o supurada) es la acumulación de material y líquido infectados dentro del espacio pleural. Características: marrón- rojizo, opaco; exudado, proteina total alta (>3/dl), Gravedad específica (>1.025), Conteo celular (>5000/ul). Evaluación citológica: Neutrófilos degenerados, y se pueden ver bacterias. 70 Los agentes causales pueden alcanzar el espacio pleural mediante tres rutas: como resultado de la sepsis sistémica, la infección llega a la pleura mediante la linfa o la sangre; como resultado de la difusión desde estructuras contiguas (neumonía con comunicación broncopleural y difusión paraneumónica, ruptura esofágica, mediastinitis o infección subfrénica); mediante la introducción directa de organismos como resultado de trauma penetrante, cuerpos extraños, toracocentesis o cirugía. El aumento de la permeabilidad capilar crea un flujo coloide hacia la cavidad pleural que incrementa la presión oncótica pleural. Con la pérdida de un gradiente oncótico favorable, la extracción del líquido debe ser mantenida con los linfoductos regionales cuya eficacia puede verse comprometida por la fibrosis u obstrucción con detritos celulares e infecciosos. El examen de laboratorio de la efusión es el único medio definitivo para hacer la diagnosis; por lo tanto la pleurocentesis es necesaria. La presencia de organismos en las tinciones de Gram o para acidorresistentes y su posterior multiplicación en medios de cultivos son un requisito absoluto para el diagnóstico y la terapia definitivos. Presentación clínica. Los principales signos vinculados con el piotórax son fiebre, anorexia, perdida de peso y dificultad respiratoria. La naturaleza subaguda o aguda del proceso puede ser señalada por antecedentes de cirugía, hospitalización por una enfermedad en apariencia no relacionada o escape del hogar durante varios días. Microbiología. La tinción de Gram es el método más importante para la valoración rápida de los microorganismos en el líquido pleural. Hay una alta incidencia de infecciones por anaerobios, ya sea como patógenos solos o en combinación con organismos aeróbicos. Por este motivo es de extrema 70 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 59 Pneumothorax. 2003. En. importancia remitir muestras para ambos tipos de cultivos. Los anaerobios son capaces de generar un olor fétido, sobre todo debido a las aminas volátiles, ácidos grasos de cadena corta y ácidos orgánicos que producen. Terapia. El tubo de toracostomía se coloca tan pronto como se realice el diagnóstico. El drenaje toráxico se establece mejor con una succión continua con cierre hidráulico a casi 20 cm. La aplicación de succión continua es ideal y es fundamental para la remoción rápida y completa del exudado pleural infectado. La colocación de tubos sin este sistema tiene menores posibilidades de éxito. La extracción continua facilita la resolución veloz y plena de las bolsas infecciosas; Igual que para el tratamiento de cualquier cavidad abscedada, la resolución médica no puede tener lugar sin el drenaje completo del material infectado; los pacientes no mejorarán hasta que se establezca un drenaje eficiente. La restauración de la presión sanguínea y el volumen intravascular antes del tubo de toracostomía reduce bastante la incidencia de hipotensión o apnea durante el procedimiento. Por lo general no se requiere la transfusión con sangre entera porque el grado de anemia en estos enfermos no suele ser significativo. Después de la restauración del volumen, la colocación del tubo se realiza sin anestesia general. En los pacientes con ansiedad o que no cooperan se puede emplear una sedación narcótica en dosis baja antes del procedimiento. La misma debe ser muy cuidadosa; la reserva respiratoria en general es mínima y toda reducción del esfuerzo o impulso respiratorio por acción de la sedación puede tener consecuencias fatales. El examen citológico del líquido pleural debería realizarse con frecuencia para determinar la eficacia de la antibioticoterapia. Las tinciones de Gram pueden ser evaluadas cada 48 horas durante el curso del proceso. Este método suele fracasar en la identificación microbiológica después de 2 a 3 días. Los cultivos seriados se obtienen cuando los pacientes continúan elaborando una efusión infectada a pesar de la antibioticoterapia y cuando se advierten modificaciones en la morfología bacteriana de las preparaciones con Gram. En muchos pacientes la terapia se instituye con penicilina sintética parenteral en dosis moderadamente altas. Cuando el estado clínico mejora se puede cambiar por un producto bucal. La ampicilina es la droga de elección para la mayoría de las formas de infección pleuropulmonar con anaerobios. 71 71 ETTINGER, Op. cit., p. 1229 60 2.1.3.7 Quilotórax. Tabla 1. Quilotórax y pseudoquilo QUILOTORAX PSEUDOQUILO - Gran [ ] de quilomicrones y linfa,y se acumula en el espacio pleural - Proviene del conducto linfático toráxico - Fluido pleural de lechoso a blanco - Al ser centrifugado no se aclara el contenido - No contiene quilomicras - Se asocia con enfermedades toráxicas inflamatorias - Color lechoso - Se vuelve claro después de la centrifugación - Contiene colesterol y proteína lecitina, da un alto contenido de colesterol en suero. Fuente: http://www.vet.uga.edu/vpp/clerk/Rockwell/ Patofisiología Los lípidos en la dieta, que incluyen trigliceridos, colesterol y fospolipidos, sufren de 4 grandes procesos de asimilación. • El primer estado, la emulsificación, rompe los lípidos y los convierte en gotas. comienza en el estómago y continúa dentro del intestino delgado. En el estomago se romper los glóbulos de lípidos en pequeñas gotas las cuales pasan fácilmente al duodeno. Una vez que los lípidos pasan al intestino delgado, los ácidos de la bilis cubren y disminuyen la superficie de tensión de las gotas de lípidos, además reduce el tamaño de las gotas emulsificadas. • El segundo estado, es la hidrólisis, ocurre en el yeyuno. Las enzimas pancreáticas tales como la lipasa, la co-lipasa, colinesterasa y la fosfolipasa degradan los lípidos en las gotas emulsificadas a ácidos grasos no esterificados, monoglicéridos, colesterol y lisofosfolípidos. 61 • En el tercer estado la formación de micelas, los productos de la hidrólisis combinada con los ácidos de la bilis y los fosfolípidos forman las micelas, los cuales son hidrosolubles. • El cuarto estado es la absorción, durante la cual las micelas se difunden a través de las membranas apicales de los enterocitos en el yeyuno. Los ácidos de la bilis no entran en el entericito, pero son reabsorbidos en el ileon. Dentro de los enterocitos los lípidos son re-esterificados dentro triglicéridos y fosfolípidos. Los lípidos re-esterificados son combinados con colesterol, otros lípidos y proteínas para formas los quilomicrones. Los quilomicrones son pequeñas estructuras hidrosolubles con un núcleo hidrofobito, lípidos no polares y una cubierta exterior de lípidos polares. El conducto toráxico lleva los quilomicrones de la cisterna del quilo a la circulación venosa para la distribución a los tejidos. Figura 6. Quilotorax* *Efusión lechosa a blanca alrededor del corazón y los pulmones Fuente: http://www.vet.uga.edu/vpp/clerk/Rockwell/ Las efusiones pueden resultar de la salida de quilo de los vasos linfáticos intactos o de una perforación en el conducto toráxico. El quilotórax puede ser idiopático, pero varias causas están implicadas como lo son las cardiomiopatias, neoplasias mediastínicas y torácicas, granulomas mediastínicas, parásitos del corazón, defectos linfáticos congénitos, trauma, vomito crónica o tos crónica, linfangiectasia o ruptura de los vasos linfáticos, hernia diafragmática, torsión de lóbulos de pulmón y trombo venoso. La ruptura del conducto toráxico después del trauma fue una vez la única 62 causa de quilotórax, pero se ha visto que el mayoría de los pacientes se ha encontrado e el conducto intacto72. Presentación clínica y diagnóstico: La edad si se ve como un factor predisponentes, las causas idiopáticas y causas congénitas de quilo tórax tienden a ocurrir en perros jóvenes. El quilo tórax asociado a las neoplasias y los parásitos del corazón tienden a presentarse en perros viejos. Existen razas predispuestas a desarrollar quilo tórax como lo es la raza Mastiff y los afganos. El diagnóstico es realizado basado en el examen físico, los signos clínicos, la radiografía torácica y el análisis de fluido pleural. Los signos más comunes son disnea y tos. Otros signos incluyen perdida de peso, anorexia, letargia, regurgitación, vomito, intolerancia al ejercicio, nauseas y salivación. Los hallazgos físicos anormales incluyen comúnmente disnea, sonidos cardiacos, aumento de los sonidos broncovesiculares y taquicardia. La toracocentesis puede ser necesaria para estabilizar al animal. La suplementación de oxigeno y las radiografías dorsoventrales pueden ser requeridas dependiendo de el grado de disnea. La ultrasonografía y la ecocardiografía pueden ser útiles para identificar la causa fundamental de la efusión, tal como lo hace en la cardiomiopatía o neoplasia mediastínica. Figura 7. Radiografía de perro con quilotoráx Radiografía ventrodorsal de un perro con quilotorax ilustrando la efusión pleural Fuente: http://www.vet.uga.edu/vpp/clerk/Rockwell/ 72 BAIN J. Perry, et al. Chylothorax in dogs and cats. En: http://www.vet.uga.edu/vpp/clerk/Rockwell/ 63 El conteo de sangre completa puede revelar una neutrofilia madura debido a la inflamación y a la linfopenia por la perdida de linfocitos dentro del fluido. El perfil de química en suero puede revelar hipoalbuminemia, hiponatremia o hipercalemia. • La hipoalbuminemia resulta de una deficiencia de proteína y la frecuente eliminación de proteína en la efusión. • La hiponatremia puede resultar de la eliminación de electrolitos que se encuentran en el fluido (en el drenaje terapéutico de la efusión). • La hipercalemia puede ser debido a la hipovolemia y/o a defectos en la secreción de potasio por parte del riñón. El análisis del fluido pleural es requerido para el diagnostico del quilo tórax. La efusión es de color blanco lechoso o rosado, dependiendo del grado de hemorragia asociado con la efusión, además no debe de coagular o tener olor y debe ser libre de material. La recolección de del fluido dentro de un tubo con EDTA permite el conteo de células en la muestra. Un cultivo debe ser realizado, aunque el quilo es considerado bacteriostático. La efusión debe de formar una capa crema en la muestra quieta que esta en el tubo porque la quilomicra tiene una baja densidad y sobrepasa la superficie. En la centrifugación, la muestra debe volverse blanca después de la centrifugación si las células sanguíneas están presentes (aunque la presencia de eritrocitos bemolizados puede resultar en un fluido con restos de rojo o rosado después de la centrifugación) y debe ser opaco73. Características citológicas y químicas: Los análisis de laboratorio que pueden ser realizados al fluido incluyen la determinación de la gravedad específica, la concentración de proteína total, conteo total y diferencial de células, concentración de colesterol y triglicéridos, y la relación colesterol triglicéridos. Típicamente, hay un predominio de linfocitos pequeños; sin embargo, el aumento en neutrófilos y macrófagos puede ser asociado con la cronicidad. El aumento de los neutrófilos puede ocurrir como resultado del efecto irritante que causa la efusión 73 BAIN J. Perry, et al. Chylothorax in dogs and cats. En: http://www.vet.uga.edu/vpp/clerk/Rockwell/ 64 sobre la pleural o debido a repetidos drenajes terapéuticos de la efusión con una subsiguiente linfopenia periférica. Las efusiones de quilo se caracterizan por una concentración de colesterol que disminuye o que esta dentro los intervalos de referencia y por una concentración de trigliceridos elevadas en comparación a la que se encuentran en suero. En contraste, las efusiones de seudoquilo usualmente tiene concentraciones elevadas de colesterol, mientras que la concentración de triglicéridos es igual o menor que la del suero. La concentración de los triglicéridos puede aumentarse marcadamente en la efusión de quilo, ya que los quilomicrones están compuestos en gran parte por triglicéridos. Figura 8. Citología de quilotórax Citología de un quilo tórax crónico que contiene una mezcla de linfocitos pequeños, neutrófilos y macrófagos. (100X, Wright’s stain) Fuente: http://www.vet.uga.edu/vpp/clerk/Rockwell/ Diagnóstico diferencial: Anormalidades congénitas del conducto anormales, hernia diafragmática, infección por hongos, enfermedad de parásitos en el corazón (dirofilariosis) idiomático, torsión de lóbulos del pulmón, Linfangiectasia, neoplasia, y Trauma y ruptura del conducto toráxico. 65 Tratamiento y pronóstico: Depende de la causa de la efusión. La terapia medica como la quirúrgica ha sido usada. La terapia médica consiste en toracocentesis, manejo de dieta, y terapia con drogas. La toracocentesis permite el drenaje paliativo y mejora el distress respiratorio. Tradicionalmente se debe de suministrar al animal una dieta baja en grasa para disminuir la cantidad de lípidos absorbidos por vía intestinal, sin embargo, las perdida de vitaminas liposolubles, lípidos, y linfa rica en proteína puede contribuir a un estado de malnutrición en el animal. Los mecanismos de acción indicados de forma rutinaria incluyen, la salida de linfa de los vasos linfáticos, un aumento en la eliminación de proteína por medio linfático, aumento en la fagocitosis debido a la estimulación de los macrófagos, aumento en el reclutamiento de macrófagos por parte de los tejidos, y aumento de la proteolisis y de la eliminación de proteína por parte del tejido. El manejo quirúrgico típicamente es realizado en casos donde la terapia médica ha fallado. Las opciones quirúrgicas incluyen: Ligar el conducto toráxico: Las efusiones de quilo o sin quilo pueden continuar acumulándose después de ser ligado el conducto toráxico. La acumulación subcutánea de quilo ha sido reportada en perros después de ligar el conducto toráxico. La pleurodesis: es la formación de adhesiones entre las superficies pleurales parietal y visceral. Sustancias tales como la tetraciclina han sido infundidas para crear adhesiones. Desvió pleuroperitoneal o pleurovenoso: están asociados a complicaciones tales como las infecciones, las adhesiones y la obstrucción de los implantes. Una secuela común del quilo tórax es la pleuritis restrictiva, resultando en la inhabilidad de los pulmones para expandirse. El quilo irrita la superficie pleural; la exposición crónica de quilo puede causar un depósito de fibrina y una formación de 66 tejido conectivo en la pleura el cual causa la pleuritis restrictiva. Aunque el quilo tórax es raro, es un desorden fatal74 2.1.3.8 son: - Efusión pleural. Los mecanismos generales que causan efusión pleural Incremento de la presión hidrostática (falla cardiaca congestiva) Disminución de la presión oncótica – hipoalbuminemia (higado, GI, enfermedad glomerular) Aumento de la permeabilidad de la membrana capilar (piotorax, FIP) Obstrucción linfática / disfunción (neoplasia, quilotorax idiomático)75 La efusión pleural puede también resultar en el desarrollo de distress respiratorio de moderado a marcado. El manejo de la mascota con efusión pleural es dirigido a remover la efusión y de acuerdo al tratamiento adaptado se conocerá el diagnóstico final. Muestras de fluido deben ser tomadas para la evaluación citológica y el cultivo bacteriano. Las causas de la efusión pleural comúnmente incluyen la falla cardiaca congestiva, neoplasias, piotórax, neumotórax, hemotórax y quilotórax así como las causas comunes como la torsión de lóbulos pulmonares, pancreatitis o hernia diafragmática. Los agentes farmacéuticos usados en el tratamiento de la efusión pleural incluye diuréticos, antibióticos, quimioterapia, vitamina K / plasma fresco o congelado y otros.76 Hallazgos en el examen físico - Historia: distress respiratorio, intolerancia al ejercicio, a veces tos. Examen físico: taquipnea, distress respiratorio, sonidos del corazón amortiguados, aumento de los sonidos respiratorios a nivel dorsal. Diagnóstico: toracocentesis y radiografía torácica77 74 BAIN J. Perry, et al. Chylothorax in dogs and cats. En: http://www.vet.uga.edu/vpp/clerk/Rockwell/ FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / Pneumothorax. 2003. En. http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 76 DAY K, Thoma. Blood gas Analisis. En: Veterinary clinics of Norh America: Small Animals Practice WB. USA. Vol. 32 (2002). p 1075 77 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / Pneumothorax. 2003. En. http://education.vetmed.vt.edu/Curriculum/VM8754/respir/sdf/study/pleural.pdf 75 67 2.1.3.9 Fracturas de costillas y del tórax flotante. Se examina al animal en busca de fracturas; se deben de examinar de manera concisa para no obviar posibles lesiones internas más graves. Si se sospecha de fracturas de columna, se manipula al animal con mucho cuidado hasta que éstas se hayan estabilizado o se haya determinado radiográficamente que la columna vertebral está intacta. La presencia de fracturas sugiere que ha ocurrido un traumatismo de fuerza suficiente para infligir daño al tórax y a su contenido. 78 Con mayor frecuencia suceden en el tercio superior de la costilla en la zona cerca de la columna vertebral. Tales fracturas ocasionan un dolor muy vivo, en cuchillada, acentuado por los movimientos. Con motivo de este dolor los movimientos respiratorios pueden estar disminuidos tratando el animal de aliviarse, inmovilizando las costillas. La respiración puede hacerse rápida y superficial, perturbando este hecho la eficacia de los recambios gaseoso que pueden conducir a la hipoxia.79 Las complicaciones potenciales de las fracturas de costillas incluyen: - Neumotórax (debido a laceración pulmonar por los extremos cortantes del fragmento). Contusiones pulmonares. Hemotórax (por sangrado de vasos intercostales dañados, laceración pulmonar o exposición de la cavidad medular de la costilla). Pared torácica inestable (tórax flotante). El tórax flotante ocurre cuando dos o más costillas adyacentes se fracturan o dislocan dorsal y ventralmente, lo que produce el movimiento paradójico de un segmento de la pared torácica durante la respiración. Esto puede disminuir el volumen pulmonar y dañar las vísceras subyacentes conforme el segmento flotante se desplaza durante la respiración. Tratamiento: Las fracturas de las costillas se pueden estabilizar por fijación abierta con clavos y alambres. Otro método consiste en asegurar las costillas aun soporte externo por medio de colocación percutánea de suturas alrededor de las costillas .El 78 79 BIRCHARD, Op. cit., p. 705 ARCHIBALD, Op cit., p. 45 68 soporte se hace de varillas moldeables, las que se usan para construir férulas, que se contornean a la curvatura normal de la pared toráxica. Las barras se pasan sobre los lados dorsal y ventral del segmento flotante. Se colocan por lo menos dos suturas alrededor de las costillas del segmento flotante, dorsal y ventralmente, y se anudan al soporte para desplazar el segmento flotante en dirección lateral y hacia afuera. Por lo general no se daña al tejido pulmonar subyacente al pasar la aguja de sutura alrededor de la costilla, debido a la presencia del neumotórax. La posibilidad de dañar el pulmón puede reducirse al mínimo si se toma una costilla con las pinzas de campo y se retrae el segmento flotante lateralmente. El soporte se mantiene en posición por lo menos durante tres semanas. No se deben aplicar vendajes apretados para estabilizar costillas fracturadas, pues esto las desplaza medialmente y provoca daño continuo a las vísceras subyacentes, y las costillas cicatrizan en tal posición que el volumen pulmonar puede disminuir de manera permanente.80 Para estabilizar al animal se puede utilizar una venda de soporte. Figura 9. Vendaje de soporte Fuente: http://www.vin.com/proceedings/Proceedings.plx?CID=WSAVA2002&PID=2701 80 BIRCHARD, Op. cit., p. 709 69 La terapéutica auxiliar para la fractura de costillas incluye analgesia y bloqueo de los nervios intercostales para controlar el dolor, lo que promueve que no se inhiba la tos y que las respiraciones sean más profundas y menos restrictivas; esto ayuda a evitar la hipoventilación, atelectasia, retención de secreciones y neumonía. 81 2.1.3.10 Hernia diafragmática. La ruptura diafragmática consiste en el desgarro de dicho músculo, ocasionada por un traumatismo, como por ejemplo: caídas de altura, traumatismos automovilísticos, mordeduras de perros grandes, patadas, etc. Se puede dividir la ruptura del diafragma en: Aguda y Crónica - Aguda: Fisiopatología. La fisiopatología depende del grado de traumatismo y las lesiones que el mismo haya ocasionado; se puede tener: Secuestro visceral: El pasaje de las vísceras abdominales al tórax ocasiona: - - - 81 Ocupación: El pasaje de las vísceras abdominales al tórax, disminuye el espacio funcional de la cavidad torácica, limitando la expansión pulmonar y provocando atelectasia de los mismos. Esto lleva a una menor ventilación y a alteraciones en la relación ventilación-perfusión. Efusión: Se produce generalmente por alteraciones en el retorno venoso de las vísceras traslocadas, lo que altera el equilibrio hidrostático generándose un trasudado. Acúmulo de gas: El acúmulo de gas en el estómago o el intestino atrapado en el tórax puede generar una insuficiencia respiratoria severa por ocupación. Compromiso del tránsito gastrointestinal (Incarceración): La compresión de las vísceras abdominales puede provocar un cuadro de tipo obstructivo al impedir el normal pasaje del contenido gastrointestinal, produciendo en este caso sintomatología digestiva. Ibid., p. 709 70 - Compromiso vascular (Estrangulación): Se pude producir tanto en las vísceras huecas, como en las parenquimatosas (hígado y bazo); y se produce cuando el grado de compresión llega a un punto donde provoca compromiso del aporte sanguíneo, con la consecuente isquemia. manifestándose a través de un cuadro de abdomen agudo con signos de toxemia y/o shock endotóxico. Disminución de la presión pleural negativa. Provoca una menor expansión pulmonar y la imposibilidad de disminuir la atelectasia mediante los suspiros Fracturas costales. Las misma producen un intenso dolor con disminución del volumen tidal y por ende de la ventilación, Las fracturas costales también pueden ocasionar lesiones pulmonares perforantes. Colecta pleural. Se puede producir un trasudado, pero también se puede tener hemotórax, (ya sea por hemorragia torácica y/o abdominal) y neumotórax. Contusión pulmonar (antes mencionada) Otras lesiones ocasionadas por el trauma. Según el tipo de traumatismo y los órganos, aparatos y sistemas afectados por el mismo, tendremos sobre agregada la fisiopatología de dichas lesiones. Signos: Las principales manifestaciones de la ruptura de diafragma aguda son: disnea, shock y dolor - Crónica: Fisiopatología. La fisiopatología es más sencilla, ya que carece de los componentes del trauma agudo, dado que el mismo ya se ha resuelto. Disminución de la presión pleural negativa 71 Secuestro visceral (Ocupación, Efusión, Acúmulo de gas, Compromiso del tránsito gastrointestinal (incarceración) y Compromiso vascular (estrangulación) Edema Pulmonar. La reexpansión de los pulmones luego de la corrección quirúrgica ocasiona varios factores: - La presión positiva ocasionada por la ventilación a presión positiva intermitente incrementa la permeabilidad vascular. - La atelectasia crónica. - Disrupción de la integridad capilar. - Incremento de la permeabilidad capilar. - Disminución de las enzimas superóxido dismutasa y citocromo oxidasa mitocondrial, las que son responsables de neutralizar los radicales superóxido. - Colapso vascular. - Anoxia local. La reoxigenación provoca la liberación de radicales superóxido que incrementan la permeabilidad capilar. Signos. Las manifestaciones de la ruptura diafragmática crónica son: disnea, intolerancia a ejercicio, anorexia, depresión, vomito, diarrea, perdida de peso. Examen clínico: Al examen clínico se pueden encontrar diversos signos: Mucosas pálidas, grises o cianóticas TLLC aumentado, FR aumentada, FC aumentada Auscultación (Atenuación sonidos pulmonares arritmias,borborismos Percusión matidez o hiper-resonancia 72 y cardíacos, Diagnostico: Contraste gastrointestinal: Cuando existen dudas diagnósticas si las vísceras que se encuentran en el tórax son el estómago o los intestinos es de gran ayuda la realización de un tránsito gastrointestinal con bario, revelando la presencia intratoráxica de dichos órganos. Ecografía: Mediante la ecografía, se puede visualizar la disrupción en la línea diafragmática, como también ver desplazamientos del hígado y/o del bazo. Diagnóstico diferencial: Efusión pleural, Neumotórax, Neumonía, Hernia Peritoneo pericárdica, Hernias hiatales y otras patologías con sintomatología GI o respiratoria82 2.1.3.11 Hernia diafragmática peritoneopericardica. Esta afección congénita suele constituir un hallazgo incidental en pacientes geriátricos que son examinados radiológicamente por otros motivos. No se la conoce como una anomalía adquirida; esto debería ser recordado cuando se debaten las relaciones causales de los signos en los pacientes gerontes. En las radiografías, la silueta cardíaca puede aparecer como una estructura globular de localización central. Puede haber sombras de gas cuando hay asas intestinales o se ven densidades granulares que representan la ingesta.83 2.1.3.12 Frenoplejia. La parálisis del diafragma es la disfunción de mayor importancia clínica y puede representar un fenómeno unilateral o bilateral y permanente o transitorio. La inervación se efectúa mediante los nervios frénicos que se originan en las raíces cervicales de C4-C7. La disfunción proviene de la disrupción de las vías frénicas en cualquier parte entre su origen y el diafragma. La frenoplejía unilateral puede estar causada por la transección traumática o quirúrgica, lesiones infiltrativas o en masas y desórdenes neuropáticos. La frenoplejía bilateral suele estar inducida por trauma raquídeo cervical, pero los problemas ya mencionados también la pueden ocasionar. 82 83 ROHR A, Adrian. Ruptura diafragmatica. En: http://www.aamefe.org.ar/ruptura_diafr_fel.htm ETTINGER, Op. cit., p. 1252 73 Los pacientes con parálisis unilateral rara vez son sintomáticos y la diagnosis puede ser un hallazgo incidental. La forma bilateral puede causar disnea y ansiedad importantes. El diagnóstico de la frenoplejía puede ser inferido a partir del cuadro clínico y las manifestaciones radiológicas de un diafragma desplazado hacia craneal.84 2.1.3.13 Hemomediastino. Los perros pueden sufrir hemorragia mediastinal secundaria a trauma, cirugía torácica o coagulopatías. Como tal, el hemomediastino casi siempre representa una patología médica y no justifica la exploración quirúrgica. 2.1.3.14 Edema mediastínico. El edema aparece en el mediastino como fenómeno secundario a procesos infecciosos y traumáticos, así como insuficiencia cardíaca y linfangiectasia. 2.1.3.15 Mediastinitis. Mediastinitis comprende todo proceso productor de inflamación dentro del espacio mediastinal. Mediastinitis aguda. La mediastinitis aguda suele provenir de la perforación o ruptura traqueal o esofágica. El cuadro inusualmente puede reconocer origenes en sepsis, neumonía, pericarditis o empiema. Si no se trata de manera adecuada la mediastinitis puede progresar al absceso, el cual suele evolucionar hasta el empiema franco. La mediastinitis puede ser reconocida luego del drenaje cerrado, mediante el tubo de toracostomía, de un piotórax encapsulado. Mediastinitis crónica. La mediastinitis granulomatosa deriva de infecciones causadas por una serie de agentes. Histoplasma, Cryptococcus, Coccidioides, Actinomyces y Nocardia son los organismos encontrados con mayor regularidad. La pericarditis, epicarditis e incluso miocarditis pueden complicar el curso clínico de la mediastinitis. Los abscesos y los granulomas pueden imitar una neoplasia mediastinal. 85 84 85 Ibid., p. 995 Ibid., p. 1022 74 2.1.3.16 Neumomediastino. Es la presencia de aire dentro del mediastino, puede ocurrir como suceso espontáneo, secundario a trauma, como resultado de una ventilación mecánica o en relación con maniobras diagnósticas y terapéuticas. El aire puede ingresar en el mediastino mediante varias rutas, el aire es transmitido desde las vías o espacios aéreos hasta el intersticio desde donde se encamina hacia el hilio para ocupar por último el mediastino aparece en forma aislada o en combinación con el neumotórax. El neumomediastino puede estar generado por un escape pulmonar primario o como secuela de la ruptura de la pleura mediastinal. En las radiografías se pueden observar estructuras mediastínicas que normalmente no se visualizan (aorta, venas cava y ácigos y esófago). Asimismo; puede haber enfisema subcutáneo y los planos fasciales del cuello y tren anterior también se hacen evidentes en las radiografías. La compresión de las grandes venas produce disminución del retorno venoso. El neumotórax agudo, que puede ser a tensión, ocasiona disnea manifiesta. 2.1.3.17 Ruptura aórtica: La ruptura aórtica torácica es una lesión por desaceleración, localizados fundamentalmente en puntos de fijación de la aórta (área distal del origen subclavia izq. y en porción ascendente inmediatamente distal a la válvula aórtica. El tratamiento es quirurgico cuyo objetivo es el impedir la ruptura → reparar puerta de entrada → sustituir V Ao y reimplantar coronarias cuando sea necesario. La cirugía generalmente se realiza mediante injerto endovascular86. 2.1.3.18 Trauma toráxico romo. El trauma no penetrante es una causa sustancial de disfunción torácica seria y fatal en los animales. Si bien una preponderancia de estas injurias proviene de los traumas por automóviles, otros eventos tales como caídas, puntapiés y lesiones deportivas pueden ser causales en muchos casos. El trauma toráxico romo puede ser responsable por una serie de daños que ocurren solos, o en combinación: Lesiones pulmonares (contusión, laceración o hematoma), disrupción de la pared del tórax, fractura del árbol traqueo-bronquial, ruptura del diafragma y hemotórax, neumotórax o neumomediastino. 86 BELTRAN, Rafael. Anestesia, reanimación y terapeutica al dolor: Cirugia aorta. En: http:/chguv.san.gua.es/ descargas/AreaMedica/servQuir/AnesRes/BELTRAN_Cir_aorta_CHGUV151105PPS256 75 El término aleteo (o sacudida) toráxico se refiere a la disrupción de la pared con fracturas lineales múltiples de costillas y movimiento segmentario paradójico asociado de la sección fracturada. Las fracturas de costillas o esternales múltiples en esencia aíslan la herida del resto de la pared toráxica permitiéndole un movimiento independiente durante la respiración. Este fenómeno reduce eficazmente la presión transpulmonar y lleva a hipoventilación. Esto se ve complicado aún más por cualquier proceso que reduzca la distensibilidad pulmonar, como hemorragia, contusión o edema. El tratamiento del aIeteo toráxico está determinado por el estado respiratorio del paciente y las injurias concomitantes en el tórax. La narcoanalgesia combinada con el bloqueo de nervios, intercostales suele reducir la disnea y aumenta la cooperación del paciente para el manejo de la injuria. Los segmentos de aleteo en general curan sin reparación quirúrgica. La fijación interna de las fracturas de costillas con clavos o alambres K puede ser útil en la estabilización de los segmentos con hemisacudida. Con frecuencia las complicaciones concurrentes como el hemotórax y neumotórax son de mayor importancia clínica. 87 2.1.3.19 Traumas Internos pulmonares ocasionados por inhalación o aspiración de materiales nocivos. Al respecto se discuten la neumonía por aspiración, el preahogamiento y la inhalación de humo. Neumonía por aspiración: La neumonía por aspiración ocurre cuando un material extraño es inspirado dentro de los pulmones. La aspiración puede suceder por la falta de mecanismos protectores normales o en forma iatrogénica (administración de alimentos, medicaciones o compuestos diagnósticos mediante tubos estomacales, de faringostomía o nasogástricos colocados en forma incorrecta en el interior de la tráquea). La aspiración puede ocasionar signos respiratorios a causa de muchos mecanismos incluidos la obstrucción física de los pasajes aéreos grandes o pequeños por detritos, inflamación en respuesta al ácido gástrico, partículas de alimento, aceite mineral u otros materiales reactivos, infección bacteriana, daño 87 ETTINGER, Op. cit., p. 997 76 químico del epitelio respiratorio, disminución de la distensibilidad pulmonar y broncoconstricción. La intensidad de los signos depende de las características del material aspirado. La exploración física detecta crujidos y a veces sibilancias en especial en los campos pulmonares. Puede haber fiebre. La evaluación diagnóstica se realiza por medio de radiografías torácicas, análisis del lavado traqueal muestra una inflamación aguda o crónica e identificación de bacterias indicándose cultivos antibiogramas .La broncoscopia puede realizarse para extraer grandes fragmentos de material extraño. La endoscopia se indica sólo si se sospecha de obstrucción de las vías aéreas grandes. El hematocrito, concentración proteica, estado electrolítico, medición de gases en sangre son útiles para el cuadro de urgencias. Los pacientes afectados requieren suplementación de O2, ventilación a presión positiva, fluido terapia EV, succión o broncoscopia si existe material en vías aéreas superiores.88 Preahogamiento: ocurre como resultado de la inmersión en agua. Las concentraciones de CO2, en la sangre se incrementan, estimulando el trabajo respiratorio. En la mayoría de los casos sucede la aspiración que ocasiona daño pulmonar grave. En un porcentaje reducido de casos, el laringospasmo impide la aspiración de agua. Se produce ahogamiento seco sin daño pulmonar. El daño pulmonar ocurre por una serie de mecanismos. El agua dulce que alcanza los alvéolos diluye el surfactante, con el resultante colapso alveolar y disminución de la distensibilidad. El agua salada es hipertónica y hace que el líquido intersticial difunda hacia los alvéolos (ahogamiento secundario), contribuyendo al lleno alveolar; El resultado de ambas circunstancias es la anormalidad ventilación/perfusión o cortocircuitos pronunciados. La neumonía por aspiración puede darse por la inhalación del vómito y de detritos o sustancias químicas dentro del agua. En ésta puede haber bacterias con potencial de originar infecciones complicadas. El síndrome de aflicción respiratoria del adulto (SARA) puede ser secundario al preahogamiento. El examen físico en general revela la pérdida de la conciencia y disnea marcada o apnea. El choque cardiovascular e hipotermia son comunes y el pulso es difícil 88 Ibid., p. 984 77 de palpar. La auscultación pulmonar revela crujidos intensos y tal vez sibilancias. El estado neurológico se supervisa de cerca por signos de edema cerebral. La primera prioridad en estos animales es la estabilización. Lograda ésta, las radiografías torácicas son útiles para determinar el alcance de la afección. El estado sistémico se vigila con el hemograma y con el panel de bioquímica sérica. Se indica el control cardiaco con ECG. Para el tratamiento, la ventilación debe iniciarse lo antes posible, la reanimación boca- a –hocico puede iniciarse en el sitio del accidente. La fluido-terapia permite tratar el choque y mantener el volumen minuto. El pronóstico depende del estado del paciente; los indicadores de un pronóstico malo son el coma, el pH menor de 7 y la necesidad de reanimación.89 Inhalación de humo: El daño pulmonar debido a la inhalación de sustancias químicas puede suceder durante la exposición a contaminantes, ambientes mal ventilados, escapes de motores a gasolina o diesel, funcionamiento inadecuado de calentadores y varias otras causas. La fuente de inhalación registrada con mayor regularidad es el fuego. La inhalación de CO provoca la formación de carboxihemoglobina con desplazamiento del 02, desde la hemoglobina ⇒ El resultado es la hipoxia tisular. La inhalación de altas concentraciones de CO, puede causar acidosis intensa. El calor del aire inhalado puede dañar las vías respiratorias altas hasta el nivel de la laringe, y la inflamación y el edema resultantes pueden causar obstrucción aérea superior. La presencia de quemaduras alrededor de la cara, vibrisas chamuscadas, inflamación bucal y secreción nasal o salival con tizne son indicativas de una exposición a la inhalación de humo. La ausencia de estas señales no elimina la posibilidad de una exposición significativa. Las membranas mucosas pueden ser de color rojo brillante debido a la carboxihemoglobina o cianóticas. 89 Ibid., p. 986 78 El diagnóstico mediante radiografías torácicas, son de particular valor para seguir la progresión y resolución lesional, análisis del lavado traqueal o broncoscopia permiten el estudio citológico y microbiológico del área. Para el tratamiento una vía aérea permeable es esencial y los pacientes con laringenfraxis90 (obstrucción o cierre de la laringe)91 pueden requerir traqueostomía. La suplementación de O2, humectación de vías aéreas y fisioterapia. Uso de broncodilatadores, antibioticoterapia (confirmación de una infección), La fluidoterapia EV (mantener el volumen minuto). 2.1.3.20 Traumatismo perforante. El traumatismo perforante por lo general es resultado de un disparo de bala. También puede ser causado por un instrumento filoso (p. ej., cuchillo, desarmador, estaca, flecha) o por una mordida profunda infringida por un perro grande a un perro pequeño. Se debe de conocer el tipo de proyectil, el punto de entrada y la ruta seguida por el objeto penetrante cuando se determine la presencia de traumatismo toráxico, incluso si el punto de entrada es distante a la cavidad torácica. La ruta del proyectil puede alterarse si choca contra estructuras óseas. Con frecuencia no es muy claro si el daño toráxico se ha producido como consecuencia de la herida penetrante. Dependiendo de la extensión de la lesión, pueden desarrollarse lentamente signos de colapso vascular o dificultad respiratoria en pacientes que han sufrido lesiones penetrantes del tórax.92 2.1.4 Signos y diagnostico en trauma torácico 2.1.4.1 Signos que prevalecen en traumatismos torácicos Los perros que sufren traumatismo toráxico por lo general son presentados para evaluación de taquipnea o disnea (dificultad respiratoria). El animal puede parecer 90 Ibid., p. 987 STUDDERT P., D.C. BLOOD, Op. cit., p 617 92 BIRCHARD, Op. cit., p. 703 91 79 ansioso o inquieto. El inicio de los signos clínicos de traumatismo toráxico puede retrasarse sobre todo cuando se asocia a hernia diafragmática. El choque hipovolémico puede resultar de hemorragia interna o externa o de la acumulación de liquido en los espacios tisulares. El animal que sufre de choque hipovolémico presenta incremento en la frecuencia respiratoria, pulsos arteriales periféricos débiles, extremidades frías y membranas mucosas pálidas. Con frecuencia sé le ve deprimido o en estupor. Se pueden observar signos gastrointestinales (diarrea o vómito debido a obstrucción) si una porción del aparato gastrointestinal se ha desplazado hacia la cavidad torácica a través de una hernia diafragmática. Comúnmente estos signos no ocurren de inmediato.93 Cuando un animal presenta un trastorno respiratorio, el conocimiento de la duración puede ayudar en el diagnóstico; la aparición brusca de una disnea fuerte señala frecuentemente al neumotórax, mientras que la ruptura del diafragma da como resultado una molestia respiratoria de evolución lenta.94 Taquipnea, hiperpnea y disnea. La taquipnea, también conocida como polipnea, hace referencia al incremento de la frecuencia respiratoria pero no es una indicación de disnea. Esta normalmente precede a la disnea. Es importante diferenciar la taquipnea asociada con disnea de la taquipnea por funciones fisiológicas como el jadeo normal, ejercicio, hipertermia o ansiedad.95 También se puede manifestar un aumento en la profundidad de la respiración (hiperpnea), la cual aparece en las alteraciones de los gases sanguíneos (aumento del dióxido de carbono, disminución del oxígeno, disminución del pH) Mientras que la taquipnea puede ser documentada por la frecuencia respiratoria, para la hiperpnea se deben buscar signos secundarios. Esto es porque la profundidad de la respiración es comúnmente medida como volumen tidal, o el volumen de aire que se toma durante una inspiración normal en reposo. Los signos de hiperpnea pueden ser: 93 Ibid., p. 704 ARCHIBALD, Op. cit., p. 42 95 ETTINGER, Op. cit., p. 182 94 80 Ojos abultados, temblor muscular durante la inspiración, tensión de los músculos del cuello, renuencia a acostarse o a echarse , o de pie con los miembros toráxicos en abducción y o la presencia de un aumento inusual de la temperatura de la nariz. Para poder documentar estos signos se puede producir una acidosis respiratoria al contener la respiración del animal por 15 segundos; luego se debe de contar el número de respiraciones x los 15 segundos después.96 El termino disnea o aflicción respiratoria en pacientes veterinarios se define como el grado inapropiado de esfuerzo respiratorio, basado en la valoración de la frecuencia, ritmo y carácter de la respiración. La disnea puede ser de esfuerzo, paroxístico o continúa dependiendo de la causa y alcance de la anormalidad.97 La disnea causada por enfermedades respiratorias también puede dividirse en tres categorías: Enfermedad pulmonar obstructiva, enfermedad pulmonar restrictiva y enfermedad vascular pulmonar. La obstrucción del flujo de aire puede ser: endomural, tal como la acumulación de moco dentro de los bronquiolos con bronquitis; mural, tal como la hiperplasia de la mucosa en bronquitis crónica o construcción del músculo liso en el asma; y extramural, tal como la compresión dinámica de las vías respiratorias en el colapso traqueal o la presencia de una masa en las vías aéreas. Las enfermedades respiratorias restrictivas son las que limitan la expansión de los pulmones, algo que también se presenta en las alteraciones del parénquima pulmonar o en enfermedades de la pleura, de la pared del pecho o el aparato neuromuscular. El esfuerzo respiratorio se acentúa durante la inspiración. Estas enfermedades se caracterizan además por un pequeño volumen que queda a nivel pulmonar (reducida la capacidad vital) y la resistencia de las vías respiratorias normales. Las más comunes se deben a la limitada expansión de los pulmones que resulta de enfermedades que envuelven el espacio pleural (neumotórax, efusión pleural, tumores de la pared torácica). La fibrosis pulmonar y el edema pulmonar intersticial. Estas enfermedades alteran las propiedades elásticas del intersticio pulmonar, lo cual reduce la capacidad pulmonar. 96 97 HAMLIN, Op. cit., 1177 ETTINGER, Op. cit., p. 183 81 Existen enfermedades que pueden estar dentro de 2 o tres de las categorías de las enfermedades respiratorias. Por ejemplo el edema pulmonar fulminante: Una vez las fuerzas causan la extravasación del fluido de las venas pulmonares excede la responsabilidad de la reabsorción de fluido y se desarrolla el edema. Un defecto restrictivo es reconocido debido a la alteración de las propiedades elásticas del intersticio pulmonar causado por la acumulación del fluido. En un edema continuo se acumula fluido en el intersticio, el cual eventualmente fluye hacia los alvéolos y las pequeñas vías respiratorias. La disnea puede ser clasificada según la fase del ciclo respiratorio como inspiratoria o espiratoria o ambas (mixta). La taquipnea es típicamente asociada tanto con la disnea inspiratoria como con la espiratoria. La disnea mixta ocurre cuando el esfuerzo respiratorio se realiza en las 2 etapas del ciclo respiratorio. Las enfermedades respiratorias obstructivas causan disnea inspiratoria o espiratoria, dependiendo de la localización del impedimento que exista en el flujo de aire; las obstrucciones extra-torácicas causan disnea inspiratoria y las obstrucciones intratorácicas causan disnea espiratoria. 98 Ciertas razas están predispuestas a condiciones que causan la disnea: Razas braquiocefálicas (razas de cara corta “chatos” como son el Bulldogs y Boston Terriers) están predispuestos a problemas respiratorios superiores, tal como nariz estrecha, parálisis laríngea y paladar blando, donde ellos tienen problemas para llevar el aire hacia las vías respiratorias. Por supuesto, las razas braquiocefálicas frecuentemente presentan un ruido al respirar debido a la forma de su cara y cuello, pero la dificultad respiratoria puede ser exacerbada y se puede convertir en seria cuanto el animal es expuesto a stress o a climas calientes o húmedos, bajo anestesia, o en fiebre y-o excesiva excitación. Perros de razas largas y gigantes (ej. El Doberman pinschers, gran danés) están predispuestos a adquirir una cardiomiopatia y falla cardiaca congestiva. 98 KUEHN F. Ned. Diagnostic Approach to respiratory causes of dyspnea. En: htp://www.michvet.com/articles/internal_medicine/Diagnostic%20Approach%20to%20Dyspnea.asp 82 La parálisis laríngea congénita se ve repetidamente en ciertas razas de perros (Siberian Husky, Bouvier des Flanders, Bull terrier, Leonberger). Perros de razas pequeñas están predispuestos a colapso traqueal, bronquitis crónica y enfermedad crónica de la válvula mitral, la cual impide el funcionamiento normal de las válvulas del corazón. Traqueobronquitis infecciosa (Kennel cough) es común en perros (todas las razas) que se encuentran en perreras o en lugares en que hay hacinamiento de los mismos. 99 Durante la inspección si se observa una respiración rápida, superficial y entrecortada puede ser resultado de restricción de la pared torácica debido a fracturas dolorosas de costillas. Se puede observar disminución de movimiento del hemitórax (fijación) del lado en el cual se han herniado las vísceras abdominales a consecuencia de la ruptura diafragmática. La herniación del pulmón hacia el espacio intercostal con cada respiración indica ruptura de los músculos intercostales100. 2.1.4.2 Diagnostico en traumatología torácica Un test diagnóstico es necesario para determinar las posibles alteraciones ocasionadas por el trauma, ya que varios signos son poco notorios y pueden comprometer la vida del animal. El test debe incluir los siguientes datos: - Historia médica completa y examen físico (ver capitulo examen clínico orientado al trauma de torax). - Ayudas diagnósticas: 99 Pet place veterinarians. Dyspnea in dogs articles/artShow.asp?artID=43=&infections+pulmonary 100 BIRCHARD, Op.cit., p. 704 83 (2005) En: http://petplace.nestcape.com/ 2.1.4.2.1 Radiografías del tórax. La radiografía es un método diagnóstico de alta efectividad a la hora de evaluar el corazón, los pulmones, el espacio pleural y la pared toráxica. Se deben evaluar los cambios en la radiopacidad del parénquima pulmonar. El patrón de cambio se debe definir entre localizado y generalizado, y entre solitario, múltiple o difuso. El patrón define la ubicación de los cambios (alveólos, bronquios, intersticio y vasos sanguíneos). - Patrón alveolar: Los alveólos están llenos de detritus o colapsados, entonces se observa una radiopacidad difusa. Se puede observar el broncograma aéreo (el bronquio se observa mejor), con vasos sanguíneos mal definidos. Las causas más comunes son bronconeumonia, atelectasia por neumotórax, contusión pulmonar y edema pulmonar. - Patrón intersticial. Por el llenado del intersticio (septos alveolares e interlobares) de fluido, exudado, fibrosis o, asas (neoplasias). Puede ser nodular (nódulos > 5mm), reticulonodular o linear. Se presenta en edema intersticial, neumonia intersticial, neumonia eosinofilia, hemorragia intersticial, fibrosis pulmonar o neopalsia (primaria o metastásica). - Patrón bronquial: La pared bronquial esta engrosada o irregular; por la presencia de fluido o infiltrados celulares, se observa el signo de dona (visualización de bronquios terminales). En casos de bronquitis crónica y bronquiectasia. - Patrón vascular. Agrandamiento de arterias y venas, por sobrecirculación (anastomosis izquierda a derecha, como la persistencia del ducto arterioso, defectos del septo atrial o ventricular) hipervolemia. Aumento exclusivo de arterias por dirofilariosis, enfermedad tromboembólica e hipertesión pulmonar. Aumento exclusivo de venas por falla del corazón izquierdo (congestión). 84 No es raro que estos patrones se vean mezclados, como en el edema pulmonar, en el cual se observa combinación de patrón alveolar e intersticial.101 Es recomendable retrasar la toma de radiografías toráxicas de animales lesionados hasta que se hayan estabilizado, mediante el tratamiento de urgencia, las alteraciones de alta prioridad, como el choque. Se evalúa el espacio pleural cuidadosamente en busca de líquido, aire o vísceras abdominales, y se valora la integridad de la silueta diafragmática. Se buscan datos radiográficos de fractura o luxación de las estructuras esqueléticas, así como la presencia de enfisema subcutáneo, el cual indica penetración de aire hacia este espacio, ya sea ambiental, de la cavidad toráxica o de una vía aérea importante. Cuando hay neumomediastino, el aire permite observar las estructuras mediastínicas y esto indica ruptura traqueo- bronquial. Si el estado del paciente lo permite, se recomienda tomar dos proyecciones radiográficas. Con frecuencia es difícil identificar la presencia de una hernia diafragmática en las radiografías de tórax, particularmente cuando la silueta de este órgano está oculta por la acumulación de líquido en el espacio pleural. Si hay una gran cantidad de líquido pleural, se extrae y se repiten las radiografías. Las observaciones que sugieren la presencia de hernia diafragmática incluyen: desplazamiento craneal del estómago, pérdida de la silueta caudal del hígado y la presencia de vísceras llenas de gas dentro de la cavidad torácica. Cuando se sospecha hernia diafragmática y no se confirma en las radiografías simples, se debe considerar la peritoneografia con contraste positivo o ultrasonido abdominal102. 101 TAMAYO, Arango Lynda. Examen del aparato respiratorio en caninos http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf 102 BIRCHARD, Op. cit., p. 705 85 y felinos. En. 2.1.4.2.2 Ultrasonografia. La sonografía toráxica esta limitada por las barreras de transmisión ultrasónicas causadas por el pulmón por estar lleno de aire, por el aire dentro de la cavidad pleural y por el componente óseo que hay en el tórax. La ultrasonografía puede ser útil para detectar y caracterizar: fluidos pleurales, enfermedades pulmonares, mediastínicas además permite el examen de la integridad del diafragma. La ultrasonografía es usada de manera rutinaria durante la toracocentésis para ayudar a posicionar la aguja en el lugar correcto de manera segura. Técnicas: Los pacientes pueden ser posicionados de manera lateral, esternal o dorsal o pueden ser escaneados cuando se encuentran de pie, la aproximación usualmente determina la localización de la patología hallada en las radiografías torácicas. El posicionamiento esternal o de pie del animal, son preferibles cuando el animal presenta inconformidad o compromiso respiratorio. Una apropiada rasurada del área es necesaria para luego poder aplicar el gel acústico. El fluido pleural permite una excelente ventana acústica para la visualización de las estructuras intra-torácicas. Cuando hay grandes efusiones, cualquier ventan puede ser efectiva. - Pared corporal y superficie pulmonar: la ultrasonografía por medio de la vía intercostal produce una imagen del tejido subcutáneo, musculatura intercostal, pleura parietal la cual recubre el tórax y la pleura visceral que recubre la superficie pulmonar. La grasa subcutánea y el tejido conectivo son totalmente ecogénicos, en la profundidad están los músculos intercostales delgados los cuales son vistos como tejido relativamente hipoecóico. Al menos que un transductor de alta frecuencia sea utilizado, o transductores capaces de tener un campo visual de alta resolución (transductores convexos, lineales o microconvexo), estos tejidos no pueden ser vistos. La pleura parietal es reconocida como una estructura delgada, ecogénica y lineal. La superficie pulmonar es también visto como una línea ecogénica lisa, delgada que se encuentra adyacente a la pleura parietal. Al deslizarse de aquí para allá a través de la superficie parietal durante la respiración, se puede observar el movimiento respiratorio, este término es conocido como “signo de 86 deslizamiento”. La apariencia de una superficie pleural empedrada o áspera se observa en casos de: pleuritis, carcinomatosis, efusión pleural crónica y algunas enfermedades pulmonares. El pulmón tiene una apariencia muy característica debido al artefacto de reverberación creado como un reflejo ultrasonográfico fuerte de la superficie de los pulmones llenos de aire. Una serie de reflejos que resultan entre la superficie pulmonar y el transductor crean una serie de ecos lineales altamente ecogénicos conocidos como artefacto de reverberación. - Mediastino craneal: es difícil de ver en un paciente normal y en casos en los cuales solo pequeñas lesiones están presentes, o si el fluido pleural esta ausente. Las masas mediastínicas que son suficientemente grandes entran en contacto con la pared torácica son fácilmente vistas en una aproximación intercostal. En la presencia de fluido pleural, el mediastino normal en un animal delgado es muy delgado, ecogénico y claro. Cantidades de grasa ecogénica pueden estar presentes, y esto aumenta el grosor presente. Los vasos sanguíneos aparecen con facilidad. - Diafragma: El diafragma se ve de manera rutinaria en la vía al abdomen (aproximación subcostal) usando el hígado como ventana acústica. Normalmente es difícil ver el diafragma como una estructura de alta ecogenicidad separada de la superficie pulmonar adyacente. El diafragma aparece como una estructura muy ecogénica, delgada y curvilínea unida a la superficie craneal del hígado. El artefacto de imagen en espejo se ve usualmente, con la ilusión de hígado sobre el lado toráxico del diafragma. La presencia de fluido pleural permite el análisis fácil del diafragma tanto por la aproximación subcostal vía del hígado como por la vía intercostal, la ventana cardiaca o paraesternal, como el fluido sirve como un buen “telón“ para la silueta delgada y ecogénica del contorno liso del diafragma. Patología: La presencia de fluido pleural (Efusión Pleural), particularmente moderado o en grandes cantidades, aumenta mucho la habilidad de poder observar las estructuras intra-toráxicas. Esto es contrario a la radiografía, donde la anatomía normal es imperceptible. 87 La grasa mediastínica y los vasos, aparecen con facilidad sobre las superficies del corazón, pulmón y diafragma. Ocasionalmente, el esófago, la tráquea y los bronquios mayores se ven. La efusión pleural se reconoce como un material anecóico o ecogénico dentro del espacio pleural, entre la pared toráxica o el diafragma y el pulmón. Trasudado o trasudado modificado de origen reciente son generalmente anecóicos mientras que los exudados, hemorragias o carcinomatosis son más ecogénicas. Efusiones crónicas pueden inducir a la formación de fibrina, la cual se ve como hilos ecogénicos, irregulares y lineares que flotan dentro del fluido. Efusiones moderadas o las grandes efusiones son reconocidas inmediatamente por cualquier ventana dentro del tórax. Los pulmones y el corazón pueden estar literalmente flotando. Cuando la cantidad de fluido aumente, el volumen pulmonar disminuye, hasta el punto de atelectasia total. Pequeñas cantidades de fluido pueden ser difíciles de detectar. La acumulación asimétrica de fluido puede ser difícil o imposible de detectar en un examen ultrasonográfico a menos que tenga su localización la cual es obtenida por la radiografía toráxica. Los ejemplos incluyen: hemorragia focal por trauma, enfermedades pleurales (inflamación secundaria por la migración de cuerpos extraños o por procesos neoplásicos que envuelven la pleura o las costillas). La contribución de las radiografías toráxicas para el éxito de la ultrasonografía del tórax pueden no dar demasiado énfasis.103 2.1.4.2.3 Toracocentesis. Si está indicado, se efectúa toracocentesis para obtener una muestra de líquido pleural o para drenar el aire del espacio pleural. Se analiza el líquido en busca de la presencia y concentración de eritrocitos y proteínas plasmáticas. Puede ser que el líquido sea sangre completa o una combinación de transudado, exudado, quilo o sangre, dependiendo de la gravedad y duración del daño o de los órganos afectados. Se centrifuga una muestra del líquido y se examina microscópicamente la porción celular para descubrir la presencia de 103 CRAIG Cornell- RVT, VTS. Cardiology veterinarian technician:Cardiac anatomy and physiology. En: American Animal Hospital Association(AAHA) 70th Annual meeting scientific, Management, Veterinary Technician and Service Skills programs. 88 neutrófilos degenerados, bacterias y materia orgánica. Estos datos pueden sugerir un proceso inflamatorio intenso y posible perforación del esófago o del aparato gastrointestinal. En raras ocasiones puede haber ruptura del sistema biliar y hernia diafragmática, lo cual se identifica al determinar la concentración de bilirrubina en el líquido pleural. 104 Es un procedimiento inocuo, no causa daño y se puede realizar cuantas veces sea necesario. Tiene como finalidad obtener secreciones torácicas, ya sean exudados o trasudados o de cualquier naturaleza para analizarlos. Cuando hay líquidos en el tórax, a la percusión se produce un sonido mate. Los líquidos presentes pueden ser así: Inflamatorio: En casos de pleuritis pueden ser serosos, serofibrinosos, fibrinosos, purulentos, pútridos o icorosos. Líquidos de trasudación: En procesos no inflamatorios, como hidrotórax, que siempre es bilateral y generalmente hay ascitis simultánea (en caninos viejos). Estasis hemático: Insuficiencia cardíaca, dilatación. - Hipoproteinemia: la sangre se licúa, pierde viscosidad y coagula con dificultad. - Compresión de vasos sanguíneos venosos grandes por tumores, abscesos, quistes y ganglios infartados Líquidos Intermedios: Entre trasudado y exudado; por estrangulación de hernias diafragmáticas. Sangre: Hemotórax, hemorragias severas. Se debe realizar una percusión vertical para determinar el nivel de los líquidos presentes en el tórax (macicez horizontal). 104 BIRCHARD, Op, cit., p. 705 89 Según sus propiedades químicas, los líquidos que se pueden obtener por toracocentesis son diferentes: Tabla 2. Características de Exudado y Trasudado EXUDADO TRASUDADO Densos, oscuros y turbios Claros, limpios y transparentes como el agua, ( en ascitis puede ser amarillento pero limpio) Coagulan rápidamente y forman No coagulan, fluyen fácilmente abundante sedimento y pegajosos Contienen abundante albúmina, más del Contiene poca albúmina, tiene menos 3.5% del 2% Peso específico mayor de 1036 Peso específico de 1016 Constituido por células de descamación leucocitos, glóbulos rojos y bacterias Fuente: GARCIA, G. Argemiro. Sistema respiratorio y sistema circulatorio. Bogotá: Fondo Nacional Universitario, 1995. p. 123 Líquidos intermedios: Entre exudado y trasudado; para diferenciarlos se emplea la Prueba de Rivalta o la de Moritz. prueba Rivalta: Consiste en mezclar 2 gotas de ácido acético en 200 cc de agua y en esta solución se dejan caer de 2 a 3 gotas del líquido obtenido en la toracocentesis. Si es exudado, al caer las gotas en el líquido, se forma hacia el fondo una película u opacidad (como humo de cigarrillo); si es trasudado, no se forma esta película. 90 Prueba de Moritz: 2 cc de líquido problema y dejar caer 2 gotas de ácido acético, su reacción y lectura son iguales a la anterior. 105 Procedimiento: La toracocentesis es realizada en el 7 o 8 espacio intercostal a nivel de la unión costocondral, con el paciente de pie o en recumbencia ventral. Las radiografías pueden ser necesarias como método de guía para la selección del sitio, particularmente cuando las efusiones son unilaterales. El área es depilada, y la piel es preparada de forma aséptica y es infiltrada con anestesia local. Una aguja de 1 pulgada calibre 20 es insertada dentro del espacio pleural, y luego es conectada a una llave de 3 vías. Una jeringa grande puede ser usada para la recolección aséptica del fluido. Una parte del fluido que se recoge (2-3 ml) debe ser almacenada en un Vacutainer, en un tubo que contenga EDTA para que con esta muestra se puede realizar el conteo de células, el análisis de proteína, y la evaluación citológica, esta forma de almacenaje previene la formación de coágulos que se forman en el fluido cuando hay contaminación con sangre. Una segunda porción (23ml) debe ser almacenada en un tubo estéril sin anticoagulante en caso de que se requieran realizar cultivos aerobicos o anaerobicos o para evaluar si hay presencia o no de coágulos en fluidos sanguinolentos.106 Figura 10. Jeringa para Toracocentesis* *jeringa de 60 ml, llave de 3 vías, tubo de extensión IV, y aguja calibre 20 de 1 pulgada. Fuente: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/tension.htm 105 GARCIA, Op. cit., p. 123 ALLEMAN, Rick. Abdominal, thoracic and pericardial effusions. En: Veterinary Clinic Small Animal: Small Animal Practice. Florida. Vol. 33 ( 2003); p. 90 106 91 Figura 11. Ubicación del sitio para punción en toracocentesis* *Toracocentesis en el 7th espacio intercostal en la parte media Fuente: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/tension.htm El espacio pleural puede drenarse en forma intermitente por toracocentesis si se utiliza una aguja hipodérmica, dependiendo si se necesita un drenaje continuo o prolongado para la extracción de líquido o aire cabe la posibilidad de utilizar un tubo de toracostomía. Los tubos de toracostomía se conectan a una válvula de tres vías para permitir la aspiración intermitente del líquido (p. ej., cada 2 a 4 horas) o se conectan a un dispositivo de aspiración continua. Cuando se emplea aspiración continua, se controla cuidadosamente la presión negativa; ésta no debe ser menor que -5 a -10 cm H20.En forma alternativa se conecta el tubo de toracostomía a una válvula de Heimlich fluctuante de una vía. Cuando se usa esta válvula, se evalúa cuidadosamente al paciente, ya que puede haber complicaciones. Se debe estar al cuidado de que la válvula no se fisure, ni el diafragma de la misma se humedezca, ya que la función de mantener una sola dirección puede perderse y en consecuencia se desarrolla neumotórax grave. Cuando no se logra aspirar líquido o aire del tubo de toracostomía, se considera que el espacio pleural puede estar completamente evacuado o el tubo obstruido por un coágulo de fibrina, o bien el tubo puede estar doblado. Se debe de realizar radiografías torácicas, además se debe de lavar el tubo con solución salina para por 92 medio de esto confirmar su permeabilidad. Luego se debe Remover el tubo. Cuando ya no se necesite. La presencia del tubo de toracostomía ocasiona la producción continua de un pequeño volumen de líquido (por lo menos 30 a 60 ml de líquido/24 horas en un perro de 25 kg).También es posible que se acumule un pequeño volumen de aire dentro del espacio pleural, debido a la migración del aire a lo largo de la superficie externa del tubo o a través de fugas en el sistema. Por consiguiente, no se puede esperar hasta que no haya acumulación de líquido o aire dentro del tórax para quitar el tubo de toracostomía, por lo que se extrae cuando el volumen de aire y líquido haya alcanzado niveles insignificantes. 107 2.1.4.2.4 Muestras sanguíneas. De preferencia antes de iniciar cualquier tratamiento se deben de obtener muestras de sangre, las cuales se deben de almacenar en un tubo con y sin anticoagulante. Estas muestras pueden no necesitarse, pero ayudan a determinar el estado bioquímico del animal al momento de su admisión al hospital, cuando se intenta distinguir entre enfermedad preexistente y la que se ha desarrollado en forma aguda después del traumatismo. Esto mismo se aplica para las muestras de orina y su almacenamiento. ● Equipos. - Analizadores de gases sanguíneos: Los avances tecnológicos que se encuentran en la cabecera de los analizadores de gases sanguíneos han proporcionado un manejo exacto y efectivo para la evaluación de gases sanguíneos y del estado ácido- base en los pacientes. Una de las unidades más populares es la I- STAT. Otras unidades que están disponibles y que han sido evaluadas incluyen la Stat- Pal II. El desarrollo de un monitoreo exacto y confiable puede disminuir la cantidad de tiempo de la recolección de la muestra hasta su posterior análisis, permitiendo obtener resultados más exactos. Las variables de los gases sanguíneos 107 BIRCHARD, Op cit., p. 707 93 PCO2 y PO2 son medidas directamente como el pH sanguíneo. La saturación de oxígeno (SO2), dióxido de carbono en sangre total (TCO2), exceso de base, y HCO3 son variables calculadas. Recientemente, la determinación de lactato en sangre ha sido incorporado como una variable de rutina que es determinada concurrentemente con el análisis de gases sanguíneos.108 Figura 12. I- STAT Fuente: http://www.shalix.com/store.html?id_fam=20&p=2 - Cooxímetro: SO2 es dependiente de varias variables, incluyendo PaO2, temperatura de la sangre, la concentración de ion hidrógeno (pH), y la cantidad de 2,3 – difosfoglicerato. El analizador de gases sanguíneos no toma estas variables en consideración cuando reporta SO2. Un co-oxímetro directamente mide porcentajes de carboxi y metahemoglobina y SO2. La methemoglobina resulta en una pobre saturación de oxígeno en la sangre arterial (SaO2); aunque PaO2 puede ser normal. La PaO2 es de primer interés en los pacientes veterinarios en vez de la SaO2. - 108 Pulsioxímetro: son comunes y no invasivos para monitorear pacientes veterinarios mientras están bajo anestesia y durante el soporte respiratorio (ventilación mecánica). El principio de la oximetría de pulso es la saturación del pulso de la sangre arterial (SpO2), la cual puede ser determinada sobre las pulsaciones. DAY k, Op cit., p 1032 94 Debe ser usado con precaución cuando se determina la SaO2 en pacientes críticos, especialmente aquellos con compromiso cardiovascular y con pobre perfusión. Una pulsación detectable en el sitio de colocación de la sonda que se requiere para reportar el SpO2. La pobre perfusión de sitio en donde se coloca la sonda (usualmente la lengua) resulta en valores bajos de SpO2 a pesar de la posibilidad de una adecuada SpO2. El aumento de los valores de PaCO2 puede ocurrir aún con valores normales de PaO2, SaO2 y SpO2. Otros factores que pueden resultar en valores pobres de SpO2 a pesar de la saturación de oxígeno normal, incluyen la excesiva luz en el cuarto, que se encuentre seca el área donde se coloca la sonda y si hay un excesivo movimiento. Desafortunadamente en algunos pacientes críticos, la muestra de sangre arterial debe de ser recolectada para determinar si el valor bajo de SpO2 es real. - 109 Capnometría: Los capnómetros son aparatos no invasivos que miden la cantidad de dióxido de carbono expirado. El CO2 del tidal final (ETCO2) pone en ecuación cerca la PaCO2. El uso principal de la capnometría es el monitoreo de una adecuada ventilación. La Hipoventilación es conocida como un aumento en la PaCO2. Cualquier aumento en el ETCO2 se correlación con un aumento en la PaCO2 en pacientes con función cardiaca normal. Un aumento en la diferencia entre PaCO2 y ETCO2 (PaCO2 - ETCO2) usualmente es el signo de un aumento en la ventilación del espacio muerto y una alteración en la relación ventilaciónperfusión dentro de los pulmones. La causa más común de aumento en PaCO2 - ETCO2 es la pobre perfusión de los pulmones (pobre salida cardiaca). por lo tanto, el estado cardiovascular de un paciente debe ser investigada cuando hay una repentina disminución en la ETCO2 durante la anestesia o al monitorear el ventilador. El Tromboembolismo pulmonar es otro ejemplo de un caso clínico que resulta en un aumento del valor PaCO2 - ETCO2. monitoreando el ETCO2 durante la resucitación cardiopulmonar (CPR) puede ayudar en la evaluación de la perfusión pulmonar y la salida cardiaca y puede predecir el resultado de la CPR. 109 Ibid., p. 1033 95 ● Recolección de la muestra. El primer paso para el análisis de los gases sanguíneos es obtener una muestra apropiada. El equipo que puede ser utilizado consiste de una jeringa de 1 o 3 ml con una pequeña aguja (calibre 23-29). Una pequeña cantidad de heparina debe ser colocada en el centro de la aguja. Mucha heparina puede causar una dilución de la muestra y la posibilidad de resultados inadecuados, tales como pH, PCO2 y HCO3 bajos. Las muestras necesitan estar almacenadas en un medio anaeróbico tan pronto como la recolección se completa. Cualquier burbuja de aire en la muestra debe ser evacuada, y la aguja debe de ser tapada por un tapón de goma. Otro método para mantener un medio anaeróbico puede ser el de remover la aguja después de la recolección y se debe de colocar un tapón sobre la punta de la jeringa. Las burbujas también pueden alterar los valores de los gases sanguíneos. La PCO2 del cuarto de aire es extremadamente baja, y la PO2 del cuarto de aire es mucho mayor comparada con la muestra de sangre. Sin embargo, la prolongada exposición a las burbujas de aire, especialmente una que ocupe más del 10% del volumen de la muestra, puede resultar en la disminución de la PCO2 y en el aumento de la PO2. La muestra debe de ser analizada tan pronto como sea posible, usualmente entre los 15 a 20 minutos después de la recolección. La muestra debe ser colocada sobre la balanza y debe de ser mezclada constantemente si hay demoras en el análisis. La sangre que se estanca antes del análisis resulta en un aumento de la PCO2. Aumento de la PCO2, disminución del pH, disminución de la glucosa, aumento lactato. Una demora en el análisis necesita que las muestras sean colocadas en el refrigerador o en hielo por no más de 2 horas antes del análisis. La muestra de sangre arterial puede ser recolectada por punción percutánea ocasional o vía catéter. Las arterias que pueden ser usadas en el perro incluyen la femoral, dorsal podal, y dorsal auricular en grandes razas110. ● Muestra arterial o venosa. El análisis de la función pulmonar requiere de una muestra de sangre arterial. La evaluación apropiada del valor de PaO2 obtenido de la muestra de sangre arterial también requiere conocimiento de la fracción de oxigeno inspirado (FiO2) y la presión parcial de oxígeno en el alvéolo (PAO2). El 110 Ibid., p. 1034 96 cálculo de la diferencia alveolar- arterial (PAO2 – PaO2) y otros índices de oxigenación (PaO2/FiO2) ayudan a determi8nar el estado de hipoxemia. El análisis de la perfusión del tejido y el estado total ácido- base, o a la inversa, requiere evaluar una mezcla de sangre venosa (arteria pulmonar). La presión parcial de oxigeno en la sangre venosa (PVO2) es una variable importante que se usa para ayudar a determinar la perfusión global del tejido. Es posible tener una Pao2 normal o más alta de lo normal y verse seriamente comprometida la PVO2 en perros con función pulmonar normal y con una pobre perfusión del tejido. Una verdadera mezcla de la sangre venosa es recolectada de la arteria pulmonar. La cateterización de la arteria pulmonar no es una técnica de rutina en los pacientes veterinarios, aunque la cateterización de la vena yugular es una técnica fácil de hacer y menos cara para realizar111. La reciente adicción del análisis del lactato con los valores de gases sanguíneos usando el i- STAT ha proveído información de las variables que afectan la producción de lactato. 2 tipos de acidosis láctica (producción de lactato que excede la utilización por parte de los riñones y del hígado) ocurre. La primera es la Tipo A (hipóxica) acidosis láctica que ocurre cuando la función mitocondrial esta normal pero la entrega de oxigeno a los tejidos es inadecuada. La segunda es la Tipo B (no hipóxica) la acidosis láctica ocurre cuando la entrega de oxigeno es adecuada pero existe el defecto de la función mitocondrial. La acidosis láctica hipóxica ocurre cuando la entrega de oxígeno esta deteriorada debido a la pobre perfusión de los tejidos o a la reducción del contenido de oxígeno. Los ejemplos clínicos incluyen CPR, shock, falla cardiaca, hipovolemia y hipoxemia y anemia severa. Las concentraciones de lactato mayor de 2- 2.5 mEq/L son consideradas altas en perros y gatos. ○ Hematocrito (Ht) y concentración de proteínas plasmáticas (CPP). Determinar el Ht y la CPP tan pronto como sea posible después del examen inicial. 111 Ibid., p. 1034 97 Es crítico registrar estos valores, debido a que el diagnóstico de hemorragia persistente con frecuencia depende de la comparación de determinaciones seriadas de Ht y CPP. Si la hemorragia continúa, estos dos valores seguirán disminuyendo a una velocidad similar. Sin embargo, si la hemorragia ha cesado es común que las CPP se estabilicen, en tanto que el Ht sigue declinando. La administración de líquidos intravenosos puede disminuir aún más estos valores. ○ Tensiones de gas en sangre y pH arterial. Estos valores proporcionan una indicación de la función ventilatoria. La oxigenación satisfactoria de la sangre por los pulmones requiere de un gasto cardiaco adecuado. La disminución de este gasto, causada por el choque hipovolémico o depresión de la función cardiaca, puede afectar bastante los valores de gases en sangre arterial. ○ Análisis de gases sanguíneos. Este análisis se realiza en una arteria o vena central, la cual puede proveer una información valiosa a la hora de evaluar el estado cardiopulmonar y ácido- base de un paciente crítico. Las muestras de sangre arterial proveen una información principalmente en cuanto a la función pulmonar, mientras que una muestra de sangre yugular o una mezcla de sangre venosa puede proveer información sobre la función cardiaca total (perfusión) y todo el estado ácido- base corporal. Tradicionalmente, las muestras arteriales han sido utilizadas principalmente para evaluar los gases sanguíneos y para juzgar la perfusión y todo el estado metabólico de los tejidos. ○ Análisis de gases de la sangre arterial. Las muestras de sangre arterial proveen información principalmente relacionada con el sistema pulmonar usando las verdaderas variables de gases sanguíneos (PaO2, SaO2 y PaCO2). Una evaluación apropiada de las variables de gases sanguíneos puede solo ocurrir con una muestra de sangre arterial, aunque tradicionalmente, todo el estado ácido base y las decisiones sobre la terapia se basan también en las muestras de sangre arterial. 98 Los únicos gases sanguíneos que incluye el análisis de gases son la PaO2 y PaCO2. la SaO2 es un valor derivado que puede no ser confiable basándose en el método de calculación del analizador de gases sanguíneos. la PaCO2 provee información de la ventilación mientras que la PaO2 provee información con respecto a la oxigenación. Ventilación: la ventilación alveolar es directamente proporcional a la PaCO2 basado en la ecuación de ventilación alveolar112: PaCO2: VCO2 x 0.863/ VA Donde VCO2 es la cantidad de dióxido de carbono producido por el metabolismo y la entrega de los pulmones. VA es la ventilación alveolar, y 0.863 es una constante. Oxigenación: La Medida de la Pao2 es la base para determinar la oxigenación. Dos terminos que han sido utilizados intercambiables que son algo diferentes en la definición: hipoxemia y hipoxia. Hipoxemia se refiere a la disminución en la Pao2 (< 60 mmHg), mientras que la hipoxia hace referencia a la reducción general en la entrega de oxigeno sea por la hipoxemia o la d disminución en la salida cardiaca. Pao2 es principalmente determinada por la PAO2, la cual es descrita por la ecuación del gas alveolar: PAO2 : PIO2 – 1..2 ( Paco2) Donde PIO2 es la presión parcial de oxigeno inspirado y 1.2 representa el cociente respiratorio. la PIO2 es determinada por la siguiente ecuación: PIO2: FIO2 (PB – 47) 112 Ibid., p. 1035 99 Donde FIO2 es la fracción de oxigeno inspirado, PB es la presión barométrica y 47 representa la presión de vapor de agua en milímetros de mercurio, el cual es substraído de la medida de los gases secos. Existen 5 causas comunes de hipoxemia: - Hipoventilación - Disminución de FIO2 - Deterioro de la difusión - Mala relación entre la ventilación- perfusión ( V-Q) - Desviación pulmonar de derecha a izquierda. Hipoventilación, por definición, es hipoxemia debido al aumento de la Paco2, y se resuelve usualmente con ventilación. Hipoxemia causada por baja FIO2 se resuelve con la suplementación de oxigeno. Un incremento en la ventilación sin una apropiada perfusión Pueden ser causados por: resulta en un radio V- Q mayor que 1 y comúnmente hace referencia a un aumento en el espacio muerto alveolar. Ejemplos clínicos. Incluyen Tromboembolismo pulmonar y enfisema severo. Una disminución en la ventilación del alvéolo que esta siendo perfundido resulta en un radio V-Q menor que 1. Ejemplos clínicos: edema pulmonar, neumonía y contusión pulmonar. La suplementación de oxígeno puede mejorar la hipoxemia dependiendo del grado de severidad de la poca de relación entre V- Q113. Un radio V- Q que se aproxima a 0 o a áreas del pulmón con poca ventilación con perfusión adecuada hace referencia a la desviación pulmonar de derecha a izquierda. Cuando grandes áreas del pulmón no están siendo ventiladas, pero su perfusión sigue ocurriendo. Causas comunes a esta desviación son similares a las que causan la falta de relación entre V- Q pero incluye una presentación muy severa, tales como edema pulmonar severo, consolidación de un lóbulo pulmonar 113 Ibid., p. 1036 100 debido a neumonía, atelectasia, desviación extrapulmonar (conducto arteriosos persistente, defectos severos del septo ventricular). La suplementación de oxígeno no resuelve la hipoxemia causada por la desviación de derecha a izquierda. La diferencia PAO2 – PaO2: - - Es usada para determinar si esta presente o no la falta de relación de la V- Q. Es un valor que representa la severidad de la hipoxemia. La PAO2 – PaO2 normal es de 5 a 15 mmHg dependiendo de si se suministra oxígeno. La variabilidad de PAO2 – PaO2 durante la administración de la suplementación de oxígeno puede necesitar el cálculo de otra variable para ayudar a determinar la severidad de la hipoxemia. Aunque es una variable principalmente pulmonar, la función cardiovascular puede afectar el valor obtenido. La supervivencia de los pacientes con un PAO2 – PaO2 grande no esta influenciada por el proceso de enfermedad. El radio PaO2/FIO2: - Es un método confiable para determinar la severidad de la hipoxemia cuando FIO2 es > que 0.5 y PaO2 es menos de 100 mmHg. - - Indica la respuesta de la hipoxemia a la suplementación de oxígeno y puede también indicar cuanto de la hipoxemia es resultado del shunt intrapulmonar de derecha a izquierda El valor normal mientras se respira en un cuarto de aire es de 100/0.2 : 500 mmHg Radio PaO2/ FIO2 menor de 300 indica lesión pulmonar aguda y valores menores de 200 mmHg indica “síndrome de distress respiratorio agudo” Calcular estas variables pueden ayudar a determinar si un paciente necesita o no ventilación mecánica. Una definición de hipoxemia puede incluir el cálculo del contenido de oxígeno en la sangre arterial (CaO2). La ecuación de CaO2 es la siguiente: 101 CaO2: (Hb x SaO2 x1.34) + (PaO2 x 0.003) Hb: concentración de hemoglobina, 1.34: es la cantidad de oxígeno disuelto en plasma y (0.3%) expresada en forma decimal114. Las unidades finales de CaO2 son expresadas como milímetros de oxígeno por decilitro de sangre. La ecuación que calcula CO2 esta basada en la cantidad de hemoglobina. La anemia afecta el CaO2 más que la hipoxemia sola. La importancia de la PaO2, SaO2 y CaO2 gira alrededor de una del las variables cardiovasculares primarias llamada entrega de oxígeno (DO2). La ecuación es: DO2 : CO x CaO2 CO: salida cardiaca Estado ácido – base. La base para la aproximación tradicional del balance ácido – base gira alrededor de la concentración del ion hidrógeno (expresado como pH), PCO2 y HCO3. CO2 combinado con el agua forma ácido carbónico, el cual se disocia nuevamente ion hidrógeno y bicarbonato. La ecuación de Henderson – Hasselbach describe esta interacción: PH + pK + log [HCO3-] / 0.03 (PCO2) Simplificando, cambios en bicarbonato y PCO2 se muestran en 4 disturbios ácidobase, además de mostrar la dirección de compensación para mantener el pH. La compensación puede ser aguda, envolviendo los pulmones, hígado y fluido extracelular y crónica, principalmente envuelve los riñones. 114 Ibid., p. 1037 102 Valores normales de gases de sangre arterial pH : 7.40 PaO2 : 80 a 100 mmHg ( basado en FIO2: 0.21) PaCO2: 40mmHg HCO3- : 24 mEq/ L Análisis ácido- base debe seguir una lógica para determinar las anormalidades que actualmente siguen el orden previo de presentación. Primero examina el pH, segundo PaCO2 y tercero HCO3-. Entonces, basados en los cambios compensatorios esperados, se determina si se tiene un desorden primario con una respuesta compensatoria apropiada, una mezcla de desordenes (actualmente 2 o 3 desordenes primarios ocurren simultáneamente) o un desorden compensatorio. Un desorden compensatorio puede solo ser identificado por un pH normal con PaCO2 anormal y bicarbonato anormal que puede cambiar apropiadamente basado en un desorden primario. Como cualquier prueba de diagnóstico, el análisis de gases sanguíneos debe ser usado como una pieza de rompecabeza y no debe ser el único medio de diagnóstico. Acidosis metabólica. Es un disturbio ácido- base común en pacientes críticos. El primer evento de la acidosis metabólica es la disminución de la concentración de bicarbonato. La ecuación H-H en la cual cuando hay disminución del bicarbonato da como resultado una disminución compensatorio en la PaCO2 o hiperventilación. La cantidad de presión de dióxido de carbono en relación a la disminución del bicarbonato es 1.2 mmHg que disminuye el PaCO2 por cada 1 mEq/ L de disminución en el bicarbonato. El anion gap puede ser usado para ayudar a diferenciar las causas potenciales de acidosis metabólica. El cálculo del anión gap es más practica con la siguiente ecuación : (Na+ + K+) - (CL- + HCO-3)115 115 Ibid., p. 1039 103 anión gap (AG), o brecha aniónica :Las compensaciones fisiológicas se basan en el intercambio de gases y electrolitos a través de las membranas celulares, teniendo valor, sobre todo en el caso de las acidemias, informa sobre alteraciones electrolíticas, puede alertar ante presencia de tóxicos en sangre (aniones no medidos que se escapan). En cualquier acidemia metabólica hay disminución del bicarbonato, pudiendo compensarse esta reducción del bicarbonato con un aumento de cloro (columna de en medio) en cuyo caso el AG es normal, puede no existir la antedicha compensación por el cloro (AG alto), y también hay acidemias con hipercloremia y con aumento del Anión Gap, existiendo múltiples condiciones patológicas en uno y otro grupo. Es preferible la determinación directa del lactato, cuyo valor normal es de 1,5 mmol/L= 1,5 mEq/L= 13,5 mg, pudiendo aumentar normalmente en ejercicio hasta 10-15 mEq/L. 116 Existen 2 categorías de acidosis metabólica que combinan el concepto del anión gap. Una acidosis metabólica con aumento en anión gap usualmente envuelve normocloremia, Las causas comunes son: - toxicosis con el etilenglicol cetoacidosis diabética acidosis urémica acidosis láctica intoxicación con salicilto La acidosis metabólica caracterizada por un anión gap normal usualmente tiene hipercloremia como un componente, en la mayoría de los ejemplos, bicarbonato se pierde en exceso de cloro, resultando en hipercloridemia. Causas comunes de acidosis metabólica con anión gap (hipercloremia): - Diarrea aguda del intestino delgado Acidosis diluida (rápida administración de cloruro de sodio al 0.9%) 116 MORALES, Mérida. et al. Función pulmonar y su evaluación. En: Principios de Urgencia, emergencia y cuidados criticos SAMIUC; http://tratado.uninet.edu/c020105.html 104 - Acidosis metabólica post- hipocapnica Tratamiento de la acidosis metabólica envuelve primero la identificación y el tratamiento de la causa principal. La administración de Bicarbonato de sodio a sido un tema controversial en la medicina veterinaria. La mayoría esta de acuerdo que si el pH es < de 7.1 o 7.2, la terapia con bicarbonato para aumentar el pH a más de 7.2 es indicado a lo largo de la terapia para resolver la causa primaria de la acidosis metabólica. El pH sanguínea de < de 7.1 o 7.2 puede conducir a complicaciones cardiovasculares que amenacen la vida incluyendo deterioro de la contractibilidad cardiaca y sensibilización a arritmias ventriculares. Una fórmula común que es usada para calcular el déficit total de bicarbonato es la siguiente: Dosis de HCO-3 (mEq): 0.3 x peso corporal (kg) x exceso de base (Déficit) (mEq) Una administración arbitraria de ¼ o 1/3 de la dosis total sobre los 20 a 30 minutos, debe corregir el pH y aumentarlo hasta donde se desea que es 7.2. Análisis repetidos de gases sanguíneos son requeridos para determinar el Ph deseado. Acidosis respiratoria El evento primario de la acidosis respiratoria es un aumento en la concentración de PaCO2 (también llamada hipercapnia). En la ecuación H-H, un aumento de PaCO2 resulta en un aumento compensatorio en el HCO3- . La cantidad en la que aumenta el bicarbonato en relación al aumento en PaCO2 es de 0.15 mEq/L de aumento de bicarbonato por cada 1 mmHg de aumento en PaCO2 en una acidosis respiratoria aguda. La cantidad de aumento en el HCO3- es mayor en la acidosis respiratoria aguda, debido que los riñones tienen tiempo para proveer un efecto compensatorio. La cantidad de aumento de bicarbonato en relación a un aumento en PaCO2 es de un aumento de 0.35 mEq/L en bicarbonato por cada 1 mmHg de aumento en PaCO2 en acidosis respiratoria crónica. Causas comunes de acidosis respiratoria en pacientes críticos incluyen: Cualquier enfermedad pulmonar (aguda o crónica), enfermedad neurológica y drogas (agentes 105 anestésicos, analgésicos opioides, enfermedad neuromuscular y enfermedad pleural). La Hipercapnia aguda aumenta el fluido sanguíneo cerebral (CBF) y la presión intracraneal, la cual puede tener efectos perjudiciales en los pacientes con lesión cerebral. Cuando las concentraciones de PaCO2 llegan hasta aproximadamente 100 mmHg, lo cual resulta en un estado de depresión cerebral severa. Finalmente, el aumento en PaCO2 causa vasodilatación que es expresada por el color ladrillo rojo de las membranas mucosas. El Análisis de los gases de la sangre arterial puede ayudar a determinar la definición de la falla respiratoria, especialmente en relación a la hipoxemia recurrente. Una definición de la falla respiratoria es la presencia de PaCO2 mayor a 50 mmHg en pacientes no sedados y no anestesiados, otras definiciones de falla respiratoria incluye la presencia de PaO2 menor de 50 mmHg con una FIO2 de 0.21 o una pobre respuesta de PaO2 menor de 50 mmHg con FIO2 menor de 0.5. Hipercapnia e hipoxemia concurrente deben ser tratados agresivamente con ventilación mecánica. Alcalosis metabólica El evento principal de la alcalosis metabólica es un aumento en la concentración de bicarbonato. En la ecuación H-H un aumento en el bicarbonato resulta en un aumento compensatorio en la PaCO2 o hiperventilación. La cantidad en la que aumenta el PCO2 en relación al aumento en HCO3- , es la siguiente, hay un aumento de 0.6 mmHg en el PaCO2 por el aumento de 1.0 mEq/L de bicarbonato. La respuesta de PaCO2 a la alcalosis metabólica no es usualmente tan marcada como en la acidosis metabólica. Alcalosis metabólica es usualmente el resultado de la perdida del ion hidrógeno (H+) que ocurre con vomito gástrico puro. Otras dos causas son la terapia diurética y la administración sensata de bicarbonato de Na+. La regulación renal de los electrolitos es importante en la creación y mantenimiento de exceso de HCO3-. El riñón trata de retener tanto sodio como sea posible, usualmente reteniendo Clcon Na+. La perdida recurrente de cloruro, resulta en la retención del ion negativo que se encuentra en segundo lugar en abundancia en el cuerpo, el HCO3-. El 106 resultado es un exceso de mayores de 7.50. HCO3- y alcalosis metabólica con valores de pH Signos clínicos: usualmente envuelven la causa principal y los efectos clínicos de los disturbios electrolíticos. - Hipokalemia severa (menor de 2.5 Eq/L) puede resultar en debilidad y cambios en el ECG. Una disminución en el calcio ionizado como un resultado de alcalosis metabólica puede contribuir ha la debilidad y a tensión muscular. Alcalosis metabólica es un evento secundario y la terapia debe ser dirigida a la causa principal. Los cambios acido-base en la alcalosis metabólica no son corregidos hasta que haya una restitución adecuada de cloruro. El déficit de Na y K deben ser remplazados en su totalidad. Comúnmente la administración de cloruro de Na al 0.9% con suplementación de K, es el fluido de elección para remplazar el déficit de electrolitos y ayuda a corregir la alcalosis metabólica. Antieméticos, cirugía por obstrucción pilórica y otras terapias específicas para corregir la causa principal ayudan a reducir las perdidas de Cl- y H+. Alcalosis respiratoria El evento principal es la baja concentración de PaCO2 (también llamada hipocapnia). En la ecuación H-H cuando hay disminución en la PaCO2 se presenta una disminución compensatoria de HCO3-. La cantidad en que disminuye el HCO3- en relación a la disminución en PaCO2 es: una disminución de 0.25 mEq/L de HCO3por cada 1 mmHg de PaCO2 que se diminuye en una alcalosis respiratoria aguda. La cantidad de HCO3- que disminuye es mayor en una alcalosis respiratoria crónica, porque los riñones tienen que proveer un efecto compensatorio. La cantidad de HCO3- que disminuye en relación a la disminución de PaCO2 es de 0.55 mEq/L de disminución de HCO3- por cada 1 mmHg de PaCO2 que disminuye en la acidosis respiratoria crónica. Causas comunes en pacientes críticos incluye: 107 - Estimulación de quimioreceptores periféricos en respuesta a la hipoxemia Cualquier enfermedad pulmonar Estimulación directa del centro respiratorio (drogas, sepsis, enfermedad SNC, insolación). Signos clínicos: Pacientes anestesiados pueden tener una disminución en la salida cardiaca y en la presión sanguínea en respuesta a la hipocapnia pero este efecto no ha sido observado en pacientes despiertos. La terapia es dirigida al tratamiento del proceso principal de enfermedad, ya que otras terapias son efectivas117. Disturbios acido-base mixtos Estos disturbios son extremadamente comunes en pacientes críticos. El diagnostico puede ser difícil, sin embargo existe una guía que puede ayudar al clínico a establecer un acceso lógico del análisis de gases sanguíneos. El acceso no tradicional para el balance acido-base puede ser de mucha ayuda en los desordenes mixtos. Los siguientes pasos pueden ayudar a determinar un desorden mixto. - La presencia de pH normal y PaCO2-HCO3- anormales, implica un desorden mixto. - Un cambio en pH en la dirección opuesta que la predecida por un desorden primario requiere un diagnostico de un desorden mixto. - Cuando hay cambios en PaCO2 y HCO3- en dirección opuesta que la predecida, esto es un desorden mixto. Errores en la recolección y en el análisis en el laboratorio de la muestra pueden dar como resultado el diagnóstico de un desorden mixto. El análisis de gases de sangre venosa para valores pulmonares (PaCO2) resulta en un mal cálculo de la compensación. La presencia de mucha heparina en la jeringa, el almacena la muestra de sangre por más de 15 a 20 minutos a temperatura ambiente y el mal cálculo de HCO3- pueden resultar en el diagnóstico de un desorden mixto cuando no esta presente. 117 DAY k, Op cit., p 1042 108 Los desordenes mixtos caen entre de las siguientes categorías: 1. Desorden mixto neutralizando efectos sobre pH. 2. Desorden mixto con efectos aditivos sobre pH. 3. Desordenes triples. Ejemplos clínicos de estas tres categorías son: 1. Una mezcla de alcalosis respiratoria y acidosis metabólica pede ocurrir en muchas situaciones clínicas. La mayoría de estos pacientes tienen una alcalosis respiratoria aguda en presencia de una acidosis metabólica con anión Gap aumentado. El análisis de gases sanguíneos se caracteriza por disminución de PaCO2 y disminución de HCO3- en la fase de un pH que puede ser cercano a lo normal. El único desorden simple que puede resultar con estos mismos hallazgos es la alcalosis respiratoria crónica que ha sido completamente compensada. La dilatación vólvulo gástrica (GDV) es un ejemplo común. La acidosis metabólica es usualmente un resultado de la acidosis láctica secundaria con pobre perfusión, y la alcalosis respiratoria aguda es un resultado de la hiperventilación inducida por el dolor, la terapia debe incluir la descompresión gástrica, terapia agresiva de fluidos y analgesia. 2. Los desórdenes con un efecto adicional sobre el pH pueden tener un aumento o disminución dramático en los valores, una acidosis mixta (metabólica y respiratoria) puede ocurrir en varias situaciones clínicas, incluyendo arresto cardio-pulmonar y edema pulmonar severo secundario a la falla en la salida cardiaca (disminución), y acidosis láctica como una respuesta a la pobre perfusión del tejido. La PaCO2 esta usualmente normal o aumentada, el HCO3- esta disminuido y el pH puede estar peligrosamente bajo. La terapia es dirigida a mejorar perfusión al tejido, con la posibilidad de suministrar ventilación mecánica, especialmente si hay hipoxemia. 109 Una alcalosis mixta (metabólica y respiratoria) es poco común en pacientes veterinarios. La PaCO2 esta baja, el HCO3- esta bajo y pH esta alto. Este tipo de desorden puede ocurrir en el complejo GDV (perdida de cloruro, hidrogeno y dolor) y en pacientes con falla cardiaca congestiva que ha sido tratada con diuréticos. Terapia consiste en suministrar una fuente de cloruro para corregir el componente metabólico y tratar la causa principal del componente respiratorio. 3. Los desordenes triples usualmente ocurren cuando un desorden metabólico mixto (acidosis y alcalosis) es complicado por un disturbio respiratorio agudo. El pH y el HCO3- pueden estar aumentados, disminuidos o normales. La PaCO2 esta incrementada cuando el disturbio metabólico mixto esta complicado por una acidosis respiratoria aguda, y la PaCO2 esta disminuida cuando la alcalosis respiratoria aguda esta presente. Dos tipos de ejemplos de estos desordenes son la falla y la disminución en la salida cardiaca y síndrome GDV. Pacientes con falla cardiaca tratados con diuréticos pueden tener acidosis metabólica secundaria a la acidosis láctica y alcalosis metabólica causada por la hipocloremia. El edema pulmonar agudo puede presentarse resultar en un aumento en la ventilación y una disminución de PaCO2 (alcalosis respiratoria). La acidosis metabólica ocurre por que hay pobre perfusión, alcalosis metabólica puede ocurrir secundaria a hipocloridemia, y distensión de la torsión del estomago puede disminuir la ventilación (acidosis respiratoria). Pacientes con distensión mínima puede tener hiperventilación inducida por dolor y disminución PaCO2 (alcalosis respiratoria) además de los dos disturbios118. ○ Análisis de gases de sangre venosa. La habilidad para tener un acceso adecuado de oxigenación es limitado y usualmente envuelve medir algunos aspectos de la oxigenación global comparada con la oxigenación individual de un órgano. La habilidad para examinar una medida de oxigenación global es limitada en algunos casos, tales como sepsis, en el cual la medida de oxigenación global puede ser normal, mientras que los órganos individuales se vuelven hipóxicos. Evidencia de 118 Ibid., p. 1044 110 pobre oxigenación de los órganos, usualmente es reconocido después de que el órgano ha estado dañado y comienza a fallar. La cateterización arterial pulmonar es limitado en medicina veterinaria, aunque una muestra de sangre yugular puede proveer una información similar sobre perfusión. La PVO2 asociada con SVO2, puede proveer una base de información para calcular el contenido de oxígeno en sangre venosa (CVO2). La PVO2 de la vena yugular o de la cateterización de la arteria pulmonar puede proveer evidencia de la perfusión tisular. Una disminución de la PVO2 indica que la cantidad máxima de oxigeno ha sido extraído de los tejidos. PVO2 normal es de 35 a 50 mmHg. Cuando la PVO2 cae entre 28 y 35 mmHg, este es el límite de oxigeno de reserva en el tejido y un estado de metabolismo anaeróbico esta presente; la terapia agresiva con coloides, cristaloides, inótropos o otros métodos que aumenten la perfusión son necesarios para prevenir nuevas disminuciones. Un valor de PVO2 de 27 mmHg indica la presencia de un metabolismo anaeróbico y la producción de acidosis láctica. Estos valores tan bajos son considerados un evento preterminal. Elevación en PVO2 más de 60 mmHg en un animal respirando aire ambiental sugiere una disminución del oxígeno que toma el tejido, el cual no recibe el oxígeno debido a una desviación de la sangre lejos del tejido. El lactato venoso puede también proveer evidencia de la pobre perfusión tisular. Concentraciones de lactato mayores de 2 a 2.5 mEq/l indica un acumulo anormal en perros y gatos muy enfermos. El I-STAT recurrentemente tiene la capacidad de proveer la información de las concentraciones de lactato y de gases sanguíneos. Estado acido-base: El análisis ácido-base venosa puede ser importante cuando se presenta una pobre perfusión tisular. Hay una gran diferencia entre los valores ácido base a nivel arterial y venoso durante CPR tal que la sangre arterial indica un pH adecuado pero la sangre venosa indica una severa acidosis con PCO2 elevado. Una elevación en el PVCO2 usualmente indica una ventilación inadecuada en el paciente con una perfusión tisular normal o pobre, elevación PVCO2 indica 111 pobre perfusión. La terapia en un paciente con tal disparidad entre la sangre arterial y venosa consiste en suministrar perfusión con coloides, cristaloides. Oxigenación cerebral: Aunque varias variables han sido propuestas para el monitoreo de pacientes con lesión cerebral, SjVO2 ha sido sugerida como medida de la eficiencia de CBF (Fluido Sanguíneo Cerebral). La siguiente ecuación ha sido propuesta para dar información sobre CBF global: CMRO2= CBF (CaO2-CjVO2) CMRO2: es la rata metabólica cerebral para oxigeno. CjVO2: Contenido de oxigeno en la sangre venosa y yugular, el cual es calculado por la presión parcial de oxigeno de la sangre venosa yugular (PjVO2) y SjVO2 similar a los cálculos para CaO2 y CVO2. Una disminución anormal de SjVO2 (menor del 50% - normal 65%) sugiere la posibilidad de isquemia cerebral.119 2.1 .4.2.5 Electrocardiografía (ECG). La electrocardiografía es una representación gráfica de la actividad eléctrica de corazón. No se usa de rutina porque los cambios no son específicos, pero pueden existir trastornos de la onda T, alteraciones del segmento ST o signos de isquemia si la lesión de trauma es severa. Los trastornos de conducción intraventricular que conducen a la prolongación del intervalo QRS, pueden asociarse con traumatismos y cardiopatía isquémica. El ECG sirve para valorar contusión miocárdica, aunque a sabiendas de que apenas 25-38% de los pacientes con trauma de tórax tienen alteraciones en el trazado (Hurst et al,1990). La ecocardiografía y la angiografía con radionúclidos permiten detectar alteraciones tanto funcionales como estructurales en estos pacientes. En el postoperatorio puede servir para el control del paciente120. 119 120 Ibid., p. 1046 PATIÑO R. Jose. Trauma de torax: Manejo general. En: http://www.aibarra.org/Guias/2-8.htm 112 2.1.4.2.6 Ecocardiografia. La ecocardiografía es una herramienta importante para la evaluación del corazón y estructuras adyacentes, identificando lesiones específicas y permitiendo estimar su función de una manera no invasora y sin riesgos para el enfermo. Se utiliza para la medición de las cámaras cardíacas, espesor mural y su motilidad, evaluación de la anatomía y función valvular y examen de los grandes vasos proximales. Además es un método sensible para la detección de efusiones pericárdicas y pleurales, y la identificación de masas tanto intracardíacas como vecinas al órgano. Este estudio, al igual que otros métodos complementarios, es de mayor utilidad dentro del contexto de una anamnesis detallada y examen cardiovascular minucioso. El equipo utilizado así como las características individuales de cada paciente también afectan la calidad de las imágenes obtenidas.121 La efusión se observa por la presencia de un área anecoica entre el epicardio y el pericardio, el cual se torna más ecogénico. La dimensión dependerá de la cantidad de líquido acumulada, y esta no es necesariamente determinante de taponamiento cardiaco.122 La ecocargiografía es el mejor método no invasor para hacer el diagnóstico de derrame pericárdico e incluso para determinar si existen lesiones intracavitarias.123 2.1.4.2.7 Toracoscopia. El examen directo del espacio pleural mediante la toracoscopia y el muestreo de la pleura u otras lesiones pueden ser recomendados cuando los análisis de laboratorio o del líquido pleural y las muestras percutáneas no logran establecer un diagnóstico. La exploración quirúrgica y la necropsia de tales casos a menudo descubren metástasis o granulomas discretos que fueron pasados por alto mediante el muestreo percutáneo aleatorio. Además, algunos tumores pleurales primarios y sarcomas metastáticos pueden producir derrame sin la exfoliación de muchas células neoplásicas, lo que lleva a resultados negativos falsos en el examen citológico del líquido pleural. En la actualidad se reserva la 121 SUBIROS, Isabel. Ecocardiografia: Casuística.En: Selecciones veterinarias.Mar del Plata – Argentina. Vol. 7 No. 5. (Octubre 1999); p. 476 122 ANDRADE, J.N.B.M; BELERENIAN , G. Afecciones pericárdicas en caninos. En: Selecciones Veterinarias. Argentina. Vol. 11. No. 3 (Noviembre 2003); p 254. 123 PATIÑO R. Jose. Trauma de torax: Manejo general. En: http://www.aibarra.org/Guias/2-8.htm 113 toracoscopia para aquellos pacientes con enorme discapacidad para cicatrizar heridas quirúrgicas. Diversos instrumentos fibroscópicos diseñados específicamente para la toracoscopia y otros para la artroscopia o broncoscopia son adecuados. El artroscopio de Storz y el broncoscopio Olympus brindan resultados aceptables. Los instrumentos más apropiados son los toracoscopios rígidos (Storz, Dyonics, Wolt) que aportan un tubo fibroscópico en un canal para extracción de muestras para la biopsia. El procedimiento se realiza con el uso de anestesia general o sedación narcótica profunda y anestesia local. Si está presente una efusión de consideración, debe ser drenada antes de la exploración. Con el paciente en decúbito lateral se inserta una cánula dentro del espacio pleural induciendo un neumotórax parcial para causar la retracción de los lóbulos pulmonares de modo que se puedan examinar las superficies pleurales. Muchos pacientes toleran bien el neumotórax parcial y no detectamos hipoxemia sustancial en los pacientes que reciben suplemento de O2. El toracoscopio es introducido a través de una incisopunción intercostal después de la diéresis incruenta de los músculos intercostales con un fórceps pequeño. El espacio pleural se examina con la ayuda de la succión y la rotación limitada del tórax. El muestreo de lesiones sobre la superficie pleural parietal posee escasos riesgos diferentes de la hemorragia. La obtención de biopsias lesionales de la pleura visceral tiene el riesgo de ocasionar laceraciones y neumotórax adicional. La visualización del mediastino es dificultosa y la exploración del hilio o la base cardiaca son desalentadoras. 2.1.4.2.8 Biopsia a cielo abierto. La toracotomía y la obtención de muestras bajo visualización directa deben ser la última alternativa para el diagnóstico. La obtención de biopsias a cielo abierto naturalmente acarrea los riesgos de la anestesia general y cirugía. Tales procedimientos siempre deben incluir biopsia de pleura, mediastino, ganglios linfáticos traqueobronquiales y en la mayoría de los casos, pulmón. Las muestras deben ser colocadas en medios de cultivo y algunos especímenes se destinan a la inmunofluorescencia. 124 124 ETTINGER,. Op. cit., p. 1153 114 2.1.4.2.9 Biopsias pleurales. La obtención de la biopsia pleural puede ser alcanzada mediante un procedimiento a cielo abierto durante la toracotomía o en forma menos invasiva con técnicas cerradas que se valen del uso de agujas especiales. La biopsia pleural es un medio de particular utilidad en el diagnóstico de la pleuropatía tumoral y desórdenes granulomatosos que redundan en pleurorrea. Puesto que la técnica permite la obtención de muestras tisulares, la anatomía histopatológica es preservada y a menudo se consigue un diagnóstico cuando el examen citopatológico fue negativo o ambiguo. Como tal, este procedimiento suele Ilevarse a cabo frente a efusiones pleurales de etiología desconocida cuando la toracocentesis y los estudios citopatológicos dieron resultados negativos. Las contraindicaciones para la obtención de muestras con aguja son pocas: coagulopatías, insuficiencia pulmonar significativa, piodermia o celulitis en el sitio del muestreo y empiema. Si bien fueron utilizados muchos tipos de agujas en el pasado, los dos instrumentos de aplicación más frecuente son las agujas pleurales de Abrams y Cope. Aunque la aguja de Cope en 4 partes tiene el beneficio agregado de posibilitar la toracocentesis y la obtención de varias muestras sin retirar el instrumento del paciente entre los muestreos. El sitio elegido se prepara en forma aséptica y se procede a la anestesia cutánea y pleural con lidocaína al 2%. Se practica una incisopunción sobre el margen caudal de la costilla para evitar los vasos intercostales. El líquido pleural no debe ser extraído antes de la obtención de la muestra a menos que el paciente tenga una disnea tal que lo justifique. La remoción del líquido pleural impide la biopsia porque obra como separación entre ambas pleuras. Las posibles secuelas incluyen hemotórax, neumotórax o enfisema subcuticular, empiema y la siembra tumoral en el recorrido de la aguja. El neumotórax o hemotórax iatrogénicos de importancia que son sintomáticos, requieren la rápida colocación de un tubo de toracostomía y drenaje con cierre hidráulico. La acumulación de aire o líquido en el subcutáneo puede requerir vendajes compresivos durante un período breve luego del procedimiento. 125 125 Ibid., p. 1154 115 2.1.1 Tratamiento Según el Manual ATLS (Advanced Trauma Life Support Course for Physicians) del American College of Surgeons (ACS,1993), en el manejo general del trauma torácico el médico debe poder identificar e iniciar tratamiento en aquellas lesiones que ponen en serio peligro la vida del paciente. Específicamente, el médico debe identificar y manejar las siguientes entidades son potencialmente fatales a muy corto plazo: En una evaluación primaria: a. b. c. d. e. f. Obstrucción de la vía aérea Neumotórax a tensión Neumotórax abierto Hemotórax masivo Tórax inestable (paradójico) Taponamiento cardíaco. Tabla 3. Pasos a tener en cuenta en la inspección primaria Asegurar la Evaluación de la Evaluar el aparato cardiovascular ( permeabilidad respiración corazón, frecuencia, ritmo) de las vías aéreas Sonidos Palpación Inspección Interrupción de la vía aérea Succiónremoción de cuerpos extraños Cateterización de la tráquea Intubación Ventilación adecuada Color mucosas Auscultación Palpación Severo distress respiratorio Suplementación veces de oxígeno y/o toracocentesis inmediata Mucosas Color Humedad TLLC fuente. http://www.aamefe.org.ar/ruptura_diafr_fel.htm 116 Pulso Temperatura (femoral, Central metatarsiano, Periférica carotídeo) Frecuencia Ritmo Calidad Y en una evaluación secundaria, las siguientes entidades, que también son potencialmente letales: a. b. c. d. e. f. Contusión pulmonar Contusión miocárdica Ruptura aórtica Ruptura del diafragma Ruptura traqueobronquial Ruptura del esófago Para cada una de estas entidades debe el hospital o el servicio de salud definir normas, guías y protocolos de manejo126. Tabla 4. Clasificación tratamientos para trauma CLASE I CLASE II CLASE III Tratamiento inmediato Animales inconcientes, con fallo cardiorespiratorio u obstrucción de las vías aéreas Tratamiento en las primeras horas Politraumatizados Hemorragias Shock CLASE IV A tratar en las Tratar después siguientes horas de las primeras 24 horas Fracturas expuestas Quemaduras Heridas abiertas Heridas que penetran cavidades fuente. http://www.aamefe.org.ar/ruptura_diafr_fel.htm En todos los casos de traumatismos es importante tener en cuenta que el examen clínico detallado debe hacerse después del tratamiento de urgencia, cuyo fin es poner la salud en un estado de mayor estabilidad: corrección de un estado de shock, 126 PATIÑO R. Jose. Trauma de torax: Manejo general. En: http://www.aibarra.org/Guias/2-8.htm 117 detención de la hemorragia, restauración del volumen y de la presión sanguínea, retorno de la estabilidad cardiorrespiratoria.127 El tratamiento se debe de adaptar a las necesidades individuales de cada animal. Es recomendable colocar y mantener por lo menos un catéter IV para la administración de líquidos y medicamentos al inicio del tratamiento. En animales muy traumatizados es aconsejable colocar dos catéteres IV (uno puede ser en una vena central) para permitir la instilación rápida de líquidos intravenosos. El método ABC es consistente y completo para el tratamiento inicial de animales con traumatismo toráxico.128 2.1.5.1 Método ABC 2.1.5.1.1 Vía aérea: Lo primero que se debe hacer es suministrar al paciente una adecuada ventilación. La ventilación envuelve una adecuada función del pulmón, de la pared del pecho y del diafragma. Los signos que se muestran cuando hay una obstrucción en las vías aéreas y/o una inadecuada ventilación son: 1) Retracción intercostal 2) Sonidos de borboteo 3) Estridor 4) Arduo trabajo de los músculos accesorios de la respiración (cara y el cuello) 5) Disminución de los sonidos respiratorios (unilateral o bilateral) 6) Cianosis (signo poco confiable y tardío) 7) Movimiento mínimo o ausente de la pared del pecho 8) Ausencia de intercambio de aire de la nariz o la boca 9) Intranquilidad y/o ansiedad Manejo de problemas que amenazan la respiración/vías respiratorias: 1) Succión de las vías respiratorias 127 128 ARCHIBALD, Op. cit., p. 42 BIRCHARD, Op. cit., p. 706 118 2) Remoción de lo que pueda causar obstrucción de las vías aéreas 3) Administración de oxígeno 4) Intubación o colocación de tubo de traqueostomia 5) Ventilación mecánica o manual 6) Cierre temporal de las heridas abiertas en el pecho 7) Toracentesis 8) Colocación de tubo de Toracostomia y succión intermitente o continua / drenaje129 Todo obstáculo en el árbol respiratorio debe ser retirado inmediatamente. Si hay lesiones traqueales, vómitos o hemorragias nasofaríngeas, es necesario hacer rápidamente una intubación traqueal, y si fuera preciso una traqueotomia130 Lo principal es asegurarse de que el animal tenga una vía aérea viable, por lo consiguiente se debe tener en cuenta que no exista ningún objeto que obstruya la tráquea o los bronquios, de lo contrario se deben de emplear fórceps o aspiración o se debe pasar un tubo endotraquial. Si la faringe, la laringe o la porción craneal de la tráquea están muy dañados, se puede efectuar traqueostomía.131 Hay que recordar que los animales tienen la traquea de mayor longitud que la de los humanos o pueden tener el mismo tamaño, se debe de escoger el tipo de tubo a colocar ya que varia de acuerdo al tamaño del animal. Los pasos para una intubación son: 1. Colocar el animal en posición esternal 2. Usar una gasa de 4x4, se toma la punta de la lengua y se jala hacia fuera de la boca. Esto es frecuentemente suficiente para exponer la glotis. 3. Usa un laringoscopio largo de Miller, se presiona la epiglotis contra la parte anterior de la garganta 129 Harold Davis Jr., RVT, VTS (Emergency & Critical Care). Management of the Shock Trauma Patient. En:http://www.vetlatranquera.com.ar/pages/ACVC2001/PR0460.htm 130 ARCHIBALD, Op cit., p. 43 131 BIRCHARD, Op cit,. p. 706 119 Figura 13. Laringoscopio de Miller para sondeo endotraqueal Fuente: http://members.aol.com/henryhbk/avls.html 4. se inserta en tubo, y se infla el balón. 5. se controla que el tubo este en su lugar. Se envuelve con una tira de vendaje de 25 cm el tubo dentro de la boca y se ata en un moño sobre el hocico, esto debe de mantener el tubo en su lugar. Siempre se debe chequear que el tubo esta en el lugar después de cualquier movimiento. Figura 14. Colocación de sonda endotraqueal Fuente: http://members.aol.com/henryhbk/avls.html 120 2.1.5.1.2 Circulación: La inestabilidad circulatoria puede ser debido a la hipovolemia como resultado de: Una perdida externa de sangre o perdida de sangre oculta (perdida dentro de una cavidad corporal o extremidades), pero también puede ser debido a una falla en el corazón (falla intrínseca en el corazón, arritmias, taponamiento del corazón). El tipo más común de shock que se ve en el trauma es el shock hipovolémico. Shock: es una inadecuada perfusión del tejido resultando en una entrega inadecuada de oxígeno; los signos de shock son indicados por la disminución de la perfusión del tejido y por la respuesta del sistema simpático.132 Si la función del miocardio es satisfactoria, se administran líquidos IV en la cantidad necesaria para incrementar el volumen sanguíneo circulatorio y el gasto cardiaco. En la mayoría de los casos de choque hipovolémico se administra un volumen de sangre (90 ml/kg en perros) tan rápido como el flujo de la gravedad lo permita. Después de la infusión rápida de un bolo de líquidos IV equivalente a un volumen de sangre, se vuelve a evaluar el estado de! paciente y se determina la necesidad de continuar la hidroterapia. Cuando se han abatido los signos de choque hipovolémico y la hemorragia ha cesado, se sigue administrando líquidos a una velocidad de 30 a 50 ml/kg/24 horas. Si la condición del animal no se estabiliza, se continúa la administración rápida de líquidos. Se auscultan los pulmones en busca de edema pulmonar y se evalúan cuidadosamente otros signos de edema (p. ej., quemosis, lagrimeo, inflamación tisular, disminución del Ht y de la CPP). Si es necesario, se evalúa la presión venosa central (PVC) para determinar la capacidad del lado derecho del corazón para bombear el volumen de sangre que se le presenta. El cambio relativo en la PVC es más significativo que el valor absoluto, y un incremento de 7 al 0 cm H20 indica que la velocidad de administración de líquidos debe disminuirse. 132 DAVIS, Harold. Management of the Shock Trauma Patient (Emergency and critical care). En: http://www.vetlatranquera.com.ar/pages/ACVC2001/PR0460.htm 121 Debido a que la baja presión oncótica de los líquidos cristaloides puede contribuir a la pérdida de líquido hacia el espacio tisular, una regla general para la reposición del volumen sanguíneo por líquidos cristaloides es la siguiente: Por cada mililitro de sangre perdida se administran 3 ml de líquido cristaloide. Pasos para la cateterización venosa: 1. Afeitar una porción del brazo (2-5 cm) aproximadamente a 4-8 cm proximal al carpo Figura 15. Cateterización venosa Nº1. (Vena cefálica) Fuente. http://members.aol.com/henryhbk/avls.html 2. Se limpia el sitio con una solución (yodo diluido o ixodine) y luego pasar alcohol. 3. Una persona debe de coger firmemente la extremidad anterior un poco distal al codo, se estira la extremidad con el pulgar sobre el lado medial del brazo. La persona que inserte el catéter debe de sostener la parte distal de la extremidad anterior se luego se estira con una moderada tensión, asegurándose de que no corte la circulación 4. Se balancea el pulgar a la parte lateral, se gira el brazo unos 60 grados. Este balanceo permite ver la vena cefálica en una posición más fácil de encontrar y al momento que es colocado el torniquete 5. Con el bisel del catéter hacia arriba , deliberadamente se inserta el catéter dentro de la vena. Nota, las venas de los animales son más superficiales que la de los humanos. Se debe de usar el tamaño de catéter adecuado, para perros grandes (50 lbs / 22kg) se usan 20 o 18. 122 Figura 16. Cateterización venosa Nº 2. (Vena cefálica) Fuente. http://members.aol.com/henryhbk/avls.html 6. Cuando se ve la cámara accesoria del catéter con sangre, se debe de introducir el catéter dentro de la vena, luego se jala el estilete y se deja a dentro el capuchón de plástico. Se debe de probar si existe un buen flujo esto se hace administrando una pequeña cantidad de solución salina en la vena. 7. Luego se tapa el catéter con esparadrapo, y se asegura de que también llegue el esparadrapo a la parte proximal al catéter para poder fijarlo a la piel del animal133. Figura 17. Cateterización venosa Nº 3. (Vena cefálica) Fuente. http://members.aol.com/henryhbk/avls.html 2.1.5.1.3 Respiración (espontánea o asistida) y oxigenoterapia. La suplementación de oxígeno tiene 3 funciones principales: tratar la hipoxemia, disminuir el esfuerzo respiratorio y disminuir el esfuerzo miocardial. La terapia de 133 FELDMAN, Henry y FELDMAN, Lori. Advanced Veterinary life support for the ACLS Health care professional. En: http://members.aol.com/henryhbk/avls.html 123 suplementación de oxígeno es indicado en cualquier paciente con una grado de dificultad respiratoria, usando métodos de administración convencionales. Los 4 métodos comúnmente usados para proveer suplementación de oxígeno son: máscara facial, insuflación nasal de oxígeno, jaula con oxígeno y administración intratraqueal de oxígeno. Tabla 5. Métodos de suplementación de oxígeno MÉTODO Máscara facial Oxígeno nasal Jaula de oxígeno VENTAJAS Simple Económico Rápidamente disponible Provee una FIO2 de 4060% Más libertad de movimiento para el paciente No invasivo Provee FIO2 en un ambiente con humedad y temperatura controlada Menos stress para el paciente DESVENTAJAS Requiere un gran flujo de O2 Paciente puede no tolerar la máscara paciente debe ser asistido todo el tiempo FIO2 no es conocida (2444%?) Un excesivo flujo puede causar dilatación gástrica Paciente es fisicamente separado del que suministra el oxígeno Entradas abiertas permiten la salida del oxígeno Máximo de FIO2 es 40-50% en porcentaje económico www.jaulashb.com.ar/ Jaulas%202.htm Intratraqueal Puede colocarse un cateter transtraqueal durante emergencias FIO2 de 40-80%, depende del catéter o el tubo endotraqueal que es usado La colocación del tubo endotraqueal puede requerir sedación o anestesia, un tubo de traqueostomia puede ser requerido requiere de monitoreo continuo Fuente: http://www.cvmbs.colostate.edu/clinsci/wing/trauma/dyspnea.htm 124 La conservación de la integridad de la pared toráxica es uno de los puntos importantes a la hora de establecer un tratamiento, ya que se busca estabilizar al animal para que se pueda realizar una ventilación adecuada; si el animal después de este sellado no puede realizar una respiración por si solo se debe de suministrar ventilación asistida, la cual requiere de un tubo endotraqueal o de traqueostomia, algunas veces es necesario anestesiar al animal o suministrarle bloqueadores neouromusculares para ocasionar el menor movimiento por parte del paciente. El catéter transtraqueal puede colocarse empleando un catéter yugular de gran calibre (12 a 18) que se pasa entre los anillos de la tráquea, este se asegura a la piel y se conecta a la fuente de oxígeno. Se administra el oxígeno por el catéter transtraqueal a una velocidad inicial de 10 a 20 ml/kg/min. 134 Tabla 6. Modificaciones de la gasometría sanguínea, pH, equilibrio ácido-base y saturación de oxígeno en pacientes normo, hipo e hiperventilados Normales hipoventilación hipoventilación+O2 hiperventilación pH 7,40 7,29 7,29 7,51 PCO2 (mmHg) 40 63 62 25 PO2(mmHg) 99 55 127 162 Bicarbonato(mmHg) 25 21 21 23 Exceso de bases 0 -5 -4 4 Saturación de O2 98 88 99.8 99.6 Estos valores son aproximados y dependen de cada caso Fuente:www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Informacion/Temas_anestesia/VEN TILAC.PDF Ventilación pulmonar. La ventilación es el movimiento de los gases a través del pulmón. Es un proceso de entrada y salida de aire, seguido de una pausa respiratoria en el que se permite el ingreso de diferentes volúmenes de aire así como la salida de estos. 135 El oxígeno es necesario para el funcionamiento celular, y el anhídrido carbónico se produce del metabolismo tisular y debe ser eliminado fuera 134 135 BIRCHARD, Op. cit., p. 706 CUNNINGHAM, Fisiología Veterinaria. México: Mc Graw Hill, 1999. p. 627 125 del organismo. La función principal del sistema respiratorio es captar oxígeno del aire y eliminar el anhídrido carbónico del organismo. El intercambio gaseoso se realiza en los alvéolos entre el aire alveolar y los capilares sanguíneos. 136 Ventilación artificial. La ventilación artificial es un soporte respiratorio por medios manuales o mecánicos, cuando la respiración normal es ineficaz o se ha deteriorado. Los principales objetivos de la ventilación artificial, asistida o controlada son revertir la apnea, disminuir la PaCO2, aumentar la PaO2 y, por último, minimizar el trabajo de la ventilación. Cualquier procedimiento que proporcione oxígeno y anestésico a los pulmones del paciente mediante presión exterior se denomina ventilación por presión positiva intermitente (VPPI). Mediante esta técnica, los pulmones son inflados forzando la entrada de aire o mezcla gaseosa de aire/oxígeno/protóxido/anestésico inhalado desde el balón del circuito o desde un ventilador mecánico. Es el método de ventilación más común, sencillo y similar a la ventilación fisiológica aunque en este último caso la entrada de aire se produce por una fuerza negativa proveniente de la cavidad toráxica. La importancia de esta técnica reside en que en muchos casos, durante la anestesia, la ventilación pulmonar esta deprimida en grados que la hacen incompatible con una oxigenación adecuada, comprometiendo incluso la vida del animal. La VPP esta indicada siempre que un paciente es incapaz de mantener sus propias necesidades ventilatorias o de oxigenanción. Tabla 7. Ventilación artificial Valores típicos de ventilación artificial Pico de presión 6-15 cm H2O* Frecuencia respiratoria 8-15 resp/min Volumen corriente 6-12 ml/kg Volumen minuto 150 y 250 ml/kg/min Tiempo inspiratorio 0.75 – 1.5 seg Relación inspiración/espiración en seg 1/1 - 1/3 * las presiones más bajas se aplican en animales de menor tamaño como gatos, aumentando progresivamente con el peso del animal Fuente:www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Informacion/Temas_anestesia/VEN TILAC.PDF 136 SACRISTAN, Garcia A. Fisiología Veterinaria. España: Mac Graw Hill. 1995, p.383. 126 Los efectos adversos de la ventilación artificial (VPP) son: Las grandes venas del tórax se comprimen impidiéndose el flujo de sangre venosa de retorno a las aurículas derecha e izquierda afectando además el volumen sanguíneo pulmonar. La disminución del retorno venoso reduce el llenado diastólico ventricular, el volumen sistólico, la presión arterial y finalmente el gasto cardíaco. La VPP puede provocar ruptura alveolar con neumomediastino, enfisema subcutáneo, neumotórax y / embolismo gaseoso. Presiones medias sostenidas de 50 cm H2O en el perro normal sano provocan ruptura alveolar septal. La hiperventilación es una complicación iatrogénica frecuente de la VPP, donde se producen cambios muy rápidos en la PaCO2 y pH arterial que desembocan en alcalosis respiratoria. - Ventilación asistida y controlada. La ventilación puede asistirse o controlarse. En la ventilación asistida, se asegura que el paciente inspire un mayor volumen de aire siendo el paciente el que inicia la inspiración. Este método se emplea muy poco durante la anestesia porque tiende a producir hiperventilación. En la ventilación controlada, se fuerza la entrada del aire en los pulmones, y el paciente no realiza ningún esfuerzo ventilatorio espontáneo. En este caso, el anestesista controla el volumen de aire, la frecuencia respiratoria y la presión de aire introducida al animal. - Ventilación manual y mecánica. La ventilación manual puede usarse para asistir o controlar la ventilación mediante la administración de presión sobre el balón del circuito anestésico. Este se comprime hasta que los pulmones se expanden de forma similar a como lo harían en un animal despierto y sano. Debe evitarse una presión excesiva (> 20 cm H2O o 14 mmHg) que es especialmente fácil de alcanzar en animales pequeños. Su aplicación ocasional, cada 5 min, permite expandir los alvéolos colapsados y revertir la aparición de atelectasias. La presión aplicada puede comprobarse dado que algunos circuitos anestésicos incorporan un manómetro o puede adaptarse uno al circuito. 127 Alternativamente puede conectarse una columna de agua que mide la presión en cm de agua en lugar de mmHg; este último método es una forma muy sencilla de aprender a calcular la presión ejercida sobre el balón del circuito durante la ventilación manual. Figura 18. AMBU Fuente. www.mediset.cz/ambu/ambuvaky.htm Las desventajas de la ventilación manual radican en que una persona debe atender de forma constante e intensiva (y costosa en tiempo y/o dinero) la ventilación y que la ventilación mecánica es más precisa, y continua; resulta difícil que alguien sea capaz de mantener una ventilación manual constante durante períodos largos de tiempo sin distraerse como lo haría una máquina. La ventilación mecánica es básicamente idéntica a la ventilación manual. Existen varios tipos de ventiladores mecánicos con diferentes formas de controlarlos. El ventilador ciclado por presión suministra gases hasta que se alcanza una presión máxima (6-15 cm H2O), Ej: Bird Mark. El ventilador ciclado por volumen suministra gases hasta que se alcanza un volumen predeterminado (6-12 ml/kg). El ventilador ciclado por tiempo suministra gases durante un tiempo prefijado (1-2 seg) manteniendo un tiempo espiratorio del doble o triple (relación I/E: ½ o 1/3), ej: Penlon. (Figura 2). 137 137 ALVAREZ, et al. La ventilación artificial en el perro y el gato. www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Informacion/Temas_anestesia/VENTILAC.PDF 128 2001. En: Figura 19. Ventilador Penlon Fuente:www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Informacion/Temas_anestesia/VEN TILAC.PDF La ventilación mecánica se recomienda en toracotomías o en intervenciones de larga duración donde la ventilación manual no es lo suficientemente regular como para evitar desviaciones hacia la hiper o hipoventilación. - Ventilación espontánea. Respiración normal, sin ayuda en la cual el paciente crea el gradiente de presión mediante los movimientos de la pared del tórax y de los músculos que desplazan el aire hacia dentro y hacia fuera de los pulmones. Diferencias entre ventilación espontánea y mecánica: • Presión intrapulmonar. Durante la respiración espontánea, el flujo de aire desde el exterior al interior de los pulmones se produce por una diferencia de presión entre el exterior y le alvéolo. Esta diferencia de presión sería de poca magnitud siempre y cuando solo hubiese que vencer la resistencia de las vías aéreas. El principal esfuerzo de los músculos respiratorios se realiza para vencer la distensibilidad del pulmón. La diferencia de presión en un sujeto consciente que respira en reposo es del orden de 1-2 cm H2O, y como la presión en la boca es atmosférica, la presión en el alvéolo durante la inspiración debe ser subatmosférica. Al final de la inspiración la presión en del alvéolo aumenta a unos pocos cm de agua sobre la presión atmosférica, 129 disminuyendo gradualmente hasta la presión atmosférica cuando los pulmones se vacían. Por el contrario, durante la respiración controlada con presión positiva, la presión en el alvéolo aumenta desde atmosférica hasta 615 cm de agua. Durante la fase espiratoria la presión disminuye hasta igualar la atmosférica mientras los pulmones se vacían. • Presión intrapleural: durante la ventilación espontánea la presión intrapleural es normalmente de – 5 cm H2O al final de la espiración; sin embargo, cuando comienza la inspiración se produce una importante caída hasta – 10 cm H2O, volviendo a – 5 cm H2O durante la espiración. Durante la ventilación controlada, la presión intrapleural aumenta durante la fase inspiratoria desde – 5 cm H2O hasta 3 cm H2O, cayendo nuevamente a – 5 cm H2O durante la espiración. Manejo del paciente ventilado. La eficacia de la ventilación manual o mecánica debe comprobarse periódicamente mediante una valoración clínica del color de las mucosas y de la expansión pulmonar o del balón del circuito, o mediante equipamiento que permita valorar la saturación de oxígeno de la hemoglobina (pulsioxímetro), la eliminación de CO2 al final de la espiración (capnógrafo; ETCO2 o end tidal CO2 entre 30 y 40 mmHg), determinando el volumen corriente o minuto (espirómetro) o mediante gasometría sanguínea. El empeoramiento del gasto cardiaco puede comprobarse rápidamente verificando la disminución de la amplitud del pulso o de la presión arterial. Ventilación del animal anestesiado. La ventilación del animal anestesiado difiere significativamente de la ventilación normal; prácticamente todas las técnicas anestésicas generales producen depresión respiratoria. Uno de los efectos más evidentes es la depresión central y periférica de la respiración producida por el empleo de fármacos durante la anestesia. Los tranquilizantes y anestésicos generales reducen la respuesta del centro respiratorio al CO2, como consecuencia la inspiración es menos frecuente. 130 Los tranquilizantes y anestésicos generales actúan también periféricamente relajando los músculos intercostales y diafragma, expandiendo el tórax en menor medida y reduciendo el volumen corriente. Si el volumen corriente de un animal despierto es de 6-12 ml/kg, este puede reducirse en el animal dormido a 6 ml/kg o menos. La consecuencia de la reducción de la frecuencia respiratoria y volumen corriente es la considerable disminución del volumen minuto y las alteraciones de la gasometría sanguínea así como del equilibrio ácido–base. La PaCO2 se incrementa al no eliminarse el CO2 lo suficientemente rápido. Este exceso de CO2 se combina con agua formando iones bicarbonato e hidrógeno siendo este último incremento de hidrogeniones la causa de acidosis (de origen) respiratoria. Si el pH fisiológico es de 7.38 – 7.42, este puede descender hasta 7.2 en un animal anestesiado. Si el animal respira aire, la concentración arterial de oxígeno (PaO2) descenderá como consecuencia de la disminución del volumen minuto y una reducción de la cantidad total de O2 que entra hacia los pulmones. Además, la reducción del volumen corriente no permite la expansión total del alvéolo y ciertas zonas del pulmón pueden colapsarse produciendo atelectasias. El anestesista debe contrarrestar estos efectos empleando diferentes técnicas. La PaO2 puede elevarse, normalmente por encima de los niveles fisiológicos, administrando oxígeno con el aire o sustituyéndolo ( 100% O2) ; la concentración mínima de O2 que debe administrarse a un paciente anestesiado es del 30 %. Resulta más difícil prevenir la aparición de atelectasias o un incremento de la PaCO2 pero estos solo son significativos si el paciente está anestesiado por períodos largos de tiempo ( >2 h ) o en pacientes con depresión respiratoria grave. En estos casos debe asistirse o controlarse la ventilación manualmente mediante la compresión intermitente del balón de circuito anestésico o ambú (cada 5 segundos es adecuado en la mayoría de los casos), o bien utilizando un ventilador mecánico. Retorno a la ventilación espontánea. Cuando la cirugía termina y se va a proceder a despertar al animal, el control de la ventilación debe volver a espontáneo. Esto se realiza disminuyendo la profundidad anestésica reduciendo la concentración de anestésicos inhalatorios que se suministran al animal o 131 dejando que estos se eliminen si son anestésicos inyectables. Este proceso puede prolongarse durante varios minutos, especialmente en pacientes debilitados. La reducción de la frecuencia respiratoria, a 5 resp/min aproximadamente, permite aumentar los niveles de CO2 que actúan como estimulante respiratorio y favorecen el inicio de la ventilación espontánea. Si los esfuerzos ventilatorios son adecuados puede desconectarse el ventilador. En algunos casos el animal puede empezar a moverse antes de comenzar a ventilar espontáneamente; en estos casos no debe retirarse el tubo endotraqueal hasta comprobar que el animal ventila correctamente. Si el periodo de transición a la ventilación espontánea es muy brusco, los pacientes pueden desarrollar complicaciones hipoventilatorias o hipóxicas. En la mayoría de los casos un plano anestésico excesivamente profundo es la causa de estas complicaciones. Hasta que este plano no sea suficientemente superficial, debe mantenerse el soporte ventilatorio. Tampoco debe retrasarse porque resulta muy molesto para un animal consciente y la presencia del tubo endotraqueal puede producir un espasmo bronquial o laríngeo. Durante el proceso de desconexión de la ventilación artificial se debe administrar oxígeno al 100% hasta que el animal presente un patrón ventilatorio normal.138 Evaluar SNC (Nivel de conciencia, grado de disfunción neurológica, cabeza, cuello, columna, abdomen, extremidades, si hay evidencias de trauma específico del S.N.C, desplazamiento columna, pupilas y fracturas obvias). 2.1.5.2 Inspección secundaria post resucitación y estabilización - Historia detallada o Examen físico cuidadoso (=orden inspección primaria) o Sistema respiratorio 138 ALVAREZ, et al. La ventilación artificial en el perro y el gato. www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Informacion/Temas_anestesia/VENTILAC.PDF 132 2001. En: o Disfunciones severas pueden NO ser comprometer más tarde la vida del paciente aparentes al principio y o Sistema cardiovascular o Igual que el respiratorio, puede haber complicaciones que tarden en manifestarse - E.C.G. atención al trauma romo cerrado - Llevar planilla con datos y gráficos para controlar o Abdomen (Visualización, palpación, auscultación, percusión, paracentesis, lavado peritoneal como diagnóstico y cateterización vesical) - Reexaminar al paciente a intervalos regulares desde la nariz a la cola - Concluida la inspección secundaria - Prioridades médicas - Prioridades quirúrgicas 2.1.5.3 Tratamiento quirúrgico 2.1.5.3.1 Tipos de abordajes Toracotomía Mediana: No es un método muy utilizado, ya que no es un abordaje rutinario, requiere el uso de una sierra oscilante, es sumamente dolorosa y como única técnica no permite explorar la cavidad abdominal, lo cual es fundamental en los pacientes con traumatismo reciente. Como contrapartida da un adecuado abordaje a ambos hemitórax facilitando la liberación de adherencias, otra ventaja de éste abordaje es que en caso de existir hemorragia intratoráxica se facilita su identificación y control. 133 Toracotomía Intercostal: Si bien su ejecución no precisa de una sierra como en el caso anterior, permite abordar un solo hemitórax, por lo que la ruptura debe ser unilateral, debiendo tener previamente identificado el lado afectado, tampoco permite la exploración abdominal y es más dolorosa que una laparotomía Laparotomía mediana; Es el abordaje más utilizado por varias razones, es sencillo, de las técnicas utilizadas es la menos dolorosa, permite una adecuada exploración abdominal, permite resolver las mayoría de los casos y en caso de no ser así se puede combinar con otras técnicas. Laparotomía mediana + Toracotomía mediana: Se realiza, cuando tras haber realizado una laparotomía mediana, se necesitan liberar las adherencias intratoráxicas , o controlar una hemorragia intratoráxica, a la que no sea posible acceder desde la laparotomía Laparotomía mediana + Laparotomía Paracostal: Se realiza, cuando tras haber realizado una laparotomía mediana, se dificulta el acceso a las porciones más dorsales del diafragma. 2.1.5.3.2 Instrumental especial. Hay una serie de elementos que son de gran ayuda en ésta cirugía. Es fundamental una iluminación adecuada, y el mejor medio de lograrlo es mediante un frontoluz. Es necesario el uso de separadores estáticos del tipo Gosset o Balfour para la laparotomía mediana, para toracotomías podemos utilizar un Gosset; Balfour, Baby Finochietton o un par de Gelpi (Gráfica 5 ). Otro elemento que puede ser de utilidad para no obstruir con las manos el campo visual, son las pinzas de prensión elásticas acodadas o en bayoneta.139 139 ROHR A, Adrian. Ruptura diafragmatica. En: http://www.aamefe.org.ar/ruptura_diafr_fel.htm 134 Figura 20. Separadores estáticos del tipo Balfour, Finochietton y Gelpi Fuente. http://www.faico.com.ar/fotos/Separador_Balfour_Mediano.jpg;´http://www.faico.com.ar/fotos /Separador_Finochietto.jpg; http://www.faico.com.ar/fotos/Separador_Gelpi.jpg 2.1.5.3.3 Técnica o Manténgase al paciente bajo ventilación mecánica durante todo el proceso de reparación. o Hágase un acceso al diafragma mediante incisión en la línea media ventral del abdomen. o Inicialmente puede ser necesario aumentar el defecto diafragmático con el fin de reducir las vísceras herniadas. Si este es el caso, se hace la incisión en dirección ventral para simplificar su reparación. o En casos de hernia crónica, pueden presentarse adherencias entre las vísceras y el diafragma o los pulmones; se deben romper cuidadosamente. o Una vez reducidos los órganos desplazados, se examinan los pulmones y el espacio pleural; se cierra el orificio con sutura sintética absorbible o con 135 monofilamento no absorbible (sutura continua simple o de colchonero horizontal). o La sutura se inicia en la cara más dorsal de la hernia y se continúa cerrando en dirección ventral. o Se toman grandes "mordidas" de la musculatura de la pared abdominal o de las costillas cuando se suture el diafragma que se ha avulsionado de la pared corporal' ventrolateral. o Si se han destruido grandes porciones del diafragma, se repara el defecto con malla sintética o trasponiendo un colgajo del músculo abdominal transverso. o Después de la cirugía se coloca un tubo de toracostomía para extraer aire y líquido.140 2.1.5.3.4 Cuidados post- quirúrgicos. Es la parte más importante de la cirugía. El soporte respiratorio (tubo de oxígeno o jaula), es esencial en estos casos. La mayoría de los perros son presentan hipotermia y shock. La manta térmica, el control de la temperatura ambiental y el soporte de fluido son necesarios. La analgesia es de extrema importancia en cualquier caso de trauma. El dolor evita la buena función de la mayoría de los sistemas corporales.141 2.1.5.3.5 Complicaciones. Puede haber colecta pleural, en caso de producirse se debe drenar, por punción o si la acumulación es importante se puede colocar una sonda de toracostomía. El edema pulmonar por reexpansión se produce dentro de las 24 a 48 hs, se lo trata con oxigenoterapia, corticoides y diuréticos, pero generalmente con no muy buenos 140 BIRCHARD, Op. cit., p. 710 KIRPENSTEIJIN J. The role of emergency surgery in thoracic trauma : Soft tissue surgery section. department of clinical science of companion animals faculty of veterinary medicine , Utrecht University. En: http://www.vin.com/proceedings/Proceedings.plx?CID=WSAVA2002&PID=2701 141 136 resultados, por eso es muy importante su prevención evitando presiones de ventilación elevadas y la sobredistensión pulmonar.142 2.1.5.4 Farmacoterapia utilizada en eventos de emergencia respiratoria. 2.1.5.4.1 Manejo de emergencia para el distress respiratorio. El manejo inicial de un paciente con distress respiratorio debe de estar enfocado en minimizar el stress del paciente y en identificar los hallazgos diferentes encontrados en el examen físico. Se suministra suplementación de oxígeno por cualquiera de los medios antes mencionados. Raramente un paciente con distress severo requiere anestesia de inducción de emergencia y ventilación manual con un AMBU, máquina de anestesia o ventilador mecánico. Los clínicos deben de recordar que en un animal con distress marcado o molestia respiratoria, las dosis de anestésico requerido para permitir la intubación endotraqueal son reducidas. 2.1.5.4.2 Obstrucción de las vías respiratorias. Las 2 causas más comunes de obstrucción que son identificadas en cuidados intensivos son la parálisis laríngea y el síndrome respiratorio de los braquicéfalos. La mayoría de los animales afectados con parálisis laríngea son perros viejos de razas grandes (Retrievers y Setters) con una historia crónica de sonido de carraspeo al respirar y posibles cambios al ladrar. Los perros que llegan a emergencia frecuentemente presentan un distress respiratorio severo a moderado con una exacerbación aguda. Los perros se encuentran con frecuencia con hipertermia, algunas veces en exceso o sea más de 105 0 F. El manejo farmacológico exitoso de los perros afectados incluye: 142 Suplementación de oxigeno Sedación Agente antiinflamatorio Fluido intravenoso ROHR A, Adrian. Ruptura diafragmática. En: http://www.aamefe.org.ar/ruptura_diafr_fel.htm 137 - Una posible traqueostomia por medio de anestesia general. (Tabla 8) Tabla 8. Agentes farmacéuticos usados para el manejo médico de la enfermedad de las vías respiratorias altas. Agente farmacéutico Dosis Ruta Comentarios Acepromacina 0.01 – 0.05 mg/kg IV, IM sedante, no dar más 3 mg por perro Dexamentasona 0.01 – 0.25 mg/kg IV antiinflamatorio Prednisona 0.25–1.00 mg/kg SC, PO antiinflamatorio Butorfanol 0.1 – 0.4 IV, IM analgésico, sedante mg/kg Abreviaciones: IV, intravenoso; IM, intramuscular; SC, subcutáneo; PO, oral Fuente. RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1075 La droga más usada para la sedación es la acepromacina a bajas dosis. Típicamente, muchos perros mejoran si se alivia la ansiedad asociada con la obstrucción de las vías respiratorias altas. La mayoría de los perros se mejoran con las drogas antiinflamatorias tales como la dexametasona o la prednisolona. Perros con parálisis laríngea son propensos a presentar neumonía por aspiración, particularmente después de la cirugía debido a la perdida de la habilidad para guardar el aire143. 2.1.5.4.3 Trauma. Los perros frecuentemente experimentan trauma toráxico. El trauma toráxico es típicamente tratado con cuidado de soporte, incluyendo el reposo, 143 RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1075 138 suplementación de oxígeno, toracocentesis para neumotórax y fluidos intravenosos necesarios para mantener la perfusión. La mejor recomendación para el tratamiento incluye el mantenimiento adecuado pero no excesivo del volumen intravascular u el monitoreo cuidadoso del animal para el progreso de la dificultad respiratoria. Diuréticos tales como la FUROSEMIDA, deben de ser evitados en animales con hipovolemia144. 2.1.5.4.4 Neumonía. Es común que se desarrolle en perros hospitalizados. La neumonía más frecuente en perros es la desarrollada como resultado de aspiración, aunque pueden adquirir hongos o problemas hematógenos. Los hallazgos clínicos frecuentes incluyen: infiltración alveolar vista por medio de radiología, tos, fiebre y letargia. El tratamiento de la neumonía incluye eliminar la causa principal si es posible, usando los antibióticos apropiados, suministrando suplementación de oxígeno de acuerdo a lo que necesite el paciente y la realización de fisioterapia (nebulización). La terapia con antibióticos es idealmente escogida de acuerdo al cultivo bacterial y al test de sensibilización de los fluidos de muestra del lavado traqueal. Los antibióticos de amplio espectro deben de ser aplicados tan pronto como la neumonía sea identificada. En una neumonía causada por la Bordetella Bronchiseptica, al hacer el análisis microbiológico se ve que es susceptible a las tetraciclinas, doxiciclinas, enrofloxacina y amoxicilina/ ácido clavulónico. En áreas endémicas, las neumonías por hongos (blastomicosis, histoplasmosis y coccidiomicosis) pueden resultar en enfermedad pulmonar moderada a severa. (Cuadro 9). En perros muy enfermos que se encuentran hospitalizados, la terapia es frecuentemente comenzada de acuerdo al cultivo bacterial y a los resultados de sensibilidad con una combinación de ampicilina y enrofloxacina o cefalozina, gentamicina y metronidazol en infecciones adquiridas en hospitales, se esperan que sean resistentes, la elección de antibióticos puede incluir Imipenem, Amikacina, Cefoxitina. 144 Ibid., p. 1076 139 Tabla 9. Antibióticos usados en el tratamiento de neumonía a ___________________________________________________________ Antibióticos Dosis (mg/kg) Ruta Gram + GramAnaeróbios Ampicilina 22 cada 6 h IV +++ ++++ Cefalozina 22 cada 8 h IV +++ ++ Gentamicina 5-6 cada 24 h IV Enrofloxacina 2.5 – 10 cada 12- 24 horas IM, IV,PO Metronidazol 10 cada 8 h IV +++ +++ +++ +++ Abreviaciones: IV, intravenoso; IM, intramuscular; PO, oral; +, positivo. Fuente. RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1076 2.1.5.4.5 Lesión pulmonar aguda y síndrome de distress respiratorio agudo: Estas condiciones son definidas como síndromes clínicos de distress respiratorio caracterizados por la presencia de un evento anterior (trauma o sepsis), el desarrollo de infiltración alveolar en radiografía torácica, disminución del desempeño pulmonar, y la ausencia de falla cardiaca congestiva. Las recomendaciones para el tratamiento y manejo, incluyen el monitoreo cuidadoso del paciente en riesgo, limitar los picos de presión en animales con ventilación y tratar de manera agresiva la causa principal145. 2.1.5.4.6 Tromboembolismo pulmonar: Es una condición que ha sido reconocida en perros críticamente enfermos. PTE puede ser una condición desafiante para identificar tanto en perros como en personas, porque los signos clínicos pueden variar de imprecisos a una muerte peraguda. 145 Ibid., p. 1077 140 Farmacológicamente las intervenciones utilizadas en el tratamiento de PTE incluye terapia anticoagulante y terapia trombolítica (Tabla 10). Terapia con anticoagulantes usada en animales incluye la heparina no fraccionada (UFH), heparina de bajo peso molecular (LMWH) y warfarina. UFH ha sido más utilizada por su extensa disponibilidad y por su bajo costo. Ambas formas de heparina actúan principalmente para limitar la conversión del fibrinógeno a fibrina al acelerar la acción de la antitrombina III que inhibe los factores activados de coagulación (II, IX, X, XI y XII). Tabla 10. Anticoagulantes Droga Dosis Mecanismo de acción Heparina no fraccionada 10-20 IU/kg/h CRI a 300 IU/kg SC 6 horas Realza la actividad de AT al inhibir el factor de coagulación Heparina de bajo peso Molecular 100 IU/kg cada 12 horas Lo mismo, pero más previsible Aspirina 0.5 – 2.0 mg/kg cada 24 horas Antiplaquetario 25.000 IU por 1 hora, luego 10.000 IU/h Trombolitico Warfarina 0.05–0.2mg/kg Anticoagulante, requiere un monitoreo cuidadoso Abreviaciones: CRI, rata de infusión continua; AT, antitrombina; SC, subcutáneo. Fuente. RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1079 La LMWH difiere de la UFH por ser más específica para el factor X, teniendo un efecto anticoagulante más previsible al darse una dosis de esta, y requiere menos monitoreo de rutina. Las LMWHs más usadas son ENOXAPARIN (lovenox) y 141 DALTEPARIN (fragmin), pero no son muy usados en veterinaria por los altos costos y por la poca experiencia clínica, aunque un estudio reciente reporta la farmacocinética de un LMWH en perros. La UFH dada para el tratamiento de PTE debe ser dosificada para prolongar el tiempo activado de la tromboplastina parcial (aPTT) de 1.5 veces a 2 veces. En animales hipercoagulables, es frecuente que requieran altas dosis (250 – 500 IU/kg administrado por vía subcutánea cada 6 horas) de UFH. La warfarina previene la formación de los factores de coagulación dependiente de vitamina K. warfarina también inhibe la producción de la proteína C anticoagulante. La vida media de la proteína C es más corta que la de los factores procoagulación, entonces se superpone que la heparina es recomendada para prevenir un estado hipercoagulable. La terapia con warfarina es cuestionada en pequeños animales. El tiempo de protrombina (PT) debe ser seguida cada 48 horas hasta que este estable por varios días, después cada 3 días por 1 mes, y luego 1 vez a semana o una semana de por medio. La remoción quirúrgica del coagulo (tromboembolectomia) ha sido recomendado en algunos animales, pero, de nuevo, el éxito de un resultado bien definido es raro146. 2.1.5.4.7 Edema pulmonar. Es definido como un exceso de agua en el pulmón. El edema pulmonar puede desarrollarse como un resultado de causas cardiogénicas o no cardiogénicas. Edema cardiogénico (causado por falla cardiaca congestiva izquierda) es más común. La falla cardiaca, resulta en el acúmulo de edema pulmonar por el aumento de la presión hidrostática cuando se desarrolla hipertensión venosa pulmonar como un resultado del aumento de la presión atrial izquierda. La presión atrial izquierda puede aumentar por varias razones, incluyendo condiciones congénitas (persistencia de conducto arterioso) o condiciones adquiridas (enfermedad valvular crónica o cardiomiopatias). 146 Ibid., p. 1079 142 El edema pulmonar cardiogénico es usualmente reconocido por medio de radiografía como un aumento del patrón alveolar o intersticial, frecuente se asocia con cardiomegalia y congestión pulmonar venosa. El tratamiento del edema pulmonar cardiogénico incluye, descanso, suplementación de oxigeno, vasodilatadores y terapia de diuréticos. (Tabla 11). Tabla 11. Agentes farmacéuticos usados en el manejo del edema pulmonar ___________________________________________________________________ Droga Dosis Ruta Mecanismo Furosemida 1-4 mg/kg IV, IM, PO diurético Espirinolactona 1-2 mg/kg cada 12 h PO diurético Hidroclorotiazide 1-2 mg/kg cada 12 h PO diurético Enalapril 0.5 mg/kg cada 12- 24 h PO inhibidor de ACE Nitropruside Balanceado 0.5–5.0 µg/kg/min IV vasodilatador Nitroglicerina 0.125-0.25 por cada 10 kg tópico vasodilatador Hidralazine 0.5 – 1.0 mg/kg PO vasodilatador arterial cada 12 h ___________________________________________________________ Abreviaciones: IM, intramuscular; IV, intravenosa; PO, oral; ACE, enzima covertidora de angiotensina Fuente. RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1081 La FUROSEMIDA es el diurético de primera opción, aunque otros diuréticos frecuentemente han sido utilizados, como lo son la ESPIRONOLACTONA o HIDROCLOROTIAZIDE. En una situación de emergencia, la furosemida es administrada tanto por vía intravenosa (preferiblemente) como intramuscular en una 143 dosis de 2 a 4 mg/kg. Esto puede ser repetido una vez cada hora por 4 horas y puede ser disminuido a 2 o 4 veces al día. El excesivo uso de los diureticos puede resultar en una azotemia prerenal marcada y una subsecuente anorexia y letargia. Los vasodilatadores son útiles en el tratamiento de la falla cardiaca por la reducción de la postcarga y la precarga. Los vasodilatadores más usados en emergencia incluyen pasta de nitroglicerina y una rata de infusión continua de nitropuside. El nitropuside es un potente vasodilatador, y su uso requiere una bomba de infusión y un monitoreo cercano. Los inhibidores de la enzima corvertidora de angiotensina (ACE) son también útiles para el manejo a largo plazo de la falla cardiaca congestiva. La terapia a largo plazo es indispensable para las enfermedades cardiacas dependiendo de la causa principal pero normalmente incluye diuréticos y vasodilatadores. Medicamentos para controlar la frecuencia, tales como los β- bloqueadores, antagonistas del canal de calcio, o DIGOXIN, son frecuentemente usados. Las causas comunes de edema cardiogénico incluyen: Ataques, obstrucción de las vías respiratorias altas y electrocución. ALI y ARDS son formas de edema no cardiogénico. La terapia del edema no cardiogénico esta dirigida principalmente a un cuidado de soporte y el tratamiento necesario para la solución de la enfermedad principal.147 2.2 PRESIÓN INTRAPLEURAL (PIP) 2.2.1 Anatomia pleural y fascia endotorácica Las pleuras son membranas serosas que tapizan la cavidad torácica y forman dos sacos cerrados de los cuales el izquierdo es más pequeño ya que el corazón esta desplazado hacia ese lado. Estos dos sacos pleurales recubren las paredes, como pleura parietal, se juntan en la línea media como pleura mediastínica y de esta se refleja sobre el parénquima pulmonar los pulmones para continuarse en la pleura visceral. La fascia endotoráxica es un tejido conjuntivo que recubre la superficie interna de las paredes de la cavidad torácica. Se pueden distinguir las porciones parietal, 147 Ibid., p. 1081 144 mediastínica y pulmonar de la pleura. La pleura parietal sobre la pared torácica lateral se adhiere a las costillas y a los músculos intercostales y se denomina pleura costal. Por detrás está íntimamente unida al diafragma formando la pleura diafragmática y tiene 2 hojas mediastínicas. Más o menos en el plano medio, ambos sacos pleurales contactan formando el mediastínico que se sitúa aproximadamente en la línea media; esta pleura mediastínica se convierte insensiblemente en la pleura costal y diafragmática. La porción que recubre a la capa fibrosa del pericardio se denomina pleura pericardiaca. Partiendo del mediastino en cada saco se introduce el pulmón respectivo, por lo que en la pleura mediastínica se invagina y cubre al pulmón formando la pleura pulmonar. De esta forma se origina el pliegue pleural, el ligamento pulmonar que consolida el pulmón al mediastino. El saco pleural contiene un liquido seroso claro, el liquido pleural que mantiene húmedas las superficies puestas en contacto, las pleuras parietal y visceral, además sirve como lubricante. Como los pulmones no llegan caudolateralmente hasta el esternón y a la porción costal del diafragma, queda en este lugar la pleura costal y la pleura diafragmática formando un espacio o recodo que es pequeño en la inspiración y más grande en la espiración; este espacio se llama seno frenicocostal. Entre las dos hojas de la pleura mediastínica se encuentra un espacio llamado mediastino dividido en tres partes en concordancia con las partes del mediastino. Las dos hojas pleurales mediastínicas forman hasta el diafragma, localizándose en el plano medio de la cavidad torácica y dividiéndola en dos porciones iguales, derecha e izquierda que se denominan comúnmente hemitórax.148 Las tres partes del mediastino son: • El espacio mediastínico craneal se halla en la porción del mediastino situado cranealmente al corazón que en los animales jóvenes aloja el timo toráxico. 148 MARTINEZ., Op. cit., p. 209 145 • El espacio mediastínico medio donde se sitúa el corazón envuelto en el pericardio, al igual que los vasos que entren y salen de él; además la traquea y el esófago. • El espacio mediastinito caudal, ubicado por detrás del corazón no es evidente puesto que aquí las dos capas del mediastino están adosadas sobre todo en la parte dorsal Líneas de reflexión pleural: • Línea vertebral de reflexión pleural. Es aquella a lo largo de la cual la pleura parietal costal se acoda centralmente para formar la pleura mediastínica; se extiende junto a la porción toráxico del músculo largo del cuello y del cuerpo de las vértebras, hasta la extremidad vertebral del ultimo espacio intercostal, donde se une con la línea de reflexión diafragmática. • Línea esternal de reflexión pleural. Se presenta cuando la pleura parietal costal se refleja dorsalmente para convertirse en pleura mediastínica. • Línea diafragmática de reflexión pleural, frenito-costal o costo diafragmática. Es aquella a lo largo de la cual la pleura parietal costal se dirige desde la pared lateral hasta el diafragma. Esta marca la línea de demarcación entre las cavidades toráxico y abdominal. La cúpula pleural o vértice de cada saco pleural se halla en el orificio craneal de la cavidad toráxico y se forma cuando la pleura parietal costal se refleja para convertirse en pleura mediastínica149. Histológicamente la pleura esta conformado por células mesoteliales, las cualesson células activas, que están envueltas en varias funciones metabolicas y estructurales. Sintetizan macromoléculas del tejido conectivo fundamental, y biológicamente activa las moléculas. 149 TOBOS. Op cit. p. 68 146 Son células reactivas, que responden al estimulo inflamatorio con un aumento en la cantidad de actividades; hay expresión de más enzimas, liberación de citoquinas, y de factores de crecimiento y péptidos quimiotácticos. Su densidad de 26 a 30 mm2 varia de acuerdo a la región, es más grande en la región caudal y en la visceral que en la pleura parietal.Su número aumenta después de una inyección intraperitoneal de albumina porque las células mesoteliales se activan. Ellas también contribuyen a la disminución de la fricción entre el mesotelio visceral y parietal, a través de las glicoproteínas ricas en ácido hialurónico. Su superficie apical absorbe los fosfolípidos los cuales proveen lubricación (apropiada para el movimiento suave de las pleuras) en puntos donde no hay líquido interpuesto entre las células, y reduce la permeabilidad mesotelial. En ellas se encuentran numerosas vesículas citoplasmáticas libre de 40 a 60 nm de diámetro Una función principal del mesotelio, es su rol activo en el transporte transeroso. Los estomas linfáticos se encargan del intercambio a través de la pleura. El tejido submesotelial conectivo contiene vasos sanguíneos y linfáticos, en este tejido la restricción de la difusión del agua y los solutos (incluyendo las macromoléculas) es insignificante. Fibras (tipo I y II de colágeno, elastina) están distribuidas de acuerdo a las diferentes densidades y orientación en la matriz intersticial (glicoproteina, proteoglicanos y agua), organizadas en diferentes capas, a través de canales que existen entre estas fibras fluyen el agua y los solutos. La densidad del tejido conectivo determina la densidad total de la serosa (las células mesoteliales tienen una densidad de 2 mm) y varia en las diferentes especies y en las diferentes regiones de la serosa. La densidad de la pleura parietal se incrementa con el tamaño del animal y es justamente constante por todo el espacio (pleura). La pleura parietal en algunos animales (perro, gato, conejo) es delgada (15-35 mm) y esta irrigada por las arterias pulmonares, mientras que es más gruesa en otras especies (hombre, oveja, cerdo) y la diferencia es principalmente en el lóbulo caudal. En las especies con pleura visceral gruesa, la mayoría de la irrigación proviene de las arterias bronquiales sistémicas. Sin embargo, la presión capilar de la pleura visceral (que afecta el balance en la presión que existe en el flujo del líquido transmesotelial) puede ser similar en la pleura delgada como la pleura gruesa, en ambos casos el drenaje capilar se realiza dentro de las venas pulmonares de baja presión. Los 147 capilares se encuentran cerca al mesotelio visceral en ambas clases de pleura. En la pleura parietal del mediastino caudoventral, los espacios intercostales caudales y el diafragma, el sistema linfático submesotelial esta directamente comunicado con el espacio pleural a través de las aberturas entre las células mesoteliales (estomas).150 La producción y absorción de los líquidos pleurales son procesos continuos y dinámicos que dependen del gradiente de presión, del área de superficie de las membranas pleurales, y de varios mecanismos del desagüe. La cantidad de fluido presente en el espacio pleural es constante, debido al equilibrio que existe entre el fluido producido y el absorbido. La formación de fluidos y el movimiento a través del espacio pleural están adherida a las fuerzas de Starling, incluye presión hidrostática, presión coloido-osmotica, permeabilidad capilar, y función linfática. 151 Movimiento del fluido = k ((HPc-HPf)-(COPc-COPf) k= El coeficiente de filtración (una medida de la permeabilidad de la pared del capilar) HPc = La presión hidrostática capilar (las redes del capilar parietales y viscerales) HPf = La presión hidrostática Pericapilar (espacio pleural)) COPc = Presión plasma coloide osmótica COPf = presión coloide osmótica Pericapilar (Espacio pleural) Normalmente, el fluido sale de los capilares arteriales de la pleura parietal, se mueve a través del espacio pleural, y luego es reabsorbido por los capilares venosos y el sistema linfático de la pleura visceral. Los capilares de la pleura parietal que provienen de la circulación sistémica, tienen una presión hidrostática mayor que la de los capilares de la pleura viceral que vienen de la circulación pulmonar. Esta diferencia crea un gradiente que fuerza al fluido pleural a través de la cavidad pleural, la cual tiene una presión hidrostática menor. Por eso se piensa que la pleura viceral tiene un rol más importante en la absorción de fluido debido a la presión hidrostática baja y a su gran vascularización. 150 Universidad de Chile, Facultad de medicina. Células mesoteliales. (2005). En: http://www.med.uchile.cl/otros/dra_ancic/capitulo19.html 151 JASON A. Scout, DOUGLASS K. Macintire. Canine phyothorax: pleural anatomy and pathophysiology. Compendium, North Carolina. Vol 25, Nº 3 (March 2003); p. 173. 148 Las presiones oncónicas de los capilares vicerales y parietales son iguales y son mayores a los de la cavidad intrapleural. Esto favorece la absorción por parte de la cavidad pleural a los capilares parietal y viceral. La permeabilidad de las membranas capilares afecta el movimiento del fluido, células, solutos y proteinas entre los espacios vasculares y pleurales. Esto también determina el tamaño de las moléculas que pueden dejar el capilar y su velocidad. Gradiente de presión: Una presión de 9 cmH2O a nivel de la pleura parietal conduce el fluido hacia el espacio pleural. La cantidad de fluido que entra al espacio depende de la permeabilidad capilar y del área de superficie de la pleura parietal. La absorción de fluidos es favorable a nivel de la pleura viceral. Una presión de 10 cmH2O mueve el fluido del espacio pleural a la pleura viceral. El aumento de la vascularización de la pleura viceral disminuye la resistencia del flujo de fluidos. La acción elástica inerte de la pleura disminuye la presión hidrostática subatmosferica en el espacio pleural.. Esto aumenta la presión negativa desarrollada entre los puntos de contacto pleural y disminuye toda la absorción de la presión. Figura 21. Dinámica de los fluidos pleurales Fuente. JASON A. Scout, DOUGLASS K. Macintire. Canine phyothorax: pleural anatomy and pathophysiology. Compendium, North Carolina. Vol 25, Nº 3 (March 2003); p. 173. 149 2.2.2 Presión y volumen en el ciclo respiratorio. Los pulmones y la pared torácica son estructuras elásticas que se distienden o se contraen durante el ciclo respiratorio. Mientras se produce el ciclo respiratorio se observan variaciones de presión tanto en los pulmones como en la cavidad pleural. 2.2.2.1 Presión pulmonar. La presión pulmonar, intrapulmonar o alveolar es la presión que se genera en los pulmones. Cuando la glotis esta abierta y no hay un flujo de aire en ningún sentido entre el exterior y los pulmones, la presión de aire en los pulmones es igual a la presión atmosférica que se considera como presión 0 (lo cual equivale a una atmósfera o 760 mmHg); esto ocurre la final de la inspiración y al final de la espiración. El aire se mueve se mayor a menor presión. Para que se produzca la inspiración y el aire entre al árbol respiratorio, la presión en los pulmones debe de ser menor que la presión atmosférica. La presión pulmonar cuando se inicia la inspiración es menor que la presión atmosférica, es decir, negativa, del orden de – 1 mmHg. Este valor es suficiente para que el aire penetre durante la inspiración a los pulmones. La contracción de los músculos inspiratorios hace que disminuya la presión pulmonar. Cuando se iguala la presión del pulmón a la presión atmosférica, deja de fluir aire al pulmón y finaliza la inspiración. Durante la espiración, el aire sale del pulmón hacia el exterior, al principio rápido y luego más lento; esto ocurre porque la presión del pulmón es mayor que la presión atmosférica. La relajación de los músculos inspiratorios aumenta la presión pulmonar. Cuando la presión en los pulmones se equilibra con la atmosférica finaliza la espiración. Tras la espiración hay una pausa respiratoria, para iniciarse de nuevo otro ciclo respiratorio, repitiéndose este proceso durante la vida del animal. Durante la inspiración forzada se pueden generar valores de presión pulmonar de – 100 mmHg, y durante la espiración forzada máxima, con la glotis cerrada, se puede incrementar la presión a valores de 140 mmHg. 2.2.2.2 Presión intrapleural Recubriendo los pulmones se encuentra la pleura visceral tapizando el pulmón y la pleura parietal en contacto con la pared de la cavidad torácica. Entre las 2 pleuras queda un espacio pleural con una pequeña cantidad de líquido, que genera una presión conocida como presión intrapleural o 150 pleural. La presión que ejerce la cavidad pleural durante el ciclo respiratorio siempre es negativa con respecto a la presión atmosférica. La presión negativa de la cavidad pleural es producida por la interacción mecánica del pulmón y la cavidad torácica durante el ciclo respiratorio. Al final de la inspiración, cuando los músculos inspiratorios están relajados, el pulmón y la pared de la caja torácica generan presiones que actúan en direcciones opuestas. El pulmón tiende a reducir su volumen, debido a la retracción elástica, que tira de las paredes alveolares expandidas, y la pared de la caja torácica tiende a aumentar su volumen, debido a la expansión elástica de sus estructuras. Así, la pared torácica mantiene abiertos los alvéolos en oposición a su expansión elástica. De igual manera, el pulmón actúa frente a su retracción elástica, para mantener la pared torácica en una posición adecuada para que se realice el proceso respiratorio. Figura 22. Cambios de presión alveolar e intrapleural durante el ciclo respiratorio. Fuente:http://mcb.berkeley.edu/courses/mcb136/topic/Respiration/SlideSet1/Resp1_files/slid e0017_image026.gif 151 Durante la inspiración, la presión intrapleural se hace más negativa debido a: La retracción elástica de los pulmones cuando se expanden y La caída de presión en las vías aéreas. Estos 2 mecanismos aumentan el carácter negativo de la presión mientras se produce la inspiración. Durante la espiración la presión intrapleural es menos negativa que en inspiración, ya que se anula la resistencia en las vías aéreas, siendo además la presión intrapulmonar positiva.152 Durante la ventilación espontánea, PIP es normalmente de -5cmH2O al final de la espiración; sin embargo, cuando comienza la inspiración se produce una importante caída hasta -10cmH2O, volviendo a -5cmH2O durante la espiración. Durante la ventilación controlada, PIP ↑ durante la fase inspiratoria desde – 5 cmH2O hasta 3cmH2O, ↓ nuevamente a -5 cm H2O durante la espiración 153 Algunos cambios en el valor de la PIP se deben a diversas razones, como cuando el pulmón es incapaz de expandirse a medida que se extrae el derrame pleural, sea por atelectasia secundaria a obstrucción bronquial o por incarceración por tumor, se generan presiones muy negativas que contribuyen a una rápida reproducción del derrame 154 ; cuando existe pleuritis debido a un proceso pulmonar subyacente (p. ej., neumonía,etc); o a la entrada directa de un agente infeccioso o sustancia irritante en el espacio pleural (rotura esofágica, empiema amebiano o pleuritis pancreática); al transporte de un agente infeccioso o lesivo o de células neoplásicas hacia la pleura a través de la corriente sanguínea o los linfáticos; a lesiones de la pleura parietal (traumatismo, sobre todo fractura costal, o pleural); o al derrame pleural relacionado con ingesta de fármacos , se presenta como síntoma principal el dolor súbito, que es de tipo punzante y se agrava con la respiración y la tos, aunque puede variar. La pleura visceral carece de sensibilidad y el dolor se produce por la inflamación de la pleura parietal, que es inervada principalmente por los nervios intercostales. La respiración suele ser rápida y superficial, con movimientos limitados 152 SACRISTAN, Op.cit., p. 386 ALVAREZ, et al. La ventilación artificial en el perro y el gato. En: www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Información/Temasanestesia/VENTILAC.PDF 154 PERTUZE, Julio y RAMIREZ, Rodrigo. Boletín de la escuela de Medicina del la Universidad Católica de Chile. Chile. Vol. 26 No. 2 . (1997) En: http://escuela.med.puc.cl/publ/Boletin/PatologiaPleural/DerramePleuralNeoplasico.html 153 152 en el lado afectado. Al presentarse este tipo de respiración la PIP es menos negativa, se produce una disminución de los sonidos respiratorios.155 Los traumatismos toráxicos penetrantes y romos pueden causar lesiones del espacio pleural, entre los que se encuentran el hemotórax, Neumotórax y los desgarros traqueobronquiales. Estas lesiones son el resultado de una perforación o laceración de una estructura intratoráxica, habitualmente el pulmón o un vaso sanguíneo. El aire o la sangre, se almacenan entre las capas pleurales y reducen la presión intrapleural normalmente negativa ( la hace más positiva), hasta que parte o todo el pulmón se colapsa. La lesión específica puede ser: Neumotórax (acumulación de aire) Hemotórax (acumulación de sangre) Hemoneumotórax (acumulación de sangre y aire).156 2.2.3 Historia Carl Ludwing (1847) fue el primero en reportar la medición de la presión intrapleural en animales vivos. El introdujo un tubo recubierto con un balón de caucho lleno de agua entre la pleura parietal y la visceral y a dicho tubo le conectó un manómetro de mercurio. Este sistema proveyó información de los animales en cuanto a las fuerzas que actúan sobre la superficie del pulmón, pero podría difícilmente ser aplicado en hombres sanos, o usado de manera rutinaria en donde se analiza la función pulmonar. La duda es si es posible hallar un camino seguro para medir la presión por fuera de los pulmones pero dentro de la caja torácica, esto se lo cuestionó Luciani en 1878. Luciani colocó un tubo dentro del esófago intratoráxico y midió los cambios de presión en la pared del esófago; el tubo tenia un gran número de huecos en su parte final (algunos tubos estaban recubiertos con un balón de caucho), fue conectado a una cápsula de Marey que registra los cambios en la presión documentados por el balón del tubo intraesofágico, pero a la vez dicho cápsula es menos sensitiva que el manómetro de mercurio. La sonda esofágica de Luciani se ve que sirve bien, 155 ROJAS Maruri. Cesar. Enfermedades de la pleura. En: http://hgm.salud.gob.mx/ensenanza/temario/pdf/Enfermedades_de_pleura.pdf 156 ETXEBERRIA, Garin. Traumatismo torácico En: http://es.geocities.com/simplex59/traumatismo toracico.html 153 además da datos razonables, y todos pueden estar de acuerdo que es mucho más seguro introducir un tubo a nivel esofágico que colocar una aguja en su tórax, pero el método nunca fue aplicado en humanos hasta 1949. Con el pasar de los siglos solo se tuvo interés en el conocimiento de la fisiología respiratoria; pero luego de un tiempo se empezaron a interesar en las fuerzas, las presiones y el flujo de aire, pero no supieron apreciar las ventajas de la utilización de manómetros para medir la presión sanguínea y mucho menos el contéo y el manejo del balón esofágico. Heynsius (1882) criticó la presión esofágica porque es considerablemente más baja que la intrapleural y era inconsistente; él atribuyó este problema al grosor de la pared esofágica y a la contracción irregular del músculo liso provocada por el balón de caucho que actúa como un cuerpo irritante. Meltzer (1892) esta de acuerdo con él y esto puso fin a la utilización del balón intraesofágico por varias décadas. Wirz, quien hizo un importante trabajo sobre la relación de presión volumen y flujo de presión en 1923, midió la presión intrapleural de manera directa. En sus papeles él analizó otros métodos, incluyendo la sonda de Luciani, aparentemente sin hacer algunos estudios usando un balón esofágico, el descarto el método con la declaración “solo tiene una pequeña importante histórica. Basado en premisas incorrectas, esto nuca contribuyó a perfeccionar los metodós o a ampliar el punto de vista del problema” dicho esto, se desterró la idea por 26 años más y mientras tanto, aquellos que querían aprender acerca de las propiedades mecánicas de los pulmones de hombres sanos y vivos no tuvieron alternativas, pero la punción de la cavidad pleural debe ser de manera cuidadosa. Esta precaución fue bien expresada por Aron, el primero en medir PIP en hombres sanos en 1896; en 1900 el escribió “es discutible quizás que un experimento de este tipo se realice en hombres sanos y vivos, pero se justifica, sin embargo, confiando en la seguridad de hoy que es la asepsis y antisepsis, Yó decido arriesgarme. Yo no fui suficientemente valiente como para realizarlo a menudo” Ronald Christie lo hizo de nuevo en 1934, pero Mead escribió que entre 1896 y 1961 probablemente menos de 10 personas sirvieron como sujetos normales para una medida directa de la presión intrapleural. En 1949, Hermanus Johannes Buytendijk completó su tesis para el grado de PhD en la Universidad de Groningen, esta fue titulada “presión esofágica y elasticidad 154 pulmonar”. El uso un balón esofágico y un manómetro con una delgada membrana de cobre. Su tesis escrita en Holandés, tomo un tiempo en llamar la atención de los fisiólogos de habla inglés. En 1952, cuando Dornhorst y Leathart escribieron en un papel sobre la medida de la presión esofágico ( con un tubo de polietileno sin balón) , en el cual ellos concluyen que “ la presión en el esófago es fácil de medir y da un valor satisfactorio de la presión intratorácica”. Cuando la tesis PhD fue traducida a ingles proveyó evidencia convincente de que el método fue verdaderamente confiable en el hombre y abre una vía para que se realice de manera rutinaria el examen de la funcionalidad pulmonar. Aguja de filtración: hoy los fisiólogos pulmonares usan este tipo de agujas de manera rutinaria para medir la presión transpulmonar o de la vía aérea, los fisiólogos cardiovasculares usan este tipo de agujas para medir la presión transvascular y la intra-cardiaca. Pero fue un largo u tortuosos camino entre el primer uso del manómetro de mercurio ( tubo en U) por Poiseuille en 1828 y el primer uso del manómetro con aguja de filtración por Lambert y Word en 1947. Porque la inercia del mercurio y la fricción entre este y el vidrio impide que el manómetro de mercurio de una información de la presión verdadera en un sistema dinámico, hubo una búsqueda de 119 años de un manómetro preciso, sensible, agudo, confiable y resistente. Este periodo muestra la subida y declive del manómetro de goma de Chauveaus y Marey, manómetros Ficks de resorte elástico, manómetro de resorte de acero Hurthles, una serie de manómetros ópticos diseñados por Frank, Wiggers, Hamilton, Kubicek y Green, y el manómetro con capacidad eléctrica de Lilly, Warburg y Hansen . Los últimos 71 años de esta investigación, el principio de la aguja de filtración fue conocido; y fue publicado por Herbert Tomlinson en 1876 en el Procedimiento de la Sociedad Royal de Londres. El objetivo de esta investigación fue “ determinar la relación entre el aumento de la resistencia al paso de una corriente eléctrica y a la fuerza de estiramiento”, y él concluyó que “ el aumento temporal por ciento de la resistencia de un alambre cuando es estirado en la misma dirección del flujo de la corriente es exactamente proporcional a la fuerza de estiramiento” el no especulo sobre el posible uso de esta precisa relación y 155 aparentemente este estudio no fue aplicado en la industria o en la medicina hasta que Simmonds patento la aguja unida de presión en 1942 , rápidamente se le encontraron varias aplicaciones y pronto se volvió más viable a nivel comercial. Lambert y Word fueron los primeros en reportar sobre el uso de la aguja de presión en la medición del a presión sanguínea. En 1945, ellos intentaron desarrollar métodos directos para la recolección continua de la información dada de la toma de la presión arterial en sujetos expuestos a una aceleración positiva en la centrífuga de la clínica Mayo. Algunos años antes, Louis Statham, un físico de la compañía de aviones Curtis – Wright de Buffalo, N.Y, desarrolló la aguja de presión sin unión o fijación. Statham patentó el dispositivo y puso en marcha su laboratorio en los Angeles en 1943, él hizo uno para Lambert y Wood en 1946 que ellos adaptaron para medir la presión del fluido. 157 2.2.4 Medición de la presión intrapleural Primero se debe de hallar un medio para medir la presión intratoráxica (intrapleural) para facilitar el estudio de la fuerza retráctil de los pulmones y la dinámica de la respiración. La presión debe de ser tomada por medio de una inserción percutánea de una aguja dentro del espacio pleural y se debe medir la presión intra-toráxica con un manómetro de H2O.158 Complicaciones de la medición directa de la presión intrapleural - Neumotórax (colapso pulmonar) - Lesión por desgarro del paquete vasculo nervioso intercostal: (Hemotórax, Neuritis o neuralgias). - Mialgia intercostal - Infección con agrandamiento del orificio parietal 157 COMROE, H. Julios JR. American review of respiratory diceases. Retrospectroscope. Vol 113, (1976) del sitio web American Thoracic Society (ATS). En: http://www.thoracic.org/aboutats/retrospectroscope/adobe/10HydrogenBalloonsandPressures.pdf 158 LM Kaplan, SK Epstein, SL Schwartz, QL Cao, and NG Pandian. Clinical, echocardiographic, and hemodynamic evidence of cardiac tamponade caused by large pleural effusions. En: American Jornal of respiratory and critical care medicine; http:/ajrccm.atsjournals.org/cgi/content/full/162/3/715 156 - Taponamiento del tubo por enrollamiento o molde de fibrina159 - Sangrado - Sufrimiento respiratorio160 Otro método de medición es el “Balón intraesofagico”: Al transmitirse la Presión pleural, tanto al esófago, como a la pared traqueal, y desde ella, al manguito de neumotaponamiento intratoráxico, puede estimarse la presión pleural, asumiendo que es similar a la transmitida por un catéter balón situado en el tercio inferior esofágico.161 La presión encontrada, es a la que están sometidos el pulmón, corazón, esófago y grandes vasos; como son estructuras distensibles, los cambios de presión intrapleural afectan su volumen. La presión intraesofágica proporciona una de las determinaciones más confiables en la continuidad de la actividad muscular respiratoria para diferenciar las apneas centrales de las obstructivas .El esófago en reposo es una cavidad virtual y como esta dentro de la caja toráxica tiene presión negativa de –5 a –10 mmHg, la presión intraesofágica es un reflejo de la presión intrapleural162 Morfología básica del intercambio transpleural: La superficie total de la pleura visceral (ambas cavidades) es de 1,000 cm2 en un perro de 9 kg. El área de la superficie pleural aumenta aproximadamente en proporción de la masa corporal (una medida de la superficie de área: 2/3 del peso corporal). La pleura comprende una capa de células mesoteliales y de tejido conectivo. Las facciones estructurales y la histoquímica de las células mesoteliales son comunes en toda la serosa en una gran variedad de animales (oveja, cerdo, perro y conejo). 159 RETTAZZINI, Fernando. El empiema pleural: Esquemas de tratamiento. Buenos Aires (2003) En: http://www.paideianet.com.ar/empiema2.htm 160 GREENE, Alam. Toracocentesis (2002) En:http://salud.terra.es/web/enciclopedia/ muestra.aspx?i=003420 161 ALFAGEME Michavilla, Principios de urgencias, emergencias y cuidados críticos: Función pulmonar y su evaluación. En:http://tratado.uninet.edu/c020107.html 162 VILLAGRAN Carrasco, Osvaldo. Fisiología. En: http://www.medmayor.d/apuntes/ apuntes/fisiologia/fisiologiaIII.htm 157 3. MATERIALES Y MÉTODOS 3.1 LOCALIZACIÓN Clínica de pequeñas especies de particulares de la Universidad de la Salle, sede la floresta, ubicada en la Cr.7 172-85 Bogotá - capital de la república de Colombia 3.2 POBLACIÓN Y MUESTRA La población animal en estudio pertenece a la especie canina, raza criollo, peso promedio 15 kilos; sin patologías torácicas; sin discriminación de raza, sexo y/o estado reproductivo. El número representativo de animales a muestrear: 30 animales Este número representativo se determino por las siguientes razones: Ética: hoy en día los estudios experimentales han disminuido el número de animales a muestrear debido a razones éticas; entre las que se encuentra, la de no inflingirle algún tipo de dolor al animal cuando se le realice un procedimiento médico. Económico: el presupuesto disponible para el estudio permite la toma de muestra a 30 animales, ofreciendo a cada uno de estos elementos utilizados durante la preparación del paciente la premedicación y la toma de la muestra. Población: se cuenta con una población de 30 animales de la cátedra de cirugía de pequeñas especies de la Universidad de la Salle para el trabajo 3.3 VARIABLES Las variables a tener en cuenta son: Presión intrapleural en caninos Vs posición del animal y constantes fisiológicas (Frecuencia cardiaca, frecuencia respiratoria). 158 3.4 ANÁLISIS ESTADÍSTICO Los datos obtenidos se llevaran a un sistema computacional en el cual se le realizara un análisis de estadística descriptiva modelo completamente al azar el cual es el más simple y se usa cuando las Unidades experimentales son homogéneas y la variación entre ellas es muy pequeña.163 3.5 MATERIALES Y EQUIPOS 163 • Materiales asepsia - Algodón - Alcohol - Yodopovidona - Hojas o cuchillas de afeitar - Guantes de cirugía - Jabón • Materiales premedicación - Venoclisis macrogoteo 20 gotas/minuto - I.V. catéter calibre 20 - Solución Cloruro de sodio al 9% • Fármacos premedicación y anestesia - Atropina - Thiopental sodico (Pentotal®) - Xilazine UNIVERSIDAD DEL TOLIMA. Estadistica inferencial. En. http://www.ut.edu.co/idead/pregrado/ 0802/cursos/ei.html 159 • Materiales de procedimiento (medición PIP) - Anestesia gas sampling line (datex ohmeda) - I.V. catéter (BD insyte) calibre 14 GA - Escalas de conversión de milibares y mmHg a cm H2O Figura 23. I.V. catéter calibre 14 GA Figura 24. Anestesia gas sampling line (datex ohmeda) • Equipos - Simulador de presiones marca SIMCUBE; determina presión en mmHg. Manómetro con estructuras modificadas “Controle presión moyenne” (se retiro bomba de reserva y botones de control y se le instalo una conexión directa); este manómetro determina presiones en mbar. 160 Figura 25. Simulador de presión marca SIMCUBE Figura 26. Manómetro de presión con estructuras modificadas “Controle presión moyenne” 161 3.6 METODOS Y PROCEDIMIENTOS • Determinación de la población animal a estudiar: - Número representativo de animales a muestrear : 30 animales • Se hará un registro de cada animal que contenga los siguientes datos: nombre, raza, peso, edad y sexo • Preparación del paciente para toma de PIP - Canulación del paciente (establecimiento de vía vascular abierta). - Premedicación de los caninos con atropina:xilazina e inducción con thiopental sódico. - Posicionar al animal decúbito lateral derecho - Preparación del área a puncionar (4-6 EIC), se rasura y embroca el área caudal al 4to y 6to espacio intercostal, esto se realiza para evitar dejar un orificio de entrada o salida de aire hacia y desde el pulmón, por lo cual la técnica indica direccionar la piel cranealmente y luego realizar la punción en el sitio designado anatómicamente. • Conexión y calibración de equipos utilizados para la toma de muestras: Simulador de presiones marca SIMCUBE y Manómetro “Controle presión moyenne” • Toma de presión intrapleural - Ubicación de espacio intercostales (4to-6to) y punción con el catéter calibre 14; el bisel debe retirarse tan pronto se atraviese (piel, fascias, músculos toráxicos) y continuar con la vaina plástica. - Conexión de la línea de gas anestésico al catéter ya posicionado y al equipo; primero se realizará la medición con el manómetro Controle presión moyenne y se continuará con la medición en el simulador de presiones marca SIMCUBE 162 • - Registro escrito de los resultado - Empleo de escalas de conversión de milibares y mmHg a cm H2O Toma de constantes fisiológicas (frecuencia respiratoria, frecuencia cardiaca y pulso) de los animales sanos. NOTA: Luego se procede a posicionar el animal en decúbito lateral izquierdo y se realiza el mismo procedimiento para la toma de la presión intrapleural. • Los resultados serán ingresados a un sistema computarizado para observar el análisis estadístico de los valores y las variables fisiológicas. • Análisis y discusión de los datos obtenidos comparándolos con reportes bibliográficos existentes para de esta forma poder concluir sobre los datos encontrados. Figura 27. Punción con catéter calibre 14 163 Figura 28. Medición de la presión intrapleural (PIP) con el simulador de presión marca SIMCUBE Figura 29. Medición de la presión intrapleural (PIP) con el manómetro de presión con estructuras modificadas “Controle presión moyenne” 164 4. RESULTADO Y DISCUSIÓN El objetivo de este estudio fue el determinar la presión intrapleural de una población canina ubicada en la ciudad de Bogotá a una altura 2600 msnm, el trabajo fue dirigido a comparar datos registrados en práctica, de los dos equipos (manómetro y simulador de presión), utilizando la misma técnica de punción. Tabla 12 . Datos registrados en caninos de práctica. ESPECIE RAZA Canino Criollo 21- Canino Criollo Sep Canino Criollo Canino Criollo 22- Canino Criollo Sep Canino Criollo Canino Criollo Canino Criollo Canino Criollo Canino Criollo Canino Criollo Canino Criollo 28Sep Canino Criollo Canino Criollo Canino Criollo 29- Canino Criollo Sep Canino Criollo Canino Criollo Canino Criollo Canino Criollo Criollo 05- Canino Criollo Oct Canino Canino Criollo Canino Criollo 06- Canino Criollo Oct Canino Criollo Canino Criollo Canino Criollo Canino Criollo Canino Criollo NOMBRE Tommy Tona EDAD PESO Fc Fc Manómetro Simulador Años Kilos cardiaca respirat. Mbar mmHg 3 15,2 96 32 -4 -3 3½ 17 104 38 -5 -5 Sacha Brinky Scar Rene Tabata Negro Magda Pamela Saturnina Tomas Lola Astro Mona Hanna Jacobo Rex Dona Tata Lupe Manchas Barbas Orejas Pamela Astro Siko Mateo Luna Lucas 4 2½ 5 6 4 2½ 5 2 3 2 3 5 4 3 3½ 2½ 4 6 4½ 2 3 4 3 5 4 2 4 2½ 31 14,3 22 17 19 14 18 21 12,3 16 15 24 15 13 33 19 17,5 18,5 16 15,6 15 19 15 21 18 13,5 17 14 165 92 140 94 99 114 128 92 100 128 112 97 92 112 128 120 108 99 94 96 128 100 112 132 120 120 128 112 120 28 35 32 32 36 38 30 30 36 32 32 32 36 34 32 27 32 32 30 36 30 32 39 32 30 36 30 34 -5 -4,8 -3,8 -5 -5,2 -4,5 -3,8 -4,2 -5,5 -4 -4,8 -3,5 -5,6 -4,5 -4 -6,8 -4,3 -4,5 -4,2 -3,5 -4 -3,7 -4,8 -5,3 -4,2 -6,5 -4 -5,7 -4 -4 -3 -5 -4 -3 -2 -4 -5 -4 -4 -2 -5 -4 -3 -5 -4 -3 -4 -2 -3 -3 -4 -4 -4 -4 -3 -4 En la tabla No 12 se encuentran registrados los datos obtenido durante la práctica de determinación de Presión Intrapleural con el método de punción directa y registro de los Equipos Simulador de presión marca SIMCUBE (medida de presión = mmHg) y Manómetro de Presión Mayonne modificado (medida de presión = mbar) La punción se realizo principalmente en caninos en decúbito lateral izquierdo, esto no afecto el valor de la presión intrapleural en comparación con el lado derecho, ya que los caninos presentan un hemitórax fenestrado que permite que estos valores sean iguales. Tabla 13. Conversiones de registro de Presión Intrapleural de mmHg y mbar a cmH20 mbar -4 -5 -5 -4,8 -3,8 -5 -5,2 -4,5 -3,8 -4,2 -5,5 -4 -4,8 -3,5 -5,6 -4,5 -4 -6,8 -4,3 -4,5 -4,2 -3,5 -4 -3,7 -4,8 -5,3 -4,2 -6,5 -4 -5,7 cmH2O -4,076 -5,095 -5,095 -4,8912 -3,8722 -5,095 -5,2988 -4,5855 -3,8722 -4,2798 -5,6045 -4,076 -4,8912 -3,5665 -5,7064 -4,5855 -4,076 -6,9292 -4,3817 -4,5855 -4,2798 -3,5665 -4,076 -3,7703 -4,8912 -5,4007 -4,2798 -6,6235 -4,076 -5,8083 mmHg -3 -5 -4 -4 -3 -5 -4 -3 -2 -4 -5 -4 -4 -2 -5 -4 -3 -5 -4 -3 -4 -2 -3 -3 -4 -4 -4 -4 -3 -4 166 cmH2O -4,07608696 -6,79347826 -5,43478261 -5,43478261 -4,07608696 -6,79347826 -5,43478261 -4,07608696 -2,7173913 -5,43478261 -6,79347826 -5,43478261 -5,43478261 -2,7173913 -6,79347826 -5,43478261 -4,07608696 -6,79347826 -5,43478261 -4,07608696 -5,43478261 -2,7173913 -4,07608696 -4,07608696 -5,43478261 -5,43478261 -5,43478261 -5,43478261 -4,07608696 -5,43478261 Se realizó la conversión de unidades. Donde: 1 cm H2O = 0,736 mmHg 1 mbar = 1,019 cm H2O164 Tabla 14. Datos calculados 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 T0 -4,076 -5,095 -5,095 -4,891 -3,872 -5,095 -5,299 -4,586 -3,872 -4,280 -5,605 -4,076 -4,891 -3,567 -5,706 -4,586 -4,076 -6,929 -4,382 -4,586 -4,280 -3,567 -4,076 -3,770 -4,891 -5,401 -4,280 -6,624 -4,076 -5,808 -141,335 T 1 -4,076 -6,793 -5,435 -5,435 -4,076 -6,793 -5,435 -4,076 -2,717 -5,435 -6,793 -5,435 -5,435 -2,717 -6,793 -5,435 -4,076 -6,793 -5,435 -4,076 -5,435 -2,717 -4,076 -4,076 -5,435 -5,435 -5,435 -5,435 -4,076 -5,435 -150,815 T02 16,613776 25,959025 25,959025 23,9238374 14,9939328 25,959025 28,0772814 21,0268103 14,9939328 18,316688 31,4104203 16,613776 23,9238374 12,7199223 32,563001 21,0268103 16,613776 48,0138126 19,1992949 21,0268103 18,316688 12,7199223 16,613776 14,2151621 23,9238374 29,1675605 18,316688 43,8707523 16,613776 33,7363489 686,429306 164 T12 16,6144849 46,1513469 29,536862 29,536862 16,6144849 46,1513469 29,536862 16,6144849 7,3842155 29,536862 46,1513469 29,536862 29,536862 7,3842155 46,1513469 29,536862 16,6144849 46,1513469 29,536862 16,6144849 29,536862 7,3842155 16,6144849 16,6144849 29,536862 29,536862 29,536862 29,536862 16,6144849 29,536862 799,341 ∑ T02+ T12 33,2282609 72,1103719 55,495887 53,4606994 31,6084177 72,1103719 57,6141434 37,6412951 22,3781483 47,85355 77,5617671 46,150638 53,4606994 20,1041378 78,7143478 50,5636723 33,2282609 94,1651595 48,7361569 37,6412951 47,85355 20,1041378 33,2282609 30,829647 53,4606994 58,7044225 47,85355 73,4076143 33,2282609 63,2732109 1485,771 The resident's electronic handbook : SI – CONVERSION. En. http://www.medana.unibas.ch/eng/ amnesix1/si_1.htm 167 Tabla 15. Análisis de varianza de un factor RESUMEN Grupos Cuenta T0 T1 30 30 Suma Promedio Varianza -141,3353 -150,815217 -4,71117667 -5,02717391 0,70943927 1,41955177 Los treinta caninos de práctica se sometieron a una punción directa en tórax y el registro de valores en dos equipos (manómetro = T0 y simulador = T1). El valor promedio obtenido con el manómetro controle presión Mayonne (modificado) = 4.7 y con el Simulador de presión marca simcube = 5.0, la variación entre estos es mínima, la cual se puede deber a la sensibilidad que presenta cada uno de estos equipos. La varianza con el manómetro = 0.7 y el Simulador de presión = 1.4, indica que los datos obtenidos con el manómetro presentan un rango menor de variación, la cual se debe al sistema de dial que proporciona datos más exactos al ser comparado con el sistema digital el cual registra la numeración sin decimales. Tabla 16. Análisis de varianza ANÁLISIS DE VARIANZA Origen de las variaciones Suma de cuadrados Grados de libertad Promedio de los cuadrados Entre grupos Dentro de los grupos 1,497813896 1 1,497813896 61,74074015 58 1,06449552 Total 63,23855405 59 F 1,40706454 Probabilidad 0,240380849 168 Valor crítico para F 4,006872822 De acuerdo al modelo estadístico COMPLETAMENTE AL AZAR utilizado para el análisis de los datos obtenidos con el “manómetro marca controle presión Mayonne (modificado)” y el “Simulador de presión marca simcube”, se puede concluir que no hay diferencia significativa entre los valores con los dos métodos empleados. En la práctica de medición de la presión intrapleural con la técnica de punción directa, los valores registrados por los dos equipos son similares. Los valores obtenidos en promedio registra un valor de presión intrapleural igual a 5 cmH2O, al ser comparados con datos bibliograficos “Durante la ventilación espontánea, PIP es normalmente de -5cmH2O al final de la espiración; sin embargo, cuando comienza la inspiración se produce una importante caída hasta 10cmH2O, volviendo a -5cmH2O durante la espiración. Durante la ventilación controlada, PIP ↑ durante la fase inspiratoria desde – 5 cmH2O hasta 3cmH2O, ↓ nuevamente a -5 cm H2O durante la espiración 165” se observo que nuestros parámetros se aproximan a los registrados, pero el valor tiende a ser menor. Un factor que se considera que pueden producir alteración de los resultados es la reacción a la premedicación suministrada al animal antes de realizar la punción, ya que algunos animales muestran una constante inhibitoria en la respiración post premedicación. La premedicación se utilizó como método analgésico ya que la sensibilidad pleural es bastante alta. Se observo que los movimientos respiratorios de inspiración y espiración, causan una deflexión en los valores de la presión, los cuales se pudieron observar con mayor facilidad en el Manómetro controle presión Mayonne (modificado) ya que este equipo hace la medición con una dial análogo; mientras que con el simulador digital Simcube los cambios no se registraban en momentos puntuales llevando la pantalla digital nuevamente a cero. 165 ALVAREZ, Ignacio et al. La ventilación artificial en el perro y el gato. www.ciberconta.unizar.es/cirugiaveterinaria/Mas_Información/Temasanestesia/VENTILAC.PDF 169 En: Consideramos importante el estudio de la presión intrapleural en caninos sometido a diferentes presiones atmosfericas, siendo esta una posible causa de variación. La falta de estudios de presión intrapleural en nuestro país publicados, no permite realizar comparativos a nuestra práctica, razón por la que fueron comparados con datos bibliográficos reportados a nivel internacional. Se estandarizo la técnica de presión intrapleural por punción directa con manómetro marca controle presión Mayonne (modificado)” y el “Simulador de presión marca simcube”, con medidas de presión en mmHg y mbar, las cuales al ser comparadas con valores ya reportados en cmH2O y la utilización de otros equipos son similares. , 170 CONCLUSIONES Y RECOMENDACIONES • La medición de la presión intrapleural representa una alternativa diagnóstica a diferentes tipos de afecciones causadas por trauma de tórax. Aún siendo esta práctica descrita, y conociendo sus beneficios, continua siendo poco empleada por los profesionales en salud animal. • Para una correcta medición de la presión intrapleural es importante evaluar en forma general al paciente, conocer la técnica, manejar una buena asepsia, utilizar equipos calibrados y verificar que todos los elementos utilizados estén disponibles y en perfecto estado al momento de realizar la punción. • La medición de la presión intrapleural como método diagnostico en un paciente con trauma, debe ser justificada o empleada solo cuando se crea que este afectado el volumen minuto respiratorio por una posible alteración de las presiones dentro del tórax. • El método de punción directa es empleado para la medición de la presión intrapleural, el conocimiento de la técnica y elementos a utilizar facilita el desarrollo práctico. • Los Equipos empleados para la medición de la presión intrapleural “Manómetro controle presión Mayonne (modificado) y el simulador digital Simcube” registran valores confiables, para la medición de la presión intrapleural. 171 • Los Equipos (manómetro y simulador) utilizados en la práctica, son apropiados para la medición de la presión intrapleural, por su alta sensibilidad a cambios de presiones y registros negativos. • La conformación anatómica de las pleuras (fenestradas) permiten el conocimiento de la presión intrapleural de ambos hemitórax mediante una única punción. • Para finalizar, pretende con este trabajo, se provea información del tema traumatismo torácico, incremente la curiosidad e interés por conocer acerca del mismo, ya que se hace evidente la alta casuística por trauma en caninos y la necesaria utilización de métodos diagnósticos para la solución de los mismos. 172 BIBLIOGRAFÍA ALFAGEME, Michavilla. Principios de urgencias, emergencias y cuidados críticos: Función pulmonar y su evaluación. En: http://tratado.uninet.edu/c020107.html ALLEMAN, Rick. Abdominal, thoracic and pericardial effusions. En: Veterinary Clinic of North America: Small Animal: Small Animal Practice. Florida. Vol. 33 ( 2003); p. 118 ALVAREZ, Ignacio; BURZACO, Olga y TENDILLO, Francisco. La ventilación artificial en el perro y el gato. (2001). En: www.ciberconta.unizar.es/cirugiaveterinaria/ Mas_Informacion/Temas_anestesia/VENTILAC.PDF ANDRADE, J.N.B.M y BELERENIAN , G. Afecciones pericárdicas en caninos. En: Selecciones Veterinarias. Argentina. Vol. 11. No. 3 (Noviembre 2003); p 257. ARCHIBALD, James.Traumatologia Canina. Zaragoza:Acribia, 1977. p 149 BAIN J. Perry, DIAMOND L. Halise; LATIMER S. Kenneth y ROCKWELL. Jennifer. Chylothorax in Dogs and Cats. Del sitio web del College of Veterinary Medicine, The University of Georgia, Athens. En: http://www.vet.uga.edu/vpp/clerk/Rockwell/ BELTRAN, Rafael. Anestesia, reanimación y terapeutica al dolor: Cirugia aorta. En: http:/chguv.san.gua.es/descargas/AreaMedica/servQuir/AnesRes/BELTRAN_Cir_aor ta_CHGUV151105PPS256 BIRCHARD, Stephen J. Manual clínico de pequeñas especies. Primera edición. México: Mcgraw Hill Interamericana. 1996. Vol. 2. p. 1742 COLORADO STATE UNIVERSITY, BIOMEDICAL SCIENCE. 173 COLLEGE OF VETERINARY AND ---- Tensión pneumothorax. En. http://www.cvmbs.colostate.edu/clinsci/wing/ trauma/tension.htm ----.--- Pulmonary contusions. En. http://www.cvmbs.colostate.edu/clinsci/wing/ trauma/pulmcont.htm ---.---.--- Respiratory Distress. Suspect a Thoracic injury with any sort of trauma. En:http://www.cvmbs.colostate.edu/clinsci/wing/trauma/dyspnea.htm COMROE, H. Julios JR. American Review of Respiratory Diceases. Retrospectroscope. Vol 113, (1976) del sitio web American Thoracic Society (ATS). En: http://www.thoracic.org/aboutats/retrospectroscope/adobe/10Hydrogen BalloonsandPressures.pdf CRAIG Cornell- RVT, VTS. Cardiology veterinarian technician:Cardiac anatomy and physiology. En: American Animal Hospital Association(AAHA) 70th Annual meeting scientific, Management, Veterinary Technician and Service Skills programs. CUNNINGHAM, Fisiología Veterinaria. 2 ed. México: Mc Graw Hill, 1999. p. 627 DAVIS, Harold. Management of the Shock Trauma Patient (Emergency and critical care). En: http://www.vetlatranquera.com.ar/pages/ACVC2001/PR0460.htm DAY K, Thoma. Blood gas Analisis. En: Veterinary clinics of Norh America: Small Animals Practice WB. USA. Vol. 32 (2002). p 1075 ETTINGER, Stephen J. Tratado de Medicina Interna Veterinaria: enfermedades del perro y el gato. 4 ed. Buenos Aires: Intermedica, 1997. p. 1306 ETXEBERRIA, Garin. Diplomado de enfermería:Traumatismo torácico En: http://es.geocities.com/simplex59/traumatismo toracico.html FELDMAN, Henry y FELDMAN, Lori. Advanced Veterinary life support for the ACLS Health care professional. En: http://members.aol.com/henryhbk/avls.html 174 FORRESTER, Dru. Respiratory Medicine. Pleural Effussions / (January 2003). En. Pneumothorax. http://education.vetmed.vt.edu/Curriculum/VM8754/respir/ sdf/study/pleural.pdf GARCIA G. Argemiro . Sistema Respiratorio y Sistema Circulatorio .En Semiología veterinaria: Clínica General. Primera edición. Colombia -.Fondo Nacional Universitario. 1995., p. 300 GETTY, Robert. Sisson y Grossman. Anatomía de los animales domésticos. 5 ed. Mexico: Salvat editores S.A., 1993. p. 1581 GREENE, Alam. Toracocentesis (2002) En:http://salud.terra.es/web/enciclopedia/ muestra.aspx?i=003420 GREGORY C., Troy. Clinical techniques: Thorax and Forelimb. En: ---- En:http://education.vetmed.vt.edu/Curriculum/VM8354/clintech_gct/ Techniques/Thorax4. ----.---- En:http://education.vetmed.vt.edu/Curriculum/VM8354/clintech_gct/ Techniques/Thorax3.htm GUTIERREZ, J,A y MERIDA, A. Principios de Urgencias, Emergencias y cuidados críticos. Capítulo 2.1 Función Pulmonar y su evaluación. Mecánica Respiratoria. En: http://tratado.uninet.edu/c020107.html HACKNER, Susan. Contusiones pulmonares. En:Selecciones veterinarias. Pennsylvania. Vol. 8 Nº. 4 (Octubre. 2000); p. 367 HAMLIN L, Robert. Physical examination of the pulmonary system: Respiratory medicine and surgery. En: Veterinary Clinic of North America: Small Animal practice. Ohio. Vol. 30 No. 6 (Noviembre. 2000); p. 1185 http://petplace.nestcape.com/articles/artShow.asp?artID=43=&infections+pulmonary 175 HAROLD Davis Jr., RVT, VTS (Emergency & Critical Care). Management of the Shock Trauma Patient. En:http://www.vetlatranquera.com.ar/pages/ACVC2001/ PR0460.htm JASON A. Scout, DOUGLASS K. Macintire. Canine phyothorax: pleural anatomy and pathophysiology. Compendium, North Carolina. Vol 25, Nº 3 (March 2003); p. 178. KIRPENSTEIJIN J. The Role of Emergency Surgery in Thoracic Trauma. Soft Tissue Surgery Section, Department of Clinical Sciences of Companion Animals, Faculty of Veterinary Medicine, Utrecht University Utrecht, The Netherlands En: http://www.vin.com/proceedings/Proceedings.plx?CID =WSAVA2002&PID=2701 KUEHN F. Ned. Diagnostic Approach to Respiratory causes of dyspnea. Del sitio web del michigan veterinary specialists internal medicine department (MICHVET). En:http://www.michvet.com/articles/internal_medicine/Diagnostic%20Approach%20to %20Dyspnea.asp LM Kaplan, SK Epstein, SL Schwartz, QL Cao, and NG Pandian. Clinical, echocardiographic, and hemodynamic evidence of cardiac tamponade caused by large pleural effusions. En: American Jornal of respiratory and critical care medicine .http:/ajrccm.atsjournals.org/cgi/content/full/162/3/715 MARTINEZ H. Manuel. Radiología veterinaria: pequeños animales. 1 ed. Madrid:Interamericana, 1992. p. 493 Morales, Mérida. et al. Función pulmonar y su evaluación. En: Principios de Urgencia, emergencia y cuidados criticos SAMIUC; http://tratado.uninet.edu/c020105.html PATIÑO R, Jose. Trauma de http://www.aibarra.org/Guias/2-8.htm 176 torax: Manejo general. En: PERTUZE, Julio y Ramírez, Rodrigo. Boletín de la Escuela de Medicina. Del sitio web de la Universidad Católica de Chile. Vol 26 no. 2, 1997. En: http://escuela.med.cl/publ/Boletin/PatologiaPleural/DerramePleuralNeoplasico.html PET PLACE VETERINARIANS. Dyspnea in dogs (2005) En: http://petplace.nestcape.com/articles/artShow.asp?artID=43=&infections+pulmonary REISS, Adam. Myocardial Injury Secondary to Blunt Thoracic Trauma in Dogs: Incidence y Pathophysiology. Compendium. Colorado. Vol. 24 No. 12. (December. 2002); p. 940 RETTAZZINI, Fernando. El empiema pleural: Esquemas de tratamiento. Buenos Aires (2003) En: http://www.paideianet.com.ar/empiema2.htm ROHR A, Adrian. Ruptura diafragmatica. En: http://www.aamefe.org.ar/ruptura_diafr_fel.htm ROJAS Maruri. Cesar. Enfermedades de la pleura. En: http://hgm.salud.gob.mx/ensenanza/temario/pdf/Enfermedades_de_pleura.pdf RONDEAU P, Mark y ROZANSKY A, Elizabeth. Respiratory pharmacotherapy in emergency and critical care medicine. En Veterinary Clinics of North America: Small Animal Practice. Philadelphia. Vol 32 (2002)., p. 1086 SACRISTAN, Garcia A. Fisiología Veterinaria. España: Mac Graw Hill. 1995, p.1074. STUDDERT P. Virginia D.C. BLOOD. Diccionario de veterinaria. Mexico: Mac Graw Hill Interamericana, 1994. p 239 SUBIROS, Isabel. Ecocardiografia: Casuística. En: Selecciones veterinarias. Mar del Plata – Argentina. Vol. 7 No. 5. (Octubre 1999); p. 477 177 TAMAYO Arango Lynda. Examen del aparato respiratorio en caninos y felinos. En. http://docencia.udea.edu.co/ca/SistemasOrganicosII/documentos/resSemiologia.pdf TEXAS HEART INSTITUTE at St. Luke´s Episcopal Hospital. The Heart of Discovery, Anatomia del corazón. (Junio 2004) En: http://www.tmc.edu/thi/anato_sp.html THE RESIDENT'S ELECTRONIC HANDBOOK : SI – Conversion. En. http://www.medana.unibas.ch/eng/ amnesix1/si_1.htm TOBOS, Juan A. Generalidades de anatomía. Bogotá D.C.:Universidad Nacional de Colombia, 1999. p. 68 TORRES, Guzmán. Patricio. Principios de Cirugía Torácica. Del sitio web de MEVEPA En: http://www.mevepa.cl/modules.php?name=News&file=article&sid=323 UNIVERSIDAD DE CHILE, Facultad de medicina. Células mesoteliales. (2005). En: http://www.med.uchile.cl/otros/dra_ancic/ capitulo19.html UNIVERSIDAD DEL TOLIMA. Estadistica inferencial. En. http://www.ut.edu.co/idead/ pregrado/0802/cursos/ei.html VILLAGRAN Carrasco, Osvaldo. Fisiología. http://www.medmayor.d/apuntes/apuntes/fisiologia/fisiologiaIII.htm 178 En: 179